新华制药:关于布洛芬片(0.1g和0.2g)通过仿制药一致性评价的公告
PSUR-布洛芬片定期安全性更新报告模板

(布洛芬片药品)定期安全性更新报告第 2 次报告报告期:2013年 1 月1 日至2019 年6 月30 日报告提交时间:2019年7月19日目录一、前言 (3)二、主要内容 (3)(一)、药品的基本信息 (3)(二)、国内外上市情况 (5)1、国内外上市情况参照下表: (5)2、药品批准上市时提出的有关要求(安全性要求): (5)3、批准的适应症(功能主治)和特殊人群: (6)4、注册情况: (7)(三)、因药品安全性原因而采取措施的情况 (7)(四)、药品安全性信息的变更情况: (8)(五)、用药人数估算资料 (8)(六)、药品不良反应报告信息: (8)1、个例药品不良反应: (8)2、药品群体不良事件 (8)(七)、安全性相关的研究信息 (8)(八)、其他信息 (9)1、与疗效有关的信息 (9)2、数据截止日后的新信息 (9)3、风险管理计划 (9)4、专题分析报告 (9)(九)、药品安全性分析评价结果 (9)(十)、结论 (10)(十一)、附件 (11)附件1:药品批准证明文件;附件2:药品质量标准;附件3:药品说明书;附件4:参考文献;正文(说明:本报告所报药品本公司已经有长时间没有生产)一、前言1、布洛芬片为化药制剂产品,我公司布洛芬片的批准文号:国药准字H****,规格为每片0.1克。
2002年10月16日,取得药品注册证;2009年12月14日,获得了药品再注册批件;2014年12月5日,获得了药品再注册批件。
2、布洛芬片,适应症为适用于:①.缓解类风湿关节炎、骨关节炎、脊柱关节病、痛风性关节炎、风湿性关节炎等各种慢性关节炎的急性发作期或持续性的关节肿痛症状,无病因治疗及控制病程的作用。
②.治疗非关节性的各种软组织风湿性疼痛,如肩痛、腱鞘炎、滑囊炎、肌痛及运动后损伤性疼痛等。
③.急性的轻、中度疼痛如:手术后、创伤后、劳损后、原发性痛经、牙痛、头痛等。
④.对成人和儿童的发热有解热作用。
国家药监局关于发布仿制药参比制剂目录(第四十一批)的通告-国家药品监督管理局通告2021年第29号

国家药监局关于发布仿制药参比制剂目录(第四十一批)的通告正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家药品监督管理局通告2021年第29号国家药监局关于发布仿制药参比制剂目录(第四十一批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第四十一批)。
特此通告。
附件:仿制药参比制剂目录(第四十一批)国家药监局2021年4月26日附件仿制药参比制剂目录(第四十一批)序号药品通用名称英文名称/商品名规格备注1备注241-1拉坦噻吗滴眼液Latanoprost and Timolol Maleate Eye Drops每1ml溶液含50μg拉坦前列素和6.8mg马来酸噻吗洛尔Pfizer SA国内上市的原研药品原研进口41-2甲磺酸奥希替尼片Osimertinib Mesylate Tablets/ Tagrisso(泰瑞沙)80mgAstraZeneca AB国内上市的原研药品原研进口41-3枸橼酸伊沙佐米胶囊Ixazomib Citrate Capsules/Ninlaro(恩莱瑞)2.3mg(按C14H19BCl2N2O4计)Takeda Pharma A/S国内上市的原研药品原研进口41-4枸橼酸伊沙佐米胶囊Ixazomib Citrate Capsules/Ninlaro(恩莱瑞)3mg(按C14H19BCl2N2O4计)Takeda Pharma A/S国内上市的原研药品41-5枸橼酸伊沙佐米胶囊Ixazomib Citrate Capsules/Ninlaro(恩莱瑞)4mg(按C14H19BCl2N2O4计)Takeda Pharma A/S国内上市的原研药品原研进口41-6吲哚美辛凝胶Indometacin Gel/Vantelinkowa(万特力)每克含吲哚美辛0.01克与l-薄荷醇0.03克Kowa Company,Ltd.国内上市的原研药品原研进口41-7醋酸阿比特龙片(II)Abiraterone Acetate Tablets/Yonsa125mgSun Pharma Global FZE未进口原研药品美国橙皮书41-8丁酸氯维地平注射用乳剂Clevidipine Injectable Emulsion/Cleviprex 25mg/50ml(0.5mg/ml)Chiesi USA INC未进口原研药品美国橙皮书41-9丁酸氯维地平注射用乳剂Clevidipine Injectable Emulsion/Cleviprex50mg/100ml(0.5mg/ml)Chiesi USA INC未进口原研药品美国橙皮书41-10碳酸司维拉姆干混悬剂Sevelamer Carbonate Powder for oral suspension/ Renvela 2.4gGenzyme Corporation未进口原研药品美国橙皮书41-11碳酸司维拉姆干混悬剂Sevelamer Carbonate Powder for oral suspension/ Renvela 0.8gGenzyme Corporation未进口原研药品美国橙皮书41-12钆贝葡胺注射液Gadobenate dimeglumine Injection /Multihance15ml:7.935g(529mg/ml)Bracco Diagnostics Inc未进口原研药品美国橙皮书41-13琥珀酸舒马普坦萘普生钠片Sumatriptan and Naproxen Sodium Tablets/Treximet85/500mgCurrax Pharmaceuticals LLC未进口原研药品美国橙皮书41-14盐酸达克罗宁局部溶液剂Dyclonine Topical Solution/Dyclopro0.50%Novocol Inc国际公认的同种药品美国橙皮书41-15盐酸达克罗宁局部溶液剂Dyclonine Topical Solution/Dyclopro1%Novocol Inc国际公认的同种药品美国橙皮书41-16克霉唑含片Clotrimazole Troche10mgHikma Pharmaceuticals USA INC国际公认的同种药品美国橙皮书41-17蒙脱石混悬液Montmorillonite Suspension3gIpsen Pharma / Ipsen Consumer Healthcare未进口原研药品欧盟上市41-18ω-3鱼油中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液ω-3 Fish Oil Medium and Long Chain Fat Emulsion/Amino Acids (16)/Glucose (30%) Injection 1250mlB.Braun Melsungen AG未进口原研药品欧盟上市41-19甲磺酸奥希替尼片Osimertinib Mesylate Tablets/ Tagrisso40mgAstraZeneca AB未进口原研药品欧盟上市41-20肠内营养乳剂(SP)Enteral Nutritional Emulsion(SP)/ Survimed OPD500mlFresenius Kabi Deutschland GmbH未进口原研药品欧盟上市41-21匹可硫酸钠滴剂Sodium Picosulfate Drops7.5 mg/ml帝人ファーマ株式会社未进口原研药品日本上市41-22布美他尼注射液Bumetanide Injection1ml:0.5mg第一三共株式会社未进口原研药品日本上市41-23盐酸纳呋拉啡口崩片Nalfurafine Hydrochloride OD Tablets/Remitch OD Tablets 2.5μg東レ株式会社未进口原研药品日本上市41-24来特莫韦注射液Letermovir Injection/Prevymis20mg/ml(240mg:12ml)MSD株式会社未进口原研药品日本上市41-25来特莫韦片Letermovir Tablets/Prevymis240mgMSD株式会社未进口原研药品日本上市41-26克立硼罗软膏Crisaborole Ointment/Staquis(舒坦明)2%(30g、60g)Anacor Pharmaceuticals, Inc.国内上市的原研药品原研进口41-27司来帕格片Selexipag Tablets/Uptravi(优拓比)0.4mgActelion Pharmaceuticals Ltd国内上市的原研药原研进口41-28曲安奈德注射液Triamcinolone Acetonide Injectable Suspension /Kenalog-1010mg/mlApothecon Inc Div Bristol Myers Squibb未进口原研药品美国橙皮书41-29坎地沙坦酯氢氯噻嗪片Candesartan Cilexetil and Hydrochlorothiazide Tablets/Atacand HCT 16mg/12.5mgANI Pharmaceuticals INC/Astrazeneca未进口原研药品美国橙皮书41-30注射用米卡芬净钠Micafungin Sodium for Injection /Mycamine50mgAstellas Pharma US Inc未进口原研药品美国橙皮书41-31注射用哌拉西林钠他唑巴坦钠Piperacillin And Tazobactam/Zosyn4.5gWyeth Pharmaceuticals LLC未进口原研药品美国橙皮书41-32盐酸托莫西汀胶囊Atomoxetine Hydrochloride Capsules/Strattera 10mg(以托莫西汀碱计)Eli Lilly And Co未进口原研药品美国橙皮书41-33盐酸托莫西汀胶囊Atomoxetine Hydrochloride Capsules/Strattera 25mg(以托莫西汀碱计)Eli Lilly And Co未进口原研药品美国橙皮书41-34盐酸托莫西汀胶囊Atomoxetine Hydrochloride Capsules/Strattera 40mg(以托莫西汀碱计)Eli Lilly And Co未进口原研药品美国橙皮书41-35熊去氧胆酸胶囊Ursodeoxycholic Acid Capsules / Actigall300mgAllergan Sales LLC未进口原研药品美国橙皮书41-36碳酸镧咀嚼片Lanthanum Carbonate Chewable Tablets/FosrenolEq 500mg BaseShire Development LLC/Takeda Pharmaceuticals USA INC 未进口原研药品美国橙皮书41-37钆布醇注射液Gadobutrol Injection/Gadavist6.0472g/10ml (604.72mg/ml)Bayer Healthcare Pharmaceuticals Inc未进口原研药品美国橙皮书41-38阿昔洛韦胶囊Aciclovir Capsules0.2gApotex Inc国际公认的同种药品美国橙皮书41-39他达拉非片Tadalafil Tablets/Adcirca20mgEli Lilly CO未进口原研药品美国橙皮书41-40他达拉非片Tadalafil Tablets/Cialis2.5mgEli Lilly Nederland B.V.未进口原研药品欧盟上市41-41米氮平片Mirtazapine Tablets / Norset15mgMSD France未进口原研药品欧盟上市41-42醋酸阿托西班注射液Atosiban Acetate Injection /Tractocile 0.9ml:7.5mg/ml(以阿托西班计)Ferring Pharmaceuticals A/S未进口原研药品欧盟上市41-43醋酸阿托西班注射液Atosiban Acetate Injection /Tractocile5ml:7.5mg/ml(以阿托西班计)Ferring Pharmaceuticals A/S未进口原研药品欧盟上市41-44盐酸普拉克索片Pramipexole Dihydrochloride Tablets/Sifrol0.5mgBoehringer Ingelheim International GmbH未进口原研药品欧盟上市41-45中长链脂肪乳/氨基酸(16)/葡萄糖(16%)注射液Medium and Long Chain Fat Emulsion/Amino Acids(16)/Glucose(16%)Injection 1250mlB.Braun Melsungen AG未进口原研药品欧盟上市41-46二甲双胍维格列汀片(III)Metformin Hydrochloride and Vildagliptin Tablets / Eucreas每片含盐酸二甲双胍1000mg和维格列汀50mgNovartis Europharm Limited未进口原研药品欧盟上市41-47伊立替康脂质体注射液Irinotecan Liposome injection/Onivyde43mg/10mlLes Laboratoires Servier未进口原研药品欧盟上市41-48吡拉西坦注射液Piracetam Injection12g/60mlUCB Pharma未进口原研药品欧盟上市41-49阿加曲班注射液Argatroban Injection/Novastan2mL:10mg田辺三菱製薬株式会社未进口原研药品日本上市41-50玻璃酸钠滴眼液Sodium Hyaluronate Eye Drops/ Hyalein 0.1%(0.4ml:0.4mg)参天制药株式会社未进口原研药品日本上市41-51苯甲酸阿格列汀片Alogliptin Benzoate Oral Tablet/Nesina 6.25mg武田薬品工業株式会社未进口原研药品日本上市41-52苯甲酸阿格列汀片Alogliptin Benzoate Oral Tablet/Nesina 25mg武田薬品工業株式会社未进口原研药品日本上市41-53马来酸曲美布汀片Trimebutine Maleate Tablets / Cerekinon 100 mg田边三菱制药株式会社未进口原研药品日本上市41-54盐酸昂丹司琼片Ondansetron Hydrochloride Tablets/Zofran 4mgNovartis Pharmaceuticals Corp未进口原研药品德国上市41-55盐酸昂丹司琼片Ondansetron Hydrochloride Tablets/Zofran 8mgNovartis Pharmaceuticals Corp未进口原研药品德国上市1-33阿立哌唑口崩片Aripiprazole Orally Disintegrating tablets/Abilify10mgOtsuka Pharmaceutical Europe Ltd./Otsuka Pharmaceutical Netherlands B.V. 欧盟上市持证商发生变更,增加持证商Otsuka Pharmaceutical Netherlands B.V.10-6氨酚双氢可待因片Paracetamol and Dihydrocodeine Tartrate Tablets/Co-dydramol对乙酰氨基酚500mg;酒石酸双氢可待因10mgActavis UK Limited/Accord UK Ltd欧盟上市(上市国家:英国;产地:英国)持证商发生变更,增加变更后持证商Accord UK Ltd10-220枸橼酸托法替布片Tofacitinib Citrate Tablets/ Xeljanz5mgPF Prism C.V./Pfizer Limited/Pfizer Europe MA EEIG原研进口持证商发生变更,增加变更后持证商Pfizer Limited/Pfizer Europe MA EEIG12-4交沙霉素片Josamycin Tablets50mgAstellasPharma Inc./LTL ファーマ株式会社未进口原研药品持证商发生变更,增加持证商LTL ファーマ株式会社12-5交沙霉素片Josamycin Tablets200mgAstellasPharma Inc./LTL ファーマ株式会社未进口原研药品持证商发生变更,增加持证商LTL ファーマ株式会社22-104羟乙基淀粉130/0.4电解质注射液Hydroxyethyl Starch 130/0.4 and Electrolyte Injection/Volulyte 6% Soluzione per Infusione 500mlFresenius Kabi Deutschland GmbH/Fresenius Kabi ltaliaS.r.l.未进口原研药品持证商发生变更,增加持证商Fresenius Kabi ltaliaS.r.l.,不限定上市国23-267注射用头孢哌酮钠Cefoperazone Sodium For Injection/Cefobid2.0g(以头孢哌酮计)Pfizer Italia S.R.L./Pfizer, Spol. S R.O/Pfizer, Austria Ges.m.b.H未进口原研药品持证商发生变更,增加持证商Pfizer, Spol. S R.O; Pfizer, Austria Ges.m.b.H23-284碳酸镧咀嚼片Lanthanum Carbonate Chewable Tablets/FosrenolEq 750mg BaseShire Development LLC/Takeda Pharmaceuticals USA INC未进口原研药品持证商发生变更,增加持证商Takeda Pharmaceuticals USA INC23-286碳酸镧咀嚼片Lanthanum Carbonate Chewable Tablets/FosrenolEq 1gm BaseShire Development LLC/Takeda Pharmaceuticals USA INC未进口原研药品持证商发生变更,增加持证商Takeda Pharmaceuticals USA INC27-249氨己烯酸口服溶液用散Vigabatrin Powder for Oral Solution /Sabril;Sabrilex500mgSanofi未进口原研药品药品通用名称更正为氨己烯酸口服溶液用散,英文名称更正为Vigabatrin Powder for Oral Solution。
双氯芬酸制剂

北京市药品检验所 二〇〇九年十一月
目录Biblioteka 一、基本情况 ....................................................................................................................... 1 1. 药品的历史沿革,基本特性,适应症 ..................................................................... 1 2. 剂型、药品规格与包装材料 ..................................................................................... 1 2. 1 剂型 ....................................................................................................................... 1 2.2 规格 ........................................................................................................................ 1 2.3 包装材料 ............................................................................................................... 2 3. 药品处方与生产工艺简述 ......................................................................................... 2 4. 近几年临床使用不良反应信息 ................................................................................. 2 二、药品生产及抽样基本信息 ........................................................................................... 3 1. 全国该药品的生产企业与批准文号数 ..................................................................... 3 2. 抽取的样品总批次,在企业抽取的样品批次 ........................................................ 3 3. 抽取样品涉及的生产企业和批准文号数................................................................. 3 4. 抽取双氯芬酸制剂涉及生产企业和批准文号均占全国范围内 该药品的生产企业与批准文号的百分数 ................................................................. 4 5. 抽取样品的地域分布: ............................................................................................. 4 6. 样品的确认情况 ......................................................................................................... 4 三、检验标准 ....................................................................................................................... 4 四、依据现行标准检验结果及分析 ................................................................................... 5 1. 总的检验结果.............................................................................................................. 5 2. 不同抽样地域样品检验结果对比分析 ..................................................................... 5 3. 同一抽样地域(大区或省)不同抽样点(省级、县级与乡级) 样品检验结果对比分析 .............................................................................................. 6 4. 不同样品保存条件对检验结果影响分析................................................................. 6 5. 不合格批次分析 ......................................................................................................... 6 6. 双氯芬酸钠肠溶片结果分析 ..................................................................................... 6 7. 双氯芬酸钾片结果分析 ............................................................................................. 7 8. 双氯芬酸钠缓释片 ..................................................................................................... 7 9. 其他制剂 ...................................................................................................................... 8 五、开展的探索性研究 ....................................................................................................... 8 1. 有关物质 ...................................................................................................................... 8 1.1 杂质的液相色谱-质谱结构确证 ........................................................................ 8 1.2 双氯芬酸钠肠溶片检验情况 .............................................................................. 8 1.3 双氯芬酸钾片 ........................................................................................................ 9 1.4 双氯芬酸钠缓释片................................................................................................ 9
力生制药:关于药品碳酸氢钠片通过仿制药一致性评价的公告

证券代码:002393 证券简称:力生制药公告编号:2020-038
天津力生制药股份有限公司
关于药品碳酸氢钠片通过仿制药一致性评价的公告
一、概况
近日,天津力生制药股份有限公司(以下简称“本公司”)收到国家药品监督管理局颁发的关于碳酸氢钠片(以下简称“该药品”)0.5g规格的《药品补充申请批件》(批件号:2020B02969),该药品通过仿制药质量和疗效一致性评价。
二、该药品的基本情况
药品名称:碳酸氢钠片剂型:片剂
规格:0.5g 注册分类:化学药品
药品生产企业:天津力生制药股份有限公司
原批准文号:国药准字H12020220
申请事项:国产药品注册一致性评价
受理号:CYHB1950174
审批结论:通过仿制药质量和疗效一致性评价。
三、该药品的相关信息
碳酸氢钠片适应症:用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸。
四、对本公司的影响及风险提示
公司该药品通过仿制药质量和疗效一致性评价,有利于提升该药品市场竞争力。
由于医药产品的行业特点,各类产品/药品的具体销售情况可能受到市场环境变化等因素影响,具有较大不确定性,敬请广大投资者注意投资风险。
特此公告。
天津力生制药股份有限公司
董事会
2020年5月6日。
2010年版药典药品标准布洛芬片

《中华人民共和国药典》2010年版二部布洛芬片Buluofen PianIbuprofen Tablets本品含布洛芬(C13H18O2)应为标示量的95.0%~105.0%。
【性状】本品为糖衣或薄膜衣片,除去包衣后显白色。
【鉴别】(1) 取本品的细粉适量,加0.4%氢氧化钠溶液制成每1ml中含布洛芬0.25mg 的溶液,滤过,取续滤液,照布洛芬项下的鉴别(1)项试验,显相同的结果。
(2) 取供试品5片,研细,加丙酮20ml使布洛芬溶解,滤过,取滤液挥干,真空干燥后测定。
本品的红外光吸收图谱应与对照的图谱(光谱集943图)一致。
(3)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】溶出度取本品,照溶出度测定法(附录Ⅹ C 第一法),以磷酸盐缓冲液(pH7.2)900ml为溶出介质,转速为每分钟100转,依法操作,经30分钟时,取溶液10ml,滤过,精密量取续滤液适量,用溶出介质定量稀释制成每1ml中约含布洛芬0.1mg的溶液,作为供试品溶液。
另取布洛芬对照品,精密称定,加甲醇适量溶解并用溶出介质定量稀释制成每1ml 中约含0.1mg的溶液,作为对照品溶液。
取上述两种溶液,照含量测定项下的方法测定,计算每片的溶出量。
限度为标示量的75%,应符合规定,其他应符合片剂项下有关的各项规定(附录ⅠA)。
【含量测定】照高效液相色谱法(附录V D)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以醋酸钠缓冲液(取醋酸钠6.13g,加水750ml使溶解,用冰醋酸调节pH值至2.5)-乙腈(40:60)为流动相;检测波长为263nm。
理论板数按布洛芬峰计算不低于2500。
测定法取本品20片(糖衣片应除去包衣),精密称定,研细,精密称取适量(约相当于布洛芬50mg),置100ml量瓶中,加甲醇适量,振摇使布洛芬溶解,用甲醇稀释至刻度,摇匀,滤过,精密量取续滤液20µl,注入液相色谱仪,记录色谱图;另取布洛芬对照品25mg,精密称定,置50ml量瓶中,加甲醇2ml使溶解,用甲醇稀释至刻度,摇匀,同法测定。
“”药品集中带量采购解读

“4+7”药品集中带量采购解读国务院办公厅日前印发《国家组织药品集中采购和使用试点方案》(以下简称《方案》),对国家组织药品集中采购和使用试点工作作出部署,选择北京、天津、上海、重庆和沈阳、大连、厦门、广州、深圳、成都、西安11个城市开展试点工作。
《方案》明确,从通过质量和疗效一致性评价的仿制药对应的通用名药品中遴选试点品种。
经国家药品监督管理部门批准、在中国大陆地区上市的集中采购范围内药品的生产企业,均可参加试点。
具体措施如下:期内提前完成约定采购量的,超过部分仍按中选价进行采购,直至采购周期届满。
(1)带量采购,以量换价。
按照试点地区所有公立医疗机构年度药品总用量的60%-70%估算采购总量,进行带量采购,量价挂钩、以量换价,形成药品集中采购价格,试点城市公立医疗机构或其代表根据上述采购价格与生产企业签订带量购销合同。
(2)招采合一,保证使用。
试点地区公立医疗机构应优先使用中选药品,确保1年内完成合同用量。
(3)确保质量,保障供应。
要严格执行质量入围标准和供应入围标准,建立对入围企业产品质量和供应能力的调查、评估、考核、监测体系。
(4)保证回款,降低交易成本。
医疗机构作为药款结算第一责任人,应按合同规定与企业及时结算,降低企业交易成本。
严查医疗机构不按时结算药款问题。
医保基金在总额预算的基础上,按不低于采购金额的30%提前预付给医疗机构。
有条件的城市可试点医保直接结算。
一直接影响1月17日上午,上海药事所召集未中标企业进行了通气会。
会议消息显示,未中标产品根据与中标产品之间的价差,决定降价比例,降价比例分为三档,分别为10%、20%、30%。
这个降价幅度被认为是较为温和的。
“4+7”城市带量采购拟中选结果公示结束。
与2017年同种药品最低采购价相比,拟中选的25个品种药价平均降幅52%,最高降幅达96%,其中22个为通过一致性评价的仿制药。
此次“4+7”城市带量采购受益人群有哪些、药企能否赚钱、流标药企如何应对以及未来股价走势等问题,新京报记者采访了多位业内人士。
贵州省物价局关于核定公布2011年贵州省基本药物中标零售价格的通知

贵州省物价局关于核定公布2011年贵州省基本药物中标零售价格的通知文章属性•【制定机关】贵州省物价局•【公布日期】2013.05.27•【字号】黔价医药[2013]133号•【施行日期】2013.06.13•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】价格正文贵州省物价局关于核定公布2011年贵州省基本药物中标零售价格的通知(黔价医药〔2013〕133号)各市(州)、县(市、区、特区)物价(发改)局(办):根据《国务院办公厅关于印发建立和规范政府办基层医疗卫生机构基本药物采购机制的指导意见的通知》(国办发[2010]56号)文件,我局会同省卫生厅、省纠风办、省发改委、省工商局等部门联合出台了《关于印发<贵州省政府办基层医疗卫生机构基本药物集中采购实施方案(试行)>的通知》(黔卫发[2011]98号),于2011年6月30日正式启动新一轮基本药物集中采购工作,省药品集中采购服务中心根据《实施方案》相关规定,按照公开、公正、公平的原则,经过长时间认真地对药品数据的收集、整理、筛查,完成了本轮基本药物的集中招标采购工作。
我局依据省药品集中采购服务中心提供的数据进行了审核,现将中标药品零售价格核定并公布,请遵照执行。
一、全省非营利性医疗机构须严格执行此次核定公布的955个药品中标零售价格。
二、此次药品集中采购公布的中标零售价格,严格按照《贵州省物价局关于医疗机构药品销售实行差别差率政策的通知》(黔价医药[2012]237号)文件规定执行,即我省所有非营利性医疗机构应以最小零售包装的实际购进价格为基础顺加规定的差率,加价率分4档,分别为0-10元(含)加价率为25%,10-50元(含)加价率为15%,50-300元(含)加价率为10%,300元以上加价率为7%(最高70元),若最小包装被拆零销售,则加价率按照药品拆零前的包装价格档次计算。
三、各级价格主管部门要加强对价格政策执行情况的监督检查,对违反本通知规定的单位,要依法严肃查处。
集中带量采购阿莫西林与阿莫西林克拉维酸钾根除幽门螺杆菌临床疗效评估

◇医院药学之窗◇摘要目的:评估集中带量采购(集采)阿莫西林与阿莫西林克拉维酸钾根除幽门螺杆菌(helico-bacter pylori ,Hp )的疗效,为临床方案选择提供依据。
方法:利用合理用药管理系统调取2021年5月至2022年5月接受Hp 根除治疗患者的数据,筛选使用阿莫西林方案(集采阿莫西林1.0g bid +枸橼酸铋钾220mg bid +艾司奥美拉唑20mg bid +克拉霉素0.5g bid ,14d )和阿莫西林克拉维酸钾方案(阿莫西林克拉维酸钾0.914g bid +枸橼酸铋钾220mg bid +艾司奥美拉唑20mg bid +克拉霉素0.5g bid ,14d )患者的数据,对两方案的疗效进行比较探讨。
结果:集采阿莫西林组共收集到171例,根除成功率87.8%(150/171)。
阿莫西林克拉维酸钾组共收集到69例,根除成功率76.8%(53/69)。
两组患者基线资料差异无显著性(P >0.05)。
两组临床疗效存在统计学差异(P <0.05)。
阿莫西林方案成本效果比值(C/E )低于阿莫西林克拉维酸钾方案。
结论:集采阿莫西林方案根除Hp 感染临床疗效优于阿莫西林克拉维酸方案,值得临床推广。
关键词幽门螺杆菌;集中带量采购;阿莫西林;阿莫西林克拉维酸钾中图分类号:R969文献标志码:A 文章编号:1009-2501(2023)09-1061-06doi :10.12092/j.issn.1009-2501.2023.09.013幽门螺杆菌(helicobacter pylori ,Hp )感染与消化性溃疡、胃黏膜相关淋巴组织淋巴瘤、胃增生性息肉、早期胃癌、胃炎、不明原因缺铁性贫血、原发免疫性血小板减少、维生素B12缺乏症等多种疾病的发生发展密切相关,对人类健康构成严重的威胁。
1994年WHO 下属国际癌症研究机构将Hp 定义为I 类致癌原,2022年美国卫生和公共服务部将Hp 列为明确致癌物[1]。
陕西省关于第二批国家组织药品集中采购未通过一致性评价药品报价符合要求的产品公示表
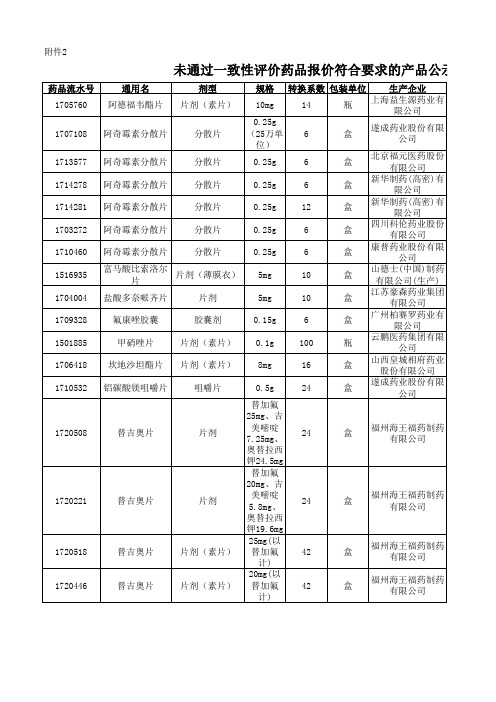
11.65 4.21 4.98 6.34 11.22 3.33
云鹏医药集团有限公司
山西皇城相府药业股份有 限公司
遂成药业股份有限公司
4.5 4.19 7.26
福州海王福药制药有限公 司
223.52
福州海王福药制药有限公 司
188.42
福州海王福药制药有限公 司
383.26
福州海王福药制药有限公 司
323.07
美嘧啶 7.25mg、
24
盒
福州海王福药制药 有限公司
奥替拉西
钾24.5mg
替加氟
20mg、吉
片剂
美嘧啶 5.8mg、
24
盒
福州海王福药制药 有限公司
奥替拉西
钾19.6mg
25mg(以 片剂(素片) 替加氟 42
计)
盒
福州海王福药制药 有限公司
20mg(以 片剂(素片) 替加氟 42计)盒来自福州海王福药制药 有限公司
分散片
0.25g (25万单 6
位)
盒
遂成药业股份有限 公司
分散片
0.25g
6
盒
北京福元医药股份 有限公司
分散片
0.25g
6
盒
新华制药(高密)有 限公司
分散片
0.25g
12
盒
新华制药(高密)有 限公司
分散片
0.25g
6
盒
四川科伦药业股份 有限公司
分散片
0.25g
6
盒
康普药业股份有限 公司
片剂(薄膜衣) 5mg
10
盒
山德士(中国)制药 有限公司(生产)
片剂
5mg
10
盒
布洛芬片素片质量标准
XXXXXXXXX有限公司
一、目的:建立布洛芬片素片的质量标准,确保所用素片的质量。
二、范围:本规定适用于布洛芬片素片的质量控制。
三、责任:
四、内容:
1.标准来源
2015年版《中国药典》一部及2015年版《中国药典》四部
2.技术要求
3.贮存条件:车间中间站,密封保存。
4.相关标准操作规程:布洛芬片素片检验操作规程(SOP-ZL-JG(ZJP)-076)、物料取样标准操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:布洛芬片素片。
6.内部使用的物料代码:无此项内容。
布洛芬片素片质量标准版本号:
7.经批准的供应商:无此项内容。
8.包装形式:洁净内袋包装。
9.注意事项:无此项内容。
10.贮存期:15天。
11.文件附件:共0份。
12.修订及变更历史:。
仿制药一致性评价

仿制药一致性评价一:背景信息1) 2016年2月6日,国务院颁布了国办发【2016】8号文件“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”,随后国家又在短时间内连续颁布了一系列关于仿制药一致性评价工作的相关文件和指南,真正拉开了仿制药产品质量和疗效一致性评价工作的序幕。
2) 根据国家仿制药一致性评价政策和时限要求,289种基本药物要求在2018年底完成评价,其他仿制药产品若能成为“首名”或“前三名”,对市场和经济意义重大。
否则,则存在较大风险失去市场甚至文号不保。
二:认识与建议虽然国家提出了明确的时间要求和评价原则,但当前的法规并不具体,企业左右为难。
公司基于长期从事药政法规研究的工作经验,我们对本轮要求的认识如下:1) 不等不靠、主动研究。
2) 要充分重视对产品的信息回顾与整理,重视仿制药评价的整体策划,为开展研究工作打基础。
3) 重视药学研究。
仿制药研究的重点是药学部分,也是国家评价仿制药质量的重要内容,CMC是重中之重,必须先行。
4) 时间紧迫仿制药一致性评价,尤其是基本药物的评价看起来还有2年多时间,实际分解后留给企业的时间已经非常紧张,即使一切顺利也需要20-25个月。
5) 逐步开展,分段进行。
仿制药一致性评价是一个综合工程,链条长,费用高。
尤其是早年完成注册的产品,注册研究与申报资料更加薄弱,适合先初步摸索产品质量现状再进行系统深入的研究。
6) 仿制药一致性评价应分为四个阶段开展三:优势与业绩仿制药一致性评价工作是一个系统工程,需要完整的服务链条和资源配置,包括CMC研发实验室、动物GLP实验室、BE临床实验基地、生化分析实验室和注册服务团队,以及良好的公共资源,并且各个环节都要有经验丰富的技术团队与完善的质量管理体系,要经得起注册现场核查与临床现场核查。
1) 咨询拥有的优势包括以下几方面:✔建立了高水平配置的国家级CMC研发实验室,拥有专业的研发人员和十多年药品研发经验,为中国三大医药技术研究成果转化平台之一,国家基本药物标准溶出度曲线制作承担单位之一;✔合作动物GLP实验室,比格犬等大动物试验不是问题;✔集团内拥有BE临床试验基地与通过FDA审计的生化分析实验室(海口、长春、南京3个BE基地),BE试验优先快速安排;✔18年丰富经验的注册团队,轻松化解技术难题。
国家药品监督管理局药品注册司关于已批准临床研究的新药品种公告(第31号)--公布复方布洛芬片等药品

国家药品监督管理局药品注册司关于已批准临床研究的新药品种公告(第31号)--公布复方布洛芬片等药品文章属性•【制定机关】国家药品监督管理局•【公布日期】2001.04.11•【文号】药监注函[2001]154号•【施行日期】2001.04.11•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药品监督管理局药品注册司关于已批准临床研究的新药品种公告(第31号)(药监注函[2001]154号)各省、自治区、直辖市药品监督管理局,解放军总后勤部卫生部:现将2001年3月21日前已批准临床研究的新药品种予以公告。
自公告之日起,各省级药品监督管理局应停止受理相同品种的新药临床研究申请。
化学药品品名类别剂型备注复方布洛芬片四片剂布洛芬、对乙酰氨基酚美洛昔康凝胶四凝胶剂七叶皂甙钠片四片剂七叶皂甙钠凝胶四凝胶剂头孢泊肟酯四原料药头孢泊肟酯片四片剂复方丙酸氯倍他索软膏软膏剂丙酸氯倍他索、全反式维A酸盐酸左旋布比卡因四原料药盐酸左旋布比卡因注射液四注射剂布洛芬精氨酸颗粒剂四颗粒剂奥硝唑氯化钠注射液四注射剂奥硝唑葡萄糖注射液四注射剂奥硝唑胶囊四胶囊剂克拉维酸钾/阿莫西林分散四颗粒剂片(1:7)颗粒盐酸氮卓斯汀胶囊四胶囊剂辛伐他汀咀嚼片四咀嚼片阿昔洛韦缓释胶囊四胶囊剂黄体酮胶丸四胶丸扎来普隆片二片剂盐酸坦索罗辛四原料药萘丁美酮颗粒剂四颗粒剂L-谷氨酰胺咀嚼片四咀嚼片复方谷氨酰胺颗粒剂四颗粒剂水溶性薁、L-谷氨酰胺双半胱乙酯四原料药布洛伪麻混悬液四混悬液布洛芬、盐酸伪麻黄碱锝[99mTc]双半胱乙酯注射液四注射剂中药品名类别剂型骨归原胶囊三胶囊剂人知降糖胶囊三胶囊剂克肝脂胶囊三胶囊剂脂肝消三丸剂麝香心痛宁片三片剂妇血净颗粒三颗粒剂天星定痫胶囊三胶囊剂脑溢安颗粒三颗粒剂半夏和胃颗粒三颗粒剂龙香平喘胶囊三胶囊剂芪薏助康颗粒三颗粒剂熊胆明目液三滴眼液二至明目胶囊三胶囊剂经前安片三片剂参松养心胶囊三胶囊剂软肝颗粒三颗粒剂赤丹通脉胶囊三胶囊脾胃宁口服液三口服液脑痛宁胶囊三胶囊剂八味健骨片三片剂珍芪降糖胶囊三胶囊剂柴葛清热颗粒三颗粒剂苦金片三片剂气滞胃炎颗粒三颗粒剂地贞颗粒三颗粒剂芩桑止咳合剂三合剂芪英愈疡颗粒三颗粒剂乳腺增生口服液三口服液养血妇康颗粒三颗粒剂芪参益智胶囊三胶囊剂芪丹通脉片三片剂补肾壮骨颗粒三颗粒剂杏菀止咳颗粒三颗粒剂硒蒜胶囊三胶囊剂国家药品监督管理局药品注册司二○○一年四月十一日。
药品集中带量采购解读

药品集中带量采购解读文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]“4+7”药品集中带量采购解读国务院办公厅日前印发《国家组织药品集中采购和使用试点方案》(以下简称《方案》),对国家组织药品集中采购和使用试点工作作出部署,选择北京、天津、上海、重庆和沈阳、大连、厦门、广州、深圳、成都、西安11个城市开展试点工作。
《方案》明确,从通过质量和疗效一致性评价的仿制药对应的通用名药品中遴选试点品种。
经国家药品监督管理部门批准、在中国大陆地区上市的集中采购范围内药品的生产企业,均可参加试点。
具体措施如下:本次“4+7带量采购”以结果执行日起12个月为一个。
若在采购周期内提前完成约定采购量的,超过部分仍按中选价进行采购,直至采购周期届满。
(1)带量采购,以量换价。
按照试点地区所有公立医疗机构年度药品总用量的60%-70%估算采购总量,进行带量采购,量价挂钩、以量换价,形成药品集中采购价格,试点城市公立医疗机构或其代表根据上述采购价格与生产企业签订带量购销合同。
(2)招采合一,保证使用。
试点地区公立医疗机构应优先使用中选药品,确保1年内完成合同用量。
(3)确保质量,保障供应。
要严格执行质量入围标准和供应入围标准,建立对入围企业产品质量和供应能力的调查、评估、考核、监测体系。
(4)保证回款,降低交易成本。
医疗机构作为药款结算第一责任人,应按合同规定与企业及时结算,降低企业交易成本。
严查医疗机构不按时结算药款问题。
医保基金在总额预算的基础上,按不低于采购金额的30%提前预付给医疗机构。
有条件的城市可试点医保直接结算。
一直接影响1月17日上午,上海药事所召集未中标企业进行了通气会。
会议消息显示,未中标产品根据与中标产品之间的价差,决定降价比例,降价比例分为三档,分别为10%、20%、30%。
这个降价幅度被认为是较为温和的。
“4+7”城市带量采购拟中选结果公示结束。
与2017年同种药品最低采购价相比,拟中选的25个品种药价平均降幅52%,最高降幅达96%,其中22个为通过一致性评价的仿制药。
仿制药参比制剂目录(第三十一至四十批)

Guanfacine Hydrochloride Extended Release Tablets/
Intuniv Guanfacine Hydrochloride Extended Release Tablets/
Intuniv Guanfacine Hydrochloride Extended Release Tablets/
片
Tablets/Odefsey
Bimatoprost ophthalmic 31-24 贝美前列素涂剂
solution/Latisse
3ml:0.9mg
Allergan INC
31-25 奥泽沙星乳膏 Ozenoxacin Cream/Xepi 1%(10g、30g、45g)Ferrer Internacional SA
Intuniv
Lidocaine and Tetracaine Cream/Pliaglis
规格 15mg 30mg
1mg
持证商 Specgx LLC Specgx LLC
Shire Development Inc
2mg
Shire Development Inc
3mg
Shire Development Inc
Infants' Motrin
40mg:ml(15ml、 30ml)
Johnson And Johnson Consumer Inc Mcneil Consumer Healthcare
Divisioon
利巴韦林冻干粉 Ribavirin For Inhalation
31-17
6g
吸入剂
Solution/Virazole
布洛芬原料药唯二龙头:新华制药、亨迪药业,该选谁?

布洛芬原料药唯二龙头:新华制药、亨迪药业,该选谁?根据下图《金融时报》援引的这家咨询机构的模型预测,中国的日感染人数将处于迅速上升的趋势,预计在3月中旬才会达到顶峰。
在12月初防控放开之后,整个市场最大的风口就是医疗板块了。
医疗板块的最大风口是新冠防治用药,鉴于最近北京卫健委专家称,”除了连花清瘟,类似的中成药还有上百种“,连花清瘟在中成药中的官方地位不再唯一。
然而像布洛芬,对乙酰氨基酚(扑热息痛)等退烧抗炎镇痛药,无论中外,无论信否,其治疗效果都是显著的、客观的。
布洛芬的库存和产能已经非常紧张,未来伴随着感染人数的迅速上升,需求量还会进一步增加。
进一步研究布洛芬原料药市场,会发现这个行业存在着诸多壁垒,比如生产规模壁垒、注册认证壁垒、环保壁垒等,整个行业呈现出只有少数玩家的寡头垄断格局。
01布洛芬原料药行业分析全球的布洛芬原料药生产主要控制在六家公司:中国的新华制药和亨迪药业,美国圣莱科特,德国巴斯夫,印度的SOLARA和IOL。
根据北京东方比特科技有限公司《中国布洛芬原料药市场分析报告》,2019年新华制药占中国布洛芬出口数量的比例为67.2%,亨迪药业占比32.8%;在布洛芬的国内销售数量的比例,新华制药占62.66%,亨迪药业占37.34%。
可见,无论是国内市场还是出口,中国布洛芬原料药市场基本被新华制药和亨迪药业瓜分。
根据各家公布的产能情况,新华制药产能10,000吨/年,亨迪药业3,500吨/年,印度SOLARA的产能是5,000吨/年,印度IOL产能为10,000到12,000吨/年,德国巴斯夫和美国圣莱科特没有公布自己的年产能。
不过,根据印度IOL年报中称自己占全球33%的市场份额来算,全球产能应在3万至3.6万吨/年,据此推算德国巴斯夫和美国圣莱科特合计产能大约在2,000到5,000吨/年。
以上的行业格局和进入壁垒,使得行业格局呈现一种稳定的状态,任何的供应变化和需求变化,都有可能导致价格的大幅波动。
新华制药开足马力生产布洛芬

152022年12月·山东国资省属企业 | STATE-OWNED ENTERPRISE本刊讯 近日,随着疫情防控政策的调整,布洛芬等解热镇痛药物需求在短时间内迅速上涨。
新华制药作为全球重要的解热镇痛类药物生产与出口企业,在疫情防控新形势下,紧跟人民用药需求和市场形势,全力稳生产、抢进度、保供应,展现国企担当,引领医药产业高质量发展。
据了解,秋冬季是传统的解热镇痛药需求旺季,再加上目前疫情发展的实际情况,市场需求迅猛增加。
面对市场需求变化,新华制药及时做出调整,多条智能化生产线加班加点生产市场紧缺药品,处于满负荷状态,全力以赴保障布洛芬、阿司匹林等解热镇痛药物的市场需求。
新华制药是全国原料药和制剂一体化生产企业的龙头之一,包括布洛芬、阿司匹林等品种在内的多款产品,其产能和规模均处于领先地位,并实现了产业链配套,通过了欧美规范市场质量认证,市场竞争力明显。
多年来,秉承“产品质量关系企业生命,药品质量关系人的生命”的“两个生命”质量价值观,新华制药在产品质量上苦练内功,被授予山东省工业企业质量标杆。
以布洛芬为例,1981年新华牌布洛芬片在国内首家上市,在质量规格的确定上,新华制药制定了高于药新华制药开足马力生产布洛芬□ 本刊记者 梁晴典的企业内控指标,曾获国家质量金奖,并于2020年在国内首家通过一致性评价。
下一步,新华制药将尽最大努力调动一切能够调动的力量,调整智能生产线,24小时轮班不停机,确保最大限度释放产能,全力保障重点药品的市场供应,同时关爱好企业职工健康,团结带领广大党员群众为百姓健康贡献新华制药的红色国企力量。
□ 责任编辑 张小杰新华制药制剂生产车间智能包装线新华制药制剂生产现场Copyright ©博看网. All Rights Reserved.。
【药品名称】通用名:布洛芬片英文名:Ibuprofen...-威高集团有限公司

【药品名称】通 用 名:布洛芬片英 文 名:Ibuprofen Tablets汉语拼音:Buluofen Pian【性 状】本品为白色薄膜衣片,除去包衣后显白色。
【成 份】本品每片含主要成份布洛芬0.1克。
辅料为淀粉、羟丙基纤维素、微晶纤维素、羟丙基甲基纤维素、滑石粉。
【作用类别】本品为解热镇痛类非处方药药品。
【药理毒理】本品能抑制前列腺素的合成,具有镇痛、解热和抗炎的作用。
本品口服吸收迅速。
【适 应 症】用于减轻疼痛,如关节痛、神经痛、肌肉痛、偏头痛、头痛、痛经、牙痛,也可用于减轻普通感冒或流行性感冒引起的发热。
【用法用量】口服。
成人一次0.2克(2片),若疼痛或发热症状持续不缓解,可间隔4-6小时重复用药一次,24小时内不超过0.8克(8片)。
儿童用量请咨询医师或药师。
【注意事项】1、 本品为对症治疗药,用于止痛不得超过5天,用于解热不得超过3天,症状不缓解,请咨询医师或药师。
2、 对本品及其他解热、镇痛、抗炎药物过敏者禁用。
3、 孕妇及哺乳期妇女禁用。
4、 肾功能不全、高血压、心功能不全、消化道溃疡、血友病或其他出血性疾病(包括凝血或血小板功能异常)的患者,使用前必须咨询医师或药师。
5、 用药期间如出现胃肠道出血,肝、肾功能损害,视力、听力障碍,血象异常,应立即停止用药。
6、 当药品性状发生改变时禁用。
7、 如服用过量或发生严重不良反应时应立即就医。
8、 儿童必须在成人监护下使用。
9、 请将此药品放在儿童不能接触的地方。
【药物相互作用】1、 本品与其他解热、镇痛、抗炎药物同用时可增加胃肠道的副作用,并可能导致溃疡。
2、 本品与肝素、双香豆素等抗凝药同用时,可导致凝血酶原时间延长,增加出血倾向。
3、 本品与地高辛、甲氨蝶呤、口服降血糖药物同用时,能使这些药物的血药浓度增高,不宜同用。
4、 本品与呋塞米(呋喃苯胺酸)同用时,后者的排钠和降压作用减弱;与抗高血压药同用时,也降低后者的降压效果。
5、 如正在服用其他药品,使用本品前请咨询医师或药师。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
证券代码:000756 证券简称:新华制药公告编号:2020-23
山东新华制药股份有限公司
关于布洛芬片(0.1g和0.2g)通过仿制药一致性评价的公告
本公司及董事会全体成员保证信息披露内容的真实、准确和完整,没有虚假记载、误导性陈述或重大遗漏。
近日,山东新华制药股份有限公司(“新华制药”或“本公司”)收到国家药品监督管理局核准签发的布洛芬片(0.1g和0.2g)(“该产品”)《药品补充申请批件》,该产品通过仿制药质量和疗效一致性评价(“仿制药一致性评价”)。
本公司成为国内布洛芬片0.2g第一家、
0.1g第二家通过仿制药一致性评价的企业。
现将相关情况公告如下:
一、基本情况
1.药品名称:布洛芬片
剂型:片剂
规格:0.1g和0.2g
药品分类:非处方药
注册分类:化学药品
申请人:山东新华制药股份有限公司
申请事项:仿制药质量和疗效一致性评价
受理号:CYHB1950333、CYHB1950334
药品批准文号:国药准字H37020387、国药准字H37020386
批件号:2020B02994、2020B02995
审批结论:通过仿制药质量和疗效一致性评价
2.其他相关信息
2019年4月新华制药向国家药品监督管理局递交布洛芬片(0.1g和0.2g)仿制药一致性评价注册申报资料并获受理,同年10月31日CDE发出补充研究通知,2020年1月公司完成补充资料的递交,2020年5月通过仿制药质量和疗效一致性评价审评并获得《药品补充申请批件》。
布洛芬片为解热镇痛类非处方药品,是医保甲类药品,用于缓解轻至中度疼痛如头痛、关节痛、偏头痛、牙痛、肌肉痛、神经痛、痛经,也用于普通感冒或流行性感冒引起的发热。
布洛芬是世界卫生组织、美国FDA共同推荐的儿童退烧药,是公认的儿童抗炎药。
据Insight数据库统计,目前于中国境内上市的布洛芬片企业305家,申请仿制药一致性评价的企业6家。
新华制药生产的0.2g布洛芬片为国内首家通过一致性评价产品。
截至本公告日,公司针对布洛芬片的一致性评价已投入研发费用约为人民币961.64万元。
二、风险提示
新华制药的布洛芬片已有多规格于2020年2月通过美国FDA认证,获得美国市场通行证,成功打响新华品牌,如今该品种又通过了仿制药一致性评价,有利于进一步提升该产品的市场竞争力。
因药品销售业务易受到国内医药行业政策变动、招标采购、市场环境变化等因素影响,存在不确定性,敬请广大投资者理性投资,注意投资风险。
特此公告。
山东新华制药股份有限公司董事会 2020年5月18日。
