Beckmann重排
贝克曼重排

贝克曼重排1. 背景贝克曼重排(Beckmann Rearrangement)是有机化学中一种重要的反应,以德国化学家Ernst Otto Beckmann的名字命名。
该反应可将胺腙(Amide Oxime)转化为相应的酰胺(Amide)或肟(Oxime)转化为相应的酮(Ketone),反应通常在酸性条件下进行。
贝克曼重排在有机合成中具有广泛的应用,因此对该反应的研究非常重要。
2. 反应机理贝克曼重排反应的机理如下:1.首先,酸性条件下,负电荷的氧原子攻击羰基碳,生成一个离子型的中间体。
2.离子中间体经过重排,重新排列原子,形成贝克曼重排产物。
3.最后,质子化产物使其中的阴离子中间体离去,生成目标酰胺或酮。
反应机理简化表达为以下步骤:beckmann rearrangement mechanismbeckmann rearrangement mechanism3. 应用示例3.1. 合成酰胺贝克曼重排反应可用于将胺腙转化为相应的酰胺。
以下是一个示例反应:H3C-C(=O)NHOH -> H3C-C(=O)NH23.2. 合成酮贝克曼重排反应也可用于将肟转化为相应的酮。
以下是一个示例反应:CH3-C(=O)NHOH -> CH3-C(=O)-CH34. 影响因素贝克曼重排反应的速率和产率受多种因素的影响,包括但不限于:•温度:通常,反应在较高温度下进行,因为贝克曼重排反应是一个热力学过程。
•酸性:由于反应是在酸性条件下进行的,酸性的选择和浓度会影响反应的速率和产率。
•反应物浓度:反应物浓度的变化也会影响反应的速率和产率。
5. 结论贝克曼重排是一种重要的有机化学反应,可用于合成酰胺和酮。
该反应具有广泛的应用领域,如药物合成和材料科学等。
了解贝克曼重排的反应机理和影响因素对于优化反应条件和提高反应产率至关重要。
进一步的研究可以探索更多应用领域和改进该反应的方法。
参考文献[1] Beckmann, E. (1886).。
应用化学 beckmann重排

陈尧 应用化学
Beckmann重排定义
酮肟类化合物在酸性催化剂的作用 下,重排成取代的酰胺称之为Beckmann 重排反应。
Beckmann重排反应式
反应机理
Beckmann反应化学式
重排反应过程
a、酮肟在酸催化下,经过氮一氧键的异裂, 生成 缺电子的(1); b、处于肟羟基反位的烃基即进行分子内的迁 移,形 成氮杂环丙烯的过渡正离子(2); c、瞬即转变成活泼的nitrilium离子(3)并立即 与反应介质中的亲核试剂,如水作用生成 亚胺(4),最后异构化而得取代酰胺(5) 。
哪种异构体占优势与其构型的稳定性有关, 而构型的稳定性又受到肟羟基的立体位阻和取 代基的电子效应的影响,一般地说,以位阻大 的羟基与肟羟基处于反位者占优势。
(2)重排反应的条件 在反应中,催化剂的选择 反应温度及溶剂对反 应速度、收率、酰胺异构 体的比例有很大影响, 一般来说,极性溶剂和较高的温度都能加速反应。
参考文献
[1]李德江,孙碧海,李斌.浅谈Beckmann重排 在有机合成中的应用[J].化学教育.2004,3:7-9. [2]邢其毅,徐瑞秋.基础有机化学.北京:高等教 育出版社,1994:459. [3]力吉木仁.甾体酮肟的贝克曼重排反应.大 学化学[J].1995,10(5):53-56.
谢谢观看
但有些酮肟在排条件下,得不到正常的重排 产物,例如:
总结
除了人们熟悉的环己酮肟经Beckmann重排 生成己内酰胺(合成尼龙一6的单体)以外,它在有 机合成中的应用日益广泛,例如:化合物1,3, 4,5-四氢-1H-[1]苯并氮杂卓-2-酮(新一代抗高血 压药Benazepril的重要中间体)的合成和甾体内酰 胺的合成,都获得了很高的收率。 我们可以预料在不久的将来,Beckmann重排 反应会在多方面得到应用,放射出异样的光彩。
酰胺和Beckman重排

• • • •
基本简介 酰胺可以看作羧酸与氨或胺缩合形成的化合物,是羧 酸衍生物的一类。 酰胺可以由肟通过beckmann重排而获 得。也可以从腈水解而来。 有机酰胺中的C-N键比起胺中 的C-N键要短很多。这一方面是因为酰胺中C-N键的碳是用 sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨 道与氮成键,s成分较少;另一方面是因为羰基与氨基的 氮共轭,从而使C-N键具有某些双键性质造成的。
• (3)磺胺类及氯胺类药物 • 烃分子中的氢原子被磺基(-SO3H)取代而成的化合物叫磺酸。芳香 磺酸最为重要,例如苯磺酸。磺酸的化学性质与羧酸类似,但酸性比 羧酸强得多。苯磺酰氯与氨或胺作用,可生成磺酰胺。 在医药上, 重要的磺酰胺类化合物有磺胺类药物及氯胺类药物。 • a.磺胺类药物:磺胺类药物是优良的化学治疗剂,开始应用于20世 纪30年代。它们能抑制多种细菌,如链球菌、葡萄球菌、肺炎球菌、 脑膜炎球菌、痢疾杆菌等的生长和繁殖,因此常用以治疗由上述细菌 所引起的疾病。 最简单的磺胺类药物是对氨基苯磺酰胺,简称磺胺 (SN)。 磺胺是无色晶体,熔点163℃,味微苦,微溶于水。磺胺能 溶于强酸或强碱溶液中,这是由于它在苯环上连有氨基,因此能与酸 作用生成盐;同时。与磺胺基结合的氨基上的氢原子,因受磺酰基的 影响而呈酸性,故又能与碱作用。 磺胺口服时副作用很大,仅外用 以治疗化脓性创伤。为了减少磺胺的副作用,一般采用其它原子团取 代磺酰氨基上的氢原子, 其副作用较小,称为磺胺类药物。 磺胺类 药物的抗菌谱广,性质稳定,口服吸收良好,使用方便。表18-2是一 些常见的磺胺类药物。甲氧芐氨嘧啶(TMP),在化学结构上不属于 磺胺类,但它能加强磺胺药的作用,也能增强多种抗生素的疗效,称 为磺胺增效剂,常与磺胺类药物或抗生素伍用。 甲氧苄氨嘧啶(TMP) 常见的磺胺类药物 • b.氯胺类药物:苯磺酰胺分子中,氨基的氢原子被氯原子取代的化 合物叫做氯胺类药物。例如: 氯胺类药物是白色或黄色结晶性粉末, 微具氯气味。能溶于水及乙醇,难溶于乙醚等有机溶剂。 氯胺类药 物都是氧化剂,它们与水反应生成次氯酸或次氯酸钠,而有杀菌和对 化学毒剂的消毒作用,故在军事医学上有重要意义。
Beckman重排反应

11.1PEG-OSO3H的制备将PEG-6000 溶于适量的二氯甲烷中,然后在冰浴下边搅拌边滴入氯磺酸(10倍过量于PEG-6000)的二氯甲烷溶液,约60 min滴加完毕,冰浴搅拌2 h,升温至室温后搅拌24 h,反应完毕后蒸馏出部分二氯甲烷,冷却,将反应液倒入冷的乙醚中,有白色沉淀PEG-OSO3H析出,冷冻,抽滤,最后用乙醚洗涤三次,自然风干。
1.2PEG-OSO3H催化Beckmann重排反应将5 mL的乙腈加入50 mL的圆底烧瓶中,再加入苯乙酮肟(270 mg,2 mmol),然后加热升温到65 ℃,再加入PEG-OSO3H(0.6 mmol, 3.66 g)约1 min 加完,升温回流约5 小时,经TLC检测反应完毕后减压蒸馏出乙腈,冷却到室温,倒入适量乙醚搅拌,PEG-OSO3H沉淀析出,抽滤后蒸馏出乙醚即得粗产品乙酰苯胺,粗产品经柱层析或重结晶后得到纯品。
在相同的条件下,用PEG-OSO3H催化醛肟脱水生成相应的腈。
产物的熔点值都与文献值基本一致,目标化合物经IR和1H NMR表征也和真实样品基本吻合。
1.3PEG-400/对甲苯磺酸体系催化Beckmann 重排反应在50 mL烧瓶中加入PEG-400(4 mL, 4.5 g, 10.8 mmol),后加入二苯甲酮肟(395 mg,2mmol)搅拌油浴升温到65℃,加入对甲苯磺酸(220 mg,1.3 mmol),然后,将烧瓶油浴加热至115℃,恒温搅拌6 h,经TLC跟踪检测,反应完毕后冷却,加入氢氧化钠约1.1 mmol,然后加入冰水40 mL,产物即以白色沉淀析出,抽滤。
粗产品经柱层析或重结晶后得纯品。
在相同的条件下,对甲苯磺酸催化醛肟脱水生成相应的腈。
产物的熔点值都与文献值基本一致,目标化合物经IR和1H NMR表征也和真实样品基本吻合。
反应结束后,将反应混合物倒入冰水中,析出沉淀,过滤,水洗,得到产物。
合并滤液,用二氯甲烷萃取,萃取液减压下蒸除二氯甲烷,得到PEG,实验发现,PEG-400 的回收率为85 %左右。
【NR】Beckmannrearrangement贝克曼重排

【NR】Beckmannrearrangement贝克曼重排在酸性介质中,醛肟和酮肟转变为相应的酰胺,称为贝克曼重排。
该反应主要用于工业上从环己酮生产己内酰胺,作为生产合成聚酰胺纤维(尼龙66)的单体。
该反应通常在苛刻条件下进行(高温>130°C,大量的强质子酸),它是非催化的。
1)常用的Bronsted酸有:H2SO4, HCl/Ac2O/AcOH等,这意味着反应中不能使用敏感的底物2)重排的立体化学结果是可以预测的:R基团对氮上的离去基团的反作用力会迁移3)如果肟在反应条件下异构化,就会得到两种可能的酰胺的混合物4)由于氢原子不迁移,因此该方法不能用于双取代酰胺的合成在该机理的第一步中,X基团通过亲电试剂的反应转变为离去基。
处于离去基反位的R基团进行[1,2]-迁移。
生成的碳正离子与亲核试剂(水分子或离去基)发生反应,经过互变异构化后生成酰胺。
1) Rhodium-Catalyzed Beckmann RearrangementOrganic Letters 2001, 3, 2, 311-3122)Cyanuric Chloride as a Mild and Active Beckmann Rearrangement CatalystJournal of the American Chemical Society 2005, 127, 32, 11240-112413)Beckmann Rearrangement of Ketoximes to Lactams by Triphosphazene CatalystThe Journal of Organic Chemistry 2008, 73, 7, 2894-28974)Dichloroimidazolidinedione-Activated Beckmann Rearrangement of Ketoximes for Accessing Amides and LactamsThe Journal of Organic Chemistry 2018, 83, 4, 2040-20495)Beckmann Rearrangement of Oximes under Very Mild ConditionsThe Journal of Organic Chemistry 2002, 67, 17, 6272-6274Beckmann rearrangement最重要的工业应用在于从环己酮生成己内酰胺,这是用于制备聚己二酰己二胺(俗称尼龙66)的单体。
酮肟Beckmann重排反应研究

研究报告酮肟Beckmann重排反应在酰胺类化合物合成中的应用研究目录第一章酮肟重排反应最优化条件研究的实验方案 ................................................. - 2 -1.1课题背景、意义及介绍 ....................................................................................... - 2 -1.2实验方案设计 .......................................................................................................... - 2 -1.2.1制备底物肟................................................................................................... - 2 -1.2.2最优离子溶剂的筛选................................................................................ - 3 -1.2.3最优催化剂的筛选 .................................................................................... - 3 -1.2.4最优条件下底物取代基对反应的影响 .............................................. - 3 -1.2.5最优条件下的循环反应........................................................................... - 4 -1.2.6产物的表征测试 ......................................................................................... - 4 -第二章酮肟重排反应最优化条件研究的实验方法与步骤................................... - 5 -2.1实验原料与设备...................................................................................................... - 5 -2.1.1实验原料(如表1)................................................................................. - 5 -2.1.2实验仪器(如表2)................................................................................. - 6 -2.2实验方法与步骤...................................................................................................... - 6 -2.2.1制备底物肟................................................................................................... - 6 -2.2.2最优离子溶剂筛选 .................................................................................... - 8 -2.2.3最优催化剂筛选 ......................................................................................... - 8 -2.2.4最优条件下底物取代基对反应的影响 .............................................. - 8 -2.2.5最优条件下的循环反应........................................................................... - 8 -2.2.6产物的表征测试 ......................................................................................... - 9 -第三章酮肟重排反应最优化条件研究的结果与讨论 ......................................... - 10 -3.1制备底物肟 ............................................................................................................ - 10 -3.2最优离子溶剂筛选.............................................................................................. - 14 -3.3最优催化剂的筛选.............................................................................................. - 15 -3.4 3.4 最优条件下底物取代基对反应的影响 ............................................... - 16 -3.5最优条件下的循环反应 .................................................................................... - 20 -3.6实验结果总结 ....................................................................................................... - 21 -3.7参考文献................................................................................................................. - 22 -第四章附图:...................................................................................................................... - 23 -4.1肟 ............................................................................................................................... - 23 -4.1.1............................................................................................................................ - 23 -4.1.2............................................................................................................................ - 24 -4.2酰胺 .......................................................................................................................... - 26 -4.2.1............................................................................................................................ - 26 -4.2.2............................................................................................................................ - 27 -4.2.3............................................................................................................................ - 28 -4.2.4............................................................................................................................ - 28 -4.2.5............................................................................................................................ - 29 -第一章酮肟重排反应最优化条件研究的实验方案1.1课题背景、意义及介绍酰胺在有机化学和生物化学中是一类非常重要的官能团,因此发展高效和可持续性的方法制备酰胺类化合物具有重要的现实意义。
Beckmann重排制己内酰胺研究进展

Beckmann重排制己内酰胺研究进展1886年Beckmann发现五氯化磷与二苯酮肪作用时,生成了苯甲酞苯胺。
他首次提出酮肘能够发生重排反应,他认为重排反应的形式是羟基和肟的烷基之一的移换,所应用的试剂仅是催化剂。
Beckmann重排反应的特点:①分子内协同的亲核同步反应:Beckmann重排是分子内协同的亲核重排反应,其中烃基的迁移与反式位置羟基的离去是同时发生的,是属于同步协同的反应;②手性分子迁移前后的构型保持不变:如果迁移基团为手性碳原子,其迁移后的手性构型保持不变;③烃基的迁移为反位迁移:烃基的迁移是立体专一的,由于迁移的基因只能从羟基背面进攻缺电子的N原子,因此,烃基的迁移为反位迁移;④紫外线照射下,Z式、E式结构互变;⑤芳基比烷基优先迁移。
Beckmann重排反应最初主要用于鉴定生成的酰胺或酰胺的水解产物,测定原来酮肟的结构,随着该反应研究的不断深入,现已广泛应用于有机合成中,合成一系列的有机原料。
该类反应的原子转化率为100%,是原子经济性反应,是绿色化学的首选反应类型之一。
Beckmann重排还可认为是一个较为普遍的反应,它不仅适用于大多数的酮肟及酮肟的衍生物,而且一些α位上有氨基、羟基、羰基或酯基存在的酮肟进行Beckmann重排时,生成的不是酰胺,而是碳碳键断裂后生成的腈、芳醛或芳酸,这样一种类型的Beckmann重排反应称为“第二类Beckmann重排”或“Beckmann 裂解”反应。
Beckmann重排反应的研究有着重要的意义:①对有机化学结构理论的阐明有着积极的作用;②用来确定酮肠和酮的结构;③代替由酸和胺反应制取酸胺的困难,特别是从酸胺再进一步制取。
现今,关于Beckmann重排反应的机理,多数认为是在催化剂(包括酸性催化剂)影响下,肟的氮氧键部分离子化形成缺电子的氮原子,同时位于经基反位的原子团发生分子内转移而形成过渡状态正离子。
重排反应的最初产物为亚胺衍生物,它迅速重排为相应的酰胺。
环己酮肟的重排.

实验原理
制备己内酰胺的原理
O + NH2OH - H2O N OH H+ N OH2
N - H2O
OH
20%NH4OH
NH
O
实验步骤
羟胺盐酸盐 4.9 g 30mL水溶解 环己酮 5.25 mL 塞住瓶口激烈振荡 冷却,抽滤 环己酮肟 o 无水醋酸钠 7 g 分批加入 至白色粉状固体析出 洗涤,干燥 mp:89-90 C
三颈烧瓶 环己酮肟5g 85%硫酸5 mL
安装温度计 回流冷凝管 磨口塞
升温至120oC 立即移去热源
强烈反应 3-5d水冷却 棕色粘稠液体
冷却至80oC以下 冰盐浴冷却至0-5oC
MgSO4干燥 转入分液漏斗 滴加浓氨水 至 Ph=8 油层 12-20oC以下
减压蒸馏 收集137-140/1.6kPa馏分
己内酰胺 mp:69-70oC
实验装置
温度计 回流冷凝管 磨口塞
三颈烧瓶
注意事项
1. 与羟胺反应时温度不宜过高。加完环己酮以后, 充分摇荡反应瓶使反应完全,若环己酮肟呈白色小球 状,则表示反应未完全,需继续振摇。 2. 重排反应很激烈,升温至110-120oC,要求立即移 去热源,当温度上升至130oC时,可从回流冷凝管上口 适量滴加3-5滴水冷却。 3. 氨水中和时会大量放热,故滴加氨水时滴加速度 要慢。否则温度太高,将导致酰胺水解。 4. 己内酰胺为低熔点固体,减压蒸馏过程中极易固 化,堵塞管道,可采用空气冷凝管,并用电吹风在外 壁加热等方法,防止固体析出。
Beckmann 重排 环 己 酮 肟 的 重 排
实验目的
۩ 验证Beckmann重排反应
۩ 学习Beckmann重排反应的实施方法 ۩ 复习搅拌滴加、液体干燥、减压蒸馏等 操作
Beckmann重排反应的综合性实验设计与教学应用

大 学 化 学Univ. Chem. 2024, 39 (1), 239收稿:2023-06-13;录用:2023-08-15;网络发表:2023-09-01 *通讯作者,Email:****************.cn基金资助:2022浙江农林大学教改项目(SZJY21003)•化学实验•doi: 10.3866/PKU.DXHX202306025Beckmann 重排反应的综合性实验设计与教学应用周建钟,郭明*,陶厚璜,郑泽涛浙江农林大学化学与材料工程学院,杭州 311300摘要:Beckmann 反应是含有羰基的醛、酮与羟胺反应生成有机肟,在催化剂作用下发生重排,在有机合成中具有重要意义。
针对实验教学中有机肟Beckmann 重排反应的实验原理直观性不足、反应机理佐证性欠缺等问题,通过二苯甲酮与盐酸羟胺反应生成二苯甲酮肟,多聚磷酸催化分子重排反应生成苯甲酰基苯胺为案例,交叉运用无机化学、分析化学、仪器分析的知识和实验技能,测定阶段产物和终产物的熔点、红外光谱、核磁共振谱并表征其结构,将宏观理化性质与微观结构相结合,解析和验证反应机理,达到Beckmann 重排反应实验原理直观、反应机理佐证完善的结果,实验的综合设计与交叉创新提升了Beckmann 重排实验的教学效果,并激发学生的创新意识。
本文既可为肟类Beckmann 重排反应的综合性、设计性实验提供借鉴,也可为教材及实验的改进提供有价值的参考。
关键词:Beckmann 重排;实验教学;二苯甲酮肟;反应机理 中图分类号:G64;O6Comprehensive Experimental Design and Teaching Application of Beckmann Rearrangement ReactionJianzhong Zhou, Ming Guo *, Houhuang Tao, Zetao ZhengSchool of Chemical and Material Engineering, Zhejiang A&F University, Hangzhou 311300, China.Abstract: The Beckmann rearrangement, a pivotal reaction wherein carbonyl-rich aldehydes and ketones engage with hydroxylamines to forge organoximes, undergoes a rearrangement in the catalyst's presence and holds significant importance in organic synthesis. Addressing the perceptual gaps in understanding the experimental principles and the insufficient verification of reaction mechanisms during the instruction of Beckmann rearrangement of organoximes, this study utilizes the reaction between benzophenone and hydroxylamine hydrochloride. This reaction results in benzophenone oxime, which undergoes molecular rearrangement catalyzed by polyphosphoric acid to produce benzoyl aniline. This exercise adeptly interweaves elements from inorganic, analytical, and instrumental analysis chemistry, augmenting holistic design and innovative capabilities of students. Employing tools like melting point assessment, infrared spectroscopy, and nuclear magnetic resonance, this study elucidates the nuanced structures of both intermediate and final products. By juxtaposing macroscopic physicochemical attributes with their microscopic counterparts, it robustly deciphers and authenticates the underlying reaction mechanism, enhancing the pedagogical efficacy of the Beckmann rearrangement and kindling innovative sense. This paper can serve as a reference for comprehensive and design-focused experiments on oxime-type Beckmann rearrangements, and also provide valuable insights for the enhancement of teaching materials and experimental procedures.Key Words: Beckmann rearrangement; Laboratory teaching; Benzophenone oxime; Reaction mechanisms脂肪酮和芳香酮都可以与羟胺作用生成肟,肟在酸性催化剂如硫酸、五氯化磷或多聚磷酸作用下发生分子重排生成酰胺的反应称为Beckmann重排。
Beckmann重排反应

Beckmann重排反应展开全文肟在酸催化下重排得到酰胺的反应。
各种强质子酸,路易斯酸和各种能与肟羟基形成好的离去基团的化合物(如TsCl,PCl5,TCT等)都可以引发反应。
此反应与Hofmann重排,Schmidt反应和Curtius重排类似,反应中会形成带正电的氮原子, 会发生烷基迁移。
反应机理一、质子酸催化机理肟顺反异构的互变有很高的能垒,反应中首先肟的氧原子质子化,处在反位的烷基迁移到氮原子上,与此同时N-O键断裂,脱水,进而形成氮正离子中间体,加一分子水,脱质子,异构化得到酰胺。
二、PCl5催化机理类似,磷氧化物作为离去基团,引发重排。
底物的离去基团都是反式迁移。
反应实例【Synth. Commun. 2000, 30, 2105-2011】【Synth. Commun. 2001, 31, 2047-2050】【Synthesis, 2002, 1057-1059】【J. Org. Chem., 2002, 67, 6272-6274】【Tetrahedron Lett., 2003, 44, 755-756】【Org. Lett. 2005, 7, 2067-2069】【Synthesis 2006, 2319-2322】【J. Org. Chem., 2007, 72, 4536-4538】【J. Org. Chem., 2008, 73, 2894-2897】【Synthesis, 2010, 3705-3709】【Synthesis, 2010, 1771-1776】【J. Org. Chem., 2010, 75, 1197-1202】【Synlett, 2014, 25, 665-670】【J. Org. Chem., 2018, 83, 2040-2049】【J. Am. Chem. Soc., 2018, 140, 5264-5271】【Synlett, 2018, 29, 1465-1468】【J. Org. Chem., 2018, 83, 13080-13087】【Synthesis, 2019, 51, 3709-3714】【Org. Lett., 2019, 21, 2818-2822】另外有一些非常规的Beckmann重排反应,迁移片段迁移后,可以得到稳定的腈类化合物和稳定的碳正离子,相当于Ritter反应的逆反应。
固体酸催化环己酮肟液相Beckmann重排

固体酸催化环己酮肟液相Beckmann重排固体酸催化剂是一种新型的环保催化材料,具有很高的催化活性、良好的选择性、低腐蚀性、易回收循环使用的特点,随着环保意识和绿色化学理念的不断加深,环境友好型的绿色催化工艺技术受到了越来越多的重视。
将固体酸催化剂应用于环己酮肟液相Beckmann重排中,不仅可以缓解催化剂的结焦,延长催化剂的寿命,又能实现催化剂与反应液的迅速分离,对开发环境友好的己内酰胺生产工艺具有十分重要的意义。
本文制备了四种类型的固体酸催化剂,对其进行了表征分析,催化环己酮肟液相Beckmann重排,并对催化剂的活性中心、重排产物的生成历程进行了探究。
本文首先采用沉淀-浸渍法合成了硫酸化氧化锆S-ZrO<sub>2</sub>,对其进行了傅里叶红外、热重、吡啶吸附红外和NH3-TPD等表征分析,并将其应用于液相Beckmann重排中。
结果表明,由于S-ZrO<sub>2</sub>的比表面太小,其对环己酮肟的活性很低,但SO42-与Zr形成的酸性位利于己内酰胺的生成。
除环己酮外,体系中主要副产物是环己酮肟的缩聚产物、聚合产物和己内酰胺的缩聚产物,而环己酮肟聚合生成的水会进一步水解环己酮肟生成环己酮。
其次,采用MFI结构的沸石分子筛为载体,先向其中掺入杂原子Zr,再用硫酸浸渍,使Zr与SO42-结合形成类似超强酸的结构,制备出硫酸化锆硅分子筛S-ZS,并考察其催化液相Beckmann重排的性能。
结果表明,Zr原子的掺入和硫酸功能化都能增加催化剂对环己酮肟的活性,增加对己内酰胺的选择性并减少对环己酮的选择性。
S-ZS的强酸中心生成的己内酰胺更难脱附,易进一步反应生成高沸点产物,其催化环己酮肟Beckmann重排反应的副产物种类和体系中水的生成途径与S-ZrO<sub>2</sub>相同。
进一步采用模板离子交换法和原位合成法制备了两种含铝分子筛TIE-MCM-41和SA20-MCM-41,对两种催化剂进行了表征,对比了两种分子筛催化Beckmann重排的结果,并对结果的差异进行了分析。
4-重排反应-其他重排反应

αβ γ OCH 2CH CHCH 3
△
H3C
αβ OCH 2CH
CH 3
γ CHCH 3
△
OH γβ CHCH CH 3
α CH 2
H3C
OH CH 3
αCH 2βCH=CγHCH 3
克莱森(Claisen)重排机理:
α Oβ
γ
α
O
β
γ
过渡态
互变异构
原烯丙基中的γ-C与苯环相连
贝克曼重排反应历程中,中间体是“氮宾”正离子,随即邻近烃基转移到这 个正中心形成邻碳正离子,然后水合,去质子,异构化得到酰胺。以上各步 反应是连续且同时发生的。
Beckmann贝克曼重排反应的应用实例 环己酮肟在硫酸作用下重排生成己内酰胺:
己内酰胺是制造尼龙6的重要原料,所以此反应也是贝克曼重排的一 个很重要的应用
13.2.3 Hofmann 霍夫曼重排 霍夫曼重排反应指的是酰胺与次氯酸钠或次溴酸钠的碱溶液作用时,
脱去羰基生成少一个碳的伯胺反应:
R-CONH₂ + NaOX + 2NaOH——→R-NH₂ +Na₂CO₃+ NaX +H₂O
由于在反应及过程中由于发生了亲核重排,所以又称为霍夫曼重排反应。R基 由于是迁移,所以具有光学活性的基团在重排后构型不变。
α
O
β
γ
H
OH
பைடு நூலகம்γ β
α
例1:
O-CH2-CH=14CH2
H3C
CH3
H3C
经两次六元状过渡态
α Oβ
γ
α
O
β
γ
OH CH3
CH2CH=14CH2
应用化学beckmann重排

Beckmann重排试剂
重排试剂作用:使酮肟的羟基转换成活性的 离去基团,有利于氮-氧键的断裂。
贝克曼重排试剂种类:除质子酸,H2SO4 , HCl,PPA外,还有PCl5 ,POCl3 ,Ph3PCCl4 以及苯磺酰氯等。
• 二苯酮肟在吡啶催化下,与苯磺酰氯 在室温条件下,得到N-苯磺酰基苯甲酰 苯胺,最后得到酰胺。
•(2)重排反应的条件 • 在反应中,催化剂的选择 反应温度及溶剂对反 应速度、收率、酰胺异构 体的比例有很大影响, 一般来说,极性溶剂和较高的温度都能加速反应。
• 异丁基苯基酮肟为E式异构体,用不同的催 化剂和溶剂,得到不同的产物。
• 在酮肟的结构中若含有酸敏感的基团,可 选用吡啶为溶剂,酰氯为催化剂进行重排反应 。
我们可以预料在不久的将来,Beckmann重排 反应会在多方面得到应用,放射出异样的光彩。
参考文献
[1]李德江,孙碧海,李斌.浅谈Beckmann重排 在有机合成中的应用[J].化学教育.2004,3:7-9.
[2]邢其毅,徐瑞秋.基础有机化学.北京:高等教 育出版社,1994:459.
[3]力吉木仁.甾体酮肟的贝克曼重排反应.大 学化学[J].1995,10(5):53-56.
Beckmann重排反应介质影响
•如果反应介质中有其他亲核性的化合物,如醇 、酚、胺或叠氮化合物存在,也可以向nitrilium 离子做亲核进攻,生成其他化合物,得不到酰 胺产物。
影响Beckmann重排反应因素
(1)酮肟的几何结构 酮肟有顺式(z)和反式(E)2种几何异构,本重
排的迁移基团即是位于肟羟基反位的烃基,这就 与酮肟的立体异构有关。
若用酮肟的2种异构体的混合物进行反应,重 排结果将得到酰胺的混合物。若重排的条件不会 引起异构体的转化,则只得到一种酰胺产物。
反常Beckmann重排

反常Beckmann重排
在Beckmann重排过程中,如果迁移基团是一个可以稳定碳正离子的官能团,那么过渡态就有可能是稳定碳正离子离去的过渡态。
这在固醇类的Beckmann重排过程中是非常常见的,尤其是形成叔碳正离子之后还有可能发生消除,得到腈和稳定的烯烃。
下面给出一个通式:
这类反应常常在多环体系中发生,尤其是含有角甲基的多环萜类,很容易得到三级碳正离子。
从下面的例子来看,反应并不一定是完全的E1消除,而是有一定的协同过程。
无论是Lewis酸还是质子酸,都可能发生反常Beckmann重排。
[贝克曼重排]二级贝克曼重排:二级贝克曼重排
![[贝克曼重排]二级贝克曼重排:二级贝克曼重排](https://img.taocdn.com/s3/m/6fce2d71f4335a8102d276a20029bd64783e62a9.png)
[贝克曼重排]二级贝克曼重排:二级贝克曼重排篇一: 二级贝克曼重排:二级贝克曼重排-二级贝克曼重排,二级贝克曼重排-相关二级贝克曼重排又称异常贝克曼重排,例如在路易氏酸或质子酸的作用下生成腈及其他与之相关的化合物。
[)贝克曼重排_二级贝克曼重排-二级贝克曼重排二级贝克曼重排;异常贝克曼重排;second order Beckmann rearrangement又叫异常贝克曼重排。
α-二酮、α-酮酸、α-二烷基氨基酮、α-羟基酮和β-酮醚所形成的肟。
如在路易氏酸或质子酸的作用下生成腈及其他与之相关的化合物。
贝克曼重排_二级贝克曼重排-相关条目篇二: 贝克曼重排贝克曼重排反应是1个由酸催化的重排反应,反应物肟在酸的催(]化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名试例反应的反应物为环己酮并生成己内酰胺。
因为己内酰胺是制造尼龙6的重要原料,所以此反应也是贝克曼重排的1个很重要的应用。
贝克曼溶剂被广泛用来催化重排反应,其实际成分为乙酸,盐酸和乙酸酐。
也可以其他种类的酸催化,例如硫酸和多磷酸。
在实际工业制造酰胺的流程中,通常使用的是硫酸,因为用氨进行中和处理后可以得到硫酸铵,后者是1种重要的化肥,能为土壤提供氮和硫。
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例。
贝克曼重排反应机理
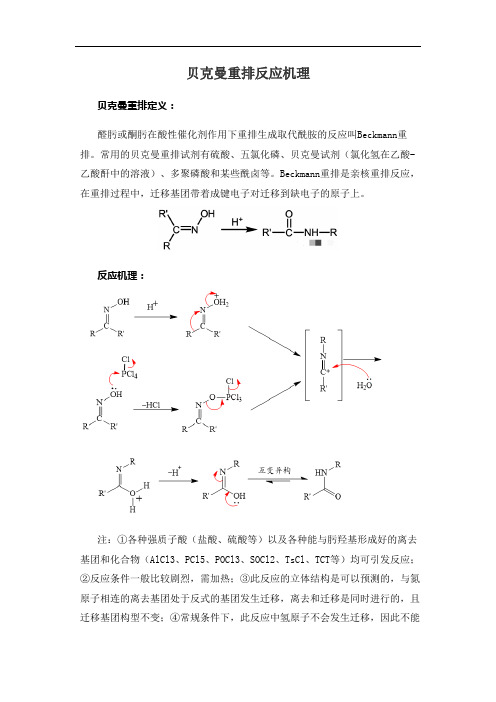
贝克曼重排反应机理贝克曼重排定义:醛肟或酮肟在酸性催化剂作用下重排生成取代酰胺的反应叫Beckmann重排。
常用的贝克曼重排试剂有硫酸、五氯化磷、贝克曼试剂(氯化氢在乙酸-乙酸酐中的溶液)、多聚磷酸和某些酰卤等。
Beckmann重排是亲核重排反应,在重排过程中,迁移基团带着成键电子对迁移到缺电子的原子上。
反应机理:注:①各种强质子酸(盐酸、硫酸等)以及各种能与肟羟基形成好的离去基团和化合物(AlCl3、PCl5、POCl3、SOCl2、TsCl、TCT等)均可引发反应;②反应条件一般比较剧烈,需加热;③此反应的立体结构是可以预测的,与氮原子相连的离去基团处于反式的基团发生迁移,离去和迁移是同时进行的,且迁移基团构型不变;④常规条件下,此反应中氢原子不会发生迁移,因此不能通过此反应制备N上无取代基的酰胺。
但是,在一些金属催化剂的作用下,可以实现醛肟的重排得到伯酰胺。
反应特点(1)离去基团与迁移基团处于反式,这是根据产物推断的;(2)基团的离去与基团的迁移是同步的,如果不是同步,羟基以水的形式先离开,形成氮正离子,这时相邻碳上两个基团均可迁移,得到混合物,但实验结果只有一种产物,因此反应是同步的;(3)迁移基团在迁移前后构型不变;(4)可用于制备取代酰胺、伯胺、氨基酸等应用实例于反应瓶中,加入盐酸羟胺(12g),结晶醋酸钠(17 g),水(150mL),搅拌溶解。
于60~65℃分5次加入对羟基苯乙酮(15g),而后继续搅拌反应1h。
冷至室温,抽滤生成的固体,水洗干燥,得中间体,收率92.5%,mp 144~145℃。
将中间体(10g)溶于70%的硫酸中,搅拌下用氨水中和,保持反应液温度在20℃,调至pH=8。
用氯仿提取3次,合并氯仿层水洗,无水硫酸钠干燥。
减压蒸出氯仿,减压蒸馏,收集137~140℃/167kPa的馏分,很快固化为白色结晶,收率50.5%,mp170~172℃。
例子2:乙腈催化醛肟制伯酰胺说明:1.部分图片来源于网络,侵删!2.实验步骤仅供参考!。
《有机化学反应类型》重排反应的类型

《有机化学反应类型》重排反应的类型有机化学反应类型——重排反应的类型在有机化学的广袤领域中,重排反应是一类引人入胜且具有重要意义的反应类型。
重排反应指的是分子中的某些原子或基团发生重新排列,从而生成结构不同的产物。
这类反应在有机合成中常常被巧妙运用,为合成具有特定结构和功能的有机化合物提供了独特的途径。
重排反应的类型丰富多样,其中较为常见的包括 WagnerMeerwein重排、Pinacol 重排、Beckmann 重排、Hofmann 重排以及 Claisen 重排等。
WagnerMeerwein 重排通常发生在碳正离子的环境中。
当一个碳正离子形成后,如果其相邻的碳原子上存在更能稳定正电荷的基团,那么这个基团就会带着它的电子迁移到带正电荷的碳原子上,从而导致碳骨架的重排。
比如说,在萜类化合物的生物合成过程中,这种重排反应就发挥着关键作用。
Pinacol 重排则是 1,2-二醇在酸性条件下发生的重排反应。
在这个过程中,首先羟基被质子化,然后脱水形成碳正离子。
接着,相邻的基团迁移到碳正离子上,得到酮类化合物。
这一重排反应在合成一些复杂的酮类化合物时具有重要价值。
Beckmann 重排是肟在酸性条件下发生分子内重排生成酰胺的反应。
肟中的羟基与酸作用形成酯,接着发生重排,烷基带着电子转移到氮原子上,同时生成碳正离子,最后水解得到酰胺。
它在有机合成中是制备酰胺的一种有效方法。
Hofmann 重排是酰胺在碱性条件下与卤素作用,失去羰基生成伯胺的反应。
反应中酰胺首先与碱作用生成氮负离子,然后与卤素反应生成 N卤代酰胺。
接着,经过一系列重排和水解步骤,最终得到伯胺。
Claisen 重排是烯丙基芳基醚在高温下发生的重排反应。
反应中,烯丙基从氧原子迁移到芳环的邻位,生成邻烯丙基酚。
这一重排反应在天然产物的合成以及复杂分子的构建中经常被运用。
除了上述这些经典的重排反应类型,还有一些其他的重排反应也值得关注。
比如Fries 重排,它是酚酯在路易斯酸催化下发生的重排反应,生成邻位或对位的酚酮化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Beckmann 重排
数据来源:维基百科,自由的百科全书
贝克曼重排反应(Beckmann rearrangement )是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若
起始物为环肟,产物则为内酰胺。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名[1][2][3]。
试例反应[4]的反应物为环己酮并生成己内酰胺。
因为己内酰胺是制造
尼龙6的重要原料,所以此反应也是贝克曼重排的一个很重要的应用。
贝克曼溶剂被广泛用来催化重排反应,其实际成分为乙酸,盐酸和乙酸酐。
也可以其他种类的酸催化,例如硫酸和
多磷酸。
在实际工业制造酰胺的流程中,通常使用的是硫酸,因为用氨进行中和处理后可以得到硫酸铵,后者是一种重要的化肥,能为土壤提供氮和硫。
目录
∙ 1 反应机理
∙ 2 氰尿酰氯辅助贝克曼反应
∙ 3 异常贝克曼重排反应
∙ 4 参见
∙ 5 参考文献
编辑 反应机理
根据推测,贝克曼重排的反应机理首先是烷基的迁移并推走羟基形成腈基基团,接下来该中间体被水解,形成产物酰胺。
反应式如下:
在一个研究中[5],研究者使用电脑模拟丙酮肟在贝克曼溶剂中的重排反应,并考虑到了溶剂分子和取代物的影响。
模拟表明,有三个乙酸分子和一个质子(以氧鎓的形式纯在)参与了反应。
形成亚胺中间体后(σ配合物),甲基通过协同反应迁徙到氮上,并推走羟基。
羟基中氧原子受到三个乙酸分子的稳定。
接下来,一分子水进攻亲电的碳原子,其中一个氢原子被一个乙酸接收,生成的中间体为N-甲基乙酰氨酸,其中氧原子为四配位。
最后异构化行程稳定的产物酰胺。
当计算对象是一个水合氢离子和六分子水的时候,结果相同。
但是当移动基团为苯基的时候,例如在苯乙酮肟的重排反应中,反应更倾向于生成三元π-配合物。
此配合物在对H3O+(H2O)6的研究中没有发现。
在环己酮肟的例子中,因为要释放环张力,所以有了第三种反应机理。
它是通过一步协同反应步骤直接生成质子化的己内酰胺,而没有π-配合物或σ-配合物中间体。
编辑氰尿酰氯辅助贝克曼反应
氰尿酰氯和氯化锌形成助催化剂可以催化贝克曼反应。
例如:环十二酮能被平稳地转化为对定的内酰胺,后者是生产尼龙12的单体。
[6]
此反应的反应机理是以循环型催化为基础的,在循环中,氰尿酰氯通过亲核芳香取代活化羟基。
通过Meisenheimer络合物中间体,最终生成产物。
编辑异常贝克曼重排反应
α-二酮、α-酮酸、α-叔烃基酮(反式)、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为“异常贝克曼重排”,又称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
例如,如下α-叔烃基酮肟生成腈鎓离子后,叔碳-碳键断裂,一部分生成腈,另一部分转变为碳正离子,碳正离子被二乙氨基三氟化硫(DAST)捕获,生成相应的氟代烃。
[7]。
