第六章化学平衡 (2)
物理化学(南大五版)第六章化学平衡
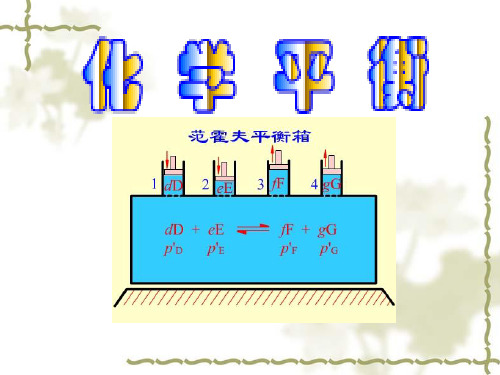
fB νB K = ∏( θ )e p B
θ f
1. 用压力表示的经验平衡常数 K p
pB νB Kp = ∏( θ ) p B
θ
Kp = ∏pνB B
B
Kγ = ∏γ νB B
B
K f = Kp ⋅ Kγ = Kp ⋅ Kγ ( p )
θ
θ
θ
−
∑νB
B
理想气体: Kθ = Kθ = Kp ( pθ ) f p
6.1 化学反应的平衡条件
热力学基本方程 化学反应的方向与限度 为什么化学反应通常不能进行到底
一、热力学基本方程
任意的封闭系统,不作非膨胀功,热力学基本方程: dU = TdS − pdV + ∑ µ B dnB = TdS − pdV + ∑ν B µ B dξ
B
B
dH = TdS + Vdp + ∑ µ B dnB = TdS + Vdp + ∑ν B µ B dξ
θ
( pG / pθ )g ( pH / pθ )h L ( pD / pθ )d ( pE / pθ )e L
pB νB Qp = ∏( θ ) p B
∆ r G m = ∆ r G m (T ) + RT ln Q p
压力商
理想液态混合物反应系统:
* µB (l) = µB (l,T, p) + RT ln xB
B
非理想液态混合物反应系统:
0 ∆rGm = ∆rGm(T) + RT ln ∏aν B B
B
二、标准平衡常数的定义
对任意化学反应,标准平衡常数的定义为: Kθ
标准平衡常数 标准平衡常数 热力学平衡常数 热力学平衡常数
第6章 化学平衡常数

5.158kJ/mol,求相应温度下的平衡常数。
由于标准自由能是温度的函数,因而平衡 常数也是温度的函数。温度不同,同一个反应 的平衡常数是不同的。反之,温度不变,平衡 常数不变.
对于气相反应:
H 2 (g) I 2 (g)
2HI(g)
2
[ p (HI ) / p ] K [ p ( H 2 ) / p ][ p (I 2 ) / p ]
或
r Gm T - RT ln
Kθ J
【应用】由Q与Kθ 的相对大小来判断反应进行的方向
J < K 时,反应正向进行, 此时 rG m < 0 ;
J > K 时,反应逆向进行, 此时
J = K 时,反应达到平衡, 此时
rGm > 0 ;
rGm = 0 。
反应商判据:
J<K J=K J>K 反应正向进行; 系统处于平衡状态; 反应逆向进行。
已知SO2和O2的初始浓度分别为0.040mol/L和
0.10mol /L。如达平衡,有80%的SO2转化为SO3,
求平衡时各种气体的浓度及KC。
6-4 压强对化学平衡的影响 分压对平衡的影响: 如果保持温度、体积不变,增大反应物的分 压或减小生成物的分压,使J减小,导致J<K , 平衡向正向移动。反之,减小反应物的分压或增 大生成物的分压,使J增大,导致J> K ,平衡向 逆向移动。
对于溶液中的反应:
Sn2+(aq)+2Fe3+(aq)
4
Sn4+ (aq)+2Fe2+(aq)
2 2
[c(Sn /c )][ c(Fe /c )] K 2 3 2 [c(Sn /c )][ c(Fe /c )]
无机化学-第六章化学平衡

1.00
J<K , 反应正向进行。
(2) Fe2+(aq)+Ag+(aq)
Fe3+(aq)+Ag(s)
开始cB/(mol·L-1) 0.100 1.00×10-2 1.00×10-3
变化cB/(mol·L-1) -x
-x
x
平衡cB/(mol·L-1) 0.100-x 1.00×10-2-x 1.00×10-3+x
2 (Ag ) > 1(Ag )
说明平衡向右移动。
6.3.2 压力对化学平衡的影响
1.部分物种分压的变化
如果保持温度、体积不变,增大反应 物的分压或减小生成物的分压,使J减小, 导致J<K ,平衡向正向移动。反之,减小 反应物的分压或增大生成物的分压,使J增 大,导致J> K ,平衡向逆向移动。
对于反应前后气体分子数不变的反应,
ΣnB =0, x ΣnB =1, J = K ,平衡不移动。
3.惰性气体的影响
①在惰性气体存在下达到平衡后,再恒
温压缩, ΣnB ≠0,平衡向气体分子数减小的 方向移动, Σ n B =0,平衡不移动。
K
[ p(HI) / p ]2
[ p(H2 ) / p ][p(I2 ) / p ]
对于溶液中的反应:
Sn2+(aq)+2Fe3+(aq) Sn4+ (aq)+2Fe2+(aq)
K
[c(Sn [c(Sn
4 2
/c /c
)][ c(Fe 2 /c )][ c(Fe3 /c
)] 2 )] 2
2000 0.00397 0.00397 0.0121 1.20 2.04
第六章 相平衡.(2)

* * p A , p B , A 或 x B ,就可把各液相组成对应的气 x 已知
相组成求出,画在 p-x 图上就得 p-x-y 图。
理想的完全互溶双液系
如果 pA pB ,则 y A xA ,即易挥发的组分在气 相中的成分大于液相中的组分,反之亦然。
* *
在等温条件下,p-x-y 图分为三个区域。在液相 线之上,体系压力高于任一混合物的饱和蒸气压,气 相无法存在,是液相区。
理想的完全互溶双液系
T-p-x图
把p-x图和T-x图合在一起,就得到T-p-x三维图。
三个坐标分别代表p,T,和x; 在右边的垂直面 xA 1, xB 0 , 则压力和温度坐标分别代表纯A * p A和沸点 T * ; 组分的饱和蒸气压 A
* p B 和 TB* 。 同理左边垂直面上是 * * pA TA* 和 p B TB* 分别代 连线
水的相图
水的相图(静分析)
水的相图是根据实验绘制的。图上有: 三个单相区 在气、液、固三个 单相区内, p=1,f=2. 温度和压力 独立地有限度地变化不会引起相的 改变。 三条两相平衡线 P=2,f=1,压力与温度只能改变一 个,指定了压力,则温度由体系自定。
水的相图
OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点 T 647 K , p 2.2 107 Pa ,这时气-液界面消失。高于临界温 度,不能用加压的方法使气体液化。
本章基本要求
• 理解相律的意义、推导,掌握其应用。 • 掌握单组分系统、二组分气——液平衡系 统和二组分凝聚系统典型相图的分析和应 用。 • 掌握用杠杆规则进行分析与计算。 • 了解由实验数据绘制简单相图的方法。
14第6章-化学平衡

K
( (
[G ] g C [A] a C
) ( ) (
[H] h C [B] b C
)
)
a A ( g ) + b B ( g ) —— g G ( g ) + h H ( g )
平衡时
K
( p ) ( P )h
a pB b A (p ) ( P ) P
pG
g
pH
对于复相反应,如
r逆
其它条件不变时,增加反应物浓度或减小生成物浓度, 平衡向正反应方向移动;相反。减小反应物浓度或增大生成 物浓度,平衡向逆反应方向移动。
对一般反应: 若在任意状态下 :
aA + bB
dD + eE
e Cd C D E J a Kc b CACB
或:
e pd p D E J a Kp b p ApB
K (
pi
p
) i
i
p2 NH 3
3 p N2 p H 2
(p )2
K (
pi
p
)
p NH3 p N2 p H22
1 2 3
(p )1
⑷. 固体、纯液体的浓度视为常数。
对溶液反应 a A ( aq ) + b B ( aq ) — g G ( aq ) + h H ( aq ) 平衡时 对气相反应
1/2 N2 + 3/2 H2 2NH3
[NH3 ] Kc (mol L)1 3 1 [N2 ] 2 [H 2 ] 2 [N2 ][H2 ]3 2 Kc (mol L) [NH3 ]2
平衡常数的单位是:
KC: (mol· L-1) i KP (atm) i 或 (Pa) i
物理化学电子教案第六章化学平衡

标准摩尔生成吉布斯自由能
• 因为吉布斯自由能的绝对值不知道,所以只 能用相对标准,即将标准压力下稳定单质(包括纯 的理想气体,纯的固体或液体)的生成吉布斯自由 能看作零,则: • 在标准压力下,由稳定单质生成1 mol化合物 时吉布斯自由能的变化值,称为该化合物的标准生 成吉布斯自由能,用下述符号表示:
•当体系达到平衡,
,则
• 称为热力学平衡常数,它仅是温度的函数。在 数值上等于平衡时的“逸度商”,是量纲为1的量 ,单位为1。因为它与标准化学势有关,所以又称
为标准平衡常数。
用化学反应等温式判断反应方向
•化学反应等温式也可表示为:
•对理想气体
•反应向右自发进行 •反应向左自发进行 •反应达平衡
6.3 平衡常数与化学方程式的关系
• 根据Le chatelier原理,增加压力,反应向体积 减小的方向进行。这里可以用压力对平衡常数的影 响从本质上对原理加以说明。
•对于理想气体,
•仅是温度的函数
压力对化学平衡的影响
•因为
•所以
•也仅是温度的函数。
压力对化学平衡的影响
•对理想气体
• 与压力有关,
,气体分子数减少,加压,
反应正向进行,反之亦然。
•等温、等压条件下,
•当
时:
热力学基本方程
•这两个公式适用条件:
•(1)等温、等压、不作非膨胀功的一个化学反应;
•(2)表示有限体系中发生微小的变化;
•
公式(b)表示在大量的体系中发生了反应进度等
于1 mol的变化。这时各物质的浓度基本不变,化学势
从自由能函数计算平衡常数
•求平衡常数 •设任意反应
• 等式右边第一项是反应前后各物质自由能函数的 差值,第二项的分子是0K时该反应热力学能的变化 值。
无机化学第6章化学平衡常数

H2
0.004 0.001 22
CO
0.006
H 2O
0.006
[CO ][H 2O] [CO2 ][H 2 ]
2.3 2.3 2.4 2.1
0.0078 0.0078 0.0069 0.0059 0.0118 0.0118
0.01 0.00 0 1 0 0.02 0.02
0.0041 0.004 1 0.0082 0.008 2
例:已知下列两反应的平衡常数分别为K1, K2 ,
(1) 2H2O(g) (2) 2HCl(g) 2H2(g)+O2(g) K1 H2(g)+Cl2(g) K2
求反应 4HCl(g)+O2(g) 衡常数。
2Cl2(g) +2H2O(g)的平
解: (2)2 4HCl(g) -) (1) 2H2O(g)
例:含有0.100 mo0.01mol/L Fe(NO3)3的溶液,发生 如下反应:Fe2+(aq)+Ag+(aq) Fe3+(aq)+Ag(s) 25℃时的标准平衡常数为2.98
(1)判断此条件下反应向哪一个方向进行. 解: 反应开始时的反应商:
(2)建立新的平衡关系
解:设需从容器中取走H2的浓度为xmol/L 2NH3 N2 +3H2
平衡时浓度/ mol/L:
1.00 0.50 改变浓度量/ mol/L: 0.20 0.20 3 -x 新平衡时浓度/ mol/L:1.20 1.10-x
2 2
0.50 - 0.20 2 0.10
0.50 0.10 3 0.50 1.00 ( 1.10 x )3 1.20 得x 0.94, nH 2 0.94 1.0 0.94mol
物理化学化学平衡PPT课件
( pB B )equi.
( p ) B K p
( p ) B
Kp
p
B
B
B
B
B
K p
K
p
B PB
2020/12/29
当 B 0 时, K p 无单位。
Kp:与T有关 16
对于理想气体
K p
K
p
B PB
对于真实气体
K p K
K
f
B PB
ln
pB p
B
B
pB p
B
9
令 r Gm =
B
B
化学反应标准摩尔Gibbs 自由能
∴
r Gm = r Gm +
RT ln
B
pB p
B
令: Qp
B
pB p
B
压力商
rGm rGm RT ln Qp …理想气体反应的等温方程
2020/12/29
10
二、理想气体反应的标准平衡常数
B
对理想气体,pB cRT
B
Kc K p (RT ) B
5.液相反应用活度表示的平衡常数 Ka
Ka
(aB B )equi.
B
2020/12/29
19
总结 说明:
Kp
B
Kx ( p) B
K
n
p n总,equi.
B B
Kc
(RT
) B B
单位:
K p (: 压强)x
Kn (: mol)x Kc (: mol m3)x
了化学反应亲和势的概念。他定义化学亲和势A为:
def
G
A
( )T , p
第六章 化学平衡常数

化学平衡的特点: 化学平衡的特点:
• (1)恒温、封闭体系是前提。只有在恒温条件 )恒温、封闭体系是前提。 下,封闭体系中进行的可逆反应,才能建立化学 平衡,这是建立平衡的前提。 • (2)自由能变等于零是平衡建立的实质条件。 )自由能变等于零是平衡建立的实质条件。 从动力学 动力学上讲就是正逆反应的速率相等 正逆反应的速率相等。 动力学 正逆反应的速率相等 • (3)平衡时各物质的浓度不变(不随时间改变) )平衡时各物质的浓度不变 是建立平衡的标志 标志,平衡是封闭体系中可逆反应 标志 的最大限度。 • (4)化学平衡是相对的,有条件的动态平衡。 )化学平衡是相对的,有条件的动态平衡。 当外界因素改变时,正逆反应速率发生变化,原 有平衡将受到破坏,直到建立新的平衡。 4 共74张
共74张 25
Jc 与 Kc的关系示意图 的关系示意图
共74张
26
例. 反应 CO(g) + H2O(g) —— H2(g) + CO2(g) 在 某温度时, Kc = 9, 求 CO 和 H2O 的起始浓度皆为 0.02 时, CO 的转化率。
共74张
27
§6-3.化学平衡的移动 - 化学平衡的移动
平衡常数( §6-2.平衡常数(重点) 平衡常数 重点)
• 2-1.经验平衡常数 - 经验平衡常数
共74张
5
• 对于一般可逆反应:aA + bB —— gG + hH 平衡时:
• K 称为经验平衡常数或实验平衡常数。上述的结 经验平衡常数或实验平衡常数。 经验平衡常数或实验平衡常数 果可表述为: • 在一定温度下, 可逆反应达到平衡时, 生成物浓度 系数次幂的连乘积与反应物浓度系数次幂的连乘 积之比是一个常数,这个关系式称为化学平衡定 律,或化学平衡体系中的质量守恒定律。 • 对气相体系,KP 也是一种经验平衡常数, 称为分 压平衡常数。而用浓度表示的经验平衡常数, 则 6 共74张 称为浓度平衡常数 KC 。
第6章 化学平衡

种物质的量及浓度的关系,以指导工业生产,此即研究
化学平衡的主要目的。
6.1 化学平衡与平衡常数
一、化学反应的可逆性
在一定温度下,一个化学反应既可以按照方程 式从左到右进行,也可以从右到左进行,这就是 化学反应的可逆性。例如
CO(g) + H2O (g) N2O4(g)
CO2(g)+H2(g) 2NO2
K
1 Kp p
Δn
697752.45Pa =6.98 5 110 Pa
6.2 标准平衡常数Kθ与化学反应的 标准自由能变(△rG m)的关系
一、标准平衡常数与化学反应的方向 对于反应:aA + bB gG + hH, 若为液相反应 若为气相反应
Q定义为某时刻反应熵。
2. 若将2个方程式相减, 则:
例. SO2+ ½ O2 = SO3 (1) △G ø1 = -70.9 kJ.mol-1 , K1 ø = 2.8 ×1012 NO2 = NO + ½ O2 (2) △G ø2 = +35.3 kJ.mol-1 , K2 ø = 6.3×10-7 方程(1) + (2) : SO2+ NO2 = NO + SO3 △G ø,K △G ø = △G ø 1 +△G ø2 = -35.6 kJ.mol-1 K ø = K1 ø K2 ø = 1.8 ×106
6.3 化学平衡的移动
条件改变使平衡态变化
浓度 压力 温度
一、浓度对化学平衡的影响
在恒温条件下增加反应物减小生成物浓度, 平衡向正反应方向移动;相反,减小反应物浓 度或增大生成物浓度,平衡向逆反应方向移动。
《无机及化学分析》第六章 化学平衡
2020/10/6
= Kc(cθ)-∑ν
第13张共68 张
K 与 Kθ 的关系:
Kθ = Kp(pθ)-∑ν Kθ = Kc(cθ)-∑ν
标准平衡常数无单 位
当 ∑ν=(d+e)-(a+b)=0时,
标准平衡常数与经验平衡常数数值相等。
2020/10/6
第14张共68 张
例:已知A(g) 2B(g)的
2020/10/6
= Kp(Pθ)-∑ν
第12张共68 张
对于溶液:
aA(aq) + bB(aq)
dD(aq) + eE(aq)
ce ( D) d ce ( E ) e
( ) ( ) θ
cθ
cθ
K ce ( A) a ce ( B) b
( ) ( ) cθ
cθ
K
cd r,e c a r ,e
(D)cer,e (E) ( A)cbr,e (B)
2NO2(g)
在25℃时的Kp = 11.5kPa , 试判断下列两种 情况下,化学反应进行的方向?
(1)在300L的密闭容器中加入1mol N2O4(g)和 10mol NO2(g);
(2) 在300L的密闭容器中加入1mol N2O4(g)和 1mol NO2(g)。
2020/10/6
第33张共68 张
ΔfGmθ/KJ.mol-1 -300.37
-370.37
ΔrGmθ(298.15K) =2×(-370.37kJ.mol-1) - 2×(-300.37kJ.mol-1)
= -140kJ.mol-1
2020/10/6
第36张共68 张
由ΔrGmθ(T)= - RTln Kθ 得
第6章 化学平衡

r G m r G (T) RT ln J p A
0 m
即理想气体反应的等温方程。
12
2. 理想气体反应的标准平衡常数
r G m r G 0 (T) RT ln J p m
当反应达平衡时,rGm = 0,则有
rGm0 = -RTln(Jp)平衡
(Jp)平衡 = exp(-rGm0/RT) = K0
0
23
B
§6.4
复相化学平衡
1. 复相化学平衡 化学反应的平衡条件是
B 1
N
B
B 0
设有n种是气体,其余是凝聚相,并且凝聚 相均处于纯态、不形成固溶体或溶液。 若把气态物质与凝聚相分开写,则平衡 条件可以写为
BB BB 0
B1 Bn 1
24
n
N
BB BB 0
p NH3 p H 2S p 2 1 2 K0 0 0 ( 0) p 4 p p p
K p p NH3 p H2S
p p p2 ( )( ) 2 2 4
由此可见,离解压力在一定条件下为定 值,其值可由离解压力与平衡常数关系求得。
29
3. 平衡常数的测定 测定了平衡体系中各物质的浓度或压力, 就可以计算平衡常数。测定浓度或压力时, 视具体情况可以采用物理方法或化学方法。 (1)物理方法 通过体系物理性质的测定求出体系平衡 时各物质的浓度,一般都是取体系的物理性 质与浓度成正比的函数,物理性质=Kc,如 折光率n、电导率、光吸收强度A、体积V、 压力P等。其优点是:不干扰体系。
17
B
B m G r
m
B
G r
K a a B ( b B B ) B ( b B ) B B B B 0 B b0 B B b B
第六章 化学平衡

第六章 化学平衡【复习题】【1】请判断下列说法是否正确,为什么? (1)某一反应的平衡常数是一个不变的常数;(2)r m G θ∆是平衡状态时,Gibbs 自由能的变化值,因为ln r m pG RT K θθ∆=-; (3)反应222CO g H O CO g +H g +ƒ()(g )()(),因为反应前后气体分子数相等,所以无论压力如何变化,对平衡均无影响;(4)在一定的温度和压力下,某反应的 0r m G θ∆f ,所以要寻找合适的催化剂,使反应得以进行;(5)某反应的0r m G θ∆p ,所以该反应一定能正向进行;(6)平衡常数值改变了,平衡一定会移动;反之,平衡移动了,平衡常数值也一定改变。
【解析】(1)不正确;因为平衡常数是温度的函数,温度改变,平衡常数也改变;(2)不正确;r m G θ∆是标准状态时Gibbs 自由能的变化值。
(3)不正确;因为=0B ν,若气体为理想气体,则x c p K K K ==,p K 与压力无关;若气体为非理想气体,则KK K fr pθθ=,由于压力对K r有影响,所以压力对pK 也有影响。
(4)不正确;因为催化剂只能改变反应速率,不能改变反应方向。
因为0r m G θ∆f ,故无论用什么催化剂都不会改变反应方向。
(5)不正确;因为ln r m r m a G G RT Q θ∆=∆+,0r m G θ∆p ,r G ∆却不一定小于零,所以不能由反应的r m G θ∆来判断反应的方向。
(6)不正确;平衡常数值改变了,平衡不一定会移动,而平衡移动了,平衡常数不一定发生改变,故题中说法不正确。
【2】化学反应的r m G ∆的下标“m”的含义是什么?若用下列两个化学计量方程式来表示合成氨的反应,问两者的r m G θ∆,pK θ之间的关系如何? (1)()()()22332H g N g NH g +ƒ ,1,1,r m p G K θθ∆ (2)()()()2233122H g N g NH g +ƒ ,2,2,r m p G K θθ∆答:r m G ∆的下标“m”的含义是反应进度为1mol 。
化学平衡习题及解答

第六章化学平衡习题及解答(总8页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第六章 习题及解答1.反应CO(g)+H 2O(g)CO 2(g)+H 2(g)的标准平衡常数与温度的关系为lg p K =2150K/,当CO ,H 2O ,H 2,CO 2的起初组成的质量分数分别为,,和,总压为时,问在什么温度以下(或以上)反应才能向生成产物的方向进行?解 设反应体系的总量为1000g ,已知M(CO)=28g·mol -1, M(H 2O)=18g·mol -1,M(H 2)=2g·mol -1,M(CO 2)=44g·mol -1, 则 n(CO)=(300/28)mol=n(H 2O)=(300/18)mol=n(H 2)=(200/2)mol=100mol n(CO 2)=(200/44)mol= Σn=++100+mol= mol x(CO)= mol= x(H 2O)= mol=x(H 2)=100mol/ mol= x(CO 2)= mol=222(CO )(H )0.03450.7850 2.6408(CO)(H O)0.08120.1263x x x Q x x ⨯===⨯因为本题ΣνB =0,所以p K =K x ,要使反应向生成产物方向进行,须 Q x < K x ,即2150K/>,解得2150K815.1K 2.216lg 2.6408T <=+,即在温度以下反应才能向生成产物方向进行。
2. PCl 5的分解作用为 PCl 5(g)PCl 3(g)+Cl 2(g)在、下反应达到平衡后,测得平衡混合物的密度为·m -3,试计算(1) PCl 5(g)的离解度。
(2)该反应的p K 和r m G ∆。
解 (1) PCl 5(g)PCl 3(g)+Cl 2(g) 设α为解离度,开始 n 0 0平衡 n(1-α) n α n α 平衡时物质的总量为n(1+α)平衡体系中pV= n(1+α)RT ,从反应可以看出,反应前后的分子数虽然增加了,但总质量没有变(即质量守恒),故555PCl PCl PCl M W M W n 混==又W Vρ=混所以 8.01)523)(314.8)(695.2(102.2081013251113135=-⋅⋅⋅⋅⨯⨯=-=-----K K mol J m kg mol kg Pa RT pM PCl ρα (2)以1mol PCl 5为基准3252111PC Cl p PCl p p p K p p p αααα⎛⎫⎪⋅+⎝⎭==-⋅⎛⎫ ⎪+⎝⎭当p = p, α= 时1.778p K =11ln (8.314)(523)ln1.778r m p G RT K J mol K K --∆=-=-⋅⋅1502.2-⋅-=mol kJ 。
江苏师范大学《物理化学》作业指导第6章 化学平衡

(1) 平衡时乙苯的解离度 α;
(2) 若在原料中添加水蒸气,使乙苯和水蒸气的摩尔比为 1:9,总压仍为 100kPa,
求此时乙苯的解离度 α。
解:
(1)
C6H5C2H5(g)==C6H5C2H3(g)+H2(g)
ö ÷ ø
=
æ
2x
2
öæ
x
ö
èç 101.325 ø÷ èç 101.325 ø÷
æ
50.66
-
x
2
ö
çè 101.325 ÷ø
=
x3 25.33´ (50.66 -
x)2
即0.125
=
x3 25.33´(50.66
-
x)2
........解得
x = 15.72kPa
22.800K,100kPa 时,C6H5C2H5(g)==C6H5C2H3(g)+H2(g)的 Kpө=0.05,试计算:
DGm
=
DG m
+
RT
ln Qa
=
-7240
+
8.314
´
298
lnççèæ
0.5 0.5
p p
÷÷øö
=
-7240
<
0
所以在恒温恒压下,Ag 会被腐蚀。
(2) 设不发生腐蚀时 H2S(g)的摩尔分数为 x,
-
7240
+
8.314
´
298
lnçæ
1
-
x
ö ÷
>
0
x < 0.05107 = 5.107%
Qp = pCH4 pө /pH22 = xCH4 pө/xH22p = 0.10×100/(0.802×100) = 0.15625 △rGөm = -RT lnKpө lnKpө = -△rGөm/RT = -19.29×103/(8.314×1000) = -2.32018 Kpө= 0.098256 Qp>Kpө,故在 1000 K 和 100 kPa 压力下不能生成 CH4(g)。
第6章 化学反应速率和化学平衡答案

思考题1. 区别下列概念:(1) 化学反应平均速率和瞬时速率;(2) 基元反应和复杂反应;(3) 活化分子和活化能;(4) 反应速率常数和化学平衡常数。
【答】(1) 化学反应平均速率是指反应在某时间范围内,以某反应物的浓度减小或某一生成物浓度的增加来表示,在该时间范围内,反应速率不是恒定的,而是在不断发生变化。
瞬时速率是指反应在某个瞬时的反应速率,在该瞬间反应速率是恒定的。
(2) 基元反应是指一步能够完成的反应。
复杂反应是指一步不能完成的反应。
复杂反应是由二个或二个以上的基元反应构成的。
(3) 能发生有效碰撞的分子称为活化分子。
E a为活化能是指活化分子所具有的最低能量E c与分子的平均能量E e的差值或把1mol具有平均能量的反应物分子变成活化分子所需吸收的最低能量。
(4) 反应速率常数是指单位反应物浓度时的反应速率,与反应物本性有关,也与反应时的温度、催化剂、溶剂等有关,与反应物浓度、分压无关。
对任何可逆反应,在一定温度下,达到平衡时各生成物浓度幂的乘积与各反应物浓度幂的乘积的比值是一常数,即为化学反应平衡常数。
化学平衡常数与反应本质、温度、溶剂等有关,与催化剂、反应物浓度或分压无关。
2. 简述反应速率的碰撞理论的要点。
【答】①原子、分子或离子只有相互碰撞才能发生反应,但并不是每次碰撞都能发生反应。
碰撞是反应发生的先决条件。
②分子发生有效碰撞必须具备一定的能量。
③活化分子间的碰撞还必须考虑碰撞时的方位。
3. 简述反应速率的过渡状态理论的要点。
【答】过渡状态理论认为,化学反应的发生仍是活化分子碰撞的结果,但活化分子不是只通过简单的碰撞就能完成,而是在反应过程中,要经过一个中间的过渡状态,即反应物分子先形成活化配合物,然后才分解为产物。
因此过渡状态理论也称为活化配合物理论。
4. 下列说法是否正确?(1) 对同一反应,用反应进度表示反应速率时,不论用何种物质(反应物或产物)来表示,其数值大小是一样的。
第六章 化学平衡常数

6-2平衡常数
已转化了某反应物的量
反应前该反应物的量
3.转化率 a= 为平衡转化率)
×100%(工业上为实际转化率本书
6-2平衡常数
K与转化率a的关系 1.化学平衡状态是反应进行的最大限度。某反应 物在给定条件下,平衡时具有最大转化率。平衡转 化率即指定条件下的最大转化率。
2.两者都可表示反应的程度,但K抽象、a具体,
求在 1073 K (800°C)时反应的平衡常数
6-2平衡常数
解 根据上述数据可以计算 H = 6×(–241.82 ) + 4×90.25 – 4×(-46.11 ) – 0 = – 905.48 kJ· -1 mol S = 6×188.72 + 4×210.65 – 4×192.3 – 5×205.03 = 180.57 J· -1· -1 mol K G = H – T S = – 905.48 – 1073 ×180.57 ×10-3
Kp
[ p NH 3 ]2 [ pH 2 ]3 [ p N 2 ]
1.56 10 15 ( Pa 2 )
K
[ p NH 3 / p ]2 [ pH 2 / p ] [ p N 2 / p ]
3
1.56 10
5
标准平衡常数无量纲,数值上与经验平衡常数 往往不同。
内容:如果某反应可以由几个反应相加(减)得
到,则该反应的平衡常数等于几个反应平衡
常数之积(商)。
证明:反应(3)=反应(1)+反应(2)
6-2平衡常数
rG3 rG1 rG2
RT ln K RT ln K RT ln K
3 1 2 3 1 2 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、选择题1.( )A 0.0595B 0.00354C 0.290D 0.539【B】2.( )A △r G m表示有限体系中反应终态和始态的自由能变化BC △r G m表示维持各组分的化学势不变时,发生一个单位化学反应的自由能变化D 根据△r G m的大小可以判断反应进行的方向AHA12GAGGAGAGGAFFFFAFAF【A】3. ( )ABCD【B】4. 恒温下某氧化物分解反应:AO2(s)=A(s)+O2(g)的平衡常数为Kp(1),若反应2AO2(s)=2A(s)+2O2(g)的平衡常数K p (2),则 ( )A K p(1) > K p(2)B K p(1) < K p(2)C K p(1) = K p(2)D 有的K p(1) > K p(2),有的K p(1) < K p(2)AHA12GAGGAGAGGAFFFFAFAF【D】5. 下列平衡常数中都无量纲的是 ( )AHA12GAGGAGAGGAFFFFAFAFA K f、K p、KB K c、K a、K xC K x、Kp、KD K a、K x、K 【D】6. 加入惰性气体对哪一个反应能增大其平衡转化率?( )ABCD 【A】7.( )AHA12GAGGAGAGGAFFFFAFAFA BC D【A】8. 在T、p 时,理想气体反应C2H6(g) = H2(g) + C2H4(g)的Kc/Kx 为: ( )A RTB 1/RTC RT/pD p/RT【D】9. 已知分解反应NH2COONH4(s) = 2NH3(g) + CO2(g) 在30℃时的平衡常数K=6.55×10-4,则此时NH2COONH4(s)的分解压力为:( )A 16.63×103PaB 594.0×103 PaC 5.542×103 PaD 2.928×103 Pa 【A】10. 气相反应A+B = 2L+M ,在25℃下和恒定容器内进行,AHA12GAGGAGAGGAFFFFAFAF最初A 和B 各为101.325 kPa,而没有L和M,平衡时A 和B 均为(1/3)×101.325 kPa,则该反应的Kc/(mol·dm-3)为: ( )A 4.31×10-3B 8C 10.67D 16 【A】AHA12GAGGAGAGGAFFFFAFAF11. 在S、H、cV、G、F 几个热力学函数中,其数值与最低能级能量数值的选取无关的是:( )A S、H、cV、G、FB cVC cV、SD F、G、H 【C】12. 在一定的温度下,一定量的PCl5(g) 在一密闭容器中达到分解平衡。
若往容器中充入氮气,使体系的压力增加一倍(体积不变),则PCl5的解离度将为: ( )A 增加B 减少C 不变D 不定【C】13. 一定温度下,一定量的PCl5(g)在某种条件下的解离度为,改变下列条件,何者可使α增大? ( )A 增加压力使体积缩小一倍B 体积不变,通入N2 气使压力增大一倍C 压力不变,通入N2气使体积增大一倍AHA12GAGGAGAGGAFFFFAFAFD 体积不变,通入Cl2气使压力增大一倍【C】14. PCl5的分解反应是PCl5(g) = PCl3(g) + Cl2(g) 在473K 达到平衡时, PCl5(g)有48.5% 分解,在573K 达到平衡时,有97% 分解,则此反应为:()A 放热反应B 吸热反应C 即不放热也不吸热D 这两个温度下的平衡常数相等【B】15. 在通常温度下,NH4HCO3(s) 可发生下列分解反应:NH4HCO3(s) = NH3(g) + CO2(g) + H2O(g)设在两个容积相等的密闭容器A 和B 中,开始分别只盛有纯NH4HCO3(s)1kg 及20kg 均保持在298K 达到平衡后,下列哪种说法AHA12GAGGAGAGGAFFFFAFAF是正确的?( )A 两容器中压力相等B A 内压力大于B 内压力C B 内压力大于A 内压力D 须经实际测定方能判别哪个容器中压力大【AHA12GAGGAGAGGAFFFFAFAFA 】二、填空题1. 固体氧化物的分解压(分解反应是吸热的)当温度升高时,分解压【增大】2. 将固体 NH 4I 迅速加热到 308.8K,测得其蒸气压为3.666×104Pa,在此温度气态 NH4I 实际上完全分解为 NH3和 HI,因此测得的蒸气压等于 NH3和 HI 分压之和。
如果在每一段时间内保持这个温度不变,则由于 HI 按下式分解:而使 NH4I(s)上方的压力增大。
已知HI的分解反应在308.8K 时的=0.127,达到平衡后,固体 NH4I 上方的总压是【4.10*104Pa】3. 已知445℃时, Ag2O(s) 的分解压力为20974 kPa,则此时AHA12GAGGAGAGGAFFFFAFAF分解反应Ag2O(s)=2Ag(s)+ 0.5O2(g) 的△r G m为【-15.92 kJ·mol-1】4. 对反应CO(g)+H2O(g)=H2(g)+CO2(g) ,K p K C【 = 】5.300K 时,某分子的基态能量是6.21×10-21J,其玻耳兹曼因子为【.2AHA12GAGGAGAGGAFFFFAFAF23】6. 反应CO(g) + H2O(g) = CO2(g) + H2(g) 在600℃、100kPa下达到化学平衡,当压力增大到5000kPa时,各气体的逸度系数为:γ (CO2) = 1.90,γ (H2) = 1.10,γ (CO)= 1.23,γ(H2O) = 0.77则平衡点【向左移动】7. 已知等温反应(i)CH4(g)=C(s)+2H2(g) ,(ii)CO(g)+2H(g)=CH3OH(g) 若提高系统总压,则它们的平衡移动方向分别为、【向左,向右】8. 理想气体反应A(g)+3B(g) = 2C(g)的△r G mθ=-3.0 kJ.mol-1,则反应C (g) = A(g)+ B(g)在400K时的Kθ为【0.64】AHA12GAGGAGAGGAFFFFAFAF9. 298K已知下列化学反应方程的平衡常数2A=2B+C K1;2D=2E+C K2;则D+B=E+A K为【(K2/K1)1/210. 在732K 时反应NH4Cl(s)=NH3(g)+HCl(g)的△r Gm⊙=-20.8kJ·mol-1,△r H m=154kJ·mol-1,则反应的△r S mθ为【239J·K-1·mol-1】AHA12GAGGAGAGGAFFFFAFAF二、是非题1.任何反应物都不能百分之百地变为产物,因此,反应进度永远小于 1。
【错】2.化学势不适用于整个化学反应体系,因此,化学亲合势也不适用于化学反应体系。
【错】3.因为,所以就是标准态下的平衡常数。
【错】4.对理想气体的化学反应,当温度一定时,有定值,因此其平衡组成不变。
【错】5.复相反应中,平衡常数的表达式中并没有出现凝聚相的分压成浓度项,因此,计算此类反应的只需考虑参与反应的气相物质。
【错】6.的数值不但与温度(和方程式写法)有关,还与标准态的选择有关。
【对】AHA12GAGGAGAGGAFFFFAFAF7.对同一化学反应,若反应计量式写法不同,则反应进度应不同。
但与选用反应式中何种物质的量的的变化来进行计算无关。
【对】8.对 Hg(l)+S(s)=Hg(s) 反应,因有平衡限制,因此,Hg(l)无法全部参与反应。
【错】9.处于标准态的CO2(g) 和O2(g),其标准燃烧焓值为零。
【对】10.化学平衡发生新的移动,平衡常数必发生变化【对】四、计算题1 .现有蔗糖(C12H22O11)溶于水形成某一浓度的稀溶液,其凝固点为-0.200℃,计算此溶液在25℃时的蒸气压。
已知水的,纯水在25℃时的蒸气压为。
AHA12GAGGAGAGGAFFFFAFAF解:首先计算蔗糖的质量摩尔浓度AHA12GAGGAGAGGAFFFFAFAF由上题可知,质量摩尔浓度和摩尔分数有以下关系假设溶剂服从拉乌尔定律,则此溶液在25℃时的蒸气压2.在25℃时,10 g某溶剂溶于1 dm3溶剂中,测出该溶剂的渗透压为Π=0.4000kPa,确定该溶质的相对分子质量。
解:溶剂的渗透压表示为3.在20℃下将68.4 g蔗糖(C12H22O11)溶于1 kg的水中。
求AHA12GAGGAGAGGAFFFFAFAF(1)此溶液的蒸气压。
(2)此溶液的渗透压。
已知20℃下此溶液的密度为。
纯水的饱和蒸气压。
解:溶液的蒸气压、渗透压分别为如有侵权请联系告知删除,感谢你们的配合!<x(33032 8108 脈29545 7369 獩g38306 95A2 関24102 5E26 带27228 6A5C 橜'22763 58EB 士36073 8CE9 賩.38752 9760 靠28121 6DD9 淙AHA12GAGGAGAGGAFFFFAFAF。
