卤代烃和醇方程式默写 (震川 山地之人)
醇和卤代烃

液态
能与水以任意比 比水小 率互溶,是常见 的有机溶剂
三、卤代烃和醇的化学性质 • 1、消去反应定义:
• 在一定条件下,从一个 有机物分子 中脱去一个或几个 小分子 生成 不饱和化合物 的反应。
反应方程式
H H
H C
H
C
Br
H + NaOH
醇
△
CH2=CH2 +H2O+NaBr
溴和氢脱去结合成溴化氢
50 0
醇羟基越多 沸点越高。
2 3
羟基数
1
小结三
• ①能够发生催化氧化生成醛的醇,结构特点是 有2个α氢原子 ,即结构通式为 R-CH2OH ; • ②能够被催化氧化生成酮的醇,结构特点是 有1个α氢原子,即结构通式为 R-CH(OH)-R'; • ③不能被催化氧化的醇,结构特点是 没有α氢原子,即结构通式为R-C(OH)-R'
醇 1、醇的分类: 饱和一元醇: CnH2n+1OH 一元醇 不饱和一元醇 醇 多元醇 :如乙二醇、丙三醇等 2、同系物的物理性质比较:
表3-2图 沸点/℃
● ● ●
醇
●
氢键
200
150 乙醇
● ●
氢键数 目增多
0
-50 -100
30 40 50 60相对分子质量 100
●
●
丙醇
● ●
烷
●
醇的沸点远 高于烷烃。
卤代烃和醇
一、卤代烃和醇的结构特点 通式
卤代烃 醇类 R-X R-OH
官能团
-X
代表物
CH3CH2Br
-OH CH3CH2OH
*X——指F、Cl、Br、I等卤族 元素原子。
新教材高中化学第3章烃的衍生物阶段突破3卤代烃醇酚pptx课件新人教版选择性必修3

1.掌握卤代烃、醇、酚等的化学性质,会熟练书写有关化学方程 式。
2.能由官能团判断有机物的性质,形成“结构”决定性质的思维。 3.掌握有关有机物性质的实验。
科学态度和社会责任:关注反应条件,指导化工生产,尽可能减小 对环境影响。
一、化学方程式的书写
书写下列反应的化学方程式,并注明反应条件。
___________________________2_N__a_C_l_+__2_H_2_O__;___________________。
二、卤代烃、醇、酚相关实验
1.卤代烃中卤素原子的检验 一般思路:水解、酸化、加AgNO3溶液。 具 体 过 程 : 少 量 卤 代 烃 ―N―a―O―H的― △水――溶―液→ ―冷―却→ ―稀―硝―酸――酸―化→ ―A―g―NO―3―溶―液→观察沉淀颜色。
(2)可以替代酸性KMnO4溶液的试剂是__溴__的__四__氯__化__碳__溶__液___,此时 如果去掉盛水的试管,对实验结果_无____(填“有”或“无”)影响。
(3)在另一支试管中取少量溴乙烷与NaOH的水溶液混合,加热,充
分反应后,向混合液中滴加AgNO3溶液,结果产生沉淀。化学实验小组 的同学由此得出结论:溴乙烷与NaOH的水溶液发生取代反应,生成了 溴化钠。该实验方案的错误之处是_滴__加__A_g_N__O_3_溶__液__前__没__有__用__稀__硝__酸__中__ _和__过__量__的__N_a_O__H_溶__液____,原因是_N__a_O_H__溶__液__会__和__A_g_N__O_3_溶__液__反__应__生__成___ _沉__淀__,__影__响__B__r_-_的__检__验____。
2.实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法中正 确的个数是( B )
卤代烃和醇

2、CH3CH=CH2+HBr
3、CH2=CH2+Br2
CH2£ CH2 Br Br
4、
5、
CH CH 2Br Cl
2
+
官能团种类的转化
1.引入羟基 CH2£ CH2 水解的化学方程式 例1、写出 Br Br
H2C Br H2C Br
+
2NaOH
水
△
H2C OH H2C OH
+ 2 NaBr
2.引入碳碳双键 例2、写出2—溴丙烷与 NaOH乙醇溶液共热的化学方程式 CH3CHCH3 + NaOH Br 醇
分子结构:
H H
①
H
④
C—C—O—H H
③
H
②
官能团-羟基(-OH)
主要化学 性质:
1、跟金属钠反应。 (断①键) 2、跟氢卤酸反应。 (断②键) 3、分子间脱水--取代。 (断①或②键) 4、分子内脱水--消去。 (断②和④键) 5、氧化反应。 (断①和③键) 6、酯化反应。 (断①键)
1、跟金属钠反应。
请根据已知条件,设计由CH3CHBr CH3合成CH3CH2CH2Br CH3CHBr CH3 CH3CH2CH2Br
消去 NaOH 醇 CH3CH=CH2
△
HBr
加成
过氧化物, 适当溶剂
醇
饱和一元醇通式:CnH2n+1OH( CnH2n+2O) 官能团:羟基 -OH
代表物质: C2H5OH
物理性质:俗名酒精,无色具有特殊香味的液体, 沸点低,易挥发,与水以任意比互溶, 密度比水小(浓度越大,密度越小)
①取少量卤代烃 ,②加氢), ⑥加入硝酸
2024届高考化学一轮复习:卤代烃、醇、酚

第61讲卤代烃醇酚[课程标准]1.掌握卤代烃的结构与性质,理解卤代烃在有机合成中的“桥梁”作用。
2.掌握醇、酚的结构、性质及应用。
考点一卤代烃1.概念(1)卤代烃是烃分子里的氢原子被卤素原子取代后生成的化合物。
通式可表示为R—X (其中R—表示烃基)。
(2)官能团是—X 。
2.物理性质(1)状态:通常情况下,除一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余为液体或固体;(2)沸点:比同碳原子数的烃沸点要高;(3)溶解性:水中不溶,有机溶剂中易溶;(4)密度:一般一氟代烃、一氯代烃比水小,其余比水大。
[JP][HT]3.化学性质(以溴乙烷为例)[HT](1)水解反应(取代反应)CH 3CH 2Br +NaOH A――→H 2O△CH 3CH 2OH +NaBr 。
(2)消去反应有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H 2O 、HX 等),而生成含不饱和键(如双键或三键)化合物的反应。
CH 3CH 2Br +NaOH ――→乙醇△CH 2===CH 2↑+NaBr +H 2O 。
4.对环境的影响氟氯烃在平流层中会破坏臭氧层,是造成臭氧空洞的主要原因。
[正误辨析](1)CH 3CH 2Cl 的沸点比CH 3CH 3的沸点高()(2)溴乙烷与NaOH 乙醇溶液共热生成乙烯()(3)在溴乙烷中加入AgNO 3溶液,立即产生淡黄色沉淀()(4)取溴乙烷水解液,向其中加入AgNO 3溶液,可观察到淡黄色沉淀(5)所有卤代烃都能够发生水解反应和消去反应()答案:(1)√(2)√(3)×(4)×(5)×学生用书第294页1.在卤代烃RCH2CH2X中化学键如图所示,则下列说法正确的是()A.发生水解反应时,被破坏的键是①和③B.发生消去反应时,被破坏的键是①和④C.发生水解反应时,被破坏的键是①D.发生消去反应时,被破坏的键是②和③答案:C2.有两种有机物Q()与P(),下列有关说法正确的是()A.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶2B.二者在NaOH醇溶液中均可发生消去反应C.一定条件下,二者在NaOH溶液中均可发生取代反应D.Q的一氯代物只有1种,P的一溴代物有2种C[Q中两个甲基上有6个等效氢原子,苯环上有2个等效氢原子,峰面积之比应为3∶1,A项错误;Q中苯环上的卤素原子无法发生消去反应,P中与卤素原子相连的碳原子的邻位碳原子上缺少氢原子,无法发生消去反应,B项错误;在适当条件下,Q、P中的卤素原子均可被—OH取代,C项正确;Q中苯环上的氢原子、甲基上的氢原子均可被氯原子取代,其一氯代物有2种,D项错误。
有机方程式默写单答案

有机化学方程式汇总1、甲烷及烷烃(易燃烧、易取代、可裂解)2、乙烯及烯烃 (易氧化、能使酸性高锰酸钾褪色、易加成、易加聚)1乙烯的制备CH 3CH 2OH C︒−−→−170浓硫酸CH 2===CH 2↑+H 2O 2乙烯的燃烧反应 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O3乙烯能使酸性高锰酸钾褪色 5CH 2=CH 2+12KMnO 4+18H 2SO 4―→10CO 2+12MnSO 4+6K 2SO 4+28H 2O4乙烯与溴水加成CH 2==CH 2+Br 2−−→−4CCl CH 2Br —CH 2Br5乙烯与水加成CH 2==CH 2+H 2O 加热、加压催化剂−−→−CH 3CH 2OH 6乙烯与氯化氢加成CH 2==CH 2+HCl ∆−−→−催化剂CH 3CH 2Cl 7乙烯与氢气加成CH 2==CH 2+H 2∆−→−NiCH 3—CH 3 8乙烯的加聚反应n CH 2==CH 2−−→−催化剂9丙烯与溴水加成CH 2==CHCH 3+Br 2−−→−4CCl CH 2Br —CHBrCH 310丙烯和溴化氢加成CH 2==CHCH 3+HBr −−→−催化剂CH 3—CHBrCH 311烯烃的燃烧通式 C n H 2n +3n2O 2−−→−点燃n CO 2+n H 2O 121,3—丁二烯与溴水的1,2加成131,3—丁二烯与溴水的1,4加成141,3—丁二烯与溴水的1:2加成 CH 2=CHCH=CH 2+2Br 2―→CH 2BrCHBrCHBrCH 2Br151,3—丁二烯的加聚16异戊二烯的加聚烯烃与酸性高锰酸KMnO方程式)R 1—CH==CH —R 2OH Zn O23/−→−R 1CHO +R 2CHO 3、乙炔及炔烃 (易氧化、能使酸性高锰酸钾褪色、易加成、易加聚)1实验室制乙炔CaC 2+2H 2O ―→C 2H 2↑+Ca(OH)22乙炔的燃烧反应2CH≡CH +5O 2−−→−点燃4CO 2+2H 2O3乙炔与氢气加成HC≡CH +H 2∆−→−NiCH 2==CH 2,CH 2==CH 2+H 2∆−→−NiCH 3—CH 34乙炔与溴水加成HC≡CH +Br 2―→CHBr ==CHBrCHBr==CHBr +Br 2―→CHBr 2—CHBr 25乙炔与氯化氢加成HC≡CH +HCl ∆−−→−催化剂CH 2==CHC l (氯乙烯) 6乙炔与水加成HC≡CH +H 2O −−→−催化剂CH 3CHO 7氯乙烯的加聚反应nCHCl =CH 2−−→−催化剂8乙炔的加聚反应n HC≡CH −−→−催化剂9 乙炔自身加成2CH≡CH―→CH 2==CH —C≡CH4、苯及苯的同系物 (苯能氧化、易取代,难加成,不能使酸性高锰酸钾褪色)1苯的燃烧反应2C 6H 6+15O 2――→点燃12CO 2+6H 2O2苯与液溴的取代3苯与浓硝酸的取代CC SO H NO HO ︒︒−−−→−-+60~55242浓NO 2O H 2+4苯环的磺化反应HSO 3−−−→−-+C80~C 703..H SO HO OH 2+5苯与氢气加成6甲苯的燃烧反应 C 7H 8+9O 2−−→−点燃7CO 2+4H 2O 7甲苯被酸性高锰酸钾氧化 +−−→−HKMnO 48乙苯被酸性高锰酸钾氧化(与苯环直接相连的碳上必须有氢原子,无论侧链有多长,均将烃基氧化为羧基)9甲苯与浓硝酸的取代10甲苯与液溴的取代11甲苯与氯气的光照取代5、卤代烃 (易水解、能消去)1溴乙烷水解成醇CH 3CH 2—Br +NaOH ∆−→−水CH 3CH 2—OH +NaBr 2溴乙烷消去成烯CH 3CH 2Br +NaOH ∆−−→−乙醇CH 2==CH 2↑+NaBr +H 2O 3R —X 水解R —X +NaOH ∆−−→−O H 2R —OH +NaX 4一氯乙烷的水解 CH 3CH 2—Cl +NaOH ∆−→−水CH 3CH 2—OH +NaCl 51,2—二溴乙烷的水解 CH 2Br —CH 2Br +2NaOH ∆−→−水+2NaBr6 苄基溴的水解反应7溴苯水解反应 (较难进行) CH 2Br —CH 2Br +2NaOH ∆−→−水+2NaBr8R -CH 2CH 2X 的消去反应R -CH 2CH 2X +NaOH ∆−−→−乙醇RCH=CH 2+NaX +H 2O 9的消去反应103—甲基—3—溴己烷的消去反应11的消去反应12 1,2—二溴乙烷发生消去反应成双键或者三键13 CH 3—CH 2—CHCl 2的消去反应(成三键)CH 3—CH 2—CHCl 2+2NaOH ∆−−→−乙醇CH 3—C≡CH↑+2NaCl +2H 2O6、乙醇及醇类 (易氧化、易取代、能消去)1乙醇和钠的置换反应2CH 3CH 2OH +2Na ―→2CH 3CH 2ONa +H 2↑2乙醇和镁的置换反应2CH 3CH 2OH +Mg ―→(CH 3CH 2O)2Mg +H 2↑3乙醇的燃烧反应CH 3CH 2OH +3O 2−−→−点燃2CO 2+3H 2O4乙醇的催化氧化2CH 3CH 2OH +O 2∆−−→−AgCu /2CH 3CHO +2H 2O5正丙醇催化氧化2CH 3CH 2CH 2OH +O 2∆−−→−AgCu /2CH 3CH 2CHO +2H 2O 6异丙醇催化氧化 2+O 2∆−−→−AgCu /2+2H 2O7乙醇直接被氧化成乙酸CH 3CH 2OH −−−−−−−→−酸性重铬酸钾酸性高锰酸钾/CH 3COOH8乙醇分子间脱水成醚C 2H 5OH +HOC 2H 5 C︒−−→−140浓硫酸C 2H 5OC 2H 5+H 2O 9乙醇与浓氢卤酸的取代CH 3CH 2OH +HBr −→−∆CH 3CH 2Br +H 2O10乙醇与酸的酯化反应CH 3COOH +CH 3CH 2OH CH 3COOC 2H 5+H 2O11 乙醇的消去反应CH 3CH 2OH C︒−−→−170浓硫酸CH 2==CH 2↑+H 2O 12R —CH 2OH 的催化氧化13的催化氧化14的消去反应15 乙二醇与钠反应16 丙三醇与硝酸反应7、苯酚及酚类(易氧化、易取代、能加成)1 苯酚的弱电离C6H5OH C6H5O-+H+2 苯酚与金属钠的反应OH2→+Na22ONa ↑+2H3 苯酚与氢氧化钠的反应OH2→+Na22ONa ↑+2H4 苯酚与碳酸钠的反应5 向苯酚钠溶液中通入少量CO2气体OH→+32CONa ONa3NaHCO+`向苯酚钠溶液中通入过量量CO2气体OH→+32CONa ONa3NaHCO+`6 向苯酚钠溶液加入盐酸7 苯酚与浓溴水的取代反应8 苯酚与浓硝酸的硝化反应9 酚类的显色反应10 苯酚与乙酸酯化反应11 苯酚与氢气的加成反应12 苯酚与甲醛的缩聚反应8、乙醛及醛类 (易氧化、能加成)1乙醛与氢气的加成CH 3CHO +H 2∆−→−NiCH 3CH 2—OH2乙醛的催化氧化2CH 3CHO +O 2∆−−→−催化剂2CH 3COOH 3乙醛的银镜反应 CH 3CHO +2Ag(NH 3)2OH CH 3COONH 4+2Ag↓+3NH 3+H 2O4乙醛与新制Cu(OH)2悬浊液反应 CH 3CHO +2Cu(OH)2+NaOHCH 3COONa +Cu 2O↓+3H 2O5乙醛与酸性高锰酸钾溶液反应 CH 3CHO −−−−→−+)(4H KMnO CH 3COOH6乙醛与溴水反应CH 3CHO +Br 2+H 2O ―→CH 3COOH +2HBr7乙醛的燃烧反应2CH 3CHO +5O 2−−→−点燃4CO 2+3H 2O8甲醛与氢气的加成HCHO +H 2 ∆−→−NiCH 3OH 9甲醛的银镜反应 HCHO +4Ag(NH 3)2OH (NH 4)2CO 3+4Ag↓+6NH 3+2 H 2O10甲醛与Cu(OH)2反应HCHO +4Cu(OH)2+2NaOH −→−∆Na 2CO 3+2Cu 2O↓ +6H 2O11丙酮与氢气的加成+H 2∆−→−Ni12 乙醛与HCN 加成CH 3CHO +HCN ―→13羟醛缩合(两分子乙醛)9、乙酸及羧酸 (酸性、酯化反应)1乙酸与金属钠反应 2Na +2CH 3COOH ―→2CH 3COONa +H 2↑2与某些金属氧化物(CaO)反应 CaO +2CH 3COOH ―→(CH 3COO)2Ca +H 2O3乙酸与NaOH 反应 CH 3COOH +NaOH ―→CH 3COONa +H 2O4乙酸与弱碱 (NH 3·H 2O)反应CH 3COOH +NH 3·H 2O ―→CH 3COONH 4+H 2O5乙酸与Na 2CO 3反应 2CH 3COOH +Na 2CO 3―→2CH 3COONa +CO 2↑+H 2O 6乙酸与NaHCO 3反应CH 3COOH +NaHCO 3―→CH 3COONa +CO 2↑+H 2O7乙酸与乙醇的酯化反应CH 3COOH +CH 3CH 2OH CH 3COOC 2H 5+H 2O8乙醇与硝酸的酯化反应C 2H 5OH +HONO 2∆−−→−浓硫酸C 2H 5—O —NO 2(硝酸乙酯)+H 2O 9乙醇与硫酸的酯化反应C 2H 5OH +HO —SO 3H −−→−C。
有机化学方程式默写

有机化学方程式默写
九、有机化学方程式默写(答案)
CH4 + Cl2CH3Cl + HCl
CH3Cl+ Cl2CH2Cl2 + HCl
CH2Cl2 + Cl2CHCl3 + HCl
CHCl3 + Cl2CCl4 + HCl
炔烃的化学性质(可加成、加聚,可使酸性高锰酸钾褪色)
苯酚(易被氧气氧化成粉红色,有毒,沾到皮肤时,应立即用酒精清洗;
℃以上时与水混溶;能使高锰酸钾褪色)
(可用于
除去苯中混有的少量苯酚)
(紫色,可用于检验酚类物质)
醛的化学性质(甲醛是室内装修的主要污染物,其水溶液叫福尔马林,可使高锰酸钾、溴水
酯的化学性质(有催化剂及加热情况下才会水解;碱存在时完全水解,反应不可逆;酸存在时,部分水解,反应可逆)
(皂化反应)。
高二烃与卤代烃-方程式默写

天津学大教育信息咨询有限公司
TIANJIN XUEDA EDUCATION INFORMATION CONSULTING CO.,LTD
烃与卤代烃-方程式默写
新戊烷的一溴取代反应甲苯在光照条件下的一氯取代反应
对二甲苯在铁作催化剂的的一溴取代反应制取TNT的反应方程式
2-氯-2-甲基丙烷的水解反应1,2-二溴丙烷的水解反应
丙炔与足量氯水的反应方程式邻二甲苯与足量的氢气的反应方程式
氯乙烯的加聚反应乙烯与丙烯1:1的加聚反应
2-溴-2-甲基丙烷的消去反应1,2-二溴乙烷的完全消去反应
甲烷的二溴取代反应邻二甲苯的一溴见光取代反应
苯以铁作催化剂的溴代反应对二甲苯以铁作催化剂的一溴代反应
苯的硝化反应CH3CHBrCH3的水解反应
1,2-二氯丙烷的水解反应苯乙烯与溴水的加成反应
2-丁烯与水的加成反应苯乙炔与足量氢气的加成反应
制取的反应2,3-二氯-2,3-甲基丁烷的完全消去反应
1。
高二高中化学方程式(烃卤代烃醇苯醛酸酯糖类)
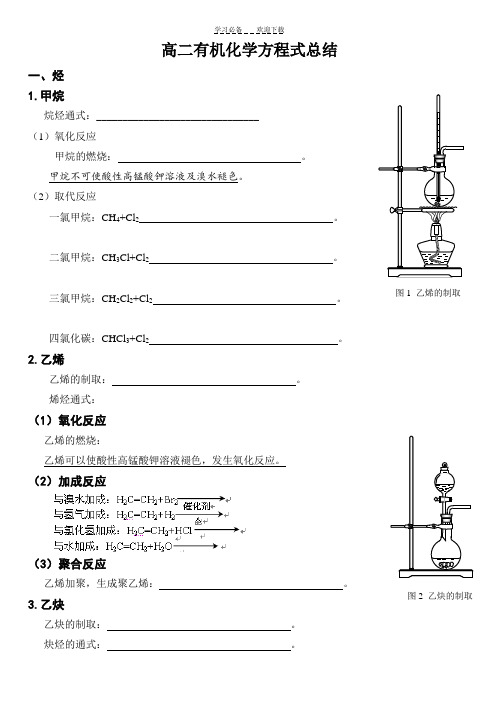
高二有机化学方程式总结一、烃1.甲烷烷烃通式:_______________________________(1)氧化反应甲烷的燃烧:。
甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH4+Cl2。
二氯甲烷:CH3Cl+Cl2。
三氯甲烷:CH2Cl2+Cl2。
四氯化碳:CHCl3+Cl2。
2.乙烯乙烯的制取:。
烯烃通式:___________________________(1)氧化反应乙烯的燃烧:___________________________________乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应(3)聚合反应乙烯加聚,生成聚乙烯:。
3.乙炔乙炔的制取:。
图1 乙烯的制取图2 乙炔的制取(1)氧化反应乙炔的燃烧: 。
乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC CH+Br 2 →CHBr=CHBr+Br 2 → 与氢气加成:_______________________________与氯化氢加成:_________________________________(3)聚合反应氯乙烯加聚,得到聚氯乙烯: 。
乙炔加聚,得到聚乙炔: 。
4.苯苯的同系物通式:__________________________________(1)氧化反应苯的燃烧: 。
苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应①苯与溴反应________________________________________________________________________②硝化反应_________________________________________________________________________(3)加成反应注意:制取乙烯、乙炔均用排水法收集;乙烯、乙炔的加成反应一般都需要催化剂(溴除外)。
5.甲苯(1)氧化反应甲苯的燃烧:。
第二十五讲卤代烃醇

第二十五讲卤代烃醇①溴乙烷取代反应:②溴乙烷消去反应有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HX等),而生成不饱和(含双键或三键)化合物的反应,例1.分子式为C3H6Cl2的有机物,发生一元氯代反应后,可生成2种同分异构体,则原C3H6Cl2应是A.1,3—二氯丙烷 B.1,1—二氯丙烷C.1,2—二氯丙烷 D.2,2—二氯丙烷例2.下列物质沸点最高的是A.1—氯戊烷B.2—氯丁烷C.2—甲基—2—氯丙烷 D.1—氯丙烷例3.要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是①加入AgNO3溶液②加入NaOH溶液③加热④加蒸馏水⑤冷却后加入HNO3酸化⑥加入NaOH的乙醇溶液A.④③①⑤B.②③⑤①C.④③①D.⑥③⑤①②消去反应:试写出1-氯丙烷和2-氯丙烷分别发生消去反应的化学方程式发生消去反应的卤代烃结构要求:例4.由2—氯丙烷为主要原料制取1,2—丙二醇时,经过的反应为A.加成—消去—取代B.消去—加成—取代C.取代—消去—加成D.取代—加成—消去例5.写出实现下列转化的反应方程式并注明反应类型。
C2H5Cl→CH2=CH2→CH2BrCH2Br→CH≡CH→ CH2=CHCl →例6.一定量的乙醇在氧气不足的情况下燃烧,得CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为A.4.4g B.2.2g C.1.4g D.在2.2g与4.4g之间消去反应——分子内脱水,生成乙烯。
取代反应——分子间脱水,生成乙醚。
例7.某饱和一元醇(C 8H 17OH )发生消去反应,能得到三种单烯烃,则该醇的结构简式为A .CH 3CH 2C (CH 3)2C (CH 3)2OHB .(CH 3)3CCH 2C (CH 3)2OHC .(CH 3)2CHCHOHCH 2CH (CH 3)2D .(CH 3)2CHC (CH 3)(OH )CH 2CH 2CH 3例8.正丙醇、异丙醇和浓硫酸混合液在加热条件下得到的有机产物有 种。
《烃、卤代烃》化学方程式 默写(一)

1.甲烷燃烧
2.甲烷隔绝空气高温分解
3.甲烷和氯气制一氯甲烷
4.乙烯燃烧
5.将乙烯通入溴水,现象为,反应的化学方程式为
6.乙烯和水反应:
7.乙烯和氯化氢反应:
8.乙烯和氢气反应;
《烃、卤代烃》化学方程式默写(一)
1.甲烷燃烧
2.甲烷隔绝空气高温分解
3.甲烷和氯气制一氯甲烷
8.乙烯和氢气反应;
《烃、卤代烃》化学方程式默写(一)
1.甲烷燃烧
烧
5.将乙烯通入溴水,现象为,反应的化学方程式为
6.乙烯和水反应:
7.乙烯和氯化氢反应:
8.乙烯和氢气反应;
4.乙烯燃烧
5.将乙烯通入溴水,现象为,反应的化学方程式为
6.乙烯和水反应:
7.乙烯和氯化氢反应:
8.乙烯和氢气反应;
《烃、卤代烃》化学方程式默写(一)
1.甲烷燃烧
2.甲烷隔绝空气高温分解
3.甲烷和氯气制一氯甲烷
4.乙烯燃烧
5.将乙烯通入溴水,现象为,反应的化学方程式为
6.乙烯和水反应:
7.乙烯和氯化氢反应:
卤代烃和醇
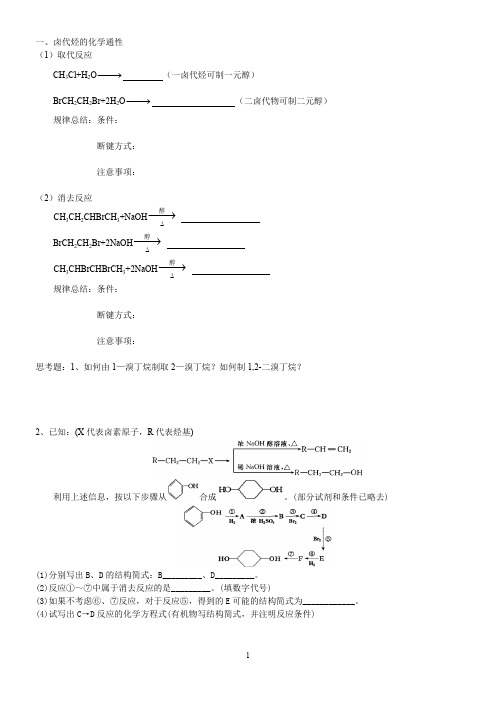
一、卤代烃的化学通性(1)取代反应CH 3Cl+H 2O −→− (一卤代烃可制一元醇)BrCH 2CH 2Br+2H 2O −→− (二卤代物可制二元醇)规律总结:条件:断键方式:注意事项:(2)消去反应CH 3CH 2CHBrCH 3+NaOH ∆−→−醇BrCH 2CH 2Br+2NaOH ∆−→−醇 CH 3CHBrCHBrCH 3+2NaOH ∆−→−醇规律总结:条件:断键方式:注意事项:思考题:1、如何由1—溴丁烷制取2—溴丁烷?如何制1,2-二溴丁烷?2、已知:(X 代表卤素原子,R 代表烃基)利用上述信息,按以下步骤从合成。
(部分试剂和条件已略去)(1)分别写出B 、D 的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是_________。
(填数字代号)(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E 可能的结构简式为____________。
(4)试写出C →D 反应的化学方程式(有机物写结构简式,并注明反应条件)二、醇的化学性质:三、醇的催化氧化发生条件和规律1、发生条件:醇分子结构中与—OH相连的碳原子上至少要有一个氢原子,即具有的结构。
因为醇的催化氧化,其实质是“去氢”。
在有机反应中,氧化反应是指有机物去氢或加氧的反应,上述氧化反应也可通过碳元素的平均价态的变化来理解。
2、规律(1)—OH连在链端点碳原子上的醇,即结构的醇,被氧化成醛。
(2)与—OH相连碳原子上只有一个氢原子的醇,即结构的醇,被氧化成酮(,其中R、R′为烃基,可同,可不同)。
(3)与—OH相连碳原子上没有氢原子的醇,即结构的醇(R、R′、R″为烃基,可相同可不同),不能被催化氧化。
∵不能形成。
三、醇消去反应发生的条件1、醇分子结构:与—OH相连的碳必须有相邻的碳原子,且此相邻的碳原子上还必须连有氢原子时,才能发生消去反应。
即:如:都不能发生消去反应。
2、反应条件:浓H2SO4,加热。
新课标选修5有机化学方程式默写_答案和题目

光照Ni△催化剂△催化剂Fe/FeBr3浓硫酸55~60℃Ni△H2O△浓硫酸140℃高中化学选修5《有机化学基础》有机方程式过关默写内容和题目一、烷烃:1. 甲烷与氯气光照生成一氯甲烷CH4 + Cl2CH3Cl + HCl二、烯烃:1.乙烯与氢气(加成反应) CH2 = CH22.乙烯与溴的四氯化碳溶液(加成反应2Br—CH2Br3.乙烯与氯化氢(加成反应) CH2 = CH2Cl4.乙烯与水(加成反应)CH2 = CH2 + H25.乙烯生成聚乙烯(加聚反应)nCH26.丙烯与氯化氢(加成反应)CH2 = CH——CH3或CH3—CH2—CH2Cl7. 丙烯生成聚丙烯(加聚反应)8.1,3—丁二烯与溴的1、2加成CH2=CH-CH=CH2 + Br2 CH2Br-CHBr-CH=CH29.1,3—丁二烯与溴的1、4加成CH2=CH-CH=CH2 + Br2 CH2Br-CH=CH-CH2Br10. 1,3—丁二烯与乙烯成环(1、4加成新应用)11.1,3—丁二烯生成聚合物(加聚反应) nCH2=CH-CH=CH2-CH=CH-CH2]n三、炔烃:1.乙炔与足量氢气(加成反应) CH≡CH + 2H2 CH3-CH32.乙炔制氯乙烯(加成反应)CH≡CH + HCl H2C=CHCl3.乙炔生成聚乙炔(加聚反应)nCH≡CH [ CH=CH ]n四、苯及其同系物:1.苯与液溴(取代反应2 Br + HBr2.苯与浓硝酸、浓硫酸混合液(取代反应+ HO-NO2 NO2 +H2O3. 苯与氢气(加成反应)+ 3H24. 甲苯与溴蒸气光照(取代反应)5. 甲苯与液溴对位(取代反应)6.甲苯与浓硝酸、浓硫酸混合液(取代反应)7.甲苯与氢气的反应五、卤代烃:1.溴乙烷与NaOH水溶液(水解或取代反应) CH3CH2Br + NaOH CH3CH2OH + NaBr2.溴乙烷与NaOH醇溶液(消去反应,标断键)3. 溴乙烷与NaOH醇溶液(消去反应,简式)六、醇1.乙醇与钠(取代反应) 2CH3CH2OH+2Na →2ONa + H2↑2.乙醇与氢溴酸(取代反应) CH3CH2OH+HBr(浓3CH2Br + H2O3.乙醇分子间脱水(取代反应,标断键位置) CH3OH+HOCH2CH3 CH3CH2OCH2CH3+H2O 4.乙醇分子内脱水(消去反应,结构式,断键位置)5.乙醇的消去反应(结构简式) CH3CH2OH CH2 = CH2↑+ H2O浓硫酸170℃+ Br2光照+ HBr32Br+ Br2+ HBrFe/FeBr333+ 3H233-NO2+3H2O浓硫酸55~60℃NO2NO2O2NCH3+ NaOH 醇△C CHBrHH HH C CHHHH + NaBr +H2O醇△CH3CH2Br+ NaOH CH2= CH2+ NaBr +H2OCH3[ 2CH ]nnCH2 = 3催化剂CHHH CHHO H CHH CHH + H2O浓硫酸170℃Ni △ 催化剂 △△ △ 稀硫酸 △△ 6. 乙醇的催化氧化(结构式,标断键位置) 7. 乙醇的催化氧化(结构简式) 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 8.乙醇与乙酸的酯化反应(标断键位置) 9.1-丙醇催化氧化反应2CH 3CH 2CH 2OH+O 23CH 2CHO + 2H 2O 10.2-丙醇催化氧化反应(标断键位置) 七、酚1.苯酚与钠(取代反应) 2.苯酚与氢氧化钠(3.苯酚与碳酸钠(4.向苯酚钠溶液中通入CO 2 5.苯酚与浓溴水(取代反应)6. 苯酚遇FeCl 3溶液显 紫 色八、醛、酮 1.乙醛与氢气(还原/加成反应) 或CH 3CHO + H 2 CH 3CH 2OH 2. 乙醛的催化氧化 或2CH 3CHO + O 2 2CH 3COOH 3. 乙醛与银氨溶液(氧化反应) CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4 +2Ag↓+3NH 3+H 2O4. 乙醛与新制氢氧化铜(氧化反应) CH 3CHO+2Cu(OH)2 + NaOH CH 3COONa+Cu 2O↓+3H 2O5. 甲醛与银氨溶液(氧化反应) HCHO+4Ag(NH 3)2OH (NH )CO 3 +4Ag↓+6NH 3+2H 2O6. 甲醛与新制氢氧化铜(氧化反应) HCHO+4Cu(OH)2+ 2NaOH 2CO 3+2Cu 2O↓+6H 2O 7.丙酮与氢气的反应(还原/加成反应) 九、羧酸1.醋酸与碳酸氢钠反应 CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 2.乙二酸与乙二醇成六元环(酯化/取代反应) 十、酯1.乙酸乙酯酸性条件下水解CH 3COOCH 2CH 3 +H 2O CH 3COOH+CH 3CH 2OH 2.乙酸乙酯碱性条件下水解CH 3COOCH 2CH 3+NaOH CH 3COONa + CH 3CH 2OH 十一、高分子合成 1.苯乙烯的加聚反应聚苯乙烯 泡沫塑料) 2.氯乙烯的加聚反应 (聚氯乙烯 PVC 管材) 3. 乳酸的缩聚反应(4.乙二酸与乙二醇的缩聚反应 5.对苯二甲酸与乙二醇的缩聚反应(涤纶)Cu/Ag △ Cu/Ag + CO 2 + H 2O + NaHCO 3 C + O 浓硫酸 △ CH 2 OH C O OH CH 2 HO HO C +2H 2O O CH 2 C O CH 2 O O 2CH 3 C O CH 3 + O 2 Cu/Ag △ +2H 2O 3 C H H 2H C HH O H + 2H 2O + O 2C H H 2H C H O Cu/Ag △催化剂 △ n CH C n OH CH 3 C O OH CH 3 H OH +(n-1)H 2O CH O O ] [ n 催化剂 △ +(2n-1)H 2O n HO CH 2 OH HO + HO [ CH 2 O ] n H CH 3 C O H + H 2 Ni △ CH 3 C OH H 2 (乙醇) 2↑+ H 2O + Na 2 NaHCO 3 +3Br 2 ↓+3HBr OH Br Br Br OH C CH 3 + H 2 H 3C O Ni △ CH CH 3CH 3C n[CH CH 2] n n 催化剂 △ [C C O CH 2 CH 2 O] nC O OH H HO +(2n-1)H 2O n HO CH 2 OH C O HO + O O [CH CH 2] n Cl 2CH 3 C O H + O 2 催化剂△ 2CH 3 C O CH 3 OH + HOCH 2CH 3 CH 3COOCH 2CH 3 +H 2O 浓硫酸 △ O C高中化学《有机化学基础》化学方程式默写题目一、烷烃:1. 甲烷与氯气光照生成一氯甲烷二、烯烃:1.乙烯与氢气的反应2.乙烯与溴的四氯化碳溶液反应3.乙烯与氯化氢的反应4.乙烯与水的反应5.乙烯生成聚乙烯的反应6.丙烯与氯化氢的反应7. 丙烯生成聚丙烯的反应8.1,3—丁二烯与溴的1、2加成9.1,3—丁二烯与溴的1、4加成10.1,3—丁二烯乙烯成环10.1,3—丁二烯生成高聚物的反应三、炔烃:1.乙炔与足量氢气的反应2.乙炔制氯乙烯的反应3.乙炔生成聚乙炔的反应四、苯及其同系物:1.苯与液溴的反应2.苯与浓硝酸、浓硫酸混合液的反应(60℃)3.苯与氢气的反应4. 甲苯与溴蒸气气光照反应5. 甲苯与液溴反应(对位) 6.甲苯与浓硝酸、浓硫酸混合液的反应7.甲苯与氢气的反应五、卤代烃:1.溴乙烷与氢氧化钠水溶液水解反应2.溴乙烷与NaOH醇溶液(消去反应,标断键)3. 溴乙烷与NaOH醇溶液(消去反应,简式)六、醇1.乙醇与钠的反应2.乙醇与氢溴酸的反应3.乙醇分子间脱水(成醚,标断键位置)4.乙醇消去反应(结构式,标断键位置)5.乙醇的消去反应(结构简式)6.乙醇的催化氧化反应(结构式,标断键位置)7. 乙醇的催化氧化反应(结构简式)8.乙醇与乙酸的酯化反应(标断键位置) 9.1-丙醇的催化氧化反应10.2-丙醇的催化氧化反应(标断键位置)七、酚1.苯酚与钠的反应2.苯酚与氢氧化钠的反应3.苯酚与碳酸钠的反应4.向苯酚钠溶液中通入CO:25.苯酚与浓溴水的反应6. 苯酚遇FeCl溶液显色3八、醛、酮1.乙醛与氢气的反应2. 乙醛的催化氧化3. 乙醛与银氨溶液的反应4. 乙醛与新制氢氧化铜的反应5. 甲醛与银氨溶液的反应6. 甲醛与新制氢氧化铜的反应7.丙酮与氢气的反应九、羧酸1.醋酸溶液与碳酸氢钠溶液的反应2.乙二酸与乙二醇酯化成六元环十、酯1.乙酸乙酯酸性条件下水解2.乙酸乙酯碱性条件下水解十一、高分子的合成1.苯乙烯的加聚反应(泡沫塑料)2.氯乙烯的加聚反应(PVC管材) 3.乳酸(α-羟基丙酸)的缩聚反应(可吸收缝合线)4.乙二酸与乙二醇的缩聚反应5.对苯二甲酸与乙二醇的缩聚反应(涤纶)。
高中有机化学方程式总结(烃卤代烃默写版)
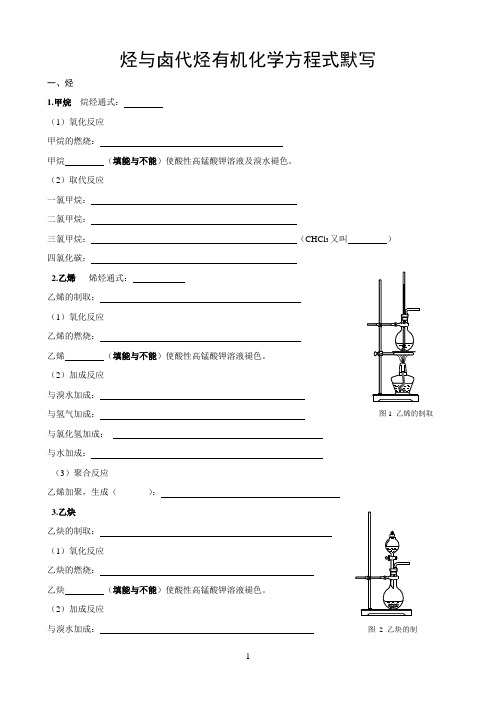
烃与卤代烃有机化学方程式默写一、烃1.甲烷烷烃通式:(1)氧化反应甲烷的燃烧:甲烷(填能与不能)使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:二氯甲烷:三氯甲烷:(CHCl3又叫)四氯化碳:2.乙烯烯烃通式:乙烯的制取:(1)氧化反应乙烯的燃烧:乙烯(填能与不能)使酸性高锰酸钾溶液褪色。
(2)加成反应与溴水加成:与氢气加成:与氯化氢加成:与水加成:(3)聚合反应乙烯加聚,生成():3.乙炔乙炔的制取:(1)氧化反应乙炔的燃烧:乙炔(填能与不能)使酸性高锰酸钾溶液褪色。
(2)加成反应与溴水加成:图1 乙烯的制取图 2 乙炔的制与氢气加成:与氯化氢加成:(3)聚合反应氯乙烯加聚,得到( ):乙炔加聚,得到聚乙炔:4.苯苯的同系物通式:(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯 (填能与不能)使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应①苯与溴反应②硝化反应(3)加成反应5.甲苯(1)氧化反应甲苯的燃烧:C 7H 8+9O 2 7CO 2+4H 2O 甲苯 (填能与不能)使溴水褪色, (填能与不能)使酸性高锰酸钾溶液褪色。
(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT ),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
6.溴乙烷:(1)取代反应(水解反应)(2)消去反应点燃点燃。
卤代烃、醇、考点总结

考点一 卤代烃 1.饱和卤代烃的性质 (1)物理性质①沸点:比同碳原子数的烷烃沸点要高; ②溶解性:水中____溶,有机溶剂中____溶;③密度:一般一氟代烃、一氯代烃比水小,其余比水大。
(2)化学性质 ①取代反应:R —X +NaOH ――→H 2O△____________(R 代表烃基); R —CHX —CH 2X +2NaOH ――→H 2O△______________。
②消去反应:R —CH 2—CH 2—X +NaOH ――→醇△______________或R —CH 2—CH 2—X ――→强碱、醇△______________;2.检验卤代烃分子中卤素的方法 (1)实验方法(2)实验说明①加热是为了加快卤代烃的反应速率。
②加入稀硝酸酸化,一是为了中和过量的NaOH ,防止NaOH 与AgNO 3反应产生沉淀,影响对实验现象的观察和AgX 沉淀质量的称量;二是检验生成的沉淀是否溶于稀硝酸。
③量的关系:R —X ~NaX ~AgX ↓,1 mol 一卤代烃可得到1 mol AgX(除F 外)沉淀,常利用此关系来定量测定卤代烃中卤素原子的含量。
HBr ;C 2H 5OH +HBr ――→△__________________+H 2O 。
1.实验室现有失去标签的溴乙烷、戊烷各一瓶,如何鉴别?2.某卤代烷烃C 5H 11Cl 发生消去反应时,可以得到两种烯烃,则该卤代烷烃的结构简式可能为( )3.下列化合物在一定条件下,既能发生消去反应,又能发生水解反应的是( )4.由CH CH CH Br制备CH CH(OH)CH OH,依次(从左至右)发生的反应类型和反应条件都正确的是5. 证明溴乙烷中溴元素的存在,下列操作步骤中正确的是()①加入硝酸银溶液②加入氢氧化钠溶液③加热④加入蒸馏水⑤加入稀硝酸至溶液呈酸性⑥加入氢氧化钠醇溶液A.④③①⑤B.②③⑤①C.④⑥③①D.⑥③⑤①6.根下面的反应路线及所给信息填空。
高三化学第一轮复习:卤代烃和醇苏教版知识精讲

高三化学第一轮复习:卤代烃和醇苏教版【本讲教育信息】一. 教学内容:卤代烃和醇二. 教学目标1. 了解卤代烃的典型代表物的结构与性质特点,掌握卤代烃的消去反应和取代反应的原理和条件;2、了解醇的结构特点,并能对饱和一元醇进行系统命名,以乙醇为例,理解并掌握醇的性质与用途。
三. 教学重点、难点卤代烃和醇的结构特点与主要化学性质[教学过程]一、卤代烃:1、烃分子中的H 原子被卤原子取代后所生成的一系列有机物称为卤代烃。
物理通性:都不溶于水,可溶于有机溶剂。
氯代烷的沸点随烃基增大呈现升高的趋势;氯代烷的密度随烃基增大呈现减小的趋势。
如:溴乙烷的物理性质:无色液体,沸点38.4℃,密度比水大2、化学通性:卤代烃的化学性质通常比烃活泼,能发生许多化学反应。
①取代反应:CH 3Cl +H 2O −−→−NaOHCH 3OH +HCl (一卤代烃可制一元醇) BrCH 2CH 2Br +2H 2O −−→−NaOH HOCH 2CH 2OH +2HBr (二卤代烃可制二元醇) ②消去反应:BrCH 2CH 2Br +NaOH ∆−→−醇CH 2═CH —Br +NaBr +H 2O (消去1分子HBr ) BrCH 2CH 2Br +2NaOH ∆−→−醇CH ≡CH +2NaBr +2H 2O (消去2分子HBr ) 说明:1、溴乙烷的水解反应与消去反应的反应条件与产物 反应类型 反应条件主要产物 相互关系水解(取代)反应NaOH 的水溶液,△CH 3CH 2OH 同时发生的两个互相平行,互相竞争的反应 消去反应NaOH 的醇溶液,△CH 2═CH 2 2、卤代烃在发生消去反应的前提条件是:与卤原子所连碳原子相邻碳原子上有H 存在时,可发生消去反应;卤代烃发生消去反应时生成取代基较多的烯烃,这样的烯烃对称,稳定,(扎依采夫规律)。
习惯上称为“氢少失氢”。
如:3、检验卤代烃分子中卤素的方法:⑴实验原理:R —X +H 2O ∆−−→−NaOH R —OH +HX HX +NaOH NaX +H 2OHNO 3+NaOH NaNO 3+H 2O AgNO 3+NaX AgX ↓+NaNO 3根据沉淀(AgX )的颜色(白色、浅黄色、黄色)可确定卤素(氯、溴、碘)。
高二卤代烃和醇
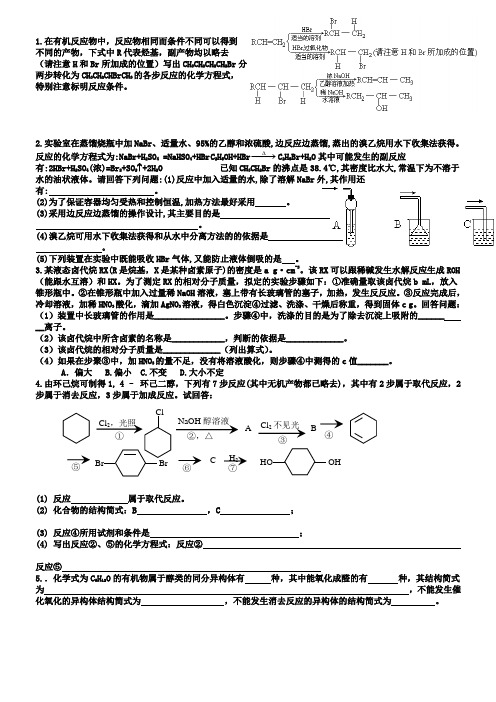
1.在有机反应物中,反应物相同而条件不同可以得到不同的产物,下式中R 代表烃基,副产物均以略去(请注意H 和Br 所加成的位置)写出CH 3CH 2CH 2CH 2Br 分两步转化为CH 3CH 2CHBrCH 3的各步反应的化学方程式,特别注意标明反应条件。
2.实验室在蒸馏烧瓶中加NaBr 、适量水、95%的乙醇和浓硫酸,边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。
反应的化学方程式为:NaBr+H 2SO 4 =NaHSO 4+HBr C 2H 5OH+HBr ∆−→−C 2H 5Br+H 2O 其中可能发生的副反应有:2HBr+H 2SO 4(浓)=Br 2+SO 2↑+2H 2O 已知CH 3CH 2Br 的沸点是38.4℃,其密度比水大,常温下为不溶于水的油状液体。
请回答下列问题:(1)反应中加入适量的水,除了溶解NaBr 外,其作用还有: 。
(2)为了保证容器均匀受热和控制恒温,加热方法最好采用 。
(3)采用边反应边蒸馏的操作设计,其主要目的是 。
(4)溴乙烷可用水下收集法获得和从水中分离方法的的依据是 。
(5)下列装置在实验中既能吸收HBr 气体,又能防止液体倒吸的是 。
3.某液态卤代烷RX(R 是烷基,X 是某种卤素原子)的密度是a g ·cm -3。
该RX 可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX 。
为了测定RX 的相对分子质量,拟定的实验步骤如下:①准确量取该卤代烷b mL ,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH 溶液,塞上带有长玻璃管的塞子,加热,发生反反应。
③反应完成后,冷却溶液,加稀HNO 3酸化,滴加AgNO 3溶液,得白色沉淀④过滤、洗涤、干燥后称重,得到固体c g 。
回答问题:(1)装置中长玻璃管的作用是________________。
步骤④中,洗涤的目的是为了除去沉淀上吸附的______ __离子。
(2)该卤代烷中所含卤素的名称是____________,判断的依据是_____________。
