复分解反应及其发生条件
复分解反应发生的条件PPT授课课件

血液循环复习
本节目标:
一:掌握血液的成分及功能. 二:理解血型鉴定的原理. 三:能区别三种血管.
观察 人血永久涂片
对照人的血细胞彩图 和人血细胞形态的模式 图,用显微镜观察人血 永久看涂一片看。,各类血细胞 的形态结构和数量有什 么不同?
想一想,人的血液为 什么是红色的?
人的血细胞彩图 人血细胞形态的模式图
模拟血型鉴定
A型标准血清
B型标准血清
血型
(抗B)
(抗A)
A
B
O
AB
请你来鉴定
病人
A型标准血清 B型标准血清 血型
赵
凝集 不凝集 B
钱
凝集 凝集
AB
孙
不凝集 不凝集 O
李
不凝集 凝集
A
5.你认为: “动脉里流的都是 动脉血,静脉里 流的都是静脉血” 这种说法对吗? 如不对,请举例。
输血原则: 同血型输血
练习三:一同学下肢受伤后发炎,通过手腕处静脉注 射药物进行治疗.试说出药物到达伤口炎症处所经
2.可以止血 并加速血
液凝固。
五:血液循环
心脏比停地跳动,促使血液在心脏和全部血 管所组成的密闭管道中循环流动,这一过程 就是血液循环.一昼夜流经心脏的血液约为
10000L 人体的血液循环系统由心脏.动脉.毛细血管 和静脉组成.血液就在遍布全身的血管中循 环流根动据.人体血液循环途径的不同,可将 血液循环分为体循环和肺循环两部分。
不可接受血型
A、AB 无
A、AB、B B、AB
右心室 左心房
肺动脉 肺静脉
肺 静脉血 部 毛 细
血 动脉血 管
4.想一想:体循环 和肺循环过程中, 血液的含氧量、 含二氧化碳量 各有什么变化? 在什么部位
复分解反应的发生条件和应用

复分解反应的条件及其应用所谓复分解反应,即由两种化合物互相交换成分生成另外两种化合物的反应。
这类反应酬可表示为AB+CD=AD+CB。
写复分解反应的化学方程式和写其他化学方程式一样,应该注意它们表示的化学方程式必须真实存在,而不是凭空想象捏造出来的。
1. 生成物必须有沉淀或水或气体生成,否则不反应。
①,有水生成。
②,即没有沉淀或水生成,也没有气体生成。
2. 反应物也有一定的要求,否则同样也不反应。
(1)碱与盐反应必须都可溶,但都可溶不一定都能反应。
①,因为反应物都可溶,且生成物中有沉淀。
②,虽然好像有沉淀生成,但是反应物都不溶或不都溶。
③,因为反应物虽都可溶,但没有符合条件的生成物。
(2)盐与盐的反应,反应物必须都可溶,但都可溶也不一定都能反应。
①,因为反应物都可溶,且有沉淀生成。
②,,好像都有沉淀生成,但是两个反应的反应物都不溶或有一种不溶,所以都不反应。
③,虽然反应物都可溶,但生成物中无沉淀、无水、也无气体。
(3)常见的酸与碱,无论碱是否可溶,它们都能反应生成盐和水。
(4)常见的酸与盐的反应,这类反应比较复杂,初中阶段只要求记住碳酸盐与常见的酸都能反应,其他盐则要求可溶且生成物中要有气体或沉淀或水。
①,生成物、反应物都符合要求。
②,,前一个反应式中的反应物不溶,所以不反应。
后一个反应式中的反应物虽都可溶,但生成物不符合要求,因此也不反应。
同学们要掌握两种化合物间是否会发生复分解反应,不仅要掌握复分解反应发生的条件,还必须掌握酸、碱、盐的溶解性。
(注:文章中的可溶是指可溶于水。
)利用复分解反应发生条件解决中考试题一、复分解反应的条件二、复分解反应的应用应用一:判断物质能否在溶液中共存物质相互间不反应就能在溶液中大量共存。
比如:H+与CO32-、OH-不能共存,OH-与NH4+、H+、Fe3+、Cu2+不能共存,Ag+与Cl-、OH-不能共存,Ba2+与CO32-、SO42-不能共存。
例题:下列各组物质在溶液中能大量共存的是()A.FeCl3、Na2SO4、HCl B.NaOH 、NaCl 、HNO3C.MgSO4、NaNO3、KOH D.Na2CO3、KNO3、HCl【分析】此类题目可用排除法来选择。
复分解反应发生的条件及其应用

复分解反应发生的条件及其应用一、复分解反应的概念由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
反应形式: AB+CD=AD+CB 二、复分解反应的书写原则(特点)1.双交换(结合、外结合)2.价不变:反应前后各元素的化合价均保持不变(如:AB+CD=AD+CB中,B与C结合成CB, A与D结合成AD;HCl + NaOH === NaCl+H2 O)三、复分解反应的类型四、复分解反应发生的条件复分解反应要发生,且能够进行到底,一般应考虑两方面的条件:1、考虑反应发生的基本条件(对反应物要求的条件)2、对生成物的条件要求(以下两者缺一不可)先看反应物:盐盐、盐碱反应物均可溶,有酸不看溶解性;后看生成物:出现气体、沉淀、水一种,复分解反应能发生。
五、复分解反应的实质:酸、碱、盐所电离出的离子相互结合,生成沉淀、气体或水的过程。
六、复分解反应的应用应用一、判断复分解反应能否发生 (比较反应前后是否有离子种类减少,如:生成沉淀、水、气体时,会导致离子种类减少,则该复分解反应可以发生;否则,该复分解反应不能发生)【例1】下列物质间两两组合共能发生多少个化学反应?其中发生的复分解反应有几个?写出相关化学方程式:铁、氧化铁、硫酸、氢氧化钙、碳酸钠【例2】判断复分解反应能否发生,能反应的写出化学方程式。
1、 KOH+HCl2、 Na2CO3+ CaCl23、 H2SO4+NaCl4、 BaCl2+CuSO45、 K2CO3+HCl【中考】1、下列各组物质的溶液,不能发生复分解反应的一组是()A.HCl与NaOHB. Na2CO3与H2SO4C. KNO3与NaClD. NaOH与CuSO42、下列物质不能与碳酸钠溶液发生反应的是()A. Ba(OH)2溶液B. 稀盐酸C. CaCl2溶液D. KNO3溶液3、下列物质的转变,不能由一步反应实现的是( )A.HCl → NaClB. Ca(OH)2→ NaOHC. CaO → CaCO3D. CO2→ Na2CO3应用二:判断物质或离子能否在溶液量共存物质相互间不反应或离子间不能结合生成沉淀、气体、水就能在溶液量共存。
复分解反应物的条件

复分解反应物的条件
复分解反应发生的条件是两种化合物互相交换成分,生成物中有水、
气体或沉淀生成。
当两种化合物相遇时,它们会相互交换其成分。
这意味着组成它们的
离子(或分子)被解离,并在溶液中成为可被检测到的形式。
这一过
程发生在已经发生电离的水或其他溶剂中。
在复分解反应中,至少有一种化合物是可溶于水的。
例如,氯化铁和
氢氧化钠反应生成氢氧化铁沉淀和氯化钠,这个反应就可以发生。
这
是因为氢氧化铁沉淀可以与溶液中的氯化钠分开,不会使溶液中的离
子浓度降低到足够低的水平,从而阻止反应继续进行。
总结来说,复分解反应发生的条件是生成物中有水、气体或沉淀生成,并且至少有一种化合物是可溶于水的。
发生复分解反应的条件

发生复分解反应的条件所谓复分解反应,即由两种化合物互相交换成分生成另外两种化合物的反应。
这类反应酬可表示为AB+CD=AD+CB。
写复分解反应的化学方程式和写其他化学方程式一样,应该注意它们表示的化学方程式必须真实存在,而不是凭空想象捏造出来的。
1. 生成物必须有沉淀或水或气体生成,否则不反应。
①,有水生成。
②,即没有沉淀或水生成,也没有气体生成。
2. 反应物也有一定的要求,否则同样也不反应。
(1)碱与盐反应必须都可溶,但都可溶不一定都能反应。
①,因为反应物都可溶,且生成物中有沉淀。
②,虽然好像有沉淀生成,但是反应物都不溶或不都溶。
③,因为反应物虽都可溶,但没有符合条件的生成物。
(2)盐与盐的反应,反应物必须都可溶,但都可溶也不一定都能反应。
①,因为反应物都可溶,且有沉淀生成。
②,,好像都有沉淀生成,但是两个反应的反应物都不溶或有一种不溶,所以都不反应。
③,虽然反应物都可溶,但生成物中无沉淀、无水、也无气体。
(3)常见的酸与碱,无论碱是否可溶,它们都能反应生成盐和水。
(4)常见的酸与盐的反应,这类反应比较复杂,初中阶段只要求记住碳酸盐与常见的酸都能反应,其他盐则要求可溶且生成物中要有气体或沉淀或水。
①,生成物、反应物都符合要求。
②,,前一个反应式中的反应物不溶,所以不反应。
后一个反应式中的反应物虽都可溶,但生成物不符合要求,因此也不反应。
同学们要掌握两种化合物间是否会发生复分解反应,不仅要掌握复分解反应发生的条件,还必须掌握酸、碱、盐的溶解性。
(注:文章中的可溶是指可溶于水。
)复分解反应的实质在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是电解质,在溶液中都能电离出离子。
因此,复分解反应的实质,实际上是电解质在溶液中发生的离子间的互换反应。
当溶液中存在的某些离子能互相结合而使其浓度迅速减小的话,那么反应就向减小离子浓度的方向进行。
如果用离子方程式来表示发生的复分解反应,就更能反映出它的实质。
复分解反应的定义概念

复分解反应的定义概念 复分解反应是初中化学必须掌握中的四⼤反应类型之⼀,复分解反应发⽣的条件,在教材中只是对于反应物和⽣成物进⾏了概括性的描述。
以下是店铺为⼤家整理的关于复分解反应的定义,欢迎⼤家前来阅读! 复分解反应的定义 复分解反应是指由两种化合物互相交换成分,⽣成另外两种化合物的反应(AB+CD=AD+CB)。
复分解反应是化学中四⼤基本反应类型之⼀,其实质是:发⽣复分解反应的两种物质在⽔溶液中相互交换离⼦,结合成难电离的物质——沉淀、⽓体、⽔,使溶液中离⼦浓度降低,化学反应即向着离⼦浓度降低的⽅向进⾏。
复分解反应介绍 复分解反应是化学中四⼤基本反应类型之⼀。
(复分解反应中有⼀特例——中和反应,即酸与碱发⽣的复分解反应)要理解它必须抓住概念中的“化合物”和“互相交换成分”这两个关键词。
酸、碱、盐溶液间发⽣的反应⼀般是两种化合物相互交换成分⽽形成的,即参加复分解反应的化合物在⽔溶液中发⽣电离并解离成⾃由移动的离⼦,离⼦间重新组合成新的化合物。
因此酸、碱、盐溶液间的反应⼀般是复分解反应。
⽆机化学中,很少有既是复分解反应⼜是氧化还原反应的,在中学阶段不考虑化合价变化的复分解反应,如Mg2Si+4HCl=2MgCl2+SiH4(硅烷⽓体)。
复分解反应发⽣条件 碱性氧化物+酸:酸的酸性较强(如HCl、H2SO4、HNO3等),可发⽣反应。
酸+碱(中和反应):当酸、碱都很弱时,不发⽣反应。
酸+盐:强酸制弱酸;交换离⼦后有沉淀;强酸与碳酸盐反应;满⾜⼀个条件即可发⽣反应。
碱+盐:强碱与铵盐反应;两种反应物都可溶、交换离⼦后有沉淀、⽔、⽓体三者之⼀;满⾜⼀个条件即可发⽣反应。
盐+盐:两种反应物都可溶,交换离⼦后有沉淀、⽔、⽓体三者之⼀。
复分解反应反应⽰例 酸与盐 反应时酸完全可以不溶,例如硅酸溶于碳酸钠浓溶液 如:2HCl+CaCO₃=CaCl₂+H₂O+CO₂↑(⽣成H₂CO₃和CaCl₂,H₂CO₃不稳定分解成H₂O和CO₂) BaCl₂+H₂SO₄=BaSO₄↓+2HCl AgNO₃+HCl=AgCl↓+HNO₃ 注:⼤多数酸都可以与碳酸盐(碳酸氢盐)反应,⽣成新盐,⽔和⼆氧化碳。
复分解反应及其发生的条件ppt课件

⑩CuSO4+BaCl2=BaSO4↓+CuCl2 盐+盐——(新)盐+(新)盐
2、根据⑥-⑩这5个反应归纳复分解反应的类型?
精选PPT课件
4
NaOH 碱
+ NaCl 盐
+
HCl
NaCl
酸
盐
精选PPT课件
有条件
5
二、探究复分解反应发生的条件
【合作探究】将现象记录在表格里
①酸与碱反应 HCl
NaOH(滴加酚酞) Ca(OH)2(滴加酚酞)
有沉淀(↓)
生成物
或有气体(↑)
或有水(H2O ) 满足三者之一复分解反应才能发生
【拓展延伸】为什么满足这些条件就能发生反应呢?
精选PPT课件
7
√ H2SO4 + Na2CO3 = Na2SO4+CO2↑ + H2O
H+、SO42- Na+、CO3 2 - Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
精选PPT课件
8
√
NaOH+ CuSO4 ———— 2Na2SO4+ Cu(OH)2↓
Na+、OH- Cu2+、SO4 2- - Na+、 SO4 2-
反应前
反应后
溶液中离子种类发生改变
精选PPT课件
9
复分解反应的实质:溶液中离子种类发生改变 Na2SO4 + KNO3 —×— K2SO4 + NaNO3
复分解反应及其发生的条件
简阳通材实验学校 王显均
观察教师演示实验, 描述实验现象并写出 化学方程式。
CaCO3+ 2HCl = CaCl2+ H2O+CO2↑
九年级化学复分解反应的定义条件易错点

复分解反应•复分解反应:(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB(2)特点:①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
•由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应.其实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水,使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行.可简记为AB+CD=AD+CB.复分解反应的本质是溶液中的离子结合成带电离的物质(如水)、难溶的物质或挥发性气体,而使复分解反应趋于完成.(可简记为:碱盐盐盐水中溶,沉淀气体水生成.为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性)(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。
如酸与碱发生中和反应的实质为:H++OH-==H2O。
•复分解反应发生的条件:•常见的复分解反应:①常见的有沉淀生成的复分解反应N a2CO3+Ca(OH)2=CaCO3+2NaOHCuSO4+2NaOH==Cu(OH)2↓+Na2SO4FeCl3+3NaOH==Fe(OH)3↓+3NaClNaCl+AgNO3==AgCl↓+NaNO3H2SO4+BaCl2==BaSO4↓+2HCl②常见的有气休生成的复分解反应CaCO3+2HCl==CaCl2+H2O+CO2↑2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O③常见的有水生成的复分解反应NaOH+HCl==NaCl+H2ONa2CO3+HCl==NaCl+H2O+CO2↑易错点:例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。
因为,根据复分解反应的定义。
只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。
复分解反应成立的条件

复分解反应成立的条件一、复分解反应的概念复分解反应呢,就是由两种化合物互相交换成分,生成另外两种化合物的反应。
就像两个人交换手里的东西一样,化合物之间也能这么干。
二、复分解反应成立的条件1. 有沉淀生成比如说在氯化钡溶液和硫酸钠溶液的反应中,会生成硫酸钡沉淀。
咱们在化学课上可能做过这个实验,看着溶液里突然出现了白色的沉淀,就像魔法一样。
硫酸钡是那种不溶于水的物质,所以这个反应就能发生。
这就像是两个人交换东西的时候,生成了一个新的、独特的东西(沉淀),这个新东西不能再回到原来的状态(溶解在溶液里),那这个反应就成立啦。
2. 有气体生成就像碳酸钠和盐酸的反应,会产生二氧化碳气体。
你能看到反应的时候有气泡冒出来,这是因为生成的二氧化碳从溶液里跑出来了。
这就好比两个人交换东西,产生了一个新的东西(气体),这个东西直接就跑掉了,不在原来的体系里了,那这个反应也能顺利进行。
3. 有水生成例如氢氧化钠和盐酸的反应,会生成水。
水是一种很稳定的物质,当这个反应生成水的时候,就好像两个化合物之间达成了一种稳定的交换结果,那这个复分解反应也就成立了。
三、特殊情况不过呢,也有一些看起来像是能发生复分解反应,但实际上却不能发生的情况。
这就需要我们更深入地去了解物质的性质啦。
比如说,有些物质虽然看起来好像能交换成分生成沉淀、气体或者水,但由于它们的溶解性或者其他一些化学性质的限制,反应就是不能发生。
这就像两个人看起来好像可以交换东西,但实际上因为某些规则或者限制,交换不了一样。
反正就是说,复分解反应成立的条件就是要有沉淀、气体或者水生成,当然也要注意那些特殊情况哦。
复分解反应发生的条件乐乐课堂

复分解反应发生的条件乐乐课堂
摘要:
一、复分解反应的定义
二、复分解反应发生的条件
1.适当的离子对
2.可溶于水的化合物
3.酸碱平衡
4.反应条件
5.完全反应
三、总结
正文:
复分解反应是指两种化合物相互交换成分,生成另外两种化合物的反应。
这种反应在化学领域中非常常见,它有助于我们更好地理解化学平衡和反应机制。
要进行复分解反应,需要满足一定的条件。
首先,让我们了解一下复分解反应的定义。
复分解反应是一个化合物分解成两种或更多的化合物的反应。
在复分解反应中,一个离子在反应中发生了位置的变化,这种离子通常是显性阳离子或显性阴离子。
接下来,我们来探讨复分解反应发生的条件。
第一个条件是存在适当的离子对,其中一个离子可以在反应中进行交换位置。
第二个条件是化合物必须可溶于水,因为水是一种极性溶剂,能够帮助离子在反应中移动。
第三个条件是复分解反应通常涉及到酸碱中和反应,例如,氯化亚铁会在碳酸盐碱性解离物中形成氢氧化铁。
第四个条件是大部分情况下,复分解反应需要被加热,以加
速反应速率。
有些反应需要使用催化剂来降低反应的激活能。
最后一个条件是复分解反应中产生的产物必须完全分离,且纯度较高。
总结一下,复分解反应是一种化学反应,其中一个化合物分解成两种或更多的化合物。
要进行复分解反应,需要具备适当的离子对、可溶于水的化合物、酸碱平衡、反应条件和完全反应等条件。
复分解反应发生的条件是什么呢?

复分解反应发生的条件是什么呢?复分解反应发生的条件和原理是什么,考上要掌握什么规律呢?尚不了解的小伙伴们看过来,下面由小编为你精心准备了“复分解反应发生的条件是什么呢?”,持续关注本站将可以持续获取更多的考试资讯!复分解反应发生的条件是什么呢?一、复分解反应条件1、反应物、生成物的种类要求:反应物和生成物都是两种化合物。
2、反应前后物质变化的组合形式:即反应是否“互相交换成分”。
从化合价变化的角度来看,在复分解反应的过程中,只是化合物之间彼此互相交换了成分,元素的化合价都没有变化,如酸与碱反应、盐与盐反应等。
3、反应规律和条件:反应的规律和条件一定要记牢,可利用口诀记忆。
(1)酸碱中和反应规律:酸+碱→盐+水条件:酸与碱中至少有一种是可溶的。
通常酸是可溶性酸,碱既可以是可溶性的碱,也可以是难溶性的碱。
(2)碱性氧化物与酸反应规律:金属氧化物(碱性氧化物)+酸→盐+水条件:酸要溶于水,且一般为强酸。
(3)碱与盐的反应规律:碱+盐→新盐+新碱条件:参加反应的碱和盐都必须可溶;生成的新盐、新碱中至少有一是沉淀。
(4)酸与盐的反应:规律:酸+盐→新盐+新酸条件:反应的酸为可溶性强酸、高沸点酸,生成的酸为弱酸、易挥发性或易分解的酸;生成的盐既不溶于水,也不溶于反应中生成的酸。
(5)盐与盐的反应规律:盐+盐→新盐+新盐条件:参加反应的两种盐必须都是可溶的;生成的两种新盐至少有一是沉淀。
复分解反应的原理在复分解反应中,反应物和生成物,被称为交互盐对,反应通式为:式中A、B代表阳离子;X、Y代表阴离子。
这种体系在相图中称为四元体系,可用AX-BY-H2O或A、B‖X、Y-H2O表示。
例如:可写成:K、Na‖Cl、NO婣-H2O利用四元体系相图可对复分解过程中的溶解、结晶、加热、冷却以及蒸发和稀释等操作进行分析,确定合理生产流程和操作条件,以获得所需产品。
四元体系相图由干盐图和水图组成,K、Na‖Cl、NO婣-H2O四元交互盐对的相图(见图)是其中典型的一例。
复分解反应及反应条件
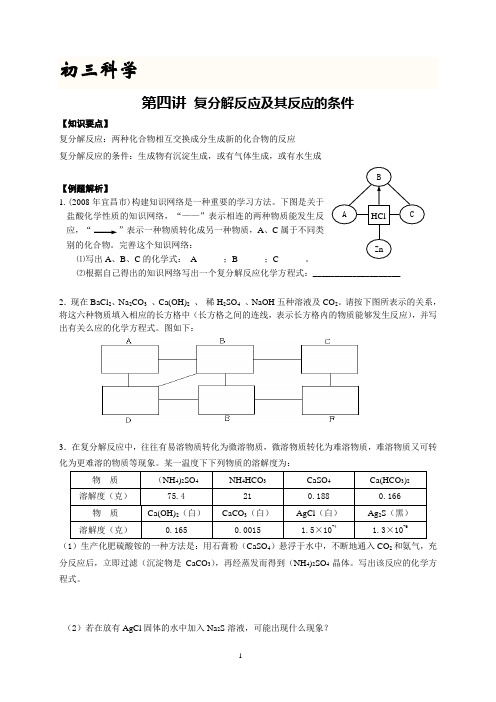
初三科学第四讲 复分解反应及其反应的条件【知识要点】复分解反应:两种化合物相互交换成分生成新的化合物的反应 复分解反应的条件:生成物有沉淀生成,或有气体生成,或有水生成【例题解析】1.(2008年宜昌市)构建知识网络是一种重要的学习方法。
下图是关于盐酸化学性质的知识网络,“——”表示相连的两种物质能发生反应,“ ”表示一种物质转化成另一种物质,A 、C 属于不同类别的化合物。
完善这个知识网络:⑴写出A 、B 、C 的化学式: A______;B______;C______。
⑵根据自己得出的知识网络写出一个复分解反应化学方程式:____________________2.现在BaCl 2、Na 2CO 3 、Ca(OH)2 、 稀H 2SO 4 、NaOH 五种溶液及CO 2。
请按下图所表示的关系,将这六种物质填入相应的长方格中(长方格之间的连线,表示长方格内的物质能够发生反应),并写出有关么应的化学方程式。
图如下:3.在复分解反应中,往往有易溶物质转化为微溶物质,微溶物质转化为难溶物质,难溶物质又可转化为更难溶的物质等现象。
某一温度下下列物质的溶解度为:物 质 (NH 4)2SO 4NH 4HCO 3CaSO 4 Ca(HCO 3)2 溶解度(克)75.4 21 0.188 0.166 物 质 Ca(OH)2(白)CaCO 3(白) AgCl (白) Ag 2S (黑) 溶解度(克)0.1650.00151.5×10-41.3×10-6(1)生产化肥硫酸铵的一种方法是:用石膏粉(CaSO 4)悬浮于水中,不断地通入CO 2和氨气,充分反应后,立即过滤(沉淀物是CaCO 3),再经蒸发而得到(NH 4)2SO 4晶体。
写出该反应的化学方程式。
(2)若在放有AgCl 固体的水中加入Na 2S 溶液,可能出现什么现象?HClZ nACB【练习巩固】1.下列物质混合,能反应的写出化学方程式。
复分解反应条件的实验

复分解反应条件的探究
复分解反应:两种化合物互相交换成分,生成另外两种化合物的反应。
AB + CD →AD + CB
复分解反应发生的条件:生成水、气体、沉淀
一、生成水
实验1:取两支分别装有氢氧化钙和氢氧化钠溶液的试管,加入酚酞,再往试管中滴加稀盐酸,观察现象。
实验现象
氢氧化钙
氢氧化钠
生成水的实质为:酸碱的中和反应。
二、生成气体(气体一般为CO2和NH3)
实验2:取两支试管,其中两两加入碳酸钠和碳酸氢钠粉末少量,往试管中滴加少量稀盐酸,观察现象
稀盐酸
碳酸氢钠
碳酸钠
CO2的生成实质为:CO32- + 2H+ →CO2 + H2O
HCO3- + H+ →CO2 + H2O
实验3:取两支试管,加入少量硝酸铵溶液,分别往试管中加入氢氧化钠和氢氧化钙,观察实验现象
NH3生成的实质:NH4+ + OH- →NH3 + H20
硝酸铵
氢氧化钠
氢氧化钙
三、生成沉淀(常见沉淀为CaCO3、BaSO4、AgCl、Cu(OH)2)
实验4:取一支试管,加入少量氯化钙溶液,再往试管中加入碳酸钠溶液,观察试验现象。
碳酸钠
氯化钙
实验5:取两支试管,分别加入氯化钡溶液,再往试管中分别加入硫酸钠和碳酸钠溶液,观察试验现象,再加入硝酸溶液,观察实验。
氯化钡
硫酸钠
碳酸钠
实验6:取两支试管,加入少量硝酸银溶液,再往试管中分别加入盐酸和氯化钠溶液,观察实验现象,再加入硝酸溶液,观察现象。
硝酸银
盐酸
氯化钠
实验7:取两支试管,加入少量硫酸铜,分别加入氢氧化钙和氢氧化钠,观察实验现象
硫酸铜
氢氧化钙
氢氧化钠。
复分解反应的条件与实质

复分解反应的条件与实质
【知识点的认识】复分解反应的条件有两个:
1.对反应物的要求是:反应物必须可溶;这里的“可溶”包括可溶于酸,即反应物中有酸时,另一种物质可以不溶于水,但必须能溶于酸.
2.对生成物的要求是:生成物中必须要有沉淀或气体或水.
例如:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4、CaCO3+2HCl=CaCl2+CO2↑+H2O、Fe2O3+6HCl=2FeCl3+3H2O.
而复分解反应的实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质(如水)、难溶的物质(即沉淀)或气体,使溶液中离子浓度降低;而化学反应正是向着离子浓度降低的方向进行的;从而使复分解反应趋于完成.可简记为AB+CD=AD+CB.。
发生复分解反应的条件

发生复分解反应的条件
1. 生成物必须有沉淀或水或气体生成,否则不反应。
①,有水生成。
②,即没有沉淀或水生成,也没有气体生成。
2. 反应物也有一定的要求,否则同样也不反应。
(1)碱与盐反应必须都可溶,但都可溶不一定都能反应。
①,因为反应物都可溶,且生成物中有沉淀。
②,虽然好像有沉淀生成,但是反应物都不溶或不都溶。
③,因为反应物虽都可溶,但没有符合条件的生成物。
(2)盐与盐的反应,反应物必须都可溶,但都可溶也不一定都能反应。
①,因为反应物都可溶,且有沉淀生成。
②,,好像都有沉淀生成,但是两个反应的反应物都不溶或有一种不溶,所以都不反应。
③,虽然反应物都可溶,但生成物中无沉淀、无水、也无
气体。
(3)常见的酸与碱,无论碱是否可溶,它们都能反应生成盐和水。
(4)常见的酸与盐的反应,这类反应比较复杂,初中阶段只要求记住碳酸盐与常见的酸都能反应,其他盐则要求可溶且生成物中要有气体或沉淀或水。
①,生成物、反应物都符合要求。
②,,前一个反应式中的反应物不溶,所以不反应。
后一个反应式中的反应物虽都可溶,但生成物不符合要
求,因此也不反应。
同学们要掌握两种化合物间是否会发生复分解反应,不仅要掌握复分解反应发生的条件,还必须掌握酸、碱、盐的溶解性。
(注:文章中的可溶是指可溶于水。
)。
九年级化学复分解反应的三个条件

复分解反应条件1、反应物、生成物的种类要求:反应物和生成物都是两种化合物。
2、反应前后物质变化的组合形式:即反应是否“互相交换成分”。
从化合价变化的角度来看,在复分解反应的过程中,只是化合物之间彼此互相交换了成分,元素的化合价都没有变化,如酸与碱反应、盐与盐反应等。
复分解反应的实质复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。
如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应是两种化合物互相交换成分生成另外两种化合物的反应,复分解反应条件为:反应物有酸可不溶于水,无酸可不溶于水;生成物有气体,沉淀,水产生(任意至少一种)。
复分解反应:(1)复分解反应的概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB(2)复分解反应的特点:①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
3、反应规律和条件:反应的规律和条件一定要记牢,可利用口诀记忆。
(1)酸碱中和反应规律:酸+碱→盐+水条件:酸与碱中至少有一种是可溶的。
通常酸是可溶性酸,碱既可以是可溶性的碱,也可以是难溶性的碱。
(2)碱性氧化物与酸反应规律:金属氧化物(碱性氧化物)+酸→盐+水条件:酸要溶于水,且一般为强酸。
(3)碱与盐的反应规律:碱+盐→新盐+新碱条件:参加反应的碱和盐都必须可溶;生成的新盐、新碱中至少有一是沉淀。
(4)酸与盐的反应:规律:酸+盐→新盐+新酸条件:反应的酸为可溶性强酸、高沸点酸,生成的酸为弱酸、易挥发性或易分解的酸;生成的盐既不溶于水,也不溶于反应中生成的酸。
(5)盐与盐的反应规律:盐+盐→新盐+新盐条件:参加反应的两种盐必须都是可溶的;生成的两种新盐至少有一是沉淀。
常见的复分解反应:①常见的有沉淀生成的复分解反应N a2CO3+Ca(OH)2=CaCO3+2NaOHCuSO4+2NaOH==Cu(OH)2↓+Na2SO4FeCl3+3NaOH==Fe(OH)3↓+3NaClNaCl+AgNO3==AgCl↓+NaNO3H2SO4+BaCl2==BaSO4↓+2HCl②常见的有气休生成的复分解反应CaCO3+2HCl==CaCl2+H2O+CO2↑2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O③常见的有水生成的复分解反应NaOH+HCl==NaCl+H2ONa2CO3+HCl==NaCl+H2O+CO2↑复分解反应易错点:例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。
复分解反应发生的条件及应用课件

目录
• 复分解反应概述 • 复分解反应发生的条件 • 复分解反应的应用 • 复分解反应的实验与操作 • 复分解反应的挑战与解决方案 • 复分解反应的前沿研究与展望
01
复分解反应概述
定义与特点
总结词
复分解反应是化学反应的一种类型,其特点是反应物通 过交换离子或分子而生成两种新的化合物。
总结词
复分解反应在新能源领域具有广泛的应用前景,如燃料电池、太阳能电池和锂离子电池 等。
详细描述
在燃料电池中,复分解反应可用于电化学氧化还原反应的催化过程,提高电池效率和稳 定性。在太阳能电池中,复分解反应可用于制备光敏材料和染料敏化剂等关键组分。在 锂离子电池中,复分解反应可用于正极和负极材料的合成,提高电池的能量密度和循环
绿色化学在复分解反应中的应用
总结词
绿色化学理念在复分解反应中得到广泛应用,旨在减少或消除对人类健康和环境 的负面影响。
详细描述
绿色化学强调使用无毒或低毒的原料、溶剂和催化剂,以及采用节能减排的技术 。在复分解反应中,绿色化学的应用包括优化反应条件、提高原子利用率和减少 废物排放等。
复分解反应在新能源领域的应用
根据实验结果分析复分解反应发生的条件, 如生成水、气体或沉淀等。
复分解反应的挑战与解决方
05
案
反应不完全的问题
01
02
03
反应物浓度
反应物浓度过低可能导致 反应不完全,需要调整反 应物浓度以促进反应进行 。
温度控制
温度过高或过低可能影响 反应速率,需要控制温度 在适宜范围内。
催化剂选择
选择适当的催化剂可以促 进反应进行,提高反来自效 率。01 肥料的生产
复分解反应在肥料的生产中起着重要作用,如氮 肥、磷肥、钾肥等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专项复习复分解反应及其发生条件
一、复分解反应概念
两种化合物相互交换成分生成另两种化合物的反应。
注意:
1、两种化合物生成另两种化合物的反应,如没有相互交换成分,则不是复
分解反应。
如:CO2+Ca(OH)2==CaCO3↓+H2O CO+CuO==Cu+CO2
2、复分解反应的特征:“等价交换”。
即:复分解反应前后各元素的化合价
不变。
3、复分解反应的实质:是化合物中离子间的反应,即两种化合物在溶液中
相互交换离子,生成气体、沉淀或水。
二、复分解反应发生的条件
三、酸、碱、盐的溶解性规律
(1)酸:初中化学常见酸都溶于水。
(2)碱:钾、钙、钠、钡、铵对应的碱溶于水,其余碱不溶于水。
(其中Ca(OH)2微溶)
(3)盐:钾、钠、铵盐、硝酸盐,都能溶解水中间。
盐酸不溶氯化银,硫酸不溶钡和铅。
碳酸可溶钾、钠、铵,其余遇水都沉淀。
(4)不同沉淀在酸中的溶解性:
1、碱沉淀和碳酸盐沉淀都能溶于酸,与酸反应。
2、AgCl和BaSO4既不溶于水,又不溶于酸。
四、常见溶液中能反应的离子组
五、复分解反应规律(1)成水的复分解反应
(2)成气的复分解反应
(3)成碱沉淀的复分解反应
(4)成碳酸盐沉淀的复分解反应
(5)成盐酸盐沉淀的复分解反应
(6)成硫酸盐沉淀的复分解反应。
