初中化学计算题专题PPT课件
合集下载
初中化学计算题专题复习 PPT课件 图文

量分数(写出计算过程).
2. 工业上高温煅烧石灰石(CaCO3)可制得生石灰和二氧化碳。如果要制取 5.6t氧化钙,需要碳酸钙多少吨?
3. 工业上制的小苏打样品中常含有少量的杂质。为了测定样品中碳酸氢钠的质 量分数,现进行如下实验:向盛有13.6 g该样品的烧杯中加入93 g稀盐酸,恰 好完全反应(杂质不参加反应,也不溶于水),反应后称得烧杯中剩余物质的 总质量为100 g(反应的化学方程式为:NaHCO3+HCl ═ NaCl+H2O+CO2↑)。 请计算:(1)完全反应数(计算结果保留一位小数)。
4)实验室配制50g质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少?
(三)方程式中的计算
1.中和反应在工农业生产中应用广泛,现向40g 10%的
氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化
(曲线如图),请分析计算:
40g 10%的氢氧化钠溶液中含有
g的氢氧化钠;当
滴入36.5g盐酸时,溶液的pH为 7 .所用盐酸的溶质质
4)X、Y两元素的相对原子质量之比为7:2,它们所形成的化合 物中,X、Y两元素的质量比为21:8,则该化合物的化学式可表 示为( ) A. X3Y4 B.X2Y3 C.X3Y2 D.XY
3.原子个数之比=(元素质量÷相对原子质量)之比 。(即为化学式脚标之比) 练习:计算下列物质中各元素原子的个数比 C6H12O6中C:H:O= NH4NO3 中H:O:N= 4.化合物中某元素的质量分数=
6.某元素的质量=
某元素的质量=某混合物的质量×纯度×某元素质量分 数 练习:1)125Kg石灰石中含有80%CaCO3,求这批石灰石 中钙元素的质量是多少?
2)合格奶粉每100克中含蛋白质(化学式为C4H11O2NS) 约18克,蛋白质中氮元素的平均质量分数为16%,则每 100克合格奶粉中,氮元素质量为多少克?
初中化学计算题专题复习课件大全(共54张PPT)

故氮原子个数=(400× 3.8%) ÷14=1.09,
B正确。
例3:
跟50千克硝酸铵NH4 NO3里所含 氮元素质量相等的碳酸 氢铵 NH4 HCO3的质量是多少?
解: 设碳酸氢铵的质量为 x
所含氮元素质量相等
2N N 50kg 100% x 100% NH4 NO3 NH4 HCO3 x 98.8kg
96g
<
反应后O元素质量
=88g×(32/44)+54g×(16/18)
=112g
所以M中一定含有C,H,O元素
根据化学方程式计算应注意的问题:
化学方程式要配平, 需将纯量代方程 关系式对关系量, 计算单位不能忘
关系量间成比例,
解设比答要牢记
第3课:有关溶液的计算
第1课:根据化学式的计算
有关溶液 的计算
例4:
质量相同的SO2和SO3中,
所含氧元素的质量比是: (A)2 : 3 (B)5 : 6 (C)6 : 5 (D)1 : 1
解:方法(1):
SO 2中氧元素的质量分数 50% SO 3中氧元素的质量分数 60%
SO 2 1g 50% 0.5g 5 SO 3 1g 60% 0.6g 6
所含氧元素的质量比为 5 : 6 选B。
方法(2)关系量法:
SO 2 2O 64 1 x : y 5: 6 32 x
SO 3 3O 80 1 48 y
FeO FeO3/2 FeO4/3
例 5.在FeO、Fe2 O 3 、 Fe3 O 4三种化
合物中,与等质量铁元素相结合的氧元 素的质量比为( A ) A 6∶9∶8 B 12∶8∶9 C 2∶3 ∶6 D 1∶ 3∶4
中考化学计算(精讲课件与训练)(共26张PPT)

如乙醇(C2H6O)中C、H、O三种元素的质量比= (12×2):(1×6):(16×1)=12:3:8 。
该元素的相对原子质量×该元素的原子个数
4.化合物中某元素的质量分数=
化合物的相对分子质量
×100%
如乙醇(C2H6O)中C元素的质量分数=
=52.2% 。【注意】求质量分数一定要乘以100%。
难点二 根据化学方程式的计算解答 解题技巧
1.在进行化学方程式计算时,化学方程式书写必须正确; 2.化学方程式的计算体现的是纯净物间按一定质量比发生反应的关系,因此解题 时,首先要找出题中反应物(或生成物)纯净的且完全反应的质量,再代入化学方 程式计算。 3.如果涉及到图像、表格、实验数据等,要运用质量守恒定律等方法在题目中寻 找“生成的气体、沉淀”或“溶解的固体”等隐含的“纯净物”的质量进行计算。 4.若涉及到液体的体积,是不能直接代入化学方程式计算的,需根据公式“质量 =体积×密度”换算成质量才能代入化学方程式计算。
难点二 根据化学方程式的计算解答
典例剖析
【典例2】(2019•湘西州)实验室用40克含碳酸钙75%的石灰石样品与足量的稀盐酸混合制取二氧化 碳(化学反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑)。 求:(l)40克石灰石样品中含碳酸钙 30 克; 40克该石灰石样品含碳酸钙的质量为40g×75%=30g (2)充分反应后,理论上可制得二氧化碳多少克?(要求:结合化学方程式计算,并写出计算过程)
难点二 根据化学方程式的计算解答 精准排查
(2019•海南)科学家正致力于研究光催化分解水制氢气,反应方程式为2H2O 用该方法制取12kg氢气至少需要分解多少千克的水?
解:设制取12kg氢气至少需要分解水的质量为x
九年级化学上册《利用化学方程式的简单计算》PPT课件

2Na2O2+2CO2 2Na2CO3+O2
2×78
32
x
48g
x =
234g
2×78
x
32
48g
=
答:要得到48g氧气,需过氧化钠的质量是234g。
氢气是未来汽车的理想燃料。1Kg的氢气就 能供一辆功率为50KW的汽车跑大约100Km。 水是生命之源,找到合适的催化剂,即可利用 光能将水分解制取氢气。
Mg+O2 MgO
点燃
24
40
72g
x
24
72g
=
X = 120g
答:燃烧72g镁最多 可得氧化镁质量为120g。
乙同学:解:设燃烧72g镁最多 可得氧化镁质量为x
点燃
24
72g
56
x
40
x
24
72g
56
x
=
X = 168g
答:燃烧72g镁最多 可得氧化镁质量为168g。
三个关键: (1)准确书写化学方程式; (2)准确计算相对分子质量; (3)代入量均指纯净物的质量(单位要代入计算过程);
作业布置:
P102 — 4、5题
杨玲玲
黄明平
沈宏根 田瑞芹
杨学儒
敬请各位专家的指导!!! Thank you
18
2
32
4
尝试运用
加热分解6g高锰酸钾,可以得到多少g氧气?
2KMnO4 K2MnO4 + MnO2 + O2↑
解:设加热分解6g高锰酸钾可以得到氧气的质量为x。
△
316
32
6g
x
316
.6g
答:加热分解6g高锰酸钾,可以得到0.6g氧气。
2×78
32
x
48g
x =
234g
2×78
x
32
48g
=
答:要得到48g氧气,需过氧化钠的质量是234g。
氢气是未来汽车的理想燃料。1Kg的氢气就 能供一辆功率为50KW的汽车跑大约100Km。 水是生命之源,找到合适的催化剂,即可利用 光能将水分解制取氢气。
Mg+O2 MgO
点燃
24
40
72g
x
24
72g
=
X = 120g
答:燃烧72g镁最多 可得氧化镁质量为120g。
乙同学:解:设燃烧72g镁最多 可得氧化镁质量为x
点燃
24
72g
56
x
40
x
24
72g
56
x
=
X = 168g
答:燃烧72g镁最多 可得氧化镁质量为168g。
三个关键: (1)准确书写化学方程式; (2)准确计算相对分子质量; (3)代入量均指纯净物的质量(单位要代入计算过程);
作业布置:
P102 — 4、5题
杨玲玲
黄明平
沈宏根 田瑞芹
杨学儒
敬请各位专家的指导!!! Thank you
18
2
32
4
尝试运用
加热分解6g高锰酸钾,可以得到多少g氧气?
2KMnO4 K2MnO4 + MnO2 + O2↑
解:设加热分解6g高锰酸钾可以得到氧气的质量为x。
△
316
32
6g
x
316
.6g
答:加热分解6g高锰酸钾,可以得到0.6g氧气。
九年级化学计算— 技巧性计算题 课件(20张PPT)

2CO+O2 2CO2 56 88 z 2.2 g 56 z z = 1.4 g 88 2.2g
故甲烷和一氧化碳的质量比为2.4 g : 1.4 g=12 : 7
点燃
6. 某气体由CH4、C2H2、C2H4中的一种或几种 组成,取该气体样品在氧气中完全燃烧,测得 生成的二氧化碳和水的质量比为22∶9,则该气 体的组成成分中( C ) A. 一定含有C2H4 C. 可能含有C2H2 D. 不可能同时含有CH4、C2H2、C2H4 B. 一定没有CH4
208g-48g=160g,则反应前CH4和O2的质量
5. 将一定质量的甲烷和一氧化碳的混合气体在
足量的氧气中充分燃烧,将生成物依次通入盛
有足量浓硫酸和氢氧化钠溶液的洗气瓶,实验
测得装有浓硫酸的洗气瓶增重5.4克;装有氢
氧化钠溶液的洗气瓶增重8.8克。混合气体中
甲烷和一氧化碳的质量之比为________。
23 46 10.6 g× ×100%+8 g× ×100%=9.2 g 40 106
2.(2017河南)现有NaCl和NaBr的混合物共2.2 g ,溶于水并加入过量AgNO3溶液后,生成 AgCl和AgBr沉淀共4.75g,则原混合物的含钠 元素的质量为_____g。
【解析】由于NaCl和NaBr溶液与AgNO3溶液反应 生成AgCl和AgBr沉淀,故反应前后氯和溴元素的 质量总和不变,反应前后的质量差是钠转化为银所 致(即Na与Ag的质量差),设 Na质量为x,则有 Na~~Ag 质量差 23 108 108-23=85 x 4.75g-2.2g=2.55g
由于二氧化碳和水质量比为22∶9,则碳元素和
12 2 氢元素的质量比为:(22× ) : (9× )=6 : 1, 44 18
化学计算PPT课件(初中科学)

全效学习中考学练测
考点管理 归类探究 限时集训
加热 Na2CO3·nH2O=====Na2CO3+nH2O
51.30克6 =189n
106 5.3 克
18n 9克
n=10
(5)设与样品C反应的盐酸的质量为a,生成氯化钠的
质量为b,生成二氯化碳的质量为c。
Na2CO3 + 2HCl===2NaCl + H2O + CO2↑
(1)设生成10.0 g碳酸钙需要碳酸钠的质量为x。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106
100
x
10.0 g
全效学习中考学练测
考点管理 归类探究 限时集训
10x6=1100.00g 解得:x=10.6 g 样品中碳酸钠的质量分数为:
10.6 11.0
gg×100%=96.4%;
(3)B样品中含有结晶水的质量是___9___克。 (4)化学式Na2CO3·nH2O中n是多少?___1_0___ (5)对C样品的操作结束后,所得NaCl溶液的溶质质 量分数是多少?(精确到0.01%)___4_.2_6_%___ 【解析】 (4)由于B样品中Na2CO3的质量与A相 等,也为5.3克,结晶水的质量为9克。
【解析】 比较不同物质的溶解度必须在相同温度下 才能比较。将t3℃的A、B两种物质的饱和溶液各200g,降 温至t1℃时由于两个温度下溶解度差值A大于B,所以析出 晶体A大于B。
全效学习中考学练测
考点管理 归类探究 限时集训
类型之三 根据化学方程式计算 [2013·绍兴]将质量为44.4克含有少量NaCl的纯
碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进 行如图Z3-2实验(Na2CO3受热不分解)。
考点管理 归类探究 限时集训
加热 Na2CO3·nH2O=====Na2CO3+nH2O
51.30克6 =189n
106 5.3 克
18n 9克
n=10
(5)设与样品C反应的盐酸的质量为a,生成氯化钠的
质量为b,生成二氯化碳的质量为c。
Na2CO3 + 2HCl===2NaCl + H2O + CO2↑
(1)设生成10.0 g碳酸钙需要碳酸钠的质量为x。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106
100
x
10.0 g
全效学习中考学练测
考点管理 归类探究 限时集训
10x6=1100.00g 解得:x=10.6 g 样品中碳酸钠的质量分数为:
10.6 11.0
gg×100%=96.4%;
(3)B样品中含有结晶水的质量是___9___克。 (4)化学式Na2CO3·nH2O中n是多少?___1_0___ (5)对C样品的操作结束后,所得NaCl溶液的溶质质 量分数是多少?(精确到0.01%)___4_.2_6_%___ 【解析】 (4)由于B样品中Na2CO3的质量与A相 等,也为5.3克,结晶水的质量为9克。
【解析】 比较不同物质的溶解度必须在相同温度下 才能比较。将t3℃的A、B两种物质的饱和溶液各200g,降 温至t1℃时由于两个温度下溶解度差值A大于B,所以析出 晶体A大于B。
全效学习中考学练测
考点管理 归类探究 限时集训
类型之三 根据化学方程式计算 [2013·绍兴]将质量为44.4克含有少量NaCl的纯
碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进 行如图Z3-2实验(Na2CO3受热不分解)。
初三化学计算题型ppt课件
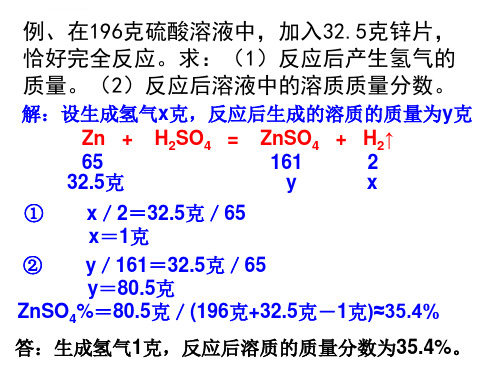
Y/95=2.2克/44
Y=4.75克
m溶质=15.8克-4.2克+4.75克=16.35克 MgCl2%=16.35克/113.6克≈14.4%
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
金属与溶液的计算
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
例1、某样品为Cu和CuO的混合物,为测定样品中 CuO的含量,甲、乙、丙、丁四位学生用同一种样 品分别进行实验,测得的数据如下表:
物质质量 所取固体样品的质量(g) 加入硫酸溶液的质量(g) 反应后剩余固体的质(g)
甲乙丙丁 30 25 20 20 100 100 100 120 22 17 12 12
500g,向其中加入溶质质量分数为20%的氢氧化
钠溶液。测得沉淀质量与所加入的氢氧化钠溶液
的质量关系如下图:
根据所得数据计算:
①500 g该废水中
硫酸铜的质量。
②该废水中硫酸的
溶质质量分数。
③在图像A点处填
上适当的数据。
A
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
NaCl%=29.25克/(157.5克+146克-11克)=10%
答:略
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
3、把含有MgCO3、MgCl2固体的混合物共15.8克 加入到100克盐酸中,完全反应,测量总质量数 据如下:
化学中考备考复习《化学计算题》精讲课件(一)(课件48页)

实验序号
①
②
③
样品的质量/g
10
20
30
生成气体的质量/g
0.1
0.2
0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
【提示】分析给出的数据,成正比例关系的都是完全反应的,打破“比例
”关系的数据存在过量问题,即未完全反应。找出反应物(稀硫酸)消耗完
时生成气体的质量代入计算。
【提示】先计算出赤铁矿的纯度,纯度= 纯净物的质量×100%=
混合物的质量
混×1合00物%的,质再量根-据杂纯质度的计质算量纯净物的质量,即纯净物的质量=混合物的质
混合物的质量
量×纯度。
(1)80%
(2)解:设参加反应的HCl的质量为xFe2O3 +6HCl === 2FeCl3
+ 3H2O160
×100%=
×100%②纯 混溶净 合质物 物质的 的量质 质=量 量溶液质量×溶质纯质净量物纯 分的净 数质物量的+ 杂质质量的质量
溶质质量 溶液质量
溶质质量 溶质质量 + 溶剂质量
文字叙述型 1. 实验室欲配制84 g质量分数为10%的碳酸氢钠溶液用于实验,请计算: (1)需要碳酸氢钠的质量为_____g。(2)已知碳酸氢钠与稀盐酸产生如下反 应:NaHCO3+HCl===NaCl+H2O+CO2↑。向84 g 10%的碳酸氢钠溶 液中加入一定量的稀盐酸,恰好完全反应,反应后剩余溶液质量为117 g(假设生成的气体全部逸出)。
答题模板
答题细则
求:求出未知数
x=9.6 g
细则5:计算结果要带单位
答:24.5 g KClO3分解可 答:简明地写出答案 以得到O2的质量为9.6 g 细则6:答案不能漏写
初中化学计算题专题复习PPT课件

❖ 化学计算并不是纯粹的数学计算,它主要是考查 化学基本概念、化学原理和化学定律的具体运用, 对物质间相互反应规律及定律关系的理解和应用。
学生分析常见考题
❖ 结合近几年河南考题分析考题类型。 ❖ 考查学生看题、分析、综合能力。
教师讲解
化
学
1.有关化学式的计算
计
算
2.根据化学方程式的计算
题
的
3.溶液中溶质质量分数的计算
反应物、生成物间的质量比来求算的,对某些反应,可直 接依据质量守恒定律进行计算. ❖ (3)根据化学方程式进行含有一定且杂质的反应物或生 成物的计算
解题要点
❖ 根据化学方程式的计算,其反应物或生成物的质 量必须是纯物质的质量.含有一定量杂质的反应 物或生成物的质量,必须换算成纯物质的质量, 才能按根据化学方程式的计算步骤和方法进行计 算.纯物质质量=含有一定量杂质的物质质量× 该物质质量分数
义马一中
初中化学计算题专题复习
说课内容
教学过程
教材分析
教学 目标
学情分析
学法教法
教学目标
知识与能力目标 1、掌握化学计算的类 2、知道化学计算的考查目标: 3、掌握化学计算的基本步骤。 过程与方法目标 1、学会分析题目。 2、培养分析判断能力。 情感态度与价值观目标 克服对计算题的为难情绪,培养自信心。
分
类
4.综合计算(化学式、化学方程式、溶液综合计算)。
常见题型
❖ 根据化学式计算物质的相对分子质量; ❖ 根据化学式计算组成物质的各元素的质量比; ❖ 根据化学式计算物质中某元素的质量分数; ❖ 根据化学式计算一定质量的物质中某元素的质量,
或含一定质量某元素的化合物的质量; ❖ 不纯物质中某元素质量分数的计算
学生分析常见考题
❖ 结合近几年河南考题分析考题类型。 ❖ 考查学生看题、分析、综合能力。
教师讲解
化
学
1.有关化学式的计算
计
算
2.根据化学方程式的计算
题
的
3.溶液中溶质质量分数的计算
反应物、生成物间的质量比来求算的,对某些反应,可直 接依据质量守恒定律进行计算. ❖ (3)根据化学方程式进行含有一定且杂质的反应物或生 成物的计算
解题要点
❖ 根据化学方程式的计算,其反应物或生成物的质 量必须是纯物质的质量.含有一定量杂质的反应 物或生成物的质量,必须换算成纯物质的质量, 才能按根据化学方程式的计算步骤和方法进行计 算.纯物质质量=含有一定量杂质的物质质量× 该物质质量分数
义马一中
初中化学计算题专题复习
说课内容
教学过程
教材分析
教学 目标
学情分析
学法教法
教学目标
知识与能力目标 1、掌握化学计算的类 2、知道化学计算的考查目标: 3、掌握化学计算的基本步骤。 过程与方法目标 1、学会分析题目。 2、培养分析判断能力。 情感态度与价值观目标 克服对计算题的为难情绪,培养自信心。
分
类
4.综合计算(化学式、化学方程式、溶液综合计算)。
常见题型
❖ 根据化学式计算物质的相对分子质量; ❖ 根据化学式计算组成物质的各元素的质量比; ❖ 根据化学式计算物质中某元素的质量分数; ❖ 根据化学式计算一定质量的物质中某元素的质量,
或含一定质量某元素的化合物的质量; ❖ 不纯物质中某元素质量分数的计算
中考化学专题复习课件 化学计算 (共13张PPT)

知识准备
物质的相对分子质量 物质中各元素的质量比 物质中某元素的质量分数 有关化学方程式的计算
思路决定出路
溶液质量、体积、密度的换算
配制溶液有关计算
溶液稀释的计算
思路决定出路
解题的一般策略:
首先认真审题,理清题中所述的化 学反应过程; 其次挖掘题目中给出的隐含条件; 最后将综合问题的转化为简单问题。
实例:某化学兴趣小组为了测定
一工厂废水中硫酸的含量,取l00g废 水于烧杯中,加入16g溶质质量分数 为10%的氢氧化钠溶液,恰好完全反 应(废水中无不溶物,其它成分不与 氢氧化钠反应)。请计算: (1)废水中硫酸的质量分数是多 少?(精确到0.01%) (2)若该工厂每天用含氢氧化钙 75%的熟石灰处理150t这种废水,需 要熟石灰多少吨?
解决综合计算题时要
注意的问题。
思路决定出路
(1)溶液的质量不能直接代入化学方程式进行 计算,溶液参与化学反应,往往是溶液中的溶 质参加反应或者生成物中的可溶物成为反应后 溶液中的溶质,形成新的溶液;
(2)对于图表分析计算,应仔细分析实验数据,理清化学 反应的过程,挖掘题目给出的隐含条件; (3)化学方程式所表示的反应物和生成物都是指纯净物,不纯物质不能代 入方程式计算,遇到不纯物质时,需要将不纯物质换算成纯净物质的量, 才能代入方程式,按质量比进行计算。
思路决定出路
解: (1)设废水中硫酸的质量分数为X。
H2SO4+2NaOH==Na2SO4+2H2O
98 80 X*100g 16g*10% 80 98 X*100g=== 16g*10% X=1.96%
(2)设需要熟石灰的质量为y。
Ca(OH)2+H2SO4==CaSO4+2H2O
中考化学专题复习课件:化学计算(共31张PPT)

专题7┃化学计算
类型二 有关表格的计算
例 2 已知氯化钠溶液和硝酸银溶液反应生成氯化银
(AgCl)沉淀和硝酸钠。为测定某生理盐水的溶质质量分数, 将生理盐水样品与足量的硝酸银溶液混合,有关实验数据如
下表:
反应前
反应后
实验 生理盐水 加入硝酸银 过滤后剩余溶液 数据 样品的质量 溶液的质量 的质量
130 g
解:设原混合物中锌的质量为 x,生成的硫酸锌的质量为 y。 Zn+H2SO4===ZnSO4+H2↑
65 161 2
x y 0.4 g 625=0.4x g x=13 g 1621=0.4y g y=32.2 g (1)黄铜屑中铜的质量为:32.5 g-13 g=19.5 g。 (2)硫酸锌的质量分数为 20%时,溶液的质量为3220.%2 g=161 g。 蒸发水的质量为 180 g+13 g-0.4 g-161 g=31.6 g。 答:略。
专题7┃化学计算
解 析 A 饱和溶液恒温蒸发水分后,所得溶液中溶质
的质量分数不变;B 和 D 没有告诉我们原溶液的溶质质量
分数无法计算,再有蒸发掉 10 g 水是否有固体析出也是不
确定的。C 混合后溶液中溶质的质量分数为:
10 g×10%+5 g×40% 10 g+5 g
×100%=20%。
专题7┃化学计算
(1)上述反应不是置换反应的理由是反__应__物__中__没__有__单__质__。 (2)Fe2O3 中铁元素的质量分数是___7_0__%__。 (3)根据化学方程式计算:用含 Fe2O360%的赤铁矿石 800 t,理论上可炼出纯铁多少吨?
专题7┃化学计算
答案
解:设理论上可炼出纯铁的质量为 x。
4.(多选) 某有机物在氧气中充分燃烧,将生成的水 蒸气、二氧化碳气体依次通过装置甲和乙(假设每步吸收 完全),称量通入气体前后装置的质量,数据如下:
类型二 有关表格的计算
例 2 已知氯化钠溶液和硝酸银溶液反应生成氯化银
(AgCl)沉淀和硝酸钠。为测定某生理盐水的溶质质量分数, 将生理盐水样品与足量的硝酸银溶液混合,有关实验数据如
下表:
反应前
反应后
实验 生理盐水 加入硝酸银 过滤后剩余溶液 数据 样品的质量 溶液的质量 的质量
130 g
解:设原混合物中锌的质量为 x,生成的硫酸锌的质量为 y。 Zn+H2SO4===ZnSO4+H2↑
65 161 2
x y 0.4 g 625=0.4x g x=13 g 1621=0.4y g y=32.2 g (1)黄铜屑中铜的质量为:32.5 g-13 g=19.5 g。 (2)硫酸锌的质量分数为 20%时,溶液的质量为3220.%2 g=161 g。 蒸发水的质量为 180 g+13 g-0.4 g-161 g=31.6 g。 答:略。
专题7┃化学计算
解 析 A 饱和溶液恒温蒸发水分后,所得溶液中溶质
的质量分数不变;B 和 D 没有告诉我们原溶液的溶质质量
分数无法计算,再有蒸发掉 10 g 水是否有固体析出也是不
确定的。C 混合后溶液中溶质的质量分数为:
10 g×10%+5 g×40% 10 g+5 g
×100%=20%。
专题7┃化学计算
(1)上述反应不是置换反应的理由是反__应__物__中__没__有__单__质__。 (2)Fe2O3 中铁元素的质量分数是___7_0__%__。 (3)根据化学方程式计算:用含 Fe2O360%的赤铁矿石 800 t,理论上可炼出纯铁多少吨?
专题7┃化学计算
答案
解:设理论上可炼出纯铁的质量为 x。
4.(多选) 某有机物在氧气中充分燃烧,将生成的水 蒸气、二氧化碳气体依次通过装置甲和乙(假设每步吸收 完全),称量通入气体前后装置的质量,数据如下:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)“质量守恒”指参加化学反应的各物质质量总和和生成物的各物质质量 总和相等,不包括未参加反应的物质的质量,也不包括杂质。
1、化学方程式的书写步骤
(1) 写:正确写出反应物、生成物的化学式
(2) 配:配平化学方程式
(3) 注:注明反应条件,如果反应物中无气体(或固体)参加,反应 后生成物中有气体(或 固体),在气体(或固体)物质的化学式右边要 标出“↑”(或“↓”). 若有气体(或固体) 参加反应,则此时生成的 气体(或固体)均不标箭头,即有气生气不标“↑”,有固生固不标“↓”
(1)维生索D种类较多,其中维生素D2的化学式为C28H44O, 试计算维生素D2的ห้องสมุดไป่ตู้对分子质量为 396 ;维生素D2中碳、 氢、氧三种元素的质量比为84:1。1:14 (2)计算高钙片中碳酸钙的质量分数 。
例8.根据尿素的化学式[CO(NH2)2]计算:
①尿素的相对分子质量为____6_0________;
三条曲线中,表示CuO和其中所
· ·
含Cu元素质量关系的曲线是
________B__________;
·
例7.下图为哈药集团制药六厂生产的“新盖中盖牌”高 钙片标签上的部分文字,请仔细阅读后回答下列问题。
[主要原料]碳酸钙、维生素D [功效成份]补钙每片中含:
钙(以Ca计)500 mg维生素D 100 IU [食用方法] 每日1次,每次1片 [规 格] 2.5g/片
解:方法(1):
SO2中氧元素的质量分数 50% SO3中氧元素的质量分数 60%
SO2 1g 50% 0.5g 5 SO3 1g 60% 0.6g 6 所含氧元素的质量比为5 : 6 选B。
方法(2)关系量法:
SO2 2O SO3 3O
64
32 80
48
1
x1
2. 运用质量守恒定律解释实验现象的一般步骤为: (1)说明化学反应的反应物、生成物 (2)根据质量守恒定律,应该是参加化学反应的各物质质量总 和等于各生成物质量总和; (3)与题目中实验现象相联系,说明原因。
3.应用质量守恒定律时应注意:
(1)质量守恒定律只能解释化学变化而不能解释物理变化
(2)质量守恒只强调“质量守恒”不包括分子个数、体积等方面的守恒
例3: 跟50千克硝酸铵NH 4 NO3里所含 氮元素质量相等的碳酸氢铵
NH4
HCO
的质量是多少?
3
解:设碳酸氢铵的质量为x
所含氮元素质量相等
2N
N
50kg
100% x
100%
NH4 NO3
NH4 HCO 3
x 98.8kg
质量相同的 SO 2和 SO 3中, 所含氧元素的质量比是 : (A)2 : 3 (B)5 : 6 (C)6 : 5 (D)1 : 1
合价×n=0
➢ 要点、考点聚焦
元
相对分子质量 或纯净物的质量
×
素 质 量
元素的质量
原子个数
÷相对原子
质量
化 学 式
分 元素质量比
原子个数比
数
➢ 典型例题解析
例1.铝土矿的主要成分是Al2O3,请按要求进行计算: (1)Al2O3中铝元素与氧元素的原子个数比_。 (2)Al2O3中铝元素与氧元素的质量比为_。 (3)求 Al2O3中铝元素的质量分数,并写出计算过程。 (结果保留至0.1%)
y
x:y 5:6
FeO FeO3/2 FeO4/3
例5.在FeO、Fe2O3、Fe3O4三种化合 物中,与等质量铁元素相结合的氧元素 的质量比为( A )
A 6∶9∶8 B12∶8∶9 C2∶3∶6 D 1∶3∶4
例6.图中的横坐标表示金属氧化物的质量, 纵坐标表示金属氧化物中金属元素的质量。 某同学绘制三条表示某些金属氧化物与其 所含金属元素质量的关系曲线。
(4) 等:将箭头换成等号
(5) 查:检查
2.根据化学方程式进行计算的步骤 (1) 设:根据题意设未知量 (2) 方:正确书写有关化学反应方程式 (3) 关:找出已知物、待求物的质量关系 (4) 比:列出比例式,求解 (5) 答:简要的写出答案
初中化学计算题法
化 根据化学式的计算
学 根据化学方程式的计算 计 算 有关溶液的计算
第1课:根据化学式的计算
相对分子质量
有关化学 式的计算
化学式
元素质量比
元素质量分数
相对原子质量 =某元素一个原子的质量/一个碳12原子质量的1/12 设某化合物化学式为AmBn ①它的相对分子质量 =A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比 =A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数ω =A的相对原子质量×m /AmBn的相对分子质量╳ 100% 混合物中A元素质量分数的计算 A元素质量分数= A元素的质量/混合物质量╳ 100% A元素质量分数= 化合物的质量分数(纯度) ╳ 该元素在化合物中的质量分数 根据化学式中化合价代数和为零求化合价 :A元素的化合价×m+B元素的化
②有一不纯的尿素样品,测知含氮元素44.8%,若已 知杂质不含氮元素,此化肥的有效成分尿素的质量分
数为_____9__6_%________。
解:设样品的质量为100g,
则氮元素的质量=100g×44.8% = 44.8g
尿素的质量= 44.8g/〔 (14×2/60)×100%〕=96g
所以此化肥中尿素的质量分数=(96g/100g )×100%
= 96%
第2课:根据化学方程式的计算
有关化学方 程式的计算
简单计算 含杂质的计算
多步反应的计算
➢ 要点、考点聚焦
1.理解并能熟练运用质量守恒定律。 2.掌握有关化学方程式计算的步骤和规 范的格式。
一、质量守恒定律 1. 理解质量守恒定律抓住“六个不变”、“两个一定 改变”及“两个可能改变”.
例2.青少年应“珍爱生命,远离毒品”。海洛 因是一种常见毒品,其元素质量分数分别为: C:68.29%,H:6.23%,O:21.68%,其余为 氮。若已知其相对分子质量不超过400,则一 个海洛因分子中氮原子个数为( ) A、3 B、1 C、2 D、4
解:依题意N元素的质量分数=1- (68.29%+ 6.23%+ 21.68%)=3.8% 故氮原子个数=(400× 3.8%) ÷14=1.09, B正确。
1、化学方程式的书写步骤
(1) 写:正确写出反应物、生成物的化学式
(2) 配:配平化学方程式
(3) 注:注明反应条件,如果反应物中无气体(或固体)参加,反应 后生成物中有气体(或 固体),在气体(或固体)物质的化学式右边要 标出“↑”(或“↓”). 若有气体(或固体) 参加反应,则此时生成的 气体(或固体)均不标箭头,即有气生气不标“↑”,有固生固不标“↓”
(1)维生索D种类较多,其中维生素D2的化学式为C28H44O, 试计算维生素D2的ห้องสมุดไป่ตู้对分子质量为 396 ;维生素D2中碳、 氢、氧三种元素的质量比为84:1。1:14 (2)计算高钙片中碳酸钙的质量分数 。
例8.根据尿素的化学式[CO(NH2)2]计算:
①尿素的相对分子质量为____6_0________;
三条曲线中,表示CuO和其中所
· ·
含Cu元素质量关系的曲线是
________B__________;
·
例7.下图为哈药集团制药六厂生产的“新盖中盖牌”高 钙片标签上的部分文字,请仔细阅读后回答下列问题。
[主要原料]碳酸钙、维生素D [功效成份]补钙每片中含:
钙(以Ca计)500 mg维生素D 100 IU [食用方法] 每日1次,每次1片 [规 格] 2.5g/片
解:方法(1):
SO2中氧元素的质量分数 50% SO3中氧元素的质量分数 60%
SO2 1g 50% 0.5g 5 SO3 1g 60% 0.6g 6 所含氧元素的质量比为5 : 6 选B。
方法(2)关系量法:
SO2 2O SO3 3O
64
32 80
48
1
x1
2. 运用质量守恒定律解释实验现象的一般步骤为: (1)说明化学反应的反应物、生成物 (2)根据质量守恒定律,应该是参加化学反应的各物质质量总 和等于各生成物质量总和; (3)与题目中实验现象相联系,说明原因。
3.应用质量守恒定律时应注意:
(1)质量守恒定律只能解释化学变化而不能解释物理变化
(2)质量守恒只强调“质量守恒”不包括分子个数、体积等方面的守恒
例3: 跟50千克硝酸铵NH 4 NO3里所含 氮元素质量相等的碳酸氢铵
NH4
HCO
的质量是多少?
3
解:设碳酸氢铵的质量为x
所含氮元素质量相等
2N
N
50kg
100% x
100%
NH4 NO3
NH4 HCO 3
x 98.8kg
质量相同的 SO 2和 SO 3中, 所含氧元素的质量比是 : (A)2 : 3 (B)5 : 6 (C)6 : 5 (D)1 : 1
合价×n=0
➢ 要点、考点聚焦
元
相对分子质量 或纯净物的质量
×
素 质 量
元素的质量
原子个数
÷相对原子
质量
化 学 式
分 元素质量比
原子个数比
数
➢ 典型例题解析
例1.铝土矿的主要成分是Al2O3,请按要求进行计算: (1)Al2O3中铝元素与氧元素的原子个数比_。 (2)Al2O3中铝元素与氧元素的质量比为_。 (3)求 Al2O3中铝元素的质量分数,并写出计算过程。 (结果保留至0.1%)
y
x:y 5:6
FeO FeO3/2 FeO4/3
例5.在FeO、Fe2O3、Fe3O4三种化合 物中,与等质量铁元素相结合的氧元素 的质量比为( A )
A 6∶9∶8 B12∶8∶9 C2∶3∶6 D 1∶3∶4
例6.图中的横坐标表示金属氧化物的质量, 纵坐标表示金属氧化物中金属元素的质量。 某同学绘制三条表示某些金属氧化物与其 所含金属元素质量的关系曲线。
(4) 等:将箭头换成等号
(5) 查:检查
2.根据化学方程式进行计算的步骤 (1) 设:根据题意设未知量 (2) 方:正确书写有关化学反应方程式 (3) 关:找出已知物、待求物的质量关系 (4) 比:列出比例式,求解 (5) 答:简要的写出答案
初中化学计算题法
化 根据化学式的计算
学 根据化学方程式的计算 计 算 有关溶液的计算
第1课:根据化学式的计算
相对分子质量
有关化学 式的计算
化学式
元素质量比
元素质量分数
相对原子质量 =某元素一个原子的质量/一个碳12原子质量的1/12 设某化合物化学式为AmBn ①它的相对分子质量 =A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比 =A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数ω =A的相对原子质量×m /AmBn的相对分子质量╳ 100% 混合物中A元素质量分数的计算 A元素质量分数= A元素的质量/混合物质量╳ 100% A元素质量分数= 化合物的质量分数(纯度) ╳ 该元素在化合物中的质量分数 根据化学式中化合价代数和为零求化合价 :A元素的化合价×m+B元素的化
②有一不纯的尿素样品,测知含氮元素44.8%,若已 知杂质不含氮元素,此化肥的有效成分尿素的质量分
数为_____9__6_%________。
解:设样品的质量为100g,
则氮元素的质量=100g×44.8% = 44.8g
尿素的质量= 44.8g/〔 (14×2/60)×100%〕=96g
所以此化肥中尿素的质量分数=(96g/100g )×100%
= 96%
第2课:根据化学方程式的计算
有关化学方 程式的计算
简单计算 含杂质的计算
多步反应的计算
➢ 要点、考点聚焦
1.理解并能熟练运用质量守恒定律。 2.掌握有关化学方程式计算的步骤和规 范的格式。
一、质量守恒定律 1. 理解质量守恒定律抓住“六个不变”、“两个一定 改变”及“两个可能改变”.
例2.青少年应“珍爱生命,远离毒品”。海洛 因是一种常见毒品,其元素质量分数分别为: C:68.29%,H:6.23%,O:21.68%,其余为 氮。若已知其相对分子质量不超过400,则一 个海洛因分子中氮原子个数为( ) A、3 B、1 C、2 D、4
解:依题意N元素的质量分数=1- (68.29%+ 6.23%+ 21.68%)=3.8% 故氮原子个数=(400× 3.8%) ÷14=1.09, B正确。
