间充质干细胞免疫调节的可塑性
人羊膜间充质干细胞的生物学特征

人羊膜间充质干细胞的生物学特征1. 引言1.1 研究背景人羊膜间充质干细胞是一类重要的干细胞类型,具有广泛的临床应用前景。
研究人羊膜间充质干细胞的生物学特征是当前生物医学领域的热点之一。
通过对人羊膜间充质干细胞的深入研究,可以更好地了解其特性和潜在应用价值,为干细胞治疗和再生医学提供更多可能性。
人羊膜间充质干细胞来源广泛,易于获取,且具有较高的增殖活性和分化潜能。
这些特点使其成为一种理想的干细胞来源,可以用于治疗多种疾病和再生医学研究。
人羊膜间充质干细胞的免疫学特征较好,能够降低排斥反应的风险,为临床应用提供了有力支持。
1.2 研究意义人羊膜间充质干细胞的研究意义在于探索这一新型干细胞在临床应用中的潜力和机制。
人羊膜间充质干细胞具有广泛的多向分化潜能和免疫调节能力,因此可用于组织修复和再生医学领域。
研究人羊膜间充质干细胞的生物学特征,有助于深入了解其在不同疾病治疗中的作用机制,为开发新型干细胞治疗方案提供重要参考。
人羊膜间充质干细胞来源容易、获取成本低廉,具有较高的临床应用前景和潜力,可为医学研究和临床治疗提供新的思路和方法。
系统地研究人羊膜间充质干细胞的生物学特征,不仅有助于完善干细胞治疗技术,还能推动干细胞在临床应用中的更广泛应用,为促进医学进步和改善患者生活质量做出贡献。
2. 正文2.1 人羊膜间充质干细胞的来源人羊膜间充质干细胞的来源可以追溯到人羊膜组织。
人羊膜是胎儿在子宫内营养的一个重要器官,由外向内分别为羊膜皮层、羊膜绒毛层和羊膜上皮层。
羊膜上皮层中含有大量的间充质细胞,这些细胞具有一定的干细胞特性,具有自我更新、多潜能分化和抗衰老等特点。
人羊膜间充质干细胞的来源主要是通过孕妇在妊娠期间的羊水检查中获得。
一般来说,孕妇接受羊水穿刺检查时,抽取的羊水中会含有大量的羊膜间充质干细胞。
这些干细胞可以通过离心、培养和纯化等处理步骤,得到高纯度的人羊膜间充质干细胞,供科研和临床应用使用。
除了羊水检查外,人羊膜间充质干细胞还可以通过胎盘组织或胎盘血液等方式获得。
间充质干细胞的免疫调节特性及其在实体器官移植中的应用

龈等 成体 组 织 中均 存 在 MS C 。它 易 于 黏 附在 塑 料
培养 板上生 长 ,具有类 似 于成纤 维细胞 的形 态 ,能
自我 更新 ,体外 可分化 为 骨细胞 、脂 肪细胞 、软 骨 细 胞 等 多 种 细 胞 , 表 达 分 化 群 (c l u s t e r
d i f f e r e n t i a t i o n ,C D) 1 3、 C D 4 4 、C D 7 3 、C D 5 4 、
治 疗手 段 。为 了保 证器 官移植 的 剂 。但这 些药物 的免 疫抑
制 作用 是非 特异性 的 ,影 响受 体全 身免疫 细胞 的功
能 ,产 生许 多不 良反应 ,包括 增加 患者感 染及 患恶 性 肿瘤 的风 险 ,引起心 血管疾 病 ,导致 代谢紊 乱 和
< < S t e m C e l l s > > 、《 B i o m a t e r i a l s > > 、( ( T r a n s p l a n t a t i o n } 等国际知名的学术刊物发表科学引文索
引 ( s c i e n c e c i t a t i o n i n d e x ,S C I )论文 3 0余 篇 。 获得 国家 重 大科 学研 究计 划 , 国 家 自然
第 4卷
第 6期
器 官移 植
Or g a n Tr a ns p l a n t a t i o n
2 0 1 3年 l 1 月
Vo 1 . 4 No . 6 NO V . 20l 3
・
述 评 ・
间 充 质 干 细 胞 的 免 疫 调 节 特 性 及 其在 实体 器 官 移 植 中 的 应 用
C D 9 0 、C D 1 0 5和 C D 1 6 6 ,但 不 表 达 造 血 干 细 胞 标
间充质干细胞的免疫调节作用及临床应用

Human gene therapy, 2015, 26(8): 506-517.
MSCs have been shown to exert profound anti-inflammatory and immunomodulatory effects on almost all the cells of the innate and adaptive immune systems via a variety of mechanisms, notably cytokine and chemokine secretion. 间充质干细胞具有很强的抗炎作用和显著的免疫调 节效果,其通过一系列复杂的调控机制几乎对固有免疫 和获得性免疫所有的免疫细胞都具有调节作用,最显著 的调节机制是细胞因子和趋化因子的分泌。 Cytokines most commonly do not directly affect the target cells but interact with other biologically active factors to achieve the effect of immunosuppression. 细胞因子通常不直接作用于靶细胞,而是通过与其 它的生物活性物质相互作用来达到免疫抑制的效果。
MSCs exert immunomodulatory effects by both cell-to-cell contacts and by secreting biologically active substances, growth factors, cytokines and chemokines. 间充质干细胞通过细胞与细胞间的直接接触,以及 分泌生物活性物质,如生长因子,细胞因子和趋化因子 等行使其免疫调节的作用。 It should be pointed out that the immunomodulatory effects of MSCs are jointly executed by both secretory factors and direct cell-to-cell contacts. 间充质干细胞的免疫调节作用是通过分泌生物活性 物质和细胞与细胞之间的直接接触两者联合来起作用的。
间充质干细胞作为免疫调节剂用于临床肝移植治疗研究进展

间 。例 如通 过 标 准 方 法 从 小 鼠骨 髓 中获 得 的 M C往 往 造 血 干 S
IO等 。 至 于 哪 种 细 胞 因 子 最 重 要 还 尚 无 定 论 。A gra D gawl
王 嗣 予 ,王 福 生 ( 解放军第 32医院传染病研究所生物工程 室 , 0 北京 10 3 ) 0 0 9
间 充质 干细 胞 ( eecy ls m cl MS ) m snhma t e , C 因其 多潜 能 e l 性 和 可 扩增 性 对 再 生 医学 产 生 了不 可估 量 的 影 响 。除 可 塑 性 疫 原 性 低 ,虽然 表 面有 M 类 分 子 表 达 , 因缺 失 C 4 、 HCI 但 D 0
依 据。 [ 键 词 ] 间 充质 干细 胞 ;移植 排 斥 .1 3 2 1 [ 献标 识码 ] A 文
MS C代表 了更稳定 的免 疫细胞 治疗 群体 。而 对于 MS C的临
床 应 用 前 景 而 言 , 规 模 、多病 种 的 临床 试 验 正 在 逐 步 展 开 , 大
问 质 细 胞 、 内 皮 细 胞 和 表 皮 细 胞 的 表 面 标 志 ,主 要 包 括
C 4 、C 2 、 D 15 D 3和 C 16等 , 表 达 胎 儿 组 织 D 4 D 9 C D 0 、C 7 D6 还 来 源的 Ot c. 4和 Sr 12。 除 骨 髓 外 , 肪 、脐 带 、脐 血 、外 t 一[ o 3 脂
性 细 胞 因 子 涉 及 到 T F0 F 一 N 一 、IN 、T F1 、H F L1 【 G .1 G 、I.0和 3
群纤维状生长 、 有黏 附性 功能 的细胞 。随后 , 们对这 群 具 人 细胞进行 了广泛而深入 的研究 。目前还 没有确定 MS C的特异 性 表型 , 但它们不表 达造血细胞标 志物 C 3 D 4和 C 4 , 达 D5 表
间充质干细胞的研究进展及其应用

表 现 出 旺 盛 的 有 丝 分 裂 活 动 ,具 有 活 跃 的 增 殖 能 力 J 。
MS s C 还具有很强 的 多 向分化 潜能 ,即使经 过 大量传 代后 ,
有 些 细 胞 仍 能 保 持 其 多 潜 能 性 。 大 量 体 外 实 验 表 明 ,不 同
改进 ,从而得 到更纯 的 M C。因多 数 MS s Ss C 缺少 特殊 的细 胞表面标记 ,所 以都 是 通过 阴性选择 进行分 离 ,筛选 出不 表达 内皮 和造血 细胞标 记 的 M C 。 目前 已从骨 髓 、骨 膜 、 Ss 骨小粱 、脂肪组 织 、滑膜 、骨 胳肌 、脐血 、外 周血 和 乳牙
近 年 来 ,对 .ss M C 的分 离 方 法 进 行 了 大 量 的 研 究 并 加 以
外培养时存在两种不 同的亚群 ,其 中一种是成纤 维样细胞 , 称为成熟 M C ,这种细胞 的分化潜 能大。在生 理稳态情 况 Ss 下 ,成人体 内大多数 M C 增 殖并 不明显。但 在体外 补充适 Ss 量血清的培养液 中,它们能贴 附在 塑料培养 器皿 壁上生长 ,
文 章 编号 : 10—9 1 (08 3O6 . 0 703 20 )0.OO0 3
中图 分 类 号 :1 3 1 3
文献 标 识 码 :A
细胞外基质和间充质干细胞在组织修复和再生中的作用

细胞外基质和间充质干细胞在组织修复和再生中的作用在人类的生命过程中,我们经历了各种各样的外部伤害和内部疾病。
这些外来因素会破坏我们身体的组织结构和细胞功能,导致身体受损。
然而,人体的自我修复能力是相当强大的。
在这样的环境下,细胞外基质和间充质干细胞展现出了其在组织修复和再生中的重要作用。
细胞外基质是组成身体各种组织的结构和支撑物。
它由胶原蛋白和其他细胞外分子组成,构成了复杂的细胞外基质网络。
它的结构可以为身体提供稳定性和可塑性并防止伤害。
细胞外基质不仅提供保护和支撑,而且还参与和控制细胞的生长差异及复制。
通过这种方式,它可以影响到细胞的功能,促进组织修复和再生。
间充质干细胞一般是从成年人骨髓、脂肪组织或其他来源中获得的一类干细胞。
它们具有多种分化能力,可以分化成肌细胞、神经细胞、心脏细胞等多种细胞类型,帮助组织修复和再生。
一些研究发现,间充质干细胞可以释放出一些信号分子和细胞因子,调节细胞的自我修复并增加受损组织中的血管生成,以促进再生和修复。
细胞外基质和间充质干细胞在组织修复和再生中的相互作用被广泛地研究。
研究人员发现,细胞外基质可以加强间充质干细胞的效应,以促进组织修复和再生。
同时,间充质干细胞可以通过分泌胶原蛋白、纤维连接蛋白等主要细胞外分子,影响细胞外基质的组成和分布。
通过这种方式,间充质干细胞可以调节身体中的细胞外基质,有助于组织修复和再生。
例如,在肝脏再生中,细胞外基质和间充质干细胞的作用显得尤为重要。
肝脏是一个重要的代谢器官,可以清除体内有害物质和维持体内的平衡。
但当肝脏受到疾病或损伤时,它仍然可以通过其自我修复机制来恢复功能。
研究发现,间充质干细胞可以通过分泌成纤维细胞生长因子、肝生长因子等细胞因子来促进肝脏再生并减轻对肝脏的损伤。
同时,细胞外基质也有助于肝脏细胞的恢复和再生。
在这个过程中,细胞外基质和间充质干细胞之间的相互作用是非常重要的。
在神经修复方面,细胞外基质和间充质干细胞也扮演着重要角色。
间充质干细胞在器官移植中的作用研究进展

【 bt c】 M snhm lt es M C)a i f bolti ou tn w i r p r o n, A s at r e cy a sm cl( S s r ak dof r a —k ppli , h ha l i t t e e l e n b sle i ao c e up e
且 经诱导 有 向内胚层 和 神经 外 胚层 谱 系 分 化 的能 力 ,
这些细胞 包 括 骨 细胞 、 骨 细胞 、 肪 细 胞 和 肌原 细 软 脂
胞, 还有 肌细胞 、 上皮 细胞 、 星形 ( 质 ) 胞 、 胶 细 神经 元 、 肝细胞 和 内皮 细胞 等 ] 2 。MS s虽 然 最 初 是 从 骨 髓 C 中分离 出来 的 , 相 似 的细胞 群 也 可 以从 其 他 组 织 中 但
的可塑性 , 能分化成多种细胞并 具有很高 的 自我 更新 能力 。它不 仅有免疫赦 免特性 , 具有免疫 还 调节作用 , 可抑制同种 异体免疫反应 。在 自身免疫性疾病 的治疗 、 器官移植方 面起 着重要作用 , 具 有十分诱人的前景 , 也是 当前研究 的热点和焦点 。
【 关键词 】 M C ; Ss 器官移植 ; 免疫抑制
织 比如 胎 儿 的 肺 和 血 液 。此 外 , 带 血 也 已 经 成 为 脐
MS s C 的一个来 源 。
17 9 6年 , r d nt n等根 据骨髓 来 源 的成 纤维 样 Fi es i e e 细胞和造 血干细胞 系对 细胞 培养皿底 部 的贴 附性 的差 异, 首次从 兔 骨 髓 中成 功 分 离 了 MS s】。随 后 的研 C 究 发现 , C 不 仅可 以分化 为 中胚 层 的各 种 细胞 , MS s 而
sl-e e n el wi h oe t l o dfee t t n o v r u el y e .MS mmu ep vlg a e b e xe ・ ef n wi gc l t t ep tn i i r n i e it a o s c l tp s r s h at a i Csi n r i e h v e n e tn i e s ey su id a d c a a t r e o e ri i l t d e n h rc e z d f rt i mmu oe u ao y p o et sa d ih b t n ali v i h n rg l tr r p ri n n i i o l mmu iain T e e c l t e i o nz t . h s el a e o s u eu o uo mmu e ds a ea d og n t n p a tt n At r s n a e o o p t n c l o n f n e t s f l ra ti f n i s n r a r s l na i . e e ti h s c me a h t o d f a i t v si e a o p t b s a o p oi —
间充质干细胞的免疫调节机制及其在器官移植中的临床应用

、
引 言
间充 质 干 细 胞 ( snhm l t e ,M C 是 一 种 meecy a s m cl e l S)
具有多分化 潜能 的成 体干 细胞 ,具有很 高 的可塑性 。目前
认为 MS C几乎 存 在 于人 体 所 有组 织 ,如骨 髓 、肌 肉、脂
第2 1 年 第 2期 2卷 3月 01
器官移植
Or a rn p a tt n g n T a s l na i o
Vo. N . I2 o2 Ma 01l L2
间充质 干细 胞 的免 疫 调 节 机 制及 其在 器 官移 植 中的 临床 应 用
赵江宁 综述
一
陈运 贤
除 了直 接 影 响 淋 巴 细 胞 ,MS 还 通 过 抗 原 提 呈 细 胞 C
( ni npeet gcl ,A C) 实现 对 免疫 细 胞 的间接 调 at e.rsni es P g n l 控 ,其 中树 突状 细胞 ( C)是参 与 MS D C免疫 调节反 应 中
最 重 要 的 A C M C可 干 扰 D 的 分 化 、 成 熟 、功 能 的 各 P。 S C
2 3二氧化酶 (noemi ,-i yeae D ,后者可 ,一 idla n 2 3do gns ,I O) e x 通 过色 氨酸途径抑制效应细胞的增殖反应 ,这可能是 IN F. 的抑制增殖作 用 的机 制。但亦 有试验显 示 ,MS C可促 进 B
研究发现 ,M C在体 内外均 显示 出以免疫抑 制为 主的 S 免疫调节作用。一般认 为 ,MS C作用于绝大多数靶细胞 时 , 需要进行黏附因子介导的细胞与细胞 间接触才能发挥作 用 , 如 M C抑制 T淋巴细胞增殖 的过程 中 ,其表面 的抑 制性分 S
间充质干细胞的免疫调控在治疗肝衰竭中的作用及机制探讨的开题报告

间充质干细胞的免疫调控在治疗肝衰竭中的作用及
机制探讨的开题报告
一、研究背景与意义
肝衰竭是一种严重危害人体健康的疾病,病因广泛,并发症多,具
有较高的病死率。
肝移植是目前治疗肝衰竭的主要方法之一,但手术复杂、费用昂贵,而且由于供体不足,很多病人无法得到及时治疗。
因此,寻找一种新型、安全有效的治疗方法是当务之急。
间充质干细胞(MSCs)具有自我更新、多向分化、抗炎免疫调节等多种生物学特性。
近年来,越来越多的研究表明,MSCs在肝脏再生和肝功能的修复中具有重要作用。
同时,MSCs在肝衰竭治疗中的免疫调节作用也逐渐受到重视。
二、研究目的
本研究旨在探讨MSCs在治疗肝衰竭中的免疫调节作用及其机制,
寻找新型、安全有效的肝衰竭治疗方法。
三、研究内容与方案
1.文献综述:对MSCs在治疗肝衰竭中的应用研究现状、相关机制进行梳理和总结,深入探讨MSCs在肝衰竭治疗中的作用机制。
2.实验设计:建立肝衰竭模型,随机分组注射MSCs或生理盐水,观察MSCs治疗对肝衰竭的影响;通过免疫学指标及相关分子机制的检测,探讨MSCs在肝衰竭治疗中的免疫调节作用及其机制。
3.数据分析:通过采用统计学方法对实验数据进行比较和分析,得
出MSCs在肝衰竭治疗中的优劣及其作用机制。
四、预期成果
1.明确MSCs在肝衰竭治疗中的免疫调控作用及机制。
2.提供一种新的、安全有效的肝衰竭治疗方法。
3.培养本文作者的实验设计和数据分析能力,提升科研能力。
骨髓间充质干细胞形态

骨髓间充质干细胞形态骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一类具有多向分化潜能的成体干细胞,广泛存在于人体的骨髓、脂肪组织、胎盘等多种组织中。
骨髓间充质干细胞形态多样,具有一定的可塑性,在治疗各种疾病和损伤中具有广泛的应用前景。
骨髓间充质干细胞主要通过形态学特征进行鉴定和分类。
在显微镜下观察,骨髓间充质干细胞呈现为纤维状或星状,细胞体积较大,胞质丰富,呈圆形或椭圆形,细胞核呈卵圆形或半圆形,染色质呈颗粒状分布。
此外,骨髓间充质干细胞胞浆内还可见到较为明显的内质网和线粒体,这些特征可以帮助鉴定和鉴别骨髓间充质干细胞。
骨髓间充质干细胞具有较高的增殖能力和自我更新能力。
它们可以通过对增殖和分化相关因子的调控,不断地进行自我更新和增殖,从而保持其细胞群体的稳定性。
同时,骨髓间充质干细胞还可以向多种细胞系分化,包括成骨细胞、软骨细胞、脂肪细胞等。
这种多向分化潜能为骨髓间充质干细胞在组织修复和再生中的应用提供了基础。
除了形态学特征外,骨髓间充质干细胞还具有一系列的免疫表型特征。
在表面标记物方面,骨髓间充质干细胞通常表达CD73、CD90、CD105等阳性标志物,同时不表达CD34、CD45等造血干细胞和免疫细胞表面标记物。
这些免疫表型特征有助于进一步确认骨髓间充质干细胞的身份。
骨髓间充质干细胞不仅具有多向分化潜能,还具有广泛的免疫调节和抗炎作用。
这些特性使得骨髓间充质干细胞在临床上有着广泛的应用前景。
目前,骨髓间充质干细胞已被广泛应用于骨科、创伤、心血管疾病、免疫性疾病等多个领域。
在骨科领域,骨髓间充质干细胞可以通过向成骨细胞的分化,促进骨组织的修复和再生。
在创伤领域,骨髓间充质干细胞可以促进创伤部位的愈合,减少炎症反应和瘢痕形成。
在心血管疾病领域,骨髓间充质干细胞可以分化为心肌细胞,促进心肌组织的再生。
在免疫性疾病领域,骨髓间充质干细胞可以通过调节免疫反应,减轻炎症反应和免疫损伤。
间充质干细胞产品及其外泌体在炎症性肠病治疗中的研究进展

间充质干细胞产品及其外泌体在炎症性肠病治疗中的研究进展杨婧雯1,陈 芊1,单云龙1,刘嘉莉1,尉 宁1,2,王 婧2,王广基1*,周 芳1**(1中国药科大学药物代谢动力学重点实验室, 南京 210009;2江苏睿源生物技术有限公司, 南京211103)摘 要 炎症性肠病(inflammatory bowel disease, IBD )发病机制不明,特征为进行性和终身复发性消化道炎症反应。
尽管现阶段新的治疗药物和策略不断涌现,但治疗作用局限于单一的抗炎功能,在复杂黏膜免疫环境下易出现耐药导致治疗失败。
间充质干细胞(mesenchymal stem cells, MSCs )能定向归巢到结肠炎症部位,具有强大的免疫调节能力,可重塑肠道免疫环境和修复上皮屏障,为药物难治性患者的治疗提供了极具潜力的替代方案。
本文对MSCs 产品及其衍生的外泌体在临床上的应用、作用机制和工程化进行综述,以期为MSCs 及其外泌体产品用于IBD 的治疗提供参考。
关键词 炎症性肠病;间充质干细胞;外泌体;工程化中图分类号 R574 文献标志码 A文章编号 1000−5048(2024)01−0103−12doi :10.11665/j.issn.1000−5048.2023113001引用本文 杨婧雯,陈芊,单云龙,等. 间充质干细胞产品及其外泌体在炎症性肠病治疗中的研究进展[J]. 中国药科大学学报,2024,55(1):103 − 114.Cite this article as: YANG Jingwen, CHEN Qian, SHAN Yunlong, et al . Research progress on mesenchymal stem cell products and their exosomes in the treatment of inflammatory bowel disease[J]. J China Pharm Univ , 2024, 55(1): 103 − 114.Research progress on mesenchymal stem cell products and their exosomes in the treatment of inflammatory bowel diseaseYANG Jingwen 1, CHEN Qian 1, SHAN Yunlong 1, LIU Jiali 1, WEI Ning 1,2, WANG Jing 2, WANG Guangji 1*,ZHOU Fang 1**1Key Laboratory of Drug Metabolism and Pharmacokinetics, China Pharmaceutical University, Nanjing 210009;2Renocell Biotechnology Co., Ltd., Nanjing 211103, ChinaAbstract Inflammatory bowel disease (IBD), whose pathogenesis remains elusive, is a group of autoimmune diseases characterized by chronic, progressive, and lifelong inflammation of the digestive tract. The pathogenesis of IBD remains elusive. Although a number of drugs have been developed to treat IBD, their effects are merely anti-inflammatory. In addition, current treatments for IBD are easily susceptible to resistance in clinical practice.Mesenchymal stem cells (MSCs) have been reported to have the ability to migrate to the site of inflammation,with potent immunoregulatory effects, and to rebalance the immune microenvironment and restore the integrity of the epithelial barrier with significant value of application, particularly for patients who are refractory to classic medicines. In this paper, we reviewed the clinical applications, mechanisms and engineerable properties of MSC products and their exosomes to provide some reference for the use of MSCs and their exosomes in the treatment of IBD.Key words inflammatory bowel disease; mesenchymal stem cells; exosomes; engineering收稿日期 2023-11-30 通信作者 *Tel :************ E-mail :*************************Tel :************ E-mail :**************基金项目 国家自然科学基金项目(No. 82073928);南京市生命健康科技专项(No.202110006);细胞生态海河实验室创新基金项目(22HHXBSS00005);江苏省南京市联合资助项目(SBK2023070039)学报 2024, 55(1): 103 − 114103This study was supported by the National Natural Science Foundation of China (No. 82073928); the Nanjing Life and Health Science and Technology Program (No.202110006); the Haihe Laboratory of Cell Ecosystem Innovation Fund (22HHXBSS00005); and the Co-funded Programs in Nanjing, Jiangsu Province (SBK2023070039)炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD),是由环境、免疫系统、肠道微生物组和个体遗传等因素的复杂互作引起的一类自身免疫性疾病,其一线治疗药物包括糖皮质激素、免疫抑制剂、抗生素和抗肿瘤坏死因子-α(tumor necrosis factor, TNF-α)疗法。
《脂肪间充质干细胞促进M1型巨噬细胞向M2型巨噬细胞转化》范文

《脂肪间充质干细胞促进M1型巨噬细胞向M2型巨噬细胞转化》篇一一、引言近年来,脂肪间充质干细胞(ADSCs)在再生医学和免疫调节领域的研究日益受到关注。
它们具有自我更新和多向分化的潜能,并能在特定条件下对免疫应答产生调控作用。
在众多免疫细胞类型中,巨噬细胞因其具有高度可塑性和在炎症反应中的关键作用而备受瞩目。
巨噬细胞可分为M1型和M2型,它们在炎症反应和免疫调节中扮演着不同的角色。
本文旨在探讨脂肪间充质干细胞如何促进M1型巨噬细胞向M2型巨噬细胞的转化。
二、研究背景与意义巨噬细胞根据其功能和活化状态可分为M1型和M2型。
M1型巨噬细胞主要参与炎症反应和Th1型免疫应答,而M2型巨噬细胞则更多地参与组织修复和Th2型免疫应答。
在许多疾病如炎症性疾病、自身免疫病和组织损伤中,调控巨噬细胞的极化状态具有重要意义。
脂肪间充质干细胞因其低免疫原性、易于获取和分化潜能等特点,在调节巨噬细胞极化方面具有巨大潜力。
因此,研究ADSCs如何促进M1型巨噬细胞向M2型巨噬细胞的转化,对于理解免疫调节机制和开发新的治疗方法具有重要意义。
三、方法与材料本研究采用体外实验方法,利用ADSCs与M1型巨噬细胞共培养体系,观察ADSCs对M1型巨噬细胞向M2型巨噬细胞转化的影响。
实验材料包括ADSCs、M1型巨噬细胞、相关培养基和抗体等。
四、实验过程与结果1. 实验过程(1)培养ADSCs和M1型巨噬细胞;(2)将ADSCs与M1型巨噬细胞共培养,设立对照组和实验组;(3)通过荧光定量PCR、Western blot和流式细胞术等方法检测M2型巨噬细胞的标志物表达;(4)分析数据,比较两组间差异。
2. 实验结果(1)ADSCs与M1型巨噬细胞共培养后,实验组中M2型巨噬细胞的标志物表达明显高于对照组;(2)荧光定量PCR、Western blot和流式细胞术等检测结果显示,ADSCs能够促进M1型巨噬细胞向M2型巨噬细胞的转化;(3)进一步机制研究显示,ADSCs通过分泌特定因子,如TGF-β和IL-4等,促进M1型巨噬细胞向M2型巨噬细胞的转化。
高中语文第6单元9呼兰河传小团圆媳妇之死作业含解析中国小说欣赏

《呼兰河传》小团圆媳妇之死阅读下面的文字,完成1~3题。
“美猴王”孙悟空可谓________,很大程度上是因为其拥有“七十二变”的能力:入了水可以变成鱼,进入森林可以化为大树,它可以变成房子,从身上拔根毛就能变化出无数只小猴子,可谓__________。
这种根据环境________变换自己的能力,多么令人羡慕!其实,在人体中有一种细胞叫做间充质干细胞,其变换自己的本领也毫不逊色于“美猴王”。
众所周知,感冒发烧那是因为身体发了炎,产生了炎症.不仅如此,其实在人类的大部分严重疾病的发病过程中,例如肝硬化、糖尿病,甚至包括癌症,炎症都在其中扮演了至关重要的角色。
炎症的强弱大小,或者炎症发生的地点促使间充质干细胞发挥不同的功能,变换自己的性质:它可以消炎,也可以促炎,它可以招募其他“伙伴"一起促进组织生长,也可以“学雷锋”做好事进行组织修复,这种变化多端的能力不就像是我们熟悉的“猴哥”吗?那么什么是间充质干细胞呢?间充质干细胞是干细胞家族的成员,具有自我复制能力和强大分化潜能。
间充质干细胞最重要的特性在于其具有很强的免疫调节作用.而人体内环境复杂多变,在不同炎症情况下,间充质干细胞的免疫调节作用是不同的。
科学家研究发现,间充质干细胞的免疫调节具有这样一种可塑性,():当炎症反应加强时,间充质干细胞就会________免疫反应;当炎症反应减弱时,间充质干细胞反而可能促进免疫反应.1.依次填入文中横线上的词语,全都恰当的一项是() A.家喻户晓神通广大随心所欲抑制B.赫赫有名手眼通天随心所欲遏制C.家喻户晓神通广大为所欲为抑制D.赫赫有名手眼通天为所欲为遏制【答案】A[家喻户晓:每家每户都知道。
赫赫有名:形容名声很大,很显赫。
手眼通天:形容手段高超,善于钻营,也比喻跟有权势的高层人物有交往。
神通广大:本指法术广大无边,现形容本领极大,办法极多。
随心所欲:一切都由着自己的心意,想怎么做就怎么做。
为所欲为:想干什么就干什么,任意行事(含贬义).遏制:制止,控制。
2023中考语文阅读理解专项训练题及答题

2023中考语文阅读理解专项训练题及答题中考语文阅读理解专题训练题及答案 1阅读下面古诗,回答问题游山西村陆游莫笑农家腊酒浑,丰年留客足鸡豚。
山重水复疑无路,柳暗花明又一村。
箫鼓追随春社近,衣冠简朴古风存。
从今若许闲乘月,拄杖无时夜叩门。
1.“山重水复疑无路,柳暗花明又一村”一联写景中蕴含哲理,耐人寻味,请简要分析。
2.诗的尾联表达了诗人怎样的感情?阅读下面文言文,回答问题。
谋战春秋时,晋平公①欲伐齐,使范昭往观齐国之政。
齐景公觞②之。
酒酣,范昭请君之樽③酌④。
公曰:“寡人之樽进客。
”范昭已饮,晏子⑤彻⑥樽,更为酌。
范昭佯醉,不悦而起舞,谓太师⑦曰:“能为我奏成周之乐⑧乎?吾为舞之。
”太师曰:“瞑臣⑨不习。
”范昭出。
景公曰:“晋,大国也。
来观吾政,今子怒大国之使者,将奈何?”晏子曰:“范昭非陋于礼者,且欲惭吾国,臣故不从也。
”太师曰:“夫成周之乐,天子之乐也,惟人主舞之。
今范昭人臣,而欲舞天子之乐,臣故不为也。
”范昭归报晋平公曰:“齐未可伐,臣欲辱其君,晏子知之;臣欲犯其礼,太师识之。
”仲尼闻之曰:“不越樽俎⑩之间,而折冲千里之外,晏子之谓也,可谓折冲矣!而太师其与焉。
”(选自《晏子春秋》)【注】①晋平公:春秋时期晋国国君。
②觞(shāng):古代盛酒器。
这里名词用作动词,以酒招待。
③樽:酒杯。
④酌:斟酒、饮酒。
⑤晏子:即晏婴,春秋时期齐国大夫。
⑥彻:同“撤”,撤去。
⑦太师:同“大师”,中国古代乐官之长。
⑧成周之乐:周天子所享用的乐曲。
⑨瞑臣:眼睛失明之臣。
齐国乐官太师以“瞑臣”自称,是自谦之意,未必是盲人。
⑩樽俎:即盛酒肉的器具,这里指筵席。
3.解释下列加点词。
(1)使范昭往观齐国之政( )(2)臣故不从也( )4.下列句子中加点词的意思和用法相同的一项是( )A.齐景公觞之能为我奏成周之乐乎B.谓太师曰晏子之谓也C.晋平公欲伐齐齐未可伐D.不悦而起舞而折冲千里之外5.用现代汉语翻译下列句子。
科学家提出干细胞“免疫调节可塑性”新理念
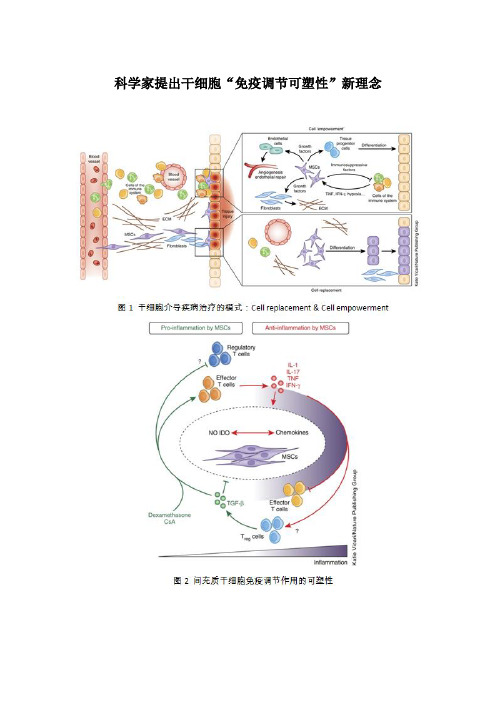
科学家提出干细胞“免疫调节可塑性”新理念10月21日,中国科学院生命科学研究团队充分阐释了间充质干细胞免疫调节的规律和临床应用价值。
干细胞是身体组织的源泉,它在机体发育和器官组织更新中发挥重要作用,同时,它的自我更新和分化潜能又赋予它在再生医学领域中的重要地位。
众多临床前和临床研究聚焦于干细胞通过分化为特定组织前体细胞发挥的“细胞替代”功能。
随着研究的不断深入,研究人员发现干细胞对于很多疾病的治疗如多发性硬化、心肌损伤等,可以不依赖于干细胞的直接作用,仅用干细胞产生的因子就有治疗作用。
有趣的是在干细胞有效治疗类风湿性关节炎病人的组织活检中也未发现干细胞的长期存在,为此时玉舫研究团队根据他们多年的研究提出了干细胞介导疾病治疗的另一种模式“细胞赋能”,即在干细胞介导疾病治疗时,定位于受损组织的干细胞,在炎症作用下,通过产生大量免疫抑制因子下调炎症反应,同时分泌大量生长因子促进组织内在的前体细胞进行分化修复,以及调控血管内皮细胞、基质细胞等参与损伤组织修复。
众所周知,组织损伤往往伴随不同程度的炎症或免疫紊乱,定位于损伤组织的干细胞必然与免疫之间存在密切的相互作用,一方面是干细胞对免疫系统的影响,另一方面是免疫因素对干细胞的调控。
在这种交互调控过程中,炎症对干细胞发挥免疫调节作用显得尤为重要。
以间充质干细胞为例,只有在炎症因子(如干扰素和肿瘤坏死因子)的作用下,干细胞才可以发挥免疫抑制作用。
然而,受损组织的炎症状态并不是一成不变的,其动态调控不仅体现在炎症因子水平的或高或低,而且还体现在病灶部位炎症因子种类的多样性,以及免疫调节剂对病灶部位的炎症调控。
以免疫状态的动态调控为视角,时玉舫领导的团队多年来通过一系列原创性研究发现炎症状态(炎症因子水平、类别及免疫抑制剂)对间充质干细胞的免疫调节作用的可塑性调控。
同时,结合最新的研究进展,总结了干细胞与免疫交互调控的规律,提出间充质干细胞介导免疫紊乱性疾病治疗时的科学学说,即炎症状态决定间充质干细胞的免疫调节作用,乃至它对于疾病治疗的积极作用。
组合精练56 语用+文化常识+名句名篇默写(《江城子·密州出猎》)(解析版)

组合精练56一、语言文字应用(20分)(一)语言文字运用Ⅰ(本题共3小题,11分)阅读下面的文字,完成1~3题。
21世纪后,机器与人类协同创作的情况日益普遍,各种写作软件(),用户只需输入关键字就可以获得系统自动生成的作品。
对于这些人工智能的作品,人们的评价并不高,更倾向于视为一种由机器或算法完成的文字游戏。
它可以模仿逼真,可以快速组合,可以在技能和信息掌握方面超过真正的艺术家,甚至大量生成具有诗或艺术形式的东西,但在自我意识、自我情感方面的天然缺失,导致它的作品从根本上讲就不是其自我情感、自我意识的表达。
诗是思想情感的表达,而思想情感又是因生活而起的。
生活的前提是生命,是包括思想情感、意识在内的生命。
生命的展开就是生活,生活是生命的体现。
人工智能,显然没有生命、没有生活、没有思想情感,它所具有的是算法,模拟,是生成,是通过算法来模拟诗人的作品所生成的文字。
现在的人工智能所生成的文字还多有不通之处,但未来的人工智能肯定会生成各种合规的甚至生动的文字。
单从字面来看这些文字也会具有其字面的意义。
但一旦用上“()”的标准,这些作品就可能现出(),丧失被称为“作品”的资格。
1.下列依次填入文中括号内的词语最恰当的一项是(3分)()A.层出不穷文学审美原形B.层出不穷知人论世原形C.不胜枚举知人论世原型D.不胜枚举文学审美原型【参考答案】B【解析】层出不穷:接连不断地出现,没有穷尽。
不胜枚举:无法一个一个全举出来,形容同一类的人或事物很多。
“层出不穷”不仅突出多,还与前一句的“日益”相吻合,所以更合适。
前后语境都是突出人工智能作品缺乏人的情感意识,缺乏生命力故可推出“知人论世”“文学审美”更合适。
现出“原形”(原来的形状)指本来面目完全暴露,伪装被彻底揭开,合于语境。
2.对上文中运用的修辞手法判断正确的一项是(3分)()A.排比、双关、对比B.对偶、顶真、双关C.排比、顶真、对比D.对偶、顶真、对比【参考答案】C【解析】无双关,排除A、B两项;无对偶,排除B、D两项。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
间充质干细胞(mesenchymal stem cells, MSCs)起 源于发育早期的中胚层 , 是一类具有高度自我更新 能力和多向分化潜能的成体干细胞. MSCs 具有免疫 原性低、造血支持、炎症趋化、免疫调节和提供营养 支持等生物学特性, 在组织损伤, 免疫调控和再生医 学领域受到了广泛的研究 [1]. 目前 , 该细胞已在临床 研究中用于造血干细胞移植后急性移植物抗宿主病 (acute graft-versus-host disease, aGVHD)及自身免疫 性相关疾病的治疗中[2,3]. MSCs 既可以抑制过激的炎 症反应, 又能够对损伤的组织进行修复, 得益于其特 殊的免疫调节作用. MSCs 的免疫调节作用最早由 Bartholomew 等 [4] 人 在 2002 年发现, 间充质干细胞表达多种黏附分
1.2
MSCs 对免疫细胞的免疫调节作用
MSCs 可以对固有免疫系统和获得性免疫系统
的多种免疫细胞进行免疫调节, MSCs 被激活后通常 会对大部分的免疫细胞表现出免疫抑制的效果 [11,12]. MSCs 主要通过细胞与细胞间的直接接触和旁分泌产 生细胞因子等方式共同对靶细胞进行免疫调控. MSCs 通过细胞与细胞直接作用的方式可作用于多种 免疫细胞, 如自然杀伤细胞[13]、 T 细胞和 B 细胞等[14]. MSCs 通过旁分泌的方式产生细胞因子、趋化因子和 生长因子等大量生物活性物质 , 参与对免疫细胞的 调控 . 这些生物活性物质包括吲哚胺 2,3 双加氧酶 (indoleamine-2,3-dioxygenase, IDO) 、前列腺素 E2 (prostaglandin E2, PGE2)、白细胞介素(IL-6, IL-10)、 转化生长因子(transforming growth factor-, TGF-)、 肝细胞生长因子(hepatocyte growth factor, HGF)、白 血 病 抑 制 因 子 (leukemia inhibitory factor, LIF) 、 HLA-G 和一氧化氮(nitric oxide, NO)等[15], 它们通过 协同或拮抗作用共同形成了一个复杂的网络调控体 系[1]. 此外, MSCs 可通过分泌微囊泡, 发挥免疫调节 作用 . 微囊泡表面富含多种白细胞分化抗原标记 ( 如 CD63, CD81 和 CD9), 内含细胞因子、生长因子、转 录因子和多种 RNAs(mRNAs, miRNA, pre-miRNA 和 非编码 RNAs), 在免疫调节和细胞与细胞间通讯等 过程中都发挥关键作用[16].
人类白细胞抗原(human leukocyte antigen, HLA)Ⅰ类 分子的表达, 下调 ULBP-3(NK 细胞活化性信号)的表 达, 从而保护“授权”后的 MSCs 不被 NK 细胞杀伤[11]. MSCs 被不同的炎症介质“授权”后表现出不同的免疫 调节表型 , 从而激活不同的信号通路调节免疫应答 . 这一发现对于了解 MSCs 与炎症微环境的信号交谈 提供了新的视角, 也为改善 MSCs 治疗不同疾病的效 果提供了理论依据.
800
1.3
不同种属之间的 MSCs 免疫调节的机制不同
MSCs 抑制淋巴细胞增殖存在多种机制, 其中产
生 IDO 或 NO 是很关键的步骤 , 但人和小鼠 (Mus musculus)的 MSCs 抑制淋巴细胞增殖的机制存在明 显的差异. 人 MSCs 通过产生大量的 IDO(仅少量的 NO)在抑制淋巴细胞增殖和增强调节性 T 细胞的功能 方面起到主要作用; 而小鼠 MSCs 通过一氧化氮合成
All article content, except where otherwise noted, is licensed under a Creative Commons Attribution 3.0 Unported license. Downloaded to IP: 61.50.122.46 On: 2016-07-28 13:48:12 /doi/10.1360/N052016-00132
中国科学: 生命科学 SCIENTIA SINICA Vitae
2016 年
第 46 卷 第 7 期: 799 ~ 808
《中国科学》杂志社
SCIENCE CHINA PRESS
评 述
间充质干细胞免疫调节的可塑性
黄庆雷, 魏晓飞*
北京市脐带血造血干细胞库, 北京 100176 * 联系人, E-mail: xfwei@ 收稿日期: 2016-03-14; 接受日期: 2016-05-06; 网络版发表日期: 2016-06-28
中国科学: 生命科学
2016 年
第 46 卷
第7期
酶(inducible nitric oxide synthase, iNOS)产生大量 NO 在抑制淋巴细胞增殖方面起到主要作用
[17]
Байду номын сангаас
的激活感受微环境的变化 . 炎症反应发生后的数小 时内 , 组织损伤产生或病原体表达的分子会被固有 免 疫 细 胞 表 面 的 Toll 样 受 体 (Toll like receptors, TLRs)所识别 , 主要通过激活巨噬细胞和中性粒细胞 等吞噬细胞启动先天性免疫应答 , 提供非特异性防 御的第一道防线[27]. TLRs 不仅在吞噬细胞表面表达, 也在基质细胞 (stromal cells) 包括 MSCs 表面表达 , TLR 通路激活后, MSCs 参与炎症微环境的形成[28,29]. (2) MSCs 在炎症反应的早期阶段促进免疫应答. 在炎症反应发生的早期阶段, MSCs 的促炎作用有利 于炎症微环境的形成. (ⅰ) MSCs 能增强中性粒细胞 的促炎效果. 在急性炎症反应发生的情况下, 中性粒 细胞在几分钟内迁移并聚集到炎症反应发生的部位 , 主要通过吞噬功能发挥作用 [30]. 无论鼠源还是人源 MSCs 实验都表明, MSCs 通过产生生长因子和集落 刺激因子等方式增强中性粒细胞的促炎效果 [31,32]. (ⅱ) MSCs 通过产生趋化因子募集淋巴细胞到达炎症 部位来增强免疫应答. MSCs 被促炎因子刺激后, 会 产生 CCL2, CCL3, CXCL-9, CXCL-10 和 CXCL-11 等 大量趋化因子家族成员[33,34]. (ⅲ) MSCs 可作为抗原 提呈细胞. 研究表明, 在低剂量 IFN-刺激下, MSCs 可具有部分抗原提呈细胞的作用 [35,36]. 无论体外还 是体内实验均表明, 低浓度的 IFN-刺激下 MSCs 会 上调 MHC-Ⅰ类和 MHC-Ⅱ类分子的表达, MSCs 会表 现出部分抗原提呈功能. MSCs 由 MHC-Ⅰ类分子介 导的抗原提呈功能可激活抗原特异性 CD8+细胞毒性 T 细胞[36]. (3) MSCs 能抑制过强的炎症反应维持组织的稳 态. 当有足量的促炎因子刺激时, MSCs 会表现出免 疫抑制的表型, 通过促进单核细胞转变为抗炎的 M2 型巨噬细胞, 降低炎症反应的严重程度, 维持组织的 稳态. MSCs 免疫抑制作用的发挥, 依赖 MSCs 与多种 免疫细胞的直接接触 (cellular contact) 以及产生大量 生物活性物质, 包括 PGE2 和 IDO, 促进巨噬细胞向 M2 型抗炎方向的极化, 抑制效应 T 细胞的功能, 促 进调节性 T 细胞的出现等多种机制[37]. MSCs 免疫调 节的可塑性对于平衡促炎和抑炎应答反应 , 维持组 织的稳态起到重要的作用.
引用格式: 黄庆雷, 魏晓飞. 间充质干细胞免疫调节的可塑性. 中国科学: 生命科学, 2016, 46: 799–808 Huang Q L, Wei X F. Plasticity of mesenchymal stem cells in immunomodulation. Sci Sin Vitae, 2016, 46: 799–808, doi: 10.1360/N052016-00132 © 2016《中国科学》杂志社
1 MSCs 的免疫调节能力
MSCs 表 达 低 水 平 的 主 要 组 织 相 容 性 复 合 体 (major histocompatibility complex, MHC)Ⅰ类分子 , 免疫原性较弱, 可保护 MSCs 免受 NK 细胞对其进行 杀伤[8]. MSCs 不表达 MHC-Ⅱ类分子和 B7-1, B7-2, CD40, CD40L 等共刺激分子, 这些分子是效应性 T 细 胞激活所必需的[9]. 共刺激分子的缺失, 使得 T 细胞 活化的第二信号不能激活, 导致 Th 细胞的无反应性 从而促成免疫耐受 . 虽然干扰素 (interferon-gamma, IFN-)可诱导 MSCs 表面 MHC-Ⅱ类分子的表达, 但 仍不足以刺激同种异体的免疫反应 [10] . 这种独特的 生物学属性使得同种异体间进行 MSCs 移植不会引 起免疫排斥反应. 但有证据表明, MSCs 表达一系列 可以激活 NK 细胞受体的配体 , 如 ULBP-3(UL16 binding protein 3), nectin-2, CD54 和 CD155 等, 表 达此类配体的 MSCs 易被活化的 NK 细胞识别并 杀伤[11].
All article content, except where otherwise noted, is licensed under a Creative Commons Attribution 3.0 Unported license. Downloaded to IP: 61.50.122.46 On: 2016-07-28 13:48:12 /doi/10.1360/N052016-00132
子 , 例如 , 血管细胞黏附分子 (vascular cell adhesion molecule 1, VCAM-1)、细胞间黏附分子(intercellular cell adhesion molecule-1, ICAM-1)和淋巴细胞功能相 关 抗 原 3(lymphocyte function-associated antigen 3, LFA-3)等与 T 细胞相互作用 , 并能抑制有丝分裂原 诱导的淋巴细胞增殖反应 . 之后 , 大量文献报道了 MSCs 可以对固有免疫和适应性免疫的多种效应细胞 都具有免疫调节作用. MSCs 的免疫调节作用并不是 天然固有的 , 它通常所表现出来的免疫抑制作用需 要炎症微环境大量促炎因子的诱导[5]. MSCs 的免疫 调节能力很大程度上取决于其所处微环境中炎症介 质 (inflammatory mediators)的种类和浓度等 . 研究发 现, 不同程度的炎症介质会诱导 MSCs 表现出截然相
