能量均分定理理想气体内能
大学物理第8章第3节-能量均分定理 理想气体的内能

在每一个平动自由度上, 分子的每个平 动自由度具有的能量都是 k BT 2 .
可以证明, 平衡态下一个转动自由的平 均能量是 k BT 2 . 能量按自由度均分定理 平衡态下气体分子的每一个自由度的 平均动能都等于 k BT 2 . 一个振动自由度的平均能量是 2(k BT 2) . ( k BT 2 是动能, k BT 2 是势能.)
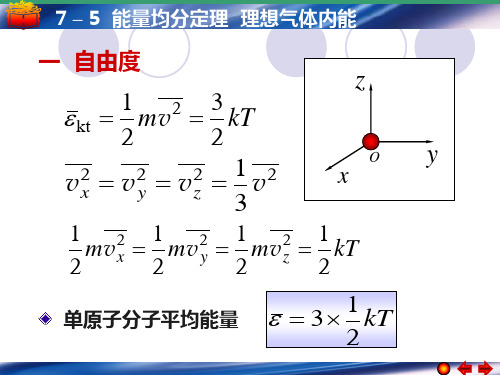
y
P( x, y, z )
o
x
z
一个刚性分子的自由度
平动: 3 单原子分子 3 个 转动: 0 平动: 3 5 个 双原子分子 转动: 2 平动: 3 6 个 多原子分子 转动: 3
一个刚性分子的自由度
i t r
ikBT 2
(ii) 一摩尔理想气体分子
E N 0 N 0 ikBT 2 i RT 2
(iii) 质量为 M 摩尔质量为 M mo l 的理想气 体ห้องสมุดไป่ตู้子
i M i i RT pV E N N k BT 2 M mol 2 2
CO 2 气体在标 O2 、 例8.2 求1 mol的 He 、 准状态下的内能. O2 、 CO 2 都可看作理想气. 解 He 、 He 是单原子分子, i 3 ,
三. 理想气体的内能 内能: 在热力学系统中, 系统与热现象 有关的能量. 包括: (i) 气体分子热运动所具有动能, (ii) 气体分子之间以及分子内的原子与 原子之间相互作用所具有的势能. 理想气体分子间没有相互作用, 理想气 体的内能只有气体分子作热运动的动能.
理想气体的内能 (i) 一个理想气体分子
理想气体内能 平均自由程

推广:在温度为T 的平衡态下,分子的每一个转动自由度
上也具有相同的平均动能,大小也为kT/2。
能量按自由度均分定理:
在温度为T的平衡态下,气体分子每个自由度 的平均动能都相等,都等于kT/2。这就是能量 按自由度均分定理,简称能量均分定理。
k
i 2
k=3kT/2
说明:
kT
•是统计规律,只适用于大量分 子组成的系统。 •统计物理可给出严格证明。
b A(x,y,z) a
y
x
说明:一般来说,n≥3个原子组成的分子,共有3n个自由度,
其中3个平动自由度,3个转动自由度,(3n-6)个振动自由度。当 气体处于低温状态时,可把分子视为刚体。
二、能量均分定理:
一个分子的平均平动能为
k
2 x
kt
2 y
3 2
kT
1 2
mv
2
1 2
E= m i M 2 RT
E E 2 E1
m i M 2
R (T 2 T1 )
在相同的t时间内,分子由A到 B的位移大小比它的路程小得多
A
B
(路程/时间) (位移量/时间)
扩散速率 平均速率 气体分子两次相邻碰撞之间自由通过的路程。
分子自由程: 分子碰撞频率:
在单位时间内一个分子与其他分子碰撞的次数。
y
q
x
z
自由刚体
三个独立的坐标 x,y,z 决定转轴上一点 两个独立的a, b 决定转轴空间位置
一个坐标q 决定刚体转过的角度
i=6 3个平动 3个转动
b A(x,y,z) a
y
刚性杆:
x,y,z,α,β i=5
z
6.4X 能量均分定理 理想气体的内能

刚性近似下, s = 0, i = t + r, 分子的平均总能量:
3 2 kT(单原子分子) i tr 5 E Ek kT kT kT(双原子分子) 2 2 2 6 2 kT 3kT(多原子分子)
当温度极低时,转动自由度 r 也被“冻结”, 任何气体分子都可视为只有平动自由度 , 就如 同单原子分子。这时, r = 0, s = 0, i = t, i t 分子的平均总能量 E Ek kT kT 2 2
1.52102 ( J / m3 )
(4) 0.3 mol气体的内能
i 5 E RT 0.3 8.31 273 1.7 10 3 J 2 2
例2:贮存有氮气的容器以速度100米/秒运动。若该容 器突然停止,问容器中温度将升多少?
已知:u
100m / s, i 5, 28 10 kg / mol
常温下热运动能kt为0026ev故转动状态很容易被激发而振动状态很少被激发因此故转动状态很容易被激发而振动状态很少被激发因此在常温下理想气体分子可近似看成是刚性的在常温下理想气体分子可近似看成是刚性的只需考虑其平动和转动自由度而不必考虑其振动自由度
6.4 能量均分定理 理想气体的内能
引言:前面我们研究气体动能时,把分子看作弹性 小球的集合,人们发现用这一模型去研究单原子气体问 题时,理论与实际符合得很好,但是用这一模型去研究 多原子分子时,理论值与实验值相差甚远。 1857年克劳修斯提出:将理想气体模型稍作修改。 即不能将所有分子都看成质点,对结构复杂的多原子 分子,考虑分子的能量时,要考虑分子各种运动的能 量。即不但要考虑分子的平动,还要考虑其转动和分 子内原子之间的振动。 下面我们来考察包括平动、转动、及振动在内的理 想气体能量。
能量均分定理-推荐精选PPT

• 单原子分子只有三个平动自由度,而没有转动自由 度。
• 双原子分子的自由度数最多可以有6个。
• 由此可估计到,N 个原子组成的多原子分子,其自 由度数最多为 3N 个。
在这 3N 自由度中,有三个(整体)平动、三个 (整体)转动及 3N – 6 个振动自由度。
理杜想隆气 -珀体蒂的定总律动: 固能体就摩是位尔内热能置容U 。所需独立坐标数也就不同。
由于固体处于静止状态,它的平动、转动运动不必考虑, 则物体在该过程中的热容C 定义为 粗略地考虑,可不必区分定压热容还是定体热容,而以 C m 表示晶体的摩尔热容。
• 若要解释单原子、双原子、多原子理想气体热容的
• 双原子分子、多原子分子及单原子分子之间的差
别在于它们的分子结构各不相同 大家知道,确定一个质点的空间位置需 x、y、z 三个独立坐标,故自由度数是3个。 ,描述它们的空间
由于分子中的原子所进行的振动都是振幅非常小的微振动,可把它看作简谐振动。 本节将在此基础上,通过与实验测量值的比较,得到能量均分定理,
• 因为转动惯量与回转半径平方成正比,,所以转动惯 量之比为 10-10 倍。转动角速度相同时的转动能量之 比也是 10-10 倍。
故双原子分子绕中心轴转动自由度不必考虑,
刚性双原子分子的自由度数为三个平动自由度两个转 动自由度。
• 非刚性双原子分子有一个沿两质心联线振动的振动自 由度,其总自由度数为六个。
一个刚性多原子分子既在空间平动又作转动,确定
空间位置就需 x、y、z 及α、β、γ 六个独立坐
标,它的自由度数是六个。 • 而双原子分子本身很像一个哑铃,每个原子的质量
气体动理论-2

返回 退出
二、能量均分定理
分子的平均平动动能:
kt
1 2
m v2
1 2
m
vx2
1 2
m vy2
1 2
m
vz2
3 kT 2
vx2
v2y
vz2
1 v2 3
1 2
m vx2
1 2
m vy2
1 2
m vz2
1 2
kT
分子的平均平动动能 3kT/2 是均匀地分配在每个
§3-3 能量均分定理 理想气体的内能
一、分子的自由度
自由度 ( i ): 决定某物体在空间的位置所需要的 独立坐标数目。
质点: (x, y, z)
i=3
做直线运动的质点: 做平面运动的质点: 做空间运动的质点:
1个自由度 2个自由度 3个自由度
返回 退出
运动刚体的自由度: 随质心的平动+绕过质心轴的转动 自由刚体有 6个自由度:
(t r 2s) 1 kT
2
返回 退出
三、理想气体的内能
气体的内能:气体中所有分子的热运动能量和分 子间相互作用势能的总和。
理想气体内能:气体中所有分子的平均能量的总和。
1mol 理想气体的内能: (只考虑刚性分子)
Emol
NA
i 2
kT
i 2
RT
质量为m',摩尔质量为M的理想气体内能:
E
率在 v 附近单位速率区间 的分子数占总
数的百分比 .
f (v)dv 的物理意义:
表示速率在v v dv区间的分 子数占总分子数的百分比.
速率在v v dv内分子数:dN Nf (v)dv
第19讲能量均分定理理想气体的内能

教学要求了解速率分布函数、分子速率的实验测定、麦克斯韦速率分布律。
理解气体分子的方均根速率、刚性分子的自由度。
掌握气体的能量均分定理,理想气体的内能。
7.4 能量均分定理 理想气体的内能前面讨论分子热运动时,把分子视为质点,只考虑分子的平动。
气体的能量是与分子结构有关的,除了单原子分子可看作质点外,一般由两个以上原子组成的分子,不仅有平动,而且还有转动和分子内原子间的振动。
为了确定分子的各种运动形式的能量的统计规律,需要引用力学中有关自由度的概念。
7.4.1自由度完全描述系统在空间位置所需独立坐标的数目,称为系统的自由度。
考察分子运动的能量时,不能再把各种分子都当作质点处理,从而还要考虑其它运动形式(如转动和振动等)的自由度。
气体分子按其结构可分为单原子分子、双原子分子和三原子或多原子分子。
当分子内原子间距离保持不变(不振动)时,这种分子称为刚性分子,否则称为非刚性分子,对于非刚性双原子分子或多原子分子,由于在原子之间相互作用力的支配下,分子内部还有原子的振动,因此还应考虑振动自由度。
但是由于关于分子振动的能量,经典物理不能给出正确的说明,正确的说明需要量子力学;另外在常温下用经典方法认为分子是刚性的也能给出与实验大致相符的结果;所以作为统计概念的初步,下面只讨论刚性分子的自由度。
1 单原子分子如氦(He)、氖(Ne)、氩(Ar)等分子只有一个原子,可看成自由质点,所以有3个平动自图7-3 分子的自由度(a )单原子分子 (b )双原子分子(c )三原子分子zzzααγββθ由度[如图7-3(a )]。
2 刚性双原子分子如氢 (H 2)、氧( O 2)、氮(N 2)、一氧化碳(CO)等分子,两个原子间联线距离保持不变。
就像两个质点之间由一根质量不计的刚性细杆相连着(如同哑铃),确定其质心C 的空间位置,需3个独立坐标(x ,y ,z );确定质点连线的空间方位,需两个独立坐标(如α,β), 而两质点绕连线的的转动没有意义(因为相对该连线的转动惯量J 是非常小的,从而与该连线相应的转动动能212J ω可以忽略不计)。
7-5 能量均分定理 理想气体内能要点
1 2
m vC2 y
1 2
m vC2 z
分子平均转动动能
kr
1 2
J
2 y
1 2
J
2 z
➢ 刚性分子平均能量
kt kr
7 – 5 能量均分定理 理想气体内能
非刚性双原子分子
y
m2
m1
* C
x
z
刚性分子平均能量
kt kr
非刚性分子平均振动能量
v
1 2
vC2x
1 kx 2 2
非刚性分子平均能量
7 – 5 能量均分定理 理想气体内能
一 自由度
kt
1 mv2 2
3 2
kT
v
2 x
v
2 y
v2z
1 v2 3
z
Oy
x
1 2
mv2x
1 2
mv
2 y
1 2
mv2z
1 kT 2
单原子分子平均能量 3 1 kT
2
7 – 5 能量均分定理 理想气体内能
刚性双原子分子
分子平均平动动能
kt
1 2
m
vC2 x
kt kr v
自由度 分子能量中独立的速度和坐标的二次方
项数目叫做分子能量自由度的数目, 简称自由度,用
符号 表i示.
7 – 5 能量均分定理 理想气体内能
自由度 分子能量中独立的速度和坐标的二次方项
数目叫做分子能量自由度的数目, 简称自由度,用符号
i 表示.
自由度数目
i t r v
平转振 动动动 刚性分子能量自由度
t r i 自由度
分子
平动
转动
总
(完整版)理想气体内能
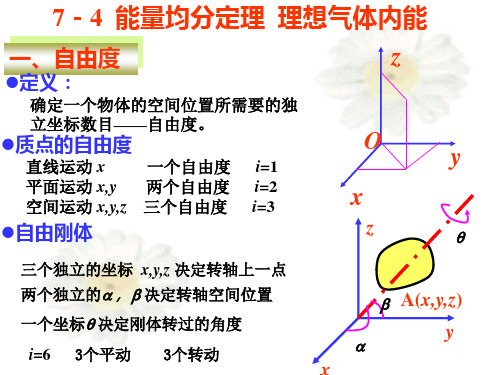
一、自由度
定义:
确定一个物体的空间位置所需要的独 立坐标数目——自由度。
质点的自由度
直线运动 x 一个自由度 i=1 平面运动 x,y 两个自由度 i=2 空间运动 x,y,z 三个自由度 i=3
自由刚体
三个独立的坐标 x,y,z 决定转轴上一点
两个独立的a, b 决定转轴空间位置
热力学系统的内能是指气体分子各种形态的动能与势能的总 和。即系统所包含的全部分子的能量总和称为系统的内能。
理想气体内能公式
理想气体内能是分子平动动能与转动动能之和
分子的自由度为i,则一个 说明:
分子能量为ikT/2, 1摩尔理 •理想气体的内能与温度和分子的想气体,有个NA分子源自内能 E= i 2kT
克劳修斯指出:气体分子的速度虽然很大,但前 进中要与其他分子作频繁的碰撞,每碰一次,分 子运动方向就发生改变,所走的路程非常曲折。
在相同的t时间内,分子由A到
B的位移大小比它的路程小得多
A• •B
扩散速率
平均速率
(位移量/时间) (路程/时间)
分子自由程: 气体分子两次相邻碰撞之间自由通过的路程。
C p,m
i
2 2
R
C p,m CV ,m
i2 i
对于单原子分子与双原子 分子,理论与实验符合得 很好,而对于多原子分子, 理论与实验相差较大。
气体
理论值
CV,m CP,m
γ
实验值
CV,m
CP,m
γ
He
12.61 20.95 1.66
12.47 20.78 1.67
Ne
12.53 20.90 1.67
一个坐标q 决定刚体转过的角度
能量均分

注意:对应分子的一个振动 自由度,除有一份 振动的动能外,还有一份平均势能 分子的平均能量
___
1 1 ( t r )kT kT 2 2
1 ( t r 2 )kT 2
令:i t r 2v
i kT 2
例:双原子(刚): t 3, r 2, i 5 : 5 kT
mv 2 2kT
v 2 dv
f (v )dv
1 dN f ( v) N dv
在温度为 T 的平衡状态下, 速率在 v 附近单位速率区间 的分子数占总数的比率 . 分子速率处在v附近单位速率区间中的几率(几率密度) 物理意义
1 dN f ( v) N dv
速率分布曲线
1 、分布函数总特征‘两头小, 中间大’(如图) 2 、a)速率在 v v dv 区间的分 子数占总分子数的百分比
结论:理想气体内能是温度的单值函数: E=E(T) (含义)
例:指出下列各式所表示的物理意义
1 3 i i m i (1) kT; ( 2) kT; ( 3) kT; (4) RT; (5) RT 2 2 2 2 M2
解(1)表示理想气体分子每一自由度 所具有的平均 能量 (2)表示单原子分子的平均动能或分子的平均平动 动能。 (3)表示自由度为i的分子的平均能量.
2
注意:
1)定理是一条统计规律,只能适用于大量分子的平 均或一个分子长时间的平均 2)能量均分到各自由度的原因 3)定理适用于液体和固体
二、理想气体内能 理想气体的内能 :分子动能和分子内原子间的 势能之和 . 平动
动 能 转 动 振动 势能(原子之间)
气体内能:气体包含的所有分子的动能,势能和分子间的相互作 用势能
10.3 能量按自由度均分原理

一个氮气(或一氧化碳)分子的转动动能为
J
2 kT 1.381023 273 3.7 1021 J 2
(4)单位体积内分子的总平均平动动能为
3 kTn 3 kT p 3 p 1.5103 J
2
2 kT 2
大学物理 第三次修订本
第10章 气体动理论及热力学
(5)0.3摩尔氮气(或一氧化碳)分子的内能为
u 2v
则
Z 2vn 2πd 2vn
二、平均自由程
每两次连续碰撞之间,分子自由运动的平 均路程。
平均自由程 v 1
Z 2πd 2n
19
大学物理 第三次修订本
第10章 气体动理论及热力学
利用 P nkT 得 kT
2πd 2P
T 一定时,
1
p
标况下多数气体 ~10-8m,氢气约为10-7m。 一般分子直径 d~10-10m, 故 d。
E
M
NA
i 2
kT
i RT
2
5 0.38.31 273 1.7 103 J 2
大学物理 第三次修订本
第10章 气体动理论及热力学
10.9 气体分子的平均自由程
前面讨论了气体处于平衡态的性质和一些 统计规律,在其中起关键作用的是分子间的碰 撞。不仅如此,系统由非平衡态向平衡态的转 变过程中,如热传递过程、扩散过程,气体分 子间的碰撞也起关键作用。
可求得: Z ~109/秒。每秒钟一个分子竟发 生几十亿次碰撞!
20
大学物理 第三次修订本
第10章 气体动理论及热力学
例 估计两种情况下空气分子的平均自由程。 (1) 273 K ,1.013×105pa 时;
(2)273 K ,1.333 ×10-3pa 时。
5-4 能量均分定理 理想气体内能
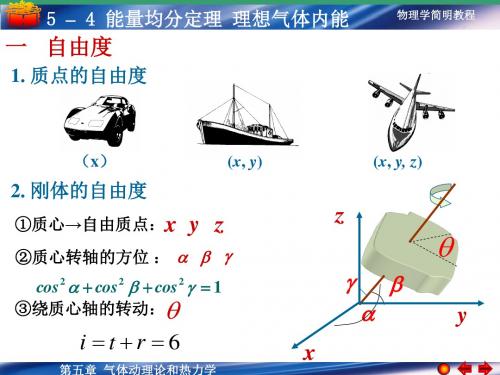
均能量都相等,均为 1 k T,这就是能量按自由度 2
均分定理 .
刚性分子的平均能量 i kT
2
第五章 气体动理论和热力学
5 – 4 能量均分定理 理想气体内能
物理学简明教程
三 理想气体的内能 1 mol 理想气体的内能
E
NA
i RT 2
1mol 单原子分子气体 E 3 RT
3
双原子分子
3
2
5
多原子分子
3
3
6
刚性分子的平均能量 i kT
2
理想气体的内能 E m i RT i RT
M2
2
第五章 气体动理论和热力学
πm πM
3. 方均根速率 v2 3kT 3RT
m
M
第五章 气体动理论和热力学
5 – 4 能量均分定理 理想气体内能 四. 能量均分定理
物理学简明教程
气体处于平衡态时,分子任何一个自由度的平均能
量都相等,均为 kT / 2 .
刚性分子能量自由度
t r i 自由度
分子
平动
转动
总
单原子分子
3
0
5 – 4 能量均分定理 理想气体内能
一 自由度
1. 质点的自由度
物理学简明教程
(x)
(x, y)
2. 刚体的自由度
①质心→自由质点:x y z
②质心转轴的方位 :
cos2 cos2 cos2 1
③绕质心轴的转动:
itr 6
第五章 气体动理论和热力学
(x, y, z)
第五章 气体动理论和热力学
能量均分原理

分子热运动的平均动能都等于 1 k T
2
—— 能量均分定理 5
能量均分定理不仅适用于气体,也适用于液体和固体 甚至适用于任何具有统计规律的系统。
刚性理想气体分子的自由度和平均动能:
分子类型
单原子分子 双原子分子 多原子分子
平动 自由度
3
3
3
转动 自由度
0
2
3
自由度i
3 5 6
分子热运动
平均动能
3 kT 2
8
5 2
kT
6 kT 2
6
三. 理想气体热力学能(内能)
热力学能:系统内部各种动能和势能的总和。 (不包括系统整体质心运动的能量)
对理想气体:分子间没有相互作用力,势能为零
自由度为 i 的 分子平均动能
w ikT
2
N
NA
i2(N
Ak
)T i2RT
热力学能(内能):U
N
i 2
kT
i
2RT
:气体系统的摩尔(mol)数 7
例:贮存有氮气的容器以速度100米/秒运动。若 该容器突然停止,问容器中温度将升多少?
已知: v 1 0 0 m / s i 5
M 28 103 kg / mol
求: T ?
解:氮气的宏观动能将转化为热力学能。
1 mv2 2
i 2
R(T2
T1 )
m
M
T2 T1
Mv2 iR
28103 1002 6.74(K ) 5 8.31
3
总自由度 i = 3 +3 = 6
x
4
二 . 能量均分定理
由
1 2
m
0
v
8-3能量均分定理_理想气体的内能_8-5麦克斯韦分布律_8.

f (v)dv dN N
【思考】
v2 v1
f (v)dv
的物理含义?
在速率v1~ v2区间内的分子数占分子总 数的百分比, 或在该区间的出现概率。
第8章 气体动理论
14
第88-5章 麦气克体斯韦动分理布论律
二、麦克斯韦速率分布律(1859)
温度为T的平衡态下,气体分子速率分布的
平动自由度 i=3
x 双原子分子
平动自由度 =3
转动自由度= 2
i 5
z
三原子分子
C(x, y,z)
y
平动自由度 =3
转动自由度 =3
i 6
x 第8章 气体动理论
6
8-第3 8章能量均气分体定动理理论理想气体的内能
二 能量均分定理(Equipartition theorem of energy )
N
N
Nv
Nv
O
f (v) dN Ndv
v
v
O
面积大小代表速率v 附近dv区间内的分子 数占总分子数的比率
O
vp
v
v
dN dv dN
Ndv
N
第8章 气体动理论
12
第88-5章 麦气克体斯韦动分理布论律
麦克斯韦速率分布曲线
f(v)
f(vp)
面积= dN N
N v2 f (v)dv
概率密度为
f (v)
f
(v)
4
m
2 kT
3/
2
v2
emv2
/
2kT
T, m
最概然速率:
能量均分定理理想气体内能

要3个平动自由度, 确定连线, 要2个转动自由度;确定沿连线的简谐振动,
要1个动能和1个势能自由度,所以共有7个自由度。
非刚性双原子分子的能量: kt kr kv
•
多原子气体分子(原子数n3)
C
刚性: 6个自由度(3个平动自由度, 3个转动自由度);
非刚性:有3n个自由度,其中3个是平动的,3个是转动的,其 余3n-6是振动的。
教程
二 能量均分定理(玻耳兹曼假设) 气体处于平衡态时,分子任何一个自由
度的平均能量都相等,均为 1 kT ,这就是 能量按自由度均分定理 . 2
分子的平均能量 i kT
2
5
物理学
7-5 能量均分定理 理想气体内能
教程
三 理想气体的内能
1.气体的内能 理想气体的动能、振动势能、分子间相互作用势能的和
刚性双原子气体
Emol
5 2
RT
6
刚性多原子气体 Emol 2 RT 6
物理学
7-5 能量均分定理 理想气体内能
教程
例 设有一恒温容器,其内储有某种理想
气体,若容器发生缓慢漏气,问:
(1)气体的压强是否变化?为什么? (2)容器内气体分子的平均平动动能是否变化? 为什么?
(3)气体的内能是否变化?为什么?
p(2V)=(v1+v2)RT
解得:
T p1 p2 p1 p2
T1 T2
9
物理学
7-5 能量均分定理 理想气体内能
教程
例:水蒸汽分解为同温度的氢气与氧气,即
H 2O
H2
1 2
O2
求:此过程中内能的增量(不记振动自由度)
解:H2O,O2,H2分子的自由度分别为 6,5,5
能量均分定理理想气体内能

2、能量按自由度均分定理
上述结果可推广到转动和振动自由度(这是因为他们之间都能通过碰 撞而交换能量)。 在平衡态下,分子无规则热运动碰撞的结果使得气体分子的任何一种 运动形式都是均等的,即没有哪一种运动形式比其他运动形式更占优势。 这相当于每一个平动自由度、转动自由度、振动自由度其平均动能都应等 1 于 kT 2
三 理想气体的内能
1、什么是内能:
内能是指系统内所有分子的热运动能量和分子间相互作用 势能之总和。
2、内能是态函数 是热力学状态参量P、V、T的函数,即E=E(P、V、T), 内能的变化量只与始末状态相关,与过程无关。 3、理想气体内能 (1) 由于理想气体不计分子间相互作用力,因此理想气体 的内能仅为热运动能量之总和。
例 一容器内某理想气体的温度为273K,密度为ρ= 1.25 g/m3, 压强为 p = 1.0×10-3 atm 求 (1) 气体的摩尔质量,是何种气体? (2) 气体分子的平均平动动能和平均转动动能? (3) 单位体积内气体分子的总平动动能? (4) 设该气体有0.3 mol,气体的内能? 解 (1) 由
m pV RT M
,有
M
RT
1.25 103 8.31 273 0.028 kg/mol 3 5 p 10 1.013 10
由结果可知,这是N2 或CO 气体。
(2) 平均平动动能和平均转动动能为
3 3 t kT 1.38 1023 273 5.56 1021 J 2 2
平均平动能为 平均转动能为
8.3 能量均分定理 理想气体的内能
解: 在空气中
N2质量 M1 28.9103 76% 22.1103 kl 1
22.1 28
0.789
O2质量 M2 28.9103 23% 6.65103 kg
摩尔数
n2
M2 M mol 2
6.65 32
0.208
Ar质量 M3 28.9103 1% 0.289103 kg
摩尔数
n3
M3 Mmol 3
0.289 0.007 40
1mol空气在标准状态下的内能
E
i1 2
n1 RT
i2 2
n2 RT
i3 2
n3 RT
1 2 ( i1n1 i2n2 i3n3 )RT
i tr5
z
三原子分子
C(x, y, z)
y
平动自由度t=3 转动自由度r=3
i tr 6
x
二、能量均分定理
w 1 mv2 3 kT
2
2
vx2
vy2
vz2
1 3
v2
1 2
mvx2
1 2
mv y 2
1 2
mvz2
1 2
kT
气体分子沿 x,y,z 三个方向运动的平均平动
动能完全相等,可以认为分子的平均平动动 能 3 kT 均匀分配在每个平动自由度上。
2
能量按自由度均分定理
平衡态下,不论何种运动,相应于每一个可 能自由度的平均动能都是 1 kT
2
如果气体分子有i个自由度,则分子的平均动能为
大学物理分子动理论

xM1M3 (p1p3)V1
M2
p2V2
(1301)0329.6(天 ) 1400
6-2 理想气体压强公式
气体对器壁的压强是大量分子对容器不断碰撞 的统计平均效果。
每个分子对器壁的作用 f t
所有分子对器壁的作用 F f t
t
理想气体的压强公式
p F S
一、理想气体的分子模型 1、分子可以看作质点
说明: •平衡态是一种热动平衡
处在平衡态的大量分子仍在作热运动,而且因 为碰撞, 每个分子的速度经常在变,但是系统的宏 观量不随时间 改变。
例如:粒子数
箱子假想分成两相同体积的部分, 达到平衡时,两侧粒子有的穿越 界线,但两侧粒子数相同。
•平衡态是一种理想状态
对热力学系统的描述:
1. 宏观量——状态参量
解: (1) p1V1 p2V2
T1
T2
由已 :V 1知 2V 2,T 127 2 3 730 K ,0
T227 1 374 75 K0
p2V V 1 2T T 2 1p12 V V 22 3405 00 3p1
(2) w 3kT 2
ww2w123k(T2T1)
31.381 023(45030)03.1 11 021J 2
w 3 kT 2
p nkT
6-4 能量均分定理 理想气体的内能
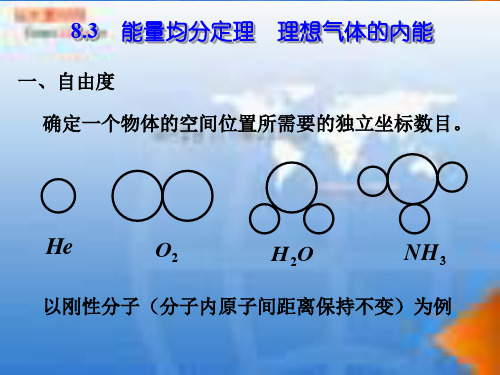
一、自由度 确定一个物体的空间位置所需要的独立坐标数目。
He
O2
H2O
NH 3
以刚性分子(分子内原子间距离保持不变)为例
z
z
C(x, y,z)
y
C(x, y,z)
y
x
单原子分子
平动自由度t=3
itr3
理想气体的内能汇总.

M i i U RT n RT 2 2
分子运动论也给出:理想气体的内能仅仅是温 度的函数。
二、理想气体的摩尔热容 :
理想气体的定体摩尔热容为
CV , m
(dQ) 1 1 dU du i V R n dT n dT dT 2
2பைடு நூலகம்
5 对于刚性双原子分子: CV , m R 27 对于非刚性双原子分子: CV , m R 2 对于刚性多原子分子: CV , m 3 R
对于单原子分子: CV , m 3 R
上页
下页
例题. 将水蒸汽分解成相同温度的氢气和氧气, 求内能增加的百分比 。 解: 2 H 2O 2 H 2 O2
2 mol 水 2 mol 氢气 1 mol 氧气
U H 2O 2 3 RT 6 RT 5 U H 2 2 RT 5 RT 2
上页 下页
在空间自由运动的质点:
位置由三个独立坐标确定,自由度 = 3 ; 在曲面上运动的质点: 位置由二个独立坐标确定 ,自由度= 2 ; 质点沿直线或曲线运动: 位置由一个独立坐标确定,自由度 = 1 .
上页
下页
(2)刚体的自由度: 刚体除平动外还有转动。由于刚体的一 般运动可分解为随质心的平动和绕质心轴 的转动,所以刚体的位置可确定如下: a.三个独立坐标 x, y, z 确定其质心的位置; b.用两个独立坐标 , z 确定转轴的方位; (三个方位角中只有两个 2 2 2 cos cos cos 1 ) 是独立的 c.用一个独立坐标 , y 确定刚体绕质心轴转过 的角度。 x
m 5 2 mv RT 2 2
T
P
v
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 1 2 m0 v x kT 2 2
气体分子在每一个平动自由度上具有相等的 平均平动动能,其大小等于二分之一kT。
前页 后页 目录
3
5.4 能量均分定理 理想气体内能
能量按自由度均分定理 在温度为T的平衡态下,气体分子每一个自由 1 度的平均动能为 kT 2
分子平均平动动能Байду номын сангаас kt
t kT 2
r 分子平均转动动能 kr kT 2
前页 后页 目录
4
5.4 能量均分定理 理想气体内能
分子平均振动动能 ks
s kT 2
trs 分子平均动能 k kT 2
分子平均振动势能 ps
s kT 2
i 分子平均能量 kT 2
i =t+r+2s,称为能量自由度
前页 后页 目录
5.4 能量均分定理 理想气体内能
5.4 能量均分定理 理想气体内能
一. 分子自由度 确定分子位置的独立坐标数。 分为平动、转动和振动自由度。 (1)单原子分子 平动自由度t =3
o x
z
( x, y, z )
y
前页 后页 目录
1
5.4 能量均分定理 理想气体内能
(2)刚性双原子分子 平动自由度t =3 转动自由度r =2 振动自由度s =0
5
5.4 能量均分定理 理想气体内能
三. 理想气体的内能 气体分子热运动能量的总和。
m i E N A kT M 2 m i E RT M 2
理想气体的内能只是温度的单值函数。
本节完
前页 后页 目录
6
z
B
A ( x, y, z )
o
x
y
(3)非刚性双原子分子 平动自由度t =3 转动自由度r =2 振动自由度s =1
(4)刚性多原子分子 平动自由度t =3 转动自由度r =3 振动自由度s =0
前页 后页 目录
2
5.4 能量均分定理 理想气体内能
二. 能量均分定理
kt
1 3 2 m0 v kT 2 2 1 3 2 2 2 m0 (v x v y v z ) kT 2 2
