物理化学课件及考试习题 试卷 答案第6章 相平衡习题及
物理化学(天津大学第四版)课后答案 第六章 相平衡

0 1.08 1.79 2.65 2.89 2.91 3.09 3.13 3.17 (1) 画出完整的压力-组成图(包括蒸气分压及总压,液相线及气相线);
(2) 组成为
的系统在平衡压力
下,气-液两相平衡,求
课 后 答 案 网
平衡时气相组成 及液相组成 。
(3) 上述系统 5 mol,在
课 后 答 案 网
(3) 某组成为 (含 CCl4 的摩尔分数)的 H2O-CCl4 气体混合物在 101.325 kPa 下恒压冷却到 80 °C 时,开始凝结出液体水,求此混合气体的组成; (4) 上述气体混合物继续冷却至 70 °C 时,气相组成如何; (5) 上述气体混合物冷却到多少度时,CCl4 也凝结成液体,此时气相组成如
(5) 上述气体混合物继续冷却至 66.53 °C 时,CCl4 也凝结成液 体(共沸),此时 H2O 和 CCl4 的分压分别为 26.818 kPa 和 74.507 kPa,因此
课 后 答 案 网
6.12 A–B二组分液态部分互溶系统的液-固平衡相图如附图,试指出各个相区
(2) 当温度由共沸点刚有上升趋势时,系统处于相平衡时存在哪 些相?其质量各为多少?
解:相图见图(6.7.2)。(1)温度刚要达到共沸点时系 统中尚无气相存在,
课 后 答 案 网
只存在两个共轭液相。系统代表点为
。
根据杠
杆原理
(2)当温度由共沸点刚有上升趋势时,L2 消失,气相和 L1 共存,因此
何? (2)外压 101.325 kPa 下的共沸点为 66.53 °C。 (3)开始凝结出液体水时,气相中 H2O 的分压为 43.37 °C,因此
(4) 上述气体混合物继续冷却至 70 °C 时,水的饱和蒸气压,即水在气相中 的分压,为 31.16 kPa,CCl4 的分压为 101.325 – 31.36 = 70.165 kPa,没有达 到 CCl4 的饱和蒸气压,CCl4 没有冷凝,故
物理化学第六章-相平衡(72).ppt

点:三相点,P=3,F=0
to 0.01C, po 0.610kPa
(3)相图的应用
① 当T、p 一定时,确定系统
相态。
② 当T、p 改变时,描述系统
相态变化。
a b cd e
系统从a到e过程系统的相态 改变如下:
H2Os H2Os H2Ol H2Ol H2Ol H2Og H2Og
度数,用 F 表示 例如:水与水蒸气两相平衡系统
变量数= 2(T、p)
自由度数= 1(T or p)
1.2 相律公式 (1)形式: F C P 2
(2)几点说明
★相律公式中的2 :特指 T、p,表示对平衡系统有影响的因素
有温度 T 和压力 p 两个,且系统整体的温度、压力皆相同。
★其它形式 :如有其它因素,F=C-P+n;
液态混合物的特点。
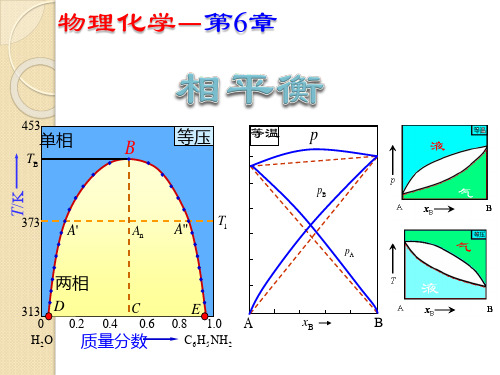
(2) 作图 以甲苯(A)-苯(B)系统为例。
理想液态混合物甲苯(A)-苯(B)系统相图
① p-xB图
p pA pB
由图可知,
p
B
pA p pB
即理想液态混合物的蒸气总
压始终介于两纯液体的饱和
pB pB xB
蒸气压之间。这也是理想液 态混合物的特点。
一样,在理想液态混合物中,
易挥发组分在平衡气相中的
相对含量总是大于它在液相
中的相对含量。
p
A
把表示溶液蒸气总压与
蒸气组成关系的线即p-y 线, 0
1
称之为气相线
A
B
理想液态混合物甲苯(A)-苯(B)系统相图
(3)读图
① 气相线、液相线
等温
② 各相区的相态及自由度 pa
大学物理化学核心教程课后参考答案第6章

第六章相平衡一.基本要求1.掌握相平衡的一些基本概念,会熟练运用相律来判断系统的组分数、相数和自由度数;2.能看懂单组分系统的相图,理解相图中的点、线和面的含义及自由度,知道相图中两相平衡线的斜率是如何用Clapeyron方程和Clausius-Clapeyron方程确定的,了解三相点与凝固点的区别;3.能看懂二组分液态混合物的相图,会在两相区使用杠杆规则,了解蒸馏与精馏的原理,知道最低和最高恒沸混合物产生的原因;4.了解部分互溶双液系和完全不互溶双液系相图的特点,掌握水蒸汽蒸馏的原理;5.掌握如何用热分析法绘制相图,会分析低共熔相图上的相区、平衡线和特殊点所包含的相数、相的状态和自由度,会从相图上的任意点绘制冷却时的步冷曲线;了解二组分低共熔相图和水盐相图在湿法冶金、分离和提纯等方面的应用;6.了解生成稳定化合物、不稳定化合物和形成固溶体相图的特点,知道如何利用相图来提纯物质;二.把握学习要点的建议相律是本章的重要内容之一,不一定要详细了解相律的推导,而必须理解相律中各个物理量的意义以及如何求算组分数,并能熟练地运用相律;水的相图是最简单也是最基本的相图,要把图中的点、线、面的含义搞清楚,知道确定两相平衡线的斜率,学会进行自由度的分析,了解三相点与凝固点的区别,为以后看懂相图和分析相图打好基础;超临界流体目前是分离和反应领域中的一个研究热点,了解一些二氧化碳超临界流体在萃取方面的应用例子,可以扩展自己的知识面,提高学习兴趣;二组分理想液态混合物的相图是二组分系统中最基本的相图,要根据纵坐标是压力还是温度来确定气相区和液相区的位置,理解气相和液相组成为什么会随着压力或温度的改变而改变,了解各区的条件自由度在二组分相图上都是条件自由度,为以后看懂复杂的二组分相图打下基础;最高或最低恒沸混合物不是化合物,是混合物,这混合物与化合物的最根本的区别在于,恒沸混合物含有两种化合物的分子,恒沸点的温度会随着外压的改变而改变,而且两种分子在气相和液相中的比例也会随之而改变,即恒沸混合物的组成也会随着外压的改变而改变,这与化合物有本质的区别;杠杆规则可以在任何两相区使用,但也只能在两相区使用,在三相区和在三相平衡线上是不能使用杠杆规则的;从具有最高会溶温度的相图,要认清帽形区的特点,是两液相的平衡共存区,这对今后理解两个固溶体也会形成帽形区很有帮助;在学习用热分析法绘制二组分低共熔相图时,首先要理解在步冷曲线上为什么会出现转折点和水平线段,这一方面要从散热与释放出的凝固热进行补偿的角度理解,另一方面要从自由度的变化来理解;理解了步冷曲线上自由度的变化情况,对相图中的自由度就容易理解;要花较多的精力掌握简单的二组分低共熔相图,要进行相区、两相平衡线、三相平衡线和特殊点的自由度分析,这样今后就容易看懂和理解复杂相图,因为复杂相图一般是简单相图的组合;低共熔混合物到底有几个相这个问题初学时容易混淆,答案当然是两相,不过这是两种固体以微小的结晶均匀混合的物系,纵然在金相显微镜中看起来也很均匀,但小晶体都保留着原有固体的物理和化学性质,所以仍是两相;低共熔点的温度和组成都会随着外压的改变而改变,所以低共熔混合物也不是化合物;对于形成稳定化合物和不稳定化合物的相图,要抓住相图的特点,了解稳定化合物的熔点与不稳定化合物的转熔温度之间的差别,比较一般的三相线与不稳定化合物转熔时的三相线有何不同要注意表示液相组成点的位置有什么不同,这样在分析复杂相图时,很容易将稳定化合物和不稳定化合物区别开来;固溶体是固体溶液的简称,固溶体中的“溶”是溶液的“溶”,所以不要把“溶”字误写为“熔”字;既然固溶体是溶液的一种,实际是混合物的一种即固体混合物,所以固溶体是单相,它的组成线与液态溶液的组成线一样,组成会随着温度的改变而改变;在相图上,固溶体总是处在由两根曲线封闭的两相区的下面;在分析复杂相图,首先要能正确认出固溶体或帽形区的位置,则其他相区的分析就变得简单了;三.思考题参考答案1.硫氢化铵NH HS(s)的分解反应:①在真空容器中分解;②在充有一定4NH(g)的容器中分解,两种情况的独立组分数是否一样3答:两种独立组分数不一样;在①中,C =1;因为物种数S 为3,但有一个独立的化学平衡和一个浓度限制条件,所以组分数等于1;在②中,物种数S 仍为3,有一个独立的化学平衡,但是浓度限制条件被破坏了,两个生成物之间没有量的限制条件,所以独立组分数C =2;2.纯的碳酸钙固体在真空容器中分解,这时独立组分数为多少答: 碳酸钙固体的分解反应为 32CaCO (s)CaO(s)CO (g)+物种数为3,有一个平衡限制条件,但没有浓度限制条件;因为氧化钙与二氧化碳不处在同一个相,没有摩尔分数的加和等于1的限制条件,所以独立组分数为2;3.制水煤气时有三个平衡反应,求独立组分数C1 H 2Og+ Cs= H 2g+ COg2 CO 2g+ H 2g= H 2Og+ COg3 CO 2g+ Cs= 2COg答: 三个反应中共有5个物种,5S =;方程1可以用方程3减去2得到,因而只有2个独立的化学平衡,2R =;没有明确的浓度限制条件,所以独立组分数3C =;4.在抽空容器中,氯化铵的分解平衡,43NH Cl(s)NH (g)HCl(g)+;指出该系统的独立组分数、相数和自由度数答:反应中有三个物种,一个平衡限制条件,一个浓度限制条件,所以独立组分数为1,相数为2;根据相律,自由度为1;即分解温度和分解压力两者之中只有一个可以发生变化;5.在含有氨的容器中氯化铵固体分解达平衡,43NH Cl(s)NH (g)HCl(g)+;指出该系统的独立组分数、相数和自由度答: 反应中有三个物种,一个平衡限制条件,没有浓度限制条件;所以独立组分数为2,相数为2,自由度为2;6.碳和氧在一定条件下达成两种平衡,指出该系统的独立组分数、相数和自由度数;答:物种数为4,碳,氧,一氧化碳和二氧化碳,有两个化学平衡,无浓度限制条件,所以独立组分数为2,相数为2,自由度为2;7.水的三相点与冰点是否相同答:不相同;纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为 Pa,温度为 K ;热力学温标1 K就是取水的三相点温度的1/ K ;水的冰点是指在大气压力下,冰与水共存时的温度;由于冰点受外界压力影响,在 kPa压力下,冰点下降 K,由于水中溶解了空气,冰点又下降 K,所以在大气压力为 kPa 时,水的冰点为 K ;虽然两者之间只相差 K,但三相点与冰点的物理意义完全不同;8.沸点和恒沸点有何不同答:沸点是对纯液体而言的;在大气压力下,纯物质的液-气两相达到平衡,当液体的饱和蒸气压等于大气压力时,液体沸腾,这时的温度称为沸点;恒沸点是对二组分液相混合系统而言的,是指两个液相能完全互溶,但对Raoult定律发生偏差,当偏差很大,在p x-图上出现极大值或极小值时,则在T x-图上出现极小值或极大值,这时气相的组成与液相组成相同,这个温度称为最低或最高恒沸点,用简单蒸馏的方法不可能把二组分完全分开;这时,所对应的双液系统称为最低或最高恒沸混合物;在恒沸点时自由度为1,改变外压,恒沸点的数值也改变,恒沸混合物的组成也随之改变;当压力固定时,条件自由度为零,恒沸点的温度有定值;9.恒沸混合物是不是化合物答:不是;它是完全互溶的两个组分的混合物,是由两种不同的分子组成;在外压固定时,它有一定的沸点,这时气相的组成和液相组成完全相同;但是,当外部压力改变时,恒沸混合物的沸点和组成都会随之而改变;化合物的沸点虽然也会随着外压的改变而改变,但它的组成是不会改变的;10.在汞面上加了一层水能减少汞的蒸气压吗答:不能;因为水和汞是完全不互溶的两种液体,两者共存时,各组分的蒸气压与单独存在时的蒸气压一样,液面上的总压力等于纯水和纯汞的饱和蒸气压之和;如果要蒸馏汞的话,加了水可以使混合系统的沸点降低,这就是蒸气蒸馏的原理;所以,仅仅在汞面上加一层水,是不可能减少汞的蒸气压的,但是可以降低汞的蒸发速度;11.单组分系统的三相点与低共熔点有何异同点答:共同点:两者都是气-液-固三相共存;不同点:单组分系统的三相点是该组分纯的气、液、固三种相态平衡共存,这时的自由度等于零,它的压力、温度由系统自身的性质决定,不受外界因素的影响;而二组分系统在低共熔点如T-x图上的E点温度时,是纯的A固体、B固体和组成为E的熔液三相平衡共存,这时的自由度为1,在等压下的条件自由度等于零;E点的组成由A和B的性质决定,但E点的温度受压力影响,当外压改变时,E点的温度和组成也会随之而改变;12.低共熔混合物能不能看作是化合物答:不能;低共熔混合物不是化合物,它没有确定的熔点,当压力改变时,低共熔物的熔化温度和组成都会改变;虽然低共熔混合物在金相显微镜下看起来非常均匀,但它仍是两个固相微晶的混合物,由两个相组成;13.在实验中,常用冰与盐的混合物作为致冷剂;试解释,当把食盐放入0℃的冰-水平衡系统中时,为什么会自动降温降温的程度有否限制,为什么这种致冷系统最多有几相解: 当把食盐放入0℃的冰-水平衡系统中时,由于食盐与冰有一个低共熔点,使水的冰点降低,因此破坏了冰-水平衡,冰就要融化;融化过程中要吸热,系统的温度下降;降温有一定的限度,因为它是属于二组分系统的低共熔混合物,当温度降到低共熔点时,冰、食盐与溶液达到了平衡,系统的温度就不再下降;根据相律:2f C P =+-,组分数为2H O(l)和NaCl(s),2C =;当0f =时,最多相数4P =,即气相,溶液,冰和NaCls 四相共存;如果指定压力,则条件自由度等于零时,最多相数3P =,溶液,冰和NaCls 三相平衡共存;四.概念题参考答案1.4NH HS(s)与任意量的3NH (g)及2H S(g)达平衡时,有A C = 2,P = 2,f = 2BC = 1,P = 2,f = 1C C = 2,P = 3,f = 2D C = 3,P = 2,f = 3答:A;系统中有三个物种,一个平衡条件,由于已存在3NH (g)及2H S(g),就不存在浓度限制条件,所以组分数2C =;平衡共存时有固相和气相两个相,根据相律,自由度2f =;2.在大气压力下,3FeCl (s)与2H O(l)可以生成32FeCl 2H O(s),32FeCl 5H O(s),32FeCl 6H O(s)和32FeCl 7H O(s)四种固体水合物,则该平衡系统的组分数C 和能够平衡共存的最大相数P 为A 3, 3C P ==B 3, 4C P == C 2, 3C P ==D 3, 5C P == 答:C;这是二组分系统生成稳定化合物或稳定水合物的一个例子,3FeCl (s)与2H O(l)可以生成多种水合物,但它还是二组分系统,所以组分数必定等于2;不能把生成的稳定水合物也看作是组分;如果要写出生成水合物的多个平衡方程式,则多一个水合物物种,也多一个化学平衡方程,所以组分数是不会改变的;根据组分数等于2这一点,就可以决定选C;根据相律,当自由度等于零时,能得到平衡共存的最大相数;则20f C P =+-=,理论上最大相数似乎应等于4,但是题目已标明是在大气压力下,用*13f C P P =+-=-,所以能见到的平衡共存的最大相数只有3个;如果题目不标明是在大气压力下,由于凝聚相系统受压力影响极小,也应该看作是在等压条件下进行的,能见到的平衡共存的最大相数只能是3个;3.在 100 kPa 的压力下,2I (s)在2H O(l)和4CCl (l)两个完全不互溶的液相系统中达分配平衡;设平衡时2I (s)已不存在,则该系统的组分数和自由度数分别为A *2, 1C f ==B *2, 2C f == C *3, 2C f ==D *3, 3C f == 答:C;该系统中显然有2I (s),2H O(l)和4CCl (l)三个物种,3S =,但无化学平衡,0R =,也无浓度限制条件,'0R =不要把2I 在两相中的分配平衡看作是浓度关系式,因为在推导分配常数时已用到了2I 在两相中化学势相等的条件,所以组分数3C =;由于是两相平衡,又指定了压力,所以条件自由度*13122f C P =+-=+-=;4.4CuSO 与水可生成42CuSO H O ⋅,42CuSO 3H O ⋅和42CuSO 5H O ⋅三种水合物,则在一定温度下与水蒸气达平衡的含水盐最多为A 3种B 2种C 1种D 不可能有共存的含水盐答:B;系统的组分数为2,已指定温度,根据相律,条件自由度等于零时,可得最多可以共存的相数,*1210f C P P =+-=+-=,最多可以三相共存;现在已指定有水蒸气存在,所以,可以共存的含水盐只可能有2种;5.某一物质X,在三相点时的温度是20℃,压力是200 kPa;下列哪一种说法是不正确的A 在20℃以上,X 能以液体存在B 在20℃以下,X 能以固体存在C 在25℃和100 kPa 下,液体X 是稳定的D 在20℃时,液体X 和固体X 具有相同的蒸气压答:C;可以画一张单组分系统相图的草图,C 所描述的条件只能落在气相区,所以这种说法是不正确的;6.2N 的临界温度是124 K,如果想要液化2N (g),就必须A 在恒温下增加压力B 在恒温下降低压力C 在恒压下升高温度D 在恒压下降低温度答:D;临界温度是指在这个温度之上,不能用加压的方法使气体液化,所以只有在恒压下用降低温度的方法使之液化;7.当Clausius-Clapeyron 方程应用于凝聚相转变为蒸气时,则A p 必随T 之升高而降低B p 必不随T 而变C p必随T之升高而变大D p随T之升高可变大也可减少答:C; 因为凝聚相转变为蒸气时总是吸热的,根据Clausius-Clapeyron方程,等式右方为正值,等式左方也必定为正值,所以p随T之升高而变大;8.对于恒沸混合物的描述,下列各种叙述中不正确的是A 与化合物一样,具有确定的组成B 不具有确定的组成C 平衡时,气相和液相的组成相同D 恒沸点随外压的改变而改变答:A;恒沸混合物不是化合物,不具有确定的组成,其恒沸点和组成都会随着外压的改变而改变;9.对于二组分气—液平衡系统,哪一个可以用蒸馏或精馏的方法将两个组分分离成纯组分A接近于理想的液体混合物B对Raoult定律产生最大正偏差的双液系C对Raoult定律产生最大负偏差的双液系 D部分互溶的双液系答:A;完全互溶的理想双液系,或对Raoult定律发生较小正负偏差的都可以用蒸馏或精馏的方法将其分开,两者的沸点差别越大,分离越容易;而对Raoult定律产生最大正负偏差的双液系,气-液两相区分成两个分支,形成了最低或最高恒沸混合物,用蒸馏方法只能得到一个纯组分和一个恒沸混合物;部分互溶的双液系首先要将两个液层分离,然后视具体情况而决定分离两个互溶部分的液相,或采用萃取的方法,单用蒸馏方法是不行的;10.某一固体,在25℃和大气压力下升华,这意味着A 固体比液体密度大些B 三相点的压力大于大气压力C 固体比液体密度小些D 三相点的压力小于大气压力答:B;画一单组分系统相图的草图,当三相点的压力大于大气压力时,在25℃和大气压力下处于气相区,所以固体会升华;2CO 的相图就属于这一类型;11.在相图上,当系统处于下列哪一点时,只存在一个相A 恒沸点B 熔点C 临界点D 低共熔点答:C;在临界点时,气-液界面消失,只有一个相;其余三个点是两相或三相共存;12.在水的三相点附近,其摩尔气化焓和摩尔熔化焓分别为144.82 kJ mol -⋅和15.99 kJ mol -⋅;则在三相点附近,冰的摩尔升华焓为 A 138.83 kJ mol -⋅ B 150.81 kJ mol -⋅C 138.83 kJ mol --⋅D 150.81 kJ mol --⋅答:B;摩尔升华焓等于摩尔气化焓与摩尔熔化焓之和;13.某反应系统中共有的物种为Ni(s),NiO(s),2H O(l),2H (g),CO(g)和2CO (g),它们之间可以达成如下三个化学平衡1 ,12NiO(s)CO(g)Ni(s)CO (g)p K ++ 2 ,2222H O(l)CO(g)H (g)CO (g)p K ++ 3 ,322NiO(s)H (g)Ni(s)H O(l)p K ++该反应的组分数C 和平衡常数之间的关系为A ,1,2,33, p p p C K K K ==B ,3,1,24, /p p pC K K K == C ,3,1,23, /p p p C K K K ==D ,3,2,14, /p p p C K K K ==答:B;这个系统有6个物种,在三个化学平衡中只有2个是独立的,没有其他限制条件,所以组分数4C =;因为(1)(2)(3)-=,方程式的加减关系,反应的Gibbs 自由能也是加减关系,而平衡常数之间则是乘除关系,所以,3,1,2/p p p K K K =;14.将纯的2H O(l)放入抽空、密闭的石英容器中,不断加热容器,可以观察到哪种现象A 沸腾现象B 三相共存现象C 升华现象D 临界现象 答:D;在单组分系统的相图上,是该系统自身的压力和温度,就象该实验所示;实验不是在外压下进行的,系统中也没有空气,所以不可能有沸腾现象出现;在加热过程中,水的气、液两种相态一直处于平衡状态,即22H O(l)H O(g);随着温度的升高,2H O(l)的密度不断降低,而水的蒸气压不断升高,致使2H O(g)的密度变大,当2H O(l)和2H O(g)的两种相态的密度相等时,气-液界面消失,这就是临界状态;15.Na 2CO 3和水可形成三种水合盐:Na 2CO 3·H 2O 、Na 2CO 3·7H 2O 和NaCO 3·10H 2O;在常压下,将Na 2CO 3投入冰-水混合物中达三相平衡时,若一相是冰,一相是Na 2CO 3水溶液,则另一相是A Na 2CO 3B Na 2CO 3·H 2OC Na 2CO 3·7H 2OD Na 2CO 3·10H 2O答:D;画一张草图,NaCO 3·10H 2O 的含水量最多,一定最靠近表示纯水的坐标一边;五.习题解析1.将2N (g),2H (g)和3NH (g)三种气体,输入773 K,73.210 kPa ⨯的放有催化剂的合成塔中;指出下列三种情况系统的独立组分数设催化剂不属于组分数1 2N (g),2H (g)和3NH (g)三种气体在输入合成塔之前;2 三种气体在塔内反应达平衡时;3 开始只输入3NH (g),合成塔中无其它气体,待其反应达平衡后;解: 1 进入合成塔之前,三种气体没有发生反应,故组分数3C =;2在塔内反应达平衡时,系统的物种数3S =,但有一个化学平衡条件,故2C =; 3开始只输入3NH (g),3NH (g)分解达平衡,系统的物种数3S =,但有一个化学平衡条件和一个浓度限制条件,故1C =;2.指出下列平衡系统中的物种数,组分数,相数和自由度数;1 CaSO 4的饱和水溶液;2 将5g3NH (g)通入1 dm 3水中,在常温下与蒸气平衡共存;解:1物种数2S =,4CaSO (s)和2H O(l);组分数2C =,相数2P =;根据相律,22f C P =+-=;这两个自由度是指温度和压力,即在一定的温度和压力的范围内,能保持固、液两相平衡不发生变化;2 因为3NH (g)与水会发生相互作用,生成32NH H O ⋅,所以物种数3S =,3NH (g),2H O(l)和32NH H O ⋅;有一个形成一水合氨的平衡,故1R =,所以2C =;有气、液两相,2P =;根据相律,22f C P =+-=;这两个自由度是指温度和压力,即在一定的温度和压力的范围内,能维持固、气两相平衡的状态不发生变化;3.3CaCO (s)在高温下分解为CaO(s)和2CO (g),根据相律解释下述实验事实; 1 在一定压力的2CO (g)中,将3CaCO (s)加热,实验证明在加热过程中,在一定的温度范围内3CaCO (s)不会分解;2 在3CaCO (s)的分解过程中,若保持2CO (g)的压力恒定,实验证明达分解平衡时,温度有定值;解:1 该系统中有两个物种,2CO (g)和3CaCO (s),所以物种数2S =;在没有发生反应时,组分数2C =;现在是一个固相和一个气相两相共存,2P =;当2CO (g)的压力有定值时,根据相律,条件自由度*12121f C P =+-=+-=;这个自由度就是温度,即在一定的温度范围内,可维持两相平衡共存不变,所以3CaCO (s)不会分解; 2该系统有三个物种,2CO (g),3CaCO (s)和CaO(s),所以物种数3S =;有一个化学平衡,1R =;没有浓度限制条件,因为产物不在同一个相,故2C =;现在有三相共存两个固相和一个气相,3P =;若保持2CO (g)的压力恒定,条件自由度*12130f C P =+-=+-=;也就是说,在保持2CO (g)的压力恒定时,温度不能发生变化,即3CaCO (s)的分解温度有定值;4.已知固体苯的蒸气压在273 K 时为 k Pa,293 K 时为 k Pa ;液体苯的蒸气压在293 K 时为 k Pa,液体苯的摩尔气化焓为1vap m 34.17 kJ mol H -∆=⋅;试计算1 在303 K 时液体苯的蒸气压,设摩尔气化焓在这个温度区间内是常数;2 苯的摩尔升华焓;3 苯的摩尔熔化焓;解:1 用Clausius-Clapeyron 方程,求出液态苯在303 K 时的蒸气压 解得液体苯在303 K 时的蒸气压2用Clausius-Clapeyron 方程,求出固体苯的摩尔升华焓解得固体苯的摩尔升华焓3苯的摩尔熔化焓等于摩尔升华焓减去摩尔气化焓5.结霜后的早晨冷而干燥,在-5℃,当大气中的水蒸气分压降至 Pa 时,霜会升华变为水蒸气吗 若要使霜不升华,空气中水蒸气的分压要有多大已知水的三相点的温度和压力分别为 K 和611 Pa,水的摩尔气化焓1vap m 45.05 kJ mol H -∆=⋅,冰的摩尔融化焓1fus m 6.01 kJ mol H -∆=⋅;设相变时的摩尔焓变在这个温度区间内是常数;解:冰的摩尔升华焓等于摩尔熔化焓与摩尔气化焓的加和,用Clausius-Clapeyron 方程,计算 K-5℃时冰的饱和蒸气压解得 (268.15K)401.4 Pa p =而 K-5℃时,水蒸气的分压为 Pa,低于霜的水蒸气分压,所以这时霜要升华;当水蒸气分压等于或大于401.4 Pa 时,霜可以存在;6.在平均海拔为4 500 m 的高原上,大气压力只有 kPa;已知压力与温度的关系式为 5 216 K ln(/Pa)25.567p T=-;试计算在这高原上水的沸点; 解:沸点是指水的蒸气压等于外界压力时的温度;现根据压力与温度的关系式,代入压力的数据,计算蒸气压等于 kPa 时的温度,解得: 357 K T =即在海拔为4 500 m 的高原上,水的沸点只有357 K,即84 ℃,这时煮水做饭都要用压力锅才行;7.将3NH (g)加压,然后在冷凝器中用水冷却,即可得液氨,即3NH (l);已知某地区一年中最低水温为2℃,最高水温为37℃,问若要保证该地区的氮肥厂终年都能生产液氨,则所选氨气压缩机的最低压力是多少已知:氨的正常沸点为-33℃,蒸发焓为11 368 J g -⋅,设蒸发焓是与温度无关的常数;解: 氨在正常沸点-33℃240 K 时,它的蒸气压等于大气压力,为 kPa;水温为2℃275 K 时,氨的蒸气压较低,得到液氨没有问题;主要是计算在37℃310K 时氨的蒸气压,这就是压缩机所需的最低压力;已知氨的摩尔蒸发焓为:根据Clausius-Clapeyron 方程,计算310 K 时 氨的蒸气压,;解得: (310K) 1 408.3 kPa p =即在37℃时,压缩机的最低压力必须大于1 408.3 kPa ,才能终年都能生产液氨;8.CO 2的固态和液态的蒸气压与温度的关系式,分别由以下两个方程给出:试计算: 1 二氧化碳三相点的温度和压力;2 二氧化碳在三相点时的熔化焓和熔化熵;解: 1 在三相点时,固态和液态的蒸气压相等,s l p p =,即解得三相点的温度 215.3 K T =代入任意一个蒸气压与温度的方程式,计算三相点时的压力两个结果稍有不同 解得 ()466.7 kPa p =三相点2 根据Clausius-Clapeyron 方程的一般积分式式中'C 是积分常数;对照题中所给的方程,从固体的蒸气压与温度的关系式,可计算得到二氧化碳的摩尔升华焓,从液体的蒸气压与温度的关系式,可计算得到二氧化碳的摩尔蒸发焓,摩尔熔化焓等于摩尔升华焓减去摩尔蒸发焓,9.根据2CO 的相图,回答如下问题;1说出OA ,OB 和OC 三条曲线以及特殊点O 点与A 点的含义;2在常温、常压下,将2CO 高压钢瓶的阀门慢慢打开一点,喷出的2CO 呈什么相态为什么3在常温、常压下,将2CO 高压钢瓶的阀门迅速开大,喷出的2CO 呈什么相态为什么4为什么将2CO (s)称为“干冰”2CO (l)在怎样的温度和压力范围内能存在 解:1OA 线是2CO (l)的饱和蒸气压曲线;OB 线是2CO (s)的饱和蒸气压曲线,也就是升华曲线;OC 线是2CO (s)与2CO (l)的两相平衡曲线;O 点是2CO 的三相平衡共存的点,简称三相点,这时的自由度等于零,温度和压力由系统自定;A 点是2CO 的临界点,这时气-液界面消失,只有一个相;在A 点温度以上,不能用加压的方法将。
物理化学《相平衡》习题及答案

物理化学《相平衡》习题及答案选择题1.二元恒沸混合物的组成(A)固定(B) 随温度而变(C) 随压力而变(D) 无法判断答案:C2.一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4 答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0 答案:B。
此为可逆过程故ΔG=0。
5.以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物 (B) 漂白粉 (C) 大小不一的一堆单斜硫碎粒(D) 墨汁答案:C。
6.NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3 答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7.如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
8.对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统 (B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变 (D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B9.关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点 (B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变 (D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D10.用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1 (B) 在每个单相区, 自由度F=2(C)在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D)在水的沸点曲线上任一点,压力随温度的变化率都小于零。
物理化学6相平衡资料
水的相图
p / Pa
C
水f
A
冰
P
610.62 D O
q
B
水蒸气
OC 是液-固两相平衡线
273.16
TC T / K
• OC线不能任意延长:当C点延长至压力大于2.07×108Pa时, 相图变得复杂,有不同结构的冰生成。
OA,OB,OC线 p / Pa 的斜率都可以用克-
E
超 临
C
水
界 水
F
A
f
克方程或克拉佩龙方
例如:对于没有气相存在的凝聚系统,可以忽略压力
f * f 1
多相系统平衡的一般条件――吉布斯相律
对具有 个相系统的热力学平衡,实际上包
含了如下四个平衡: (1) 热平衡
(2) 力学平衡 (3) 相平衡
(4) 化学平衡
某平衡系统中有 S 种不同的化学物种,有 个
相,需要多少独立强度变量(f)才能确定系统的状 态?
物种数(S):系统中存在的化学物种数。 组分数(K):构成平衡系统所需的最少物种数。
K=S- R- R′
R表示独立的化学反应数, R′表示独立的浓度限 制条件数。物质在不同相之间保持一定的数量关 系,不能算作浓度限制条件。
平衡系统 NH4Cl (s) =NH3 (g) + HCl (g)中, S = 3, R = 1, R′= 1,K=1
K=S- R- R′=5- 0- 1=4
若考虑可能析出固体,以K+、Na+、 SO42-、NO3-、H2O和K2SO4、Na2SO4、 KNO3、NaNO3为对象 S=9 R=4,4个独立的化学平衡 R′=1,溶液保持电中性
K=S- R- R′=9- 4- 1=4
物理化学《相平衡》习题及答案

物理化学《相平衡》习题及答案选择题1.二元恒沸混合物的组成(A)固定(B) 随温度而变(C) 随压力而变(D) 无法判断答案:C2.一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4 答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0 答案:B。
此为可逆过程故ΔG=0。
5.以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物 (B) 漂白粉 (C) 大小不一的一堆单斜硫碎粒(D) 墨汁答案:C。
6.NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3 答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7.如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
8.对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统 (B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变 (D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B9.关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点 (B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变 (D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D10.用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1 (B) 在每个单相区, 自由度F=2(C)在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D)在水的沸点曲线上任一点,压力随温度的变化率都小于零。
物理化学《相平衡》习题及参考答案

物理化学《相平衡》习题及答案2-3 选择题1、水煤气发生炉中共有)()()()(22g CO g CO g O H s C 、、、及)(2g H 5种物质,它们能发生下述反应:)(2)()(2g CO s C g CO ⇒+,)()()()(222g O H g CO g H g CO +⇒+,)()()()(22g CO g H s C g O H +⇒+,则此体系的组分数、自由度为( C )A.5、3B.4、3C.3、3D.2、22、物质A 与B 可形成低共沸混合物E ,已知纯A 的沸点小于纯B 的沸点,若将任意比例的A+B 混合在一个精馏塔中精馏,则塔顶的馏出物是( C )A.纯AB.纯BC.低共沸混合物D.都有可能3、克拉贝隆-克劳修斯方程适用于( C )A.)()(22g I s I ⇔B.)()(金刚石石墨C C ⇔C.),,(),,(222112p T g I p T g I ⇔D.)()(22l I s I ⇔4、将一透明容器抽成真空,放入固体碘,当温度为50℃时,可见到明显的碘升华现象,有紫色气体出现。
若温度维持不变,向容器中充入氧气使之压力达到100kPa 时,将看到容器中( C )A.紫色变深B.紫色变浅C.颜色不变D.有液态碘出现5、在一定温度下,水在其饱和蒸汽压下汽化,下列各函数增量中那一项为零( D )A.U ∆B.H ∆C.S ∆D.G ∆6、在一定外压下,多组分体系的沸点( D )A.有恒定值B.随组分而变化C.随浓度而变化D.随组分及浓度而变化7、压力升高时,单组份体系的沸点将( A )A.升高B.降低C.不变D.不一定8、进行水蒸气蒸馏的必要条件是( A )A.两种液体互不相容B.两种液体蒸汽压都较大C.外压小于101kPaD.两种液体的沸点相近9、液体A 与液体B 不相混溶。
在一定温度T ,当有B 存在时,液体A 的蒸汽压为( B )A.与体系中A 的摩尔分数成比例B.等于T 温度下纯A 的蒸汽压C.大于T 温度下纯A 的蒸汽压D.与T 温度下纯B 的蒸汽压之和等于体系的总压力10、氢气和石墨粉在没有催化剂时,在一定温度下不发生化学反应,体系的组分数是( A )A.2B.3C.4D.511、上述体系中,有催化剂存在时可生成n 种碳氢化合物,平衡是组分数为( A )A.2B.4C.n+2D.n12、相率适用于( D )A.封闭体系B.敞开体系C.非平衡敞开体系D.以达到平衡的多向敞开体系13、某物质在某溶剂中的溶解度( C )A.仅是温度的函数B.仅是压力的函数C.同是温度和压力的函数D.除了温度压力以外,还是其他因素的函数14、在实验室的敞口容器中装有单组份液体,对其不断加热,则看到( A )A.沸腾现象B.三项共存现象C.临界现象D.生化现象15、相图与相率之间的关系是( B )A.相图由相率推导得出B.相图由实验结果绘制得出,不能违背相率C.相图决定相率D.相图由实验结果绘制得出,与相率无关16、下述说法中错误的是( C )A.通过相图可确定一定条件下体系由几相构成B.相图可表示出平衡时每一相的组成如何C.相图可表示达到相平衡所需时间的长短D.通过杠杆规则可在相图上计算各相的相对含量17、三组分体系的最大自由度及平衡共存的最大相数为( D )A.3;3B.3;4C.4;4D.4;518、定容条件下)(4s HS NH 的分解压力为1θp 时,反应)()()(234g S H g NH s HS NH +⇔的标准平衡常数是( C )A.1B.1/2C.1/4D.1/819、水的三相点附近其蒸发热为44.821-⋅mol kJ ,熔化热为5.991-⋅mol kJ ,则在三相点附近冰的升华热约为( B )A.38.831-⋅mol kJB.50.811-⋅mol kJC.-38.831-⋅mol kJD.-50.811-⋅mol kJ20、在相图上,当物系点处于哪一点时,只存在一个相( C )A.恒沸点B.熔点C.临界点D.最低共沸点21、具有最低恒沸温度的某两组份体系,在其T-x 相图的最低点有( A )A.l g x x f ==;0B.l g x x f ==;1C.l g x x f >=;0D.l g x x f >=;122、80℃时纯苯的蒸汽压为0.991θp ,纯甲苯的蒸汽压为0.382θp ,若有苯-甲苯气、液平衡混合物在80℃时气相中苯的摩尔分数为30.0=苯y 则液相组成苯x 接近于( D )A.0.85B.0.65C.0.35 D0.1423、体系处于标准状态时,能与水蒸气共存的盐可能是: CA. Na 2CO 3B. Na 2CO 3 Na 2CO 3•H 2O Na 2CO 3•7H 2OC. Na 2CO 3 Na 2CO 3•H 2OD. 以上全否24.一个水溶液共有S 种溶质,相互之间无化学反应。
物理化学课后答案 第六章 相平衡

第六章相平衡6.1指出下列平衡系统中的组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;(3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;(4)取任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1.(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2.(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2.6.2已知液体甲苯(A)和液体苯(B)在90 C时的饱和蒸气压分别为=和。
两者可形成理想液态混合物。
今有系统组成为的甲苯-苯混合物5 mol,在90 C下成气-液两相平衡,若气相组成为求:(1)平衡时液相组成及系统的压力p。
(2)平衡时气、液两相的物质的量解:(1)对于理想液态混合物,每个组分服从Raoult定律,因此(2)系统代表点,根据杠杆原理6.3单组分系统的相图示意如右图。
试用相律分析途中各点、线、面的相平衡关系及自由度。
解:单相区已标于图上。
二相线(F = 1):三相点(F = 0):图中虚线表示介稳态。
6.4已知甲苯、苯在90 ︒C下纯液体的饱和蒸气压分别为54.22 kPa和136.12 kPa。
两者可形成理想液态混合物。
取200.0 g甲苯和200.0 g苯置于带活塞的导热容器中,始态为一定压力下90 ︒C的液态混合物。
物理化学第六章课后答案完整版

第六章相平衡6.1(1)(2)(3)(4)(5)解:指出下列平衡系统中的组分数G相数P及自由度尸。
島(S)与其蒸气成平衡;CaC03 (s)与其分解产物CaO (s)和C02 (g)成平衡;NHJIS (s)放入一抽空的容器中,并与其分解产物NH$ (g)和H2S (g)成平衡;取任意量的NH, (g)和泾(g)与NH<HS (s)成平衡。
L作为溶质在两不互溶液体氏0和CCh中达到分配平衡(凝聚系统)。
(1) C=1,P = 2,F = C - P+2=l-2 + 2= 1・(2) C = 3- l = 2,P = 3,F = C- P + 2 = 2 ・3 + 2= 1・(3) C = 3- l- l = l,P=2,F = C- P + 2= l- 2 + 2=l.(4) C = 3- l = 2,P = 2,F = C- P + 2 = 2- 2 + 2 = 2.(5) C = 3,P = 2,F = C- P+ l= 3- 2+ l = 2・6.2已知液体甲苯(A)和液体苯(B)在90°C时的饱和蒸气压分别为卩;二54-22kPa和讥二l36.12kPa。
两者可形成理想液态混合物。
今有系统组成为So二的甲苯 -苯混合物5 mol,在90 °C下成气-液两相平衡,若气相组成为沟二°4%6求:(1)平衡时液相组成忑及系统的压力a(2)平衡时气、液两相的物质的量从8丄皿)解:(1)对于理想液态混合物,每个组分服从拉乌尔定律,因此"兀2;+恶卩;卫;十&; ■ pix0.4556X54.22珑■◎訂加為136J2- (136.12- 54.22>0.4556P = “; + 裨;=0.75X54.22+ 0.25X136.12= 74.70 kPa(2)系统代表点花。
二°6根据杠杆原理(y B.g一U H = (m一m )叫n l +— = 0.5(0.4556 —0.3”. = (0.3-0.25 Xii K = 1.216/?/<?/ n t =3.784加o/6.3 单组分系统的相图示意如右图。
化学工业出版社物理化学答案第6章 相平衡

第六章相平衡思考题解答1、答:可能平衡。
相平衡的条件是任一组分在各相的化学势相等。
2、答:不等于零,约为水的饱和蒸气压。
3、答:不变,因为根据相律有:F=C-P+2=1,即蒸气压只是温度的函数。
4、答:是两相,因为二者的物理性质不同。
5、答:是两相,因为从微观的角度来看,粒子之间仍存在界面。
6、答:是一相,因为形成了固溶体(合金)。
7、答:都等于1。
因为C=S-R-R’=3-1-1=1。
8、答:在冰点的自由度不为零。
对于单组分体系C=1,F+P=3,冰点时P=2,故F=1。
9、答:有液体。
根据其相图可知液态存在的条件是T:216.6~304.3K;P:5.11~73pθ。
10、答:是的,此时是三相平衡。
习题解答1. 解:① C=5,P=4,F=3 ② C=5,P=2,F=5 ③ C=2,P=1,F=2 ④ C=2,P=2,F=2 ⑤ C=3,P=2,F=3 2. 解:因甲苯和苯形成理想液态混合物,故两者蒸气分压均可以用拉乌尔定律进行计算。
(1)原来系统为液态,当开始出现气相时,其量极少,可以认为液相组成不变,此时系统的压力p :B A p p p +=B B A A x p x p p ∗∗+=,而1=+B A x x ,联解、整理可得)1(A B A A x p x p p −+=∗∗设甲苯为A ,苯为B ,则459.0)114.78(0.200)078.92(0.200)078.92(0.200)()(111=⋅+⋅⋅=+=−−−mol g g mol g g mol g g M m M m M m x B B A AA A A所以,p=54.22kP a×0.459+136.12kP a×(1-0.459)=98.53kPa 又253.053.98/459.022.54//=×===∗kPa kPa p x p p p y A A A A 故747.0253.011=−=−=A B y y(2)压力降低,液体不断气化,当压力降至某一数值时,则系统内产生极小的一液滴,此时气相组成与未气化前的液体组成相同,即y A =0.459。
物理化学6 相平衡

例 根据条件,确定以下平衡系统中的组分数
H 2 (g) I 2 (g) 2HI(g)
(1)反应前只有HI;
(2)反应前有等物质量的H2和I2;
(3)反应前有任意量的HI、 H2和I2。 解: (1)K=S- R- R′=3- 1- 1=1; (2) K=S- R- R′=3- 1- 1=1 ;
定T,以P为纵坐标,气相组成和液相组成为横坐标, 作 p—x图,叫作蒸气压—组成图。 理想二元混合溶液(xA与xB为溶液中两组分的物质的量分数):
* pA pA xA
pA与xB呈线性关系 pB与xB呈线性关系
p pA*
pB*
* pB pB xB
* * * p pA pB pA ( pB pA ) xB
B
273.16
水蒸气
C
T T /K • 在线上, = 2, f =1 • 压力与温度只能改变一个,指定了压力,则温度由系统自
定,反之亦然。
(3)O点是三相点,冰、水、水蒸气三相共存
• 气-液-固三相共存
• = 3, f =0
p / Pa
C
水的相图
水
A
f
OA是气-液两相平衡线 即水的蒸气压曲线
Φ =2 f =K- Φ+2=1-2+2=1
例
教材143页,习题1: 一种含有K+、Na+、SO42-、NO3-的水溶液系统,其 组分数是多少?在某温度和压力下,此系统最多能有几 相平衡?
解:
以K+、Na+、SO42-、NO3-、H2O 为对象 S=5, K+、Na+、SO42-、NO3-、H2O R=0,没有化学反应(平衡) R′=1,溶液保持电中性 K=S- R- R′=5- 0- 1=4
物理化学答案 第六章 相平衡

第六章相平衡6.1 指出下列平衡系统中的组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;(3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;(4)取任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1.(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2.(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2.6.2 已知液体甲苯(A)和液体苯(B)在90 °C时的饱和蒸气压分别为=和。
两者可形成理想液态混合物。
今有系统组成为的甲苯-苯混合物5 mol,在90 °C下成气-液两相平衡,若气相组成为求:(1)平衡时液相组成及系统的压力p。
(2)平衡时气、液两相的物质的量解:(1)对于理想液态混合物,每个组分服从Raoult定律,因此(2)系统代表点,根据杠杆原理6.3 单组分系统的相图示意如右图。
试用相律分析途中各点、线、面的相平衡关系及自由度。
解:单相区已标于图上。
二相线(F = 1):三相点(F = 0):图中虚线表示介稳态。
6.4 已知甲苯、苯在90 °C下纯液体的饱和蒸气压分别为54.22 kPa和136.12 kPa。
两者可形成理想液态混合物。
取200.0 g甲苯和200.0 g苯置于带活塞的导热容器中,始态为一定压力下90 °C的液态混合物。
物理化学课后习题第六章答案

第六章相平衡6、1指出下列平衡系统中得组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)与CO2(g)成平衡;(3)NH4HS(s)放入一抽空得容器中,并与其分解产物NH3(g)与H2S(g)成平衡;(4)取任意量得NH3(g)与H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O与CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1、(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1、(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 –2 + 2 = 1、(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2、(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2、6、2 常见得Na2CO3(s)水合物有Na2CO3∙H2O(s),Na2CO3∙7H2O(s)与Na2CO3∙10H2O(s)、(1)101、325kPa下,与Na2CO3水溶液及冰平衡共存得水合物最多能有几种?(2)20℃时,与水蒸气平衡得水合物最多可能有几种?解:(1)C = S – R R' = 2 – 0 – 0 =2F = C–P + 1 =2 –P + 1= 3 – P ≥0, 即P2≤1,那么能与Na2CO3水溶液及冰平衡共存得水合物最多只有一种。
(2)C = S – R R' = 2 – 0 – 0 =2F = C–P + 1 =2 –P + 1= 3 – P ≥0,即P1≤2,那么与水蒸气平衡得水合物最多可能有两种。
6、4 单组分系统碳得想吐(示意图)如附图所示。
(1)分析图中各点、线、面得相平衡关系及自由度数;(2)25℃,101、325kPa下,碳以什么状态稳定存在?(3)增加压力可以使石墨转换为金刚石。
物理化学课件及考试习题试卷答案第6章相平衡习题及解答

物理化学课件及考试习题试卷答案第6章相平衡习题及解答第五章相平衡⼀、填空题1、⼀定温度下,蔗糖⽔溶液与纯⽔达到渗透平衡时的⾃由度数等于__________。
2、纯物质在⼀定温度下两相共存时的⾃由度数等于__________。
3、NaCl(S)和含有稀盐酸的NaCl 饱和⽔溶液的平衡系统,其独⽴组分数是_______。
4、设下列化学反应同时共存时并达到平衡(900-1200K ):()()()g CO s CaO s CaCO 23+=()()()()g O H g CO g H g CO 222+=+()()()g H s CaCO s CaO g CO g O H 232)()(+=++则该系统的⾃由度数为______。
5、含KNO 3和NaCl 的⽔溶液与纯⽔达到渗透平衡时,其组分数为____,相数为___,⾃由度数为____。
6、在氢和⽯墨的系统中,加⼀催化剂,H 2和⽯墨反应⽣成n 种碳氢化合物,此系统的独⽴组分数为______。
7、完全互溶的双液系中,在x B =0.6处,平衡蒸⽓压有最⾼值,那么组成为x B =0.4的溶液在⽓液平衡时,x B (g )、x B (l )、x B (总)的⼤⼩顺序为______。
将x B =0.4的溶液进⾏精馏时,塔顶将得到______。
8、对于渗透平衡系统,相律的形式应写成______。
9、NH 4Cl 固体分解达到平衡时,())()(s Cl NH 34g NH g HCl +=,系统的独⽴组分数为___,⾃由度为___。
10、将AlCl 3溶于⽔中,全部⽔解,⽣成Al(OH)3沉淀,此系统⾃由度数f=____。
11、已知100o C 时⽔的饱和蒸⽓压为101.325KPa,⽤公式_________可求出25o C 时⽔的饱和蒸⽓压。
答案1、22、03、24、35、3;2:46、27、x B (g )>x B (总)>x B (l ) x B =0.6恒沸混合物 8、3+Φ-=k f 9、1;1 10、2 11、-?=211211lnT T RH p p m1、右图为H 2OA.-(NH 4)2SO 4B.的沸点-组成图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章 相平衡一、填空题1、一定温度下,蔗糖水溶液与纯水达到渗透平衡时的自由度数等于__________。
2、纯物质在一定温度下两相共存时的自由度数等于__________。
3、NaCl(S)和含有稀盐酸的NaCl 饱和水溶液的平衡系统,其独立组分数是_______。
4、设下列化学反应同时共存时并达到平衡(900-1200K ):()()()g CO s CaO s CaCO 23+= ()()()()g O H g CO g H g CO 222+=+()()()g H s CaCO s CaO g CO g O H 232)()(+=++则该系统的自由度数为______。
5、含KNO 3和NaCl 的水溶液与纯水达到渗透平衡时,其组分数为____,相数为___, 自由度数为____。
6、在氢和石墨的系统中,加一催化剂,H 2和石墨反应生成n 种碳氢化合物,此系统的独立 组分数为______。
7、完全互溶的双液系中,在x B =0.6处,平衡蒸气压有最高值,那么组成为x B =0.4的溶液在 气液平衡时,x B (g )、x B (l )、x B (总)的大小顺序为______。
将x B =0.4的溶液进行 精馏时,塔顶将得到______。
8、对于渗透平衡系统,相律的形式应写成______。
9、NH 4Cl 固体分解达到平衡时,())()(s Cl NH 34g NH g HCl +=,系统的独立组分数为___,自由度为___。
10、将AlCl 3溶于水中,全部水解,生成Al(OH)3沉淀,此系统自由度数f=____。
11、已知100o C 时水的饱和蒸气压为101.325KPa,用公式_________可求出25o C 时 水的饱和蒸气压。
答案1、22、03、24、35、3;2:46、27、x B (g )>x B (总)>x B (l ) x B =0.6恒沸混合物 8、3+Φ-=k f 9、1;1 10、2 11、⎪⎪⎭⎫⎝⎛-∆=211211lnT T RH p p mr二、单选题1、右图为H 2OA.-(NH 4)2SO 4B.的沸点-组成图。
如何从w B =0.4 的溶液中提取较多的精制(NH 4)2SO 4固体?( ) A.降温至-18.3℃以下 B.在密闭容器中平衡蒸发 C.在敞开容器中定温蒸发 再降温至-18.3℃以上 D.先蒸发一部分水份,再 降温至-18.3℃以下2、如右图所示,当水处在三相点平衡时,若系统发生绝热膨胀,水的相态将如何变化? ( )A.气相、固相消失,全部变成液态;B.气相、液相消失,全部变成固态;C.液相消失,固相、气相共存;D.固相消失,液相、气相共存3、对简单低共熔体系,在最低共熔点,当温度继续下 降时,体系存在( )A.一相B.二相C.一相或二相D.三相4、已知纯A 和纯B 的饱和蒸气压p A *<p B *,且A 和B 所组成的体系具有最高恒沸点。
向A中不断加入B,则溶液的蒸气压( )A.不断增大B.不断减小C.先增大后减小D.先减小后增大5、在描述恒沸混合物时,下列各点何者不对?( )A. 恒沸点f*=0,定压下是一个无变量点B. 不具有明确的组成C. 平衡时气相和液相组成相同D. 恒沸点随压力改变而改变6、乙知某混合物的最低共熔点的组成为含B40%。
含B为20%的A、B混合物降温至最低共熔点时,此时析出的固体为( )A.固体AB.固体BC.最低共熔混合物D.组成小于40%的A、B固体混合物7、部分互溶双液系,一定温度下若出现两相平衡,则( )A.体系的组成一定B.两相的组成与体系的总组成无关。
且两相的量之比为常数C.两相的组成与体系的总组成关有。
且两相质量分数之比为常数D.两相的组成不定8、恒沸混合物( )A.气液两相的量相同B.气液两相中某种组分B的物质的量相同C.气液两相的组成相同D.气液两相的组成相同,在P-X图和在T-X图上均为同一值9、右图中PQ线上( )A.f*=0B.f*=1C.A和B不互溶D.A和B完全互溶10、在双组分体系P-X图上,若蒸气压-组成曲线对拉乌尔定律产生很大的负偏差,有一极小点,则( )A.叫最低恒沸混合物B.叫最高恒沸混合物C.所对应的组成在任何情况下都不发生变化D.在该点气液两相的量相同11、在有低共熔点存在的体系,若步冷曲线上出现平台,此时,体系存在的相数( )A.1B.2C.3D.2或312、能否从含80%的Bi-Cd混合物中分离出纯Cd?( )A.能完全分离,得到纯CdB.能部分分离,得到纯CdC.不能分离,得不到纯CdD.仅通过加热的方法便可得到一部分纯Cd13、在双组分体系T-X图上,若有一极小点,则该点( )A.叫最低恒沸混合物B.叫最高恒沸混合物C.所对应的组成在任何情况下都不发生变化D.在该点气液两相的量相同14、定压下,在最低共熔点,系统存在( )A.一相B.二相C.三相D.四相15、下图为气液平衡相图,图中M点( )A.代表压力为p1时气相的组成时液相的组成B.代表压力为pC.是压力为p1时气相中物质B的物质的量D.是压力为p1时液相中物质B的量16、已知苯的lgp~1/T的图中,其直线斜率为-1.767×103,则苯的摩尔蒸发热为( )A.33.83J·mol-1B.33.83kJ·mol-1C.14.29 J·mol-1D.14.29kJ·mol-117、下图为气液平衡相图,图中M点( )A.代表温度为T1时气相的组成B.代表温度为T1时液相的组成C.是温度为T1时气相中物质B的物质的量D.是温度为T1时液相中物质B的物质的量18、若A、B二组分形成三种稳定化合物,则当A-B的溶液冷却时,最多可同时析出( )A.一个固相B.二个固相C.三个固相D.四个固相19、当水处在三相点而平衡时,突然增大压力,水的相态将如何变化?( )A.气相、固相消失,全部变成液态B.气相、液相消失,全部变成固相C.液相、固相消失,全部变成气态D.固相消失,气液两相共存20、如下图所示,在相合熔点,形成的化合物的步冷曲线上出现( )A.拐点B.平台C.无拐点和平台D.一个拐点两个平台21、如右图所示,在ABC相区内,当温度一定时,两相的组成( )A.一定B.不一定C.决定于系统的总组成D.相同。
22、右图中,气液两相组成相同的点为( )A.A、B点B.C点C.A、B、C点D.气相线和液相线上各点23、若步冷曲线出现平台,此时体系的条件自由度数为( )A.0B.1C.2D.324、在101325Pa压力下,冰与被空气饱和了的水成平衡的温度叫( )A.凝固点B.冰点C.三相点D.露点25、右图中,自由度都为零的全部的点为( )A.J、E1、C、E2、KB.M、E1、N、O、E2、PC.MN线、OP线(端点除外)上各点及J、C、KD.MN线、OP线(包含端点)上各点及J、C、K26、由下图可看出,将x=0.8的CH3COOC2H5A.和C2H5OHB.组成的溶液进行分馏,则能得到( )A.纯CH3COOC2H5B.最低恒沸混合物和纯CH3COOC2H5C.最低恒沸混合物和纯C2H5OHD.纯C2H5OH和CH3COOC2H527、在下图中,将组成为x的溶液进行蒸馏时,最初馏出液的组成为( )A.aB.bC.cD.d28、当下图中,w B=0.2时,下列叙述中不正确的是( )A.溶液降温至0℃以下,可得到纯固体H2OB.溶液降温至-18.3℃时,溶液的组成为定值O先熔C.固体混合物升温至-18.3℃时,固体H化,B后熔化D.固体混合物升温至-18.3℃时,固体H2O和B同时开始熔化,至全部熔化后,温度又继续上升29、对右图描述正确的是( )A.MN线上各点,系统存在三相平衡B.M、N点,体系存在两相平衡C. E1、E2点体系存在两相平衡D.J、C、K点体系存在两相平衡30、两相平衡的标志是( )A.p(α)=p(β)B.T(α)=T(β)C.μi(α)=μi(β)D.x i(α)+ x i(β)=131、在水的p-T相图中,H2O(l)的蒸气压曲线代表的是( )A.Φ=1,f=2B.Φ=2,f=1C.Φ=3;f=0D.Φ=2,f=232、在不考虑重力场、电磁场等外界因素时,定温定压下,相律的表达式为( )A.f=K-ΦB.f=K-Φ+1C.f=K-Φ+2D.f=K-Φ-233、克-克方程的准确表示式为( )A.dp·dT=ΔS m/ΔV mB.dp/dT=ΔH m/(TΔV m)C.dlnp/dT=pΔH m/(RT2)D.dlnp/dT=ΔH m/(RT2)34、克拉佩龙方程表明( )A.两相平衡时的平衡压力随温度而变化的变化率B.任意状态下压力随温度的变化率C.它适用于任何物质的两相平衡D.以上说法都不对35、下列体系中哪一个是均相体系( )A.水雾和水蒸气混合在一起;B.乳状液C.水和被水饱和的空气D.两种不同的金属形成的固熔体答案三、多选题1、具有最高恒沸点的二组分完全双液系统( )A.溶液的蒸气压对拉乌尔定律产生正偏差B.溶液的蒸气压对拉乌尔定律产生负偏差C.溶液中的各组分对拉乌尔定律产生较大的偏差D.P-X图上具有极大点E.P-X图上具有极小2、在双组分体系p-X图上,若蒸气压-组成曲线对拉乌尔定律产生很大的正偏差,有一极大点,则该体系( )A.叫最低恒沸混合物B.叫最高恒沸混合物C.所对应的组成是唯一不变的D.在该点气液两相的组成相同E.在该点气液两相的量相同3、右图为H2OA.-(NH4)2SO4B.的沸点-组成图。
如何从w B=0.2 的溶液中题取较多的(NH4)2SO4固体?( )A.降温至-18.3℃以下B.在密闭容器中平衡蒸发C.在敞开容器中定温蒸发D.蒸发掉一部分水份,待溶液出现结晶时,再铰温至-18.3℃以上E.先蒸发掉一部份水份,待溶液很浓时,再降温至0℃以下4、0℃时冰的熔化热为6008J·mol-1。
在该温度下冰的摩尔体积为19.625cm3·mol-1,液态水的摩尔体积为18.018cm3·mol-1,则压力对于熔点的关系是( )A.压力增大,熔点升高B.压力增大101325Pa时的冰的熔点升高0.00753KC.压力增大,冰的熔点降低D.压力增大101325Pa时冰的熔点降低0.00753KE.压力增大101325Pa,冰的熔点不变5、在下图中,Q点( )A.为相点B.为物系点C.所代表的体系是由a点的液相和b点的气相所组成D.所表示的体系的组成为两相的组成a和b的总和E.确定后,一定温度下,两相的质量之比为常数6、下图为CO2的相图,把钢瓶中的液体CO2在空气中喷出的瞬间( )A.大部分成为气体B.全部成为气体C.全部成为固体D.有少部分液体存在E.无液体存在7、确切地说,稳定化合物是指该化合物( )A. 在加热过程中不易分解B. 熔点高C. 熔点较分解温度高D. 熔化时液相与固相有相同的组成E. 具有相合熔点8、当水处在三相点平衡时,系统发生绝热膨胀,温度降低0.1K,水的相态将如何变化?( )A.相数减少B.相数增加C.自由度数减少D.自由度数增加E.气相消失,液相、固相共存9、下图是一个不完全的相图,估计一下A和B要形成( )A.一种稳定化和物B.二种稳定化合物C.一种最低共熔混合物D.三种最低共熔混合物E.一种最低恒沸混合物10、当水处在三相点处,系统发生绝热压缩,温度改变0.1K,水的相态将如何变化( )A.变为一相B.变为两相共存C.液相消失D.压力会升高或降低E.固相消失11、关于步冷曲线的下述说法中,何者不妥( )A.步冷曲线出现转折,意味着有相变B.只有步冷曲线上出现平台时,才意味着系统中有相变C.步冷曲线上出现转折时,系统的条件自由度f*=0D.步冷曲线上出现平台时,条件自由度f*将减小E.步冷曲线上出现拐点时,条件自由度f*将减小12、在二组分双液T-x(或p-x)相图中,状态点由单相区进入两相区时,体系的自由度数( )A. 增加B. 减少C. f* =0D. f* =1E. f* =213、如右图所示,C点叫临界溶解温度。
