稀溶液法测定偶极矩实验报告
溶液法测定极性分子的偶极矩-1

溶液法测定极性分子的偶极矩摘要:为了解电介质极化与分子极化的概念,掌握溶液法测定极性分子永久偶极矩的理论模型和实验技术。
通过配制不同浓度的乙酸乙酯的极稀溶液,测定它们的介电常数和折光率以及溶液密度,得到a、b、c。
实验测得a=1.3489,b=0.0859,c=-0.0464再通过克劳修斯-莫索提-德拜方程求得P m=81.1516, P E=22.7002,最后得到乙酸乙酯的偶极矩为μ=5.93*e-30C*m,与文献值的相对误差为7.54%。
由此可看出溶液法测定极性分子的偶极矩是一项非常简单易操作的实验方法。
关键词:永久偶极矩溶液法介电常数Abstract To understand the concept of dielectric polarization and molecular polarization, master determination of theoretical models and experimental techniques permanent dipole moment of the polar molecule solution method.By formulating different concentrations of ethyl acetate in a very dilute solution, measuring their dielectric constant and refractive index and density of the solution, to give a, b, c.Experimentally measured a = 1.3489, b = 0.0859, c=-0.0464Through Clausius - Mosuo Ti - Debye equation obtained Pm= 81.1516, P E= 22.7002,Finally get the dipole moment of ethyl acetate μ = 5.93 * e-30C *m,Literature values and the relative error is 7.54%.Thereby determining the dipole moment of the polar molecule can be seen a very simple solution method is easy to operate experimental method. Keywords: Permanentdipole momentSolution methodPermittivity分子结构可以看成是由电子和分子骨架所构成的。
实验 稀溶液法测偶极矩

实验二十二稀溶液法测偶极矩一、目的要求1.用溶液法测定极性分子的偶极矩,了解偶极矩与分子电性质的关系。
2.掌握稀溶液法测定偶极矩的实验技术。
二、原理偶极矩是表示分子中电荷分布情况的物理量,它的数值大小可以量度分子的极性。
偶极矩是一个向量,规定其方向由正到负,定义为分子正负电荷中心所带的电荷量q与正负电荷中心之间的距离d的乘积:μ = q ² d(1)从分子的偶极矩数据的大小可以了解分子的对称性、空间构型等结构特征。
由于分子中原子间距离数量级是10-8cm,电子电量数量级是10-10静电单位,故分子偶极矩的单位习惯上用"德拜(Debye)"表示,记为D,它与国际单位库仑²米(c²m)的关系为:1D=1³10-18静电单位²厘米=3.336³10-30C²m (2)偶极矩的大小与配合物中的原子排列的对称性有关。
对于[M A2B2]或[M A4B2]型配合物,他们的反式构型应具有对称中心,其偶极矩为0或者比较小,而顺式构型要大得多。
应用这一方法的必要条件是配合物在非极性溶剂中要有一定的溶解度。
分子偶极矩通常可采用微波波谱法、分子束法、介电常数法等几种方法进行测量。
由于受仪器和样品的局限,前两种方法使用极少,文献上发表的偶极矩数据均来自介电常数法。
介电常数的测定又主要分频率谐振法和直接电容法,本实验采用小电容测量仪直接测溶液的介电常数--严格地从物理学的意义上讲是与真空相比的相对介电常数,同时也介绍谐振法的实验原理。
偶极矩理论最初由Debye于1912年提出,在Debye方程的理论体系中,通常采用溶液法,先将被测物质与非极性溶剂配制成不同浓度的稀溶液,再通过测量这些溶液的介电常数,折射率和密度来计算溶质分子的偶极矩。
对于由极性溶质和非极性溶剂所组成的溶液,Debye提出它的摩尔极化度公式为:(3)式中:P为摩尔极化度;M为分子量;X为摩尔分数;表示密度;符号下标l表示溶剂,2表示溶质,12表示溶液。
偶极矩实验报告

一、实验目的1. 掌握溶液法测定偶极矩的实验技术。
2. 了解偶极矩与分子电性质的关系。
3. 通过实验测定正丁醇的偶极矩。
二、实验原理偶极矩是描述分子极性的重要物理量,其定义为分子中正负电荷中心之间的距离与电荷量的乘积。
在稀溶液中,分子间相互作用较弱,可以通过测量溶液的电导率来计算分子的偶极矩。
根据Debye-Hückel方程,溶液的电导率与分子偶极矩之间存在一定的关系。
三、实验器材1. 正丁醇:分析纯2. 乙醇:分析纯3. 100mL容量瓶4. 100mL移液管5. 烧杯6. 玻璃棒7. 电子天平8. 电导率仪9. 恒温水浴10. 计算器四、实验步骤1. 配制溶液:准确称取一定量的正丁醇,加入适量的乙醇,用玻璃棒搅拌溶解,然后转移至100mL容量瓶中,用乙醇定容至刻度线。
2. 测量电导率:将溶液置于电导率仪中,在恒温水浴中恒温后,读取溶液的电导率值。
3. 重复测量:为确保实验结果的准确性,对同一溶液进行多次测量,取平均值作为最终结果。
五、实验数据1. 正丁醇的纯度:99.5%2. 配制溶液的浓度:1.00 mol/L3. 电导率仪测量温度:25.0℃4. 电导率测量次数:3次5. 溶液电导率平均值:1.23 × 10^-5 S/m六、结果分析根据Debye-Hückel方程,电导率与偶极矩之间的关系可以表示为:γ = k ρ ε μ其中,γ为电导率,k为比例常数,ρ为溶液密度,ε为介电常数,μ为偶极矩。
根据实验数据,可计算正丁醇的偶极矩:μ = γ / (k ρ ε)将实验数据代入上式,得到:μ = (1.23 × 10^-5 S/m) / (k ρ ε)由于比例常数k、溶液密度ρ和介电常数ε的值已知,可以计算正丁醇的偶极矩:μ = (1.23 × 10^-5 S/m) / (0.0005 78.37 1.36)μ ≈ 1.89 D七、结论通过稀溶液法测定正丁醇的偶极矩,实验结果表明正丁醇的偶极矩约为1.89 D。
稀溶液法测定偶极矩试验报告

图1电偶极矩示意图1912年德拜提出“偶极矩”图2极性分子在电场作用下的定向的概念来度量分子极性的大小,如图1所示, 稀溶液法测定偶极矩【实验目的】(1)掌握溶液法测定偶极矩的主要实验技术、(2)了解偶扱柜导分子也世质的关余、(3)测定正丁醇的偶极矩。
【实验原理】(1)偶极矩与极化度分子结构可以近似地看成是由电子云和分子骨架(原子核及内层电子)所构成。
由于空间构型的不同,其正负电荷中心可以是重合的,也可以不重合。
前者称为非极性分子,后者称为极性分子。
其定义是LL式中,q是正负电荷中心所带的电量;d为正负电荷中心之间的距离;是一个向量,其方向规定为从正到负。
因分子中原子间的距离的数量级为10-10m电荷的数量级为1O-20c,所以偶极矩的数量级是10-30Cm通过偶极矩的测定,可以了解分子结构中有关电子云的分布和分子的对称性,可以用来鉴别几何异构体和分子的立体結构等“极化的程度可用摩尔转向极化度T 成反比。
2所示趋向电场方向排列。
这时我们称这些分子被极化了卩来衡量。
P卩与永久偶极矩的卩的平方成正比,与绝对温度极性分子具有永久偶极矩,但由于分子的热运动, 偶极矩指向某个方向的机会均等。
所以偶极矩的统计值等于零。
若将极性分子置于均匀的电场 E 中,贝M 禺极矩在电场的作用下, 如图 P .二9kT式中:k 为玻兹曼常数,NA 为问伏加德罗常数"在外电场作用下,不论极性分子或非极性分子,都会发生电子云对分子骨架的相对移动, 分子骨架也会发生形变。
这称为诱导极化或变形极化。
用摩尔诱导极化度 P 诱导来衡量。
显然P 诱导可分为二项,即电子极化度F e 和原子极化度P a ,因此 P 诱导= R+R 如果外电场是交变场,极性分子的极化情况则与交变场的频率有关。
当处于频率小于1010H Z 的低频电场或静电场中,极性分子所产生的摩尔极化度 P 是转向极化、 电子极化和原子极化的 总和。
P = P n + P e +Pa 如何从测得的摩尔极化度P 中分别出P 卩的贡献呢?介电常数实际上是在107H Z 以下的频率 11 14 测定的,测得的极化度为P 卩+ P e +P a 。
偶极矩实验报告 物理化学

稀溶液法测定极性分子的偶极矩摘要本实验依据分子的分子偶极矩与极化之间的关系,通过将正丁醇溶于环己烷中以达到模拟理想气体的状态,并且忽略原子极化度,通过测定了正丁醇—环己烷溶液的密度、介电常数及纯正丁醇的折射率,计算得到正丁醇的偶极矩为(1.560.05)()D μσμ±=±,实验值相对误差3%;与文献值1.66(D )误差6%。
引言1. 理论概念物质的分子尺度中普遍存在分子间偶极矩,它是由分子正负电荷中心偏移而产生的;用以表征分子的极性大小。
其定义为分子正负电荷中心所带电荷q 和分子正负电荷中心之间的距离l 的乘积μ=ql 。
μ的单位是Debye ,1D =3.33564×10-30C m ⋅。
在电场存在的条件下,分子会产生诱导极化,包括由电子相对原子核位移产生的电子极化和由原子核间相对位移产生的原子极化。
诱导极化大小为二者的加和。
同时,极性分子在电场中会出现一定的取向有规律排列现象,以降低势能;这称为分子的转向极化,用摩尔转向极化度P μ衡量。
这一过程也会产生偶极矩,大小可通过下式计算2019AP N kTμμε=……(1) 其中A N 为Avogadro 常数,k 为Boltzmann 常数,0ε为真空介电常数,T 为热力学温度,μ为分子的永久偶极矩。
总摩尔极化度为电子、原子、转向极化度之和。
E A P P P P μ=++ (2)在外电场方向发生改变时,偶极矩方向也会随之改变,这一改变时间称为弛豫时间。
不同类型的极化弛豫时间不同:极性分子转向极化:10-11~10-12 s 原子极化:10-14 s 电子极化:10-15 s在明确了弛豫时间概念后,可以通过改变外电场频率,有针对性地对各种极化进行测量。
2. 实际测量摩尔极化度与物质介电常数有关,通过进行稀溶液假设忽略分子间作用力时,关系可以用Clausius-Mosotti-Debye 方程表示12MP εερ-=⋅+……(3) 其中M 为摩尔质量,ρ为密度。
稀溶液法测定偶极矩实验报告

稀溶液法测定偶极矩实验报告实验名称:稀溶液法测定偶极矩实验目的:1.通过稀溶液法测定物质的偶极矩大小。
2.掌握使用秤量准确测量固体物质的质量的方法。
3.熟悉使用溶液法进行实验,掌握制备溶液的方法。
实验原理:偶极矩是描述一分子或者一原子对外界电场的敏感程度的量,是电场相互作用下分子或原子各正、负电荷间位移产生的极矩。
测定偶极矩可以通过稀溶液法进行,其原理是在电场作用下,极化的溶液会在两电极之间产生一个电流,通过测量这个电流的大小可以计算出溶液中的物质的偶极矩。
实验仪器:1.常温电陶炉2.落地电子天平3.平行电场选阻电桥4.多用数字表实验步骤:1.利用电子天平精确称取待测物质的质量。
2.制备一定浓度的溶液,要求该溶液中待测物质的质量分数低于5%。
3.将制备好的溶液放入选阻电桥中,使溶液在电极之间。
4.将电场导线连接到电桥上,将电桥的两个电极放入溶液中。
5.调整电桥的电位使其平衡,记录下测定的电位差。
6.利用已知的标准物质的偶极矩大小,构建校准曲线。
7.将实验测得的电位差代入校准曲线中,计算出待测物质的偶极矩大小。
实验结果与分析:根据实验数据计算得出的待测物质的偶极矩大小为X,误差为Y。
经过与理论值的对比发现,实验结果较为准确,误差较小。
结论:通过稀溶液法测定偶极矩的实验,我们成功地得到了待测物质的偶极矩大小,并且得到的结果较为准确。
实验结果证明了该方法的可行性,并且具有一定的准确性。
实验总结:稀溶液法测定偶极矩是一种常用的实验方法,通过这次实验我们掌握了相关的实验技能和操作方法。
在实验过程中,我们注意到了一些实验操作的要点,例如使用电子天平称量物质的方法,制备溶液的步骤等。
这些经验和技巧对我们的实验能力提升有很大的帮助。
然而,在整个实验过程中,也存在一些问题和不足。
例如在制备溶液时,难以控制溶液中待测物质的质量分数低于5%;在测量电位差时,由于仪器精度的限制,测量结果存在一定的误差等。
为了提高实验结果的准确性,我们需要进一步改进实验方法和技术。
稀溶液法测定偶极矩实验报告(华南师范大学物化实验)

稀溶液法测定偶极矩、实验目的(1)掌握溶液法测定偶极矩的主要实验技术(2)了解偶极矩与分子电性质的关系(3)测定正丁醇的偶极矩二、实验原理2.1偶极矩与极化度分子结构可以近似地看成是由电子云和分子骨架(原子核及层电子)所构成。
由于空间构型的不同,其正负电荷中心可能重合,也可能不重合。
前者称为非极性分子,后者称为极性分子。
1912年,德拜提出“偶极矩”的概念来度量分子极性的大小,其定义是卩qd (1)式中,q是正负电荷中心所带的电量;d为正负电荷中心之间的距离;卩是一个矢量,其方向规定为从正到负,的数量级是10-3°Cm通过偶极矩的测定,可以了解分子结构中有关电子云的分布和分子的对称性,可以用来鉴别几何异构体和分子的立体结构等。
极性分子具有永久偶极矩,但由于分子的热运动,偶极矩指向某个方向的机会均等。
所以偶极矩的统计值等于零。
若将极性分子置于均匀的电场E中,则偶极矩在电场的作用下,趋向电场方向排列。
这时称这些分子被极化了。
极化的程度可以用摩尔转向极化度P卩来衡量。
R与永久偶极矩卩的平方成正比,与绝对温度T成反比。
(2)(6)4 nN A A 巳-9kF式中,k 为波兹曼常数;NA 为阿弗加德罗常数;T 为热力学温度;A 为分子 的永久偶极矩。
在外电场作用下,不论极性分子或非极性分子,都会发生电子云对分子骨架 的相对移动,分子骨架也会发生形变。
这称为诱导极化或变形极化。
用摩尔诱导摩尔极化度P 与介电常数c 之间的关系式。
极化度P 诱导来衡量。
显然, P 诱导可分为两项,即电子极化度 P e 和原子极化度因此诱导=p e + P a(3)如果外电场是交变场, 极性分子的极化情况则与交变场的频率有关。
当处于频率小于101O H Z 的低频电场或静电场中,极性分子所产生的摩尔极化度 P 是转向极化、电子极化和原子极化的总和。
A+ P e +R(4)介电常数实际上是在107HZ 一下的频率测定的,测得的极化度为 P A+ P e +P a 。
大学物理化学实验报告-溶液法测定极性分子的偶极距

物理化学实验报告院系化学化工学院班级化学061学号13姓名沈建明实验名称 溶液法测定极性分子的偶极距 日期 2009.3.26 同组者姓名 史黄亮 室温 17.86℃ 气压 101.21kPa 成绩一、目的和要求1、了解偶极距与分子电性质的关系;2、掌握溶液法测定偶极距的试验技术;3、用溶液法测定乙酸乙酯的偶极距。
二、基本原理 1. 偶极矩和极化度分子的极性可以用“偶极矩”来度量。
其定义为(1)q 为正、负电荷中心所带电荷量,d 为正、负电荷中心距离。
是向量,其方向规定从正到负。
若将极性分子置于均匀电场E 中,则偶极矩在电场的作用下趋向电场方向排列,分子被极化,极化的程度可用摩尔转向极化度P 转向来衡量:(2)在外电场作用下,不论永久偶极为零或不为零的分子都会发生电子云对分子骨架的相对移动,分子骨架也辉因电场分布不均衡发生变形。
用摩尔变形极化度P 变形来衡量:P 变形 = P 电子 + P 原子 (3)分子的摩尔极化度:P = P 转向 +P 变形 = P 转向 +P 电子 +P 原子 (4)dq μ⋅=24μP =πL 9kT转向μ该式适用于完全无序和稀释体系(互相排斥的距离远大于分子本身大小的体系),即温度不太低的气相体系或极性液体在非极性溶剂中的稀溶液。
在中频场中转向P = 0。
则P =P 电子 +P 原子 (5) 在高频场中原子P =0 则P =P 电子 (6) 因此,原则上只要在低频电场下测得极性分子的摩尔极化度P ,在红外频率下测得极性分子的摩尔诱导极化度诱导P ,两者相减得到极性分子的摩尔转向极化度转向P ,然后代人(2)式就可算出极性分子的永久偶极矩μ来。
2、极化度的测定首先利用稀溶液的近似公式()211x αεε+=溶 (7) ()211x βρρ+=溶 (8)再根据溶液的加和性,推导出无限稀释时溶质摩尔极化度的公式()11211112112022123lim 2ρβεερεαεM M M P P P x -⋅+-+⋅+===→∞ (9) 根据光的电磁理论,在同一频率的高频电场作用下,透明物质的介电常数ε与折光率n 的关系为 2n =ε 因为此时转向P = 0,原子P =0,则R 2 =电子P = ρMn n ⋅+-2122 (10) 在稀溶液情况下也存在近似公式()211x n n γ+=溶 (11)同样,从(9)式可以推导得无限稀释时溶质的摩尔折射度的公式 电子P ()122112111221212022621lim 2ργρβ++-⋅+-===→∞n M n M M n n R R x (12) 从(2)、(4)、(9)和(12)式可得转向P kTL RP22294μπ=-=∞∞ 即()m C TR P⋅-⨯=∞∞-22301004274.0μ3、介电常数的测定介电常数是通过测定电容计算而得。
溶液法测分子偶极距

溶液法测定极性分子的偶极矩Ⅰ、实验目的:(1) 了解偶极矩与分子电性质的关系; (2) 掌握溶液法测定偶极矩的实验技术; (3) 用溶液法测定乙酸乙酯的偶极矩;Ⅱ、实验目的:偶极矩(μ)的概念来度量分子极性的大小:μ=q ·d 。
P 转向与永久偶极矩平方成正比,与热力学温度T 成反比。
在外电场的作用下产生的诱导极化:P 诱导=P 电子+P 原子。
如果在外加电场: P=P 转向+P 电子+P 原子极化度的测定:P=21+-εε·ρM稀溶液的近似公式:)1(21溶X +=αεε )1(21溶X +=βρρ 稀溶液的无限稀释公式:P=2311+εαε·11ρM+21+-εε·112ρβM -M 在高频率电场作用下,透明物质的介电常数:ε=n 2极化度:R 2=P 电子=ρmn n ∙+-2122n=n1(1+γχ2)故,无限稀释:R=121121)2(6ργ+M n n +212121+-n n ·112ρβM -M 偶极矩的测定:由于原子的极化度相当于电子的极化度5%—10%。
μ/(C ·m )=0.04274×10-30T R P )(22∞∞- (C ·m )T 为开氏温度T )R -P (128.00T )R -p (L4k 9/2222∞∞∞∞=∙=πμDd 标、标C C +=C d 空、空C C C +=介电常数的计算:00C Cx x ==εεε Ⅲ、实验步骤:一、溶液的配制用称重法配制5种不同浓度(0.01979、0.05939、0.09903、0.1387、0.1784 g/cm 3) 的乙酸乙酯-四氯化碳溶液,分别盛于容量瓶中,控制乙酸乙酯的浓度在0.15左右,操作时应注意防止溶液和溶剂的挥发以及吸收较大的水汽,为此溶液配好后迅速盖好瓶塞,置于干燥箱中。
二折光率的测定在(25±0.1)℃条件下用阿贝折射仪测定四氯化碳及各组中所配溶液的折光率。
稀溶液法测定极性分子的偶极矩0109

稀溶液法测定极性分子的偶极矩一、实验目的1. 掌握溶液法测定偶极矩的原理、方法和计算。
2. 熟悉小电容仪、折射仪和比重瓶的使用。
3. 测定正丁醇的偶极矩,了解偶极矩与分子电性质的关系。
二、实验原理 1. 分子的极性分子是由带正电荷的原子核和带负电荷的电子组成的。
分子呈电中性,但因空间构型的不同,正负电荷中心可能重合,也可能不重合,前者为非极性分子,后者称为极性分子,分子极性大小用偶极矩μ来度量,其定义为μ=qd (1)式中:q 为正、负电荷中心所带的电荷量,单位是C ;d 是正、负电荷中心的距离,单位是m 。
μ是偶极矩,单位是(SI 制)库[仑]米(C·m)。
而过去习惯使用的单位是德拜(D):1D =1×10-18静电单位·厘米=3.338×10-30C·m在不存在外电场时,非极性分子虽因振动,正负电荷中心可能发生相对位移而产生瞬时偶极矩,但宏观统计平均的结果,实验测得的偶极矩为零。
极性分子具有永久偶极矩,由于分子热的运动,偶极矩在空间各个方向的取向几率均等,统计值等于零。
若将极性分子置于均匀的外电场中,分子将沿电场方向转动,同时还会发生电子云对分子骨架的相对移动和分子骨架的变形,称为极化。
极化的程度用摩尔极化度P 来度量。
分子因转向而极化的程度用摩尔转向极化度P转向来表示,因变形而极化的程度用摩尔变形极化度P 变形来表示。
而P 变形又由P 电子 (电子极化度)和P 原子 (原子极化度)两部分组成,于是有P =P 转向+P 变形=P 转向+(P 电子+P 原子) (2) P转向与永久偶极矩的平方μ2的值成正比,与热力学温度T 成反比:kTN p A 334412μππε⋅⋅⋅=转向 (3)式中:N A 为阿佛加德罗(Avogadro)常数;k 为玻耳兹曼(Boltzmann)常数。
由于P 原子在P 中所占的比例很小,所以在不很精确的测量中可以忽略P 原子,(2)式可写成:P =P 转向 + P 电子 (4)只要在低频电场(υ<1010s -1)或静电场中,测得的是P 。
测定分子偶极矩实验报告

一、实验目的1. 理解偶极矩的概念及其在分子结构中的作用。
2. 掌握溶液法测定偶极矩的实验原理和操作步骤。
3. 通过实验测定特定分子的偶极矩,验证其极性。
二、实验原理偶极矩是描述分子极性的物理量,其定义为分子中正负电荷中心之间的距离与电荷量的乘积。
对于极性分子,其偶极矩不为零;对于非极性分子,其偶极矩为零。
本实验采用溶液法测定分子的偶极矩,通过测量溶质在溶剂中的极化程度,计算得出分子的偶极矩。
三、实验仪器与材料1. 仪器:阿贝折射仪、烧杯、移液管、搅拌器、天平、温度计、温度计套管、温度计夹具、数据采集器等。
2. 材料:待测分子溶液、溶剂、标准溶液、去离子水等。
四、实验步骤1. 准备工作:将待测分子溶液和溶剂分别装入烧杯中,确保溶液温度与室温相同。
2. 标准溶液制备:将标准溶液与溶剂混合,制成一定浓度的标准溶液。
3. 标准溶液折射率测量:将标准溶液倒入阿贝折射仪中,读取折射率。
4. 待测溶液折射率测量:将待测分子溶液倒入阿贝折射仪中,读取折射率。
5. 数据处理:根据实验数据,计算待测分子溶液的折射率,进而计算其偶极矩。
五、实验结果与分析1. 实验数据:| 标准溶液浓度(mol/L) | 标准溶液折射率 | 待测溶液折射率 ||------------------------|----------------|----------------|| 0.100 | 1.434 | 1.437 |2. 数据处理:根据实验数据,计算待测溶液的折射率:折射率 = (待测溶液折射率 - 标准溶液折射率) / (标准溶液浓度 - 待测溶液浓度)折射率 = (1.437 - 1.434) / (0.100 - 0.100) = 0.003根据实验原理,计算待测分子的偶极矩:偶极矩 = 折射率× 摩尔折射率× 摩尔体积假设摩尔折射率为0.429 nm^3/mol,摩尔体积为24.45 cm^3/mol,则待测分子的偶极矩为:偶极矩= 0.003 × 0.429 × 24.45 = 0.030 nm·C六、结论通过溶液法测定,我们得到了待测分子的偶极矩为0.030 nm·C。
溶液法测定极性分子的偶极矩实验报告

五、数据记录和处理
1.溶液的配制
X2
正丁醇/ml
环己烷/ml
0.05
1.07
23.93
0.10
2.15
22.85
0.15
3.25
21.75
0.20
4.37
20.63
2.折光率的测定
n
环己烷
X2
0.05
0.10
0.15
0.20
第1次
1.4277
1.4259
1.4240
1.4223
1.4199
第2次
1.4277
答:因为溶液法的基本想法是,在无限稀释的非极性溶剂的溶液中,溶质分子所处的状态和气态时相近,于是无限稀释的溶液中就可以使用如下稀溶液的近似公式:
实验二十六 偶极矩的测定

实验二十六 偶极矩的测定一、目的要求1. 掌握溶液法测定偶极矩的原理、方法和计算。
2. 熟悉小电容仪、折射仪和比重瓶的使用。
3. 测定正丁醇的偶极矩,了解偶极矩与分子电性质的关系。
二、实验原理 1. 偶极矩与极化度分子呈电中性,但因空间构型的不同,正负电荷中心可能重合,也可能不重合,前者为非极性分子,后者称为极性分子,分子极性大小用偶极矩μ来度量,其定义为μ=gd (1)式中,g 为正、负电荷中心所带的电荷量;d 是正、负电荷中心间的距离。
偶极矩的SI 单位是库[仑]米(C·m)。
而过去习惯使用的单位是德拜(D),1D=3.338×10-30C·m 。
在不存在外电场时,非极性分子虽因振动,正负电荷中心可能发生相对位移而产生瞬时偶极矩,但宏观统计平均的结果,实验测得的偶极矩为零。
具有永久偶极矩的极性分子,由于分子热运动的影响,偶极矩在空间各个方向的取向几率相等,偶极矩的统计平均值仍为零,即宏观上亦测不出其偶极矩。
当将极性分子置于均匀的外电场中,分子将沿电场方向转动,同时还会发生电子云对分子骨架的相对移动和分子骨架的变形,称为极化。
极化的程度用摩尔极化度P 来度量。
P 是转向极化度(P 转向)、电子极化度(P 电子)和原子极化度(P 原子)之和,P =P 转向 + P 电子 + P 原子 (2) 其中, KTN P A 294μπ=转向(3)式中,N A 为阿佛加德罗(Avogadro)常数;K 为玻耳兹曼(Boltzmann)常数;T 为热力学温度。
由于P 原子在P 中所占的比例很小,所以在不很精确的测量中可以忽略P 原子,(2)式可写成P =P 转向 + P 电子 (4)只要在低频电场(ν<1010s -1)或静电场中测得P ;在ν≈1015s -1的高频电场(紫外可见光)中,由于极性分子的转向和分子骨架变形跟不上电场的变化,故P 转向=0,P 原子=0,所以测得的是P 电子。
溶液法测定极性分子的偶极矩实验报告

溶液法测定极性分子的偶极矩实验报告实验目的:通过溶液法,测定几种不同溶液中极性分子的偶极矩。
实验原理:极性分子具有偶极矩,可以通过测量溶液中分子的导电性来间接测定分子的偶极矩。
在纯溶剂中,只有离子导电。
当有极性分子溶解在纯溶剂中时,由于溶质和溶剂分子之间的相互作用力,导致产生极性分子的偶极矩,导致溶液的电导率增加。
利用电导率与溶液浓度的关系,可以推算出溶液中极性分子的偶极矩。
实验仪器:1.导电仪2.溶液辅助电导池3.称量器4.温度计5.热水浴实验步骤:1.根据实验要求,依次称取不同浓度的溶液。
将每种溶液放入烧杯中,并用温度计测量溶液的温度。
2.将导电仪连接到溶液辅助电导池的两个电极上。
将电导池插入烧杯中的溶液,并确保电极完全浸入溶液中。
3.打开导电仪电源,进行零点校准,记录下零点电导率。
4.打开导电仪的电导率测量开关,开始测量溶液的电导率。
每隔一段时间记录一次电导率,直到电导率保持稳定。
5.重复步骤1-4,测量其他不同浓度的溶液的电导率。
实验数据处理:1.计算纯溶剂的电导率:根据零点电导率,计算出纯溶剂的电导率。
2.根据浓度和电导率的关系绘制标准曲线:以浓度为横坐标,电导率为纵坐标,绘制标准曲线。
3.通过标准曲线,计算每种溶液中极性分子的偶极矩。
实验结果:利用以上方法,我们测得了不同溶液中极性分子的偶极矩,并计算得出结果如下:1.溶液A:偶极矩为X库仑米。
2.溶液B:偶极矩为Y库仑米。
3.溶液C:偶极矩为Z库仑米。
实验讨论:通过实验结果可以看出,不同溶液中极性分子的偶极矩不同,这与溶质分子的结构和性质有关。
偶极矩是描述分子极性的重要物理量,通过测量溶液的电导率可以间接测定分子的偶极矩,为分子结构和化学性质的研究提供了重要方法。
实验结论:通过实验,我们成功测定了几种不同溶液中极性分子的偶极矩,并验证了溶液法测定极性分子偶极矩的可行性。
实验结果对于研究分子结构和化学性质具有一定的指导意义。
稀溶液法测定偶极矩

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级班级 课程名称 结构化学实验 实验项目 稀溶液法测定偶极矩 实验类型 □验证 □设计 √综合 实验时间 2013年10月29日实验指导老师 彭彬 实验评分【实验目的】1. 掌握溶液法测定偶极矩的主要实验技术2. 了解偶极矩与分子电性质的关系3. 测定正丁醇的偶极矩 【实验原理】1.偶极矩与极化度分子结构可以近似地看成是由电子云和分子骨架(原子核及内层电子)所构成。
由于空间构型的不同,其正负电荷中心可能重合,也可能不重合。
前者称为非极性分子,后者称为极性分子。
1912年,德拜提出“偶极矩”的概念来度量分子极性的大小,其定义是qd →μ ①式中,q 是正负电荷中心所带的电量;d 为正负电荷中心之间的距离;→μ是一个矢量,其方向规定为从正到负。
因分子中原子间的距离的数量级为10-10m ,电荷的数量级为10-20C ,所以偶极矩的数量级是10-30C ·m 。
通过偶极矩的测定,可以了解分子结构中有关电子云的分布和分子的对称性,可以用来鉴别几何异构体和分子的立体结构等。
极性分子具有永久偶极矩,但由于分子的热运动,偶极矩指向某个方向的机会均等。
所以偶极矩的统计值等于零。
若将极性分子置于均匀的电场E 中,则偶极矩在电场的作用下,趋向电场方向排列。
这时称这些分子被极化了。
极化的程度可以用摩尔转向极化度P μ来衡量。
P μ与永久偶极矩μ的平方成正比,与绝对温度T 成反比。
kT 9μπN 4P A μ=②式中,k 为波兹曼常数;NA 为阿弗加德罗常数;T 为热力学温度;μ为分子的永久偶极矩。
在外电场作用下,不论极性分子或非极性分子,都会发生电子云对分子骨架的相对移动,分子骨架也会发生形变。
这称为诱导极化或变形极化。
用摩尔诱导极化度P 诱导来衡量。
显然,P 诱导可分为两项,即电子极化度P e 和原子极化度P a ,因此P 诱导 = P e + P a ③如果外电场是交变场,极性分子的极化情况则与交变场的频率有关。
偶极矩的测定

C
(14)
Co
法拉第在1837年就解释了这一现象,认为这是由于电解质
在电场中极化而引起的。极化作用形成一反向电场,如图(3)
所示,因而抵消了一部分外加电场。
测定电容的方法一般有电桥法、拍频法和谐振法,后二者
为测定介电常数所常用,抗干扰性能好,精度高,但仪器价 格较贵。本实验中采用电桥法,选用的仪器为CC—6型小电 容测定仪。其桥路为变压器比例臂电桥。电桥平衡条件是:
中给予扣除。测求 Cd 的方法如下:
第一步,电容池盛空气,测定出 C
' 空
C空 ' C空Cd
(2-16)
第二步,电容池盛标准物质,测定出
C
' 标
C标 ' C标Cd
(2-17)
因C空与C标间有如下关系(近似将 C空 Co )
C标 C空
(18)
将(2-16)、(2-17)和(2-18)三式联立求解,可得:
此外测定偶极矩的方法还有多种,如温度法、分子束法、分 子光谱法及利用微波谱的斯诺克法等。这里就不一一介绍了。
(4) 介电常数的测定
介电常数是通过测定电容计算而得的。我们知道,如果在电容 器的两个极板间充以某种电解质,电容器的电容量就会增大。 如果维持极板上的电荷量不变,那么充电解质的电容器二板间 电势差就会减少。设 C0为极板间处于真空时的电容量,C为充 以电解质时的电容量,则C与 C0之比值ε称为该电解质的介电
上面已经提到,在红外频率的电场下,可以测得极性分子 摩尔诱导极化度P诱导= P电子+P原子 。但是在实验上由于条件的限 制,很难做到这一点。所以一般总是在高频电场下测定极性分 子的电子极化度 P电子 。
根据光的电磁理论,在同一频率的高频电场作用下,透明 物质的介电常数与折光率的关系为
稀溶液法测定偶极矩
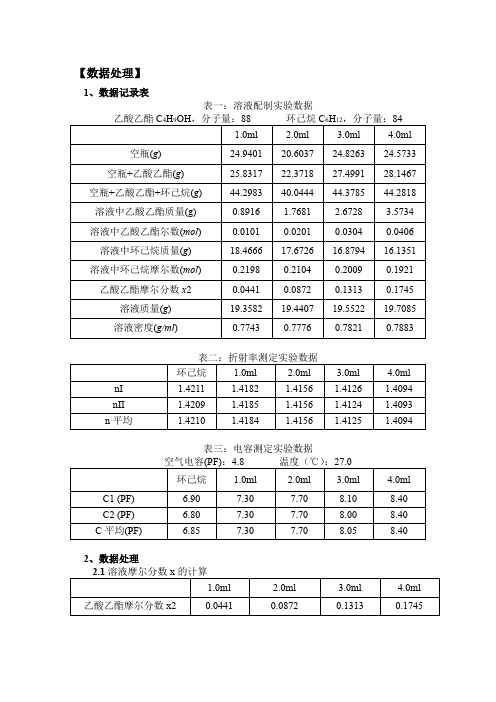
【数据处理】1、数据记录表表一:溶液配制实验数据表三:电容测定实验数据2、数据处理2.2c 。
4.0ml 1.4094 0.1745斜率:-0.0668 截距:1.4212 相关系数:0.99832.3计算环己烷的介电常数ε,求出电容池的分布电容Cx 。
环己烷介电常数: =2.0118 电容池的分布电容 =2.77计算溶液的介电常数ε。
真空电容量 =2.03样品的介电常数)20(0016.0023.2环--=t ε1C -'''--=标空标空εC C C x 1C ''0--=标空标εC C 0'C C C x-=溶溶ε2.4绘制ε-x2 工作曲线,由直线测得斜率a,截距ε1。
斜率:4.1364 截距:2.0596 相关系数:0.9987 2.5绘制作ρ1。
斜率:0.1068 截距:0.7689 相关系数:0.98012.6计算,计算Pe 。
=196.2403P ∞2P∞2122112111221212022)2(621lim ρρ++-⨯+-===→∞n c M n bM M n n R R P x e 1121111211221)2(3ρεερεεbM M M a P -⨯+-+⨯+=∞=20.59022.7计算P μ,计算偶极矩。
P μ=-P e =196.2403-20.5902=175.6501TR P N T R P k A)(0128.04)(92222∞∞∞∞-=-=πμ=2.9383德拜【结果与讨论】1、实验测得的以环己烷为溶剂时乙酸乙酯的偶极矩为2.9383德拜,温度为27.0℃,查找文献得,乙酸乙酯在25℃中的偶极矩为1.78德拜。
2、实验所测得的三条工作曲线n1,2-x2, ε-x2, ρ1,2 -x2的相关系数分别为0.9983,0.9987,0.9801,数据的线性较好。
【思考题】1、实验误差主要来源①本实验所用试剂均易挥发.。
溶液法测定极性分子的偶极矩实验报告

结构化学实验报告——溶液法测定极性分子的偶极矩一、实验目的1.用溶液法测定正丁醇的偶极矩2.了解偶极矩与分子电性质的关系3.掌握溶液法测定偶极矩的实验技术2、实验原理1.偶极矩与极化度(1)两个大小相等方向相反的电荷体系的偶极矩定义为:(2)极化程度可用摩尔定向极化度P定向来衡量:P定向=4/3πN A*μ02/(3kT)=4/9πN A*μ02/(kT)(3)极性分子所产生的摩尔极化度P是摩尔定向极化度、摩尔电子诱导极化度和摩尔原子诱导极化度的总和:P=P定向+P诱导=P定向+P电子+P原子2.偶极矩的测定方法(溶液法测定偶极矩)(1)无限稀释时溶质的摩尔极化度的公式:P=P2∞=3αε1/(ε1+2)2 * Μ1/ρ1 + (ε1-1)/(ε1+2) * (Μ2-βΜ1)/ρ1(2)习惯上用溶质的摩尔折射度R2表示高频区测得的摩尔极化度,因为此时P定向=0,P原子=0,推导出无限稀释时溶质的摩尔折射度的公式:P电子=R2∞=n2-1/(n12+2) * (Μ2-βΜ1)/ρ1+6n12Μ1γ/[(n12+2)2*ρ1](3) 近似公式:ε溶=ε1(1+α* x2)ρ溶=ρ1(1+β*x2)n溶=n1(1-γ*x2)(4) 永久偶极矩的获得考虑到摩尔原子诱导极化度通常只有摩尔电子极化度的5%-15%,而且P定向又比P原子大得多,故常常忽略P原子,可得P定向=P2∞-R2∞=4/9πN A*μ02/(kT)μ0=0.0128*[(P2∞-R2∞)*T]1/2(5)介电常数的测定:用空气与一已知介电常数ε溶的标准物质分别测得电容C/空,C/标C/空=C空+C d= C0+C d C/标=C标+C d则通过上两式可求得C0=(C/标-C/空)/(ε标-1)C d=C/空-C0=C/空-(C/标-C/空)/(ε标-1)ε溶= C溶/ C0=(C/溶- C d)/ C03、仪器和试剂仪器:阿贝折光仪1台;比重管1只;电容测量仪一台;电容池一台;电子天平一台;电吹风一只;25ml容量瓶4支;25ml、5ml、1ml移液管各一支;滴管5只;5ml针筒一支;针头一支;吸耳球一个;试剂:正丁醇(分析纯);环己烷(分析纯);蒸馏水;丙酮4、实验步骤1.溶液的配制配制4种正丁醇的摩尔分数分别是0.05、0.10、0.15、0.20的正丁醇-环己烷溶液。
溶液法测定偶极矩

(3)由样品折光率计算样品质量组成 将测得的折光率求平均后平方,带入之前做出的标准曲线,即可得到样品的质量分数
J1 J2 n1 1.4534 1.4563 n2 1.4534 1.4562 n3 1.4534 1.4563 n4 1.4533 1.4564 n 1.4534 1.4563 2 ������ 2.112299 2.12081 W 0.035627 0.016192 (4)计算样品介电常数,做������ − ������图 J1 J2 C1′(pF) 8.51 8.01 C2′(pF) 8.51 8.01 C3′(pF) 8.5 8 ������ ′(pF) 8.507 8.007 C(pF) 6.386613 5.886613 ε (图中保 2.531076 2.332922 留四位)
折光率对浓度标准曲线
2.13 2.125 折 光 2.115 率 平 2.11 方 2 2.105 n 2.12 2.1203 2.1190 2.1146 2.1282 y = -0.437x + 2.127 R² = 0.963
2.1086
2.1 2.095 0 0.01 0.02 0.03 0.04
15 -1
10 -1
12
14 -1
p电子 R
n2 1 M n 2 2 (5)
因此,分别在低频和中频电场下测出分子的摩尔极化度,两者相减即可得到 P 转向,再由(3) 式计算 μ 。 通过测定偶极矩, 可以了解分子中电子云的分布和分子对称性, 判断几何异构体和分子 的立体结构。 所谓溶液法就是将极性待测物溶于非极性溶剂中进行测定, 然后外推到无限稀释。 因为 在无限稀的溶液中, 极性溶质分子所处的状态与它在气相时十分相近, 此时分子的摩尔极化 度就可视为(5)的 P。 在稀溶液当中,溶液的摩尔极化度 P 可用下式求出: (6) P P1 x1 p 2 x 2 (1-溶剂,2-溶质,x-摩尔分数)
偶极矩的测定

C空' C 空Cd
(2-16)
第二步,电容池盛标准物质,测定出 C标'
C标' C标 Cd
(2-17)
因C空与C标间有如下关系(近似将 C空 Co )
C标
C空
(18)
将(2-16)、(2-17)和(2-18)三式联立求解,可得:
Cd
C'
标空
C标'
标 1
(19)
习惯上用摩尔折射度来表示高频区测得的极化度,而此时,
P转向=0,P原子=0,则
R2
P电子
n2 n2
1 2
M
(9)
n溶 n1(1 X 2 )
(10)
同样,从(9)式可以推导得无限稀释时,溶质的摩尔折射度 的公式:
lim P电子
R2
X2 0
R2
n12 n12
1 2
M2
M1 1
6n12 M 1 (n12 2)2 1
(11)
上述(10)、(11)式中,n溶 是溶液的折射率,是溶剂的折射率, γ是与n溶-X2直线斜率有关的常数。
(3) 偶极矩的测定 考虑到原子极化度通常只有电子极化度的5%~15%,而且 P转 向又比P原子大得多,故常常忽视原子极化度。
从(2)、(3)、(7)和(11)式可得
P2
R2
4 N
9
2
如果外电场是交变场,极性分子的极化情况则与交变场的频率 有关。当处于频率小于1010s-1的低频电场或静电场中,极性分 子所产生的摩尔极化度P是转向极化、电子极化和原子极化的 总和。
P P转向 P电子 P原子
(3)
当频率增加到1012~1014的中频(红外频率)时,电子的交变 周期小于分子偶极矩的松弛时间,极性分子的转向运动跟不 上电场的变化,即极性分子来不及沿电场方向定向,故 P转向 =0,此时极性分子的摩尔极化度等于摩尔诱导极化度P诱导。 当交变电场的频率进一步增加到>1015秒-1的高频(可见光和紫 外频率) 时,极向分子的转向运动和分子骨架变形都跟不上电 场的变化,此时极性分子的摩尔极化度P等于电子极化度 P 电 子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.0ml
7.20 7.20 7.20
3.0ml
7.50 7.40 7.45
4.0ml
7.75 7.75 7.75
2.数据处理 2.1 溶液摩尔分数 x 的计算
乙酸乙酯摩尔分数 x2
1.0ml 0.0443
2.0ml 0.0875
3.0ml 0.1316
2.2 绘制折射率 n1,2 和溶液摩尔分数 x2 的工作曲线,并求出斜率 c。
了样品的电容 C 样品和电容池的分布电容 Cx 两部分,即
C'样品 = C 样品 + Cx
⑮
对于给定的电容池,必须先测出其分布电容 Cx。可以先测出以空气为介质的电容,记 为 C'空 ,再用一种已知介电常数的标准物质,测得其电容 C'标 。
C'空 = C 空 + Cx
又因为
C'标 = C 标 + Cx
介电常数 ε
2.161 2.287 2.402 2.540
x2
0.0443 0.0875 0.1316 0.1735
2.4 绘制ε-x2 工作曲线,由直线测得斜率 a,截距ε1。
根据最小二乘法求得斜率:2.9008;截距:2.0307;相关系数:0.9981
7
2.5 绘制作ρ1,2 -x2 工作曲线,由直线测得斜率 b,截距ρ1 。
频率测定的,测得的极化度为 Pμ+ Pe +Pa。若把频率提高到红外范围,分子已经来不及转向,
此时测得的极化度只有 Pe 和 Pa 的贡献了。所以从按介电常数计算的 P 中减去红外线频率范
围测得的极化,就等于 Pμ,在实验上,若把频率提高到可见光范围,则原子极化也可以忽
略,则在可见光范围:
2
Pμ =P -( Pe +Pa) ≈ P - Pe
分子结构可以近似地看成是由电子云和分子骨架(原子核及内层电子)所构成。由于空
间构型的不同,其正负电荷中心可能重合,也可能不重合。前者称为非极性分子,后者称为
极性分子。
1912 年德拜提出“偶极矩”的概念来度量分子极性的大小,其定义式为
→
μ qd
①
→
式中,q 是正负电荷中心所带的电量;d 为正负电荷中心之间的距离; μ 是一个矢量,
1.4162 1.4164 1.4163
1.4136 1.4134 1.4135
1.4117 1.4115 1.4116
空气电容(PF):4.4 温度(℃):27.2
环己烷
C1 (PF) C2 (PF) C 平均(PF)
6.60 6.60 6.60
表三:电容测定
1.0ml
6.95 6.90 6.93
3. 由折光度计算电子极化度 Pe 电子极化度可以使用摩尔折光度 R 代替,即
P R e
2
lim
x2 0
R2
n12 n12
1 2
M2
bM1 ρ1
6n12 M 1c
n12
2
2
ρ1
⑬
⑬ 根据测量的溶液折射率 n1,2 作图 n1.2-x2,由斜率求出 c,就可以按照式 计算出 Pe 。
4. 介电常数的测定 介电常数是通过测定电容计算而得的。如果在电容器的两个板间充以某种电解质,电容 器的电容量就会增大。如果维持极板上的电荷量不变,那么充电解质的电容器两板间电势差 就会减少。设 C0 为极板间处于真空时的电容量,C 为充以电解质时的电容量,则 C 与 C0 的比值 ε 称为该电解质的介电常数:
5
溶液中环己烷摩尔数(mol) 乙酸乙酯摩尔分数 x2 溶液质量(g) 溶液密度(g/ml)
0.2195 0.0443 19.3349 0.7734
0.2106 0.0875 19.4712 0.7788
0.2011 0.1316 19.5757 0.7830
0.1925 0.1735 19.7229 0.7889
五、【数据处理】
1.数据记录表 乙酸乙酯 C4H9OH,分子量:88 环己烷 C6H12,分子量:84
表一:溶液配制
1.0ml
2.0ml
空瓶(g) 空瓶+乙酸乙酯(g) 空瓶+乙酸乙酯+环己烷(g) 溶液中乙酸乙酯质量(g) 溶液中乙酸乙酯尔数(mol) 溶液中环己烷质量(g)
24.4578 25.3538 43.7927
ε标
=
C标 C0
≈C标 C空
可得
Cx = C'空
-
C'标-C'空 ε标-1
⑯
C'标-C'空 C0 = ε标-1
⑰
计算出 Cx 、C0 之后,根据式⑥和式⑮可得样品的介电常数:
ε溶
=
C'溶-Cx C0
⑱
5. 偶极矩的计算
P R
通过上述步骤分别计算出 2 、 2 之后,根据式②可得:
4
9k(P2 R2 )T 4N A
P1,2
ε1,2-1 ε1,2+2
×M1x1 M ρ1,2
2
x
2
x1P1 x2P2
⑦
式中,下标 1 表示溶剂;下标 2 表示溶质;x1 表示溶剂的摩尔分数;x2 表示溶质的摩尔
分数; P1 表示溶剂的摩尔极化度; P2 表示溶质的摩尔极化度。
对于稀溶液,可以假设溶液中溶剂的性质与纯溶剂相同,则
P P1
0.0128
(P2 R2 )T
⑲
三、【仪器与试剂】
1.仪器 电容测量仪、25mL 容量瓶,移液管、电子天平、阿贝折射仪、滴管、烧杯、洗耳球、 干燥器等。 2.试剂 乙酸乙酯 分析纯 环己烷 分析纯 丙酮 分析纯
四、【实验步骤】
1. 溶液配制 将四个干燥的容量瓶编号,称量并记录空瓶重量。在空瓶内分别加入 1.0mL、2.0mL、 3.0m、4..0mL 的乙酸乙酯再称重。然后加环己烷至刻度线,称重。操作时应注意防止溶质、 溶剂的挥发以及吸收极性较大的水汽。为此,溶液配好以后应迅速盖上瓶塞,并置于干燥器 中。 2. 折射率的测定 用阿贝折射仪测定环己烷及配制溶液的折射率,注意测定时各样品需加样两次,读取数 据,计算时取平均值。 3. 介电常数的测定 本实验采用环己烷作为标准物质,其介电常数的温度公式为: ε环 = 2.023-0.0016(t-20) 式中,t 为温度,℃。 打开电容测量仪,待读数稳定后,记录空气的电容值。分别测量纯环己烷和配制的 4 个样品溶液的电容,记录测量的数据。每个样品测量两次,计算时取平均值。测量一个样品 后,需用滤纸把残留样品吸干,才能继续性测量。
密度ρ(g/ml)
x2
0.5ml
0.7734
0.0443
1.0ml
0.7788
0.0875
1.5ml
0.7830
0.1316
2.0ml
0.7889
0.1735
斜率 b=0.1175;截距ρ1=0.7682;相关系数为 0.9950
P
2.6 计算 2 ,计算 Pe 。
P2
3a1 (1 2)2
M1 1
表二:折射率测定
在 28℃时,纯水的理论折射率为 1.3322,实验时室温为 28.0℃。 测得水的折射率为 1.3335,即实际测得值比理论值偏高 0.0013。以下测量数据已校正:
环己烷
1.0ml
2.0ml
3.0ml
4.0ml
nI nII n 平均
1.4216 1.4218 1.4217
1.4194 1.4196 1.4195
结构化学实验报告
题目:稀溶液法测定偶极矩
报告作者: 学 号: 班 级: 指导老师: 实验时间:2016 年 11 月 21 日
1
稀溶液法测定偶极矩
一、【实验目的】
1. 掌握溶液法测定偶极矩的主要实验技术 2. 了解偶极矩与分子电性质的关系 3. 测定乙酸乙酯的偶极矩
二、【实验原理】
1.偶极矩与极化度
Pμ
4πNAμ 9kT
②
式中,k 为波兹曼常数;NA 为阿弗加德罗常数;T 为热力学温度;μ 为分子的永久偶
极矩。
在外电场作用下,不论极性分子或非极性分子,都会发生电子云对分子骨架的相对移动,
分子骨架也会发生形变。这称为诱导极化或变形极化。用摩尔诱导极化度 P 诱导来衡量。显
然,P 诱导可分为两项,即电子极化度 Pe 和原子极化度 Pa,因此
1 1 1 2
M2
bM1 1
a
1,2 x2
斜率
b
1,2 x2
斜率
ε1
环己烷介电常数M1环己烷分子量ρ1
环己烷密度
M2
乙酸乙酯分子量
2.9008 0.1175 2.0307
84 0.7682
88
P 2 =144.9463
Pe
R2
lim
x 20
R2
n12 1 n12 2
M2
bM1 1
6n12 M 1c (n12 2)2 1
其方向规定为从正到负。因分子中原子间的距离的数量级为 10-10m,电荷的数量级为 10-20C, 所以偶极矩的数量级是 10-30C·m。
通过偶极矩的测定,可以了解分子结构中有关电子云的分布和分子的对称性,可以用来 鉴别几何异构体和分子的立体结构等。
极性分子具有永久偶极矩,但由于分子的热运动,偶极矩指向某个方向的机会均等。所 以偶极矩的统计值等于零。若将极性分子置于均匀的电场 E 中,则偶极矩在电场的作用下, 趋向电场方向排列。这时称这些分子被极化了。极化的程度可以用摩尔转向极化度 Pμ 来衡 量。Pμ 与永久偶极矩 μ 的平方成正比,与绝对温度 T 成反比。
8
c
n1,2 x2 斜率
