包涵体纯化方案
包涵体蛋白的分离纯化

包涵体蛋白的分离纯化赵玲0743085096 包涵体是外源基因在原核细胞中表达时,尤其在大肠杆菌中高效表达时,形成的由膜包裹的高密度、不溶性蛋白质颗粒,在显微镜下观察时为高折射区,与胞质中其他成分有明显区别。
包涵体形成是比较复杂的,与胞质内蛋白质生成速率有关,新生成的多肽浓度较高,无充足的时间进行折叠,从而形成非结晶、无定形的蛋白质的聚集体;此外,包涵体的形成还被认为与宿主菌的培养条件,如培养基成分、温度、pH 值、离子强度等因素有关.细胞中的生物学活性蛋白质常以可融性或分子复合物的形式存在,功能性的蛋白质总是折叠成特定的三维结构型.包涵体内的蛋白是非折叠状态的聚集体,不具有生物学活性,因此要获得具有生物学活性的蛋白质必须将包涵体溶解,释放出其中的蛋白质,并进行蛋白质的复性。
包涵体的主要成分就是表达产物,其可占据集体蛋白的40%~95%,此外,还含有宿主菌的外膜蛋白、RNA聚合酶、RNA、DNA、脂类及糖类物质,所以分离包涵体后,还要采用适当的方法(如色谱法)进行重组蛋白质的纯化。
1. 包涵体的形成重组蛋白不论在原核细胞还是真核细胞中表达时,都可形成包涵体.通常所说的包涵体是指重组蛋白在大肠杆菌中高效表达时形成的无活性蛋白聚集体,一般含有50%以上重组蛋白,其余为核糖体组分、RN A聚合酶,外膜蛋白等杂蛋白,以及质粒DNA、RNA片断、脂质、肽聚糖、脂多糖等成分]。
由于包涵体在相差显微镜下为黑色斑点, 所以也称为折射体。
包涵体形成的原因主要有以下几点:⑴蛋白合成速度太快,以致于没有足够的时间进行折叠.蛋白折叠的动力学模型表明:蛋白质天然构象形成的速率取决于肽链的合成速率、折叠速率和聚集速率几个因素。
中间体正确折叠是分子内的一级反应,而中间体的聚集是发生在分子间的二级或高级反应,因此,折叠中间体的浓度对聚集反应影响非常大];⑵重组蛋白是大肠杆菌的异源蛋白,由于缺少真核生物的翻译后修饰系统(如糖基化等) ,致使中间体大量积累,容易形成包涵体;⑶培养条件不佳和重组蛋白所处的环境也可导致包涵体形成,如发酵温度高,胞内pH 接近蛋白的等电点等;⑷二硫键在蛋白折叠中有重要作用,而大肠杆菌胞内的还原环境不利于二硫键的形成;⑸包涵体不溶可能由于分子间无活性的β2片层含量高于天然结构或盐沉淀蛋白.包涵体蛋白虽然不具有天然结构、没有活性,但在基因工程中生产重组蛋白,包涵体的形成有一定优势,主要表现在: ⑴重组蛋白高水平表达,有时候可达细胞总蛋白的30%;⑵包涵体密度高(约1. 3mg/m l)[ 12 ],重组蛋白相对较纯,很容易与细胞成分分离,可减少后续纯化步骤;⑶包涵体结构致密,因而在一定程度上避免了大肠杆菌蛋白酶的降解; ⑷易于毒性蛋白和膜蛋白表达;⑸包涵体的形成降低了重组蛋白在胞质中的浓度,有利于目的基因的进一步表达。
原核蛋白包涵体纯化

原核蛋白包涵体纯化1、实验目的原核重组蛋白中试包涵体纯化2、实验准备2.1实验材料:上一步收集的中试菌体。
2.2 试剂与耗材:NaCL(国药沪试10019318)),磷酸氢二钠(国药沪试20040718);30%丙烯酰胺(华兴博创),SDS(Bomei LS0227),Glycine(Bomei GG0167),Tris(Bomei ST0497),咪唑(国药沪试),尿素(国药沪试)2.3 仪器与设备:海智城ZYW-2102C型双层摇床,15ml塑料离心管,Ultrasonic 超声仪,Thermo台式离心机miro 17R,伯乐蛋白电泳槽1658001,;北京六一DYY-6c电泳电源,镍亲和填料;3.实验步骤3.1菌体破碎菌体加入裂解液(每400ml培养体积对应菌体加30ml裂解液,如果菌体较多可以适当增加裂解液体积),将重悬菌体放置4℃冰箱等待超声,超声前加1% Triton。
3.2按超声仪使用说明超声重悬的菌体,如使用6号探头,设置功率为85%,超声3s,冷却6s,总时间25分钟即可。
超声时,要将装有菌体的离心管浸入冰中,并保证裂解样品温度在4℃左右。
3.3破碎菌液离心分上清沉淀,破碎完毕后,立即高速离心(15min,4℃,18000xg),然后去掉上清,保留沉淀待用。
3.4 再次加入裂解buffer重选沉淀,超声按照1% Triton加入,超声10分钟,如使用6号探头,设置功率为85%,超声3s,冷却6s。
二次超声完毕后,立即高速离心(15min,4℃,18000xg),然后去掉上清,保留沉淀待用。
3.5 加入2M Urea ,pH8.0,50mM tris wash buffer,重悬沉淀,超声3min,超声3s,冷却6s。
然后立即高速离心(15min,4℃,18000xg),然后去掉上清,保留沉淀待用。
3.6 加入50ml ddH2o,重选打散沉淀,超声3min,超声3s,冷却6s。
包涵体的纯化

根据不同用途,采用相应溶剂溶解包涵体。
①如用于免疫注射,用1.5倍沉淀体积旳PH8.0, 8M尿素溶解,并于4℃保存。
②如用于纯化,用2倍沉淀体积旳PH8.0旳PBS, 2%SKL(十二烷基肌氨酸钠)孵育过夜,溶解 包涵体沉淀,10000rpm,7min离心,搜集上清, 4℃保存。
5、复性
包涵体旳复性是一种复杂旳过程,我们企 业生产旳融合蛋白用作抗原免疫兔子,所以不需 要作复性处理。
白水解酶活性,在包涵体旳溶解和复性过程中 可造成重组蛋白质旳降解。
试验室用旳是低浓度旳变性剂—2M尿素在 50mM Tris pH8.0,1mM EDTA中洗涤和用温 和去垢剂1% TritonX-100洗涤清除膜碎片和膜 蛋白。
4 、溶解
变性蛋白只有空间构象旳破坏,一般以为蛋白质 变性本质是次级键、二硫键旳破坏,并不涉及一级 构造旳变化。包涵体旳溶解主要任务是拆开错配旳 二硫键和次级键 。
5、以包涵体形式体现旳重组蛋白丧失了原有旳生物 活性,必须经过有效旳变性复性操作,才干回收得到 具有正确空间构象(因而具有生物活性)旳目旳蛋白, 体外复性蛋白质旳成功率相当低,一般不超
1 、破菌
基因工程菌发酵液,经离心浓缩后,可用: 机械破碎、超声破碎。单纯超声破碎,在小规 模下且菌量较少旳情况下效果很好,因为能量 传递和局部产热等原因,极难用于大致积细胞 悬液旳破碎,这么部分未破碎细胞与包涵体混 在一起,给后期纯化带来困难。所以,在较大 规模纯化时先用溶菌酶破碎细菌旳细胞膜,再 结合超声破碎措施,可明显提升包涵体旳纯度 和回收率。
累,轻易形成包涵体沉淀。
5 、蛋白质在合成之后,于中性pH或接近中性pH
旳环境下,其本身固有旳溶解度对于包涵体旳形成比较
关键,即是说,有旳体现产率很高,如Aspartase和
包含体纯化步骤(精)

同样采用Ni-NTA His结合树脂亲和纯化重组目的蛋白,1、200mL菌液离心收集大量诱导的菌体,并用1×PBS缓冲液洗涤两次。
2、将保存的菌体沉淀用总体积为20mL的1×Bind Buffer (300mM NaCl,50MmNaH2PO4; 10mM imidazote,pH8.0)重悬,在冰浴中超声波破菌至溶液呈白色澄清。
3、4℃12,000rpm离心30分钟,然后用20mL的包涵体洗涤Buffer (50mmol/L Tris-HCl,100mmol/L NaCl,1mmol/L EDTA,0.5% Triton x-100,pH8.0)洗涤沉淀两次。
4、加20mL的包涵体溶解Buffer(50mmol/L Tris-HCl,100mmol/L NaCl,8mol/L Urea,pH8.0)充分溶解,(旋涡溶解,最好溶解时间长一点,1h左右,也可以用冰盒装放摇床上1h),4℃10,000 r/min离心30min,收集上清。
2.2.2 亲和层析纯化表达的蛋白pQE40和pET-32a(+)载体表达的蛋白C﹑N端均融合了6个组氨酸的tag,可用金属螯和层析纯化,也可用抗6个组氨酸的单克隆抗体检测表达蛋白的正确性。
根据表达蛋白的溶解情况分两种方法对蛋白进行纯化。
2.2.3 天然条件下纯化可溶形式的目的蛋白目的蛋白的表达和收获:用3.2.2.1所述的方法大量表达目的蛋白。
4℃下10,000 rpm离心5min弃上清,向细菌沉淀中加入4℃用冰预冷的1×Ni-NTA结合缓冲液(50 mmol/L NaH2PO4, 300 mmol/L NaCl, 10 mmol/L咪唑, pH8.0),每100mL培养液加入4mL结合缓冲液,重悬菌体。
-40℃冷冻,室温溶解,反复冻融三次。
再在冰水浴中超声10min(超声10s, 间隔10s),破碎菌体。
4℃下10,000 rpm离心20min,保留上清液。
包涵体溶解及蛋白纯化

IFN-α包涵体溶解和蛋白纯化
操作程序
用N-十二烷基胺酸钠溶解包涵体沉淀
1.加18mL缓冲液A和2mL 20% DOC储存于包涵体沉淀中。
用组织破碎器充分重悬
沉淀,室温下静置至少10min。
2.悬液于4℃、13000r/min离心10min。
弃去上清(注意留样,样品C),为确保沉
淀得到充分洗涤,再次按步骤一的操作重悬沉淀。
将悬液分成俩个相等的部分,编号#1和#2,于4℃、13000r/min离心10min。
3.对#1管中的沉淀,加19.7mL的缓冲液A和0.3mL的20%SKL储液。
剧烈搅动使
沉淀慢慢溶解。
然后静置30min。
4.#1管中溶解的蛋白悬液,置于4℃、13000r/min离心10min。
收集上清液,弃去
沉淀。
缓冲液A(1000mL)配制:
1mol/L Tris-HCl(PH 7.9)50mL,50mmol/L
0.5mol/L EDTA 1mL,0.5mmol/L
5mol/LNaCl 10ml,50mmol/L
甘油 50mL,5%
缓冲液A+50%甘油
脱氧胆酸钠(DOC)
N-十二烷基胺酸钠(SKL)。
包涵体的纯化和复性总结--最全的前人经验

<包涵体的纯化和复性总结二、包涵体的洗涤1、包涵体的洗涤问题通常的洗涤方法一般是洗不干净的,我以前是这么做的,先把包涵体用6M盐酸胍溶解充分,过滤除去未溶解的物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以一直稀释到合适的浓度,你可以找到一个合适去除杂质的办法,其实这就是梯度沉淀的方法,我觉得比通常的直接洗脱效果好。
包涵体一般难溶解,所以你要注意未溶解的部分,你可以跑电泳对比,因为有时候难溶解的就是你的目标蛋白,所以每次处理都要把上清和沉淀跑电泳对比,免得把目标蛋白弄丢了。
此外刚处理完的包涵体好溶解。
冷冻后难溶解,溶解也需要长点时间,也需要大量的溶剂。
如果说是不少不溶解的不是你要的,那就不用管了。
2、如何得到比较纯的包涵体对于包涵体的纯化,包涵体的前处理是很重要的。
包涵体中主要含有重组蛋白,但也含有一些细菌成分,如一些外膜蛋白、质粒DNA和其它杂质。
洗涤常用1%以下的中性去垢剂,如Tween、Triton、Lubel和NP40等加EDTA和还原剂2-巯基苏糖醇(DTT)、β-巯基乙醇等反复多次进行,因去垢剂洗涤能力随溶液离子强度升高而加强,在洗涤包涵体时可加50 mM NaCL。
这样提取的包涵体纯度至少可达50%以上,而且可保持元结构。
也可用低浓度的盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去包涵体表面吸附的大部分不溶性杂蛋白。
洗涤液pH以与工程菌生理条件相近为宜,使用的还原剂为0.1-5mM。
EDTA为0.1-0.3 mM。
去垢剂如Triton X-100、脱氧胆酸盐和低浓度的变性剂如尿素充分洗涤去除杂质,这一步很重要,因为大肠杆菌外膜蛋白Omp T(37 KDa)在4-8mol/L尿素中具有蛋白水解酶活性,在包涵体的溶解和复性过程中可导致重组蛋白质的降解。
对于尿素和盐酸胍的选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
包涵体产物的纯化工艺

包涵体产物的纯化工艺
纯化涉及从原料中分离和去除杂质以获得纯净化合物的工艺。
对于包含有机或无机物的体产物,其纯化工艺可以根据具体情况进行调整,但以下是一般常用的几种纯化工艺:
1. 结晶:通过温度控制和溶剂选择,使目标化合物从溶液中结晶出来,然后进行过滤、洗涤和干燥等步骤,以获得纯净的产物。
2. 蒸馏:利用成分之间的沸点差异来分离和纯化混合物。
通过加热混合物,使成分按照沸点的高低逐渐蒸发和冷凝,从而分离目标化合物。
3. 萃取:利用不同物质在不同溶剂中的溶解度差异,将目标化合物从混合物中分离提取出来。
常见的萃取方法包括溶剂萃取、液液萃取和固相萃取等。
4. 色谱:利用样品成分在移动相和固定相之间的差异,通过一系列分离和纯化步骤来分离和纯化产物。
常见的色谱方法包括薄层色谱、柱层析、高效液相色谱和气相色谱等。
5. 活性炭吸附:通过将目标化合物吸附在活性炭上,去除混合物中的杂质物质,从而纯化产物。
这种方法常用于水处理、空气净化和溶剂回收等领域。
6. 晶体化学:通过对化合物晶体结构的解析和再合成,消除晶体中的杂质,实
现产物纯化。
以上是一些常见的纯化工艺,具体选择哪种工艺取决于产物性质、目标纯度要求、经济性和实际应用等因素。
包涵体纯化实验报告

一、实验目的1. 掌握包涵体纯化的基本原理和操作步骤。
2. 学习利用离子交换层析法对包涵体进行纯化。
3. 评估包涵体纯化效果,并探讨优化纯化条件的方法。
二、实验原理包涵体是细菌表达外源蛋白时形成的一种不溶性蛋白质聚集体。
由于包涵体中的蛋白质缺乏生物活性,因此需要通过一系列操作将其溶解、复性,并最终纯化得到具有生物活性的蛋白质。
本实验采用离子交换层析法对包涵体进行纯化,通过改变缓冲液中的离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合,从而实现蛋白质的分离和纯化。
三、实验材料1. 包涵体样品2. 离子交换层析柱3. 标准蛋白样品4. 标准缓冲液5. 蛋白质浓度测定试剂盒6. 超声波破碎仪7. 离心机8. 荧光分光光度计9. 数据处理软件四、实验步骤1. 包涵体样品的处理将包涵体样品用超声波破碎仪处理,使包涵体溶解。
然后将溶液离心,取上清液作为后续实验的样品。
2. 样品预处理将样品用缓冲液稀释,调整离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合。
3. 离子交换层析将预处理后的样品上柱,用缓冲液进行洗脱,收集洗脱液。
4. 蛋白质纯化效果评估采用蛋白质浓度测定试剂盒对洗脱液进行蛋白质浓度测定,比较不同洗脱液中的蛋白质浓度,评估纯化效果。
5. 数据处理与分析利用数据处理软件对实验数据进行统计分析,探讨优化纯化条件的方法。
五、实验结果1. 包涵体样品经过超声波破碎后,溶液变得清澈,说明包涵体已成功溶解。
2. 通过离子交换层析法,成功将包涵体中的蛋白质与层析柱上的亲和基团结合,实现了蛋白质的分离和纯化。
3. 通过蛋白质浓度测定,发现洗脱液中的蛋白质浓度明显高于未处理的样品,说明纯化效果良好。
4. 通过数据分析,发现改变缓冲液中的离子强度和pH值对包涵体纯化效果有显著影响。
在一定范围内,增加离子强度和降低pH值有利于提高蛋白质的纯化效果。
六、实验结论1. 本实验成功实现了包涵体的纯化,并获得了具有生物活性的蛋白质。
包涵体洗涤纯化

包涵体洗涤纯化-CAL-FENGHAI.-(YICAI)-Company One11包涵体洗涤试剂1.1裂解液50mmol/L Tris·Cl(pH7.2),10mmol/L EDTA,300mmol/L NaCl.。
1.2Buffer I20mmol/L Tris-HCl,5mmol/L EDTA,100mM NaCl。
1.32M/4M/8M 尿素溶液分别称取2mol/4mol/8mol的尿素,用Buffer I定容至1L即可。
2工程菌的大量表达从平板上挑生长饱满的单克隆菌落接种于25ml LB(含抗生素),37℃振荡培养过夜。
将培养菌液按1:1000扩种,至装有500ml LB(含抗生素)的1000ml三角培养瓶中,培养的瓶数根据需要而定。
37℃振荡培养,至OD600nm1.0左右。
使菌液冷却,加IPTG至终浓度为0.2mmol/L,25℃,诱导6hr。
收集菌体,4℃,10,000g离心4min。
以培养液体积的1/50量的裂解液悬浮。
冰浴,用超声破碎仪或高压均质机破碎菌体。
超声条件为:输出功率70%,作用2sec、间歇4sec为一个脉冲,共作用时间累计30min/100ml裂解液。
同时保留上清和沉淀部分,分别制样进行SDS-PAGE分析。
3包涵体的洗涤纯化包涵体沉淀以裂解液等体积的2% Triton X100(Buffer I溶解)重悬,37℃,振荡30min。
4℃,8,000g,离心10min,沉淀以等体积的Buffer I重悬,超声波处理5min/100ml悬浮液。
4℃,8,000g,离心10min,沉淀以等体积的2% Triton X100(Buffer I 溶解)重悬,37℃,振荡30min。
4℃,8,000g,离心10min,沉淀以等体积的Buffer I重悬,37℃,振荡30min。
4℃,8,000g,离心10min,沉淀以等体积的2mol/L尿素溶解,室温搅拌30min。
包涵体纯化方法及包涵体蛋白制备
包涵体纯化方法及包涵体蛋白制备重组蛋白在大肠杆菌、酵母、哺乳动物中的表达可分为三种形式:胞外分泌表达、胞内可溶性表达和胞内不溶性表达(即产物以包涵体形式存在)。
以包涵体形式存在的重组蛋白是无生物活性的,需要进行复性处理,然后再进行分离纯化。
包涵体纯化与传统生物大分子的分离纯化方法相似,即以分子的等电点、溶解性、亲疏水性以及与其它分子的亲和性等特征为基础进行纯化。
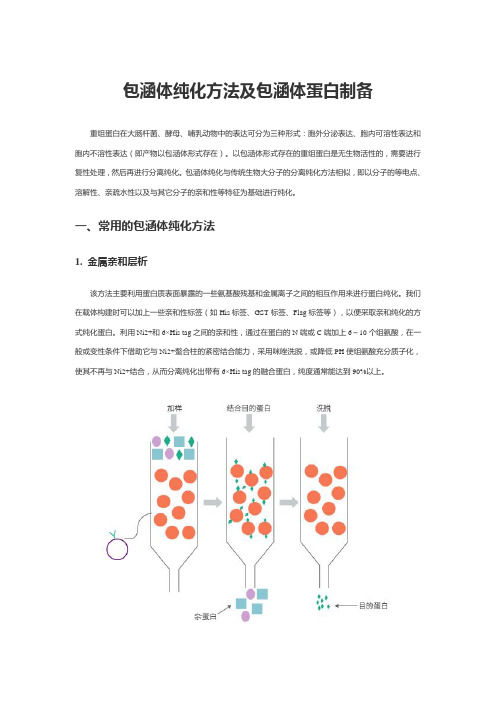
一、常用的包涵体纯化方法1. 金属亲和层析该方法主要利用蛋白质表面暴露的一些氨基酸残基和金属离子之间的相互作用来进行蛋白纯化。
我们在载体构建时可以加上一些亲和性标签(如His标签、GST标签、Flag标签等),以便采取亲和纯化的方式纯化蛋白。
利用Ni2+和6×His tag之间的亲和性,通过在蛋白的N端或C端加上6~10个组氨酸,在一般或变性条件下借助它与Ni2+螯合柱的紧密结合能力,采用咪唑洗脱,或降低PH使组氨酸充分质子化,使其不再与Ni2+结合,从而分离纯化出带有6×His tag的融合蛋白,纯度通常能达到90%以上。
2.离子交换层析离子交换层析是根据在一定pH条件下,蛋白质所带电荷不同而进行的分离的方法。
常用的离子交换剂有羧甲基纤维素(阳离子交换剂,弱酸型)和二乙基氨基乙基纤维素(阴离子交换剂,弱碱型)。
阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,需要通过提高洗脱液中的盐浓度等措施将其洗脱下来。
根据蛋白质结合能力不同,洗脱的速度会存在差异,通常结合较弱的蛋白质先被洗脱。
反之,阳离子交换基质会结合带有正电荷的蛋白质,可以通过提高洗脱液的PH或增加洗脱液中的盐浓度将蛋白洗脱下来。
3.凝胶过滤层析凝胶过滤层析通常又称为分子筛方法,主要是根据蛋白质的大小和形状达到分离和纯化的目的。
一般是大分子先流出来,小分子后流出来。
此方法的优点在于层析所用的凝胶属于惰性载体,不带电荷并且吸附力弱,可较广的温度范围内进行。
包涵体的纯化

包涵体的纯化关于包涵体的纯化是一个令人头疼的问题,包涵体的复性已经成为生物制药的瓶颈,关于包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化,内容比较庞杂一、菌体的裂解1、怎样裂解细菌?细胞的破碎方法1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
此法适用于动物内脏组织、植物肉质种子等。
2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。
对超声波及热敏感的蛋白和核酸应慎用。
4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。
无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。
基因工程包涵体的纯化方法

基因工程包涵体的纯化方法基因工程可真是个神奇的领域,像是现代科技的魔法师,把DNA这个小家伙们玩弄得团团转。
在这片神秘的土地上,包涵体就像是隐藏的宝藏,得先把它们找出来,再通过纯化的方法把这些小宝贝洗净,才能让它们为我们所用。
今天,我们就来聊聊基因工程包涵体的纯化方法,让这趟旅程轻松愉快。
1. 什么是包涵体?首先,包涵体可不是某种古怪的生物,它们其实是细胞在生产某些蛋白质时,形成的一种颗粒。
就像是做饭时,锅里油烟聚集的那些小油滴,虽然它们看起来不太好,但里面可藏着好东西。
你要知道,包涵体里面有大量的目标蛋白质,但通常它们会和其他杂质混在一起,像是大海捞针,得费点功夫才能捞出来。
1.1 包涵体的形成当细胞用上基因工程的技术,强行让某种蛋白质“上班”时,有时候它们就会不太乖,聚集成包涵体。
这就像你在做作业时,有的题目就特别难,结果一堆答案写错了,最后只好把它们堆到一边。
虽然包涵体一开始可能看起来像个废物,但其实它们是生产特定蛋白质的一种“副产品”。
1.2 包涵体的用途那包涵体有什么用呢?别小看了它们,它们可是制药、疫苗开发的重要角色。
有的包涵体能转化为活跃的蛋白质,成为我们需要的药物,甚至可以用于研究新治疗方法,简直就是科研界的“黑马”。
所以,找到它们、纯化它们,那可是相当重要的任务。
2. 包涵体的纯化步骤接下来,我们就要聊聊如何把这些包涵体给纯化出来,步骤其实不复杂,但得有点耐心。
2.1 细胞裂解首先,得把细胞给撬开,就像剥开一个鸡蛋,才能见到里面的蛋黄。
这里我们通常会用一些裂解缓冲液,像是加盐的水,帮助细胞膜变得松软。
然后,咱们可以用超声波处理、化学试剂或者冷冻融化的方式把细胞打散,让包涵体慢慢浮出来。
2.2 离心分离一旦细胞裂解,包涵体就会在液体中游荡。
这时候,就要用离心机来大显身手了。
离心机就像是一位厨师,用强大的“旋转功力”把细胞残骸和包涵体分开。
你可以想象,把一大锅汤放进离心机,旋转后,沉淀物就会在底下,清汤会在上面。
包涵体蛋白纯化步骤

包涵体蛋白纯化步骤引言:包涵体蛋白纯化是生物技术和生物制药领域中重要的工艺步骤之一。
通过纯化包涵体蛋白,可以获得高纯度的目标蛋白,为后续的研究和应用提供了基础。
本文将介绍包涵体蛋白纯化的一般步骤,包括细胞破碎、包涵体回收、包涵体溶解、亲和层析和蛋白质再折叠等。
一、细胞破碎:细胞破碎是包涵体蛋白纯化的第一步。
通常使用机械方法(如超声波破碎或高压均质)或化学方法(如洗涤剂破碎)来破碎细胞,释放包涵体蛋白。
需要注意的是,破碎条件应该使得包涵体蛋白能够充分溶解而不会发生蛋白质降解。
二、包涵体回收:包涵体蛋白通常以包涵体的形式存在于细胞裂解液中。
包涵体回收是将包涵体从其他细胞成分中分离出来的过程。
一种常用的方法是通过离心将细胞碎片和其他细胞成分与包涵体分离。
此外,还可以使用过滤、沉淀或超滤等技术来实现包涵体的回收。
三、包涵体溶解:包涵体蛋白在还原条件下通常以不溶性的形式存在。
为了使包涵体蛋白能够溶解,通常需要添加变性剂(如尿素或胍氯酸)和还原剂(如二硫醇)。
通过调节溶解条件,可以使得包涵体蛋白迅速溶解为可溶性蛋白。
四、亲和层析:亲和层析是包涵体蛋白纯化的关键步骤之一。
通过将目标蛋白与亲和层析介质上的亲和配体结合,可以实现目标蛋白的富集和纯化。
亲和配体可以是金属离子、抗体或亲和标签等。
在亲和层析过程中,需要注意选择合适的亲和配体和适宜的洗脱条件,以实现对目标蛋白的高效纯化。
五、蛋白质再折叠:由于包涵体蛋白在还原条件下溶解,其折叠状态通常不完整。
为了使得目标蛋白具有正确的结构和功能,需要对其进行再折叠。
常用的再折叠方法包括逐渐降低变性剂浓度、添加折叠辅助剂和调节pH 值等。
通过适当的再折叠条件,可以使得目标蛋白恢复到天然的折叠状态。
结论:包涵体蛋白纯化是一项复杂的工艺步骤,需要经过细胞破碎、包涵体回收、包涵体溶解、亲和层析和蛋白质再折叠等步骤。
通过这些步骤的有序进行,可以得到高纯度和高活性的包涵体蛋白。
随着生物技术和生物制药的不断发展,对包涵体蛋白纯化技术的要求也越来越高,希望通过不断的研究和创新,能够进一步提高包涵体蛋白纯化的效率和纯度,为生物医药领域的研究和应用提供更好的支持。
6HIS 包涵体蛋白纯化方法

6HIS 包涵体蛋白纯化—复性方法
1.摇500ml菌至OD小于0.5时加IPTG在37℃诱导表达3小时。
2.离心,将沉淀置于-20℃冻融。
(可无)
3.用8M尿素重溶沉淀:先用0.5ml tris-cl buffer 将沉淀吹打成悬浮状,再加入20ml 8M尿素,摇匀,室温于脱色摇床上摇20分钟,充分溶解沉淀。
4.12000rpm,15℃以上离心15分钟。
5.挂柱:取上清与平衡好的镍柱柱料混合,室温于脱色摇床上摇20分钟。
6.WASH:ph8.0尿素(8M)十倍体积
7.洗脱:PH5.0
8.选浓度OD在1.0以上的来透析,透析之前加1mMDTT,两种buffer:
IB solubilization(10×):caps(3-[Cyclohexylamino]-1-propanesulfonic acid) 500mM PH11.0 N-lauroylsarcosine(30%)10×
Sometimes: 3M NDSB(10×)
9.先加到4M 尿素in Tris 50mM,并加DTT到1mM按PH8.5
10. 降至2M, 成分同上,并加150mMNaCl
11. 降到1M 同10
12. 最后透析液:Tris 50mM
NaCl 150mM
DTT 1mM
PH8.2
13.再透析去掉DTT。
包涵体纯化技术

包涵体纯化技术嘿,咱今儿就来唠唠这包涵体纯化技术!你知道吗,这包涵体就好像是一个神秘的小宝藏,藏在细胞里面呢!要把它纯化出来,那可得有点本事。
想象一下,细胞就像是一个大仓库,包涵体呢,就是仓库里被不小心藏起来的宝贝。
我们要做的就是想办法把这个宝贝找出来,还不能把其他乱七八糟的东西也带出来。
这可不是件容易的事儿啊!首先呢,得把细胞给破开,让包涵体露出来。
这就好比是打开仓库的大门,才能看到里面的宝贝呀。
然后呢,通过一些巧妙的方法,把包涵体和其他杂质分离开来。
这就像是在一堆杂物里,精准地挑出我们想要的那个小物件。
这其中啊,有各种各样的方法和技巧。
比如说,有些方法就像是一个精细的筛子,能把大小合适的包涵体筛出来,把不合适的给挡在外面。
还有些方法呢,就像是有一双神奇的手,能准确地抓住包涵体,而不碰到其他的东西。
纯化的过程就像是一场精细的手术,每一个步骤都得小心翼翼,不能有丝毫的马虎。
要是不小心弄错了一步,那可能就前功尽弃啦!哎呀,这可真让人提心吊胆啊。
而且啊,不同的包涵体可能需要不同的纯化方法呢。
这就好比不同的宝贝需要用不同的工具去挖掘一样。
有的可能很容易就纯化出来了,可有的就像个调皮的小孩,得费好大的劲才能抓住它。
在这个过程中,经验可是非常重要的哦!那些经验丰富的科学家们,就像是熟练的老猎人,能够轻松地找到最佳的方法和路径。
他们知道什么时候该用什么方法,怎么才能让包涵体乖乖地听话。
纯化出来的包涵体,那可都是宝贝呀!它们可以用来做很多重要的事情呢,比如说研究蛋白质的结构和功能,或者用来开发新的药物。
你说这包涵体纯化技术是不是很神奇?它就像是一个魔法,能把那些隐藏在细胞里的宝贝给变出来。
虽然过程充满了挑战和困难,但当我们成功地纯化出包涵体的时候,那种成就感可真是无法用言语来形容啊!所以啊,可别小瞧了这包涵体纯化技术,它可是有着大用处呢!。
包涵体蛋白3种纯化方法的比较

包涵体蛋白3种纯化方法的比较目的比较3种纯化方法对表达的肠道病毒71型(EV71)VP1区包涵体蛋白的纯化效果。
方法分别用差速离心法、固定化金属离子亲和层析(IMAC)及不同浓度饱和硫酸氨沉淀法3种包涵体蛋白纯化法对原核表达EV71 VP1包涵体蛋白进行纯化,蛋白垂直(SDS-PAGE)电泳检测蛋白纯化效果。
结果差速离心法可以进行大批量表达蛋白纯化,纯化效果较好,但存在蛋白损失较多,且纯化蛋白不能反复冻融的问题。
IMAC柱纯化获得的蛋白纯度较高,且蛋白性状稳定,但仍存在纯化蛋白量较少的问题。
饱和硫酸氨沉淀纯化法无法获得纯度较高的包涵体蛋白。
结论差速离心法可用于大批量蛋白纯化,纯化蛋白应避免反复冻融,可小量分装冻存后备用。
IMAC柱纯化可获得纯度较高且性状相对稳定的纯化蛋白,其在相应抗体检测方法学的建立及疫苗制备方面均有广泛用途。
饱和硫酸氨法只适用于表达蛋白的初步浓缩纯化。
[Abstract] Objective To compare the expressed inclusion body protein of EV71 VP1 with three purification methods. Methods The expressed EV71 VP1 inclusion body protein was purified by differential centrifugation,IMAC column purification and ammonium sulfate precipitation. SDS-PAGE experiments determinate the purity effects. Results Expressed inclusion body purification in large quantities could been undertaken by differential centrifugation and the purification effect was better but with a lot of protein loss and the purified protein could not be repeatedly frozen and thawed. The purification effect of IMAC was good and stable,but less purified protein was purified. High purity of inclusion body protein wasn’t obtained by ammonium sulfate precipitation. Conclusion Differential centrifugation is applicable in large quantities of protein purification,but avoid repeatedly freezing and thawing. The protein purification of IMAC can be used to establish corresponding antibody detection methods. The ammonium sulfate precipitation is only applicable for the preliminary purification of the expressed proteins.[Key words] Inclusion body protein;Protein purification;SDS-PAGE electrophoresis包涵体是外源基因在细胞中表达量过高形成的一种膜包裹的高密度、不溶性蛋白颗粒。
包涵体纯化

1. 融合蛋白上清液及包涵体溶解液的制备1) 按照摸索出的最佳表达条件集菌400mL,6000rpm离心10min,收集菌体;2) 用40ml的缓冲液重悬菌体进行洗涤,重离心弃上清;3) 加40ml冰浴的缓冲液,重悬菌体沉淀4) 冰上超声破碎菌体,超声2s,间隔10s,功率800W,超声40次;5) 18000rpm离心30min,取上清备用;6) 向离心后沉淀中加入40ml的包涵体洗涤液,重悬沉淀,冰浴超声洗涤一次:超声2s,间隔10s,功率1200W,超声40次;7) 12000rpm离心10min,弃上清,留沉淀;8) 包涵体沉淀的溶解:向洗涤后的包涵体沉淀中加入20ml的包涵体溶解液,用5mL枪头吹散沉淀,室温下放置1个小时使其充分溶解,18000rpm离心30min,取上清即得包涵体溶解液;9) 将包涵体溶解液装入透析袋中(透析范围:8000-14000),置于含4mol/L尿素的透析液中,4℃透析2h,然后转入含2mol/L尿素的透析液中,4℃透析12h,最后转入含0mol/L尿素的透析液中,4℃透析24h,充分脱尿素。
2. 利用凝血酶切割融合蛋白得到目的蛋白按照10bp凝血酶/mg融合蛋白的比例加入凝血酶,25℃水浴切割12h。
3. 利用GST亲和层析纯化融合蛋白菌体破碎后上清或者透析后包涵体溶解液1) 30ml的1×PBS预平衡Glutathione-Sepharose 2ml柱(含1ml Glutathione-Sepharose亲和介质),液体的流速0.4ml/min;2) 上样:菌体破碎后上清或者透析后包涵体溶解液过Glutathione-Sepharose 2ml柱,反复过两次;3) 洗涤杂蛋白:用10ml的1×PBS洗涤杂蛋白;4) 洗脱:向柱子中加入洗脱液(10mM reduced Glutathione)进行洗脱,利用记录仪记录洗脱峰;5) 收集洗脱液,利用Bradford法检测蛋白浓度;6) 用30ml的1×PBS洗涤Glutathione-Sepharose 2ml柱;7) 用10ml的含有20%乙醇的1×PBS洗涤Glutathione-Sepharose 2ml柱,4℃保存。
包涵体重组蛋白不同纯化方法的比较

包涵体重组蛋白不同纯化方法的比较1. 本文概述本文旨在比较三种不同的纯化方法对表达的肠道病毒71型(EV71)VP1区包涵体蛋白的纯化效果。
研究中使用了差速离心法、固定化金属离子亲和层析(IMAC)以及不同浓度饱和硫酸铵沉淀法这三种包涵体蛋白纯化方法,并对原核表达的EV71 VP1包涵体蛋白进行了纯化。
通过蛋白垂直(SDSPAGE)电泳检测了蛋白的纯化效果。
研究结果显示,差速离心法适用于大批量蛋白纯化,纯化效果较好,但存在蛋白损失较多且纯化蛋白不能反复冻融的问题。
IMAC柱纯化可获得纯度较高且性状相对稳定的纯化蛋白,但在纯化蛋白量方面存在较少的问题。
而饱和硫酸铵沉淀纯化法则无法获得纯度较高的包涵体蛋白。
本文得出的结论是,差速离心法适用于大批量蛋白纯化,但应避免纯化蛋白的反复冻融,可采用小量分装冻存的方式备用。
IMAC 柱纯化适用于获得高纯度且性状稳定的纯化蛋白,在抗体检测方法学的建立及疫苗制备方面有广泛的应用。
饱和硫酸铵法仅适用于表达蛋白的初步浓缩纯化。
2. 包涵体重组蛋白的形成机制包涵体是外源基因在细胞中表达量过高时形成的一种膜包裹的高密度、不溶性蛋白颗粒。
这种蛋白通常不具有生物学活性,其分子的空间结构表现为非折叠态的聚集体,但复性后可以恢复其生物学活性。
包涵体形成的主要原因包括:蛋白表达量高,合成速度快:当蛋白表达量过高或合成速度过快时,蛋白质可能没有足够的时间进行正确的二硫键配对,导致蛋白质溶解度差,从而形成包涵体。
氨基酸组成:蛋白质中涉及二硫键配对的半胱氨酸含量越多,越容易形成包涵体。
脯氨酸的含量也与包涵体的形成呈正相关。
重组蛋白产生环境:发酵温度高或胞内pH接近蛋白的等电点时,蛋白质的正确折叠和组装受到影响,容易形成包涵体。
蛋白异源性:在大肠杆菌等原核生物中表达真核生物的蛋白质时,由于缺乏真核生物中翻译后修饰所需的酶类,可能导致中间体大量积累,从而形成包涵体沉淀。
包涵体的形成虽然会导致重组蛋白的不溶性,但也存在一些优势,如避免内源和外源蛋白酶的降解、降低细胞质中外源蛋白的含量、减少杂蛋白等,这些特性使得包涵体更有利于重组蛋白的纯化。
包涵体分离纯化

包涵体分离纯化1. 2×YT 液体培养基:Tryptone 8gY east Extract 5gNaCl 2.5g定容至500ml,高压灭菌挑取单菌落接种于3 ml 2YT 液体培养基(加Amp)(不加蔗糖)中,于37℃,180rpm/min 摇床培养过夜。
取过夜培养物按1:100 接种于新鲜的2×YT 液体培养基(加蔗糖)(Amp50μg/ml)中,在37℃摇床培养,在菌种长到OD600约为0.4 时,向培养基中加入IPTG,使IPTG 的终浓度为0.5mM,诱导表达4h。
2.0.1MTris-HCL 缓冲液(PH7.5):称取6.05gTris,水溶解,PH7.5,定容至500ml。
20mMTris-HCL 缓冲液(PH7.5):0.1MTris-HCL 缓冲液稀释五倍。
包涵体洗涤液Ⅰ:TritonX-100 1ml NaCl 0.585g Urea 6g 0.1MTris-HCl20ml 定容至100ml,PH7.5。
包涵体洗涤液Ⅱ:将包涵体洗涤液Ⅰ稀释10 倍。
将诱导表达后的菌液离心收集菌体,,用事先预冷的20mM Tris-HCl(PH7.5)将菌体洗涤一次,将菌体重悬于20mM Tris-HCl(PH7.5)缓冲液中(或者加1mg/ml 溶菌酶),-80℃,反复冻融后,超声波破碎菌体,12000 rpm/min 离心5min,收集包涵体。
将收集的包涵体依次用洗液(溶液Ⅰ和溶液Ⅱ)洗涤,每种溶液洗涤三次。
DS-PAGE 检测洗涤效果。
洗涤后的包涵体重悬于20mMTris-HCl (PH7.5)中保存,每克湿重包涵体加入10ml 20mM Tris-HCl (PH7.5)。
3.包涵体溶解将20mM Tris-HCl溶解的包涵体离心收集沉淀,每克包涵体湿重加20ml 20mM Tris-HCl,8M 尿素,PH7.5 的包涵体溶解液,悬涡震荡2 小时,使包涵体充分溶解,12000rpm/min 离心5min,取上清,过滤除杂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
包涵体纯化方案
缓冲液配方:
1. 变性复性缓冲液
①②
缓冲液 A: 50mM Tris-HCl (pH8.5), 1mM EDTA , 100mM NaCl ,1%Triton
③
X-100
缓冲液 B:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl ,1%Triton X-100 ,④
2M 脲素
缓冲液 C: 50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl ,1%Triton X-100 缓冲液 D:50mM Tris-HCl (pH8.5), 1mM EDTA, 100mM NaCl ,1%Triton X-100 ,
④
2M 盐酸胍
溶解缓冲液 E: 50mM Tris-HCI (pH8.5), 1mM EDTA, 100mM NaCI , 1OmM B -巯基
⑤⑥
乙醇 /DTT , 2mM 脱氧胆酸钠, 8M 脲素
复性缓冲液: 50mM Tris-HCI (pH8.5), 100mM NaCI , 6M/4M/2M 脲素, 1 %甘氨⑦ ⑧ ⑨
酸,5%甘油,0.2%PEG , 1mM氧化型谷胱甘肽,1mM还原型谷
⑩ 胱甘肽
2. 纯化缓冲液
Binding buffer : 50mM Tris-HCI, 100mM NaCI, 10mM 咪唑, pH8.5
EIution buffer : 50mM Tris-HCI, 100mM NaCI, 不同浓度梯度咪唑 , pH8.5
具体实施步骤:
1. 大量诱导表达的菌液7000rpm离心10min。
弃上清,用1 >PBS重悬,洗涤菌体细胞,7000rpm,离心10min。
再用PBS重复洗一遍。
离心后留菌体沉淀。
2. 将菌体细胞用缓冲液 A重悬,液氮中反复冻融后,超声破碎。
13000rpm离心 10min,弃上清,收集包涵体沉淀。
2.分别用缓冲液B、C、D超声清洗包涵体沉淀。
13000rpm离心10min收集沉淀。
3•用缓冲液E溶解包涵体,缓慢摇动使其缓慢溶解,室温放置30min,然后13000rpm离心10mi n。
取上清。
4. 将上清稀释至0.1-1.0mg/ml,装入透析袋中,放置于梯度复性缓冲液中,4C缓慢透析24-36h。
最后在纯化binding buffer中透析,确保蛋白稳定可溶。
5. 对溶解的包涵体蛋白进行亲和层析。
附注:
①EDTA防止蛋白降解
②NaCI —定的盐离子可降低某些带电基团间的斥力
③Triton X-100除去其他细菌成分,如膜外蛋白,质粒 DNA和其他杂质
④脲素,盐酸胍,洗掉包涵体表面的不溶性杂蛋白
⑤&巯基乙醇/DTT作为还原剂打开错配的二硫键
⑥脱氧胆酸钠作为离子型去垢剂能促溶蛋白
⑦⑧甘氨酸、甘油促溶
⑨PEG可逆修饰折叠中间体的疏水基团
⑩氧化型和还原型谷胱甘肽促进二硫键的形成。
(11)1g 菌使用 35mI 液体重悬即可。
