第三节磷及其化合物
磷及其化合物

③磷酸比硝酸稳定,不易分解 。
制法:高纯度磷酸制法: 4P(白磷) + 5O2 =点=燃 2P2O5
P2O5 + 3H2O热=水= 2H3PO4 工业制法:Ca3(PO4)2 + 3H2SO4 =△= 2H3PO4 + 3CaSO4↓
3、磷酸盐
(1)种类:一种正盐 、两种酸式盐 (三种)
(2)转化关系:
+ OH-
+ OH-
H3PO4 + H+
H2PO4- + H+
(3)三种盐的溶解规律:
HPO42-
+ OH- + H+ PO43-
① 除K+ 、Na+ 、NH4+ 外, 其余的正盐和一氢盐均不溶于水。 ② 所有的二氢盐均易溶于水。
(4)常见的磷肥:①普钙 (过磷酸钙) ②重钙 (重过磷酸钙)
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4 ( 普钙 ) Ca3(PO4)2 + 2H3PO4 = 3Ca(H2PO4)2 ( 重钙 )
注意: 普钙和重钙在施用时不可与碱性物质混用
H2PO4- + 2OH- = PO43- + 2H2O
五、磷的化合物
1、五氧化二磷(P2O5) 物性:白色固体 ,有强烈的吸水性 、脱水性,作干燥剂。 化性:P2O5 + H2O(冷水) = 2HPO3 (剧毒)
P2O5 + 3H2O(热水)= 2H3PO4(无毒) 2、磷酸(H3PO4) 物性:无色透明晶体,有吸湿性,与水以任意比互溶。
无机化学下册氮族省名师优质课赛课获奖课件市赛课一等奖课件

b. 物理性质:
熔沸点较低 溶解度大
偶极矩较大,介电常数较大。 液氨是极性溶剂,它能够溶解碱金属形成蓝色溶液 17
Na
Na+ + e-
Na+ +xNH3
e- + yNH3 c. 化学性质:
Na(NH3)x+ e(NH3)y-
I. 还原性:
Cl2少许
N2+ NH4Cl
NH3
Cl2过量 CuO
NCl3+ HCl
原子半径/pm
70 110 121 141 155
r(M3-)/pm 171 212 222 245 213
离子 半径
r(M3+)/pm
16
44
58
76 103
r(M5+)/pm 13
38
46
60
76
I1/(kJ·mol-1) 电负性
1402 1012 944 832 703 3.04 2.19 2.18 2.05 2.02
sp2杂化 分子中有34
••
N • H
23
a. 构造: b. 弱碱性:
NH3 > 联氨 > 羟氨
联氨有两对孤电子对,所以体现出二元弱碱性,碱性
比氨弱:
N2H4+H2O==N2H5++OH- K1=8.5×10-7(298K) N2H5++H2O==N2H62++OH- K2=8.9×10-16(298K)
ns2
np3
5
ⅤA
氮(N) 磷(P) 砷(As) 锑(Sb) 铋(Bi)
原子序数
7
15
33
51
83
价层电子构型 2s22p3 3s23p3 4s24p3 5s25p3 6s26p3
中国农业大学_864植物营养学_《植物营养学(上)》陆景陵_第三节_磷

(一)缺磷
植物光合作用 呼吸作用 生物合成过程
(三)积极参与体内的代谢
1、碳水化合物代谢
在光合作用中,光合磷酸化作用必须 有磷参加; 光合产物的运输也离不开磷。
二、磷的营养功能
Pi对光合作用中蔗糖及淀粉形成的调节
蔗糖合成不同途径的示意图
Pi
磷酸蔗糖
磷酸蔗糖 合成酶
葡萄糖 6-磷酸葡萄糖 6-磷酸果糖
蔗糖
蔗糖合成酶
果糖
2.氮素代谢
磷是氮素代谢过程中一些重要酶的组分 硝酸还原酶 氨基转移酶
磷含量 (mg P/100籽粒)
6 全磷
4 植素磷
2
Pi
0
0
10
20
30
开花后天数
水稻籽粒发育过程中,
籽粒中无机磷和植素磷含量的变化
磷酸化葡萄糖
淀粉+Pi 磷脂 无机磷 磷酸酯 RNA+DNA
3 2.5
含量(%)
2
1.5
1
0.5
0 0
24
48
72
发芽时间(h)
在发芽期间水稻种子中磷组分的变化
影响吸收磷的主要因素
3、温度 温度升高有利于磷的吸收。增加 水分也有利于土壤溶液中磷的扩散,因此能提高 磷的有效性。
4、养分的相互关系 磷与氮在植物的吸收 和利用方面相互影响。施用氮肥能促进磷的吸收。
三、作物对磷的吸收和利用
(三)利用
根系吸收的磷酸盐进入细胞后迅速参与代谢作用(?)
磷被吸收10分钟内就有80%的磷酸盐 可结合到有机化合物中,即形成 有机含磷化合物。
提高体内可溶性糖和磷脂的含量
细胞原生质的冰点降低
增强细胞对温度变化的适应性
磷及其化合物ppt课件

29
A. +5 B. +3 C. –3 D. -6
22
8、牙齿表面由一层硬的、组成为Ca5(PO4)3OH 的物质保护着,它在唾液中存在下列变化:
脱矿
Ca5(PO4)3OH(固)矿化5Ca2++3PO43-+OH-
(1)进食后,细菌和酶作用于食物产生有机酸,这时
牙齿就会受到侵蚀,其原因是________________。
Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
重过磷酸钙(重钙)
PO43-的检验:
纯净物
12
例题
1、有一固体单质,质软,在空气中极易
燃烧,生成物溶于热水后滴加紫色石蕊试
剂显红色。把所得溶液分盛两支试管,向
第一支试管中滴入少量饱和澄清石灰水,
无混浊出现,若继续滴加,出现白色混浊,
过量则产生白色沉淀。过滤,取少量白色
沉淀投入第二支试管,则沉淀消失。试确
定该单质的化学式。写出有关的化学方程
式。
13
点燃
P4+5O2==2P2O5 P2O5+3H2O===2H3PO4 2H3PO4+Ca(OH)2==Ca(H2PO4)2+H2O Ca(H2PO4)2+Ca(OH)2==2CaHPO4↓+2H2O 2CaHPO4+Ca(OH)2==Ca3(PO4)2↓+2H2O Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
24
9、亚磷酸H3PO3是一种无色晶体,有大蒜气味和 强吸湿性。 (1)在亚磷酸溶液中加入过量的NaOH溶液,生 成的主要产物是Na2HPO3,这一事实说明亚磷酸 是几元酸。推断它的电离方程式和结构式。 (2)亚磷酸具有强还原性,当它与碘水混合后, 可以看到碘水的棕黄色褪去,经检验有磷酸生成, 写出有关方程式。 (3)在亚磷酸溶液中加入AgNO3溶液后,有黑 色沉淀生成和无色气体产生,试管口有红棕色气 体产生。写出有关方程式。
第4章氮族元素

2 NH2OH + 2 AgBr === 2 Ag + N2 + 2 HBr+ 2 H2O 2NH2OH + 4 AgBr === 4 Ag + N2O +4 HBr +H2O
1.熟悉氮元素在本族元素中的特殊性。 2、掌握氮、磷以及它们的氢化物,含氧酸 及其盐的结构、性质、制备和用途。 3、熟悉本族元素不同氧化态间的转化关系,
4、掌握砷、锑、铋单质及其化合物的性质递 变规律。 5、从结构特点上分析理解本族元素的通性和特性。
本章讲解内容
第一节 通性
第二节 氮及其化合物 第三节 磷及其化合物 第四节 砷 锑 铋
NH2OH+2Fe(OH)2+H2O=2Fe(OH)3+NH3
3.氮化物 (N— )
离子型氮化物只存在于固态,水 溶液中水解为氨: 3Mg+N2=Mg3N2 Mg3N2+6H2O=3Mg(OH)2+2NH3
间充型氮化物不服从一般化合价定律, 如TiN、Mn5N2、W2N3等,氮原子填充在 金属晶格的间隙中,化学性质稳定, 熔点高,硬度大,用于作高强度材料。 氮与非金属元素如C,Si,P等可形成共 价型氮化物,这类化合物中,氮元素 氧化数为-3,如AlN, BN, GaN, Si3N4 等,它们都是大分子物质,熔点高。
结构式:N
N
由于N2分子中存在叁键N≡N,所以N2分子具有很 大的稳定性,将它分解为原子需要吸收946 kJ•mol1的能量。N 分子是已知的双原子分子中最稳定的。 2
主要反应
加热加压催化剂
N2+3H2===========2NH3
无机化学 磷的含氧化合物 PPT课件

易溶的碱金属的正盐水解, 溶液显碱性
PO43- + H2O —— HPO42- + OH-
磷酸一氢盐水解,溶液亦显碱性
HPO42- + H2O —— H2PO4- + OH- Kh2
HPO42-—— PO43- + H+ Ka3
说明水解强于解离。
二氢盐水溶液显酸性,说明 解离强于水解。
·O·
HO P OH
OH
·· ··
·O·
HO P OH OH
磷酸结构式中 P 和 O 之间的双键, 就是一个 σ 配键和一对 d-p 配键。
·· ··
·O·
HO P OH OH
d-p 配键是对于 P=O 双键的一 种解释。
2. 磷酸的性质
纯的磷酸是固体,熔点 42℃, 沸点高,沸点 407℃。
14. 7 磷的含氧化合物
14. 7. 1 磷的氧化物
磷的氧化物以 P4O6 和 P4O10 为最常见。
1. 分子结构
P4 分子中弯曲的 P - P 键, 在 O2 分子的进攻下很易断裂。
在每两个 P 原子间嵌入一个 O 原子,则形成 P4O6 分子。
+ 3 O2
P4O6 的每个 P 上各有一个孤电子对, 还可以再结合 O 原子,形成 P4O10。
CaCl2 浓 H2SO4 KOH P4O10 H2O(g) 0.34 0.003 0.002 0.00001
P4O10 是强脱水剂,它可以使 H2SO4 脱水
P4O10 + 2 H2SO4 —— 2 SO3 + 4 HPO3
14. 7. 2 磷 酸 1. 磷酸的分子结构
磷酸 H3PO4(Ⅴ)
磷化工教学课件-第5章-磷化合物

(水量不足)
三氯氧磷
PCl5 + 4H2O = H3PO4 + 5HCl
(水过量)
6PCl5 + P4O10 = 10POCl3
五氯化磷生产工艺: 1.间歇法 2.连续法
PCl5 + CH3COOH = CH3COCl + HCl+ POCl3 PCl5 + SO2 = SOCl2 + POCl3 PCl5 + NH4Cl —— (NPCl2)n
PH3的性质 1、 PH3是无色剧毒、有大蒜气味的气体,着火点是423K,火焰为浅 蓝色。若制得的磷化氢中含有痕量的联膦(P2H2),则在常温时可自 动燃烧生成H3PO4。
2、PH3的水溶性小(与氨相比),且水溶液的碱性弱得多。
Kbo=1×10-25 PH3 +H2O
PH3 ·H2O
PH4++OH-
将赤磷和液体溴作为原料,用三溴化磷作溶剂,进行反应,制 得三溴化磷。
应用: 转化醇为溴化物 合成烯烃 合成磷酰胺的反应
(3)三碘化磷 熔点:61°C(lit.) 密度:4.18g/mL at 25°C(lit.)加热至 600k分解出碘单质。遇水迅速发生水解。
2PI3+3H2O=P2O3+3HI 3P2O3+3H2O=3H3PO3 该反应应用于氢碘酸的制备。
③反应罐应预热至150℃,否则反应太慢或不反应,导致黄磷大 量积聚,放料后遇空气即将引起燃烧。搅拌要有效,不得中断, 这样可使反应完全,防止黄磷积聚。即使如此,反应罐上仍应 装有防爆膜。 ④五硫化二磷在高温下极易自燃起火,从反应罐放入中间槽冷 却时,温度已超过300℃,必须通二氧化碳气体保护,以防自 燃。 ⑤黄磷计量罐有热水封住磷面,计量罐应有特殊设计,应使黄 磷放到一定高度时与反应管内磷面平衡;操作时也要注意,保 证放熔磷时水不进入反应管,以免五硫化二磷遇水分解,产生 大量硫化氢气体,使体积猛增而发生爆炸。硫化氢剧毒,易燃 易爆,如大量逸出后,燃烧爆炸的危险性更大。
《磷元素及其化合物》 讲义

《磷元素及其化合物》讲义一、磷元素的简介磷是一种非常重要的化学元素,原子序数为 15,位于元素周期表的第15 位。
它的元素符号是P。
磷在自然界中主要以磷酸盐的形式存在。
磷对于生命活动具有极其重要的意义。
在生物体中,磷是构成核酸、磷脂等重要生物分子的关键成分。
核酸是遗传信息的携带者,而磷脂则是细胞膜的重要组成部分。
二、磷单质1、红磷红磷是一种常见的磷单质,呈暗红色粉末状。
它的着火点相对较高,约为 240℃,比较稳定,在空气中不易自燃。
红磷常用于制造安全火柴、农药等。
2、白磷白磷是另一种磷单质,外观为白色或浅黄色半透明性固体。
白磷的性质比较活泼,着火点很低,只有 40℃左右,在空气中容易自燃,因此必须保存在水中。
白磷具有剧毒,曾经被用于军事上的燃烧弹。
三、磷的氧化物1、五氧化二磷(P₂O₅)五氧化二磷是磷在氧气中燃烧的产物,是一种白色的粉末状固体。
它具有很强的吸水性,常用作干燥剂。
但需要注意的是,五氧化二磷不能干燥氨气等碱性气体,因为会发生化学反应。
2、三氧化二磷(P₂O₃)三氧化二磷也是磷的氧化物之一,是一种无色有蒜味的气体。
在潮湿空气中会缓慢氧化为五氧化二磷。
四、磷的含氧酸1、磷酸(H₃PO₄)磷酸是一种常见的无机酸,是三元中强酸。
工业上常用硫酸处理磷矿石来制取磷酸。
磷酸在农业上是重要的化肥,在食品、制药等领域也有广泛的应用。
2、亚磷酸(H₃PO₃)亚磷酸是一种二元酸,具有较强的还原性。
3、次磷酸(H₃PO₂)次磷酸是一种一元酸,也是一种较强的还原剂。
五、磷的卤化物1、三氯化磷(PCl₃)三氯化磷是一种无色透明的液体,具有刺激性气味。
它在有机合成中是一种重要的氯化试剂。
2、五氯化磷(PCl₅)五氯化磷是一种淡黄色的固体,在加热条件下会分解为三氯化磷和氯气。
六、磷的硫化物1、三硫化四磷(P₄S₃)三硫化四磷是一种黄色固体,常用于制造火柴等。
2、五硫化二磷(P₂S₅)五硫化二磷是一种黄色结晶固体,具有很强的吸湿性,常用于润滑油添加剂等。
磷及其化合物的种类和应用

磷及其化合物的种类和应用磷是一种非金属元素,化学符号为P,原子序数为15,在元素周期表中位于氮和硅之间。
磷及其化合物具有多种应用,从饲料和肥料到药物、电池和半导体等方面都有广泛的应用。
在本文中,将介绍磷及其化合物的种类和应用。
一、磷的种类磷的自然存在形式包括白磷、红磷和黑磷。
白磷是一种有毒且易燃的物质,通常呈黄色或白色,具有刺激性气味。
红磷是一种不易燃烧的红色晶体,可以用作制造火柴头和磷光体等。
黑磷是一种具有半导体性质的物质,可用于制造电子器件。
另外,磷还可以以离子的形式存在于磷酸盐中。
磷酸盐是一种化合物,其中包含磷酸根离子(PO4 3-)和金属离子,如钙、铁和镁等。
磷酸盐是一种常见的饲料、肥料和农业化学品,在生物活动和生命过程中发挥重要作用。
二、磷的应用1.饲料和肥料磷是一种必需元素,对于维持动物和植物的生长和健康非常重要。
磷酸盐是一种主要的饲料和肥料成分,广泛用于农业生产中。
磷肥可以提高农作物的生长速度和产量,同时增加农作物的抗病性和营养价值。
在动物饲料中,磷是一种必需元素,可以促进骨骼生长和代谢过程。
2.药物磷是一种重要的药物成分,用于制造药品和医用器械。
例如,磷酸盐可以用于制造抗酸剂和钙补充剂,以改善胃肠道问题和骨骼健康。
磷酸盐还可以用于制造肾脏疾病的药物,以调节身体的酸碱平衡。
3.电池磷还可以作为电池的重要组成部分。
磷基锂离子电池是一种高效的电池类型,具有高能量密度和长寿命特点。
磷基锂离子电池被广泛应用于电动汽车、智能手机和笔记本电脑等领域。
4.半导体磷在半导体制造中也发挥了重要作用。
在半导体生产过程中,磷可以作为杂质原子加入到硅晶体中,以改变其电学性质和半导体类型。
这种技术被称为掺杂,可以使硅晶体具有导电性能并用于制造电子器件,如晶体管、集成电路和太阳能电池等。
三、结论磷及其化合物的种类和应用广泛,从生物学、化学到工程学等领域都有着重要的应用价值。
饲料和肥料中的磷酸盐可以提高农作物的产量和质量,用于制造的药物可以改善身体健康,而半导体行业中的磷掺杂技术则可以推动电子技术和新能源领域的发展。
【高中化学】高中化学知识点:单质磷及其化合物

【高中化学】高中化学知识点:单质磷及其化合物磷在自然界中的存在:自然界中没有游离磷。
磷主要以磷酸盐的形式存在于矿石中。
磷和氮一样,是蛋白质的组成部分之一。
动物骨骼、牙齿和神经组织、植物果实和芽以及生物细胞都含有磷。
磷在维持生物体正常生理功能中起着重要作用。
磷的物理性质:磷有许多亚型,其中白磷和红磷是常见的。
白磷和红磷的主要特性如下表所示。
特别提醒白磷遇光会逐渐变为黄色。
因此,白磷又称黄磷,白磷的颜色往往表述为“白色或黄色”。
白磷和红磷的化学性质:白磷和红磷都能在空气或氧气中燃烧,燃烧产物一般是五氧化二磷,且反应放出大量的热,4p+5o22p2o5磷的用途:白磷和红磷有很多用途。
例如,它们可以用来生产高纯度的磷酸;白磷可用于制造燃烧弹、烟雾弹等;红磷可用于制造杀虫剂、安全火柴等。
白磷和红磷的分子结构:白磷的分子组成为P4,分子的空间构型为四面体(如图a所示)。
红磷的结构复杂。
有些人认为红磷是一种长链分子,由P4分子在断键后结合而成(见图b)特别提醒白磷和红磷的化学式通常都写为p。
磷化合物:(1)五氧化二磷:五氧化二磷的分子式为,通常写为,分子的空间构型如图所示。
五氧化二磷通常是白色固体,由磷在空气中燃烧形成,并在632K下升华。
五氧化二磷是典型的酸性氧化物,具有酸性氧化物的通性。
五氧化二磷容易与水反应,与冷水反应生成偏磷酸,与热水反应生成磷酸,释放大量热量。
五氧化二磷的强亲水性决定了它可用作干燥剂。
五氧化二磷是一种固态、酸性、无强氧化性的干燥剂,干燥能力非常强。
(2)磷酸:磷酸为三元中强酸,属于弱电解质,易溶于水,在水中分三级电离。
纯磷酸是一种无色晶体,熔点为315K。
它沸点高,易溶于水。
磷酸无强氧化性,具有酸的通性。
为了避免br-、i-被氧化,可用浓磷酸代替浓硫酸在实验室中制备hbr和hi。
(3)磷酸盐:磷酸是三元酸,对应的盐有正盐和酸式盐:.相关高中化学知识点:氮气自然界中氮的形式:既有游离态又有化合态。
无机化学 磷的含氧化合物 PPT课件

14. 7. 1 磷的氧化物
磷的氧化物以 P4O6 和 P4O10 为最常见。
1. 分子结构
P4 分子中弯曲的 P - P 键, 在 O2 分子的进攻下很易断裂。
在每两个 P 原子间嵌入一个 O 原子,则形成 P4O6 分子。
+ 3 O2
P4O6 的每个 P 上各有一个孤电子对, 还可以再结合 O 原子,形成 P4O10。
市售 85% 的 H3PO4,相当于 15 mol·dm-3。
这种磷酸中形成许多氢键,呈 粘稠状。
磷酸是三元中强酸 。
H3PO4 H2PO4- HPO42-
H+ + H2PO4- K1 = 7.1 10-3
H+ + HPO42- K2 = 6.3 10-8
H+ + PO43- K3 = 4.8 10-13
因为 3d 和 2p 的对称性一致。
-+ + + --
就成键轨道的对称性来讲,这是 键, 且是 d-p 之间的轨道重叠。
·· ··
-+ +
·O·Biblioteka + --HO P OH OH
就共用电子对的来源讲,这是配位
键 —— 故称为 d-p 配键。
·· ··
这是含氧酸中常见的键型,该 键的强度很弱,两个这种键才相当 于一个单键。
P4O10 + 2 H2O —— 4 HPO3
水略多于上述条件时,生成 焦磷酸 H4P2O7 4 HPO3 + 2 H2O —— 2 H4P2O7
当有硝酸催化,H2O 量大于 P4O10 的 6 倍时,将很快地生成 磷酸 H3PO4
2020高中化学磷及其化合物
C、含氧酸及其盐的缩合
说明:
①、含氧酸缩合的必要条件:必须有羟基,才能脱水,否则,不能缩合。 比如,稀的HClO4不能缩合,因为质子完全解离。稀的H2SO4也不能缩合, 但是算式硫酸氢盐可缩合。 ②、酸越弱,越易缩合,缩合产物越多越稳定。
磷酸经强热时就发生脱水作用,生成焦磷酸、三磷酸等多磷酸或
五、磷的成键特征
1、离子型:P3-,第三周期,半径大,易变形,因此完全意 义上的离子化合物极少,且只能存在于干态,遇水水解。
2、共价型:由于磷的半径大,难以形成 p-p 键,但可形成 p-d 键。
3、形成配合物:主要作为配位原子,但 PF5 采用 sp3d 杂化, 有空的 d 轨道,易与 F- 结合形成 PF6-,sp3d2 杂化,后者配 位能力弱。
P4 分子中,由于键角较小,成环张力大,所以分子很不稳定。
1、磷单质的结构(P4)
白磷
分子晶体 熔点 44.15 ℃ 沸点 280.35 ℃ 密度 1.8g·cm-3
红磷
成对等边三角 形连成的链状 的巨大分子
黑磷
片层结构 网状结构 有导电性
许多磷的化合物结构与正四面体P4有关 ; 磷是亲氧元素,磷氧四面体PO4结构单元很稳定,许多 P(V)含氧化合物都是以磷氧四面体为结构基础的
2、单质与碱的作用 当单质中原子与原 子间是单键时,易 在碱溶液中发生歧 化反应。
特殊
二、氧化物:P2O3、 P2O5
P4O6
P4O10
P原子有空的3d轨道可以利用,故 P 与端基 O 之间可以形成 反馈键,p-d键,但与配位化合物中的方向正好相反。
三、含氧酸和含氧酸盐 1、PO43- 的结构:正四面体
第 3 节 磷及其化合物 Phosphorus and its Compounds
磷化学知识点高中总结

磷化学知识点高中总结一、磷的性质1. 物理性质磷是一种黄白色固体,常温下呈现为透明或半透明的晶体。
磷具有两种常见的同素异形体,即白磷和红磷。
白磷是常见的形态,它在空气中容易氧化,发出绿色荧光,因此需要存放在水中或惰性气体中。
红磷则比较稳定,是不溶于水的黑色粉末状固体。
2. 化学性质磷是一种活泼的非金属元素,它能和许多元素发生化学反应。
磷能够和氧气反应生成氧化磷,也能和氢气反应生成氢化磷。
此外,磷还能和金属形成金属磷化物,如和铝反应生成磷化铝。
3. 同位素磷拥有多种同位素,其中最常见的是磷-31,它是自然界中最丰富的磷同位素,占据了地壳中的85%。
二、磷的化合物1. 磷的氧化物磷的氧化物包括五氧化二磷(P4O10)、三氧化二磷(P2O3)、一氧化二磷(P2O)等。
其中,五氧化二磷是最常见的一种氧化物,它是一种白色晶体,可溶于水生成磷酸。
2. 磷酸盐磷酸盐是磷的重要化合物,它们在生物体内起到多种重要的作用。
磷酸盐通过水解生成磷酸根离子,可与钙、钠、镁等金属形成不同的盐类。
常见的磷酸盐包括磷酸三钙(Ca3(PO4)2)、磷酸二氢钾(KH2PO4)等。
3. 有机磷化合物有机磷化合物是一类重要的磷化合物,它们常用于农药、医药和合成材料等领域。
有机磷化合物可分为磷酸酯类、磷腈类、磷酰胺类等多种类别,它们在生产和应用中需要特别注意安全性和环境友好性。
三、磷的应用1. 农业磷是植物生长的必需元素之一,在农业生产中,磷肥的施用能够促进作物的生长和发育,提高产量和品质。
磷肥通常以磷酸盐的形式添加到土壤中,为作物提供充足的磷营养。
2. 农药农药中常含有有机磷化合物,它们具有杀虫、除草、杀菌等作用,能够起到保护作物和提高产量的作用。
3. 医药有机磷化合物在医药领域中具有重要的应用,如磷酸肌酸盐是一种重要的肌肉营养物质,具有增强肌肉功能和提高运动能力的作用。
4. 材料磷化合物在合成材料中具有广泛的应用,如磷酸酯类化合物可用于阻燃材料的生产,磷化铝可作为防腐蚀材料使用。
氮、磷及其化合物

氮、磷及其化合物一、教学目的1、掌握铵盐、硝酸盐、亚硝酸及其盐的主要性质;2、了解磷酸盐的主要性质;3、学会NH 4+,NO 3-,NO 2-,磷酸盐、偏磷酸盐和焦磷酸盐的鉴定方法。
二、实验提要N 的常见氧化值为-3,0,+3,+4,+5。
氨是氮的主要氢化物,加酸生成铵盐,加强碱生成NH 3。
氨气极易溶于水,水溶液显碱性。
铵盐是NH 3与酸所生成的化合物。
在热稳定性方面,由于NH 3的挥发性和还原性,与其它金属离子盐相比要不稳定得多,根据对应酸的行为,分解产物不同。
若对应酸无氧化性则分解放出 NH 3,如 NH 4Cl 、 (NH 4)2SO 4、(NH 4)2HPO 4、(NH 4)2MoO 4等;若对应酸有氧化性,则分解氧化,一般放出 N 2、N 2O ,如 NH 4NO 2、NH 4NO 3、(NH 4)2Cr 2O 7、NH 4ClO 4等。
铵盐的溶解行为与钾盐类似,除少数如酸式酒石酸盐、高氯酸盐外,基本上都易溶于水。
由于 NH 3是弱碱,故铵盐的水溶液由于水解一般呈酸性。
NH 4+ 的鉴定:方法一,加碱,若产生气体使红色石蕊试纸变兰,说明有NH 4+。
方法二,使奈氏试剂变成红棕色,说明有NH 4+。
HNO 2的水溶液是弱酸,K a =5.0×10-4,比醋酸的酸性略强,它可以由NaNO 2与强酸反应制得。
HNO 2是极不稳定的酸,仅在低温时存在于水溶液。
当温度高于4℃时,HNO 2就按下式分解:2HNO 2H 2O+ N 2O 3 (浅蓝色) H 2O+NO+NO 2 加热冷却 加热冷却热的条件下向右进行,冷条件下向左进行。
中间产物N 2O 3在水溶液中呈浅蓝色,N 2O 3不稳定进一步分解为棕色NO 2和无色的NO 气体。
利用该性质可以鉴定NO 2-或HNO 2。
亚硝酸和亚硝酸盐在酸性溶液中,它们的标准电极电势如下:HNO 2+H ++e===NO+H 2O E=0.99VNO 3-+3H ++2e===HNO 2+H 2O E=0.94V可见,HNO 2及其盐在酸性介质中既有氧化性又有还原性。
高三化学磷知识点总结

高三化学磷知识点总结磷是一种非金属元素,化学符号为P,原子序数为15。
它在生物体中扮演着至关重要的角色,同时也广泛用于工业制造和农业生产。
以下是关于高三化学磷知识点的总结。
一、磷的性质和常见化合物1. 磷的物理性质:磷是一种具有两种常见形态的元素:红磷和白磷。
红磷是暗红色的固体,具有难燃的性质。
白磷是黄白色或淡黄褐色的固体,具有可燃的性质。
2. 磷的化学性质:磷易与氧气反应,生成氧化磷。
红磷在空气中缓慢氧化,白磷在空气中燃烧,并生成白磷酸。
磷也能与其他元素形成多种化合物,如磷化氢、磷酸等。
3. 磷的常见化合物:a. 磷化氢(化学式:PH3):磷化氢是一种无色易燃气体,有刺激性的气味。
其用途广泛,如用作燃料、杀虫剂、还原剂等。
b. 磷酸(化学式:H3PO4):磷酸是一种无色透明的液体,具有强酸性。
它广泛应用于农业、食品工业和医药工业中,如做肥料、食品添加剂和制药原料等。
二、磷的化合物合成和应用1. 磷的制取:磷的主要制取方法有两种:从磷矿石中提取和通过化学反应合成。
磷矿石中的磷酸钙可以经过煅烧得到无水磷酸钙,再与煤焦反应制得磷酸钙。
另外,磷还通过化学反应合成磷化氢、磷酸和其他化合物。
2. 磷的应用:a. 农业方面:磷是植物必需的养分之一,被广泛用作农业肥料,在促进植物生长和提高农作物产量方面发挥着重要作用。
b. 工业方面:磷在化工和冶金行业中被广泛应用,用于制造肥料、农药、洗涤剂、清洁剂、火柴等。
此外,磷也是合成高能化合物(如三聚磷酸盐)的重要原料。
c. 医药方面:磷酸和磷酸盐是制药工业中的重要原料,广泛用于制造抗生素、酶、维生素等药物。
三、磷在生物体中的重要性1. 磷在DNA和RNA中的作用:磷是DNA和RNA的组成部分之一,它们是生物体内储存和传递遗传信息的分子。
磷的存在使得DNA和RNA能够稳定存在并编码生物的遗传信息。
2. 磷在能量代谢中的作用:磷是ATP(三磷酸腺苷)和ADP(二磷酸腺苷)的组成部分,这些物质在细胞中储存和释放能量。
磷及其化合物

磷的卤化物
三氯化磷,分子式:PCl3。一种无色透明液体,沸点 76℃,在潮湿空气中能水解成亚磷酸和氯化氢,发生 白烟而变质,须密封贮藏。 PCl3 + 3H2O → H3PO3 + 3 HCl 遇乙醇和水起水解反应, 遇氧能生成三氯氧磷。 2PCl3 + O2 → 2 POCl3 在水存在下,可与甲醇反应生成亚磷酸二甲酯。 反应分两步进行: 1.PCl3 + 3H2O → H3PO3 + 3HCl 2.H3PO3 + 2CH3OH → HOP(OCH3)2 + 2H2O 总反应为 PCl3 + 2CH3OH + H2O → HOP(OCH3)2 + 3HCl
磷的含氧酸
磷的含氧酸
磷酸(英语:phosphoric acid)或称为正磷酸 (orthophosphoric acid),化学式H3PO4,是 一种常见的无机酸,不易挥发,不易分解,几乎 没有氧化性。具有酸的通性,是三元中强酸,其 酸性比盐酸、硫酸、硝酸弱,但比醋酸、硼酸等 强。由五氧化二磷溶于热水中即可得到。正磷酸 工业上用硫酸处理磷灰石即得。用硝酸使磷氧化, 可以得到较纯的磷酸;一般是83%-98%的稠厚 溶液,如果再浓缩,可以得到无色晶体。磷酸在 空气中容易潮解;加热会逐渐失水得到焦磷酸, 进一步失水得到偏磷酸。磷酸容易自行结合成多 种化合物如焦磷酸(pyrophosphoric acid)或三 聚磷酸(triphosphoric acid)等。
磷的卤化物
五氯化磷(化学式:PCl5)是一种无机化 合物。它是最重要的磷氯化物之一,其它的 还有三氯化磷和三氯氧磷。它是一种无色、 具有吸湿性的固体,主要用作氯化剂,在不 同条件下可有不同的结构。 固态时五氯化磷的结构氯化铯型晶体结构, 两个离子分别为四面体和八面体结构,阳离 子中的磷原子为sp3杂化,阴离子中的磷为 sp3d2杂化。气态和液态的五氯化磷为单分 子结构,分子呈三角双锥形。
高中化学竞赛辅导无机化学13.2磷及其化合物知识点素材

§13-2 磷及其化合物Phosphorus and its Compounds一、General Properties: 1.磷原子的成键特征(1) 形成P 3-离子化合物 e.g. Na 3P :在水溶液中P 3-离子不存在,这是由于P 3-离子易水解:P 3- + 3H 2OPH 3 + 3OH -,P 3-离子有较大的半径,易变形,另外P 3-的电荷高,附加极化作用强,所以只存在为数极少的离子化合物,许多磷化物都向共价型过渡。
(2) 中心原子(P )可采取sp 3、sp 3d 、sp 3d 2杂化,可形成-3、+1、+3、+5氧化数的化合物,P 原子的最大配位数达到6。
(3) 磷的性质与氮有很大的差别主要是由于磷原子有3d 轨道。
例如NF 3不水解,而PF 3水解,NF 3不与过渡金属形成配合物,而PF 3可以与许多过渡元素形成配合物。
解释:除了都能形成σ配键外,P 还有空的3d 空轨道,可以接受过渡金属反馈回来的电子对,形成反馈π键,所以配位能力加强。
2.存在:在自然界以磷灰石,磷钙石(phosphorite):Ca 3(PO 4)2,氟磷灰石(fluorapatite):Ca 5(PO 4)3F ,羟基磷灰石(hydroxypatite):Ca 5(PO 4)3(OH)存在。
磷是动物体中的重要成份,骨头中Ca 5(PO 4)3(OH)形成矿物质部分,牙齿中含有Ca 5(PO 4)3F ,大脑和神经细胞中含有复杂的有机磷的衍生物,所以磷是动物体中的重要成份。
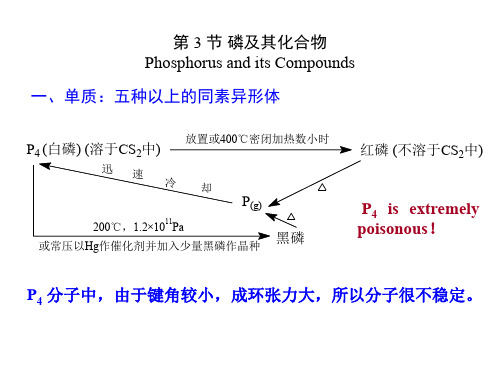
二、Simple Substance1.Allotropes : white 、red and black phosphorusP(白磷) (溶于CS 中)红磷 (不溶于CS 2中)P 4 is extremely poisonous !白磷的晶格点上是P 4分子,红磷的结构至今不清楚,有人认为红磷是P 4分子撕开一个P -P 键,把许多对成对的三角形连接起来而形成的长链状巨大分子所组成(如图)2.Properties : ( 以P 4为主 )(1) structure of P 4:Tetrahedral 键与键之间存在张力,∠PPP = 60︒,比纯p 轨道的σ键键角90°要小,P -P 键是受了应力而弯曲的键,P -P 键能很低,仅200 kJ ·mol -1,很容易受外力而张开,这说明白磷在通常情况下,非常活泼。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑵磷的同素异形体间的转化
紫磷
(暗红色) 823K 密闭容器
红磷
(赤磷)
533K 升华
白磷
(黄磷)
1200atm
773K
黑磷
(铁灰色)
689K 隔绝空气
第三节磷及其化合物
⑶磷的炼制
磷是生物体中不可缺少的重要元素之一。如:DNA 中
O
O=P -OCH2 O
A 的多核苷酸链
OH H H
HH
DNA 多核苷酸链(5’…ACTG…3’片
第三节 磷及其化合物
一、磷 二、磷的含氧化合物 三、磷的其它化合物
第三节磷及其化合物
一、磷 1.磷及其制取 ⑴磷的同素异形体
磷有多种同素异形体,如:白磷(黄磷)、红磷(赤磷)、紫磷和 黑磷等。常见的有白磷和红磷。
①白磷
纯白磷(P4)是无色透明的晶体,立方晶系,分子 为四面体构型,其键角∠PPP = 60 °。
第三节磷及其化合物
⑵三氧化二磷
三氧化二磷(P4O6)白色蜡状固体,有滑腻感,有潮解性,不稳 定,易继续氧化为P4O10,Tf = 23.8℃,Tb = 173.8℃,剧毒。
P4O6 + O2 = P4O10
三氧化二磷在冷水中缓慢反应生成亚磷酸,在热水中反应激烈, 并发生岐化。
P4O6 + 6H2O(冷)= 4H3PO3 P4O6 + 6H2O(热)= 3H3PO4 + PH3
第三节磷及其化合物
二、磷的含氧化合物
1.氧化物
磷的燃烧产物是五氧化二磷(分子为P4O10),若氧不足则生成三 氧化二磷(分子为P4O6)。
4P + 5O2 燃烧 P4O10 4P + 3O2 燃烧 P4O6
五氧化二磷是磷酸的酸酐,三氧化二磷是亚磷 酸的酸酐。
P4O10 + 6H2O = 4H3PO4 (磷酸) P4O6 + 6H2O = 4H3PO3 (亚磷酸)
磷的制备常采用电炉还原法。目前我国黄磷的总产量居世界首
位,共有黄磷生产厂上百家。
电炉法生产黄磷方法简单。即:将磷矿石、硅石和焦炭按一定
比例和粒度进行配矿并放入电炉中,在1773K 下发生分解、还原等
反应,磷蒸气与炉尘一起被冷却、精制后得到产品,高温炉渣则直
接从电炉中排出。
①选矿、配矿
磷矿石
磷矿石:[Ca3(PO4)2(F,Cl,OH)]
白磷 773K 黑磷 823K
1200atm
黑磷具有类似石墨的片状晶体,属
紫磷
于混合型晶体。
黑磷有斜方、菱形、立方等几种异
构体,有金属光泽,能导电,着火点较
高 TI = 490℃,其化学活性比白磷、红 磷差。
紫磷较为少见,属单斜晶系,不溶于水,也不溶于 CS2,其化 学活性也比白磷、红磷差。
第三节磷及其化合物
③电炉炼磷的主要问题及治理思路
利用电炉还原法制取黄磷耗能高,固体废弃物、尾气排放污染 大,严重破坏周边的生态环境。
另外,单质磷的用途不广,主要是用于制备磷酸;然后再通过 磷酸制备各种磷化工产品。
黄磷生产厂区
第三节磷及其化合物
【尾气治理】
电炉冶炼黄磷的尾气中 CO含量达90%左右。CO是化学工业的重 要原料。将 CO 回收、净化、提纯,经羰基合成或变换成合成气可 制取草酸、甲酸、醋酸、甲醇、二甲醚、碳酸二甲酯、合成氨、甲 酰胺、甲醛等系列产品。
白磷不溶于水,易溶于 CS2、C6H6 等有机溶 P 剂,见光逐渐变为黄色,有剧毒。
P
P P
白磷在常温下有较高的化 学活性,与空气接触发生缓慢 氧化并导致自燃(Tl = 40℃)。
问题讨论 实验室中如何保管白磷好
试剂?
第三节磷及其化合物
②红磷 白磷 533K 红磷
> 689K,急速冷却
红磷是紫磷的无定形体,暗红色粉末(分子结构不详),不溶于 水及 CS2,无毒,燃点TI = 260℃,化学活性比白磷小得多。
【改进工艺路线】
改进分离、提纯技术,走“湿法”炼 磷路线。
磷矿石 H2SO4 磷酸
磷酸盐
第三节磷及其化合物
黄磷尾气净化生产甲醇
2.磷的化学性质
单质磷的化学活性比氮的高,它能与氧发生激烈反应,也能在
氯气中自燃。
P4 + 3O2 P4 + 6Cl2
2P2O3 (白磷发生自燃) 4PCl3 (白磷发生自燃)
P
O
O
O
POP
O PO
P4O6
O
O
P
O
第三节磷及其化合物
2.磷的含氧酸
磷有多种含氧酸,常见的有如下几种。
名称 化学式 P的氧化数
正磷酸
H3PO4
+5
焦磷酸
H4P2O7
O
H
段)中:A—腺嘌呤;C —胞嘧啶;T—胸腺
O=P-OCH2 O
C
嘧啶;G—鸟嘌呤。
OH H H
HH
O
H
O=P-OCH2 O
T
OH H H
HH
O
H
O=P -OCH2 O
G
OH第三节磷及其化合物
磷在自然界常以磷酸盐的形式出现,如:磷酸钙、磷灰石等,
我国的磷矿石主要分布在云、贵、川、湘四省。
第三节磷及其化合物
⑴五氧化二磷
五氧化二磷单斜晶系,白色粉末状,Tf = 420℃,在300℃时升 华,有很强的吸水性,在空气中易潮解,有腐蚀性。
五氧化二磷还可从很多物质中夺取化合 态的水,使其脱水;与有机物接触,会发生 燃烧。
P4O10 + 6H2SO4 = 6SO3 + 4H3PO4 P4O10 + 12HNO3 = 6N2O5 + 4H3PO4
硅石:[SiO2]——溶剂、造渣
焦炭:[C]——发热剂、还原剂、导体
第三节磷及其化合物
②炼制
1773K
2Ca3(PO4)2 + 6SiO2 + 10C 6CaSiO3 + P4(蒸气) + 10CO
冷却
黄磷(液态)
粗磷
尾气
原料
高 温
电
炉
蒸馏
黄磷(液态)
包装
产品 黄磷(固态)
炉渣
磷泥
第三节磷及其化合物
红磷与空气长期接触也会进行及其缓慢的氧化作用,形成易吸 水的氧化物使红磷变潮。
红磷易被硝酸氧化为磷酸,与氯酸钾摩擦即着 火甚至爆炸。
P + 5HNO3 = H3PO4 + 5NO2 + H2O
红磷主常用于制造有机磷农药、安全火柴(火柴 盒侧面的涂料是红磷、三硫化二锑的混合物)等。
第三节磷及其化合物
③黑磷、紫磷
能被浓硝酸氧化成磷酸
5HNO3(浓) + P = H3PO4 + 5NO2 + H2O
白磷能溶解在热的浓碱液中
P4 + 3NaOH + 3H2O = PH3↑+ 3NaH2PO2
(次磷酸钠)
白磷能将某些金属(如:金、银、铜、铅)从其盐中置换出来。
2P + 5CuSO4 + 8H2O = 5Cu + 2H3PO4 + 5H2SO4 P + 3Cu = Cu3P
