磷及其化合物ppt课件
合集下载
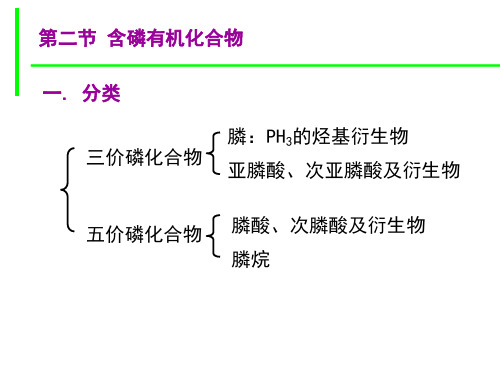
含磷化合物
RP(OR')2 + R''X 亚膦酸酯
R'2P OR'' + R'''X 次亚膦酸酯
RP O + R'X
OR’
O
R'2P + R''X R'''
5、Wittig(魏悌息)试剂及其反应
Wittig试剂:
+-
Ph3P—- CH2
Ph3P=CH2
(I)
(II)
在相邻位置上带有相反电荷的两性离子称为叶立德
(ylide)。磷叶立德也称为魏悌息试剂。
制备:
3PhH + PCl3 Ph3P + R2CHX 例: Ph3P + CH3X
Ph3P Ph3P+-CHR2Xֿ 碱 Ph3P+-ֿCR2
Ph3P+-CH3Xֿ C6H5Li Ph3P+-ֿCH2
制备
Ph3P + R2CHX
Ph3P+-CHR2Xֿ 碱 Ph3P+-ֿCR2
2 、烃基膦作为亲核试剂的反应
R
O CC
R + (C6H5)3P
R
R
O
R
R
R
R
(C6H5)3P
胺与膦亲核性比较:
R
R
R C=C R + (C6H5)3P=O
RR
(C6H5)3P+
R
R
O-
R3P > R2PH > RPH2 > PH3
3、季鏻碱的热分解
(CH3CH2)2P CH2CH2CNOH CH3
磷及其化合物ppt课件

29
A. +5 B. +3 C. –3 D. -6
22
8、牙齿表面由一层硬的、组成为Ca5(PO4)3OH 的物质保护着,它在唾液中存在下列变化:
脱矿
Ca5(PO4)3OH(固)矿化5Ca2++3PO43-+OH-
(1)进食后,细菌和酶作用于食物产生有机酸,这时
牙齿就会受到侵蚀,其原因是________________。
Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
重过磷酸钙(重钙)
PO43-的检验:
纯净物
12
例题
1、有一固体单质,质软,在空气中极易
燃烧,生成物溶于热水后滴加紫色石蕊试
剂显红色。把所得溶液分盛两支试管,向
第一支试管中滴入少量饱和澄清石灰水,
无混浊出现,若继续滴加,出现白色混浊,
过量则产生白色沉淀。过滤,取少量白色
沉淀投入第二支试管,则沉淀消失。试确
定该单质的化学式。写出有关的化学方程
式。
13
点燃
P4+5O2==2P2O5 P2O5+3H2O===2H3PO4 2H3PO4+Ca(OH)2==Ca(H2PO4)2+H2O Ca(H2PO4)2+Ca(OH)2==2CaHPO4↓+2H2O 2CaHPO4+Ca(OH)2==Ca3(PO4)2↓+2H2O Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
24
9、亚磷酸H3PO3是一种无色晶体,有大蒜气味和 强吸湿性。 (1)在亚磷酸溶液中加入过量的NaOH溶液,生 成的主要产物是Na2HPO3,这一事实说明亚磷酸 是几元酸。推断它的电离方程式和结构式。 (2)亚磷酸具有强还原性,当它与碘水混合后, 可以看到碘水的棕黄色褪去,经检验有磷酸生成, 写出有关方程式。 (3)在亚磷酸溶液中加入AgNO3溶液后,有黑 色沉淀生成和无色气体产生,试管口有红棕色气 体产生。写出有关方程式。
植物营养学课件-磷

扩大根系吸收面积
提高土壤磷的空间有效性
缩短了根吸收养分的距离
菌根的分泌物也能促进难溶性磷的溶解度。
影响吸收磷的主要因素
植物生物学特性
环境条件
1、作物特性 不同植物种类,甚至不同的栽培品种,对磷的吸收 都有明显的影响。
2、土壤供磷状况 植物能利用的磷主要是土壤中的 无机磷。虽然植物可吸收少量有机态磷,但通常有 机磷必须转化为无机磷后才能被大量吸收。因此, 土壤中磷的形态直接影响着土壤供磷状况及植物对 磷的吸收。
4.植素
OH
OH OH
OH OH
OH
+ 6H PO (- 6 H O )
O
O PO OH
O
O
O P OO P O
OH
OH O
O O PO
O PO OH
OH
O
O PO
OH
环己六醇
植酸
植素是磷脂类化合物中的一种,它是植酸的钙、 镁盐或钾、镁盐,而植酸是六磷酸肌醇,它是由 环己六醇通过羟基酯化而生成的。
共质体途径进入木质部导管(无机磷酸盐) , 然后运往植物地上部 还可通过韧皮部上运或下运(有机磷化合物和 无机磷酸盐)
影响吸收磷的主要因素
植物生物学特性
环境条件
1、作物特性 不同植物种类,甚至不同的栽培品种,对磷的吸收 都有明显的影响。
根毛 排根 菌根
缺磷诱导形成 排根及其效应
菌根
菌根能增强植物 吸磷的能力
棉 花 缺 磷
油菜缺磷叶序
梨树缺磷
草莓缺磷的叶片
缺磷导致成熟期禾谷类作物籽粒退化 较重,如玉米秃尖,
缺磷 正常
缺磷导致作物植株矮 小,禾谷类作物分蘖
减少,叶色暗绿
磷及其化合物..

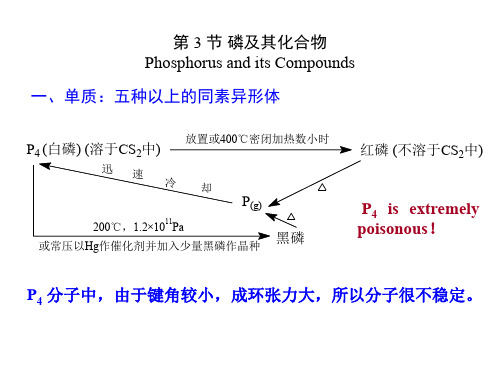
磷的单质
磷的同素异形体有许多种,其中白磷和红 磷最为常见。另外还存在紫磷和黑磷。气 态磷单质中有P2分子与磷原子。
磷的单质
白磷(因商品白磷常带黄色故又叫黄 磷),分子式P4,白色固体,质软, 有毒,致死量为50mg。不溶于水, 溶于大多数有机溶剂。常温下为立方 晶系的α-型,具体结构仍未知,熔点 为44.1℃。-77℃一以下转化为六方晶 系的β-型,密度1.88g/cm3。实验室 置于冷水中保存。常用于化学武器。 34°C时可在空气中自燃,生成白色 烟雾,主要成分为五氧化二磷(烟) 以及五氧化二磷于空气中水结合生成 的磷酸(雾),方程式为:
磷及其化合物
磷的发现
1669年,德国汉堡一位叫布朗 特(Brand H)的商人在强热蒸 发人尿的过程中,他没有制得黄 金,却意外地得到一种像白蜡一 样的物质,在黑暗的小屋里闪闪 发光。这从未见过的白蜡模样的 东西,虽不是布朗特梦寐以求的 黄金,可那神奇的蓝绿色的火光 却令他兴奋得手舞足蹈。他发现 这种绿火不发热,不引燃其它物 质,是一种冷光。于是,他就以 “冷光”的意思命名这种新发现 的物质为“磷”。磷的拉丁文名 称Phosphorum就是“冷光” 之意,它的化学符号是P,它的 英文名称是Phosphorus。
磷的卤化物
三氯化磷,分子式:PCl3。一种无色透明液体,沸点 76℃,在潮湿空气中能水解成亚磷酸和氯化氢,发生 白烟而变质,须密封贮藏。 PCl3 + 3H2O → H3PO3 + 3 HCl 遇乙醇和水起水解反应, 遇氧能生成三氯氧磷。 2PCl3 + O2 → 2 POCl3 在水存在下,可与甲醇反应生成亚磷酸二甲酯。 反应分两步进行: 1.PCl3 + 3H2O → H3PO3 + 3HCl 2.H3PO3 + 2CH3OH → HOP(OCH3)2 + 2H2O 总反应为 PCl3 + 2CH3OH + H2O → HOP(OCH3)2 + 3HCl
有机化学第9章含硫、含磷有机化合物

2—羟基乙硫醇
SH
苯硫酚
对于结构较复杂的化合物也可将—SH作为取代基来进行命名。例如:
HS CH 2 COOH
巯基乙酸
亚砜、砜、磺酸及其衍生物的命名,只需在它们的名称前加上相应的 烃基名称即可。例如:
O CH3 S CH3
二甲亚砜
O
CH3 S CH3 O
二甲砜
O
CH3
S OH
O
对甲基苯磺酸
O
CH 3 S OH O
对人、畜毒性较高,对皮肤有刺激作用。施药后经根、茎吸收传导,被植物吸
收后有较长的残效。在土壤中残效期达一个月左右。以保护作物为主,兼有治
疗作用。主要采用种子和土壤处理的方法,对烟草黑胫病,水稻烂秧及大白菜
软腐病等均有效。
H3C N
H3C
N N SO 3Na
双-二甲氨基苯重氮磺酸钠
第二节 含磷有机化合物
H2C NH C S S
乙撑双硫代氨基甲酸锌
O
(三)克菌丹 纯品为白色结晶,在中性或酸性溶
C
液中稳定。对人、畜、植物安全,但对皮肤有刺激性。
在果树、蔬菜上使用可防治多种病害,对豆类和蔬菜
N S CCl 3
的根腐病、立枯病,马铃薯晚疫病,葡萄霜霉病等有
C
良好的防治效果。
O
N-三氯甲硫基邻苯二甲酰亚胺
(四)敌克松 原粉为棕色无味粉未。在水中不稳定,光、热、碱均可促进分解。
(二)乐果 化学名称为O,O—二甲基—S—(N—甲基氨甲酰甲基)二硫代
磷酸酯,结构式如下:
S
O
H3CO P S CH 2 C NHCH 3 OCH 3
乐果纯品是白色晶体,可溶于水和多种有机溶剂。是一种高效低毒的有机磷 杀虫剂,它有内吸性,被植物吸收后能传导到整个植株,昆虫即使食用非施 药部位也能中毒。
SH
苯硫酚
对于结构较复杂的化合物也可将—SH作为取代基来进行命名。例如:
HS CH 2 COOH
巯基乙酸
亚砜、砜、磺酸及其衍生物的命名,只需在它们的名称前加上相应的 烃基名称即可。例如:
O CH3 S CH3
二甲亚砜
O
CH3 S CH3 O
二甲砜
O
CH3
S OH
O
对甲基苯磺酸
O
CH 3 S OH O
对人、畜毒性较高,对皮肤有刺激作用。施药后经根、茎吸收传导,被植物吸
收后有较长的残效。在土壤中残效期达一个月左右。以保护作物为主,兼有治
疗作用。主要采用种子和土壤处理的方法,对烟草黑胫病,水稻烂秧及大白菜
软腐病等均有效。
H3C N
H3C
N N SO 3Na
双-二甲氨基苯重氮磺酸钠
第二节 含磷有机化合物
H2C NH C S S
乙撑双硫代氨基甲酸锌
O
(三)克菌丹 纯品为白色结晶,在中性或酸性溶
C
液中稳定。对人、畜、植物安全,但对皮肤有刺激性。
在果树、蔬菜上使用可防治多种病害,对豆类和蔬菜
N S CCl 3
的根腐病、立枯病,马铃薯晚疫病,葡萄霜霉病等有
C
良好的防治效果。
O
N-三氯甲硫基邻苯二甲酰亚胺
(四)敌克松 原粉为棕色无味粉未。在水中不稳定,光、热、碱均可促进分解。
(二)乐果 化学名称为O,O—二甲基—S—(N—甲基氨甲酰甲基)二硫代
磷酸酯,结构式如下:
S
O
H3CO P S CH 2 C NHCH 3 OCH 3
乐果纯品是白色晶体,可溶于水和多种有机溶剂。是一种高效低毒的有机磷 杀虫剂,它有内吸性,被植物吸收后能传导到整个植株,昆虫即使食用非施 药部位也能中毒。
[课件]有机合成有机磷PPT
![[课件]有机合成有机磷PPT](https://img.taocdn.com/s3/m/51e07f85f524ccbff021841e.png)
+ Ph3P=O
稳定的磷叶立德反应由热力学控制,即由苏式生成E型烯
烃;在极性溶剂也有利于E型烯烃的生成 。
Ph3P=CHCO2Me + MeCHO
溶剂 CH2Cl2 DMF CH3OH 总产率 88% 98% 96%
方法四:
2Ph3P=CH2 + Me3SiCl Ph3PMeCl + Ph3P=CHSiMe3
也是纯化叶立德的反应 ,然后,硅取代的磷叶立德用三
甲硅醇(或甲醇)去硅而得到纯化的磷叶立德
Ph3P=CHSiMe3 + Me3SiOH Me3SiOSiMe3 + Ph3P=CH2
R3 R3P=CR R + R4
1 2
C
O
R1R2C=CR3R4 + R3P=O
二、 Wittig反应
R3 R3P=CR1R2 + R4
C
O
R1R2C=CR3R4 + R3P=O
1、特点: (1)反应条件温和、产率较高,双键位置确定,即双键处 于原来羰基的位置。可以制得不易得到的环外双键化合物。
O
Ph3P=CH2
O
举例:VD2的合成
1、稳定的磷叶立德:NaOH/H2O、NH4OH/H2O、 2、不稳定的磷叶立德:丁基锂、苯基锂的醚溶液氨基钠的
液氨溶液,NaH/THF,ROLi/ROH或DMF,
NaCH2SOCH3/DMSO作为质子接受体。一般要 在惰气 保护、无水条件下制备。
方法二:
卡宾或苯炔与膦作用;二氯三苯基膦在三乙胺存在下与活 泼亚甲基化合物反应:
2、由于n-Bu是+I取代基,使磷原子正电荷减少,减弱 了它分散碳负离子负电荷的能力,因此增加了叶立德的活 性。
无机磷的测定PPT优秀课件

无机磷污染的来源
■ 生活污水 洗涤废水(含磷洗衣粉、洗涤剂) 食物废渣 人体排泄
■ 工厂和畜牧业废水 化工行业(造纸业、磷肥工业) 生化制药(生物制药企业) 金属表面处理 食品工业 ……
■ 降雪降雨
影响
■ 水体的富营养化 缓慢流动的湖泊、水库、内海等水域的生物营养成分(如 氮、磷等),因长期不断补给而过多积累,导致水草、藻 类等大量繁殖,引起水质恶化、鱼群死亡的现象。
用抗坏血酸还原为磷钼蓝后,于882 nm波长测定吸光值。
□ 活性磷酸盐与钼酸铵形成磷钼黄
7PO43- + 21NH4+ + 12Mo7O246- + 72H+ =7(NH4)3[PMo12O40 ]↓(淡黄色)+ 36H2O
□ 在酒石酸锑钾存在下,磷钼黄被抗坏血酸还原为磷钼
蓝,即在酒石酸锑钾存在下,加入抗坏血酸,使磷钼酸
■ 海水中磷以两种化学形式存在,即有机磷和无机磷。每一 种化学形式又分为溶解和颗粒的两种形态。
■ 在各种无机磷形态中,仅正磷酸盐可通过标准的磷钼蓝方 法定量地测定,而焦磷酸盐和无机磷聚合物均需要首先将其水 解为活性磷酸盐后才能测定。
■ 一般情况下,活性磷酸盐绝大部分是溶解态无机磷(DIP), 通常指能被植物直接吸收的。
■ 关于样品的贮存和固定问题,目前无定论,主要有快速冷冻 法和化学保存法两种。若只放几个小时,可冷藏。
□ 冷冻法:水样采集后迅速冷冻到-20C以下,(测溶解无机 磷则要过滤)。这种方法目前大多数人认为可保存几个月,基本 用此法。
□ 化学法:加入HgCl2—100ml水样中加入约3滴HgCl2饱和溶液。 □ 样品贮存:样品采集后可存于玻璃瓶中,待分样及过滤结 束后,一般用塑料瓶贮存样品(聚丙烯或聚四氟乙烯,不可用聚 乙烯-原因:吸附有机物质、磷酸盐、油类)。
2020高中化学磷及其化合物
C、含氧酸及其盐的缩合
说明:
①、含氧酸缩合的必要条件:必须有羟基,才能脱水,否则,不能缩合。 比如,稀的HClO4不能缩合,因为质子完全解离。稀的H2SO4也不能缩合, 但是算式硫酸氢盐可缩合。 ②、酸越弱,越易缩合,缩合产物越多越稳定。
磷酸经强热时就发生脱水作用,生成焦磷酸、三磷酸等多磷酸或
五、磷的成键特征
1、离子型:P3-,第三周期,半径大,易变形,因此完全意 义上的离子化合物极少,且只能存在于干态,遇水水解。
2、共价型:由于磷的半径大,难以形成 p-p 键,但可形成 p-d 键。
3、形成配合物:主要作为配位原子,但 PF5 采用 sp3d 杂化, 有空的 d 轨道,易与 F- 结合形成 PF6-,sp3d2 杂化,后者配 位能力弱。
P4 分子中,由于键角较小,成环张力大,所以分子很不稳定。
1、磷单质的结构(P4)
白磷
分子晶体 熔点 44.15 ℃ 沸点 280.35 ℃ 密度 1.8g·cm-3
红磷
成对等边三角 形连成的链状 的巨大分子
黑磷
片层结构 网状结构 有导电性
许多磷的化合物结构与正四面体P4有关 ; 磷是亲氧元素,磷氧四面体PO4结构单元很稳定,许多 P(V)含氧化合物都是以磷氧四面体为结构基础的
2、单质与碱的作用 当单质中原子与原 子间是单键时,易 在碱溶液中发生歧 化反应。
特殊
二、氧化物:P2O3、 P2O5
P4O6
P4O10
P原子有空的3d轨道可以利用,故 P 与端基 O 之间可以形成 反馈键,p-d键,但与配位化合物中的方向正好相反。
三、含氧酸和含氧酸盐 1、PO43- 的结构:正四面体
第 3 节 磷及其化合物 Phosphorus and its Compounds
第一讲(2)磷和磷的化合物

五氧化二磷是磷酸的酸酐,也是偏磷酸的酸酐。 (2)磷酸(H3PO4) 物理性质: 纯磷酸无色透明晶体,有吸湿性,与水以任意比互 溶。浓磷酸(83-98%)无色粘稠液体,密度约是水 的2倍。
化学性质: ①是一种三元中强酸(电离不完全)
具酸的通性
H3PO4
H2PO4HPO42-
H+ + H2PO4H+ + HPO42H+ +PO43-
4.下列变化中,不属于化学变化的是 A.白磷转化为红磷 B.碘受热变成紫色蒸气 C.加热氯化铵晶体过程 D.用CCl4把溴从水中萃取出来 (
BD
)
5.白磷和红磷相同的性质是 A.毒性 B.着火点 C.溶解性
( D ) D.化学性质
6.由红磷制取白磷可采用的方法是 ( D ) A.在空气中加热至416℃,使红磷升华 B.用CS2溶解,将红磷分出 C.加高温、高压,使红磷分出 D.隔绝空气,加热到416℃ ,使红磷升华,再冷却
复习课
第一讲(2)磷及其化合物
一 、磷
1.存在:自然界中没有 游离态 的磷,只有 化合态 , 磷主要以 磷酸盐 的形式存在于矿石中。
磷的常见单质有 红磷 和 白磷 两种,它们互为同素异形体 。
白磷(P4)、红磷(P24)、P4O6、P4O10的分子结构
[
N4(CH2)6生长点
]8
P 4O 6
P4O10
解析:所给物质中只有Ca(H2PO4)2含P元素,因此应以 它为中心思考。 K2CO3由于水解呈碱性,氨水本身显碱 性,都会与Ca(H2PO4)2反应生成难溶于水的CaHPO4或 Ca3(PO4)2,而不利于P元素被植物吸收。(NH4)2SO4由于 铵根离子水解而呈酸性,因此从中和的角度和双水解 的角度看K2CO3和氨水不宜与Ca(H2PO4)2和(NH4)2SO4混合 施用。故正确的是B。
化学性质: ①是一种三元中强酸(电离不完全)
具酸的通性
H3PO4
H2PO4HPO42-
H+ + H2PO4H+ + HPO42H+ +PO43-
4.下列变化中,不属于化学变化的是 A.白磷转化为红磷 B.碘受热变成紫色蒸气 C.加热氯化铵晶体过程 D.用CCl4把溴从水中萃取出来 (
BD
)
5.白磷和红磷相同的性质是 A.毒性 B.着火点 C.溶解性
( D ) D.化学性质
6.由红磷制取白磷可采用的方法是 ( D ) A.在空气中加热至416℃,使红磷升华 B.用CS2溶解,将红磷分出 C.加高温、高压,使红磷分出 D.隔绝空气,加热到416℃ ,使红磷升华,再冷却
复习课
第一讲(2)磷及其化合物
一 、磷
1.存在:自然界中没有 游离态 的磷,只有 化合态 , 磷主要以 磷酸盐 的形式存在于矿石中。
磷的常见单质有 红磷 和 白磷 两种,它们互为同素异形体 。
白磷(P4)、红磷(P24)、P4O6、P4O10的分子结构
[
N4(CH2)6生长点
]8
P 4O 6
P4O10
解析:所给物质中只有Ca(H2PO4)2含P元素,因此应以 它为中心思考。 K2CO3由于水解呈碱性,氨水本身显碱 性,都会与Ca(H2PO4)2反应生成难溶于水的CaHPO4或 Ca3(PO4)2,而不利于P元素被植物吸收。(NH4)2SO4由于 铵根离子水解而呈酸性,因此从中和的角度和双水解 的角度看K2CO3和氨水不宜与Ca(H2PO4)2和(NH4)2SO4混合 施用。故正确的是B。
植物磷素营养(PPT)

脂肪合成途径示意图
3-磷酸甘油醛→磷酸二羟丙酮→磷酸甘油→甘油 ↓
3-磷酸甘油酸 ↓
丙酮酸 ───→乙酰辅酶 A ───→脂肪酸
脂肪
生产实践
• 在缺磷土壤上给油料作物施用磷肥能显著 提高油料作物产量和含油量。
植素
• 植素是环已六醇磷酸酯的钙镁盐,是磷 的贮藏形态,主要在种籽中(种籽中80% 全磷以该形态存在)。为种籽萌发和幼 苗生长提供磷。
• 在植物生命早期充分供磷对形成繁殖器 官原基至关重要。在种子和果实中测出 了大量磷,磷对种子的形成不可缺少。
磷含量 (mg P/100籽粒)
6 全磷
4 植素磷
2
❖ 参与CO2的固定和同化产物的形成; ❖光合磷酸化过程,将太阳能转化为化学能,产生ATP。
➢ 蔗糖和淀粉的形成有磷的参与; ➢ 磷促进碳水化合物在植物体内的运输; ➢ 参与呼吸作用。
蔗糖合成不同途经的示意图
Pi
磷酸蔗糖
磷酸蔗糖 合成酶
葡萄糖 6-磷酸葡萄糖 6-磷酸果糖
蔗糖
蔗糖合成酶
果糖
生产实践
植物磷素营养
重点: 1 磷在植物抗逆上的重要作用。 2 磷营养缺乏的形态鉴定。 3 主要磷肥种类的性质和合理施用技术。
难点: 磷在土壤中迁移固定的机理及其发生条件
第一节 植物的磷素营养
一、植物体内磷的含量和分布 二、磷的营养功能 三、磷的吸收利用 四、磷营养失调症状
第一节 植物中的磷素营养
一、植物体内磷的含量、形态和分布
1、含量:植物体内P2O5含量约占干 物质重的0.2-1.1%。
几种作物籽粒和秸杆中磷的含量
作物 玉米 棉花 花生 水稻 大豆 小麦
籽粒(%P) 0.22 0.66 0.2 0.28 0.42 0.42
磷及其化合物

磷的卤化物
三氯化磷,分子式:PCl3。一种无色透明液体,沸点 76℃,在潮湿空气中能水解成亚磷酸和氯化氢,发生 白烟而变质,须密封贮藏。 PCl3 + 3H2O → H3PO3 + 3 HCl 遇乙醇和水起水解反应, 遇氧能生成三氯氧磷。 2PCl3 + O2 → 2 POCl3 在水存在下,可与甲醇反应生成亚磷酸二甲酯。 反应分两步进行: 1.PCl3 + 3H2O → H3PO3 + 3HCl 2.H3PO3 + 2CH3OH → HOP(OCH3)2 + 2H2O 总反应为 PCl3 + 2CH3OH + H2O → HOP(OCH3)2 + 3HCl
磷的含氧酸
磷的含氧酸
磷酸(英语:phosphoric acid)或称为正磷酸 (orthophosphoric acid),化学式H3PO4,是 一种常见的无机酸,不易挥发,不易分解,几乎 没有氧化性。具有酸的通性,是三元中强酸,其 酸性比盐酸、硫酸、硝酸弱,但比醋酸、硼酸等 强。由五氧化二磷溶于热水中即可得到。正磷酸 工业上用硫酸处理磷灰石即得。用硝酸使磷氧化, 可以得到较纯的磷酸;一般是83%-98%的稠厚 溶液,如果再浓缩,可以得到无色晶体。磷酸在 空气中容易潮解;加热会逐渐失水得到焦磷酸, 进一步失水得到偏磷酸。磷酸容易自行结合成多 种化合物如焦磷酸(pyrophosphoric acid)或三 聚磷酸(triphosphoric acid)等。
磷的卤化物
五氯化磷(化学式:PCl5)是一种无机化 合物。它是最重要的磷氯化物之一,其它的 还有三氯化磷和三氯氧磷。它是一种无色、 具有吸湿性的固体,主要用作氯化剂,在不 同条件下可有不同的结构。 固态时五氯化磷的结构氯化铯型晶体结构, 两个离子分别为四面体和八面体结构,阳离 子中的磷原子为sp3杂化,阴离子中的磷为 sp3d2杂化。气态和液态的五氯化磷为单分 子结构,分子呈三角双锥形。
无机化学 磷的含氧化合物 PPT课件

其他盐类难溶。
易溶的碱金属的正盐水解, 溶液显碱性
PO43- + H2O —— HPO42- + OH-
磷酸一氢盐水解,溶液亦显碱性
HPO42- + H2O —— H2PO4- + OH- Kh2
HPO42-—— PO43- + H+ Ka3
说明水解强于解离。
二氢盐水溶液显酸性,说明 解离强于水解。
·O·
HO P OH
OH
·· ··
·O·
HO P OH OH
磷酸结构式中 P 和 O 之间的双键, 就是一个 σ 配键和一对 d-p 配键。
·· ··
·O·
HO P OH OH
d-p 配键是对于 P=O 双键的一 种解释。
2. 磷酸的性质
纯的磷酸是固体,熔点 42℃, 沸点高,沸点 407℃。
14. 7 磷的含氧化合物
14. 7. 1 磷的氧化物
磷的氧化物以 P4O6 和 P4O10 为最常见。
1. 分子结构
P4 分子中弯曲的 P - P 键, 在 O2 分子的进攻下很易断裂。
在每两个 P 原子间嵌入一个 O 原子,则形成 P4O6 分子。
+ 3 O2
P4O6 的每个 P 上各有一个孤电子对, 还可以再结合 O 原子,形成 P4O10。
CaCl2 浓 H2SO4 KOH P4O10 H2O(g) 0.34 0.003 0.002 0.00001
P4O10 是强脱水剂,它可以使 H2SO4 脱水
P4O10 + 2 H2SO4 —— 2 SO3 + 4 HPO3
14. 7. 2 磷 酸 1. 磷酸的分子结构
磷酸 H3PO4(Ⅴ)
易溶的碱金属的正盐水解, 溶液显碱性
PO43- + H2O —— HPO42- + OH-
磷酸一氢盐水解,溶液亦显碱性
HPO42- + H2O —— H2PO4- + OH- Kh2
HPO42-—— PO43- + H+ Ka3
说明水解强于解离。
二氢盐水溶液显酸性,说明 解离强于水解。
·O·
HO P OH
OH
·· ··
·O·
HO P OH OH
磷酸结构式中 P 和 O 之间的双键, 就是一个 σ 配键和一对 d-p 配键。
·· ··
·O·
HO P OH OH
d-p 配键是对于 P=O 双键的一 种解释。
2. 磷酸的性质
纯的磷酸是固体,熔点 42℃, 沸点高,沸点 407℃。
14. 7 磷的含氧化合物
14. 7. 1 磷的氧化物
磷的氧化物以 P4O6 和 P4O10 为最常见。
1. 分子结构
P4 分子中弯曲的 P - P 键, 在 O2 分子的进攻下很易断裂。
在每两个 P 原子间嵌入一个 O 原子,则形成 P4O6 分子。
+ 3 O2
P4O6 的每个 P 上各有一个孤电子对, 还可以再结合 O 原子,形成 P4O10。
CaCl2 浓 H2SO4 KOH P4O10 H2O(g) 0.34 0.003 0.002 0.00001
P4O10 是强脱水剂,它可以使 H2SO4 脱水
P4O10 + 2 H2SO4 —— 2 SO3 + 4 HPO3
14. 7. 2 磷 酸 1. 磷酸的分子结构
磷酸 H3PO4(Ⅴ)
《含氮、磷硫化合物》课件

03
影响因素
温度、压力、催化剂等对含氮化 合物的合成与反应机理有重要影
响。
02
反应机理
含氮化合物的合成涉及复杂的化 学反应机理,如亲核取代和亲电
加成。
04
应用前景
随着科技的发展,含氮化合物的 合成与反应机理在化工、制药等
领域的应用前景广阔。
PART 03
含磷化合物
磷的氧化物
磷的氧化物概述
介绍磷的氧化物的性质、分类和制备方法。
。硫是一种非金属元素,其化学性质不活泼,但在加热条件下可以与氧
反应生成二氧化硫。
氮、磷、硫元素在自然界中的存在形式
氮
在自然界中,氮主要以氮气的形 式存在,占大气组成的约78%。 此外,氮还存在于多种含氮化合 物中,如蛋白质、氨基酸、核酸
等。
磷
磷在地壳中的丰度较低,主要以 磷酸盐的形式存在,如磷酸钙、 磷酸钠等。此外,磷还存在于生 物体内,是构成生物体的必需元
含硫有机化合物
含硫有机化合物的概述
含硫有机化合物是指含有碳和硫两种元素的有机化合物,如磺酸 、硫醇等。
磺酸的物理和化学性质
磺酸是一类具有通式R-SO3H的有机化合物,具有强酸性,是工业 上广泛应用的重要化工原料。
硫醇的物理和化学性质
硫醇是一类具有通式R-SH的有机化合物,具有特殊的气味和毒性 ,是工业上制取各种含硫化合物的重要原料。
硫的氢化物
硫氢化物的概述
01
硫的氢化物是一类含硫和氢元素的化合物,如氢硫酸(H2S)
和硫化氢(H2S)。
氢硫酸的物理和化学性质
02
氢硫酸是一种无色、有刺激性气味的气体,有毒,易溶于水,
是工业上制取硫化物的重要原料。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制取: △
Ca3(PO4)2+3H2SO4==3CaSO4↓+2H3PO4
△
︸ Ca3(PO4)2+2H2SO4==Ca(H2PO4)2+2CaSO4 过磷酸钙(普钙)
3P4+20HNO3+8H2O====12H3PO4+20NO ↑
11
四、磷酸盐
溶解性:1、从阳离子来看,无论是酸式盐还是正盐, 钾、钠、 铵盐均易溶于水。 2、从阴离子来看,磷酸二氢盐易溶,其余 难溶。如Ca(H2PO4)2、Ba(H2PO4)2易溶于水, Ca3(PO4)2、Ba3(PO4)2、CaHPO4、BaHPO4 难溶与水。
H3PO4 + NaOH==NaH2PO4+H2O H3PO4 +2NaOH==Na2HPO4+2H2O H3PO4 +3NaOH==Na3PO4+3H2O
NaH2PO4
数轴法:
1
Na2HPO4 2
Na3PO4
n(NaOH)/n(H3PO4)
3
10
8NaOH+3H3PO4== 2Na3PO4+Na2HPO4+8H2O
范围 单质
条件 同一元素、性质不同
(1)物理性质不同
质子数相同而中子数不同的 同一元素的不同原子 原子
质子数相同、中子数不同
(1)自然界含量几乎不变
特性 (2)化学性质相似
(2)化学性质几乎完全相同
(3)彼此可以相互转化 (3)彼此不能互变
7
5、用途
都可用于制造纯度较高的 磷酸。白磷可用于制造燃 烧弹和烟幕弹等;红磷可 用于制造农药、安全火柴 等。
8
二、氧化物
加热
P2O5+3H2O ==== 2H3PO4 (无毒) P2O5+H2O(冷水)===2HPO3(有毒)
P2O5是H3PO4、HPO3的酸酐,具有 酸性氧化物的通性,常用作干燥剂。
9
三、磷酸
无色透明晶体,熔点42.35℃。是一种中 等强度的三元弱酸,具有吸湿性(作干燥 剂)和酸的通性。
[思考2]哪些情况可构成同素异形体3 ?
3、物理性质
白磷(黄磷)
红磷(赤磷)
分子结构 P4正四面体形,分子晶体 结构复杂,分子晶体
颜色状态 白色蜡状固体
暗红色粉末
溶解性 毒性
不溶于水,
易溶于CS2 剧毒(0.1g致死)
不溶于水,
也不溶于CS2 无毒
着火点 40℃(可自燃)
240℃
熔点
44℃
升华
保存
磷及其化合物
1
一、磷
1、存在:自然界没有游离态的磷存 在,磷主要以磷酸盐的形式存在于矿 石中[磷矿石:Ca3(PO4)2 ,氟磷灰石: Ca5F(PO4)3]。是构成蛋白质的成份之 一,动物的骨骼、牙齿和神经组织, 植物的果实和幼芽,生物的细胞里都 含有磷。
2
2、单质结构
白磷
红磷,对吗?
沉淀投入第二支试管,则沉淀消失。试确
定该单质的化学式。写出有关的化学方程
式。
13
点燃
P4+5O2==2P2O5 P2O5+3H2O===2H3PO4 2H3PO4+Ca(OH)2==Ca(H2PO4)2+H2O Ca(H2PO4)2+Ca(OH)2==2CaHPO4↓+2H2O 2CaHPO4+Ca(OH)2==Ca3(PO4)2↓+2H2O Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
少量保存在水中
密闭保存
相互转化
260℃
白磷
红磷
416℃(升华)
4
4、化学性质
(1)与O2反应
点燃
4P+3O2=====2P2O3
点燃
4P+5O2=====2P2O5
(2)与Cl2反应
点燃
2P+3Cl2=====2PCl3
点燃
2P+5Cl2=====2PCl5
5
(3)其它反应 (指出氧化剂、还原剂)
写出氟化钙与浓硫酸反应制取氟化氢 的化学方程式;
写出氟磷灰石[Ca5(PO4)3F]与浓硫酸 反应的化学方程式。
16
4、工业上常用氟磷灰石[Ca5(PO4)3F]为原料,按 图示制取磷酸、重过磷酸钙[Ca(H2PO4)2]和氢氟酸。 图中反应(I)为氟磷灰石跟另一种原料反应,生成 A、B、C三种物质,其中的产物C又跟氟磷灰石发 生反应(II),生成B和重过磷酸钙。试写出两个反 应的化学方程式。
Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
重过磷酸钙(重钙)
PO43-的检验:
纯净物
12
例题
1、有一固体单质,质软,在空气中极易
燃烧,生成物溶于热水后滴加紫色石蕊试
剂显红色。把所得溶液分盛两支试管,向
第一支试管中滴入少量饱和澄清石灰水,
无混浊出现,若继续滴加,出现白色混浊,
过量则产生白色沉淀。过滤,取少量白色
14
2、将 amolCa3(PO4)2和bmolH2SO4混 合恰好完全反应反应后的物质中含有:
Ca(H2PO4)2、CaHPO4、CaSO4三种 物质,则a/b的取值范围是
A. 1<a/b<2
B. 1/2<a/b<1
C.3/2<a/b<2
D. 1/3<a/b<1
答案:B
15
3、写出磷酸钙与浓硫酸反应制取磷酸的 化学方程式;
3P4+20HNO3+8H2O====12H3PO4+20NO ↑ (制取磷酸)
P4+3NaOH+9H2O====3NaH2PO4+5PH3↑
11P+15CuSO4+24H2O=5Cu3P↓+6H3PO4+15H2SO4
(白磷中毒的内服解毒剂)
6
同素异形体与同位素的比较
同素异形体
同位素
概念
由同一种元素所形成的 几种性质不同的单质
A
(I)
氟磷灰石
B
C (II) D
17
反应(I): Ca5(PO4)3F+5H2SO4===5CaSO4+3H3PO4+HF↑
反应(II): Ca5(PO4)3F+7H3PO4===5Ca(H2PO4)2+HF↑
18
5、三硫化四磷是制造火柴的主要原 料,它分子里的硫为二价,磷为三价。 又知分子里有一个由非极性键形成的 正三角形和三个由共价键形成的五原 子环。若分别用“.”和“。”代表磷 原子和硫原子,则三硫化四磷的结构 式是____________。
19
●
o oo
●
●
●
20
6、三磷酸钠(Na5P3O10)是用Na2HPO4和NaH2PO4 溶液在623K左右反应制得。这一反应的化学方程式是 ____________。 三磷酸钠是三磷酸的钠盐,三磷酸可看作是三个磷酸
分子脱去两分子水而生成的。磷酸根离子的结构式为
O P O 3- ,若三磷酸根P3O105-中只有磷氧 O O 键,它的结构可表示为________。
Ca3(PO4)2+3H2SO4==3CaSO4↓+2H3PO4
△
︸ Ca3(PO4)2+2H2SO4==Ca(H2PO4)2+2CaSO4 过磷酸钙(普钙)
3P4+20HNO3+8H2O====12H3PO4+20NO ↑
11
四、磷酸盐
溶解性:1、从阳离子来看,无论是酸式盐还是正盐, 钾、钠、 铵盐均易溶于水。 2、从阴离子来看,磷酸二氢盐易溶,其余 难溶。如Ca(H2PO4)2、Ba(H2PO4)2易溶于水, Ca3(PO4)2、Ba3(PO4)2、CaHPO4、BaHPO4 难溶与水。
H3PO4 + NaOH==NaH2PO4+H2O H3PO4 +2NaOH==Na2HPO4+2H2O H3PO4 +3NaOH==Na3PO4+3H2O
NaH2PO4
数轴法:
1
Na2HPO4 2
Na3PO4
n(NaOH)/n(H3PO4)
3
10
8NaOH+3H3PO4== 2Na3PO4+Na2HPO4+8H2O
范围 单质
条件 同一元素、性质不同
(1)物理性质不同
质子数相同而中子数不同的 同一元素的不同原子 原子
质子数相同、中子数不同
(1)自然界含量几乎不变
特性 (2)化学性质相似
(2)化学性质几乎完全相同
(3)彼此可以相互转化 (3)彼此不能互变
7
5、用途
都可用于制造纯度较高的 磷酸。白磷可用于制造燃 烧弹和烟幕弹等;红磷可 用于制造农药、安全火柴 等。
8
二、氧化物
加热
P2O5+3H2O ==== 2H3PO4 (无毒) P2O5+H2O(冷水)===2HPO3(有毒)
P2O5是H3PO4、HPO3的酸酐,具有 酸性氧化物的通性,常用作干燥剂。
9
三、磷酸
无色透明晶体,熔点42.35℃。是一种中 等强度的三元弱酸,具有吸湿性(作干燥 剂)和酸的通性。
[思考2]哪些情况可构成同素异形体3 ?
3、物理性质
白磷(黄磷)
红磷(赤磷)
分子结构 P4正四面体形,分子晶体 结构复杂,分子晶体
颜色状态 白色蜡状固体
暗红色粉末
溶解性 毒性
不溶于水,
易溶于CS2 剧毒(0.1g致死)
不溶于水,
也不溶于CS2 无毒
着火点 40℃(可自燃)
240℃
熔点
44℃
升华
保存
磷及其化合物
1
一、磷
1、存在:自然界没有游离态的磷存 在,磷主要以磷酸盐的形式存在于矿 石中[磷矿石:Ca3(PO4)2 ,氟磷灰石: Ca5F(PO4)3]。是构成蛋白质的成份之 一,动物的骨骼、牙齿和神经组织, 植物的果实和幼芽,生物的细胞里都 含有磷。
2
2、单质结构
白磷
红磷,对吗?
沉淀投入第二支试管,则沉淀消失。试确
定该单质的化学式。写出有关的化学方程
式。
13
点燃
P4+5O2==2P2O5 P2O5+3H2O===2H3PO4 2H3PO4+Ca(OH)2==Ca(H2PO4)2+H2O Ca(H2PO4)2+Ca(OH)2==2CaHPO4↓+2H2O 2CaHPO4+Ca(OH)2==Ca3(PO4)2↓+2H2O Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
少量保存在水中
密闭保存
相互转化
260℃
白磷
红磷
416℃(升华)
4
4、化学性质
(1)与O2反应
点燃
4P+3O2=====2P2O3
点燃
4P+5O2=====2P2O5
(2)与Cl2反应
点燃
2P+3Cl2=====2PCl3
点燃
2P+5Cl2=====2PCl5
5
(3)其它反应 (指出氧化剂、还原剂)
写出氟化钙与浓硫酸反应制取氟化氢 的化学方程式;
写出氟磷灰石[Ca5(PO4)3F]与浓硫酸 反应的化学方程式。
16
4、工业上常用氟磷灰石[Ca5(PO4)3F]为原料,按 图示制取磷酸、重过磷酸钙[Ca(H2PO4)2]和氢氟酸。 图中反应(I)为氟磷灰石跟另一种原料反应,生成 A、B、C三种物质,其中的产物C又跟氟磷灰石发 生反应(II),生成B和重过磷酸钙。试写出两个反 应的化学方程式。
Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
重过磷酸钙(重钙)
PO43-的检验:
纯净物
12
例题
1、有一固体单质,质软,在空气中极易
燃烧,生成物溶于热水后滴加紫色石蕊试
剂显红色。把所得溶液分盛两支试管,向
第一支试管中滴入少量饱和澄清石灰水,
无混浊出现,若继续滴加,出现白色混浊,
过量则产生白色沉淀。过滤,取少量白色
14
2、将 amolCa3(PO4)2和bmolH2SO4混 合恰好完全反应反应后的物质中含有:
Ca(H2PO4)2、CaHPO4、CaSO4三种 物质,则a/b的取值范围是
A. 1<a/b<2
B. 1/2<a/b<1
C.3/2<a/b<2
D. 1/3<a/b<1
答案:B
15
3、写出磷酸钙与浓硫酸反应制取磷酸的 化学方程式;
3P4+20HNO3+8H2O====12H3PO4+20NO ↑ (制取磷酸)
P4+3NaOH+9H2O====3NaH2PO4+5PH3↑
11P+15CuSO4+24H2O=5Cu3P↓+6H3PO4+15H2SO4
(白磷中毒的内服解毒剂)
6
同素异形体与同位素的比较
同素异形体
同位素
概念
由同一种元素所形成的 几种性质不同的单质
A
(I)
氟磷灰石
B
C (II) D
17
反应(I): Ca5(PO4)3F+5H2SO4===5CaSO4+3H3PO4+HF↑
反应(II): Ca5(PO4)3F+7H3PO4===5Ca(H2PO4)2+HF↑
18
5、三硫化四磷是制造火柴的主要原 料,它分子里的硫为二价,磷为三价。 又知分子里有一个由非极性键形成的 正三角形和三个由共价键形成的五原 子环。若分别用“.”和“。”代表磷 原子和硫原子,则三硫化四磷的结构 式是____________。
19
●
o oo
●
●
●
20
6、三磷酸钠(Na5P3O10)是用Na2HPO4和NaH2PO4 溶液在623K左右反应制得。这一反应的化学方程式是 ____________。 三磷酸钠是三磷酸的钠盐,三磷酸可看作是三个磷酸
分子脱去两分子水而生成的。磷酸根离子的结构式为
O P O 3- ,若三磷酸根P3O105-中只有磷氧 O O 键,它的结构可表示为________。
