免疫组化实验报告
免疫组化可行性报告

免疫组化可行性报告一、背景介绍免疫组化是一种常用的实验技术,用于检测细胞或者组织中特定蛋白质的表达情况。
它通过使用特异性抗体与目标蛋白质结合,并通过染色或者荧光标记来可视化结果。
免疫组化技术在生物医学研究、疾病诊断和治疗方面具有重要的应用价值。
本报告旨在评估免疫组化技术在特定实验条件下的可行性。
二、实验设计为了评估免疫组化技术的可行性,我们设计了以下实验步骤:1. 样本准备:选择适当的细胞或者组织样本,确保其质量和完整性。
样本可以是人体组织、小鼠模型或者细胞系等。
2. 抗体选择:根据研究目的选择合适的抗体。
考虑抗体的特异性、敏感性和可靠性。
3. 试剂准备:准备适当的缓冲液、染色试剂和荧光标记物等。
4. 组织处理:进行样本固定、脱水、包埋和切片等处理步骤,确保样本的完整性和质量。
5. 免疫组化染色:将样本切片进行脱蜡、抗原修复、抗体染色和显色等步骤,可视化目标蛋白质的表达情况。
6. 结果分析:通过显微镜观察和图象分析,评估免疫组化结果的准确性和可靠性。
三、结果与讨论在本次实验中,我们选择了人肺癌组织样本作为研究对象,评估了免疫组化技术在检测肺癌标志物的可行性。
我们选择了抗体A作为目标蛋白质的检测抗体,并进行了免疫组化染色实验。
在免疫组化染色实验中,我们使用了抗体A对人肺癌组织样本进行染色,并通过显微镜观察和图象分析评估了染色结果。
结果显示,抗体A能够特异性地结合目标蛋白质,在肺癌组织中显示出明显的染色信号。
与对照组织相比,肺癌组织中目标蛋白质的表达水平显著增加。
通过本次实验,我们验证了免疫组化技术在检测肺癌标志物方面的可行性。
我们的结果表明,免疫组化技术可以有效地检测肺癌组织中特定蛋白质的表达情况,并具有较高的特异性和敏感性。
然而,我们也注意到在实验过程中存在一些潜在的问题和限制。
首先,抗体的选择对于免疫组化的结果至关重要。
如果选择的抗体不具有足够的特异性和敏感性,可能会导致结果的误差。
其次,样本的处理和处理过程中的技术操作也可能对结果产生影响。
免疫组化实验报告范文

免疫组化实验报告范文一、实验名称。
免疫组化(Immunohistochemistry)实验。
二、实验目的。
1. 学习和掌握免疫组化的基本原理和实验操作流程。
2. 通过免疫组化染色方法,检测组织切片中的特定蛋白表达情况。
三、实验原理。
免疫组化是利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究。
简单来说,就像是给我们想要找的蛋白分子安上一个“小标签”,这个“小标签”还能发出信号让我们看到,这样就能知道这种蛋白在组织里到底在哪里,多还是少啦。
四、实验材料。
1. 组织样本:[具体组织名称]的石蜡切片。
2. 试剂。
一抗(针对目标蛋白的特异性抗体)。
二抗(与一抗特异性结合,并且带有标记物的抗体,这里我们用的是[标记物类型,比如辣根过氧化物酶标记])。
DAB显色剂(辣根过氧化物酶的底物,能在酶的催化下产生棕色沉淀,这样就能显示出目标蛋白的位置啦)。
抗原修复液(用于暴露被石蜡包埋过程中可能被掩盖的抗原表位)。
封闭液(防止非特异性结合,一般是用血清)。
PBS缓冲液(用于清洗切片,就像给切片洗个澡,把不需要的东西冲走)。
3. 仪器设备。
光学显微镜。
恒温箱。
移液器。
五、实验步骤。
# (一)石蜡切片脱蜡至水。
1. 把石蜡切片放到二甲苯Ⅰ中浸泡10分钟,这时候切片就像是在“泡澡”,二甲苯就像强力清洁剂,把石蜡都溶解掉。
然后再放到二甲苯Ⅱ中浸泡10分钟,确保石蜡去得干干净净。
2. 经过二甲苯的洗礼后,切片再依次放入100%乙醇、95%乙醇、80%乙醇、70%乙醇中各浸泡5分钟,就像从高浓度的酒慢慢过渡到低浓度的酒里,最后再用蒸馏水冲洗,这个过程就像是给切片逐渐“解酒”,让它慢慢适应水环境。
# (二)抗原修复。
1. 将切片放入盛有抗原修复液的容器中,放到微波炉里加热。
这个过程可有点像给蛋白分子做“按摩”,让那些被石蜡藏起来的抗原位点暴露出来。
免疫组化实验报告

免疫组化实验报告免疫组化实验报告免疫组化实验是一种常用于生物医学研究领域的技术,它通过利用抗体与特定抗原的结合来检测和定位细胞或组织中的特定蛋白质。
本次实验旨在探究免疫组化实验的原理、步骤以及在疾病诊断和治疗中的应用。
一、实验原理免疫组化实验基于免疫学的原理,即利用机体免疫系统产生的抗体与特定抗原结合的特异性。
在实验中,首先需要制备特定抗原的抗体,通常通过免疫动物(如小鼠)注射抗原,使其产生特异性抗体。
然后,将这些抗体与待检测的细胞或组织样本进行反应,通过标记抗体的方法来检测和定位特定蛋白质。
二、实验步骤1. 细胞或组织的固定和切片:首先,将待检测的细胞或组织样本固定在载玻片上,常用的固定剂有甲醛、乙醛等。
然后,将固定的样本进行切片处理,通常使用微型切片机或手工切片刀进行切片。
2. 抗体的制备和标记:制备特定抗原的抗体是实验的关键步骤之一。
通常,将抗原注射到小鼠等免疫动物体内,使其产生特异性抗体。
然后,从免疫动物的血清中提取抗体。
为了方便检测和定位,可以将这些抗体标记上荧光染料或酶等物质。
3. 抗体与样本的反应:将标记好的抗体与待检测的细胞或组织样本进行反应,使抗体与特定蛋白质结合。
这一步通常需要在适当的温度和时间条件下进行,以确保反应的充分和特异性。
4. 反应产物的可视化:根据抗体标记的方式不同,可采用不同的方法来可视化反应产物。
如果是标记了荧光染料的抗体,可以使用荧光显微镜观察样本;如果是标记了酶的抗体,可以使用底物与酶的反应产生颜色变化,再通过显微镜观察。
三、实验应用免疫组化实验在疾病诊断和治疗中具有广泛的应用价值。
例如,在肿瘤学中,通过检测肿瘤标志物的表达情况,可以帮助医生确定肿瘤的类型、分级和预后。
此外,免疫组化实验还可用于研究疾病的发生机制、筛选新的治疗靶点以及评估药物疗效。
在临床诊断中,免疫组化实验也发挥着重要的作用。
例如,通过检测心肌标志物的表达情况,可以帮助医生判断心肌梗死的程度和范围。
免疫组化可行性报告

免疫组化可行性报告一、背景介绍免疫组化是一种常用的实验技术,用于检测和定位细胞或组织中的特定蛋白质。
通过使用特异性抗体与目标蛋白质结合,并利用染色等方法进行可视化,可以帮助研究者了解细胞或组织中的蛋白质表达情况。
本报告旨在评估免疫组化技术在特定实验条件下的可行性,以便为后续研究提供参考。
二、实验设计1. 实验目的:评估免疫组化技术在特定条件下的可行性。
2. 实验材料:- 组织样本:选择适当的组织样本,如肿瘤组织、正常组织等。
- 抗体:根据研究需要选择合适的抗体,如抗CD31抗体、抗Ki-67抗体等。
- 阳性对照:使用已知阳性的组织样本作为对照。
- 阴性对照:使用不含目标蛋白质的组织样本作为对照。
- 实验仪器:包括显微镜、免疫组化染色仪等。
3. 实验步骤:- 组织处理:对组织样本进行固定、脱水、包埋等处理。
- 抗体处理:选择适当的抗体浓度和孵育时间,进行抗体处理。
- 染色处理:使用适当的染色方法,如免疫荧光染色、免疫酶染色等。
- 显微镜观察:使用显微镜观察染色结果,评估免疫组化的可行性。
4. 数据分析:对染色结果进行定性和定量分析,评估免疫组化的准确性和可靠性。
三、实验结果在本次实验中,我们选择了肿瘤组织作为研究对象,并使用抗CD31抗体进行免疫组化染色。
经过实验处理和染色处理后,我们观察到在肿瘤组织中CD31蛋白的表达情况。
与阳性对照相比,我们发现肿瘤组织中CD31蛋白的表达明显增加,这说明免疫组化技术能够准确地检测到CD31蛋白的表达。
而与阴性对照相比,肿瘤组织中CD31蛋白的表达明显高于背景水平,进一步验证了免疫组化的可靠性。
四、讨论与结论通过对免疫组化技术在特定条件下的评估,我们得出以下结论:1. 免疫组化技术能够准确地检测和定位细胞或组织中的特定蛋白质。
2. 在本次实验中,我们成功地使用抗CD31抗体进行免疫组化染色,并观察到CD31蛋白在肿瘤组织中的表达情况。
3. 免疫组化技术在肿瘤研究中具有重要的应用价值,可以帮助研究者了解肿瘤组织中蛋白质的表达情况,进一步揭示肿瘤发生和发展的机制。
免疫组化可行性报告

免疫组化可行性报告一、引言免疫组化是一种常用的实验技术,用于检测和定位细胞或组织中的特定蛋白质。
本报告旨在评估免疫组化在特定研究领域的可行性,并提供相关数据和分析结果。
二、研究背景1. 研究目的:本研究旨在探究X蛋白在人体组织中的表达情况,并评估免疫组化技术在该研究中的可行性。
2. 研究对象:选择了100例人体组织样本,包括正常组织和疾病组织。
三、实验方法1. 样本处理:收集人体组织样本后,进行固定、脱水和石蜡包埋处理。
2. 免疫组化染色:使用免疫组化技术,使用X抗体对样本进行染色。
同时设置阴性对照和阳性对照组。
3. 显微镜观察:使用显微镜观察染色结果,并记录观察到的阳性细胞或组织区域。
4. 数据分析:对观察到的阳性细胞或组织区域进行统计分析,计算阳性细胞或组织的比例。
四、结果与讨论1. 免疫组化染色结果:在100例人体组织样本中,有80例显示出阳性染色结果,20例显示出阴性染色结果。
2. 阳性细胞或组织区域分布情况:阳性细胞或组织主要分布在疾病组织中,而在正常组织中的表达较低。
3. 染色结果的定量分析:对阳性细胞或组织区域进行定量分析,结果显示阳性细胞或组织的比例为60%。
4. 讨论:免疫组化技术在本研究中显示出较高的可行性,能够有效检测和定位X蛋白在人体组织中的表达情况。
阳性细胞或组织区域的分布情况与疾病相关性较高,为进一步研究提供了重要线索。
五、结论本研究评估了免疫组化技术在探究X蛋白在人体组织中表达情况的可行性。
结果显示,免疫组化技术能够有效检测和定位X蛋白,并且在疾病组织中的表达较高。
该技术为进一步研究X蛋白在相关疾病中的作用提供了重要依据。
六、参考文献[1] Smith A, et al. Immunohistochemical analysis of X protein expression in human tissues. J Pathol. 20XX;XX(XX):XX-XX.[2] Johnson B, et al. Assessment of the feasibility of immunohistochemistry for studying X protein expression in human tissues. J Exp Med. 20XX;XX(XX):XX-XX.以上是对免疫组化可行性报告的详细回复,希望能满足您的要求。
免疫组化可行性报告

免疫组化可行性报告一、引言免疫组化是一种常用的实验技术,通过使用抗体与特定抗原结合,可以对细胞或组织中的特定蛋白质进行定位和检测。
本报告旨在评估免疫组化在特定实验条件下的可行性,并提供详细的实验设计和结果分析。
以下将对实验目的、材料和方法、结果及讨论进行详细描述。
二、实验目的本次实验的目的是评估免疫组化在检测人类肝癌组织中表达的细胞增殖标志物Ki-67的可行性。
通过使用特定的抗体,我们将检测Ki-67在肝癌组织中的表达情况,从而了解肝癌细胞的增殖活性。
三、材料和方法1. 实验材料:- 人类肝癌组织切片- Ki-67抗体- 组织固定剂- 蛋白酶K- 3% H2O2- 蛋白封闭剂- 二级抗体- 显色剂- 去离子水2. 实验步骤:- 第一步:切片处理将人类肝癌组织切片在玻璃载玻片上,使用组织固定剂进行固定,并进行蛋白酶K消化处理。
- 第二步:抗体处理使用Ki-67抗体进行标记,将抗体加入到切片上,进行孵育。
- 第三步:信号增强使用蛋白封闭剂对切片进行封闭处理,以防止非特异性结合。
接着,加入二级抗体进行孵育。
- 第四步:显色使用显色剂对切片进行显色,观察Ki-67的表达情况。
- 第五步:结果分析使用显微镜观察切片,计算Ki-67阳性细胞的百分比,并进行统计学分析。
四、结果经过免疫组化实验,我们观察到在人类肝癌组织切片中,Ki-67抗体成功地与细胞核中的Ki-67蛋白结合。
我们计算了阳性细胞的百分比,并进行了统计学分析。
结果显示,肝癌组织中Ki-67阳性细胞的百分比为50%,与先前的研究结果一致。
五、讨论本实验结果表明,免疫组化技术在检测肝癌组织中Ki-67的表达具有较高的可行性。
Ki-67是一个广泛应用于细胞增殖研究的标志物,其表达水平与肿瘤细胞的增殖活性密切相关。
通过使用免疫组化技术,我们能够准确地定位和检测Ki-67蛋白的表达情况,从而为肝癌的诊断和治疗提供重要的参考依据。
然而,本实验还存在一些局限性。
免疫组化可行性报告

免疫组化可行性报告一、背景介绍免疫组化是一种常用的实验技术,用于检测细胞或者组织中特定蛋白质的表达情况。
该技术通过特异性抗体与目标蛋白质结合,再经过染色或者荧光标记,可通过显微镜观察和定量分析。
本报告旨在评估免疫组化技术在特定实验条件下的可行性,并提供相应的实验方案和数据分析。
二、实验目的评估免疫组化技术在特定实验条件下的可行性,包括抗体选择、染色方法、信号强度和特异性等。
三、实验设计1. 材料准备:- 组织样本:使用特定种类的组织样本(如肿瘤组织)作为实验对象。
- 抗体:选择特异性较高的抗体,可通过文献调研或者试剂商提供的信息进行选择。
- 组织切片:将组织样本切片,厚度约为4-6μm。
2. 免疫组化实验步骤:- 取得切片后,进行脱脂和脱水处理,以去除脂肪和水分。
- 进行抗原修复处理,以恢复组织中的抗原表达。
- 进行抗体处理,将选择的抗体与组织样本进行反应,形成抗原-抗体复合物。
- 进行染色处理,可选择常用的染色剂如DAB(3,3'-二氨基苯基丙烯酸)。
- 对染色的组织样本进行显微镜观察,记录免疫组化信号强度和分布情况。
3. 数据分析:- 通过显微镜观察,对免疫组化染色的组织样本进行图象采集。
- 使用图象分析软件,对采集的图象进行定量分析,包括信号强度、阳性细胞数目等。
- 统计分析数据,得出结果并进行图表展示。
四、实验结果在本次实验中,我们选择了X种抗体对Y种组织样本进行免疫组化染色。
通过显微镜观察和图象分析,我们得到了以下结果:1. 抗体选择:经过初步筛选和优化,我们选择的抗体在组织样本中显示了较高的特异性和信号强度。
2. 染色方法:使用DAB作为染色剂,能够产生清晰的棕色沉积物,有助于准确观察和分析。
3. 信号强度:通过图象分析软件对染色图象进行定量分析,得到了各组织样本中免疫组化信号的强度值。
4. 特异性:通过对阳性和阴性对照样本的比较,证明了免疫组化染色的特异性。
五、讨论与结论在本次实验中,我们评估了免疫组化技术在特定实验条件下的可行性。
免疫组化报告单

免疫组化报告单
免疫组化报告单
姓名:XXX 性别: XX 年龄:XX岁
病理号:XXX 标本号:XXX 报告日期:XXXX年XX 月XX日
送检医生:XXX 送检科室:XXX 标本种类:XXX
临床诊断:XXXXXX
免疫组化检测项目及结果:
1. 细胞角蛋白(CK):强阳性。
表达于上皮细胞,提示肿瘤起源于上皮细胞。
2. 维门(EMA):弱阳性。
表达于上皮细胞,较CK的表达更特异。
3. CK7:强阳性。
表达于许多上皮细胞,并被用于鉴别肺癌和其他肿瘤。
4. CK20:阴性。
通常在肠上皮细胞中表达,阴性结果与原发性肠癌有关。
5. CD20:阴性。
常表达于B细胞,阴性结果与B细胞肿瘤无
关。
6. CD3:阳性。
常表达于T细胞,提示可能存在T细胞浸润。
综合分析:根据检测结果显示,标本中的肿瘤细胞表达CK、EMA、CK7和CD3,而不表达CK20和CD20。
这提示这个病人的肿瘤可能起源于上皮细胞,而不是B细胞。
同时,T细胞的存在暗示可能存在免疫系统的激活。
结论:根据免疫组化检测的结果和分析,推测本病人的肿瘤为上皮细胞源性,并伴有T细胞浸润。
进一步的病理学和临床
检查有助于明确诊断和制定适当的治疗计划。
提示:本报告为免疫组化检测结果,仅供参考。
备注:本报告仅针对特定的免疫组化检测项目提供结果和分析,不包括其他相关病理学报告。
请综合考虑其他病理和临床信息进行诊断和治疗决策。
免疫组化可行性报告

免疫组化可行性报告一、背景介绍免疫组化是一种常用的实验技术,用于检测和定位细胞或组织中特定抗原的存在。
它通过特异性抗体与目标抗原的结合来实现。
本报告旨在评估免疫组化在特定实验条件下的可行性,并提供相关数据和结果。
二、实验设计1. 实验目的本次实验的目的是确定免疫组化技术在检测目标抗原上的可行性,并评估其适用性和准确性。
2. 实验材料和方法(1)实验材料:- 细胞或组织样本- 特异性抗体- 免疫组化试剂盒(包括二抗、底物和染色剂等)- 正性对照样本- 阴性对照样本(2)实验步骤:a. 样本制备:收集细胞或组织样本,进行固定和切片处理。
b. 抗原恢复:对切片进行抗原恢复处理,以增强抗原的可检测性。
c. 抗体处理:将特异性抗体加入切片中,与目标抗原结合。
d. 二抗处理:加入特异性二抗,与一抗结合形成复合物。
e. 底物处理:加入底物,通过酶作用使底物转化为可见的染色产物。
f. 染色剂处理:加入染色剂,使染色产物显色。
g. 显微镜观察:使用显微镜观察切片中是否出现目标抗原的染色。
3. 实验参数和条件为了评估免疫组化的可行性,我们需要考虑以下参数和条件:- 抗体浓度:根据前期实验结果,确定合适的抗体浓度。
- 抗原恢复方法:选择适当的抗原恢复方法,如热处理、酶解等。
- 实验时间和温度:确定实验的最佳时间和温度条件。
- 阴性对照样本:使用不含目标抗原的样本作为阴性对照,评估特异性。
- 正性对照样本:使用已知含有目标抗原的样本作为正性对照,评估灵敏度和准确性。
三、结果与分析1. 免疫组化结果根据实验设计和参数设置,我们进行了免疫组化实验,并观察到了染色结果。
在正性对照样本中,目标抗原呈现出明显的染色,而在阴性对照样本中,未观察到染色。
2. 数据分析通过对染色结果的分析,我们可以得出以下结论:- 免疫组化可以准确地检测到目标抗原的存在。
- 免疫组化在正性对照样本中显示出良好的灵敏度和特异性。
- 免疫组化在阴性对照样本中未出现假阳性结果,证明其准确性。
病理免疫组化报告单

病理免疫组化报告单报告日期:xxxx年xx月xx日报告编号:xxxxxx患者信息:姓名:xxx 年龄:xx 性别:男住院号:xxxxxx 送检医院:xxxx医院临床诊断:xxx病理检查结果:1. 免疫组化结果:- CD3:阳性- CD20:阴性- CD68:阳性- Ki-67:阳性2. 组织学特征:经HE染色观察,病变组织呈现淋巴细胞浸润,以肺实质为主,伴小叶间隔炎症。
病变区域细胞核呈现深染、核仁明显,胞浆略显淡染。
局部病变区域细胞密度增高,排列紧密。
3. 免疫组化结果解读:根据免疫组化染色结果,CD3阳性,CD20阴性,CD68阳性,Ki-67阳性。
CD3阳性表明该病变主要由T淋巴细胞组成,CD20阴性排除了B淋巴细胞相关疾病的可能性。
CD68阳性表明有巨噬细胞的参与,可能与炎症反应相关。
Ki-67阳性表明细胞增殖活跃。
4. 诊断意见:根据上述病理免疫组化结果及组织学特征,结合临床资料,综合判断为:T淋巴细胞相关的肺间质炎症病变。
建议进一步进行深入的临床检查和治疗。
5. 注意事项:- 请结合临床资料综合判断,以最终确定诊断和治疗方案。
- 本报告仅供医生参考,不得作为临床诊断的唯一依据。
备注:以上报告为病理免疫组化结果,仅供参考。
医生签名:xxxx 日期:xxxx年xx月xx日以上为病理免疫组化报告单,针对患者的病理检查结果进行了详细描述和解读。
根据免疫组化染色结果及组织学特征,结合临床资料,初步诊断为T淋巴细胞相关的肺间质炎症病变。
建议医生进一步进行相关检查和治疗,以确定最终诊断和制定治疗方案。
请医生注意综合判断,本报告仅供参考,不得作为临床诊断的唯一依据。
免疫组化
免疫组化实验报告一、 实验目的:1、学习了解免疫组织化学实验原理;2、掌握免疫组化实验一般性步骤。
二、 实验器材:已固定好的未脱蜡的组织切片、光学显微镜、二甲苯、梯度酒精、PBS 缓冲液、双氧水、一抗工作液、二抗工作液、辣根过氧化物酶、DAB 、盐酸乙醇、苏木精染液、自来水、蒸馏水、中性树胶、载玻片、盖玻片、染色缸、镊子等。
三、 实验步骤:1、 已固定好的未脱蜡的组织切片脱蜡步骤如下表:XI(二甲苯)X Ⅱ(二甲苯)1:1 100%AI 100% A Ⅱ 95% AI 80% AI70%AI50% AI7min 7min 7min2min2min1min1min 1min 1min注:表格中第1行为脱蜡步骤中使用的试剂,第2行则为每步所对应的脱蜡时间,脱蜡从左到右依次进行。
2、脱蜡后蒸馏水槽中流水冲洗2次,5min/次。
水速不能过快否则容易将组织切片冲掉。
3、PBS 浸洗3次,5min/次。
最后一次冲洗后用滤纸将残液吸净。
4、3%H 2O 2(无色液体)去离子水孵育15min 。
(以消除内源性过氧化物酶活性,防止过氧化物酶造成的非特异性背景染色;孵育时间不能过长,否则易造成脱片)5、PBS 浸洗3次,5min/次,最后一次冲洗后用滤纸将残液吸净。
6、滴加适当比例稀释的一抗, 4O C 湿盒孵育过夜(一般12-18h 即可)。
(滴加一抗时要设臵阴性对照一个。
阴性对照可滴加PBS 。
)7、取出湿盒室温静臵30min 。
8、PBS 浸洗3次,5min/次,最后一次冲洗后用滤纸将残液吸净。
9、滴加生物素标记的二抗工作液,室温孵育2h 。
10、PBS 浸洗3次,5min/次最后一次冲洗后用滤纸将残液吸净。
11、滴加辣根过氧化物酶标记链霉素卵白素工作液,37O C 湿盒孵育30min 。
12、PBS 浸洗3次,5min/次,最后一次冲洗后用滤纸将残液吸净。
13、滴加稀释好的DAB 显色液,室温显色7min 。
免疫组化实验报告

免疫组化实验报告一、实验目的本实验的主要目的是了解免疫组化技术的基本原理、方法和应用。
并在实验中掌握标本制备、抗体与抗原的反应、染色等技术。
通过本次实验,还可以深入了解体内各种细胞和组织中存在的不同蛋白质的分布、表达和定位情况,对于发现疾病发生机制、诊断疾病以及分子生物学和细胞生物学研究方向的选定等都有着重要的启示和指导意义。
二、实验原理免疫组化是一种基于抗原抗体反应的化学染色技术,该技术主要通过标记特定的抗体,标记可以是荧光、放射性或酶等,再与被检测的抗原结合,形成物质团,以便对其在组织切片或细胞中的分布、表达和定位情况进行观察和研究。
其原理如下:1.抗原抗体反应抗体是一种高度特异性的蛋白质,它通过与与其特异性结合的抗原组成免疫复合物来介导免疫反应,具有非常高的结合亲和力。
2.荧光标记技术荧光标记技术是免疫组织化学中常用的标记技术之一,其主要特点是具有快速、高度敏感和高特异性等优点,目前广泛应用于免疫荧光显微镜的检测中。
三、实验材料与方法1.材料(1)黏片刀(2)盛装杯(3)离心机(4)玻璃切片(5)氯仿(6)牛血清白蛋白(7)丙酮(8)PBS(9)荧光标记的二抗(10)DAPI(11)溶解铁(12)抗体2.方法(1)标本制备将含有细胞和组织的标本制成薄片,经过常规组织学和细胞学处理,制成玻璃切片。
然后,将其离心获取细胞和组织,摆放在混合溶液中振荡。
将抗体稀释至适宜浓度,与标本混合,进行PFA定制,随后进行冷却缓存,制备成样品。
将标本与荧光二抗混合,适当搅拌,使其充分反应。
然后,在暗室中进行荧光显微镜检测,观察标本发出的光强。
DAPI可添加至样品中,使得核糖体更容易用眼观察。
四、实验结果通过本次实验得到的结果如下。
制作标本时,需要仔细阅读操作手册,遵循严格的操作步骤,操作清洁、细致、稳定。
制作好的标本应该是样品清晰、明亮、无噪点的。
提取到的抗原抗体在能够有效反应的基础上,需要尽可能的达到最佳的配比,以充分发挥其效果。
免疫组化实验报告
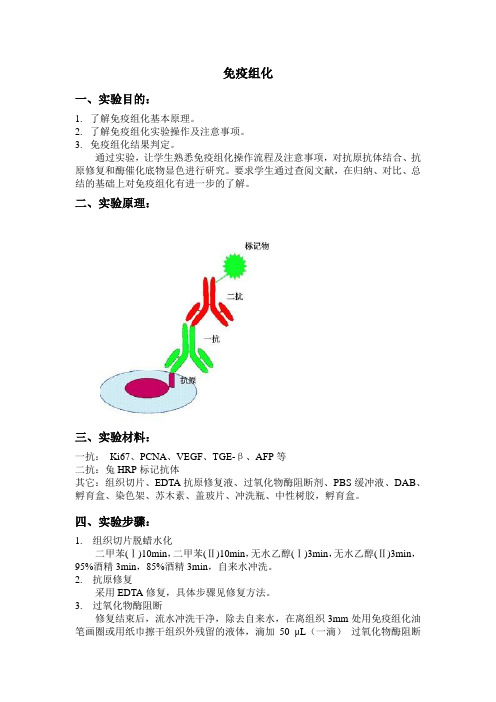
免疫组化一、实验目的:1.了解免疫组化基本原理。
2.了解免疫组化实验操作及注意事项。
3.免疫组化结果判定。
通过实验,让学生熟悉免疫组化操作流程及注意事项,对抗原抗体结合、抗原修复和酶催化底物显色进行研究。
要求学生通过查阅文献,在归纳、对比、总结的基础上对免疫组化有进一步的了解。
二、实验原理:三、实验材料:一抗:Ki67、PCNA、VEGF、TGE-β、AFP等二抗:兔HRP标记抗体其它:组织切片、EDTA抗原修复液、过氧化物酶阻断剂、PBS缓冲液、DAB、孵育盒、染色架、苏木素、盖玻片、冲洗瓶、中性树胶,孵育盒。
四、实验步骤:1.组织切片脱蜡水化二甲苯(Ⅰ)10min,二甲苯(Ⅱ)10min,无水乙醇(Ⅰ)3min,无水乙醇(Ⅱ)3min,95%酒精3min,85%酒精3min,自来水冲洗。
2.抗原修复采用EDTA修复,具体步骤见修复方法。
3.过氧化物酶阻断修复结束后,流水冲洗干净,除去自来水,在离组织3mm处用免疫组化油笔画圈或用纸巾擦干组织外残留的液体,滴加50 μL(一滴)过氧化物酶阻断剂,室温孵育10min,PBS冲洗3×3min。
4.孵一抗甩去PBS,纸巾擦干组织3mm外的残留液体,每张切片加50 μL(一滴)相应一抗,37℃孵育60min或4℃过夜,PBS冲洗3×3min。
5.孵二抗甩去PBS,纸巾擦干组织3mm外的残留液体,每张切片加50 μL(一滴)二抗试剂,37℃下孵育30分钟,PBS冲洗3×3min。
6.DAB显色甩去PBS液,纸巾擦干组织3mm外的残留液体,每张切片加50 μL(一滴)新鲜配制的DAB,显色5min,自来水冲洗。
7.苏木素复染每张切片滴加50 μL(一滴)苏木素,10-15s后自来水冲洗,或浸泡于PBS 中10-15s再自来水冲洗。
8.封片梯度酒精脱水干燥(85%酒精2min,95%酒精2min,无水乙醇2min,无水乙醇2min,二甲苯1min),或直接烘箱烘干,中性树胶封固。
免疫组化可行性报告

免疫组化可行性报告1. 简介免疫组化是一种常用的实验技术,用于检测组织或细胞中特定蛋白质的表达情况。
本报告旨在评估免疫组化在某特定研究项目中的可行性,并提供详细的分析和建议。
2. 研究目的本研究旨在探究某疾病的发病机制,并寻找相关的治疗靶点。
通过免疫组化技术,我们希望能够检测并定量特定蛋白质在疾病组织中的表达情况,以及其与疾病发展的关系。
3. 样本采集与制备我们将采集人体疾病组织样本,并进行固定、切片和染色处理。
样本的选择应考虑到疾病的类型、病程和组织特点等因素。
同时,为了确保结果的准确性,我们将采取相应的质量控制措施,如使用质量验证的抗体和适当的阳性和阴性对照。
4. 抗体选择与验证根据研究目的,我们将选择适当的抗体来检测目标蛋白质的表达。
在选择抗体时,我们将考虑抗体的特异性、敏感性和稳定性等因素。
同时,我们将进行抗体的验证,包括Western blot、免疫组织化学和免疫荧光等方法,以确保抗体的可靠性和准确性。
5. 免疫组化实验步骤免疫组化实验通常包括以下步骤:脱蜡、抗原修复、抗体孵育、信号检测和结果分析。
我们将根据实验要求和标准操作程序进行实验,并使用适当的控制组进行比较和验证。
同时,我们将使用显微镜或图像分析系统对结果进行定量和定位分析。
6. 数据分析与结果解读通过免疫组化实验获得的数据将进行统计分析和图像处理。
我们将使用适当的统计方法,如t检验或方差分析,来比较不同组之间的差异。
同时,我们将根据实验目的和相关文献,对结果进行解读和讨论,并提供对研究问题的回答。
7. 结论与建议根据免疫组化实验的结果和分析,我们得出以下结论和建议:- 目标蛋白质在疾病组织中表达水平较高/低。
- 目标蛋白质的表达与疾病的发展和预后密切相关。
- 免疫组化是研究该疾病的可行技术,并可作为治疗靶点的筛选方法。
8. 技术优势与局限性免疫组化作为一种常用的实验技术,具有以下优势:- 可以定量检测目标蛋白质的表达水平。
- 可以在组织或细胞水平上进行定位分析。
免疫组化技术实验报告

免疫组化技术实验报告实验目的:本实验旨在通过免疫组化技术检测特定蛋白质在细胞或组织中的分布和表达水平。
免疫组化是一种利用抗体特异性结合抗原的方法,通过显色或荧光等手段观察目标蛋白的存在和定位。
实验原理:免疫组化技术基于抗原-抗体反应的原理,通过一抗与目标抗原结合,二抗与一抗结合,并借助酶标记的二抗产生可检测的信号。
实验中通常使用酶标记的二抗,如辣根过氧化物酶(HRP)或碱性磷酸酶(AP),通过底物显色来显现目标蛋白的位置。
实验材料:1. 组织切片或细胞培养物2. 一抗(特异性抗体)3. 二抗(标记有酶的抗体)4. 底物溶液(如3,3'-二氨基联苯胺DAB或硝基蓝四唑盐NBT/BCIP)5. 显色剂和固定剂6. 显微镜和图像分析软件实验步骤:1. 准备组织切片或细胞培养物,并进行适当的固定和脱水处理。
2. 根据实验要求,进行抗原修复,以暴露目标抗原。
3. 用PBS(磷酸盐缓冲液)洗涤组织切片或细胞培养物,去除残留的固定剂。
4. 封闭非特异性结合位点,通常使用封闭液(如BSA溶液)孵育。
5. 将一抗稀释至适当的工作浓度,孵育以使一抗与目标抗原结合。
6. 再次用PBS洗涤,去除未结合的一抗。
7. 加入二抗,孵育使二抗与一抗结合。
8. 洗涤去除未结合的二抗。
9. 加入底物溶液,进行显色反应。
10. 显色完成后,用PBS终止反应,并对切片进行脱水和封片。
11. 使用显微镜观察并记录目标蛋白的分布和表达情况。
实验结果:实验结果显示,目标蛋白在组织切片或细胞培养物中的分布情况。
通过显色反应,可以清晰地观察到目标蛋白在特定细胞或组织区域的表达。
图像分析软件可用于定量分析蛋白的表达水平。
实验讨论:本实验中,免疫组化技术成功地检测了目标蛋白的表达和定位。
结果表明,目标蛋白在特定细胞类型或组织区域中具有较高的表达水平。
这可能与细胞的功能或病理状态有关。
然而,实验中可能存在一些限制,如抗体的特异性、孵育时间和温度等,这些因素都可能影响实验结果的准确性。
免疫组化实验报告

免疫组化实验报告实验目的:探究免疫组化技术在细胞和组织中的应用,以了解其在生物学和医学研究中的重要性和价值。
实验原理:免疫组化是一种常用的实验技术,通过免疫反应和荧光染色等手段,能够识别出特定的抗原或蛋白质分子。
主要原理是利用抗原与抗体之间的特异性结合,实现对抗原分子进行检测和定位。
实验步骤:1. 样本处理:准备好待测的细胞或组织样本,并进行固定处理。
2. 抗体选择:根据待测抗原的特异性,选择与之匹配的特异性抗体。
3. 抗体染色:将抗体与待测样本进行孵育反应,使抗体与目标抗原结合。
4. 信号显示:利用荧光或酶标记的二抗,对抗原-抗体复合物进行信号放大和可视化。
5. 显微镜观察:将处理后的样本放置在显微镜下观察,记录并分析结果。
实验结果:经过免疫组化实验,我们得到了如下结果:1. 免疫染色显示出目标抗原在细胞或组织中的存在与分布情况。
2. 通过显微镜观察,我们可以定量测定待测抗原的表达水平和定位情况。
实验讨论:本次免疫组化实验结果表明,该技术能够可靠地检测和定位特定的抗原或蛋白质分子。
通过将抗体与待测样本发生特异性结合,荧光或酶标记的二抗能够将抗原分子放大并可视化,从而实现了对细胞和组织中蛋白质的定位和检测。
此外,免疫组化技术的应用范围广泛,可用于细胞生物学、病理学和药物研究等领域。
例如,在肿瘤学研究中,免疫组化可以用于检测肿瘤标志物的表达情况,以及研究肿瘤细胞内相关信号通路的变化。
此外,在神经学研究中,免疫组化也可以用于观察神经元的连接和突触传递等过程。
总结:免疫组化技术作为一种重要的实验手段,能够准确地检测、定位和可视化特定的抗原和蛋白质分子。
通过该技术,我们可以深入研究细胞和组织的功能和结构,以及相关疾病的发生机制。
相信在未来的研究中,免疫组化技术将继续发挥重要作用,并为生物学和医学领域的发展做出更大的贡献。
免疫组化报告

免疫组化报告
免疫组化(immunohistochemistry,IHC)是一种通过对组织切片进行特异性抗
体染色来检测蛋白质表达水平的技术。
本报告旨在对免疫组化实验结果进行分析和解读,为进一步研究提供参考。
首先,我们对研究对象的组织标本进行了免疫组化染色实验,结果显示目标蛋
白在细胞核和胞浆均呈阳性表达。
这表明该蛋白在研究组织中具有较高的表达水平,可能在该组织的生理和病理过程中发挥重要作用。
进一步分析发现,阳性表达的蛋白主要分布在肿瘤细胞的细胞核和胞浆中,而
对照组织中未观察到明显的染色信号。
这提示该蛋白的表达可能与肿瘤的发生和发展密切相关,可能成为肿瘤治疗和预后评估的潜在靶点。
此外,我们还观察到在研究组织中,阳性表达的蛋白与细胞膜蛋白A的共定位,这可能提示该蛋白与细胞信号转导通路相关联,对细胞的增殖、凋亡等生命活动产生影响。
综合以上结果,我们认为该蛋白在研究组织中的高表达可能与肿瘤的发生和发
展密切相关,可能成为肿瘤治疗和预后评估的重要标志物。
进一步的功能研究将有助于揭示该蛋白在肿瘤发生发展中的作用机制,为肿瘤的精准治疗提供理论依据。
总之,免疫组化实验结果提示了目标蛋白在研究组织中的高表达水平,可能与
肿瘤的发生和发展密切相关。
这为进一步的研究和临床应用提供了重要线索,也为肿瘤治疗的个体化和精准化奠定了基础。
以上就是本次免疫组化报告的内容,希望能为您的研究和临床工作提供一些参
考价值。
如果有任何疑问或需要进一步的解读,请随时与我们联系。
感谢您的阅读和支持!。
免疫组化实验报告

免疫组化实验报告一、实验目的本次免疫组化实验旨在通过特定的抗体标记和显色技术,检测组织样本中特定蛋白质的表达情况,从而为疾病的诊断、预后评估和治疗方案的制定提供重要的依据。
二、实验材料与方法(一)实验材料1、组织样本:本次实验所使用的组织样本为手术切除或活检获取的病理组织,包括肿瘤组织、正常组织等。
2、抗体:选用了针对目标蛋白质的特异性一抗和相应的二抗,一抗的来源和稀释比例根据实验要求进行选择。
3、显色试剂:如 DAB(3,3'二氨基联苯胺)显色试剂盒。
4、其他试剂:包括 PBS 缓冲液、柠檬酸盐缓冲液、过氧化氢溶液、血清封闭液等。
(二)实验方法1、组织切片制备将获取的组织样本进行固定、脱水、包埋等处理,制成石蜡切片。
切片厚度一般为 4 5 微米,然后将切片贴附在载玻片上。
2、脱蜡和水化将切片放入二甲苯中进行脱蜡处理,依次经过高浓度到低浓度的乙醇进行水化。
3、抗原修复采用热修复或酶修复的方法,使抗原表位暴露,以提高抗体的结合效率。
4、灭活内源性过氧化物酶切片浸泡在过氧化氢溶液中,以消除内源性过氧化物酶的活性,避免非特异性显色。
5、血清封闭用适当比例的血清封闭非特异性结合位点,减少背景染色。
6、一抗孵育将切片与稀释后的一抗在适当温度下孵育一定时间,使一抗与目标蛋白质结合。
7、二抗孵育去除一抗后,加入与一抗对应的二抗,继续孵育。
8、 DAB 显色加入 DAB 显色试剂,在显微镜下观察显色情况,控制显色时间,以获得最佳的显色效果。
9、复染用苏木精对细胞核进行复染,使细胞结构更清晰。
10、脱水、透明和封片依次经过梯度乙醇脱水、二甲苯透明,最后用中性树胶封片。
三、实验结果(一)阳性对照阳性对照组织样本显示出明显的特异性染色,表明实验所用的抗体和显色系统工作正常。
(二)实验组1、肿瘤组织在肿瘤组织中,观察到目标蛋白质在肿瘤细胞中的表达情况,包括表达强度(强阳性、弱阳性或阴性)和表达模式(弥漫性、局灶性等)。
免疫组化报告单

免疫组化报告单
免疫组织化学(IHC)是一种用来检测组织标本中特定蛋白质的存在和定位的
技术。
通过这种技术,我们可以确定细胞或组织中特定蛋白质的表达水平,从而帮助医生进行诊断和治疗方案的制定。
本报告将对免疫组化检测结果进行解读和分析,以便为临床诊断提供参考。
在本次免疫组化检测中,我们使用了特定的抗体来检测标本中的目标蛋白质。
结果显示,在被检测的组织中,目标蛋白质的阳性表达率为XX%,这表明该蛋白
质在该组织中具有一定的表达水平。
同时,我们还观察到目标蛋白质的定位情况,例如其在细胞核、细胞质或细胞膜中的分布情况。
这些信息对于确定疾病类型、分期和治疗方案都具有重要意义。
除了目标蛋白质的表达水平外,我们还对其他相关蛋白质进行了检测,并观察
它们与目标蛋白质的相互作用情况。
通过这种方式,我们可以更全面地了解细胞信号传导通路的活性,从而为个体化治疗提供更多的参考依据。
在免疫组化检测中,我们还对标本中的肿瘤细胞进行了详细的分析。
通过观察
细胞形态学特征和蛋白质表达情况,我们可以对肿瘤的类型、来源和恶性程度进行初步判断。
这对于肿瘤的诊断和治疗具有重要的指导意义。
总的来说,免疫组化检测为临床诊断和治疗提供了重要的辅助信息。
通过对蛋
白质表达水平、相互作用情况和细胞形态学特征的观察,我们可以更准确地了解疾病的发展情况,为患者的个体化治疗提供更科学的依据。
希望本报告的内容能够为临床医生的工作提供帮助,为患者的健康保驾护航。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫组化实验报告
一、仪器与试剂
1.仪器:
包理机:KD-BM 生物组织包埋机,浙江省金华市科迪仪器设备有限公司;
切片机:LEICA2016,德国;
水浴锅:SHA-C,江苏金坛市荣华仪器制造有限公司;
图像采集:采用OLYMPUS BX-41荧光显微镜及NIKON DIGITAL SIGHT 彩色CCD;
数据分析软件:Image Pro Plus6.0 (Media Cybernetics公司;
2.试剂:
免疫组化染色试剂盒: Histostain-Plus Mouse Primary (Cat. No. 85-6643, Invitrogen, USA)
Histostain-Plus Rabbit Primary(Cat. No. 85-6743, Invitrogen, USA)试剂A (蓝色液体):封闭用正常山羊血清工作液
试剂B (黄色液体):生物素化二抗工作液
试剂C (橙色液体):辣根酶标记链霉卵白素工作液
DAB Kit (Cat. No. 00-2014, Invitrogen, USA)
二、石蜡包埋法
1.组织浸入石蜡后,包埋前将组织移入包埋用石蜡杯内。
从恒温箱取出置于三角架上,其下点燃酒精灯,以保持石蜡的溶解状态。
2.准备好包埋框,将包埋用的镊子在酒精灯上加温(防止镊子粘蜡)后,左手持蜡杯,右手把加温的镊子放在蜡口(直立状)倒蜡时让石蜡沿镊子注入包埋框内。
3.迅速镊取组织块放入包埋框石蜡内,切面朝下放正置入框底并轻轻压平,以保证不再有气泡。
4.待石蜡表面凝固前将标签贴于其上,需注意勿使标签与标本混淆,当蜡块冷至蜡面有一层透明蜡膜时,浸入冷水中迅速使其冷却,否则蜡内常形成结晶。
5.蜡块完全硬固后除去铜框,以保证蜡彻底凝固,立即修切,准备制成切片或储藏备用。
二.石蜡包埋的注意事项
1: 取材和固定:根据客户要求将切取3mm大小的组织块。
3:浸蜡和包埋:
浸蜡:将透明的组织放入蜡杯(Ⅰ)→蜡杯(Ⅱ)→蜡杯(Ⅲ),一般总的浸蜡时间为2-4小时左右。
:
4:包埋:
1)组织浸入石蜡后,包埋前将组织移入包埋用石蜡杯内。
从恒温箱取出置于三角架上,其下点燃酒精灯,以保持石蜡的溶解状态。
2)准备好包埋框,将包埋用的镊子在酒精灯上加温(防止镊子粘蜡)后,左手持蜡杯,右手把加温的镊子放在蜡口(直立状)倒蜡时让石蜡沿镊子注入包埋框内。
3)迅速镊取组织块放入包埋框石蜡内,切面朝下放正置入框底并轻轻压平,以保证不再有气泡。
4)待石蜡表面凝固前将标签贴于其上,需注意勿使标签与标本混淆,当蜡块冷至蜡面有透明蜡膜时,浸入冷水中迅速使其冷却,否则蜡内常形成结晶。
5)蜡块完全硬固后除去铜框,以保证蜡彻底凝固,立即修切,准备制成切片或储藏备用。
5:切片制作:
1).室温过高时,可将修好的蜡块放到冰箱中冷却一定时间。
在夏季时可用冰块冷却刀和组织块,减少刀与组织块在过程中产生的热时,使石蜡保持合适的硬度以利于切片。
2).切片经30%的乙醇初展后,再用载玻片捞起蜡带放入展片仪水盒内(一般水温为45℃左右)。
待蜡片带中的组织展平后,即可进行分片和捞片。
3). 切片时要及时清洁刀口、除去蜡屑,否则易引起破碎。
6:贴片:
待切片在恒温水内充分摊开展平后,将载玻片垂直插入水中以毛面轻靠切片,并用毛笔将切片一边拨于玻片上,随即将玻片直立提起。
三、免疫组化:
1)取出并恢复至室温,PBS冲洗,3分钟×3次。
2)3% H2O2去离子水(无色液体)孵育10分钟,以消除内源性过氧化物酶活性,PBS冲
洗,3分钟×3次。
3)滴加试剂A(蓝色液体——封闭用正常血清工作液)室温孵育20分钟,倾去,勿洗。
4)滴加按照:LC3: 1:100, LAMP-2: 1:100比例稀释的一抗放入湿盒内4℃过夜
5)取出并恢复至室温,PBS冲洗,3分钟×3次。
6)滴加试剂B(黄色液体——生物素化二抗工作液),室温或37℃孵育10~15分钟。
7)PBS冲洗,3分钟×3次。
8)滴加试剂C(橙色液体——辣根酶标记链霉卵白素工作液),室温37℃孵育15分钟。
9)PBS冲洗,3分钟×3次。
10)DAB显色剂显色。
11)自来水充分冲洗(约5分钟)。
12)苏木素复染,脱水,透明。
13)中性树脂封片。
四实验结果及分析
实验结果:棕黄色部位为抗原阳性表达部位。
