第五章 茎尖培养与快速繁殖
茎尖培养的特点

茎尖培养的特点茎尖培养是指将植物茎的顶端或顶端周围的组织进行培养,获得新植株的一种技术。
它是植物组织培养中常用的一种方法,具有以下特点。
茎尖培养的特点是快速繁殖。
茎尖是植物生长点,包含了高度分裂活性的细胞,能够迅速分化和增殖成新的植株。
通过茎尖培养,可以大量繁殖植物,快速得到数量可观的新苗。
茎尖培养的特点是可控性强。
茎尖培养可以在无菌条件下进行,可以对培养环境进行精细调控,如培养基的成分、添加激素的种类和浓度等。
这使得茎尖培养能够在较短的时间内控制植物的生长和发育过程,使其实现快速生长和分化。
茎尖培养的特点是遗传稳定性高。
茎尖培养所得到的新植株是通过细胞分裂和分化产生的,其遗传物质与母本完全一致。
因此,茎尖培养可以保持植物的遗传纯度,确保植株的遗传特性不发生改变。
茎尖培养的特点是适用范围广。
茎尖培养适用于多种植物,包括禾本科、豆科、百合科等多个科属植物。
而且,茎尖培养还可以用于繁殖难以通过其他方式繁殖的植物,如无性繁殖困难的珍稀植物、难以结实的花卉等。
茎尖培养还具有经济效益高的特点。
通过茎尖培养,可以在较短的时间内大量繁殖植株,实现规模化生产。
这对于植物育种、种苗生产以及经济林木的快速繁殖具有重要意义。
在茎尖培养中,一般采用茎尖分生组织作为外植体,将其接种到含有适宜培养基的培养容器中,经过适当的处理和培养条件,茎尖组织会分化和增殖成新的植株。
茎尖培养过程中需要注意以下几点。
要选择适宜的外植体。
外植体的选择直接影响到茎尖培养的成功率和效果。
一般来说,选择生长健壮、无病虫害的茎尖作为外植体,可以提高培养成功率。
要选择适宜的培养基。
培养基是茎尖培养中的关键因素之一,它提供了细胞分裂和分化所需的营养物质和生长因子。
培养基的成分和配方应根据不同植物的需求进行调整,以提高茎尖培养的效果。
要控制培养条件。
茎尖培养需要在无菌条件下进行,避免外界微生物的污染。
同时,培养容器的选择、培养温度和光照条件的控制等都会对茎尖培养的效果产生影响,需要加以控制和调整。
植物快速繁殖技教案5篇

植物快速繁殖技教案5篇第一篇:植物快速繁殖技教案植物快速繁殖技术(教案)5.1植物快速繁殖技术概述概念就是应用组织培养基本技术,快速繁殖名优新品种,使其在较短的时间内繁衍较多植株;快速繁衍珍稀濒危植物,使植物得以保存。
也叫组培快繁、组培苗生产、试管苗生产。
特点:第一个形成产业生产力的技术体系;农业育种方面具有重要应用价值;实现种苗繁殖产业化和商业化。
一、组培快繁方式的优势1、2、3、可在短时间内实现高质量、大批量的植物快速目标;繁殖系数高、繁殖过程不受季节和环境的影响;不存在种子(有性)繁殖中存在的世代(由于基因改变致使性状改变)的问题;4、高效的植物繁殖方法。
二、组培快繁的实质1、有性繁殖(种子繁殖):采用种子繁殖的自然方法。
其后代形状会发生改变。
2、无性繁殖(营养繁殖):采用营养体或组织培养技术进行繁殖的方法。
其后代能够有效保持母本的性状。
三、组培快繁的途径及方法1、用植物的根、茎、叶、叶柄、花等片段、孢子体作为外植体进行组培;2、取茎尖、腋芽进行离体培养。
3、4、植物快速繁殖的类型及方式,见表5—1(P.65)影响器官分化的因素:(1)、培养材料的种类、外植体的部位和生理状态;(2)、培养基的种类、植物激素的配比和浓度;(3)、温度、湿度、光照时间和强度、通气状况等培养环境。
四、外植体材料的选择和处理1、繁殖能力或再生能力:作为快速繁殖的外植体应该具有营养芽的枝条、幼嫩的组织或器官。
2、再生方式的遗传稳定性:外植体种类不同会影响繁殖植株的方式→影响繁殖种苗的遗传稳定性。
变异会影响群体中各个个体的性状表现或对产品质量难以预料和把握。
五、实现组培快繁的一般方式1、侧芽繁殖方法:控制好细胞分裂素的浓度,培养周期为20—30天,增值率为3—5倍。
2、外植体直接产生不定芽或补丁胚的方法:受植物本身特性的影响,只有少数种类的植物适用于此方法。
3、经过愈伤组织阶段或不定胚的发生途径:种类不同,繁殖率高低不同;新植株变异大。
第五章茎尖培养与快速繁殖

第五章茎尖培养与快速繁殖第五章茎尖培养与快速繁殖第一节茎尖培养脱毒技术一、培育无病毒苗的意义植物病毒病:由病毒和类病毒、支原体等引起,已发现此类病害700多种,无性繁殖植物严重;无特效药,培育无毒种苗是主要防治措施。
获得无病毒种苗的途径:1)从现有种质中筛选无毒单株;2)已感染植株脱毒。
二、植物脱毒的方法1. 热处理:病原物与植物耐热性不同,将植物在较高温度下处理一段时间,病原物钝化、失活或不能繁殖,而植物所受影响较小、生长较快,使病毒减少甚至消灭。
方法:1) 温汤浸渍:50℃温水中浸10分钟~数小时,简便易行,适用于休眠器官、接穗或种子。
2) 热空气处理:在温热治疗室/箱内,35~40℃,几十分钟~数月。
对茎尖效果较好,热处理后取较大茎尖培养,可提高成活率与脱毒率。
注意:易受伤,掌握温度与时间。
2. 茎尖培养脱毒3. 其他途径脱毒3.1 愈伤组织培养脱毒:花器官、珠心胚等愈伤中存在无病毒细胞群,从再生植株可得到无病毒苗。
3.2 茎尖微体嫁接脱毒:在无菌条件下,将切取的茎尖嫁接到培养的砧(zhen)木苗上。
3.3 抗病毒剂的应用:抗病毒醚: 可抑制病毒复制和扩散,嘌呤和嘧啶类似物;抗菌素三、茎尖培养脱毒技术1、原理病毒在植物体内分布不均匀,茎尖等生长点因为无维管束,病毒只能通过胞间连丝传递,赶不上细胞分裂和生长的速度,所以茎尖几乎不含病毒。
茎尖培养脱毒效果好,后代稳定,目前广泛应用。
2、脱毒技术2.1 操作取无菌顶稍1~2 cm→解剖镜(8—40倍)下→剥去幼叶→切取茎尖0.2~0.5 mm、带1~2个叶原基→接种。
注意:随切随接,防止变干;茎尖小较好,但太小不易成活,过大又不能保证完全脱毒。
草莓:茎尖0.2~0.3mm,脱毒率100%;1mm,脱毒率50%。
2.2 培养基基本培养基: MS、White、B5等。
碳源: 蔗糖效果好,可用白砂糖激素:2,4-D、IAA、NAA等,通常低浓度。
2.3 继代培养初代培养长成的新梢→切成小段→增殖培养基→1个月左右→新梢又可扩繁→→建立和维持茎尖无性系。
葡萄茎尖培养及快速繁殖技术研究

BA0 1 AA00 + . .:I .5 6 BA00 的 GS .5
白诗 南 ” 系 列 的 葡 萄 组 织 培 养 研 究 ,本 研 进 行 炼 苗 移 栽 。将 组 培 苗 移 植 在 培 养 基 上 启 动 较 好 。除 “ 其 个 用开水 消 毒过 的蛭石 、珍珠 岩 以 外 , 它 4 品 种 需 要 的 外 源 激 素
I AA 0. 2+6. BA 0. 5; I A 0. A 05+6-
关 于 茎 尖 培 养 对 GL V、 l w 01 Ra Yel o . %的升 汞消毒 5 分钟 , ~6 接种 当 seke Fek 良好 的 脱 毒 效 果 在 GS为 主 体 的 启 动 培 养 基 上 。 p c l、 lc 有
摘 要 :依 据 茎 尖 分 化 、伸 长和 生 根 三 阶段 中 所 需 激 素 比 例 的 不 同 ,适 当调 节它 们 之 间 的 比 例 ,从 而 筛
选 出适 合 不 同 时期 的 最 佳 激 素 配 比 ,比 常 规 微 茎 尖 处 理 缩 短 培 养 时 间 l 2~l 9天 。 关 键 词 : 葡 萄 ; 茎 尖培 养 ; 快 速 繁 殖
维普资讯
SNO— E E I OV Rs ASGR E NE&wl AP vl NE
2 2- 4 0 第 0i f
固固
葡萄 茎 尖培 养及 快 速 繁殖 技术研 究
顾 沛 雯 , 龚 玉 梅 关 晓 庆 , ( . 夏农 学院 农学 系,永宁 1宁 7 0 0 ;2 宁 夏 科 技 厅 5 15 . 7 00 ) 5 0 1
怀地黄的茎尖组织培养和快繁技术

深入研究不同品种、不同生长条件下怀地黄的 茎尖组织培养效果,以提高繁殖系数和植株质 量。
将组织培养技术与基因编辑技术相结合,定向改 良怀地黄品种的性状,提高其产量和品质。
THANKS
谢谢您的观看
怀地黄的茎尖组织培养和快 繁技术
汇报人: 2024-01-06
目录
• 引言 • 怀地黄的茎尖培养 • 怀地黄的快繁技术 • 怀地黄组织培养的优化 • 怀地黄组织培养的应用前景 • 结论
01
引言
怀地黄简介
怀地黄是一种具有药用价值的植物,主要分布在中国河南省的怀庆地区。其根茎 是重要的中药材,具有滋阴补肾、凉血补血等功效,被广泛应用于中医临床。
04
通过组织培养技术,可在短时间内获得大量遗传性状稳定的怀地黄植 株,为怀地黄的种质资源保护和生产应用提供组织培养过程中发生的基因表达和表 观遗传变化,阐明怀地黄快速繁殖的分子机制
。
扩大茎尖组织培养在怀地黄种质资源保存、新品种培 育以及生产实践等领域的应用范围,推动怀地黄产业
怀地黄在自然条件下生长周期较长,且易受环境因素影响,导致产量不稳定。为 了满足市场需求,通过组织培养和快繁技术来快速繁殖怀地黄成为了一个重要的 研究方向。
组织培养和快繁技术的概述
组织培养是一种通过无性繁殖方式,将植物的离体组织或细胞培养成完整植株的技 术。
快繁技术是指利用组织培养或其他生物技术手段,快速大量繁殖植物的育种方法。
选择合适的培养基,如MS、 1/2MS等,以支持怀地黄茎尖组
织的增殖。
激素配比
添加适量的细胞分裂素和生长素, 如6-BA和NAA,以促进细胞分裂 和生长。
培养条件
控制培养室的温度、光照和湿度, 如温度保持在25℃左右,光照时间 16小时/天,湿度70%左右。
高中生物第5章植物的组织培养技术第1节植物快速繁殖技术教案中图版

第一节植物快速繁殖技术一、植物组织培养简介1.理论基础:植物细胞的全能性。
(1)愈伤组织的特点:细胞是一种高度液泡化的薄壁细胞,呈无定形状态,排列疏松而无规则,具有很强的分生能力。
(2)脱分化:由高度分化的细胞重新恢复到未分化的状态。
(3)再分化:愈伤组织在适当的人工培养基上继续培养又可以重新分化成芽、根等器官,进而发育成一棵完整的植株。
3.培养基(1)成分:除含外植体所需的各种营养物质外,还需添加生长素和细胞分裂素两种植物激素。
(2)类型:据外植体在不同发育阶段的要求,需配制“脱分化培养基”、“生芽培养基”、“生根培养基”。
4.无菌条件:培养基的灭菌要彻底、外植体的消毒要充分、接种时的无菌操作要严格。
二、月季的快速繁殖程序1.配制培养基先将各种营养成分按比例配制成MS 培养基母液,再利用母液配制所需的三种培养基。
(1)脱分化培养基:母液中加入质量浓度为0.1 mg/L 的6-BA 和IAA 。
(2)生芽培养基:去掉脱分化培养基中的IAA 即可。
(3)生根培养基:无机盐浓度为MS 的12,另外添加质量浓度均为0.1 mg/L 的NAA 和IAA 。
2.外植体消毒清水洗净→体积分数为70%的酒精浸5 s→质量分数为2%的次氯酸钠溶液中浸泡6 min ~10 min→用无菌水清洗至少3次,漂净消毒液→用无菌滤纸吸干。
3.接种:将已消毒的月季嫩茎接种到脱分化培养基上,使嫩茎的形态学下端接触培养基。
4.培养:接种后的锥形瓶放在恒温培养箱中培养,将愈伤组织接种到生芽培养基上,每天用日光灯光照12 h ,培养10 d 左右长出小芽,小芽继续长成枝条。
待枝条长到3 cm左右时,将它切下后插在生根培养基上诱导生根。
5.驯化试管苗6.移栽预习完成后,请把你认为难以解决的问题记录在下面的表格中一、植物组织培养1.原理——细胞的全能性(1)原因:生物体的每个细胞都含有本物种生长、发育、遗传和变异的全部遗传信息。
(2)实现全能性的条件:离体状态和适宜的环境条件(如营养物质、激素、温度等)。
(第五章)第六章 植物离体茎尖培养与培育

第三节 茎尖培养脱毒
(二)茎尖培养脱毒方法的建立、发展和应用 最早,由Holmes(1948)通过茎尖扦插的方法,由 受侵染的大丽花中获得了无病毒植株。Morel和 Martin(1952)根据这一原理,建立了消除病毒 的茎尖培养方法。此后,茎尖培养方法得到迅速发 展,现已成为最有效的获得无毒植株的方法,已成 功用于多种栽培作物。利用茎尖培养不仅可以消除 病毒,还可以消除植物体中多种其它病原菌。目前 该技术已在农业生产上得到广泛的应用。据不完全 统计,用茎尖培养方法已成功对60多种植物的100 多种病毒进行“脱毒”。
第二节 防治病毒的方法
处理温度和时间因植物种类和器官生理条件等 不同而异。短则几十分钟,长则达数月。在热 处理初期,空气温度必须逐步升高,直至达到 所要求的温度为止。被处理的植株必须含有充 足的有机养分。同时,处理室内要维持合适的 相对湿度和光照。 考虑到连续长期在为病毒钝化所需要的高温中, 对寄主组织会带来危害,因此,也有采用高、 低温交替处理方法。
第三节 茎尖培养脱毒
在材料接种前可结合进行“温热处理”:
对母株,在35~38℃中热处理5~10周;
对马铃薯,将块茎在37~38℃中处理1个月。
第三节 茎尖培养脱毒
(五)脱病毒植株的检定
常用的检测方法有5种: 1、植株直观测定法: 2、指示植物测定法 3、电子显微镜观测法 4、血清学方法 5、分子生物学检测法
第三节 茎尖培养脱毒
3、接种。茎尖剥取完毕后,用锋利的解剖 刀,小心切取所需大小的生长锥,一般为 0.2~0.5mm,带有1~2个叶原基,并随 即接种于适宜的培养基上(参书P8-12,表 8-2)进行培养,每瓶接种1个茎尖。 4、培养。培养基成分及培养条件基本与离 体茎培养相似。但由于茎尖比较小,故培养 基中的无机盐浓度可以适当降低;但适当提 高K+的浓度有利于芽的分化。
马兰茎尖培养及快速繁殖的研究

年 1 7月 。 ~
1 2 3 不 同 浓 度 生 长 素 对 不 定 芽 生 根 的 影 响 ..
黑龙 江农 业 科 学 2 1 ( 1 : ~3 001)1
H in ig gil r i c e ga ruu lcne l jn A c t aS e s o
◆生物 技 术 ◆
马兰茎 尖 培 养 及 快 速 繁 殖 的研 究
牟 笛。 陈希 男 , 宝林 , 贾 徐 娜 。 长 阳 姜 ( 宁师 范大 学 生命科 学学 院, 宁 大连 1 6 2 ) 辽 辽 1 0 9
植株 的方法 得 到种 苗 , 使 本来 就 很 有 限 的野 生 这
1 2 2 不 同细胞 分 裂 素 对 萌发 生 长 芽 分化 的 影 ..
响 将 以上 培 养 的 萌 发 生 长 芽 切 成 长 1 0 c 左 . m 右 , 少 具 有 2个 生 长 点 的 茎 段 后 , 种 到 以 至 接
摘 要 : 马 兰 的 茎 尖 为试 验 材 料 , 以 进行 了茎 尖 的 萌发 与 分 化 、 管 苗 的 生根 、 栽 与 移 植 的快 繁技 术 研 究 。 结 试 移
果 表 明 : + B 0 2mg I +I . ・ +GA . ・ 生 长 点 萌 发 生 长 的 理 想培 养 基 ; + Ms A . ・ AA 0 5mg I 。0 5mg L 是 MS N . ・ +B . ・ 。 萌发 生 长 芽分 化 培 养 的 理 想 培 养 基 ;/ MS I A 0 6mg L 是 不 定 芽 AA 0 1mg I A 10mg I 是 1 2 + A . ・ -
腋 生 长 点 的 发 育 ) ~ 1 7 0 d后 , 地 上 茎 采 回 实 验 将
向日葵珍贵种质资源快速繁殖方法—茎尖培养技术

Ke y wo r d s S u n l f o w e  ̄ Wi l d s p e c i e s ;S h o o t — t i D t i s s u e ;Cu l t u r e i n v i t r o
向日葵是世界上最重要的油料作物之一 ,在世界各地 因基础 , 使得向 日葵生产一直面临着诸如菌核病 、 黄萎病 、 黑 斑病 、 褐斑病 、 拟 茎 点病 等 病 害 的 困扰 , 这 些病 害有 时 严
摘
要: 利 用改 良 MS 培 养基 , 对 向 日葵野 生种的 茎尖组 织进行 离体培养 , 快速获得无 菌母株 。将无菌母株的节 间组织和 茎 尖组 织切割后在 添加根 皮苷、 硝酸银和水解酪蛋 白的培养基上继代培养, 进 一步扩繁 出大量植株 。 在继代培养之前通过将 外植体 浸入 I B A溶液诱导生根 。采用 离体培养技 术 , 在较短 时间 内获得 了大量遗传稳定性 一致的个体 , 为进 一步科研 工作
Ab s t r a c t Ge r m— f r e e p l a n t s o f s u n f l o w e r w i l d s p e c i e s w e r e o b t a i n e d b y s h o o t — t i p t i s s u e c u l t u r e i n v i t r o wi t h mo d i f i e d MS
S U N Mi n e t a 1 . ( J i l i n P r o v i n c i a l I n s t i t u t e o f S u n f l o w e r , B a i c h e n g , J i l i n 1 3 7 0 0 0 )
高中生物 第五章 第一节 植物快速繁殖技术课后训练(含解析)中图版高中选修1生物试题

植物快速繁殖技术练习1将胡萝卜韧皮部细胞培养成幼苗时,下列条件不需要的是()。
A.具有完整细胞核的细胞B.一定的营养物质和植物激素C.离体状态D.导入指示基因2在离体的植物器官、组织或细胞脱分化形成愈伤组织的过程中,需要下列哪些条件?()①消毒灭菌②一定浓度的植物激素③适宜的温度④充足的光照⑤充足的养料A.①③④⑤ B.②③⑤C.①②③ D.①②③⑤3制备MS固体培养基操作过程中,有误的是()。
A.配制母液时,无机物中大量元素浓缩10倍,微量元素浓缩100倍B.激素类、维生素类以及用量较小的有机物一般可按1 mg·mL-1质量浓度单独配成母液C.制备1 L MS培养基时,先将母液加入800 mL蒸馏水中加热灭菌,再加琼脂凝固D.分装好的培养基连同其他器械一起进行高压蒸汽灭菌4下列植物细胞的全能性在提供了适宜条件的情况下,最易表达的是()。
A.枝条上的一个芽 B.柱头上的花粉C.胚珠中的珠被细胞 D.根尖分生区细胞5下列对植物组织培养过程中的脱分化,叙述正确的是()。
A.植物体的分生组织通过细胞分裂产生新细胞的过程B.体内分化的细胞在形态、结构和功能上发生改变的过程C.高度分化的植物器官、组织或细胞产生愈伤组织的过程D.愈伤组织分裂产生大量相同细胞的过程6下列关于接种时应注意的事项,全部正确的为()。
①接种室要消毒②无菌操作③接种时可以谈话④外植体如茎段、茎尖可随机放入培养基⑤接种时要防止交叉污染⑥接种完立刻盖好瓶口A.①②③④ B.①②③④⑤⑥C.③④⑤⑥ D.①②⑤⑥7(2011·某某高考)下列关于植物组织培养的表述,错误的是( )。
A .外植体可以来自于植物的任何细胞B .培养应在无菌条件下进行C .以花粉作为外植体可得到单倍体植株D .不同阶段的培养基中细胞分裂素和生长素的比例不同8下图是用胡萝卜根细胞进行组织培养的某些过程示意图。
请据图完成下列问题。
(1)把组织培养的过程按正确顺序排列。
第五章植物脱毒快繁技术

(2)培养条件
在茎尖培养中,光下培养的效果通常比暗培养效果 好,如马铃薯茎尖培养时,当茎已长到1cm高时,光 照强度便增加到4000lx。
(3)外植体的生理状态
茎尖最好要由活跃生长的芽上切取。 取芽的时间也很重要,一般选萌动期较好。否则 采用适当的处理,打破休眠才能进行。
(三)茎尖与热处理相结合方法
2、酶缺乏。茎尖中缺乏病毒合成所需的酶系, 存在高水平内源激素,可抑制病毒的增殖。
• 3、能量竞争。当植物细胞分裂DNA复制 时,病毒DNA随着复制。因此,植物细 胞分裂和病毒繁殖之间存在相互竞争。 在旺盛分裂的分生组织中,代谢活动很 高,正常核蛋白合成占优势,使病毒无 法进行复制。
• 4、抑制因子存在。在植物体内存在有一 种“病毒钝化系统”(抑制因子假说), 在分生组织中的活性最高,因而使分生 组织不受侵染。
愈伤组织的某些细胞不带病毒原因: 1、病毒的复制速度赶不上细胞的增殖速度; 2、有些细胞通过突变获得了抗病毒的抗性。 愈伤组织脱毒的缺陷是植株遗传性不稳定,可 能会产生变异植株。
2、茎尖微体嫁接
木本植物茎尖培养难以生根成植株,将实生苗砧 木在人工培养基上种植培育,再从成年无病树枝上切 取0.4-1mm茎尖,在砧木上进行试管微体嫁接,以获 得无病毒幼苗。
即:叶片包被严紧的芽,如菊花、兰花,只 须75%酒精中浸蘸一下,而叶片包被松散的芽, 如香石竹、马铃薯等,则要用0.1%次氯酸钠表 面消毒10min。
切取茎尖越小脱毒效果越好,但太小不易成 活,过大又不能保证完全除去病毒,所以茎尖 大小要合适。
离体茎尖大小对马铃薯脱毒效果的影响
茎尖长 叶原基数 小植株数 脱毒植株
• (一)离体繁殖的一般技术 1.外植体的选择 (1)根据培养目的选择
甘薯茎尖培养脱毒与快繁—甘薯脱毒苗快繁

一、防蚜塑料大棚快繁
1. 覆盖防虫网 大棚外覆上一层60目防虫网,四周压 严压实,不留缝隙,防止被风掀起,防止害虫进入 。
一、防蚜塑料大棚快繁
2. 将5~7片叶的脱毒试管苗打开瓶口,室温下加光照炼 苗5~7天。
一、防蚜塑料大棚快繁
3. 定植 清洗瓶苗:先用晾晒过的清水将瓶苗上的培养基洗掉, 粗洗一遍,再用清水洗涤一遍。
一、防蚜塑料大棚快繁
3. 定植 按5厘米Ⅹ5厘米株行距栽种在覆盖防虫网的塑料大棚内。
一、防蚜塑料大棚快繁4Fra bibliotek 管理要点定植后浇足水,加盖小拱棚,提高温度,以25℃为宜。 生长期间要注意小水勤浇,通风透气,保证温度既不能低 于16℃,也不能高于30℃。 待苗长至15~20厘米高时剪下蔓头断续栽种、快繁。
四、脱毒苗室内试管快繁操作步骤
6. 封口、标记 ,将培养瓶置于培养架上,在温度 20~25℃,光照强度2000~3000lx,光照时间12~14小 时/天的条件下培养。
种子生产与经营专业教学课件
《薯类种子种苗生产技术》
甘薯脱毒苗田间快繁
目录 CONTENTS
一 防蚜塑料大棚快繁 二 防蚜网棚快繁 三 防蚜冬暖大棚越冬快繁
二、防蚜网棚快繁
1. 炼苗。 2. 栽植:每667平方米栽植10000株。
二、防蚜网棚快繁
3. 管理要点:勤浇肥水,待苗长至15厘米左右时摘心,以 促进分枝。以后待分枝苗长至5片叶时继续剪苗栽种快繁, 或直接用于繁殖原原种。
三、防蚜冬暖大棚越冬快繁
1. 冬前将脱毒苗移栽到防虫冬暖大棚中,翌年春季采苗, 移到苗圃进行扩繁。 2. 此方法脱毒苗在外暴露时间过长,容易重新感染病毒, 一般较少采用。
超净工作台开机消毒
茎尖培养与微体快繁(总结)PPT课件

2021/5/5
2
(一)建立无菌材料
按照离体培养的基本操作方法,对外植体的 选择原则,严格挑选茎尖培养材料,从健康 植株上选取健壮的枝梢,除去叶片,用自来 水冲洗污物,再进行消毒处理。
常用消毒剂:消毒剂既要有良好的消毒效果, 又要易被无菌水冲洗掉或能够自行分解的物 质,而且不会损伤材料,影响生长。
热处理脱毒
为了克服茎尖培养脱毒法带来的弊 病,提高脱毒效率,热处理脱毒法与 茎尖培养脱毒法结合。
植物组织处于高于正常温度的环境 中,组织内部的病毒受热之后部分或 全部钝化,但寄主植物的组织很少或 不会受到伤害。
2021/5/5
17
愈伤组织热处理
植物组织处于高于正常温度的环境中,组织 内部的病毒受热以后部分或全部钝化,但寄 主植物的组织很少或不会受到伤害。但每种 植物都有其临界温度范围,超过这一临界范 围或在此范围内处理时间过长,都会导致寄 主植物组织受伤。为此可使用变温的处理方 法,高(40℃)和低温(16-20℃)交替处 理,既能保证植物材料不受伤害,又能除去 病毒。
2021/5/5
15
通常加入一些细胞分裂素和生长素并 调节两者的配比,是调节茎尖发育方向 的关键
采用细胞分裂素KT、6-BA或ZT与IBA、 NAA或2,4-D进行配比试验。茎尖在不 同的处理组合中的有不同发育趋势。据 此,可以确定调节茎尖发育方向及其增 殖的较佳生长调节剂组合。
2021/5/5
16
2021/5/5
3
消毒剂使用原则
防止伤害材料,经常采用少量 多次,或多种药剂交替使用。
2021/5/5
4
几种常用的灭菌方法:
茎尖、茎段及叶片等的消毒:流水冲 洗—去污粉洗涤—酒精消毒—无菌水冲 洗—升汞灭菌—无菌水冲洗
‘甜查理’草莓茎尖培养与快速繁殖研究

中 图分 类 号 :S 6 . 0 . 68436
S e Ti l r n p d Pr p g to f S r wb r y X we tc a l tm p Cu t e a d Ra i o a a in o ta e r S e h ri u e
CHA0 i u n ,LI Mi IQin ln Hu- a j U n ,J a —o g ,GAO ah n ” ,DONG n — u Xi— o g Qig h a
( . p rme to a t ce c n c n lg ,b Ce tro su lu e B in iest a De at n fPln in ea dTeh oo y . n e fTis eCu tr ; ei g Unv ri S i y o iu tr ,B i n 0 2 6 Chn ) fAg c lu e ej g 1 2 0 , ia i
The r s ls s we h tt e tme a o r a me t f r v rou t g s we e a olo e u t ho d t a he b s di r t e t n o a i s s a e r s f l ws: 1 Th a ge h ( ) elr rt e s e tps he hi e h u v v lr t ( Da k s r a me or 3 d c ul nh b t br t m i ,t gh rt e s r i a a e; 2) r ne s t e t ntf o d i i i own ng r t n n i ae a d i-
2018高中生物第五章植物的组织培养技术51植物快速繁殖技术(1)素材中图版1.
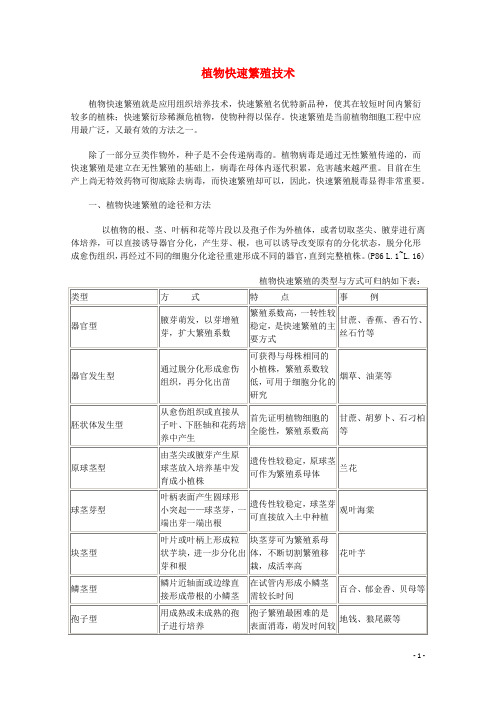
植物快速繁殖技术植物快速繁殖就是应用组织培养技术,快速繁殖名优特新品种,使其在较短时间内繁衍较多的植株;快速繁衍珍稀濒危植物,使物种得以保存。
快速繁殖是当前植物细胞工程中应用最广泛,又最有效的方法之一。
除了一部分豆类作物外,种子是不会传递病毒的。
植物病毒是通过无性繁殖传递的,而快速繁殖是建立在无性繁殖的基础上,病毒在母体内逐代积累,危害越来越严重。
目前在生产上尚无特效药物可彻底除去病毒,而快速繁殖却可以,因此,快速繁殖脱毒显得非常重要。
一、植物快速繁殖的途径和方法以植物的根、茎、叶柄和花等片段以及孢子作为外植体,或者切取茎尖、腋芽进行离体培养,可以直接诱导器官分化,产生芽、根,也可以诱导改变原有的分化状态,脱分化形成愈伤组织,再经过不同的细胞分化途径重建形成不同的器官,直到完整植株。
(P86 L.1~L.16)植物快速繁殖的类型与方式可归纳如下表:快速繁殖中茎尖培养脱毒无病毒苗的获得:(一)材料的培养和灭菌为了获得无菌的茎尖,应把供试植株种在无菌的盆土中,放在温室栽培。
浇水要浇在土中,不要浇在叶片上。
如材料取自田间,可切取插条,在实验室内进行溶液培养。
由这些插条的腋芽长成的枝条,其污染程度比直接从田间植株取来的枝条少得多。
自外,定期喷施内吸杀菌剂(如0.1%多菌灵和0.1%链霉素)也十分有效。
(二)茎类剥离取幼苗茎尖2~3cm小段,剥去可见的大叶,放在烧杯内用自来水冲洗1h左右,移入无菌室进行严格消毒。
先用95%酒精快速浸泡一下,再放入5%的漂白粉溶液内消毒7~10min (也可用市场上出售的次氯酸钠溶液稀释为5%),然后用无菌水冲洗3~4次,在双筒解剖镜下一手用细镊子将茎芽按住,另一手用解剖针仔细地将幼叶剥去,最后露出圆滑的生长点,用注的针头侧刃或自制的解剖针,仔细地切取带有1~2个叶原基的生长点,随即接种到试管培养基上进行培养。
这样外植体(生长锥带1~2个原叶基)的培养,严格来说,应称为分生组织培养。
橡皮树茎尖培养与快繁技术研1

橡皮树茎尖培养与快繁技术研究佟新萍,李娜(新疆石河子菜研究所,832000)摘要:以橡皮树茎尖为外植体,进行组织培养,结果表明,生长点可诱导形成愈伤组织及再生植物.经试验筛选出各培养阶段最适宜的培养基为:(1)愈伤组织诱导培养基:MS+6-BA5+NAA0.1;(2)分化培养基:MS+6BA2+NAA0.5;生根培养基:1/2MS+NAA1+0.5%活性炭。
关键词:橡皮树;组织培养;快速繁殖中图分类号:S687.03.8 文献标识码:B 文章编号:1001-0009(2003)02-0048-01橡皮树的繁殖一般采用扦插和分株方法,这些方法受良种基数的限制,繁殖速度较慢,而且容易积累病毒,影响生长,甚至造成退化。
对橡皮树组织培养技术的研究,以期通过试管繁殖途径达到复壮,快繁的目的。
1 材料和方法取橡皮树0.5cm-1.0cm长的茎尖作外植体,在无菌条件下,先用75%酒精浸泡数秒,然后置于0。
1%升汞溶液中处理8-10分钟,最后用消毒过的无菌水冲洗3-4次。
把经消毒灭菌后的外植体接种于MS培养基,添加不同浓度的6-BA,NAA,PH值为5。
8-6。
0,培养过程中温度保持25 ,光照8-10小时,光照强度1500-2000LX。
2 结果和分析2 1 无菌繁殖系的建立及植株再生外植体接到诱导愈伤组织培养基中,培养20天后,4周产生浅绿色愈伤组织,质地较松散,将此愈伤组织转入新鲜诱导愈伤组织培养基,继续培养,愈伤组织逐渐变绿,15天后,愈伤组织分化产生不定芽,此时,无菌繁殖系统建立。
随着芽不屡增大,将不定芽切开,转入继代分化培养基中培养,形成大量不定芽的芽块,20天左右,又长出许多丛生芽,诱导3-4倍。
此时,适量减少培养基中激素浓度进行培养,虽然不定芽分化的量相对较少,但分化的植株叶色深绿,基部长高增粗,叶片多,当功高约3-4厘米,具4-5片叶片时,从丛生芽块上单个切下转入生根培养基,15天左右长出根,开成完整植株,即植株再生。
华南适用草莓品种茎尖培养和快繁技术研究的开题报告

华南适用草莓品种茎尖培养和快繁技术研究的开题报告题目:华南适用草莓品种茎尖培养和快繁技术研究引言:草莓是一种重要的果蔬类作物,在我国南方地区具有广泛的种植和消费市场。
随着人们对生态环境和食品安全的高度关注,发展具有优良品质和产量的现代化草莓栽培技术已成为广大农民的追求。
在现代化草莓栽培中,茎尖培养和快速繁殖技术是实现现代化高效种植的关键技术之一。
本文旨在研究华南地区适用的草莓品种茎尖培养和快繁技术,为现代化草莓栽培提供科学的技术支撑。
研究内容:本研究选择华南地区适宜的草莓品种,通过茎尖培养和快速繁殖技术探索其良好的繁殖能力和适应性。
具体研究内容如下:1.选取适宜的草莓品种,比较茎尖培养和传统扦插繁殖的生长效果和经济效益;2.优化茎尖培养培养基的配方和培养条件,探索有效的生长调节措施;3.建立草莓快速繁殖(组培)体系,研究组培过程中的优化措施;4.对茎尖培养及组培的所得植株进行生长、花期和产量等方面的评估和比较;5.通过对比分析评估,确定华南地区适用的草莓茎尖培养和组培繁殖技术的最优方案。
研究意义:本研究对于华南地区的草莓种植业具有一定的意义和价值,主要表现在以下几个方面:1. 通过采用茎尖培养和快速繁殖技术,提高草莓种植效益,减少农业生产成本,为农民增加经济收益;2. 推广茎尖培养和快速繁殖技术,大力发展优质、高效、生态的草莓种植模式,逐步推进草莓种植产业的现代化和科学化;3. 研究适宜华南地区的草莓品种,并通过速繁技术快速繁殖,为华南地区的草莓种植业提供良种基础资源。
结论:本研究在华南地区草莓的茎尖培养和快速繁殖技术上进行了系统研究,筛选出了适合华南地区的草莓品种和适合栽培的技术路线,为华南地区草莓的种植业提供了科学的种植方案和延续良种资源,对于推进现代化、生态化、高效化草莓种植具有一定的借鉴意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章茎尖培养与快速繁殖
第一节茎尖培养脱毒技术
一、培育无病毒苗的意义
植物病毒病:由病毒和类病毒、支原体等引起,已发现此类病害700多种,无性繁殖植物严重;无特效药,培育无毒种苗是主要防治措施。
获得无病毒种苗的途径:
1)从现有种质中筛选无毒单株;
2)已感染植株脱毒。
二、植物脱毒的方法
1. 热处理:病原物与植物耐热性不同,将植物在较高温度下处理一段时间,病原物钝化、失活或不能繁殖,而植物所受影响较小、生长较快,使病毒减少甚至消灭。
方法:
1) 温汤浸渍:50℃温水中浸10分钟~数小时,简便易行,适用于休眠器官、接穗或种子。
2) 热空气处理:在温热治疗室/箱内,35~40℃,几十分钟~数月。
对茎尖效果较好,热处理后取较大茎尖培养,可提高成活率与脱毒率。
注意:易受伤,掌握温度与时间。
2. 茎尖培养脱毒
3. 其他途径脱毒
3.1 愈伤组织培养脱毒:花器官、珠心胚等愈伤中存在无病毒细胞群,从再生植株可得到无病毒苗。
3.2 茎尖微体嫁接脱毒:在无菌条件下,将切取的茎尖嫁接到培养的砧(zhen)木苗上。
3.3 抗病毒剂的应用:
抗病毒醚: 可抑制病毒复制和扩散,
嘌呤和嘧啶类似物;
抗菌素
三、茎尖培养脱毒技术
1、原理
病毒在植物体内分布不均匀,茎尖等生长点因为无维管束,病毒只能通过胞间连丝传递,赶不上细胞分裂和生长的速度,所以茎尖几乎不含病毒。
茎尖培养脱毒效果好,后代稳定,目前广泛应用。
2、脱毒技术
2.1 操作
取无菌顶稍1~2 cm→解剖镜(8—40倍)下→剥去幼叶→切取茎尖0.2~0.5 mm、带1~2个叶原基→接种。
注意:随切随接,防止变干;茎尖小较好,但太小不易成活,过大又不能保证完全脱毒。
草莓:茎尖0.2~0.3mm,脱毒率100%;1mm,脱毒率50%。
2.2 培养基
基本培养基: MS、White、B5等。
碳源: 蔗糖效果好,可用白砂糖
激素:2,4-D、IAA、NAA等,通常低浓度。
2.3 继代培养
初代培养长成的新梢→切成小段→增殖培养基→1个月左右→新梢又可扩繁→→建立和维持茎尖无性系。
继代培养常用MS培养基。
2.4 生根与移栽
常用生根方法:
用1/2、1/3、1/4MS或White培养基,附加NAA、IAA、IBA等,最好加活性炭(0.3%)。
或者:
将新梢基部浸入50~100mg/L的IBA中4-8h,然后转入无激素培养基中生根。
移栽:同前。
3、脱毒苗的鉴定
3.1 酶联免疫法(ELISA)
将抗原和抗体的免疫反应与酶的高效催化作用相结合,形成酶标记的免疫复合物;酶遇到底物后生色,用肉眼观察,或用比色法检测结果。
灵敏度高,广泛应用。
3.2 抗血清鉴定法
用已知抗血清鉴定未知病毒的种类。
3.3 指示植物法
指示植物:对某种或某几种病毒/类病毒具有敏感反应,并表现明显症状的寄主植物,又称鉴别寄主。
两类指示植物:
一是产生系统性症状,病毒可扩展到非接种部位,常无局部病斑;
二是只产生局部坏死、褪绿或环状斑。
方法:将脱毒苗汁液接种在指示植物上,根据病斑产生与否鉴别脱毒情况。
只能鉴定靠汁液传染的病毒,草本接种较易,木本较难,用嫁接传染法。
3.4 分子生物学检测
1)dsRNA分析
2)核酸分子杂交。
3)PCR技术。
3.5 电镜检查
4、脱毒苗的保存与利用
4.1 脱毒苗的保存
脱毒植株可能很快被重新感染,应隔离繁殖与保存。
原原种:经脱毒处理、检测无毒的植株;
原种:由原原种在隔离条件下繁殖的种苗;
由原种繁殖的脱毒苗供生产用。
隔离措施:建立隔离带、防虫网室,土壤消毒。
4.2 脱毒苗的利用
尽量用染毒轻的生产场地,一旦感染,应重新采用无病毒苗。
脱毒苗的繁育体系
流程工作区域
第一年脱毒试管苗无菌室
第二年原原种无菌室
第三年原种网室/温室
第四年良种隔离区
第五年商品种繁殖区
生产生产大田
5. 中国组培脱毒苗生产现状
已建立马铃薯(病毒病减产50%以上)、草莓、甘薯、苹果、葡萄、香蕉、菠萝、番木瓜、甘蔗等脱毒苗生产基地。
脱毒苗通常增产20~30%,草莓可达50%,且上等果比例高。
第二节茎段培养快速繁殖技术
一、离体快繁的应用
1、概念:将植物的器官和组织进行离体培养,使其快速成苗的技术,又叫微繁殖。
应用:
珍稀濒危植物
名优特新品种
脱毒苗
转基因试管苗的快繁。
林木、园艺、药用植物广泛应用,
重点在无性繁殖植物。
2、优缺点
优点:
1)繁殖系数高、速度快:扦插和嫁接每年几倍~几十倍;离体快繁几万~百万倍。
2)繁殖特殊材料:单倍体、三倍体,常规方法繁殖难。
3)可与脱毒技术相结合。
4)生长一致,商品性好,可常年进行。
缺点:
操作复杂,设备昂贵,成本较高。
二、离体快繁技术
1.无菌培养物的建立
常用带芽的茎段、茎尖或芽,某些植物用根、茎、叶或花器官等作外植体,接种培养,获得初代培养物。
2. 茎芽的增殖
以芽的增殖为主,可以不考虑根的生长。
依外植体不同,初代培养获得茎芽有4种途径:
1)顶芽/腋芽增殖:用茎尖或侧芽培养获得丛芽或芽苗,可加细胞分裂素促进之。
草莓、香石竹、唐菖蒲、非洲菊、月季、苹果、葡萄、猕猴桃等。
此途径较普遍。
2)不定芽增殖:在根、茎、叶、愈伤等非芽固定生长位置产生的芽都叫不定芽。
此途径较普遍。
由愈伤再生不定芽一般不可取(耗时、变异)。
3)体胚增殖:有200多种植物可产生体胚,前景好,但目前很多物种还不成熟,成苗率低。
4)原球茎增殖:兰科植物茎尖或侧芽培养形成球形块茎,一种特殊的繁殖体,本身可以增殖,转移到生根培养基上后长成小植株。
以兰花为例:
兰花离体快繁:
Morel提出了兰花离体无性繁殖方法。
兰茎尖→原球茎→芽→根(兰苗)
原球茎: 类似于种子萌发时由胚形成的结构;将原球茎分割成小块后可快速产生新的原球茎,并可成苗。
3. 壮苗、生根与移栽
组培苗/嫩枝1~2cm高时进行。
先壮苗后生根,即降低细胞分裂素浓度,增强光照等。
问题:不易生根(延长时间、继代);
生根:1/2或1/4 MS,减少或去掉细胞分裂素,加适量NAA或IBA(吲哚丁酸);减少蔗糖,增强光照。
移栽:同前。
4、存在问题
1)外植体褐变
原因:主要是外植体中的多酚氧化酶被激活,催化酚类生成醌类,醌经非酶促聚合,形成深色物质。
危害:毒害细胞,影响外植体生长与分化,甚至死亡。
影响因素:基因型、生理状态、外植体受伤程度、灭菌时间、培养基和培养条件。
减轻褐变的措施:
a. 外植体:选酚类含量低的基因型及幼龄材料剪取外植体→液体预培养3~7d →取出用漂白粉等还原剂浸泡→正式接种培养。
b. 培养基与培养条件:用低盐培养基,减少细胞分裂素,适当低温、弱光照,连续继代培养。
c. 用褐变抑制剂和吸附剂:培养基中加Vc、聚乙烯吡硌烷酮(PVP,酚类专一吸附剂)、活性炭、半胱氨酸、柠檬酸、谷胱甘肽[glu:tə'θaiəun]等抗氧化剂,或用SO2、亚硫酸盐、氯化钠等PPO (多酚氧化酶) 抑制剂。
几种试剂混用效果可能更好。
2)组培苗玻璃化
症状:茎叶半透明或透明、水渍状,叶皱缩卷曲,植株矮小、失绿、含水多、脆弱易碎。
原因:不清楚,基因型、培养基、细胞分裂素较高及弱光照、高温高湿、透气性差、继代次数过多等都有影响。
降低玻璃化的措施:
a. 增加琼脂或蔗糖,或加渗透剂,以提高培养基渗透压,使组培苗吸水困难;
b. 降低细胞分裂素用量,加适量IAA、GA3、ABA;
c. 减少NH4+、提高Ga2+含量;
d. 增加/进行自然光照(UV促进木质化和试管苗成熟);
e. 降低培养温度,或变温培养;
f. 用通气性好的封口材料。
3)生根难:
对策:
a. 降低培养基盐浓度;
b. 适当增加IAA等生长素用量,不用或少用细胞分裂素;
c. 减少糖供应、增加光照以增强植株的自养能力;
d. 较难生根的木本植物采取微体嫁接、化学刺激等方法处理。
