配位化学讲义第六章溶液中配合物的稳定性
(2)溶液中配合物的稳定性

3、作图外推法(β0=1)展开:移项整理:以对作图,则[L] 0时,应近似接近于一斜率为β2,截距为β1的直线。
若再展开一项:移项:整理:以对作图,[L] → 0时,应近似于斜率为β3,截距为β2的直线。
依次类推,即可得到各级βj。
二、利用Leden函数求稳定常数(要求测定[M]、[L])1、联立方程法:若测得多组([M], [L])值,列方程组用最小二乘法求βj。
2、外推法:以Y1对[L]作图,[L] →0时,应近似为一截距为β1的直线。
再令:以Y2对[L]作图,[L] →0时,外推得到截距为β2的直线。
依次类推:令,可按上述方法求出βj。
值得注意的是:j=n-1时,Y n-1 = βn-1 + βn[L]j=n 时,Y n = βn所以将Y n-1和Y n对[L]作图时,应得两条直线,并且后一直线与[L]轴平行,由此可求出配位数n。
第四节测定稳定常数的实验方法一、浓度稳定常数与条件稳定常数M + L = ML浓度稳定常数与T、P及I有关用高浓度的惰性盐维持离子强度恒定。
在这种条件下测得的浓度稳定常数称为条件稳定常数。
惰性盐的选择条件:1)其阳离子或阴离子不与配体或金属离子形成配合物。
常采用NaClO4。
2)对配合物的物理性质无干扰。
如用分光光度法测定平衡常数时,在所选波长不应有吸收。
3)在所用溶剂中应有足够的溶解度。
(以保持离子强度)4)不与配体或金属发生氧化还原反应。
如:NaClO4不能用于V3+体系,因V3+为强还原剂。
5)使用高浓度NaClO4时,应考虑其中杂质(Cl−、SO42−)的影响。
二、pH电位法适用范围:迄今应用最广的方法,适用于弱酸根离子或碱分子(Bronsted酸、碱理论)作为配体的体系。
1) 用pH电位法测定配体的加质子常数操作:用标准NaOH溶液滴定已知浓度的(salt + B + HCl)溶液, 记录pH值变化。
原理:L+H = HL β1H = K1HHL+H = H2L β2H = K1H K2HH2L+H = H3L β3H = K1H K2H K3H……… ………… ……….定义:酸生成函数总酸度:C H=T H-T OH+[OH]酸性条件下:C H = T H - T OH + 水电离产生的[H] = T H - T OH + 溶液中[OH]因此C H = T H - T OH + [OH]碱性条件下:C H = 水电离产生的[H] = 水电离产生的[OH] = 溶液中[OH] – (T OH - T H )因此C H = T H - T OH + [OH]由实验测得[H],算出即可求出多组(L)—[H]数据.进而可用前述求βj的方法求βj H(联立方程法、半整数法、外推法)2)测配合物稳定常数操作:用标准NaOH溶液滴定已知浓度的(salt + M + B + HCl)溶液, 记录pH值变化。
配位化学-中科院总结(4-6章)

(3) [Ni(en)3]2+ 和 [Fe(en)3]2+ 二者中心离子的d电子数不同,其CFSE不同。 [Ni(en)3]2+ : 3d8,电子排布为t2g6eg2,CFSE = -12Dq; [Fe(en)3]2+ : 3d6,电子排布为t2g6,CFSE = -24Dq。 所以, [Fe(en)3]2+ 更稳定。 (4) [Ni(H2O)6]2+ 和 [Ni(en)3]2+ en为螯合配体,其配合物具有螯合效应, 所以, [Ni(en)3]2+ 更稳定。
+ H2O
若为SN2机理: [Co(NH3)5 X]2+
v = k[Co(NH3)5X2+] + H2O 慢 [Co(NH3)5 X H2O]2+
[Co(NH3)5 X H2O]2+ 快 [Co(NH3)5 H2O]3+ + Xv = k[Co(NH3)5X][H2O]≈ k[Co(NH3)5X2+]
6.如何用晶体场理论判断配合物的活性和惰性。 比较活化配合物与反应物的CFSE确定。
7. [Co(NH3)5X]的水解反应机理和速率方程,如何验 证反应机理?
例如: [Co(NH3)5X]的酸式水解 若为SN1机理:[Co(NH3)5
[Co(NH3)5 ]2+ 慢 快
X]2+
[Co(NH3)5]3+ + X[Co(NH3)5H2O]3+
A5 A3 A2 A6 M B1 X4
A5
A5
-X
A2
A3
M B1 A6
4
+Y
A2
A3
M B1 A6
配位化合物之配合物在溶液稳定性介绍课件

演讲人
01.
02.
03.
04.
目录
配位化合物的基本概念
配合物的稳定性
配合物在溶液中的稳定性
配合物在溶液稳定性的实际应用
配位化合物的基本概念
配位化合物的定义
配位化合物是由中心离子(或原子)和配体分子(或离子)组成的化合物。
中心离子可以是金属离子,也可以是非金属离子。
04
配位化合物的性质
1
配位化合物是由中心离子和配体组成的化合物
2
中心离子可以是金属离子,也可以是非金属离子
3
配体可以是有机配体,也可以是无机配体
4
配位化合物的稳定性与配体的性质、中心离子的性质以及配位化合物的结构有关
配合物的稳定性
配合物的稳定性类型
热力学稳定性:指配合物在热力学上处于稳定状态,不易分解
生物修复:配合物可作为生物修复的催化剂,提高修复效率
谢谢
改变配位体的浓度:增加配位体的浓度,可以提高配合物的稳定性
改变溶剂的性质:选择合适的溶剂,如使用非质子溶剂或弱配位溶剂
改变配合物的结构:通过改变配合物的结构,如使用多核配合物或大环配合物,可以提高配合物的稳定性
配合物在溶液中的稳定性
配合物在溶液中的存在形式
离子形式:配合物以离子形式存在于溶液中,如[Cu(NH3)4]2+等。
生物成像:配合物作为造影剂,提高生物成像的清晰度和准确性
生物传感器:配合物作为生物传感器的识别元件,提高生物检测的灵敏度和特异性
基因治疗:配合物作为基因载体,提高基因治疗的有效性和安全性
01
03
02
04
配合物在材料科学领域的应用
研究生配位化学第6章

4.d1-9型金属离子
这一类是过渡金属离子,由于它们 电荷较高,半径较小,容易形成稳 定的配合物,研究最多的是第一过 渡系中的Mn2+(d5)、Fe2+(d6)、
Co2+(d7)、Ni2+(d8)和Cu2+(d9)等配离
子。
对几十种配体形成的配离子,其稳定性顺序都是:
如下表:
注意此顺序仅适用于高自旋配合物。 一般来说同一周期价数相同的过渡金 属的八面体配合物的热力学稳定性大 致有下列次序:
原因是:由于F-半径小,没有显著变 形性,所以在与Zn2+络合时,静电作 用是主要的,但在与Hg2+络合时,由 于Hg2+的变形性显著,体积小的F-离 子使Hg2+发生一定程度的变形,从而 使相互间的结合仍带有较大程度的共 价性,因而相应的配合物稍稳定些。
3.d10s2型金属离子 属于这一类金属离子的配离子中,事 实上只有T1(Ⅰ)、In(Ⅰ)、Ga(Ⅰ)、 Ge(Ⅱ)、Sn(Ⅱ)、Pb(Ⅱ)、As(Ⅲ)、 Sb(Ⅲ)、Bi(Ⅲ)等。这一类金属离子的 配离子中,只有TI(Ⅰ)、Sn(Ⅱ)、 Pb(Ⅱ)三种离子的配离子稳定常数的 数据较多,这些离子的配合物的稳定 性比电荷相同、半径相近的稀有气体 型离子的相应配合物高。
子原子配位,从HSAB原则来分析, 给电子原子O和N属硬碱配体易与硬酸 成键,而C、S和Se属软碱配体,易与 软酸成键,如SCN-能形成多种配合物, 遇硬酸Fe3+则以N为配位原子,应写为 [Fe(NSC)6]3-,若遇软酸Hg2+,则以S 为配位原子,所以应写为[Hg(SCN)4]2-。
(4)类聚现象:
软硬酸碱概念:
Pearson提出 “软硬酸碱 定则”。根据酸碱的电子理论,凡是给 出电子对者称之碱;凡是接受电子对者 谓之酸。因此配合物中金属离子是酸, 配体是碱。软、硬两词比较形象地形容 酸碱抓电子的松紧程度。而电子被抓的 松紧是酸碱接受或给予电子对难易的关 键。“硬”的概念是形容该原子或离子 对其价电子抓得很紧,而“软”的概念
化学配位化学与配合物的稳定性

化学配位化学与配合物的稳定性化学配位化学是研究金属离子和有机配体之间发生配位作用形成配合物的学科。
配位化学的一个重要方面是配合物的稳定性,即在一定条件下配合物形成的程度和配合物的稳定度。
本文将探讨配位化学与配合物稳定性的关系以及其在实际应用中的意义。
一、配位化学基础配位化学是指两种或两种以上的分子或离子通过配位键形成一个稳定的化合物的过程。
在配位化学中,金属离子称为中心离子,配体则是与中心离子通过均态或非均态(配位键)连接的分子或离子。
配位键通常由配体的孤对电子与中心离子的空位轨道形成。
二、配合物的稳定性配合物的稳定性可以通过判断配位键的强度来确定。
配位键强度与多种因素相关,包括金属离子的价态、配体的化学性质以及溶剂环境等。
以下是几个主要影响配合物稳定性的因素:1. 金属离子的价态:不同价态的金属离子对配位键的强度有不同的影响。
通常来说,高价态金属离子与配体形成的配合物更稳定。
2. 配体的化学性质:配体的化学性质也会影响配合物的稳定性。
一般而言,含有多个供体原子的配体对配位键的强度贡献更大,因此形成的配合物更稳定。
3. 配体的立体和电子效应:配体的立体和电子效应也会影响配合物的稳定性。
立体效应指的是配体的空间结构对配位键的影响,而电子效应则是指配体的电子供体性质对配位键的影响。
4. 溶剂效应:溶剂环境对配合物的稳定性也具有重要影响。
溶剂分子可以与金属离子或配体形成氢键或其他非共价键,从而影响配合物的稳定性。
三、配合物稳定性的应用意义配合物的稳定性对于理解和应用配位化学具有重要意义。
以下是几个典型的应用实例:1. 催化剂设计:稳定的配合物常用于催化剂的设计与制备。
配体的选择和调整可以使得配合物具有良好的催化活性和选择性。
2. 药物设计:配合物的稳定性与药物的活性和毒性密切相关。
通过对配合物的结构和稳定性的研究,可以为药物的设计和优化提供重要依据。
3. 金属离子输运:稳定的配合物可以用于金属离子的输运和储存。
配合物在溶液中的稳定性

配合物在溶液中的稳定性【摘要】配合物在溶液中的稳定性是指配离子或分子在溶液中解离为水合金属离子和配体,当达到平衡时其解离程度的大小。
稳定性是配合物在溶液中的一个重要性质,了解配合物对在溶液中的稳定性及其规律,必须从中心离子和配体的本性以及它们之间的相互作用入手。
本文主要讨论中心离子性质对配合物稳定性的影响【关键词】惰气性、d10型、d10s2型、d1-9型金属离子1、惰气性金属离子碱金属: Li+、Na+、K+、Rb+、Cs+碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+及:Al3+、Sc3+、Y3+、La3+(1)作用力:中心原子与配体间的作用主要是静电作用。
(2)影响稳定性的因素:中心离子的电荷和半径。
中心离子的电荷越大,半径越小形成配离子越稳定。
配合物的稳定性随z2/r增大而增大稳定性顺序为: Li>Na>K>Rb>Cs; Be>Mg>Ca>Sr>Ba2、d10型金属离子Cu(Ⅰ)、Ag(Ⅰ)、Au(Ⅰ) Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)Ga(Ⅲ)、In(Ⅲ)、Tl(Ⅲ) Ge(Ⅳ)、Sn(Ⅳ)、Pb(Ⅳ)(1)作用力:化学键在不同的程度上有明显的共价性。
(2)稳定性的规律:①这种金属离子的配合物一般比电荷相同、体积相近的惰气金属离子的配合物要稳定些。
②Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)这三种金属离子配合物的稳定性是Hg(Ⅱ)的最高。
③Zn(Ⅱ)和Cd(Ⅱ)的顺序不一致,在与有些配体配位时,Zn(Ⅱ)的配合物的稳定性大于Cd(Ⅱ)的配合物的稳定性,但与另一些配体配位时则出现相反的现象。
例如:Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)与卤素离子形成的配离子时,在Cl-、Br-、I-作配体时稳定性顺序都是Zn<Cd<Hg;在F-作为配体是,稳定性顺序却是Zn>Cd<Hg;原因:由于Cl-、Br-、I-有比较明显的变形性,配离子中共价结合的成分随着Zn、Cd、Hg的顺序而增加;因此半径越大越稳定。
配位化学讲义 第六章 溶液中配合物的稳定性
研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下:Mn2+<Fe2+< Co2+< Ni2+< Cu2+ >Zn2+CFSE(Dq) 0 -4 -8 -12 -6 0这称为Irving-Williams顺序,可用CFSE解释。
Ni2+<Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响1、碱性配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。
例:Cu2+的配合物:配体lgK H lgK1BrCH2CO2H 2.86 1.59ICH2CO2H 4.05 1.91phCH2CO2H 4.311.982、螯合效应1)螯合效应:螯合环的形成使配合物稳定性与组成和结构相似的非螯合配合物相比大大提高,称为螯合效应。
例:[Ni(NH3)6]2+lgβ6 = 8.61;心原子的关系1、软硬酸、碱概念(指Lewis酸碱)硬酸:其接受电子对的原子(离子)正电荷高,变形性低。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规那么在配合物稳定性中的应用1)硬酸倾向于与硬碱结合;2)软酸倾向于与软碱结合;配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:F>Cl>Br>I (1)O>>S>Se>Te (2)N>>P>As>Sb (3)而与软酸中心离子形成配合物的倾向的顺序为:F < Cl < Br < I (4)O << S ~ Se ~ Te(5)N << P > As > Sb (6)对(6)的解释:σ键增强N << P > As > Sb空d轨道:无3d 4d 5d反馈π键减弱π键作用大于σ键。
配位化学讲义 第六章 溶液中配合物的稳定性

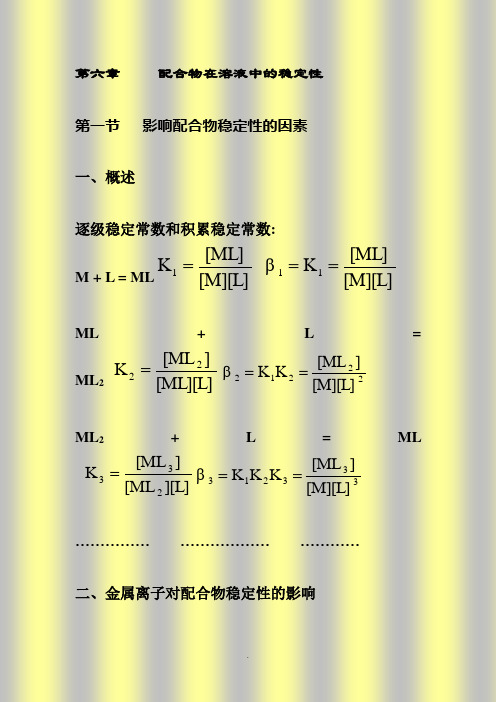
配位化学讲义第六章溶液中配合物的稳定性第六章 配合物在溶液中的稳定性第一节 影响配合物稳定性的因素一、概述逐级稳定常数和积累稳定常数: M+L=ML[M][L][ML]K 1=[M][L][ML]K β11==ML+L=ML 2[ML][L]][ML K 22=22212[M][L]][ML K K β==ML 2+L=ML][L][ML ][ML K 233=333213[M][L]][ML K K K β==…………… ……………… …………二、金属离子对配合物稳定性的影响1、具有惰性气体电子结构的金属离子碱金属:Li+、Na+、K+、Rb+、Cs+碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+及:Al3+、Sc3+、Y3+、La3+一般认为它们与配体间的作用主要是静电作用,金属离子z/r越大,配合物越稳定。
例:二苯甲酰甲烷[phC(O)CH2C(O)ph]配合物的lgK1值(30℃,75%二氧六环)M2+ lgK1Be2+13.62Mg2+8.54Ca2+7.17Sr2+ 6.40Ba2+ 6.102、Irving-Williams顺序研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下:Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+CFSE(Dq) 0 -4 -8 -12 -6 0这称为Irving-Williams顺序,可用CFSE解释。
Ni2+<Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响1、碱性配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。
例:Cu2+的配合物:配体lgK H lgK1BrCH2CO2H 2.861.59ICH2CO2H 4.051.91phCH2CO2H 4.311.982、螯合效应1)螯合效应:螯合环的形成使配合物稳定性与组成和结构相似的非螯合配合物相比大大提高,称为螯合效应。
第六章溶液中配合物地稳定性规律

第六章溶液中配合物的稳定性规律稳定性包括有两种:1 热稳定性2 溶液中的稳定性,即稳定常数的大小。
主要要讨论的内容有:1 中心离子的本性与配合物稳定性的关系2 配体性质与配合物稳定性的关系3 其它因素,如溶剂、离子强度等的影响讨论所涉及的稳定常数的类型有三种1 热力学稳定常数,即活度稳定常数2 浓度稳定常数,在固定的离子强度下测定得到的数据,3 混合稳定常数,其中有的组分(如H+)用活度,另外的组分用浓度在进行比较时,应当采用同一条件下测出的稳定常数。
第一节配位键的强弱与软硬酸碱原理1 软硬酸碱规则广义的酸碱定义:碱(如OH-)能给出电子对,而酸(H+)则能接受电子对。
据此定义,所有的金属离子都是广义酸,而所有的配体都是碱配合物的形成过程可看成是酸碱反应的过程:H++ OH- = H2OCu2++ 4NH3= Cu(NH3 )42+中心离子配体配合物广义酸广义碱酸碱化合物广义酸有软酸、硬酸、交界酸之分硬酸:若中心离子的正电荷高,体积小,极化性低的金属离子软酸:若中心离子的正电荷低,体积大,外层电易被激发。
交界酸:介于硬、软酸之间的称为交界酸广义碱:硬碱:若配体体积小,电负性高,极化性低,难氧化,难失去外层电子,称为软碱软碱:若配体体积大,极化性高,易氧化,即易失去外层电子的称为软碱。
交界碱:介于两者之间的称为交界碱。
配体中碱的分类:硬碱:O2-, H2O, OH-, F-, CH3COO-, PO3-4,SO42-, CO32-, ClO4-, NO3-, ROH, RO-, R2O, NH3软碱:S2-,R2S, RSH, RS-, I-, SCN-, S2O32-, R3P, R3As, (RO)3P, CN-, RNC, CO, C2H4, C6H6, H-, R-, 酸碱软硬的大小称为标度,现在有三种方法求得●1)由实验数据求得,●2)以酸碱的若干性质,如离子半径、电离势、电负性求得,●3)由酸碱一般性质求得其中第3)种最有意义,常称Ahland法,也称Ahland软硬标度。
配位化合物的稳定性PPT资料(正式版)

]
[A g + ] [N H 3]2
= 1 .7 ×1 0 7
= [ A g + ]
=
[A
g(
N
H
3)
+ 2
]
1 .7 ×1 0 7 [N H 3] 2
0 .0 2
1 .7 ×1 0 7 (0 .9 6 )2
= 1 .2 8 ×1 0 -9m o l.L -1
Ques+][Cl-]=1.
在1毫升-1AgNO3溶液中,加入1毫升-1NH3,
[Ag+][Cl-]=1.
第四节 配合平衡的移动
一、配合平衡与酸碱电离平衡
1、 酸效应
Cu2+ + 4NH3 + 4H+
[Cu(NH3)4]2+ 4NH4+
当溶液酸度增加时,配体L与H+结合生成相应的共轭酸而使
配合平衡向解离方向移动,导致配合物稳定性下降的现象,
称为配体的酸效应。
2、水解效应
F e 3 ++6 S C N - [ F e ( S C N ) 6 ] 3 -
NaCl也使其浓度达到-1,是否有AgCl沉淀生成?并
Fe + HO 3+ 一、配合平衡与酸碱电离平衡
一、配合平衡与酸碱电离平衡 计算[Ag(NH3)2]+ + e-
2
Fe(OH)2+ + H+
Fe(OH)2+ + H+
同样存在着一个平衡移动问题。
一、配合平衡与酸碱电离平衡
设平衡后 [Ag+]=-1
47×10-12,当该值溶小于液Ks的p(A酸gCl)度,所降以没低有氯时化银,沉淀金生成属。 离子发生水解而使配合平衡向
配合平衡和配位化合物的稳定性.pptx

=0.059lg0.01-0.059lg 0.025
K 稳
0.952
解得:Kθ稳=2.1×107
第7页/共12页
9.4 配位化合物的稳定性
9.4.1 软硬酸碱规则在配合物中的应 用
9.4.2 螯合效应
第8页/共12页
9.4.1 软硬酸碱规则在配合物中的应用
规则:硬亲硬,软亲软。硬酸容易和硬碱配体想成配合物,软 酸容易和软碱形成配合物。
解:由于NH3·H2O过量,计算时只考虑总配合平衡,即:
Ag+ + 2NH3
Ag(NH3)2+
x 1-2(0.1-x) 0.1-x
由于Kθ稳数值很大,平衡进行的很完全,因此0.1-x≈0.1,
1-2(0.1-x)≈0.8。
K 稳
[
Ag(NH
)
32
]
[Ag][NH3]2
0.1 x
x[12(0.1x)]2
x
0.1 0.82
1.1107
解得[Ag+]= x =1.4 ×10-8mol/L
第3页/共12页
9.3.2 配合平衡的移动
9.3.2.1 配合平衡与酸碱平衡 以Ag+ + 2NH3 → Ag(NH3)2+ 为例讨论:若 pH 值增大,一方面由 于 [OH-] 增大,使反应Ag+ + OH-→ AgOH进行,从而 [ Ag+ ] 减 小,导致(a) 左移;另一方面由于 [ OH-] 增大,反应NH3 + H2O→NH4+ + OH-逆向进行,从而 [NH3] 增大,使反应右移。
常见硬酸:H+, Li+, Na+, K+, Be2+, Mg2+, Ca2+, Sr2+, B3+Al3+, Fe3+, Cr3+, Ga3+, Ti4+, Si4+, Sn4+;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、Irving-Williams顺序
研究发现:第四周期过渡金属离子
与含O、N配位原子的配体的高自旋
八面体配合物,其稳定性顺序如下:
Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+
CFSE(Dq) 0 -4 -8 -12 -6 0
这称为Irving-Williams顺序,
可用CFSE解释。
Ni2+ < Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响
1、碱性
配位原子相同,结构类似的配体
与同种金属离子形成配合物时,配体
碱性越强,配合物越稳定。
例:Cu2+的配合物:
配体lgK H
lgK1
BrCH2CO2H 2.86 1.59
ICH2CO2H 4.05 1.91
phCH2CO2H 4.31
1.98
2、螯合效应
1)螯合效应:螯合环的形成使配合
物稳定性与组成和结构相似的非螯
合配合物相比大大提高,称为螯合效
应。
例:[Ni(NH3)6]2+ lgβ6= 8.61;
[Ni(en)3]2+lgβ3=
18.26
稳定常数增加近1010倍。
2)螯合环的大小
5员及6员饱和环稳定性较好,
且5员饱和环更为稳定。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性
小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规则在配合物稳定性中
的应用
1)硬酸倾向于与硬碱结合;2)软酸倾向于与软碱结合;
配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:
F>Cl>Br>I (1)
O>>S>Se>Te (2)
N>>P>As>Sb (3)
而与软酸中心离子形成配合物的倾向的顺序为:
F < Cl < Br < I (4)
O << S ~ Se ~ Te (5)
N << P > As > Sb (6)
对(6)的解释:
σ键
增强
N << P > As >
Sb
空d轨道:无 3d 4d 5d
反馈π键
减弱
π键作用大于σ键。
对于O << S ~ Se ~ Te (5),可作类
似解释。
3、软硬酸碱规则应用实例
Mg2+ + NH3·H2O Mg(OH)2↓
Ag+ + NH3·H2O [Ag(NH3)2]+
五、其他因素对配合物稳定性的影响
1、温度的影响
对于放热的配位反应,T上升,K 减小;
而对于吸热的配位反应,T上升,
K增大。
2、压力的影响
压力变化很大时,不可忽略。
如:Fe3+ + Cl- == [FeCl]2+
压力由0.1atm增至2000atm时,K减小约20倍。
*研究海洋中配合物的平衡时要考虑压力的影响。
3、溶剂的影响
1)当溶剂有配位能力时,有如下竞争反应:
ML + S == MS + L
S配位能力越强,ML稳定性越差。
如[CoCl4]2-在下列溶剂中的稳定性顺序:
CH2Cl2 > CH3NO2 > (CH3O)3P=O >
HC(O)N(CH3)2 > (CH3)2 SO
2)配体与溶剂的缔合作用
在质子溶剂(H2O、EtOH)中,有如下竞争反应
ML + S == M + L(S)
L与S通过氢键结合。
如:
C L — 配体总浓度,C M — 金属总浓度,
[L]为配体平衡浓度。
其物理意义:每个M 离子结合L 的平均数目。
C M = [M] + [ML] + [ML 2] + ……+ [MLn]
= [M] + β1[M][L] + β2[M][L]
2 + ……+ βn [M][L]n
∑=+=n 1j j
j }[L]β[M]{1
C L = [L] + [ML] + 2[ML 2] + ……+ n[ML n ]
数目
M(Hg)。
