有机化学下册--期末复习
有机化学2下学期期末复习要点

3、芳香族衍生物(酸、酯、酚)等的结构推测。
4
2014-6-12
1、重新复习要求完成的作业,并参考相关的答案,认真思考 和总结。 2、完成提供的复习资料,并归纳总结。
祝大家取得好的成绩!
5
2014-6-12
有机化学2 期末复习要点
一、回答问题
1、醛酮的亲核加成(HCN,NaHSO)反应活性顺序判断。 2、醛酮烯醇式含量高低的比较。 3、取代酚酸酸性强弱的比较。 4、取代酸酸性强以及酰卤、酸酐、酯和酰胺反应活性的比较。 5、芳香化合物亲电反应速率的比较。 6、杂环化合物发生一取代(亲电、亲核)反应的位置。 7、氨基酸的类型、性质及二肽、三肽结构的推断。 8、葡萄糖、果糖及其糖苷的结构式、构象式、变旋现象、鉴别 方法。
1
二、鉴别
1、醛、酮及羧酸的鉴别。
2、伯、仲、叔胺的鉴别。 3、单糖及其糖苷的鉴别。
2014-6-12
4、麦芽糖、蔗糖、淀粉及纤维素的鉴别。
5、-氨基的制备及-位的卤代。 2、烯胺反应及其应用。 3、伯胺及-氨基酸的合成法—Gabriel合成法。
4、胺的氧化及氧化叔胺的消去反应。
2
2014-6-12
5、芳香胺的重氮化反应及偶氮化合物的形成。 6、氨基的保护及二肽的合成。 7、乙酰乙酸乙酯、丙二酸二乙酯的反应。 8、Reformatsky反应—羟基酸酯的合成。 9、糖苷的生成及水解。
四、反应机理
1、羟醛缩合反应、克莱森酯缩合。 2、酸催化合成酯及酯的碱性水解机理。 3、酰胺的Hofmann降解机理。 4、伯胺的重氮化及重排反应机理。 5、复习上学期的亲电加成(C+离子)、自由基取代反应机理
3
2014-6-12
有机化学下复习

1 )C 2 H 5 O N a 2 )B rC H 2 C H 2 C H 2 B r
OO
C H 3 CC HCO C 2 H 5
H 2 C
C H 2 1 0 % N a O H H 3 + O △
C H 2
C O 2
O C C H 3
考点:乙酰乙酸乙酯在合成上的应用
关注
1)乙酰乙酸乙酯活泼亚甲基的反应 2)乙酰乙酸乙酯的酮式、酸式分解。
O
HO
C H 3-C -H + C H 2-C -H 稀 碱 C H 3-C H =C H -C H O
CH3 C H 3C O C H 3 + C H 3C O C H 3 B a(O H )2 C H 3-C -C H 2C O -C H 3
OH CH3 I2 C H 3-C =C H -C O C H 3
C H 3C H 2C H 2C H 2O HS O C l2
M g E t2OC H 3C H 2C H 2C H 2M gC l
C H 3C H 2C H 2C H 2O HH 2S O 4
H 2OK M nO 4 H H C H 3C H 2C O C H 3
OH
E t2O H 3O CH3CH2CH2CH2C CH2CH3
卢卡斯试剂,叔丁醇马上出现浑浊,异丙醇片刻出现浑浊, 正丁醇加热出现浑浊
考点:伯、仲、叔醇的鉴别。
2011春
华东理工大学-王朝霞课件
18
五、从指定的有机原料合成(无机试剂任选)
1、
O H
C H 3 C H 2 C H 2 C H 2 O H
C H 3 C H 2 C H 2 C H 2 CC H 2 C H 3 C H 3
11材料工程有机化学(徐寿昌-第二学期)期末复习

C2H5O + H CH3CHCOOC2H5 + C2H5OH
CHCOOC2H5 CH3
O
O
O CH3CH2 C
CH3CHCOC2H5 + CH3CH2COC2H5
CH3 O CH C OC2H5
OC2H5 O O C2H5O -
CH3CH2CCHCOC2H5 + CH3
COOCH2CH(CH3)2
七、合成题
O O 由 CH3CCH2COC2H5 合成 O CCH3
O O CH3CCH2COC2H5
1)C2H5ONa 2)BrCH2CH2CH2Br
O O CH3C CH C OC2H5 H2C CH2 CH2
10%NaOH H3+O △ -CO2
O CCH3
以三个碳及以下的有机物为原料,经丙二酸二乙酯合成:
OH O Leabharlann 3R3 OHR1 C R2
O O
R3 R3
+
R3 OH
无水 HCl
半缩醛(酮)
缩醛(酮)
(4) 与格式试剂的加成
•此反应是制备结构复杂的醇的重要方法.
(5) 与氨及其衍生物的加成
H H2N R H H OH H H NH2 H C N NH2 C N R
伯胺
H2N H C H O
西佛碱
O
H R R'
提示:羧基的
+
CO2
R R' R"
R"
β位有不饱和
基团时易发生 脱羧!!
b-羰基酸
g b
COOH R
H
R
有机化学二期末复习参考答案

有机化学二期末复习参考答案Unit A一、命名或写出结构注意立体结构1. 2-甲基-1,3-环己二酮2. 对甲氧基苯甲醛3. 丁二酸酐4. 间氯苯甲酸异丙酯5. 邻苯二甲酸二丁酯6. N-甲基丁二酰亚胺二、根据题意回答下列各题1、下列羧酸衍生物发生水解反应的活性由高到低的顺序是: B2、下列化合物中具有变旋现象的是 A3、比较下列化合物的酸性最强的是D ,最弱的是C4、比较下列化合物的碱性最强的是A ,最弱的是B5、下列二元羧酸受热后,易发生分子内脱水的是B ,易发生分子内脱羧的是A6、下列化合物与HCOOH进行酯化反应时,速率最快的是B7、下列羰基化合物与饱和NaHSO3反应活性由高到低的顺序是B:8、下列人名反应被称为C9、下列挥发油中属于单萜化合物的有:A, C10、下列化合物烯醇式含量的大小顺序是:B三、完成下列反应四、用简单化学方法鉴别下列各组化合物1.甲酸乙酸乙醇( - )( - )( + ): HCI( + ) : 褪色( — ) : 不褪色2.N-甲基苯胺4-甲基苯胺三乙胺( + )( + )(--)不反应沉淀不溶解沉淀溶解3. -丙氨酸-羟基丙酸丙烯酸αβ( + ) 显色(- )(- )不反应溴退色五、写出下列反应的历程1. CH 2=CHCOOH + H 18OCH 2CH 3H +CH 2=CHC-O 18CH 2CH 3O2.CH 3CH 2CH=O 稀 NaOHCH 3CH 2CH=CCH=OCH 33. OHCH 2NH 2HNO O六、合成1、从乙酰乙酸乙酯、甲苯及必要试剂合成CH 2CH 2CO CH 3或其它合理的路线2、从丙二酸二乙酯及必要试剂合成或其它合理的路线3、从环己酮出发合成O或其它合理的路线4.从苯和其他必要试剂出发合成镇痛药物布洛芬+-或其它合理的路线5. 由苯出发制备感冒药物对乙酰氨基苯酚OHNHCOCH 3或其它合理的路线七、推测结构1、BCN HN H 3C CH3A2、NH 2COOHNH 2OOCH CONH 2OH NO 2CH 3ABCD3、 A.H 3C C OCH 2CH2CH 32CH 3Unit B 参考答案一、命名或写出结构注意立体结构1. 丁-2-酮;2. -溴代丁酸;3. -丁内酯;4. 邻羟基苯甲酸;5. 邻苯二甲酸酐;6. N,N-二甲基苯甲酰胺;NHO7.8.H COOH NH 2CH 39.10. 三乙酸甘油酯二、 根据题意回答下列各题1、下列羧酸衍生物进行氨解反应的活性由高到低的顺序是: A2、下列糖的衍生物中有还原性的是: B3、比较下列化合物的酸性最强的是: C ,最弱的是 A4、比较下列化合物的碱性最强的是 B ,最弱的是 C5、下列化合物中可发生碘仿反应的有: B,C6、下列化合物与CH 3COOH 进行酯化反应时,速率最快的是: B7、下列羰基化合物与HCN 反应活性最高的是 A ,最低的是 D 8、下列人名反应被称为: D 9、下列化合物为油脂的是: B, D 10、下列化合物烯醇式含量的大小顺序是: B三、完成下列反应四、用简单化学方法鉴别或分离下列各组化合物1.丙醛丙酮环己醇(-)(-)(+)银镜反应Fehlin试剂(+)(-)2.OHNH2NaOH溶液乙醚乙醚层碱水层+乙醚乙醚液OH干燥NH2五、写出下列反应的历程1、2、PhCH3Ph3C CNH2OHNaNO2HClPhCH3Ph3C CN2ClOH- N2CH3C CO CH3PhPh 重排H3CPhHOOC C CH3PhPhI2OH-+ HCI3六、合成1、从乙酰乙酸乙酯、甲苯及必要试剂合成CH3COCH2CH2Ph或其它合理的路线2、从丙二酸二乙酯及必要试剂合成H3C CH COOHNH2C2H5ONaCH2(COOC2H5)2CH(COOC2H5)2CH3I CH(COOC2H5)2CH31) 5%NaOH2) 5% HClCH2COOH CH3Cl2CHCOOHCH3Cl NH3H3C CH COOHNH22、或其它合理的路线3、从环己酮出发合成OCH2PhCH3COOC2H5C2H5ONa H+CH3COCH COOC H5ONHO2解.NO NO X -CH 2Ph3+OCH 2Ph或其它合理的路线4、从苯、十二碳酸及其他必要试剂出发合成表面活性剂:十二烷基苯磺酸钠;1223AlCl 3COC 11H 23Zn(Hg)C 12H 2524C 12H 25HO 3SC 12H 25SO 3Na NaOH 解或其它合理的路线七、推测结构1、 COOCH(CH 3)2OHCOOHOHAB2、C . H 3C C OCH 2CH33Unit C 参考答案一. 命名或写出结构注意立体结构1. 2-甲基-1,3-环己二酮;2. 3-溴丁酸;3. -丁内酯;4. 2-羟基苯甲酸;5. 邻苯二甲酸酐;6. N,N-二甲基苯甲酰胺; 10. 三乙酸甘油酯;Unit D 参考答案一、命名或写出结构注意立体结构1. 2,4-二甲基环己酮;2. 对甲氧基苯磺酸;3. 丁二酸二甲酯;4. 3-氯苯甲酸;5. 2-甲基乙酰乙酸甲酯;6. 2-甲基苯肼;7. H 2NC HCH 3COOH; 8.3二、回答问题或选择填空1、 下列物质中,碱性最强的是 A ;2、下列物质中, D的亲核性最强;3、下列物质与NaI进行SN1反应的速率是:C 最快, D最慢;4、下列物质与AgNO3-醇溶液反应:A最快, C最慢;5、下列物质进行硝化反应,速率最快的是C ;6、7、下列物质的 HNMR谱中,CH3-上的H的δ值最大的是C ;8、下列物质,处在等电点时,其PH值B最大, C 最小;9、属于二环单萜类天然产物;三、把下列的反应的活性中间体填入方括号内四、完成下列反应五、推导反应历程六、推测结构:1.赖-丙-半胱2.七、合成每题4分,共16分Unit E 参考答案一、命名与结构1. 3-羟基环庚酮2. 邻苯二甲酸二丁酯5. -呋喃甲醛糠醛;6. 8-羟基喹啉二、选择题1.B; D.2. C; B.3. B; C.4. C; B.5. A; C.三、鉴定化合物四.完成反应五、解释下面反应历程:六、推求结构1.OO OOHHOHO HOH 2C OHHO HOCH 22.ABCDEFH 2C CCH 3CH 3H 2C CH CH 3CH 3OH COOH CH H 3CH 3CCOONa CH H 3CH 3CCONH 2CH H 3CH 3CCOO -+NH 4CH H 3CH 3C七、合成4.OO C O CH 3CH 3-H OC H 3CH 3C C OCH 3H C2CH 2(COOEt)21, NaOEtA 1. ACOOEt CH 3COOEtOCOOEt OO 1. NaOH + H2O2. H 3O +Unit F 参考答案一、根据题意回答下列各题1、写出α-D-甲基吡喃葡萄糖苷的构象式2、用箭头标出下列化合物在一硝化时的位置3、比较下列化合物的酸性最强的是 A ,最弱的是 B4、比较下列化合物中碱性最强的是 D ,最弱的是 B5、下列二元羧酸受热后,脱水又脱羧的是 C ,只脱羧的是 B6、苯丙氨酸在pH=10等电点pI=时的离子形式是 C7、某四肽经水解得三个二肽,分别是赖-丝,亮-甘和丝-亮,此四肽结构 AA. 赖-丝-亮-甘 B .赖-亮-丝-甘 C. 亮-丝-甘-赖 8、下列人名反应属于 D9、下列化合物中,属于双环单萜的是C10、下列化合物烯醇式含量的大小是D二、完成下列反应三、用化学方法鉴别下列各组化合物四、写出下列反应的历程五、合成1. 从乙酰乙酸乙酯及必要试剂合成2 从环己酮出发合成3 从甲苯出发合成4.从丙酮和丙二酸二乙酯出发合成六、推测结构1、NCH3CH3A. B. C.NCH3CH3H3CCH32、3、Unit G参考答案一、根据题意回答下列各题1、2、下列化合物中具有变旋现象的是A3、比较下列化合物的酸性最强的是D ,最弱的是C4、比较下列化合物的碱性最强的是B ,最弱的是 D5、下列二元羧酸受热后,脱水又脱羧的是 C ,易脱羧的是 B6、下列化合物与CH3COOH进行酯化反应时,速率最快的是 A7、某三肽经部分水解可得两种二肽:甘-亮,天冬-甘,此三肽是 B8、下列人名反应是 A9、下列化合物中B是倍半萜, C属生物碱10、下列化合物烯醇式含量的大小是DA. I II IIIB. III II IC. III I IID. I III II二、完成下列反应三、用化学方法鉴别下列各组化合物1.2.四、写出下列反应的历程五、合成1从乙酰乙酸乙酯及必要试剂合成2从丙二酸二乙酯及必要试剂合成3. 从环己酮出发合成解.4. 从甲苯出发合成5.从苯甲醛、丙酮和丙二酸二乙酯出发合成解六、推测结构1、2、3、Unit H 参考答案一、根据题意回答1、2、比较下列化合物的酸性最强的是 A ,最弱的是D3、比较下列化合物的碱性最强的是 B ,最弱的是 D4、比较下列化合物中水解速率最快的是C ,最慢的是A ;5、苯丙氨酸在pH=10等电点pI=时的离子形式是 C6、某三肽经水解得两个二肽,分别是甘-亮,丙-甘,此三肽结构C7、用箭头标出下列化合物在一硝化时的位置8、下列人名反应属于 C9、下列化合物中具有变旋现象的是A10、下列化合物中,既溶于酸又溶于碱的是B和D二、完成下列反应三、用化学方法鉴定下列各组化合物1 .2 .3 .四、推导结构1.2、3、五、由指定原料及必要试剂合成1.以甲苯为原料合成2.从乙酰乙酸乙酯及必要试剂合成3.从乙苯及丙二酸二乙酯出发合成4.从丙酮和丙二酸二乙酯出发合成Unit I 参考答案一.按题意回答1.下列化合物中碱性最强的是 B2.B AC D 3.下列化合物中能与Tollen’s试剂反应产生银镜的是 C4.写出α-D-吡喃葡萄糖的构象式:5.写出丙氨酸在等电点pI ,pH 2,pH 10时的离子形式:6.指出下列化合物在一元溴代时的位置:7.油脂在碱性条件下的水解反应俗称皂化反应;8.已知棉子油A和桐油B的碘值分别为103~115,160~180,指出这两种油哪个的不饱和度大B ;9.在有机合成中羰基需保护时,常用的试剂是 C10.某三肽经水解得两个二肽,分别是甘-丙,亮-甘,此三肽结构为:亮-甘-丙11.比较下列化合物中碱性最强的是D ,最弱的是 B二、用化学方法鉴别下列各组化合物三. 完成反应四.写出下列反应历程五.推测结构1.一个具有还原性的二糖,可被麦芽糖酶水解,得2 mol的D-葡萄糖,此二糖经甲基化再水解得到2,3,4,6-四-O-甲基-D-吡喃葡萄糖和2,3,6-三-O-甲基-D-吡喃葡萄糖,试写出此二糖的结构;2.某五肽化合物,已知氮端为亮氨酸,碳端为丝氨酸,经水解得丙氨酸和两个二肽碎片,分别为:亮-甘和苯丙-丝,请排出此五肽的结构;亮-甘-丙-苯丙-丝六.合成1.从甲苯和丙二酸二乙酯及必要试剂合成2.从乙炔及必要试剂合成3.从苯甲醛、丙酮和乙酰乙酸乙酯出发合成4.从环戊酮及必要试剂合成Unit J 参考答案一、按题意回答下列问题1.下列化合物中 B是倍半萜, C属生物碱;2.比较下列化合物碱性的强弱 D > A > C > B3.进行水解的难易程度 B > D > A > C4.下列化合物与CH3COOH进行酯化反应时,速率最快的是 A5.比较下列物质的酸性次序A > B > C6.用箭头标明下列化合物进行硝化时的位置4分7.确定下列物质有芳性的化合物为 A 和 C8.分别写出丙氨酸在下列pH值水溶应中存在的状态4分pH=2 pH=pI pH=129.某三肽经部分水解可得两种二肽:甘-亮,天冬-甘,此三肽是B10. 比较化合物的酸性次序D > B > C > A >11. 下列化合物中烯醇式含量最高的是B .二、写出区分下列各组化合物的试剂及现象样品试剂现象——————1.果糖、葡萄糖三、完成下列反应四、推求结构1、BOC CH2CH2COOH CH2COOHCH2COOH A. CH3五、实现下列转变2.从环己酮出发合成3.从CH3COCH2OC2H5出发制六、试写出下列反应的历程。
大学有机化学期末复习总结

有机化学期末复习总结一、有机化合物的命名命名是学习有机化学的“语言”,因此,要求学习者必须掌握.有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式.1、俗名及缩写:要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、甘油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酐、甘氨酸、丙氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等.还应熟悉一些常见的缩写及商品名称所代表的化合物,如:RNA、DNA、阿司匹林、福尔马林、尼古丁等.2、习惯命名法:要求掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等.3、系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则.其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视.要牢记命名中所遵循的“次序规则”.4、次序规则:次序规则是各种取代基按照优先顺序排列的规则1原子:原子序数大的排在前面,同位素质量数大的优先.几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H2饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推.常见的烃基优先次序为:CH33C->CH32CH->CH3CH2->C H3-3不饱和基团:可看作是与两个或三个相同的原子相连.不饱和烃基的优先次序为: -C≡CH>-CH=CH2>CH32CH-次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出.按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基 >丁基>丙基>乙基>甲基.(1)、几何异构体的命名:烯烃几何异构体的命名包括顺、反和Z、E两种方法.简单的化合物可以用顺反表示,也可以用Z、E表示.用顺反表示时,相同的原子或基团在双键碳原子同侧的为顺式,反之为反式.如果双键碳原子上所连四个基团都不相同时,不能用顺反表示,只能用Z、E表示.按照“次序规则”比较两对基团的优先顺序,较优基团在双键碳原子同侧的为Z型,反之为E型.必须注意,顺、反和Z、E是两种不同的表示方法,不存在必然的内在联系.有的化合物可以用顺反表示,也可以用Z、E表示,顺式的不一定是Z型,反式的不一定是E型.例如:CH3-CH2BrC=C 反式,Z型H CH2-CH3CH3-CH2CH3C=C 反式,E型H CH2-CH3脂环化合物也存在顺反异构体,两个取代基在环平面的同侧为顺式,反之为反式.双官能团化合物的命名:双官能团和多官能团化合物的命名关键是确定母体.常见的有以下几种情况:①当卤素和硝基与其它官能团并存时,把卤素和硝基作为取代基,其它官能团为母体.②当双键与羟基、羰基、羧基并存时,不以烯烃为母体,而是以醇、醛、酮、羧酸为母体.③当羟基与羰基并存时,以醛、酮为母体.④当羰基与羧基并存时,以羧酸为母体.⑤当双键与三键并存时,应选择既含有双键又含有三键的最长碳链为主链,编号时给双键或三键以尽可能低的数字,如果双键与三键的位次数相同,则应给双键以最低编号.官能团的优先顺序:-COOH羧基>-SO3H磺酸基 > -COOR酯基>-COX卤基甲酰基 > -CONH2氨基甲酰基 > -CN 氰基> -CHO醛基> -CO- 羰基> -OH醇羟基> -OH 酚羟基 >-SH 巯基> -NH2氨基 > -O- 醚基> 双键 > 叁键4、杂环化合物的命名由于大部分杂环母核是由外文名称音译而来,所以,一般采用音译法.要注意取代基的编号.二、有机化合物的基本反应1、加成反应:根据反应历程不同分为亲电加成、亲核加成和游离基加成.(1)、亲电加成:由亲电试剂的进攻而进行的加成反应.要求掌握不对称烯烃进行亲电加成反应时所遵循的马氏规则,即试剂中带正电核的部分加到含氢较多的双键碳原子上,而负性部分加到含氢较少的双键碳原子上.烯烃加卤素、卤化氢、硫酸、次卤酸、水,炔烃加卤素、卤化氢、水以及共轭双烯的1,2和1,4加成都是亲电加成反应.烯烃进行亲电加成反应时,双键上电子云密度越大,反应越容易进行.2、亲核加成:由亲核试剂进攻而进行的加成反应.要掌握亲核试剂的概念、亲核加成反应的历程简单加成及加成─消除、不同结构的羰基化合物进行亲核加成反应的活性顺序及影响反应活性的因素.羰基化合物与氰氢酸、亚硫酸氢钠、醇、格氏试剂、氨及氨衍生物的加成都是亲核加成反应. 羰基化合物进行亲核加成反应的活性顺序为:HCHO>CH3CHO>RCHO>C6H5CHO>CH3COCH3>RCOCH3>C6H5COCH3>C6H5COC6H53、自由基加成:由自由基引发而进行的加成反应.烯烃在过氧化物存在下与溴化氢进行的加成是自由基加成.不对称烯烃与溴化氢进行自由基加成时得到反马氏规则的产物,即氢加到含氢较少的双键碳原子上.加成反应除上述三种类型之外,还有不饱和烃的催化氢化,共轭二烯的双烯合成等.2、消除反应从一个化合物分子中脱去较小分子如H2O、HX、NH3而形成双键或三键的反应叫消除反应.卤代烃脱卤化氢和醇脱水是重要的消除反应.1、卤代烃脱卤化氢:卤代烃的消除反应是在强碱性条件下进行.不同结构的卤代烃进行消除反应的活性顺序为:三级>二级>一级.要掌握卤代烃进行消除反应时所遵循的查依采夫规则,当卤代烃中不只含有一个β碳时,消除时脱去含氢少的β碳上的氢原子,或者说总是生成双键碳上连有烃基较多的烯烃,亦即仲卤代烷和伯卤代烷发生消去反应时, 主要生成双键上连接烃基最多的烯烃.要注意,卤代烃的消除和水解是竞争反应.2、醇的消除:醇的消除反应在强酸性条件下进行,消除方向也遵循查依采夫规则.要掌握不同结构的醇进行消除反应的活性顺序:叔醇>仲醇>伯醇.3、取代反应根据反应历程的不同可分为亲电取代、亲核取代、游离基取代.⑴、亲电取代:由于亲电试剂的进攻而引发的取代反应称亲电取代反应.苯环上的卤化、硝化、磺化、付氏烷基化和酰基化以及重氮盐的偶合反应等,都是亲电取代反应,萘环和芳香杂环上也能发生亲电取代反应.要注意苯环上有致钝基团时不能进行付氏反应,苯环上进行烷基化时会发生异构化现象.掌握萘环上进行亲电取代反应的规律,第一个取代基主要进入α位,第二个取代基是进入同环还是异环由原取代基的定位效应决定.掌握五员、六员芳香杂环化合物的亲电取代反应以及它们与苯环比较进行亲电取代反应活性的差异,呋喃、噻吩、吡咯进行亲电取代反应的活性比苯大,而吡啶比苯小.⑵、亲核取代由亲核试剂的进攻而引起的取代反应称亲核取代反应.卤代烃的水解、醇解、氰解、氨解,醇与氢卤酸的反应,醚键的断裂,羧酸衍生物的水解、醇解、氨解等都是亲核取代反应.卤代烃的亲核取代反应可按两种历程进行,单分子历程SN 1和双分子历程SN2,伯卤代烃易按SN2历程反应,叔卤代烃一般按SN1历程反应,仲卤代烃则两者兼而有之.要在理解反应历程的基础上掌握不同卤代烃进行亲核取代反应的活性,SN1反应支链越多活性越强,反应速率越快,SN2反应支链越多,反应活性越弱,反应速率越慢.如:下列化合物按SN1历程反应的活性由大到小排序为:CH33CI > CH33CBr > CH32CHBr. 要注意,在碱性条件下卤代烃的取代和消除是互相竞争的反应,叔卤代烃容易发生消除,伯卤代烃易发生取代,强极性溶剂如水有利于取代,而弱极性溶剂如醇和强碱如醇钠有利于消除,高温有利于消除.⑶、自由基取代:由自由基的引发而进行的取代称自由基取代.烷烃的卤代,烯烃和烷基苯的α卤代是自由基取代反应.反应条件是高温、光照或过氧化物存在.自由基的稳定性和中心碳原子上所连的烷基数目有关,烷基越多,稳定性越大.自由基的稳定次序为:三级>二级>一级>·CH34、氧化还原反应包括氧化反应和还原反应两种类型.⑴、氧化反应烯、炔、芳烃侧链以及醇、酚、醛、酮等都易发生氧化反应要掌握几种常用的氧化剂,如高锰酸钾、重铬酸钾的硫酸溶液、氧气空气、臭氧以及托伦试剂、斐林试剂、次卤酸钠等.掌握氧化反应在实际中的应用,如臭氧氧化可用来推测烯烃的结构,托伦试剂和斐林试剂的氧化可用来鉴别醛和酮等.⑵、还原反应 不饱和烃的催化氢化、醛、酮、羧酸及酯还原为醇,硝基苯还原为苯胺等都是还原反应.要掌握几种常用的还原剂,如H 2/Ni 、 Na+C 2H 5OH 、Fe+HCl 、NaBH 4、、 、LiAlH 4、异丙醇/异丙醇铝等,注意后面三种是提供负氢离子的还原剂,只对羰基选择加氢,与双键、三键不发生作用.还要掌握羰基还原为亚甲基的两种方法,注意,进行克莱门森还原时反应物分子中不能存在对酸敏感的基团,如醇羟基、双键等,用伍尔夫─吉日聂尔还原及黄鸣龙改进法时,反应物分子中不能带有对碱敏感的基团,如卤素等.5、缩合反应 主要包括羟醛缩合和酯缩合.1羟醛缩合 含有α氢的醛在稀碱条件下生成β—羟基醛,此化合物不稳定受热容易脱水,生成α、β不饱和醛.因此,此反应常用来增长碳链制备α、β不饱和醛.要求掌握羟醛缩合的反应条件.2克莱森酯缩合 含有α氢的酯在强碱条件下发生克莱森酯缩合,两分子酯之间脱去一分子醇生成β酮酸酯.要掌握反应条件及在实际中的应用,有机合成中广泛应用的乙酰乙酸乙酯就是通过此反应制备的.除了上述五种类型的反应之外,还要求掌握重氮化反应、芳香重氮盐的取代反应、脱羧反应等,注意反应条件、产物及其在实际中的应用.三、有机化合物的转化及合成方法要求掌握有机化合物各类官能团之间的转化关系、增长和缩短碳的方法,在此基础上设计简单有机化合物的合成路线.熟练掌握苯进行付氏烷基化、酰基化、炔化物的烃化、羟醛缩合、格氏试剂法等都可以增长碳链;炔化物的烃化、格氏试剂法及芳香重氮盐等在有机合成中应用非常广泛.1、炔化物的烃化具有炔氢的炔烃与氨基钠作用得炔钠,炔钠与伯卤代烃反应得到烷基取代得炔烃.此反应可增长碳链,制备高级炔烃.2、格氏试剂法格氏试剂在有机合成中应用极为广泛,它与环氧乙烷、醛、酮、酯反应可用来制备不同结构的醇等.这些反应既可增长碳链,又可形成所需的官能团.3、重氮盐取代法芳香重氮盐的重氮基可被氢原子、卤素、羟基、氰基取代,由于苯环上原有取代基定位效应的影响而使某些基团不能直接引入苯环时,可采用重氮盐取代的方法.要注意被不同基团取代时的反应条件.四、有机化学的知识点1、两类定位基:邻对位定位基:使新进入的取代基主要进入它的邻位和对位邻位和对位异构体之和大于60%;同时一般使苯环活化卤素等例外.例如—O-,—NCH32,—NH2,—OH,OCH3,—NHCOCH3,—OCOCH3,—R,—XCl,Br ,I,—C6H5等.间位定位基:使新进入的取代基主要进入它的间位间位异构体大于40%;同时使苯环钝化.例如—NCH33,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CO NH2,—NH3等.2、两类电子基:吸电子基:使电子云密度减小的基团,如-COOH,-COOR,-NO2,-X,-HSO3,-CHO,-CO-R等.供电子基:使电子云密度增大的基团,如-R,-OH,-OR,-NH2,-NHCOR等.3、相同C原子有机物的熔沸点:支链越多沸点越低,对称性越高,熔点越高,如下列化合物沸点由低到高排列为:正戊烷 < 3,3-二甲基戊烷 < 2-甲基己烷 <正庚烷 < 2-甲基庚烷.五、有机化合物的鉴别烯烃、二烯、炔烃及三、四元的脂环烃:溴的四氯化碳溶液,溴腿色含有炔氢的炔烃:硝酸银或氯化亚铜的氨溶液,生成炔化银白色沉淀或炔化亚铜红色沉淀.卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀.醇:与金属钠反应放出氢气鉴别6个碳原子以下的醇;用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化.酚或烯醇类化合物:用三氯化铁溶液产生颜色.苯酚与溴水生成三溴苯酚白色沉淀.羰基化合物:2,4-二硝基苯肼,产生黄色或橙红色沉淀;区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;鉴别甲基酮和具—CH—结构的醇用碘的氢氧化钠溶液,有CH3OH生成黄色的碘仿沉淀.甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能.胺:区别伯、仲、叔胺有两仲方法1.用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应.2.用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应.芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体.糖:葡萄糖与果糖:用溴水,葡萄糖能使溴水腿色,而果糖不能.麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能.。
有机化学II 期末复习课

2009.6.19
1
醇类化合物的鉴别
Lucas(卢卡斯)试剂——浓HCl + 无水ZnCl2 用于鉴别C6以下的一元伯、仲、叔醇。
Cபைடு நூலகம்3 CH3 C OH + HCl
CH3
Zn C l2 室温
CH3 CH3 C Cl
CH3
(立即浑浊)
CH3CHCH2CH3 OH
+ HCl
Zn C l2
CH3CHCH2COOH Cl
CH2CH2CH2COOH Cl
pKa 4.84 2.84
4.06
4.52
CH3 O2N
COOH
pKa 4.20
COOH
4.38
COOH
3.42
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH
pKa
0.64
1.26
2.86
17
应用:用于分离、鉴别。
苯甲酸 对甲苯酚
R NH2
+ 2 NaX + Na2CO3 + 2 H2O
23
(二) 乙酰乙酸乙酯的化学性质
1. 酮式分解和酸式分解 2.乙酰乙酸乙酯活泼亚甲基上的反应
24
合成甲基酮
引入基团
CH3COCH 2CH3
引入基团
CH3
CH3COCHCH 2CH3
=
=
合成
O
O
=
CH3 C CH2 C OC2H5 C2H5ONa
C6H5COONH3C6H5
190℃ C6H5CONHC6H5 H2O
N-苯基苯甲酰胺
20
羧酸衍生物反应活性
21
相互转化关系图
有机化学期末复习重点

第1 章 绪 论 1. 有机化合物与有机化学的定义2.有机化合物的特点(了解)3.共价键的特性和属性。
注意:分子的极性与键的极性和分子的对称性有关。
4.共价键的断裂和有机化学反应的基本类型(1) 共价键的断裂方式分为均裂和异裂,根据共价键的断裂和形成的方式不同,可把有机反应机理分为:游离基反应、离子型反应和协同反应等 3 大类。
5.有机反应中“离子型”反应根据反应试剂类型不同,分为亲电反应与亲核反应两类:(1) 亲电试剂与亲电反应:由缺电子的试剂进攻部分负电荷的碳原子而发生的,这类十分需要电子的试剂称为亲电试剂。
如含有 H +、Cl +、Br +、NO 2+、RN 2+、R 3C +等正离子的试剂。
由亲电试剂的进攻而引起的反应称为亲电反应。
(2) 亲核试剂和亲核反应:由能供给电子的试剂进攻具有部分正电荷的碳原子而发生的,这类能供给电子的试剂称亲核试剂,如 H 2O、ROH、OH -、RO -、Br -、NH 3、RNH 2、CN -等。
由亲核试剂的进攻而引起的反应称为亲核反应。
注意:有机反应中,加成反应分为亲电加成(烯烃与卤素的反应)、亲核加成(羰基与氰氢酸、水、醇、格氏试剂、氨的衍生物之间的反应)、自由基加成(如:不对称与 HBr 在过氧化物存在下的反应属于自由基加成,遵循反马氏规则)三类。
第 2 章 烷烃和环烷烃一、烷烃的命名:1.掌握有机化合物系统命名的基本原则2.碳原子的分类(伯、仲、叔、季)与常见烷基的结构和名称(P 48)3.顺序规则 —— 主要烷基的优先次序:甲基<乙基<丙基<异丙基二、烷烃的结构(了解)三、烷烃的构象异构(属于立体异构)乙烷中最典型的 2 种构象是交叉式(稳定构象)和重叠式,用 Newman 投影式和锯架式表示。
丁烷的 4 种典型构象及其稳定顺序:对位交叉式>邻位交叉式>部分重叠式>全重叠式。
四、烷烃的化学性质(掌握)烷烃卤代反应的机制——游离基(自由基)反应,分链引发、链增长与链终止是的 3 个阶段;烷烃卤代反应的取向主要由自由基稳定性次序来决定。
大学有机化学下学期复习题

N-亚硝基化物 油层 丙醇 水相
①HCl ②NaOH
乙醚提取蒸馏
41
(4)
酰化N-甲基苯胺
乙酰氯
水相(NaOH中和)
HCl
油相
乙醚提取
洗涤蒸馏
42
9.完成下列转换
Cl Cl
(1)
NH2 NO2
CH3
NH2 NO2
(2)
NO2
CH3
43
Cl
Cl
(1)
NH2 NO2
Cl
(CH3CO)2O
Cl
Cl HNO3
10%NaOH 水溶液
水层
辛酸盐
加盐酸 调PH至酸性
辛酸
己醛 有机层 和1-溴丁烷 饱和亚硫酸氢钠
有机层 1-溴丁烷
水层
白色固体
水层
白色固体
加盐酸 调PH至酸性
己醛
6
4、将下列化合物按指定性质的活泼程度从小到大排列成序
(1)将下列化合物按醇解反应速率快慢排序: A. 苯甲酰氯 B.丙烯酰氯 C. 乙酰氯
CH3
KMnO4 H+ COOH
CN
CONH2 1) SOCl2 2 ) NH3
CN P2O5
CN HNO3 H2SO4 NO2
Fe HCl
CN
NH2
CN NaNO2 HCl CN CuCN
48
(5)
Cl
CH2CH3
Cl
NH2
(6)
NHCH3 CH3
49
Cl
CH2CH3
Cl
NH2
(5)
KMnO4
36
6. 在一组分子量相近的伯、仲和叔胺中,为何通 常伯胺的沸点最高?
《有机化学》期末复习测试卷(附答案)
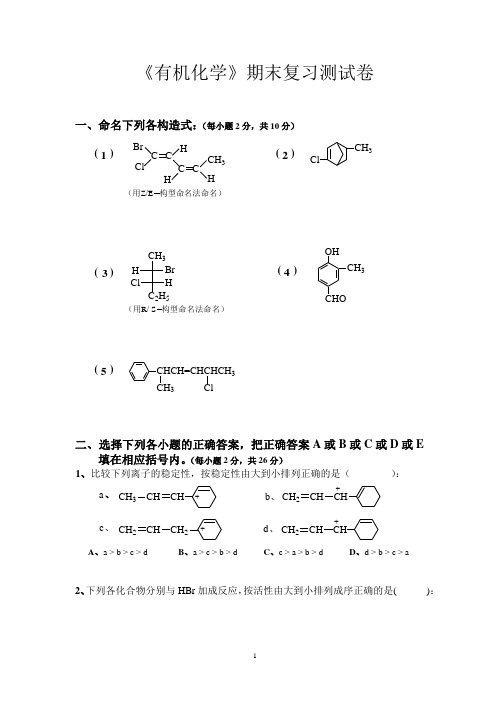
《有机化学》期末复习测试卷一、命名下列各构造式:(每小题2分,共10分)( )( )12Br ClH HCH 3HC CC C ClCH 3(用Z/E 构型命名法命名)( )( )34(用R/ S 构型命名法命名)HBr ClH C 2H 5CH 3OHCH 3CHO( )5CHCH=CHCHCH 3CH 3Cl二、 选择下列各小题的正确答案,把正确答案A 或B 或C 或D 或E 填在相应括号内。
(每小题2分,共26分)1、比较下列离子的稳定性,按稳定性由大到小排列正确的是( ):+++、、、、+a b c d CH 2 CH CHCH 3 CH CH CH 2 CH CH 2CH 2 CH CHA 、a > b > c > dB 、a > c > b > dC 、c > a > b > dD 、d > b > c > a2、下列各化合物分别与HBr 加成反应,按活性由大到小排列成序正确的是( ):Cl 3C CH=CH 2 HC CH CH 3CH=CHCH 3 CH 2=C -CH=CH 2CH 2=CHCH=CHCH=CH 2CH 3a 、b 、c 、d 、=e 、A 、 a>b>c>d>eB 、 e>d>c>b>aC 、 d>e>c>a>bD 、 d>e>c>b>a3、下列试剂的水溶液分别与1—溴丁烷反应时,按亲核取代反应活性由大到小排列 成序正确的是( )。
CH 3CH 2Li CH 3ONa NaOH (CH 3)3CONa CH 3COONaa 、b 、c 、d 、e 、 A 、 a > b > c > d > e B 、 b > d > c > e > aC 、 a > b > d > c > eD 、 d > b > c > e > a4、顺丁烯二酸酐分别与下列双烯进行Diels-Alder 反应时,反应活性由大到小排列正确的应该是( )。
有机化学期末复习

CH2
CO2
臭氧化反应
CH3 CH3CH=C CH3 O3 2) Zn/H2O
1)
CH3 CH3CHO + CH3 C O
R R' C
R R' C O
R
CH
R
C H O
CH2
H
C O
H
缩 短 碳 链 的 合 成
推 测 烯 烃 的 结 构
羰基化合物
环氧化反应
O CH3CH=CH2 + CH3COOH
C C
CH2CH3(优) CH3
CH3
C C
CH(CH3)2(优) CH2CH2CH3
(优)CH3CH2
(Z)- 3-甲基-2-戊烯
(E)- 3-甲基-4-异丙基-3-庚烯
CH3
H
H
CH3
顺-1,4-二甲基环己烷
2-乙基螺[4.5]-7-癸烯
OH
OH
CHO NH2
4-甲基双环[3.2.1]2-辛烯 2-氨基-5-羟基苯甲醛
分步反应 外消旋化 SN1的特征
SN1( 续)
正 碳 离 子
CH3 CH3-C-CH-CH3 H3C Br OH
H2O -H
+
示例
CH3 OH
H2O SN1
重排
CH3-C-CH-CH3 H3C Br
CH3- C- CH- CH3 H3C CH3
- Br
CH3 CH3-C-CH-CH3
+ 重排
CH3 C- CH CH3 H3C CH3
δ-
C=C
+ ROH + X -
查依采夫规则
Hoffmann规则
有机化学基础复习题及答案

2022学年第二学期期末考试复习题一、单选题1、淀粉遇到碘显()色。
(1.3)A、红B、黄C、蓝D、绿正确答案:C2、乙醛与斐林试剂反应生成的沉淀是()。
(1.3)A、CuB、Cu 2OC、AgD、Fe正确答案:B3、能发生塞利凡诺夫反应的是()。
(1.3)A、核糖B、乳糖C、蔗糖D、麦芽糖正确答案:C4、皮肤遇到蛋白质变黄是因为发生了()反应。
(1.3)A、茚三酮反应B、莫力许反应C、二缩脲反应D、黄蛋白反应正确答案:D5、下列分子式表示的物质,具有同分异构体的是()。
(1.3)A、CH 2ClFB、C 3H 8C、CH 2Cl 2D、C 2H 4O 2正确答案:D6、天然气的主要成分是()。
A. 甲烷B. 乙烷C. 一氧化碳D. 乙烯正确答案:A7、2-甲基戊烷是饱和化合物,说明分子中所有的键都是()。
(1.3)A、单键B、双键C、三键D、以上三种键都有正确答案:A8、下列反应无论怎样调整反应物的用量都只能生成一种物质的是()。
(1.3)A、甲烷和氯气混合后光照发生反应B、乙烯与氯化氢的加成反应C、甲苯与等物质的量的Br 2发生反应D、乙炔和氯气的加成反应正确答案:B9、关于苯分子结构的叙述正确的是() 。
A. 含有三个碳碳双键和三个碳碳单键B. 分子中6个碳碳键完全相同C. 所有碳原子都在同一平面上,氢原子不处于同一平面上D. 每两个键之间的夹角都为60°正确答案:B10、下列溶液分别和溴水混合并振荡,静置后分为两层,水层和油层均为无色的是()。
(1.3)A、己烷B、CCl 4C、NaOH溶液D、己烯正确答案:D11、下列不是乙烯用途的是()。
(1.3)A、制塑料B、做灭火剂C、制有机溶剂D、做果实催熟剂正确答案:B12、碳氢化合物简称()。
(1.3)A、烃B、羟C、羰D、烷正确答案:A13、分子式相同而结构不同的化合物互称为()。
(1.3)A、结构式B、同分异构体C、同系物D、丙醛正确答案:B14、区别苯酚和苯甲醛时,可用的试剂是()。
(完整版)大学有机化学期末复习知识点总结

3)空间效应:体积较大的基团总是取代到空间位阻较小的位置。
4)定位规律:芳烃亲电取代反应的规律,有邻、对位定位基,和间位定位基。
5)查依切夫规律:卤代烃和醇消除反应的规律,主要产物是双键碳上取代基较多的烯烃。
6)休克尔规则:判断芳香性的规则。
存在一个环状的大π键,成环原子必须共平面或接近共平面,π电子数符合4n+2规则。
7)霍夫曼规则:季铵盐消除反应的规律,只有烃基时,主要产物是双键碳上取代基较少的烯烃(动力学控制产物)。
当β-碳上连有吸电子基或不饱和键时,则消除的是酸性较强的氢,生成较稳定的产物(热力学控制产物)。
8)基团的“顺序规则”3. 反应中的立体化学烷烃:烷烃的自由基取代:外消旋化烯烃:烯烃的亲电加成:溴,氯,HOBr(HOCl),羟汞化-脱汞还原反应-----反式加成其它亲电试剂:顺式+反式加成烯烃的环氧化,与单线态卡宾的反应:保持构型烯烃的冷稀KMnO4/H2O氧化:顺式邻二醇烯烃的硼氢化-氧化:顺式加成烯烃的加氢:顺式加氢环己烯的加成(1-取代,3-取代,4-取代)炔烃:选择性加氢:Lindlar催化剂-----顺式烯烃Na/NH3(L)-----反式加氢亲核取代:S N1:外消旋化的同时构型翻转S N2:构型翻转(Walden翻转)中间体:自由基:反应类型:烯烃、炔烃的过氧化效应。
3.亲电加成反应机理中间体:环鎓离子(溴鎓离子,氯鎓离子)反应类型:烯烃与溴,氯,次卤酸的加成中间体:碳正离子,易发生重排。
反应类型:烯烃的其它亲电加成(HX,H2O,H2SO4,B2H6,羟汞化-去汞还原反应)、炔烃的亲电加成,小环烷烃的开环加成,共轭二烯烃的亲电加成。
或环鎓离子):4. 亲电取代反应机理:中间体:σ-络合物(氯代和溴代先生成π络合物)反应类型:芳烃亲电取代反应(卤代,硝化,磺化,烷基化,酰基化,氯甲基化)。
5. 亲核加成反应机理:中间体:碳负离子反应类型:炔烃的亲核加成6.亲核取代反应机理:S N1反应中间体:碳正离子,易发生重排。
有机化学期末总复习-下

炔水合
O
RC
CH X R X
RC CH3
R'(H)
H + or OHH2 O
偕二卤代物水解
O C R R'(H)
傅克酰基化
ArH + RCOCl
CH3
AlCl3
ArCOR + HCl
CuCl, AlCl 3
加特曼-科克甲酰化
+
CO + HCl
H3C
CHO
威尔斯迈尔甲酰化
ArH + RCOCl
(CH3 )2NCHO
异氰酸酯
O
R N =C
OH OH
O
=
R NH2
R NH C OH
"胺基甲酸" 不稳定
=
乙酰乙酸乙酯在合成上的应用
酮式分解
CH3 COCH2COOC2H5 RX
NaOC2H5
CH3 COCH2R
甲基酮
CH3COCHCOOC2 H5
R
酸式分解
RCH2COOH
烃
酮式分解
CH3 COCH2COR
2,4-二酮 2,4-二醇
RCHCOOH
X
ACH2COOH
加热或碱
ACH3 + CO2
A为吸电子基会使脱羧反应更容易 Kolbe反应:羧酸盐在水解条件下发生脱羧
2RCOOK + 2H2O 电解 R R + 2CO2 + H2 + KOH 阴极
阳极
Hunsdiecher反应
2RCOOK + 2H2O 电解 R R + 2CO2 + H2 + KOH 阴极
有机化学下 期末复习_看图王
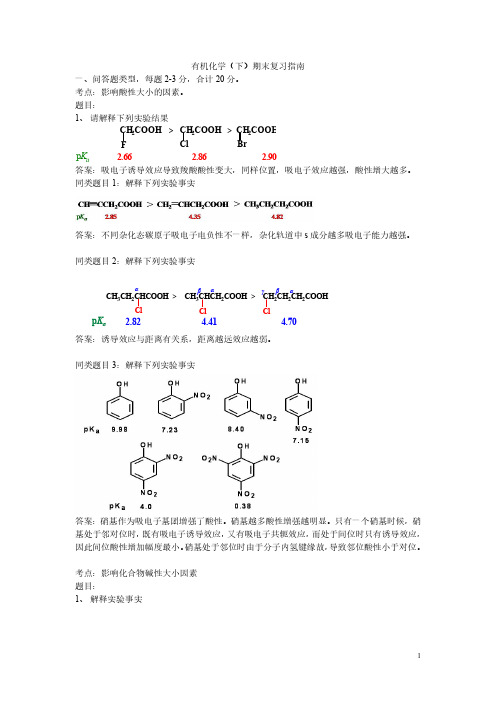
CH3COCl MW b.p(℃) MW b.p(℃) 78.5 51 (CH3CO)2O 102 139.6
CH3COOCH3 74 57.5
CH3CH2COOH 74 141.1
CH3CH2CH2CH2COOH 103 187
答案:羧酸以及酰胺分子能够形成氢键,极大增加了沸点。 同类题目 1:
b.p(℃)
有机化学(下)期末复习指南 一、问答题类型,每题 2-3 分,合计 20 分。 考点:影响酸性大小的因素。 题目: 1、 请解释下列实验结果 CH2COOH > CH2COOH > CH2COOH
pKa
2.66
F
Cl
Br
2.86
2.90
答案:吸电子诱导效应导致羧酸酸性变大,同样位置,吸电子效应越强,酸性增大越多。 同类题目 1:解释下列实验事实
考点:桑德迈尔反应
CH3 K2CrO7 COOH Zn HCl NO2 NH2 H2SO4 NO2 COOH NaNO2 HCl N2+ClCOOH CuCN KCN CN (a) COOH
题目:
题目 2:合成少一个碳原子的伯胺,Hofmann 降解反应
O (CH3)2 CHC NH2 NaOCl
(CH3)2 CH
1
NH2 > OH pkb 8.50
NH2 > CH3 8.90
NH2 >
NH2 > Cl
NH2 > NO2 13.0
NH2 NO2 NO2 13.82
9.30
10.02
答案:供电子取代基有利于碱性增强,吸电子取代基导致碱性变弱,吸电子效应越强,碱性 越弱。 同类题目 2:请解释水溶液中胺的碱性次序
O 2N NO2
7、 解释下列实验事实
有机化合物结构特点与研究方法--高二化学下学期期末重难点易错专题复习 学生版

有机化合物结构特点与研究方法复习专题微专题一:同分异构体的书写与判断1.同分异构体的异构类别(1)碳链异构:由于碳骨架不同产生的异构现象。
如C5H12有三种同分异构体:正戊烷、异戊烷和新戊烷。
(2)位置异构:由于官能团或取代基在碳链或碳环上的位置不同而产生的同分异构现象。
如氯丙烷有两种同分异构体:1-氯丙烷和2-氯丙烷。
(3)官能团异构(又称类别异构):有机物的官能团种类不同,但分子式相同。
如:①单烯烃与环烷烃;②单炔烃和二烯烃、环烯烃;③饱和一元醇和醚;④饱和一元醛和酮;⑤饱和一元羧酸和饱和一元酯;⑥芳香醇、芳香醚和酚;⑦葡萄糖和果糖;⑧蔗糖和麦芽糖;⑨硝基化合物与氨基酸等。
2.同分异构体的书写方法(1)有机物同分异构体的书写方法①烷烃(降碳对称法)主链由长到短支链由整到散位置由心到边(不到端)排布由邻、对到间②烯烃(插入法)先写出可能的碳链形式(碳骨架)再将官能团(双键)插入碳链中(此法也可适用于炔烃、酯等)③醇(取代法)先碳链异构:写出可能的碳链后位置异构:移动官能团(-OH)的位置3.同分异构体的判断方法(1)基元法:如丁基有四种结构,则丁醇有四种同分异构体。
(2)换元法:如二氯苯C6H4Cl2有三种同分异构体,四氯苯也有三种同分异构体(将H替代Cl、Cl替代H)。
(3)对称法(又称等效氢法):等效氢法的判断可按下列三点进行:①同一甲基上的氢原子是等效的;②同一碳原子上所连甲基上的氢原子是等效的;③处于对称位置上的氢原子是等效的。
(4)定一移一法:对于二元取代物的同分异构体的判定,可固定一个取代基位置,再移动另一取代基,以确定同分异构体数目。
1微专题测评1下列烷烃的一氯代物中没有同分异构体的是A.丙烷B.2-甲基丙烷C.丁烷D.新戊烷2下列各种烷烃进行一氯取代反应后,只能生成四种沸点不同的产物的是A.CH3CH2CH3B.CH32CHCH2CH3 C.CH3CH2CH2CH3 D.CH3CH24CH33下列有机物的一氯代物数目最多的是A.CH3CH2CH3B.C. D.4丙烷的二氯取代物的个数是A.3B.4C.5D.65分子式为C9H12的某烃,苯环上有一个取代基,其与足量氢气加成的产物的一氯代物共有A.6种B.11种C.12种D.13种6以下结构的三种烃分子,说法不正确的是A.1mol甲分子内含有10mol共价键B.甲、乙、丙三者互为同系物C.丙分子的二氯取代产物只有三种D.丙与苯乙烯()互为同分异构体7已知A为苯的同系物,且A的分子量为120,则A属于苯的同系物的可能结构有A.5种B.6种C.7种D.8种8某苯的同系物的分子式为C11H16,经分析分子式中除含苯环外(不含其它环状结构),还含有两个“-CH3”,两个“-CH2-”、一个“”它的可能结构式有A.2种B.3种C.4种D.5种9组成和结构可用表示的有机物(不考虑立体结构)共有种A.3种B.12种C.20种D.36种10分子式为C4H8的烯烃的二氯代物中,只含一个甲基的结构有(不考虑立体异构)A.9种B.10种C.11种D.12种微专题二:有机物的分离和提纯1.分离提纯的几种思路(1)杂转纯:如除去Na2CO3中的NaHCO3,将混合物加热使NaHCO3全部转化为Na2CO3。
有机化学下册复习总结

第六章有机波谱目前,在有机化合物的结构测定中,物理方法的应用已远远超出了化学方法。
而在物理方法中,则以紫外吸收光谱,红外吸收光谱,核磁共振谱和质谱应用最广。
其中红外光谱和核磁共振谱应用更为广泛,谱图也容易得到,所以,本章仅就这两种谱图予以讨论。
有兴趣的可以自行结合教材,适当选读一些有关紫外和质谱的资料,或在后续课中进一步学习提高。
有机化合物能吸收不同波长的电磁辐射。
在红外光区的吸收可以引起分子中成键原子的振动和转动能级的跃迁。
不同类型的化学键产生振动激发需要不同的能量。
在红外光谱中,4000~1500cm-1(2.5~6.5um)的区域对于鉴定有机化合物的官能团是有用的。
而1500~650cm-1(6.5~15um)的区域称为指纹区,在此区域内,不同结构的分子都有自己的特征光谱,分子结构的细微变化都可在这一段内反映出来。
表6-1是一些键和官能团的伸缩振动频率。
表6-2是烃类的弯曲振动频率。
表6-1 一些键和官能团的伸缩振动频率(醇,酚的氢键中)(胺和酰胺中)(炔碳上)(芳环中)(烯碳上)(饱和碳上)(COOH中)(醛基中)(腈)(炔)(酰氯中)(醛,酮,酯中)(羧酸中)(酰胺中)(烯)(芳环中,通常呈几个峰)(醚,醇,酯中)核磁共振是处于外磁场(H。
)中的质子吸收电磁辐射后,从一种自旋状态翻转到另一种自旋状态的结果。
分子中的质子并不是个裸核,在外磁场影响下,质子外围的电子环流将产生感应磁场。
感应磁场可以屏蔽质子(与H。
反平行)或去屏蔽质子(与H。
平行)并且引起吸收带的化学位移(δ)。
屏蔽的质子吸收移向高场,而去屏蔽的质子吸收移向低场。
吸收带的自旋—自旋裂分,通常是由相邻的非等性质子的自旋状态引起的。
一个质子(或一组等性质子)的信号被分成(n+1)个峰,式中n是相邻等性质子的数目。
整个吸收带下面的面积与给出该信号的质子的数目成正比。
表6-3给出了常见有机化合物中不同类型质子的化学位移。
表6-2 烃类的弯曲振动频率(cm-1)(顺式)(反式)表6-3 有机化合物中不同类型质子的化学位移环丙烷烯丙型:碘化物的α—H:酯的α—H:羧酸的α—H:羰基的α—H:炔:苄:醚的α—H:溴化物:氯化物:醇:氟化物:酯中酰氧基α—H:胺:羟基:烯基:芳基:醛:羧基:酚:烯醇:第九章醇酚醚醇,酚,醚都是烃的含氧衍生物。
有机化学_下册__复习总结

CF3CO3H
K2Cr2O7
ArNO2
AS2O3 NaOH
+
NH 4 Cl Zn
ArNHOH
ArNH2
ArN=NAr O ArNHNHAr
Zn NaOH (solution)
Zn NaOH/CH 3OH
Zn
NaOH (solution)
ArN=NAr
十二章 含氮化合物的官能团化-芳胺的官能团化
C nitroso compounds
ArOCH3
第九章 醇(酚)的官能团化
CHO
DMF POCl3
OCH3
Me2SO4 NaOH H+
OCH3
N
HCHO/HN(CH3)2 H+
O
OH OH
OH
HCHO/H+
CH2OH
OH
HOH2C OH
OH
第十章 醛酮的官能团化
RCH2CH CH2 CHO R H+ OH RCH2 R R'2NH RCH 稀 NaOH CHO R' RCH2CHOMgBr Ph3P CH2 R'MgBr HCN RCH2CHO NaHSO3
N2Cl H3CO
+
H3N
)
N2Cl
N2Cl Cl
O2N
7、下列物质进行芳香亲电取代活性并由大到小排序( A、呋喃 B、苯 C、噻吩 D、吡啶
)
24
8、比较下列化合物的碱性由大到小排序: ( ) A、吡啶 B、苯胺 C、环己基胺 D、吡咯
9、比较下列化合物稳定性并由大到小排序( A、呋喃 B、苯 C、噻吩 D、吡咯 )
25
四. 鉴别物质
有机化学试题库及答案解析期末考

有机化学试题库及答案解析期末考有机化学是化学学科中的一个重要分支,它涉及有机化合物的结构、性质、反应以及合成。
以下是一套有机化学的期末试题库及答案解析,供同学们复习和练习。
一、选择题1. 下列哪个化合物不是芳香化合物?A. 苯B. 甲苯C. 环己烯D. 呋喃答案解析:芳香化合物是指含有苯环的化合物。
选项A、B和D中,苯和甲苯都含有苯环,呋喃是一个含氧的五元杂环化合物,也具有芳香性。
而环己烯是一个六元碳环,不含苯环,因此不是芳香化合物。
正确答案为C。
2. 在有机反应中,下列哪种反应类型不涉及碳碳键的形成?A. 亲核取代反应B. 亲电取代反应C. 亲核加成反应D. 消除反应答案解析:亲核取代反应和亲电取代反应通常不涉及碳碳键的形成,它们主要是原子或原子团的替换。
亲核加成反应涉及到碳碳双键或三键与亲核试剂反应,形成新的碳碳键。
消除反应则是碳碳双键或三键的形成过程。
因此,正确答案为A和B。
二、填空题1. 请写出下列化合物的IUPAC名称:- 2-甲基-1-丙醇- 3-甲基-2-丁烯答案解析:- 2-甲基-1-丙醇的IUPAC名称是2-甲基丙-1-醇。
- 3-甲基-2-丁烯的IUPAC名称是3-甲基丁-2-烯。
2. 给出以下反应的类型:- CH3CH2Br + NaOH → CH2=CH2 + NaBr + H2O- CH3CH2OH + HBr → CH3CH2Br + H2O答案解析:- 第一个反应是消除反应,因为醇分子在碱性条件下失去水分子形成烯烃。
- 第二个反应是亲核取代反应,因为醇的羟基被溴离子取代形成卤代烃。
三、简答题1. 简述什么是SN1和SN2反应,并给出它们的主要区别。
答案解析:SN1和SN2都是亲核取代反应的类型。
SN1反应是单分子亲核取代反应,反应过程中底物分子首先发生离子化,形成一个碳正离子中间体,然后亲核试剂攻击这个中间体。
SN2反应是双分子亲核取代反应,底物分子和亲核试剂几乎同时反应,形成一个新的化学键,同时断裂另一个化学键,没有中间体生成。
《有机化学》期末复习测试卷(附答案)
24、下列基团哪个离去能力最强?( )
25、下列亲核试剂亲核性最强的是( )。
三、完成反应式。在各小题空括号内填上产物的结构式或反应试剂、
反应条件。(每空1分,共33分)
四、改错题。下列各反应式你如果认为有错误,必须在错误之处打“╳”,并在空行对应位置上写上改正的答案;你认为没错的反应式必须在反应式后标上“√”记号。(每小题1.5分,共12分)
A B C D
4、下列化合物进行硝化反应的难易次序排列正确的是( )。
a、乙酰苯胺b、苯乙酮c、氯苯
A、a>c>bB、c>a>bD、a>b>cC、c>b>a
5、下列各化合物进行溴化反应的相对速率,按由大到小排列正确的是( )。
a、对二甲苯b、对苯二甲酸c、甲苯d、对甲基苯甲酸
e、间二甲苯
A、e>a>c>d>bB、a>e>c>d>b
《有机化学》期末测试卷
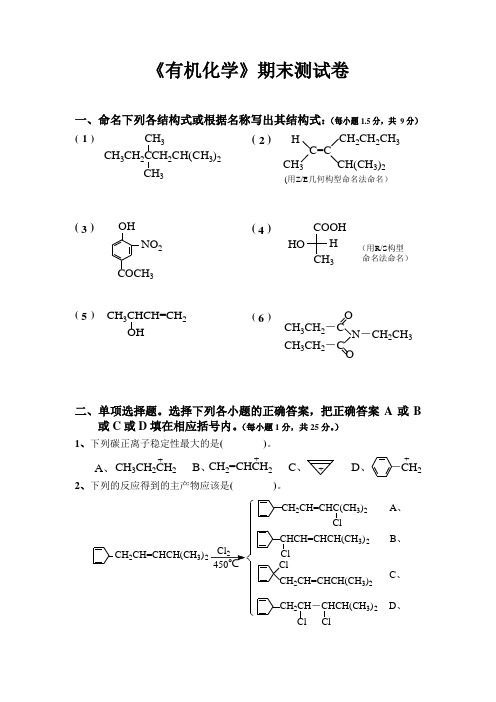
一、命名下列各结构式或根据名称写出其结构式:(每小题1.5分,共9分)
二、单项选择题。选择下列各小题的正确答案,把正确答案A或B或C或D填在相应括号内。(每小题1分,共25分。)
1、下列碳正离子稳定性最大的是( )。
2、下列的反应得到的主产物应该是( )。
3、下列哪个结构存在P-π共轭效应?( )
11、卤代烷与NaOH在水/乙醇溶液中反应,下列情况属于SN2反应的是( )。
A、增加溶剂的含水量反应明显加快;B、有重排反应;
C、叔卤代烷反应速率大于仲卤代烷;D、反应只有一步。
12、下列各化合物的羰基其活性最大的是( )。
13、下列各化合物酸性最强的是( )。
A、羟基乙酸B、三氯乙酸C、氯乙酸D、乙酸
有机化学期末试卷及答案

广西师范学院课程考试试卷05 120 题号二三四 五 六总分应得分 103020101020100实得分评卷人、命名下列化合物或根据名称写出结构式( 10 分)9、α- D -葡萄糖甲苷构象式10、已内酰胺第 1 页,共 8 页1NH 21、COOH2、COOCH 2CH 3CH 33、CHO4、(CH 3CH 2)4N +Br5、OH6、 3-甲基- 2,5-己二酮7、顺丁烯二酸酐8、苯丙氨酸、选择题,将正确答案的序号填入下表(每小题 2 分,共 30 分): 题号 11121314151617181920答案题号 2122232425答案11 、某分子的结构是,它属于哪一类结构?OH12、下列化合物中,能发生碘仿反应的是: B. CH(OH)CH 2CH 32(2 3D.CH 2CH 2CHO2(2 313、下列化合物中进行亲核加成反应的活性顺序为: a 、乙醛b 、丙酮c 、苯乙酮d 、二苯甲酮A 、 d>c>b>aB 、 a>b>c>dC 、 b>c>d>aD 、 c>d>b>a14、过氧乙酸是一种消毒液,在抗击“非典”中广泛用于医院、汽车及公共场所的消毒,过氧乙酸的结构式是:15、下列化合物能在氢氧化钠溶液中进行歧化反应的是:第 2 页,共2 8 页A. 碳水化合物B. 萜类化合物C. 甾族化合物D. 生物碱A.OH A 、OHB 、OC OHC 、D 、CH 3— C —OHCH 3-O-C OHOCH 3C O —OHOHA、乙醛B 、呋喃C 、α - 呋喃甲醛D 、α -呋喃甲酸CH 3 C.CH(OH)CH16、下列四个化合物中,不被稀酸水解的是:A. OCH3B.C.D.17、糖类化合物:①蔗糖、②麦芽糖、③甘露糖、④葡萄糖苷,分别将它们溶于水后均有变旋现象的是:A. ①和②B. ①和③C. ②和③D. ②和④18、谷氨酸HOOCCH 2CH 2CHCOOH 的等电点为 3.22,在PH=2 时的溶液中,它NH2的主要存在形成为:A. HOOCCH 2CH 2CHCOOHB. HOOCCH 2CH2CHCOONH2 NH2HOOCCH 2CH2CHCOO C. HOOCCH 2CH 2CHCOOHNH 3+D.NH+319、山道年属于倍半萜,按照“异戊二烯”规则,可以将它划分为三个异戊二烯单位,下列划分正确的是:A 、D、OO20 一滴盐酸可以使尼龙袜弄出一个大洞,这主要原因是(A) 般高聚物耐酸能力都不强(B) 盐酸对高聚物有特别强的腐蚀能力(C) 尼龙分子中的酰胺键容易被酸水解(D) 以上解释都不对21、在DNA 双螺旋结构中,能互相配对的碱基是:B、 A 与TC、C与U D 、T 与U22、体型结构的塑料具有下列性质:A、可塑性B、粘流性C、高弹性 D 、脆性大23、下列化合物:①碱性由强到弱的顺序是:A. ①>②>③>④C. ③>④>①>②24 、缩聚反应中单体比例不等于1∶1 时,会造成:A 、分子量无限增大B、链端封闭C、可逆平衡反应D、网状聚合物25、核苷酸是核酸的基本组成单位,而核苷酸有下列成分组成:A .嘌呤碱基、嘧啶碱基、戊糖、磷酸B. 嘌呤碱基、嘧啶碱基、戊糖、氨基酸C. 嘌呤碱基、嘧啶碱基、戊糖、核酸D. 嘌呤碱基、嘧啶碱基、己糖、磷酸26、、填空完成反应式(每格 1 分,共20 分)CN27、O MgBr(32B. ②>①>④>③D. ①>③>②>④300℃HCH 3I3( )CH2OH(CH3CO)2O(①AgOH②(①AgOH②()四、鉴别下列各组化合物(10 分)35 、丙酮丙氨酸丙酰氯丙烯腈30、浓硝酸+浓硫酸31、+RMgX34、H2 Ni 2CH3I) ( 32、CHO过量)Fe / HClHNO 3在乙酐中CH 3I( 36、+NHNH 233、37 、甲酸乙酸乙醛五、推导结构式(10 分)38、某 D 型己醛糖(A),用HNO 3氧化生成有光学活性的糖二酸(B);(A)经降解得到戊醛糖(C),(C)经HNO 3氧化生成无光学活性的糖二酸(D);将(C)再进行降解,得到丁醛糖(E),(E)经HNO 3氧化生成内消旋酒石酸(2,3-二羟基丁二酸)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO2H CH3
CO2H
CO2H OCH3
CO2H NO2
CO2H CO2H NO2 NO2
例:
OCH3 CH3
pKa 4.47 4.38 +C>-I +I,+C
4.27 +I
4.2
4.09 -I
3.49 -I
3.42 -I,-C
2.21 -I
2、亲核取代反应活性
酰卤 > 酸酐 > 醛 > 酮 > 羧酸 ~ 酯 > 酰胺 比较如下化合物碱性水解的速度顺序
P580 17-14(2)(3)
Chapter 18 协同反应
一、 电环化反应
二、 环加成
环加成反应的立体选择性规律
[m+n]π 电子数 4n [2+2] 反应条件 加热 光照 4n+2 [4+2] 加热 光照 对称性 禁阻 允许 允许 禁阻
P 608 3(8)
三、【3,3】σ 迁移,Cope重排
(5)乙烯基醚的反应
P338 10-7
3、环氧乙烷及其衍生物的开环反应
环氧化合物在酸性与碱性条件下都可以开环:
(1)酸性开环,为SN2机理,但具有部分SN1的性质,
不对称的环氧化合物开环时开环反应的方向受电子 因素所控制,亲核试剂加在取代多的环碳上。
(2)碱性下开环,同样为SN2机理,但不对称的环氧
Claisen重排
P606 18-6(1)
Chapter 20 杂环化合物
1. 亲电取代
(1)呋喃、噻酚和吡咯 亲电取代主要发生在α-位
(2)吲哚
4 5 6 7 3 5 6 7 4 3 5 6 7 4 3 2
N1 H
O
2 1
S
2 1
吲哚
苯并呋喃
苯并噻吩
• 进攻3-位,反应易于进行 (3)吡啶 亲电取代反应主要发生在β位
oC 100-200 o
CH2
CH2 + (CH3)3N + H2O CH2 + (CH3)3N + H2O
- 100-200 C
RCH
霍夫曼规则:四级铵碱热解时,若有两个β-H可以 发生消除。总是优先消去取代较少的碳上的β-H。
P571 17-8(1)
P586 5(8)
三、 胺的酰化和兴斯堡反应
反应历程:
P539 16-6
16.3 丙二酸二乙酯和“三乙” 化合物的α碳负 离子的亲核取代反应及在有机合成中的应用
O R' CH3 C C R H
取代乙酸
二取代丙酮
P548 7(1)
P539 16-7(2)
涉及碳负离子的亲核加成反应
1. 克脑文盖尔 (Knoevenagel)缩合反应
醛、酮在弱碱(胺、吡啶等)催化下与具有活泼-氢的化合 物缩合的反应。
期末复习
Chapter 10 醚和环氧化物
重点:醚的化学性质和制法;环氧乙烷及衍生物的性质。
1、醚的制备--威廉森合成法 Williamson Ether Synthesis
RX + NaOR’
ROR’
(SN2机理)
副反应:卤代烃的消除,因为醇钠是强碱
(1)级数较高的烃基做成相应的醇钠 制备叔烃基的混醚时,应采用叔醇钠与伯卤烷作用 (2)制备具有苯基的混醚时,一般采用酚钠;但芳基上 有吸电子基(-NO2),也可用对应的卤代芳烃 P334,10-2,P335, 10-5(2)
A
P525 6(2)
B
C
D
P524 2(6)(7)
3、酮式---烯醇式互变异构
α-H越活泼烯醇化程度越大, 羰基的-I效应强于酯基和羧基 共轭体系的延伸使烯醇型结构稳定,烯醇化程度越大;
P530 表16-1 C6H5COCH2COC6H5
4、羧酸脱羧反应(包括二元羧酸的热分解)
Y
CH2COOH
P502 6(12)
(3). 克莱门森(Clemmensen)还原
RCOR'
Zn-Hg 浓HCl
RCH2R'
(4). 歧化反应-Cannizzaro反应
没有-活泼氢的醛在强碱作用下,发生分子间的氧 化还原而生成相应醇和相应酸的反应。
P 393 11-25
8. 安息香缩合反应 芳香醛或少数不含α-H的脂肪醛在CN的催化作用下, 发生双分子缩合,生成α-羟基酮。
酮肟
酰胺
P399 11-28(1)
P412 2(3)
Chapter 14--16 羧酸及其衍生物
1、酸性 (1).取代基对芳香族羧酸酸性的影响: 吸电子基团使酸性增强,给电子使酸性减弱; 取代基处于羧基对位时,应同时考虑诱导和共轭效应; 取代基处于羧基间位时,只需考虑诱导效应;
取代基处于羧基邻位时,较复杂,可能是由于羧基与取代基非共 平面,只需考虑诱导效应(比处于间位时强);
O R C R'(H)
O R C R'(H) +
_
若R及R’的电子效应是给电子(+I、+C)的(如CH3-,+I; C6H5-,+C),会使羰基的碳正电荷密度降低,从而反应活性 降低;若R及R’是吸电子的(如X3C-,-I),羰基的碳正电荷 密度升高,反应活性升高; 第二是NU进攻羰基碳原子的空间位阻, R及R’的空间体积越大,位阻越大,活性越低; P363 11-3
强致癌物!
3、 叔胺
R3N + HONO
绿色晶体
N(CH3)2 + HONO ON N(CH3)2
五、 烯胺的反应
六、重氮基被取代的反应及在合成中的应用
(1)重氮化反应
NH2 苯胺 NaNO2, HCl, H2O 0~5℃ N+ N Cl-
氯化重氮苯
在有机合成中可利用硝基或氨基的定位将所需基团引入特 定位置,然后将硝基或氨基除去或转化为所需基团,来合 成不能由芳环直接取代法合成的化合物。
化合物开环时,开环方向由空间效应所决定,亲核 试剂加在取代少的环碳上。 (3)无论酸性或是碱性开环,亲核试剂从氧桥的反面 进攻中心碳原子,符合SN2反应的立体化学特征。
P352 2(5)(6) P348 10-12
Chapter 11 醛和酮
重点:醛酮的化学性质 1、亲核加成反应活性 第一是电子效应,
Y
CH3 + CO2
5、羟基酸脱水反应——与羟基和羧基的相对位置有关
P502 6(7)
6、羧酸的还原反应 只有LiAlH4和B2H6 能还原羧酸
罗森门德(Rosemmund)还原法
Stephen reduction
7、酯与格利雅试剂的反应
R COOH 羧酸 OH O 1.CO2 1.HCHO RMgX R CH R R CH2OH 2.H2O R CH 2.H3O 2°醇 1°醇 醛 OH 1. O R MgX O R CH2CH2OH RMgX R C R' R'COOR'' 2.H3O R Li R CR' 1°醇 R 酮 醇 3° OH 1.R'COR'' O 1.R'CHO OH RMgX R'COCl 2.H O R CHR' 3 R CR' 2.H3O R C R' 1. R'CN 2°醇 R 酮 OH 2.H3O 3°醇 R C R' O R'' R CR' 3°醇 酮 O H COR'
O CCH3 RC O3H ? O COCH3 + ? O
√
OCCH3
氧原子插入的位置规律:H > Ph- > R3C- > R2CH- > RCH2- > -CH3 P385 11-21 (1);P412 2(1)
7、还原反应:
(1).催化氢化:
(2). 化学还原-LiAlH4, NaBH4
金属氢化物只还原羰基,不还原不饱和碳键。 NaBH4只还原醛酮和酰氯不影响NO2, Cl, COOR, CN
Chapter 17 胺
一、霍夫曼(Hofmann)重排反应
酰胺与溴的碱溶液作用时,脱去羰基生成伯胺,在
反应中使碳链减少一个碳原子,这是霍夫曼所发现
制胺的一个方法。
P563 17-4(1)
P586 5(14)
二、霍夫曼(Hofmann)消除反应
[CH3CH2N+(CH3)3]OH [RCHN+(CH3)3]OH CH3
2、碱性顺序
3、糠醛
歧化反应 安息香缩合
柏金反应
4、吡啶侧链氢的反应 侧链氢具有酸性,可进行亲核加成和羟醛缩合反应
P665 20-14(3)
O OH-(d) 2 RCH2 C H
O OH H RCH2 C C C H H R
羟酮缩合 分子内缩合
P381 11-15
P414 10(2)
6、氧化反应
(1)、弱氧化剂 Tollens试剂 AgNO3/NH3.H2O [Ag(NH3)2]+OHFehling试剂 CuSO4/OH-+ 酒石酸钾钠 (2)、 拜尔- 维立格(Baeyer-Villiger)氧化反应
反应中提供羰基 碳,其碳正性大
O2 N
反应中提供碳负 离子,亲核性大
CHO + H3CO
CHO CN-
O H3CO C
H C OH NO2
羟基连在吸电子基团的芳环一边
P399 11-28(2)
9. 贝克曼重排(Beckman)-反酮肟重排
R C R O + NH2OH R R C N OH H
+
O R C NHR
2、与ROH亲核加成
