高中化学之有机物完全燃烧耗氧量规律
烃的燃烧有关计算规律

CxHy + (x+y/4)O2 →xCO2 + y/2 H2O
1
x
y/2
0.1 1 = x = y/2
0.2
0.3
0.1 0.2
0.3
整理ppt
19
解得:x=2; y=6 所以该烃的分子式是:C2H6
整理ppt
9
例4:等物质的量的下列有机物完全燃
烧耗氧量相同的有( AC )
A.C2H4和C3H6O3 B.CH4和C2H4O
C.C6H6和C5H10
D.C3H6和C4H8O2
解析: C2H4和C3H6O3 ,其中C3H6O3
可以组合成C2H4•H2O •CO2,而C6H6和
C5H10 ,x+y/4相等。故它们在等物质的
该混合烃与9 L氧气混合,充分燃烧后恢复到原
状态,所得气体体积仍是10 L,下列各组混合烃
中不符合此条件的是 B(D )
A. CH4 C2H4 C. C2H4 C3H4
B. CH4 C3H6 D. C2H2 C3H6
整理ppt
16
二 分子式的确定
整理ppt
17
1.根据相对密度确定
例:某烷烃,其蒸汽的密度是相 同条件下氢气密度的36倍,试 确定该烷烃的分子式。
整理ppt
4
例1.等质量的乙烯和乙烷完全燃烧时,
耗氧量的关系是 ( )
A.前者大 B.相等
C.后者大
D.无法比较
C
解析:等质量的乙烯和乙烷比较相当于CH2 和CH3比较,根据规律,氢原子数多的耗氧 量大,所以答案是C.
例2:已知1 mol某气态烃CxHy完全燃烧
时需5 mol O2,则x和y之和可能是 C
2016_2017学年高中化学每日一题有机物与无机物的区别新人版

5月22日有机物与无机物的区别高考频度:★★☆☆☆难易程度:★★☆☆☆典例在线下列关于有机物的说法中正确的是A.凡是含有碳元素的化合物都属于有机物B.易溶于汽油、酒精、苯等有机溶剂的物质一定是有机物C.所有的有机物都易燃烧D.大多数有机物都是由分子构成的【参考答案】 D【试题解析】有机物和无机物的性质差别是相对的,如有机物一般难溶于水,易溶于有机溶剂,但也有部分有机物易溶于水,同样有些无机物也易溶于有机溶剂,如单质碘等;并非所有的有机物都能燃烧,如CCl4是一种很好的灭火剂;大多数有机物都是由分子构成的非电解质。
解题必备有机物无机物都含有碳元素不一定含碳元素化学反应复杂,副产物多化学反应简单化学反应速率慢化学反应速率快大多易燃烧大多不易燃烧多数不溶于水,易溶于有机溶剂多数易溶于水,不溶于有机溶剂熔点低(一般在400 ℃以下) 大多熔点较高种类繁多种类相对较少注意:无机物与有机物在性质上的差别是相对的,不同的有机物有其特殊的性质。
例如,乙醇能与水以任意比互溶;四氯化碳不但不能燃烧反而可以用来灭火;乙酸能在水中电离等。
学霸推荐1.下列说法正确的是A.有机物只能从有机体中获得B.有机物和无机物在组成、结构和性质上有严格的区别,它们不能相互转化C.有机物只能溶于有机溶剂中D.合成树脂、合成橡胶、合成纤维均属于有机物2.下列物质不属于有机物的是A.碳酸B.汽油C.蔗糖D.合成纤维参考答案1.D【解析】如今大量的有机物已能通过人工合成获得,如人工合成橡胶、人工合成纤维等,A项错误;很多有机物都是由无机物转化而来的,如一氧化碳和氢气在一定条件下反应可得到甲醇,B项错误;水也能溶解部分有机物,如乙醇,但水是无机物,C项错误。
2.A【解析】含有碳元素的化合物不一定为有机物,CO、CO2、碳酸、碳酸盐、金属碳化物等属于无机物。
5月23日有机物的类型判断高考频度:★★★☆☆难易程度:★★☆☆☆典例在线下列说法正确的是A.环状化合物是指含有苯环的化合物B.烃的衍生物包括卤代烃、烃的含氧衍生物等多种类型的有机物C.卤代烃、烷烃、烯烃、炔烃、芳香烃、环烷烃等都属于烃D.有机物分子中含有羟基且羟基直接与苯环相连,故属于酚【参考答案】 B【试题解析】在有机物的分类中,把含有环状结构的有机化合物叫做环状化合物,故环烷烃等也属于环状化合物;烃的含氧衍生物是指烃分子中的氢原子被含氧原子的原子团所取代而得到的有机物;烃中仅含碳、氢两种元素,而卤代烃中除含碳、氢元素外,还含有卤族元素,故不属于烃;D项有机物的结构中不含苯环,故不属于酚,而属于醇。
烃类完全燃烧的计算规律

烃类完全燃烧的计算规律高中有机化学的学习中,经常涉及烃类完全燃烧的计算的题目。
如何解决这一类题目,既是难点,也是重点内容之一。
为了使同学们熟练解题,系统掌握基础知识,现将有关规律总结如下,供大家参考。
一、烃类完全燃烧的通式CxHy + (x+y/4)O2→xCO2 + (y/2)H2O二、烃类完全燃烧前后体积(分子总数)的变化规律1、同温同压下,1体积烃类完全燃烧,当生成的水为气态时(温度高于100℃)△V = V前– V后= 1 + x + y/4 – x – y/2 =1 – y/4当△V ? 0时, V前? V后,则燃烧前后气体的体积减小,此时y ? 4当△V?0时, V前?V后,则燃烧前后气体的体积减小,此时y ?4当△V =0时, V前= V后,则燃烧前后气体的体积减小,此时y = 4可见,当温度高于100℃时,燃烧前后的体积的变化与碳原子数无关,与氢原子数有关。
例如:150℃时,CH4、C2H4完全燃烧前后的体积不变(即分子数不变),而C2H2燃烧前后的体积变小,C2H6等氢原子数大于4的烃燃烧前后的体积变大。
对于混合气体,求氢原子的平均原子数,亦可适用。
练习1:120℃时,下列气体物质(或混合物)各 a mol,在氧气中完全燃烧,燃烧前后体积不变的有(),燃烧前的体积大于燃烧后的体积的有(),燃烧前的体积小于燃烧后的体积的有()。
A、C2H2B、C2H4与C2H2C、C2H2与C3H6(1:1)D、C3H8与CH4(1:1)E、C2H4与C3H4答案:(C、E); (A、B); (D)2、同温同压下,1体积烃类完全燃烧,当生成的水为液态时(温度低于100℃)。
△V = V前– V后= 1 + x + y/4 – x =1 + y/4则必然△V ? 0, V前? V后,则燃烧前后气体的体积一定减小,这取决于氢原子数,氢原子数越多,体积减少的越多。
例如:在50℃时,1mol的C2H6燃烧前后气体体积减少要比1mol的C2H4体积减少的多。
高二化学烃类燃烧规律总结-炔烃的通式-炔烃的性质

烃类燃烧规律总结1.等物质的量的烃(CxHy)完全燃烧时,其耗氧量的大小取决于(x+)的值,其值越大,耗氧量越大。
2.等质量的烃完全燃烧时,其耗氧量的大小取决于该烃分子中氢的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量越大。
3.实验式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧后生成的二氧化碳和水的量均为定值。
满足该条件的烃有C2H2和C6H6、烯烃与环烷烃等。
4.说明:在计算烃的衍生物的耗氧量时可将其改写成CxHy·(CO2)m·(H2O)n,耗氧量仅由CxHy 决定。
5.质量相同的烃CxHy,越大,生成的CO2越多;若两种烃的相等,则生成的CO2和H2O的质量均相等。
6.碳的质量分数ω(c)相同的有机物(最简式可以相同也可以不同),只要总质量一定,以任意比混合,完全燃烧后产生的CO2的量总是一个定值。
7.不同的有机物完全燃烧时,若生成的CO2和H2O的物质的量之比相同,则它们分子中C原子、H原子个数比也相同.8.含碳量高低与燃烧现象的关系含碳量越高,燃烧现象越明显,表现在火焰越明亮.黑烟越浓,如C2H2(92.3%)、C6H6(92·3%)、C7H8 (91.3%)燃烧时火焰明亮,伴随大量浓烟;而含碳量越低,燃烧现象越不明显,往往火焰不明亮,无黑烟,如CH4(75%)就是如此;对于C2H4及其他单烯烃(均为85.7%).燃烧时火焰较明亮,并有少量黑烟。
气态烃CxHy完全燃烧后生成CO2和H2O当H2O为气态时(T>100℃),1L气态烃燃烧前后气体总体积的变化有以下三种情况:当y=4时,反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;当y>4时,反应后气体总体积增大;当y<4时,反应后气体总体积减小当H2O为液态时(T<100℃),1L气态烃完全燃烧后气体总体积减小炔烃的通式炔烃的通式:炔烃的通式是C n H2n-2炔烃:炔烃随分子碳原子数的增加,相对分子质量的增加,熔沸点逐渐升高,相对密度逐渐增大;炔烃中n≤4时,常温常压下位气态,其他未液态或固态;炔烃的相对密度一般小于水的密度;炔烃不溶于水,易溶于有机溶剂。
有机物燃烧计算归纳

有机物燃烧计算归纳有机物完全燃烧的通式:烃:CxHy+(x+y/4)O2→xCO2+(y/2)H2O烃的衍生物:CxHyOz+(x+y/4-z/2)O2→xCO2+(y/2)H2O一、烃及其含氧衍生物完全燃烧时耗氧量规律1.有机物的质量一定时:[1] 烃类物质(CxHy)完全燃烧的耗氧量与x/y成正比;【推导】设烃的质量为m ,含氢的质量分数为ω,有关系式C~O2~CO2 及4H~O2~2H2O可知该厅的耗氧量为:n(O2) = m(1-ω)/12 + mω/4= m/12 +mω/6当m 为定值时,ω值越大,耗氧量就越大。
a 对于等质量的烷烃,碳原子数越多,氢的质量分数越小,耗氧量越小,由此可知CH4的耗氧量最多。
b 对于等质量的单烯烃,因炭、氧的个数比为定值,氢的质量分数也为定值,即耗氧量相等。
c 对于等质量的炔烃,碳原子数越多,氢的质量分数越大,耗氧量越多,由此可知C2H2 的耗氧量最少。
d 等质量烷烃、单烯烃、炔烃,因为氢的质量分数关系导致耗氧量的关系如下:“烷烃﹥烯烃﹥炔烃”。
[2] 燃烧时耗氧量相同,则两者的关系为:⑴同分异构体或⑵最简式相同。
2.有机物的物质的量一定时:a 燃烧的通式法:即烃按(x+y/4)耗氧量越多直接比较;烃的衍生物按(x+y/4-z/2)进行比较即可。
b 变形法:若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为CxHy•(H2O)n 或CxHy•(CO2)m或CxHy•(H2O)n•(CO2)m形式,再按①比较CxHy的耗氧量。
二、烃及其含氧衍生物完全燃烧时生成CO2及H2O量规律1.将CxHy转换为CHy/x,相同质量的烃完全燃烧时y/x值越大,生成水的量越多,而产生的CO2量越少。
y/x相同,耗氧量,生成H2O 及CO2的量相同。
2.有机物的物质的量一定时,有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中碳原子或氢原子的个数一定;若混合物总物质的量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的量保持不变,则混合物中各组分中碳或氢原子的个数相同。
新版高中化学讲义(选择性必修第三册):烃的燃烧、共面问题

一、有机物完全燃烧的通式1.烃(C x H y ):_______________________________________________________________ 2.烃的衍生物(C x H y O z ):_____________________________________________________ 【答案】二、烃燃烧时耗氧量大小规律1.等物质的量的烃C x H y 完全燃烧,耗氧量取决于__________,该值越大,耗氧量越大; 2.等质量的烃C x H y 完全燃烧,耗氧量取决于__________,该值越大,耗氧量越大。
【答案】(x + y4) yx三、烃燃烧前后气体体积变化规律气态烃(C x H y )燃烧的通式为:C x H y + (x + y4) O 2xCO 2 +y 2H 2OC x H y 、O 2 、CO 2 均为气态,H 2O 可能为气态,也可能是液态,需分类讨论: 1. 若燃烧后温度高于100℃,则H 2O 为气态,体积变化为ΔV=(x + y 2)-(1 + x + y 4) =(y4-1)C x H y + (x + y4) O 2xCO 2 +y 2H 2OC x H y O z + (x + y4 - z2) O 2xCO 2 + y2 H 2O点燃点燃第11讲 烃的燃烧、共面问题知识导航模块一 烃的燃烧问题知识精讲点燃(1)y <4时,ΔV <0,燃烧后体积减小; (2)y =4时,ΔV =0,燃烧后体积不变; (3)y >4时,ΔV >0,燃烧后体积增大。
2. 若燃烧后温度低于100℃(恢复至室温),则H 2O 为液态,体积变化为ΔV = x - (1 + x + y 4) =(-1-y4)因为(-1-y4)<0,所以总体积一定减小。
一、常见有机物的分子结构二、有机物原子共面、共线的分析方法 1.复杂有机分子共面情况的分析思路①以甲烷、乙烯、乙炔、苯、甲醛的分子构型为基础,将复杂的有机物分子拆分成几个部分。
有机物燃烧规律

题型一:有机物的质量一定时: 1、烃类物质(CxHy)完全燃烧的耗氧量与y/x 成正比。 2、有机物完全燃烧时生成的CO2或H2O的 物质的量一定,则有机物中含碳或氢的质量分 数一定;若混合物总质量一定,不论按何种比 例混合,完全燃烧后生成的CO2或H2O的物质 的量保持不变,则混合物中各组分含碳或氢的 质量分数相同。 3、燃烧时耗氧量相同,则两者的关系为: ⑴同分异构体 或 ⑵最简式相同
题型四:有机物完全燃烧时生成的CO2和H2O的 物质的量之比一定时: 有机物完全燃烧时,若生成的CO2和H2O的物 质的量之比为a:b,则该有机物中碳、氢原子的 个数比为a:2b,该有机物是否存在氧原子,有 几个氧原子,还要结合燃烧时的耗氧量或该物 质的摩尔质量等其他条件才能确定。
例8 某有机物在氧气中充分燃烧,生成的水蒸气和二氧 化碳的物质的量之比为1:1,由此可以得出的结论是 A、该有机物分子中C:H:O原子个数比为1:2:1 B、分子中C:H原子个数比为1:2 C、有机物必定含O 答案:B、D D、无法判断有机物是否含O
有机物燃烧的规律是中学有机化学基础中的 常见题型,也是高考化学中的热点内容,许多学 生对这些知识点往往容易产生混淆,现将其归纳 总结如下: 有机物完全燃烧的通式: 烃: CxHy+(x+y/4)O2→xCO2+(y/2)H2O 烃的衍生物: CxHyOz+(x+ y/4 - z/2)O2→xCO2+(y/2)H2O
解析:产生的CO2与耗氧量的体积比为2:3,设该有 机物为1mol,则含2mol的C原子,完全燃烧时只能消耗 2mol的氧气,剩余的1mol氧气必须由氢原子消耗,所 以氢原子为4mol,即该有机物可以是A,从耗氧量相当 的原则可知B也正确。答案为A、B。
2、生成的CO2的物质的量等于消耗的O2的物 质的量的情况符合通式Cn· 2O)m (H 3、生成的CO2的物质的量小于消耗的O2的物 质的量的情况 ⑴若CO2和O2体积比为4∶3 ,其通式为 (C2O)n · 2O)m。 (H ⑵若CO2和O2体积比为2∶1 ,其通式为 (CO)n · 2O)m。 (H
有机物完全燃烧耗氧量规律

有机物完全燃烧耗氧量规律湖南省祁东县职业中专曹兵生邮编421600电话有机物完全燃烧耗氧量规律是高考化学有机部分的一个重点,通常以选择题形式出现,有时也以计算填空形式出现。
主要考查学生知识的灵活应用能力,现对这部分常考及遇到的规律总结如下:1mol某烃Cx Hy完全燃烧的反应方程式为:C x Hy+(x + y/4)O2xCO2+ y/2H2O1mol某烃的含氧衍生物完全燃烧的化学方程式为:C x HyOz+ (x + y/4 -z/2)O2xCO2+ y/2H2O由此可知,每摩烃完全燃烧时耗氧量相当于每摩烃中碳元素和氢元素分别燃烧时耗氧量之和(x +y/4)。
每摩烃的含氧衍生物完全燃烧时耗氧量为(x+y/4-z/2)。
1.等质量的烃(设为CxHy)完全燃烧时,把烃的分子式写成CHy/x,y/x越大耗氧量越大,生成的H2O越多,而生成的CO2越少。
2.等物质的量的烃(设为CxHy)完全燃烧时,耗氧量决定于“x+y/4”的值。
还可以按1个碳原子与4个氢原子的耗氧量相当转换成碳或氢原子个数相同后再进行比较。
生成CO2(或H2O)的量决定于x(或y)3.等物质的量的烃的衍生物(设为CxHyOz)完全燃烧时,耗氧量决定于“x+y/4-z/2”的值。
例1.等质量下列各类烃: 1. C6H62. C7H83. C4H104. C3H8,分别完全燃烧时,其耗氧量由大到小的顺序排列的是()A.1234 B.4321 C.2134 D.3412 答案:B例2.等质量的下列烃完全燃烧生成CO2和H2O时,耗氧量最多的是()A.C2H6B.C3H8C.C4H10D.C5H12答案:A例3.若1mol有机物在完全燃烧时,消耗的氧气的物质的量为(3n-1)/2 mol,则它的组成通式可能是()A.Cn H2nO B.CnH2n+2OC.Cn H2n-2D.CnH2n答案:AC4.总质量一定的混合物,只要各组分的最简式相同,则完全燃烧时,其耗氧量为定值而与混合物各组分的含量无关,恒等于同质量的某单一组分完全燃烧时的耗氧量。
有机物燃烧规律和有机物的除杂和分离专题

有机物燃烧规律有机物燃烧的规律是中学有机化学基础中的常见题型,也是高考化学中的热瀹内容,许多学生对这些知识点往往容易产生ⷷ淆,现将其彐纳总结如下:有机物完全燃烧的通式:烃:O H yxCO O y x CxHy 2222)4(+→++ 烃的衍生物:O H yxCO O z y x CxHyOz 2222)24(+→-++(一)物质的量相同的烃完全燃烧:耗氧量由x+y/4决定; 生成CO 2由x 决定; 生成H 2O 由y 决定。
(二)质量相同的烃完全燃烧:耗氧量由y/x 决定; 生成CO 2由含碳量决定; 生成H 2O 由含氢量决定。
推论.总物质的量相等,任意比例混合,耗氧量相等。
而且:①生成CO 2的量相等:则分子中含碳原子数相等,即分子式符合C x H y ·m(H 2O) ,如乙醇和乙烯。
②生成H 2O 的量相等:则分子中含氢原子数相等,即分子式符合C x H y ·m(CO 2) ,如乙酸和甲烷。
例2、 充分燃烧等物质的量的下列有机物,相同条件下需要相同体积氧气的是( ) (A )乙烯、乙醛 ( B )乙酸乙酯、丙烷 (C )乙炔、苯 (D )环丙烷、丙醇 例3、下列各组有机物中不论二者以什么比例混合,只要总物质的量一定,则完全燃烧时生成水的质量和消耗氧气的质量不变的是( )(A )C 3H 8、C 4H 6 (B )C 3H 6、C 4H 6O 2 (C )C 2H 2、C 6H 6 (D )CH 4O 、C 3H 4O 5例3、下列各组有机物中不论二者以什么比例混合,只要总质量一定,则完全燃烧产生的二氧化碳的质量不变的是( )(A )C 2H 2和C 3H 6 (B )C 2H 4O 2和C 6H 12O 6 (C )C 3H 6和C 4H 6O 2 (D )CH 4和C 10H 8O 2 (三)烃燃烧前后体积变化规律: 温度不变,烃燃烧的通式:O H yxCO O y x CxHy 2222)4(+→++1、温度低于100℃,(水是液态)气态烃CxHy 完全燃烧时:△V =V 后-V 前=-(1+y/4),即气体体积总减少,反应后压强总减小。
有机物化学方程式

+HO—SO3H +H2O
(苯磺酸)
(3)加成反应
(环己烷)
苯还可以和氯气在紫外光照射下发生加成反应,生成C6H6Cl6(剧毒农药)。
5.甲苯
(1)氧化反应
甲苯的燃烧:C7H8+9O27CO2+4H2O
甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应
甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),
烷烃通式:CnH2n+2
(1)氧化反应
甲烷的燃烧:CH4+2O2CO2+2H2O
甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应
一氯甲烷:CH4+Cl2CH3Cl+HCl
二氯甲烷:CH3Cl+Cl2CH2Cl2+HCl
三氯甲烷:CH2Cl2+Cl2CHCl3+HCl(CHCl3又叫氯仿)
四氯化碳:CHCl3+Cl2CCl4+HCl
是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
(3)加成反应
(甲基环己烷)
6.溴乙烷
纯净的溴乙烷是无色液体,沸点38.4℃,密度比水大。
(1)取代反应
溴乙烷的水解:C2H5—Br+NaOHC2H5—OH+NaBr
苯酚是无色晶体,露置在空气中会因氧化显粉红色。苯酚具有特殊的气味,熔点
43℃,水中溶解度不大,易溶于有机溶剂。苯酚有毒,是一种重要的化工原料。
(1)苯酚的酸性
(苯酚钠)
2
有机物燃烧的规律及有关计算

勤奋!博学!笃志!感恩!专题:有机物燃烧的规律及有关计算一、烃完全燃烧前后气体体积的变化完全燃烧的通式:C x H y +(x+4y )O 2xCO 2+2y H 2O (1) 燃烧后温度高于100℃时,水为气态:14y V V V ∆=-=-后前 ① y =4时,V ∆=0,体积不变;② y>4时,V ∆>0,体积增大;③ y<4时,V ∆<0,体积减小。
(2) 燃烧后温度低于100℃时,水为液态:14y V V V ∆=-=+后前 ※ 无论水为气态还是液态,燃烧前后气体体积的变化都只与烃分子中的氢原子个数有关,而与烃分子中的碳原子数无关。
【典例分析】a mL 三种气态烃的混合物与足量的氧气混合点燃爆炸后,恢复到原来的状态(常温常压),体积共缩小2a mL 。
则三种烃可能是( A )A 、CH 4、C 2H 4、 C 3H 4B 、C 2H 6、C 3H 6、C 4H 6C 、CH 4、C 2H 6 、C 3H 8D 、C 2H 4、C 2H 2、CH 4【对应练习】.1.01×105 Pa 、150℃时,将1 L C 2H 4、2 L C 2H 6与20 L O 2混合并点燃,完全反应后O 2有剩余。
当反应后的混合气体恢复至原条件时,气体体积为( D )A .15 LB .20 LC .23 LD .24 L二、烃类完全燃烧时所耗氧气量的规律完全燃烧的通式:C x H y +(x+4y )O 2xCO 2+2y H 2O (1) 相同条件下等物质的量的烃完全燃烧时,(x+4y )值越大,则耗氧量越多; (2) 质量相同的有机物,其含氢百分率(或y x 值)越大,则耗氧量越多; (3) 1mol 有机物每增加一个CH 2,耗氧量多1.5mol ;(4) 1mol 含相同碳原子数的烷烃、烯烃、炔烃耗氧量依次减小0.5mol ;(5) 质量相同的C x H y ,x y 值越大,则生成的CO 2越多;若两种烃的x y值相等,质量相同,则完全燃烧耗氧量、生成的CO 2和H 2O 均相等。
高中化学选修5知识点整理(可编辑修改word版)
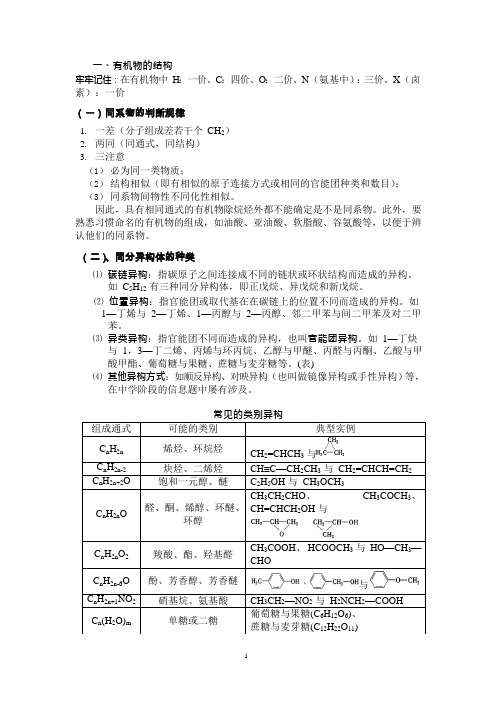
一、有机物的结构牢牢记住:在有机物中H:一价、C:四价、O:二价、N(氨基中):三价、X(卤素):一价(一)同系物的判断规律1.一差(分子组成差若干个CH2)2.两同(同通式,同结构)3.三注意(1)必为同一类物质;(2)结构相似(即有相似的原子连接方式或相同的官能团种类和数目);(3)同系物间物性不同化性相似。
因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物。
此外,要熟悉习惯命名的有机物的组成,如油酸、亚油酸、软脂酸、谷氨酸等,以便于辨认他们的同系物。
(二)、同分异构体的种类⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
(表)⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
常见的类别异构组成通式可能的类别典型实例C n H2n 烯烃、环烷烃CH2=CHCH3与C n H2n-2 炔烃、二烯烃CH≡C—CH2CH3与CH2=CHCH=CH2C n H2n+2O饱和一元醇、醚C2H5OH 与CH3OCH3C n H2n O 醛、酮、烯醇、环醚、环醇CH3CH2CHO、CH3COCH3、CH=CHCH2OH 与C n H2n O2 羧酸、酯、羟基醛CH3COOH、HCOOCH3与HO—CH3—CHOC n H2n-6O酚、芳香醇、芳香醚与C n H2n+1NO2 硝基烷、氨基酸CH3CH2—NO2与H2NCH2—COOHC n(H2O)m单糖或二糖葡萄糖与果糖(C6H12O6)、蔗糖与麦芽糖(C12H22O11)(三)、同分异构体的书写规律书写时,要尽量把主链写直,不要写得扭七歪八的,以免干扰自己的视觉;思维一定要有序,可按下列顺序考虑:1.主链由长到短,支链由整到散,位置由心到边,排列邻、间、对。
高中化学解燃烧计算题的五种思路学法指导

高中化学解燃烧计算题的五种思路有机物燃烧题是高考中常考常新的题型之一,解此类题,如具备以下五种意识,就能做到以不变应万变。
一. 燃烧规律思路1. 等物质的量的烃)H C (m n 完全燃烧时,耗氧量的多少决定于4m n +的值,4m n +的值越大,耗氧量越多,反之越少。
2. 等质量的烃)H C (m n 完全燃烧时,耗氧量的多少决定于氢的质量分数,即n m 的值,n m 越大,耗氧量越多,反之越少。
3. 等质量的烃)H C (m n 完全燃烧时,碳的质量分数越大,生成的2CO 越多;氢的质量分数越大,生成的O H 2越多。
4. 最简式相同的烃无论以何种比例混合,都有:①混合物中碳氢元素的质量比及质量分数不变;②一定质量的混合烃完全燃烧时消耗2O 的质量不变,生成的2CO 的质量均不变。
5. 对于分子式为m n H C 的烃:①当4m =时,完全燃烧前后物质的量不变;②当4m <时,完全燃烧后物质的量减少;③当4m >时,完全燃烧后物质的量增加。
例1. 下列各组混合物中,总质量一定时,二者以不同比例混合,完全燃烧时生成2CO 的质量不为定值的是( )A. 甲烷、辛醛B. 乙炔、苯乙烯C. 乙烯、庚烯D. 苯、甲苯解析:混合物总质量不变,以任意比例混合时,生成2CO 相等,即含碳量相等(质量分数),据此规律,不为定值的是D 。
答案:D例2. 相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )A. 43H C 和62H CB. 63H C 和283O H CC. 263O H C 和O H C 83D. O H C 83和264O H C解析:有机物充分燃烧时,1mol 碳原子消耗1mol 氧气,4mol 氢原子消耗1mol 氧气。
由分子式分别可推出,A 为4mol 、3.5mol ,B 为4.5mol 、4mol ,C 为3.5mol 、4.5mol ,只有D 答案符合(也可将D 变成O H H C 263⋅、263CO H C ⋅)。
【干货】有机物燃烧规律总结

【干货】有机物燃烧规律总结!一、等物质的量的有机物完全燃烧消耗O2,生成H2O与CO2的量的比较等物质的量的烃完全燃烧耗氧量由(x + y/4)值决定,(x + y/4)的值越大,消耗氧气的量就越多,若两种烃的(x + y/4)值相等,耗氧量就相同。
物质的量相等的烃C x H y和完全可拆成形式为C x H y·(CO2)m·(H2O)n的烃的衍生物分别完全燃烧后,它们消耗的O2的量相同。
【例题1】燃烧相同物质的量的下列有机物,消耗氧气最多的是A.乙醛 B.乙醇 C.乙二醇 D.甲酸甲酯解析: 将四个选项作如下变形:A:C2H4O → C2H2·(H2O) B:C2H6O → C2H4·(H2O)C:C2H6O2→ C2H2·(H2O)2 D:C2H4O2→ C2·(H2O)2经变形后“H2O”不再耗氧,耗氧量仅决定于非“H2O”部分,通过比较容易得出出答案B正确。
答案:B点拨:在总物质的量相同的前提下,由符合上述条件的有机物组成的混合物,无论以何种比例混合,消耗氧气的量相同,且等于等物质的量的任一组分的耗O2量(如CH4和CH3COOH以及C2H4和C2H5OH等)。
二、等质量的有机物完全燃烧消耗O2,生成H2O与CO2的量的比较1 mol C(12 g)完全燃烧消耗1 mol O2,4 mol H(4 g)完全燃烧消耗1 mol O2,所以质量相同的烃完全燃烧,w(H)越高,消耗的O2的量越大,生成的H2O的量也就越多。
通常将CxHy变换为CHy/x,y/x值越大,w(H)就越高,消耗O2的量就越多。
按照题目要求有时还将CxHy变换为Cx/yH,x/y值越大,w(C)就越高,生成的CO2的量就越多。
若两种烃的x/y值相等,即具有相同最简式的有机物(或最简式相同的有机物无论以何种比例混合),完全燃烧时,耗O2的量相同,生成的H2O及CO2的量也相同。
常见有机物的燃烧规律 PPT

如何利用这些信息很关键。由表中信息可得出两点 结论;一是烷烃同系物和烯烃同系物随分子中碳原 子的增多,沸点逐渐升高;二是相同碳原子数的烷烃 和烯烃沸点不同。第(3)问需要利用表中沸点数据, 该生没能利用好这一信息,还是主观地认为烷烃与 烯烃的性质不同,很盲目地使用溴水,认为溴水与烯 烃反应,与烷烃不反应这是二者最大的不同,没看清 题目要求是将两气体分离而不是鉴别。至于第(2) 中的②,该生多选了B,两种有机物分子式分别为 C6H10和C6H12,等物质的量的二者燃烧,耗氧量明显 不同,但生成CO2的量相同,该生答非所问。
的CO2最多;
n(
H 2O1 2 )n(
H 1)14 、114 、
216228
123106,121164最大,故CH4生成的H2O最多。
(4)温度≥100℃条件下,当烃分子中含有4个氢原子
时,该烃完全燃烧前后气体体积不变,y=4的为CH4、
C2H4,故答案为CH4、C2H4。
答案 (1)CH4
(2)C2H6
2.现有CH4、C2H4、C2H6三种有机物: (1)等质量的以上物质完全燃烧时耗去O2的量最多
的是_______;
(2)同状况、同体积的以上三种物质完全燃烧时耗
去O2的量最多的是______; (3)等质量的以上三种物质燃烧时,生成二氧化碳最
多的是_____,生成水最多的是_____。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 D.苯不能使酸性KMnO4溶液褪色,因此苯不能发生
氧化反应
解析 CCl4可由CH4和氯气光照取代制得,可萃取 碘水中的碘,A正确;石油和天然气的主要成分都是
有机物燃烧的有关计算技巧

有机物燃烧的有关计算技巧一.有机物燃烧通式:1.烃的燃烧通式:2.烃的衍生物燃烧通式:二.相同量的有机物在相同条件下充分燃烧,所需氧气量的比较:1.物质的量相同:耗氧量可根据的值来比较。
2.质量相同——采用“”法:当时最大,∴烷烃中耗氧最多。
烯烃的耗氧量相同。
当时最小,∴在炔烃中耗氧最少。
当时最小,∴在其中耗氧最少。
总结:当质量相同的烃完全燃烧时,耗氧量取决于y/x的比值大小,比值越大耗氧量就越大。
三.混合物总量一定时的计算:1.总质量相等,任意混合:生成相等,即含碳量相等;生成相等,即含氢量相等。
(1)相对分子量相等:指同分异构体。
(2)相对分子量不相等:2.总物质的量相等,任意混合耗氧量相等:(1)生成相等:指分子中C原子数相等,即;(2)生成相等:指分子中H原子数相等,即。
四. 混合气体的成分确定:1.差量法:1 (液)1 (气)利用的变化,可确定分子式中含H量。
2.守恒法【典型例题】[例1]在常温常压下,下列烃各,分别在足量的氧气中燃烧,消耗氧气最多的是()。
A. B. C. D. E.答案:E[例2]充分燃烧等物质的量的下列有机物,在相同条件下,需要氧气最多的是()。
A.乙酸乙酯B.异丁烷C.乙醇D.葡萄糖分析:A.B.C.D.启示:将含氧衍生物中的氧转化为或,意味着这一部分不耗氧,然后再来比较其余部分耗氧量。
[例3]相同质量的烃完全燃烧,消耗量最多的是()。
A.丙烷B.丁烯C.已炔D.苯答案:A分析:一般情况下,烃均可转化为的形式,越大耗氧量越大。
A. B. C. CH D. CH启示:质量相同的有机物完全燃烧:(1)有机物的最简式相同,耗氧量相同。
(2)当烃用表示时,越大,耗氧量越多。
[例4] A、B是相对分子量不相等的两种有机物,无论A、B以何种比例混合只要混合物的总质量不变,完全燃烧后,所产生的水的质量也不变。
试写出两组符合上述情况的有机化合物的化学式,并回答A、B应满足什么条件。
对《等质量有机物完全燃烧时耗氧量的比较》一文的意见

对《等质量有机物完全燃烧时耗氧量的比较》一文的意见佚名
【期刊名称】《化学教学》
【年(卷),期】1991(0)3
【摘要】四川省开县陈家中学张军说贵刊1990年第1期《等质量有机物完全燃烧时耗氧量的比较》一文的结论“质量相等的烃或烃的含氧衍生物在氧气中完全燃烧时,它们的分子中氢元素的质量百分比越大,耗氧量就越大”是错误的。
例
如,C<sub>14</sub>H<sub>10</sub>(蒽)中氢元素的质量百分比
【总页数】1页(P50-50)
【正文语种】中文
【中图分类】G633.8
【相关文献】
1.完全燃烧时耗氧量相等的等质量有机物最简式肯定相同吗? [J], 李雪领
2.烃及烃的含氧衍生物完全燃烧耗氧量公式 [J], 詹才书;周银波
3.也谈等质量有机物完全燃烧时耗氧量的比较 [J], 钱雪良
4.对《等质量有机物完全燃烧时耗氧量的比较》一文的异议 [J], 柳百好
5.等质量有机物完全燃烧时耗氧量的比较 [J], 王友福
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学之有机物完全燃烧耗氧量规律
烃完全燃烧耗氧量规律
(1)1摩尔烃燃烧耗氧量“等碳,1/4氢”
分析:1mol某烃CxHy完全燃烧的反应方程式为:
CxHy+(x+y/4)O2xCO2+y/2H2O
由此可知,每摩烃完全燃烧时耗氧量相当于每摩烃中碳元素和氢元素分别燃烧时耗氧量之和,(x+y/4)。
例:1.常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是(B)
A、甲烷
B、乙烷
C、乙炔
D、乙烯
2.1mol的某烷烃完全燃烧,需要8mol的氧气,这种烷烃的分子式是(C)
A、C3H8
B、C4H10
C、C5H12
D、C6H14
等质量的烃类完全燃烧时耗氧量规律质量相同的烃类完全燃烧时,耗氧量最多的是含氢量最高的耗氧量最少的是含碳量最高的。
例:1.等质量下列各类烃,分别完全燃烧时,其耗氧量由大到小的顺序排列的是1.C6H6 2.C7H8 3.C4H10 4.C3H8
A、1234
B、4321
C、2134
D、3412
答案:B
2.等质量的下列烃完全燃烧,生成CO2和H2O时耗氧量最多的是()
A、C2H6
B、C3H8
C、C4H10
D、C5H12
答案:A
3.等质量的下列烃,完全燃烧时消耗O2最多的是()
A、甲烷
B、乙烷
C、乙炔
D、乙烯
答案:A
烃的含氧衍生物完全燃烧时耗氧量规律1mol某烃的含氧衍生物完全燃烧的化学方程式为:
CxHyOz+(x+y/4-z/2)O2xCO2+y/2H2O 即:“等碳,1/4氢,去1/2氧”。
例:若1mol有机物在完全燃烧时,消耗的氧气的物质的量为(3n-1)/2mol,则它的组成通式可能是()
A、CnH2nOB、CnH2n+2O
C、CnH2n-2D、CnH2n
总质量一定的混合物,只要各组分的最简式相同,则完全燃烧时,其耗氧量为定值而与混合物各组分的含量无关,恒等于同质量的某单一组分完全燃烧时的耗氧量。
答案:A、C
例:取W克下列各组混合物,使之充分燃烧时,耗氧量跟混合物中各组分的质量比无关的是()
A、HCHO、HCOOCH3
B、CH3CH2OH、CH3COOH
C、CH2=CH-CH=CH2、C2H4
D、C2H2、C6H6
分析:HCHO和HCOOCH3,因为最简式相同,在总质量一定时,二者不论以何种比例混合,混合物中C、H、O元素的质量为定值,所以耗氧量为定值,故选A。
同理可选出D。
总物质的量一定的混合物,只要各组分每mol 物质的耗O2量相同,则完全燃烧时,其耗氧量为定值而与混合物中各组分的含量无关。
答案:A、D
例:下列各组混合物中,无论以何种比例混合,取Nmol使之充分燃烧,耗氧量为定值的是()
A、C2H2、C2H4O
B、C2H4、C3H6
C、C2H4、C2H6O
D、C6H12O6、C2H4O2
分析:C2H2和C2H4O分别完全燃烧时,其每mol耗O22.5mol,而C2H4和C2H6O分别完全燃烧时,其每mol耗O23mol,故选A、C。
由此可知:CnH2
n和CnH2n+2O、CnH2n-2和CnH2nO两物质不论以何种比例混和时,只要总物质的量一定,完全燃烧时耗氧量为定值。
答案:A、C。
