HILIC色谱柱介绍
HILIC色谱柱简介

HILIC色谱柱简介:1. HILIC的概念亲水色谱(HILIC)是一种用来改善在反相色谱中保留较差的强极性物质保留行为的色谱技术。
它通过采用强极性固定性,并且结合高比例有机相/低比例水相组成的流动相来实现这一目的。
而这样的流动相组成尤其有利于提高电喷雾离子化质谱(ESI-MS)的灵敏度。
2. HILIC的分离机制HILIC的分离机理在目前还存在着争议,主要包括以下三个方面:(1)分配机理(2)离子交换(3)偶极-偶极相互作用。
更多的试验现象则表明HILIC的保留机理包含氢键作用、偶极作用和静电作用等多种次级效应,很难将其区分开来。
”HILIC方法开发经验大披露:1. HILIC色谱柱的以waters 公司的HILIC色谱柱为例,分为HPLC和UPLC两种类型,又分为Atlantis,Xbridge,Acquity三个品牌。
填料类型分为BEH,无封尾和Amide填料三种。
2. HILIC色谱柱的应用范普通反向色谱难以保留的物质。
3.HILIC的对化合物的保留原理:亲水性吸附,离子交换和氢键作用。
应用小TIPS:1.HILIC柱如何平衡?HILIC柱使用70%的乙腈水溶液平衡。
2.HILIC柱如何保存?HILIC柱使用90%的乙腈水溶液保存。
前言:1. 一直使用Waters 的HILIC较多,感觉质量还行,但是要小心waters 的HILIC是分两种类型的填料的BEH HILIC和HILIC。
很多waters 的销售都不清楚之一点。
但是大家一定要注意,这两款的区别是很大的,保留的效果是不同的。
2. 费罗门公司的HILIC柱,感觉是小家碧玉型的,保留能力不是太强,但是清秀文雅,峰型很好看。
3. HILIC的流动相推荐使用乙腈。
4. 推荐使用乙酸铵,这也以后再说。
5.不能使用100% 的乙腈,推荐使用到95%就行了。
不能使用60%一下的乙腈。
所以梯度范围小。
但是足够用了。
因为100%的乙腈可能对HILIC的中亲水的部分不利于键合相的伸展开。
默克---HILIC柱介绍

affected during eluent optimization.
0
1
2
Retention Time (min)
Injection #1001
Injection #501
BSFBMTPEJTQMBZFE
PDUBOPMXBUFSQBSUJUJPODPFGGJDJFOU
Toluene 甲苯
Hexane 正己烷
2
3
Analyte LogP *
3PCVTU[XJUUFSJPOJDTPSCFOU 强劲的两性离子吸附剂
The ZIC®-HILIC Column is designed to retain and separate all types
通常都很小甚至是负值, normally characterized by a small or negative LogP value*
在反相色谱上保留很弱。 and have poor retention on reversed-phase columns.
The ZIC®-HILIC Column is designed to retain and separate
????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
亲水作用色谱HILIC实用指南

指导与应用手册· 1亲水作用色谱 HILIC实用指南指导与应用手册2 · HILIC实用指南亲水作用色谱(HILIC)实用指南原著作书名:A Practical Guide to HILIC原著作者:Patrik Appelblad, Tobias Jonsson, Einar Pontén, Camilla Viklund and Wen Jiang中文版编辑:Wen Jiang (江文)ISBN 978-91-631-8370-6瑞典SeQuant AB出版, 地址: Box 7956, 907 19 Umeå, Sweden.版权所有© 2005-2008, SeQuant AB2008年2月第一版,第一次印刷,瑞典于默奥(Umeå)修订及额外资料可以在Merck SeQuant公司网页上找到,网址。
如有其它问题及信息反馈,请与info@联系。
HILIC实用指南–指导与应用手册引言本手册旨在介绍一种适用于分析强极性和强亲水化合物的液相色谱分析方法–亲水作用液相色谱(H ydrophilic I nteraction Li quid C hromatography,HILIC)。
主要介绍HILIC的基本理论和该分离模式下的一些实际问题,同时给读者介绍瑞典SeQuant 公司的ZIC ®-HILIC(硅胶基质)和ZIC ®-p HILIC(聚合物基质) 两性离子液相色谱柱(见图1),以及使用这两种色谱柱分析不同类型亲水化合物的应用实例。
您也会从本手册中获得该类色谱和其他方面的色谱知识。
图1 ZIC ®-HILIC和ZIC ®-p HILIC两性离子固定相的官能团如果本手册不能解决您的HILIC 问题,SeQuant愿为你提供进一步帮助。
首先,建议您登陆SeQuant 公司网站主页(),从那您能找到关于我们产品的最新文献资料、应用报告和技术数据。
HILICpak VG-50 4E柱子使用说明

HILICpakVG-504E柱子使用说明
1、避免压力和温度的急剧变化及任何机械震动。
温度的突然变化或者使色谱柱从高处掉下都会影响柱内的填充状况;柱压的突然升高或降低也会冲动柱内填料,因此,在调节流速时应该缓慢进行,在阀进样时阀的转动不能过缓。
2、应逐渐改变溶剂的组成,特别是反相色谱中,不应直接从有机溶剂改变为全部是水,反之亦然。
3、一般说来色谱柱不能反冲,只有生产者指明该柱可以反冲时,才可以反冲除去留在柱头的杂质。
否则反冲会迅速降低柱效。
4、选择使用适宜的流动相(尤其是pH),以避免固定相被破坏。
有时可以在进样器前面连接一预柱,分析柱是键合硅胶时,预柱为硅胶,可使流动相在进入分析柱之前预先被硅胶“饱和”,避免分析柱中的硅胶基质被溶解。
亲水作用(Hilic)色谱简介,以及和正相色谱相、反相色谱比较

亲水作用(H i l i c)色谱,有时被称为“含水正相色谱”,有时又被称为“反反相色谱”,简单来说,是极性的固定相和极性的流动相组成,参考表1,在固定相方面,看似和正相色谱一样,那么,同一款色谱柱是否既可以用于正相色谱,又可以用于H i l i c色谱?在流动相方面,和反相色谱接近,那两种模式保留行为和流动相对保留的影响规律有什么差异?你对H i l i c色谱是否也疑惑重重?接下来让我们一起揭开亲水作用(H i l i c)色谱的神秘面纱吧。
表1 反相、正相、Hilic色谱对比一、Hilic简介1.1流动相在大多数的Hilic分离中,采用的流动相为含有少量水/缓冲液与有机相混合(典型的是乙腈),水的比例为3%-40%之间。
水的比例不低于3%是由于Hilic色谱的保留机理决定的,普遍认为Hilic色谱流动相中的水会被吸附到极性固定相的表面形成水膜,然后分析物在水膜和流动相之间进行液液分配作用,加上极性官能团和固定相之间的氢键作用力,离子官能团之间的静电作用力等,实现被分析物的保留。
水膜的作用非常重要,所以Hilic流动相中至少含有3%的水。
当水的比例大于40%时,保留一般很弱(k≈0)。
1.2固定相应用于Hilic色谱的固定相有:纯硅胶柱、氨基柱、二醇基柱、酰胺基柱等。
纯硅胶柱有固定相不易流失的优点,在使用CAD、ELSD和LC-MS检测器时,最受欢迎;氨基柱,在Hilic 色谱中的应用,特别适合碳水化合物(糖类)分离;二醇基柱,亲水性很好,可以提供不同的选择性。
二、Hilic和正相色谱相比2.1固定相的区别同样是Silica,NH2,Diol柱,与用于正相色谱中的色谱柱不同,专为Hilic色谱设计的色谱柱,可以用于水/有机物的流动相中,换句话说,Hilic色谱对固定相的耐水性要求更高,否则会因固定相的水解,出现基线噪音大、色谱柱寿命短等问题。
所以用于正相色谱中的色谱柱,不一定能用于Hilic色谱。
HILIC 色谱柱的使用

如下是有关HILIC色谱柱的使用:色谱柱的平衡• HILIC色谱柱的平衡使用50倍柱体积的50/50的乙腈/水相缓冲溶液(缓冲液的最终浓度为10mM)平衡新色谱柱 在开始进样前,用20倍柱体积的起始流动相平衡色谱柱进行梯度分析时,进样间隔需要用10倍柱体积起始流动相平衡色谱柱说明:色谱柱平衡不充分将导致保留时间漂移流动相需要注意的问题• HILIC流动相需要注意的问题流动相中总是至少保持5%的极性溶剂(如5%水相缓冲液,5%甲醇或3%甲醇/2%水相缓冲液等),这保证Atlantis HILIC硅胶填料始终被水浸润在流动相或梯度中至少保持有机溶剂(如乙腈)的比例不低于40%不要使用磷酸盐缓冲溶液体系,因为磷酸盐缓冲液在HILIC色谱模式下会析出;使用磷酸则没有问题缓冲系统如甲酸铵或乙酸铵水溶液比甲酸或乙酸的水溶液有重现性更好的结果。
如果不能使用缓冲液而一定要使用流动相添加剂如甲酸,最好使用0.2%的浓度而非0.1% 为得到最好的峰形,在流动相或梯度中总是保持缓冲系统的浓度为10mM进样溶剂需要注意的问题• HILIC进样溶剂需要注意的问题如果可能,尽量用100%乙腈溶解样品进样。
避免使用水配制样品溶液,请选择较弱的HILIC 溶剂如乙腈、甲醇、异丙醇等配制样品溶液。
最常用的进样溶剂为75/25 乙腈/甲醇,这个体系充分平衡了样品的溶解度和峰形两个因素。
不要用水或DMSO做进样溶剂,它们将导致峰形变得很差;使用反相SPE技术将水或DMSO置换成乙腈再进样。
如果不能这样操作,用有机溶剂稀释水或DMSO。
的建议• 其它有关使用HILIC的建议开始时可以运行一个95%乙腈至50%乙腈的梯度,如果样品不保留,使用95/3/2乙腈/甲醇/水相缓冲溶液的流动相进行等度分析将流动相中的水换成甲醇、丙酮或异丙醇也可以增加极性化合物的保留请确保弱洗针溶剂/冲洗溶剂包含和流动相一样的高比例有机相,否则峰形会受到影响。
hilic色谱柱流动相选择

hilic色谱柱流动相选择
HILIC色谱柱流动相选择是一种分析技术,它可以用来分离和检测由多种不同物质组成的有机体。
它的原理是使用氢氧化减酸的作用使用离子交换机(IEC)或氢氧化减酸机(HILIC)技术将目标物和伴随物从混合溶液中分离开来。
这两种技术都是在液相色谱(LC)柱上进行数据分析的。
IEC 技术是使用正离子交换剂对有机物进行分离,而HILIC技术则是使用负离子交换剂。
HILIC色谱柱流动相选择在分析中常常使用一种特殊的溶剂,叫做乙腈,因为它能够有效地分离具有不同电荷的物质。
乙腈的电荷足以使少量的质子离子保持稳定,从而形成溶解度较高的溶液。
另外,由于乙腈的性质,它有助于将混合物中的离子形式和非离子形式的物质分离开来,并使得用于分析的物质能够更快地从柱中释放出来。
HILIC色谱柱介绍

HILIC色谱柱介绍HILIC(Hydrophilic Interaction Liquid Chromatography)是一种基于水性相互作用的色谱技术。
与传统的反相色谱相比,HILIC色谱具有许多独特的优点,在许多研究领域中得到了广泛的应用。
HILIC色谱是一种液相色谱技术,涉及在含水流动相中使用水亲和性固定相材料。
与反相色谱不同,HILIC色谱是在极性流动相中分离极性化合物。
这些化合物通过极性流动相中的水性分区相和水相关的分区系数来进行分离。
相比之下,反相色谱使用非极性流动相进行分离,根据化合物的亲水性来分离化合物。
HILIC色谱具有许多优点。
首先,它适用于分析极性化合物,这些化合物在反相色谱中可能很难分离。
HILIC色谱对于亲水性化合物,如水溶性维生素、氨基酸和糖类化合物的分离具有很高的选择性和灵敏性。
其次,HILIC色谱不需要在样品和固定相之间添加有机溶剂,因此有利于对生物样品进行分析,如血浆、尿液和蛋白质样品。
此外,HILIC色谱还能够分离极性化合物的异构体和同分异构体,有助于解决化合物纯度和杂质分析问题。
HILIC色谱柱的选择是该技术成功应用的关键。
目前市场上有许多不同类型的HILIC色谱柱可供选择。
根据固定相材料的特性,可以将HILIC色谱柱分为两大类:吸附型HILIC色谱柱和离子交换型HILIC色谱柱。
吸附型HILIC色谱柱是通过将水亲和性的高分子有机化合物固定在色谱柱中来实现分离。
这些固定相材料通常是通过化学修饰或共价交联来实现的,以增加固定相的亲水性。
常见的吸附型HILIC色谱柱固定相材料包括亲水性羟乙基磺酸酯、碳水化合物、氨基酸和糖类衍生物等。
这些材料具有良好的亲水性,并且能够在水性条件下提供良好的分离效果。
离子交换型HILIC色谱柱是通过在色谱柱中使用离子交换材料来实现分离的。
这些材料具有固有的离子交换特性,可以在水性条件下提供选择性分离。
离子交换型HILIC色谱柱的固定相材料通常是在无机载体上固定有离子交换基团,如硅胶或硅氧烷。
amide色谱柱与hilic的区别

amide色谱柱与hilic的区别
Amide色谱柱和HILIC色谱柱都是用于分析极性化合物的色谱柱,但两者之间也存在一些差异。
●相似之处
1.Amide色谱柱和HILIC色谱柱都利用亲水性相互作用来保留极性化合物。
2.两者都能够分离各种类型的极性化合物,包括糖、氨基酸、核苷酸、有机酸和药物等。
3.两者都需要使用含有水或乙腈等亲水性溶剂的流动相。
●区别
1.Amide色谱柱的固定相是酰胺键合相,而HILIC色谱柱的固定相是含有亲水性官能团的键合相,例如diol、zwitterion或强阳离子交换树脂。
2.Amide色谱柱的保留机制主要涉及亲水性相互作用和氢键作用,而HILIC 色谱柱的保留机制主要涉及亲水性相互作用、离子交换作用和疏水性相互作用。
3.Amide色谱柱通常用于分析中性或弱酸性极性化合物,而HILIC色谱柱通常用于分析强酸性或碱性极性化合物。
4.Amide色谱柱的pH范围通常为2-11,而HILIC色谱柱的pH范围通常为1-9。
●总结
Amide色谱柱与HILIC色谱柱都是用于分离极性化合物的色谱柱,但两者之间存在一些关键的区别。
选择哪种色谱柱取决于要分离的化合物的类型。
PC_HILIC_介绍资料

0
5
[ min ]
10
他社HILIC colums比較
A: ZIC-HILIC 5μm
B: Atlantis HILIC silica C: TSKgel Amide-80 D: Acclaim Mixed HILIC-1 E: Inertsil Diol
(Merck)
(Waters) (Tosoh) (Dionex) (GL Science)
Amitriptyline (pKa=9.4)
C社
N=2660 As=1.83 Tailing
峰脱位 ⇒ 定量性差 Amitriptyline (pKa=9.4) N=19800 As=1.13 理论塔板数提高 峰型改善
PC
0
5
10
[ min ]
C社HILIC填料的结构概图
疎水性 親水性 Silica 水和层被破坏 表面硅醇基(Si-OH)暴露
cytosine
Silica + PC
Silica
0 2 4 6 8 [ min ] 10 12 14 16
移動相中 CH3CN含量
50%
氨甲环酸(两性物质)的分析
60%
70%
HPLC conditions Column Column temp. Mobile phase Flow rate
: 2.0 mm i.d. x 150 mm, 5 m : 45 º C : 0.1% HCOOH, x%CH3CN : 0.25 mL/min
CAPCELL PAK MF CAPCELL PAK SCX 強陽離子交換 Ceramospher chiral RU-2 CAPCELL PAK ACR 手性分析
专利技术PC磷酸胆碱表面修饰新型色谱填料
亲水作用色谱HILIC

亲水作用色谱HILIC亲水作用色谱(Hydrophilic Interaction Chromatography,HILIC)是一种基于相互作用原理的色谱技术,在许多领域中得到广泛应用。
相比于常规的反相色谱和离子交换色谱,HILIC具有独特的优势,能够有效地分离具有极性、亲水性及离子性特征的化合物。
HILIC分离技术的原理基于样品溶剂与固定相之间的水合作用。
传统的反相色谱使用非极性固定相和极性溶剂进行分离,而HILIC则使用极性固定相和非极性或含有一定水含量的溶剂。
这种水合作用可以通过氢键结合、疏水-极性相互作用等力学实现。
在HILIC中,固定相通常是富含极性基团的材料,如硅胶、氨基硅胶、氢氧化铯等。
而常用的流动相包括水、甲醇、乙腈等含有一定水含量的极性溶剂。
这些溶剂可以在流动相中形成水合包络,提供水合作用表面来吸附色谱柱中的样品分子。
HILIC分离技术在药物分析、食品检测和环境分析等领域中得到广泛应用。
例如,在药物分析中,许多药物和其代谢物具有较强的极性和水溶性特征,常规的反相色谱无法对其进行有效分离。
而HILIC可以通过调整流动相的极性和水含量,实现对这些极性化合物的有效分离和定量。
在食品检测中,HILIC可以用于分析和定量多种极性成分,如氨基酸、有机酸、多糖等。
这些化合物对食品质量及安全性具有重要影响,因此HILIC能够为食品行业提供快速、准确和高通量的分析手段。
在环境分析中,水中或土壤中常常存在一系列极性有机物,如农药、有机溶剂和抗生素等。
这些化合物的定量分析对于环境监测和保护至关重要。
通过使用HILIC色谱技术,可以高效地分离和测定这些环境有机污染物,为相关领域的决策和监控提供重要依据。
此外,HILIC还可以与其他色谱技术结合使用,如质谱联用(LC-MS)等。
这种联用技术可以克服HILIC分离中的一些缺点,如分离度不高、峰的峭度较差等,提高分析的选择性和灵敏度。
综上所述,亲水作用色谱HILIC是一种有效的极性分离技术,在药物分析、食品检测和环境分析等领域中具有广泛应用潜力。
HILIC色谱柱介绍

亲水作用色谱(HILIC)就是近年来色谱领域研究得热点之一。
本文简介了HILIC得起源、定义、分离特点;比较了HILIC与反相色谱(RPLC)得选择特性,讨论了HILIC与质谱联用技术得特点,并对其使用中得注意事项进行了总结.ﻫ1、HILIC得概念亲水色谱(HILIC)就是一种用来改善在反相色谱中保留较差得强极性物质保留行为得色谱技术。
它通过采用强极性固定性,并且结合高比例有机相/低比例水相组成得流动相来实现这一目得.而这样得流动相组成尤其有利于提高电喷雾离子化质谱(ESI-MS)得灵敏度。
ﻫ2、HILIC得分离机制ﻫHILIC得分离机理在目前还存在着争议,主要包括以下三个方面:(1)分配机理(2)离子交换(3)偶极—偶极相互作用。
更多得试验现象则表明HILIC得保留机理包含氢键作用、偶极作用与静电作用等多种次级效应,很难将其区分开来.3、HILIC影响保留得主要因素普遍认为HILIC保留行为受到多种参数得影响,如固定相得官能团、有机改性剂得含量、流速、柱温、流动相缓冲体系得pH值、缓冲盐得种类与浓度。
影响样品在固定相上得保留行为得最主要因素都就是流动相中有机相得比例,例如乙腈得含量得增加会显著增加样品得保留因子。
在HILIC分离模式中,溶剂洗脱能力由弱到强为:四氢呋喃<丙酮<乙腈〈异丙醇<乙醇<甲醇<水,流动相中水就是最强得洗脱溶剂。
一般采用乙腈—水体系作为流动相,其中水相得比例为5%-40%以保证其显著得亲水作用.如图1所示,将流动相中得水相用甲醇、乙醇、异丙醇代替,随着流动相极性得减小,待测物在柱上得保留就会增强。
Figure1、HILIC retention as afunctionof polar modifier、100 mm length ACQUITY UPLC BEH HILICcolumn、Peaks:1= methacryl ic acid, 2 = cytosine,3 = nortriptyline, 4 = nicotinicacid、4、HILIC与RP-HPLC得比较ﻫ传统得反相色谱(RPLC)对强极性与亲水性得小分子物质得保留与分离能力较弱,通常流动相需要采用高比例得水相才能实现其保留,然而高比例得水相会导致一系列问题,比如固定相得反浸润与ESI-MS灵敏度得下降。
hilic色谱柱新柱子活化 解释说明以及概述

hilic色谱柱新柱子活化解释说明以及概述1. 引言1.1 概述HILIC(Hydrophilic Interaction Chromatography)色谱是一种高效液相色谱分析技术,其特点是利用极性固定相与水样品间的亲和作用进行物质的分离。
随着科学研究和实际应用的需要,近年来出现了许多新型的HILIC色谱柱子。
本文将重点介绍这些新柱子的活化解释以及给出相关概述。
1.2 文章结构本文将按照以下结构进行论述:首先,将对新型HILIC色谱柱子的概述进行介绍;接着,会详细解释新柱子的活化原理;然后,探讨这些新柱子在不同领域中的应用领域和意义;其次,进行性能分析,包括分离效能评估、色谱峰形态分析和保留机制研究;最后,提供关于优化操作方法和操作指南。
1.3 目的本篇文章旨在向读者介绍最新发展的HILIC色谱柱子,并深入探讨这些柱子在实际应用中的优势及性能。
通过阐明它们的活化解释和特点,目的是帮助读者更好地理解和运用新柱子,从而推动HILIC色谱技术在分析领域的发展,并为相关研究人员提供操作指南和优化方法。
2. hilic色谱柱新柱子活化解释说明:2.1 hilic色谱柱概述HILIC(Hydrophilic Interaction Liquid Chromatography)即亲水性相互作用液相色谱,是一种基于极性分离机制的液相色谱技术。
和传统的反相色谱技术不同,HILIC色谱使用亲水性固定相,通过样品中化合物与固定相表面上的极性官能团间的疏水效应进行分离。
HILIC色谱在极性化合物、水溶性小分子药物和多肽等方面表现出优异的分离能力。
2.2 新柱子活化原理hilic色谱柱新柱子活化是为了提高柱子表面亲水性而进行的一系列处理步骤。
新柱子在经过特殊处理后,能够形成更精细的涂层结构,增加其极性官能团暴露在表面上,从而提高柱子表面对样品中目标化合物的吸附能力。
具体来说,在hilic色谱柱新柱子活化过程中,可以采用各种方法来调整和改变固定相表面的组成和结构。
聚合物基质亲水性相互作用(HILIC)色谱柱(HILICpak)

Column Eluent
5
10
15
17
有机磺酸的LC/MS/MS分析
1
泛酸和维生素C的LC/MS分析
样品 : 5µL 0.01µM each (in H2O/CH3CN=1/3) 1. 牛磺酸 (Taurine) 2. 牛黄胆酸 (Taurocholic acid)
1
样品 : 100ng/mL each, 10µL 1. 维生素 B5 (Vitamin B5) ( 泛酸 (Pantothenic acid) ) 2. 维生素 C (Vitamin C) ( 抗坏血酸 (Ascorbic acid) )
R2 NH2 NH2 OH OH
R3 NH2 NH2 OH NH2
2 3
N N R3
1 2 3
R2
N
4
3
4
0
5
10
15 min
0
5
10
15
20 min
Column : Eluent : Flow rate : Detector : Column temp. :
Shodex HILICpak VG-50 4E H2O/CH3CN/CH3OH=5/75/20 1.0mL/min RI 40˚C
果糖 (Fructose), 甘露糖 (Mannose), 葡萄糖 (Glucose)
葡萄糖胺 (Glucosamine)
蔗糖 (Sucrose) + 乳糖 (Lactose)
麦芽糖 (Maltose) 棉子糖 (Raffinose) 半乳糖醛酸
(Galacturonic acid)
: Shodex HILICpak VG-50 2D : (A); 0.5% NH3 aq./(B); CH3CN Linear gradient (High pressure); (B%) 80% (0 to 2min) 80% to 10% (2 to 12min) 10% (12 to 15min) 80% (15 to 20min) Flow rate : 0.2mL/min Detector : ESI-MS (SIM) Column temp. : 40˚C
OSAKA SODA PC HILIC系列液相色谱柱说明书(原资生堂)

PC HILIC系列色谱柱使用说明书在此,非常感谢您选购我公司的聚合物包被型PC HILIC系列色谱柱。
PC HILIC系列色谱柱以CAPCELL PAK填料合成技术应用于独有PC(磷酸胆碱)填料素材而诞生的HILIC模式用色谱柱。
磷酸胆碱结构图在亲水性相互作用法(HILIC)机理下,可实现对常规C18色谱柱保留较弱的强亲水性物质的保留。
与未修饰硅胶作为填料的硅胶色谱柱相比,PC HILIC亲水性更强,能够获得更佳保留分离效果。
物性值如下表所示。
pH范围耐压官能团细孔径粒径比表面积2PC 10 5 450 3-7.5 20 为了能够长期且稳定地使用色谱柱,请在熟读该使用说明书后进行正确使用。
1.色谱柱的启用每一根色谱柱在出厂前,都经过了严格的出厂测试,只有满足出厂标准方可出售。
每一根PC HILIC系列色谱柱的柱盒内均含有色谱柱的性能测试报告供使用者查看。
性能测试报告包含了色谱柱柱号,色谱柱规格,填料批次号,理论塔板数和所用的测试条件等的检测数据。
为了保证色谱柱的正常使用,建议在使用前检查以下事项:1.检查色谱柱包装盒是否完整,有无拆封和碰撞痕迹。
2.色谱柱标签是否与包装上的柱号、柱型相符,色谱柱两端堵头是否完整。
3.色谱柱包装盒内是否有色谱柱性能测试报告。
2.色谱柱的安装2.1安装色谱柱之前,请使用不含有缓冲盐、强酸或强碱的流动相对液相色谱系统进行冲洗置换。
2.2为尽量减少死体积,色谱柱的接头使用了外径1/16英寸配管的螺头(MALE NUT)。
请确保装置的配管接头正确连接,并且锥箍的顶端已插入接头内侧(参照图1)。
若配管不匹配,特别是直接使用其他类型色谱柱所用配管时,锥箍前端的配管长度(图1中的V)与色谱柱尾端接头的长度(图1中的L)经常会不同,因而引发故障。
若L>V,会产生死体积,甚至出现色谱峰展宽或拖尾现象,并且分离变差。
若L<V,由于锥箍无法密封,所以会导致漏液。
※频繁更换色谱柱,可能会导致螺头的锥箍损坏而发生漏液现象。
HILIC色谱柱介绍
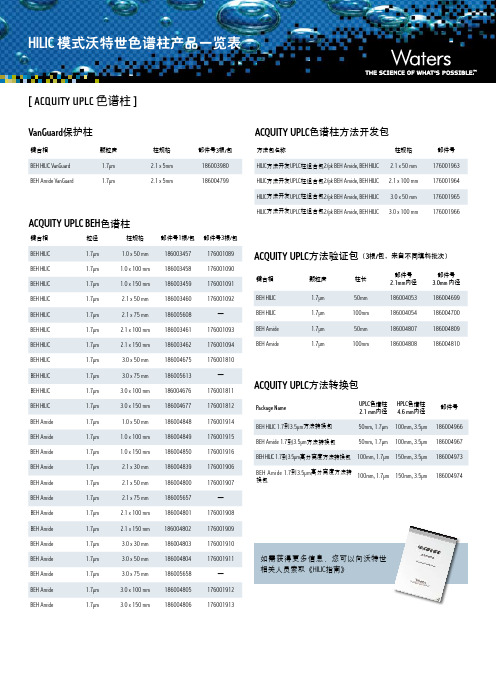
部件号 176001963 176001964 176001965 176001966
ACQUITY UPLC方法验证包(3根/包,来自不同填料批次)
键合相
BEH HILIC BEH HILIC BEH Amide BEH Amide
颗粒度
1.7µm 1.7µm 1.7µm 1.7µm
柱长
50mm 100mm 50mm 100mm
ACQUITY UPLC BEH色谱柱
键合相
粒径
柱规格
部件号1根/包 部件号3根/包
BEH HILIC
1.7µm
1.0 x 50 mm
186003457
176001089
BEH HILIC
1.7µm
1.0 x 100 mm 186003458
176001090
BEH HILIC
1.7µm
1.0 x 150 mm 186003459
XBridge HILIC
186004455 186004456 186004457 186004458 1860044592 186004460 186004461 186004429 1860044301 186004431 186004432 186004433 186004434
—
186004435 186004436 1860044372 186004438 186004439 186004440 186004441
部件号 2.1mm内径 186004053 186004054 186004807 186004808
部件号 3.0mm 内径 186004699 186004700 186004809 186004810
ACQUITY UPLC方法转换包
agilent hilic色谱柱分离糖

近年来,随着人们对健康和营养的关注不断增加,糖类成为了备受关注的食品成分。
糖在食品中的含量及种类多样,对于研究和分析其中的糖类成分,色谱技术成为了一种重要的手段。
在色谱分析中,Agilent HILIC色谱柱以其优秀的分离效果和稳定性备受研究人员的青睐。
我们需要了解HILIC色谱技术的基本原理。
HILIC色谱是一种亲水性相逆向色谱技术,其名字HILIC即Hydrophilic Interaction Liquid Chromatography的缩写。
相比传统的反相色谱,HILIC色谱是在亲水性固定相的作用下,以水相为流动相,通过调节有机溶剂的含量来实现糖类成分的分离。
这种技术不仅可以有效分离极性化合物,还能够在保持分离效果的对样品进行浓缩。
这使得HILIC色谱在糖类分析中具有独特的优势。
在Agilent HILIC色谱柱中,其采用了高负荷度的亲水性固定相,能够更好地保持极性化合物的保持能力。
这意味着即使在高流速下,也能够保持较好的分离效果。
Agilent HILIC色谱柱还具备较高的稳定性和重现性,这对于糖类分析来说尤为重要。
在糖类分析中,样品中往往含有多种不同种类的糖,需要较高的分离能力和选择性。
Agilent HILIC色谱柱在分离糖类成分时能够较好地满足这一需求。
值得一提的是,在糖类分析中,常常需要对样品进行前处理。
对于一些复杂的食品样品,需要通过样品制备技术来提取和纯化糖类成分。
在这一过程中,Agilent HILIC色谱柱也能够发挥其优势。
由于其较强的浓缩作用和对极性化合物的较好保持能力,Agilent HILIC色谱柱能够更好地保留样品中的糖类成分,并在分离过程中达到更好的分离效果。
在我的个人观点和理解中,Agilent HILIC色谱柱作为一种重要的色谱分析技术,在糖类分析中具有不可替代的地位。
其优秀的分离效果、稳定性和重现性,为研究人员提供了一种可靠的手段,能够更全面、深入地了解食品中的糖类成分及其含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亲水作用(HILIC)是近年来色谱领域研究的热点之一。
本文简介了HILIC的起源、定义、分离特点;比较了HILIC和反相色谱(RPLC)的选择特性,讨论了HILIC与质谱联用技术的特点,并对其使用中的进行了总结。
1. HILIC的概念
亲水色谱(HILIC)是一种用来改善在反相色谱中保留较差的强极性物质保留行为的色谱技术。
它通过采用强极性固定性,并且结合高比例有机相/低比例水相组成的流动相来实现这一目的。
而这样的流动相组成尤其有利于提高电喷雾离子化质谱(ESI-MS)的灵敏度。
2. HILIC的分离机制
HILIC的分离机理在目前还存在着争议,主要包括以下三个方面:(1)分配机理(2)离子交换(3)偶极-偶极相互作用。
更多的试验现象则表明HILIC的保留机理包含氢键作用、偶极作用和静电作用等多种次级效应,很难将其区分开来。
影响保留的主要因素
普遍认为HILIC保留行为受到多种参数的影响,如固定相的官能团、有机改性剂的含量、流速、柱温、流动相缓冲体系的pH值、缓冲盐的种类和浓度。
影响样品在固定相上的保留行为的最主要因素都是流动相中有机相的比例,例如乙腈的含量的增加会显着增加样品的保留因子。
在HILIC分离模式中,溶剂洗脱能力由弱到强为:四氢呋喃<丙酮<乙腈<异丙醇<乙醇<甲醇<水, 流动相中水是最强的洗脱溶剂。
一般采用乙腈-水体系作为流动相,其中水相的比例为5%-40%以保证其显着的亲水作用。
如图1所示,将流动相中的水相用甲醇、乙醇、异丙醇代替,随着流动相极性的减小,待测物在柱上的保留就会增强。
Figure 1. HILIC retention as a function of polar modifier. 100 mm length ACQUITY UPLC BEH HILIC column. Peaks: 1 = methacrylic acid, 2 = cytosine, 3 = nortriptyline, 4 = nicotinic acid.
4. HILIC与RP-HPLC的比较
传统的反相色谱(RPLC)对强极性和亲水性的小分子物质的保留和分离能力较弱,通常流动相需要采用高比例的水相才能实现其保留,然而高比例的水相会导致一系列问题,比如固定相的反浸润和ESI-MS灵敏度的下降。
HILIC正好可以解决这些问题,它提供了一种与传统RPLC互补的保留方式,能够使在RPLC 上保留较弱或没有保留的物质在HILIC柱上提供合适的保留,如图2所示:
Figure 2: Chromatograms comparing the retention of allantoin on Atlantis HILIC Silica and Atlantis dC18 columns. (a) Column: 50 mm×4.6 mm, 3-μm dp Atlantis dC18; mobile phase: 10 mM ammonium formate, pH 3; Shows no retention (k =0) of allantoin. (b) Column: 50 mm×4.6 mm, 3-μm dp Atlantis HILIC Silica; mobile phase: 95:5 (v/v) acetonitrile–water containing 10 mM ammonium formate, pH 3; Shows retention (k =1) of allantoin.
另外,HILIC柱上的洗脱顺序与RPLC柱上的正好相反,极性较小的物质先出峰,极性较大的物质后出峰。
如图3所示:
Figure 3. Comparison of ESI+MS response using HILIC and RP conditions. SIR channels of acetylcholine (m/z and choline (m/z ; Co lumns: 100 mm×2.1 mm, μm (A) ACQUITY UPLC BEH C18 (B) ACQUITY UPLC BEH HILIC. Peaks: 1 = acetylcholine, 2 = choline
与质谱技术联用
HILIC可为强极性和强亲水性的化合物提供合适的保留。
通过优化多个色谱参数,有利于实现目标组分和基质中干扰物质的分离,从而降低基质效应的影响;而含有高比例水溶性有机相的流动相又有利于提高质谱离子化效率,进而提高质谱分析的灵敏度。
质谱响应在某种程度上是取决于流动相中有机相的比例。
采用ESI源时,毛细管中离子化的过程类似于一个电泳过程。
由于毛细管被加高压,形成带电液滴。
溶剂蒸发,离子向液滴表面移动,当液滴表面电荷产生的库仑排斥力与液滴表面的张力大致相等时,液滴会分裂成更小的液滴,对于半径<10nm的液滴, 液滴表面形成的电场足够强,电荷的排斥作用最终导致部分离子从液滴表面蒸发出来,形成了气相离子。
而有机相的表面张力比水相的表面张力小得多。
因此,在相同的条件下,流动相中有机相的比例越高,质谱的响应越高。
从图4可以看出,在HILIC柱上的响应比在RPLC柱上的响应高出十倍左右。
Figure 4. Chromatograms comparing the retention and MS response of analyte on C18 m Inertsil ODS-3; mobilecolumn and HILIC column. (A) Column: ×50mm, 3 phase: methanol-water containing % formic acid (15:85, v/v) (B) Column: m ACQUITY UPLC BEH HILIC; mobile phase: methanol-water containing×50mm, % formic acid (85:15, v/v)
6. HILIC柱的使用
(1)初次使用HILIC柱时,应采用50倍柱体积的乙腈-水(50:50)平衡,在进第一针前,应用初始流动相平衡20倍的柱体积。
(2)HILIC柱冲柱子时,采用的是乙腈-水(50:50)来洗去极性物质。
如果解决不了问题,可以使用乙腈-水(5:95) 来冲柱子。
长时间不用时,将柱子保存在乙腈-水(95:5)中。
(3)要保证流动相中至少40%的有机相。
流动相中使用添加剂时,醋酸铵、甲酸铵的重现性优于乙酸和甲酸。
如必须使用甲酸等,%优于%,不要使用磷酸。
(4)水是最强的洗脱溶剂,所以强洗和弱洗溶剂与反相系统的正好相反:弱洗是初始流动相,即高比例的有机相。
并且进样溶剂最好是100%的有机相。
柱如何平衡?
HILIC柱使用70%的乙腈水溶液平衡。
柱如何保存?
HILIC柱使用90%的乙腈水溶液保存。
1.一直使用Waters 的HILIC较多,感觉质量还行,但是要小心waters 的HILIC是分两种类型的填料的BEH HILIC和HILIC。
很多waters 的销售都不清楚之一点。
但是大家一定要注意,这两款的区别是很大的,保留的效果是不同的。
2. 费罗门公司的HILIC柱,感觉是小家碧玉型的,保留能力不是太强,但是清秀文雅,峰型很好看。
3. HILIC的流动相推荐使用乙腈。
4. 推荐使用乙酸铵,这也以后再说。
5.不能使用100% 的乙腈,推荐使用到95%就行了。
不能使用60%以下的乙腈。
所以梯度范围小。
但是足够用了。
因为100%的乙腈可能对HILIC的中亲水的部分不利于键合相的伸展开。
使得保留性能下降。
其中的解释也是经验,研究论文解释的也让人不太信服。
所以大家可以一起讨论一下这点。
使用甲醇的问题也是这样的。
在甲醇分子附近,HILIC的保留能力下降了,色谱峰型较差。
这也是经验结果。
Pubmed compound XlogP -2 -3,。
