各种离子的鉴定方法
如何鉴别金属离子

如何鉴别金属离子金属离子鉴别是化学领域中一项重要的技术,对于分析金属离子的种类和浓度具有重要意义。
本文将介绍几种常用的金属离子鉴别方法,包括化学试剂法、仪器分析法和电化学方法等。
一、化学试剂法化学试剂法是一种传统的金属离子鉴别方法,通过观察金属离子与特定试剂发生反应的现象来判断离子的种类。
以下为几种常见的化学试剂法:1.硫化钠法:适用于检测汞、银、铅等金属离子。
将硫化钠加入待测溶液中,若生成沉淀,则表示存在相应金属离子。
2.氨水法:适用于检测铜、铅、镍等金属离子。
将氨水加入待测溶液中,若生成沉淀,则表示存在相应金属离子。
3.氯化钡法:适用于检测硫酸根离子。
将氯化钡加入待测溶液中,若生成沉淀,则表示存在硫酸根离子。
4.硝酸银法:适用于检测氯离子。
将硝酸银加入待测溶液中,若生成沉淀,则表示存在氯离子。
二、仪器分析法仪器分析法是利用现代仪器设备对金属离子进行定性和定量分析的方法,具有高灵敏度、高准确度和快速的特点。
以下为几种常见的仪器分析法:1.原子光谱法:包括原子发射光谱法(AES)和原子吸收光谱法(AAS),适用于检测金属离子的种类和浓度。
2.电感耦合等离子体质谱法(ICP-MS):适用于多种金属离子的定量分析,具有高灵敏度和高准确度。
3. X射线荧光光谱法(XRF):适用于检测金属离子的种类和浓度,具有快速、无损的特点。
三、电化学方法电化学方法是利用金属离子在电极表面的电化学反应来鉴别金属离子种类的方法。
以下为几种常见的电化学方法:1.阳极溶出法:通过观察阳极表面的金属沉淀来判断金属离子的存在。
2.极谱法:利用金属离子在电极表面的还原或氧化反应产生电流,通过电流-电压曲线来鉴别金属离子。
3.电化学阻抗谱法(EIS):通过测量金属离子在电极表面的电化学反应产生的阻抗变化来判断金属离子的存在。
综上所述,金属离子鉴别方法多种多样,可根据实际需求选择合适的方法。
在实际应用中,化学试剂法、仪器分析法和电化学方法相互补充,共同为金属离子鉴别提供准确、高效的技术支持。
常见离子的定性鉴定方法完整版

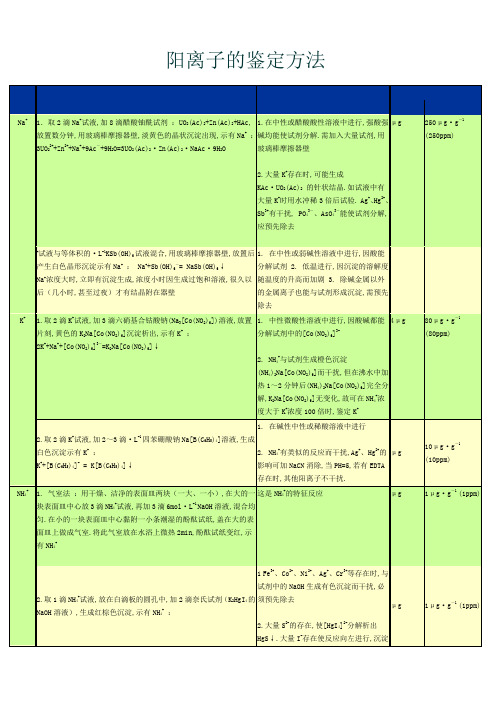
常见离子的定性鉴定方法Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】阳离子的鉴定方法Na+1.取2滴Na+试液,加8滴醋酸铀酰试剂:UO2(Ac)2+Zn(Ac)2+HAc,放置数分钟,用玻璃棒摩擦器壁,淡黄色的晶状沉淀出现,示有Na+:3UO22++Zn2++Na++9Ac-+9H2O=3UO2(Ac)2·Zn(Ac)2·NaAc·9H2O 1.在中性或醋酸酸性溶液中进行,强酸强碱均能使试剂分解。
需加入大量试剂,用玻璃棒摩擦器壁 2.大量K+存在时,可能生成KAc·UO2(Ac)2的针状结晶。
如试液中有大量K+时用水冲稀3倍后试验。
Ag+、Hg2+、Sb3+有干扰, PO43-、AsO43-能使试剂分解,应预先除去μg250μg·g-1(250ppm)+试液与等体积的·L-1KSb(OH)6试液混合,用玻璃棒摩擦器壁,放置后产生白色晶形沉淀示有Na+: Na++Sb(OH)6-= NaSb(OH)6↓ Na+浓度大时,立即有沉淀生成,浓度小时因生成过饱和溶液,很久以后(几小时,甚至过夜)才有结晶附在器壁1. 在中性或弱碱性溶液中进行,因酸能分解试剂 2. 低温进行,因沉淀的溶解度随温度的升高而加剧 3. 除碱金属以外的金属离子也能与试剂形成沉淀,需预先除去K+ 1.取2滴K+试液,加3滴六硝基合钴酸钠(Na3[Co(NO2)6])溶液,放置片刻,黄色的K2Na[Co(NO2)6]沉淀析出,示有K+:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓1. 中性微酸性溶液中进行,因酸碱都能分解试剂中的[Co(NO2)6]3- 2. NH4+与试剂生成橙色沉淀(NH4)2Na[Co(NO2)6]而干扰,但在沸水中加热1~2分钟后(NH4)2Na[Co(NO2)6]完全分解,K2Na[Co(NO2)6]无变化,故可在NH4+浓度大于K+浓度100倍时,鉴定K+4μg80μg·g-1(80ppm)2.取2滴K+试液,加2~3滴·L-1四苯硼酸钠Na[B(C6H5)4]溶液,生成白色沉淀示有K+:K++[B(C6H5)4]- = K[B(C6H5)4]↓1. 在碱性中性或稀酸溶液中进行 2.NH4+有类似的反应而干扰,Ag+、Hg2+的影响可加NaCN消除,当PH=5,若有EDTA存在时,其他阳离子不干扰。
几种离子的鉴别方法

几种离子的鉴别方法离子鉴别方法是化学分析领域中常用的方法之一,在确定化合物组成和性质时起着非常重要的作用。
下面将介绍几种常用的离子鉴别方法。
1.气体析出法气体析出法主要用于气态离子的鉴别。
通过在反应中加入适当的酸或碱,使产生气体离子,然后通过对其进行化学反应来鉴别。
例如,加入盐酸酸化,产生氯气的离子,然后通过将气体通入二硫化碳中,根据形成的颜色以及气体溶解性的变化来鉴别不同的气体。
2.气固法气固法主要用于固态离子的鉴别。
通过将固态离子与气体反应,产生可溶于水或非水溶剂的离子盐。
例如,将固态氯化银与氨气反应形成氯氨络合离子Ag(NH3)2+的溶液,根据络合离子的溶解性和颜色变化来鉴别固态氯化银。
3.摩尔构效关系法摩尔构效关系法根据离子化合物的溶解度和颜色变化来鉴别离子。
例如,根据主族元素的性质,我们可以预测一些阳离子的溶解度和阴离子的稳定性。
并且,根据共价性和离子性的差异,可以根据颜色的变化来鉴别不同的离子。
4.沉淀法沉淀法是利用化学反应产生沉淀来鉴别离子。
根据离子的溶解度和生成的沉淀物的性质,可以鉴别不同的离子。
例如,加入氯化银溶液和硝酸钡溶液到待鉴定溶液中,形成沉淀物后,通过观察沉淀的颜色、形态和溶解性等特征来鉴别不同的离子。
5.甲醇火焰离子化法甲醇火焰离子化法主要用于鉴别有机离子。
该方法利用甲醇的高燃烧温度和易于离化的性质,在火焰中将有机物离化。
离子化后的有机物会在气相中产生特定的质谱图,通过质谱仪可以鉴别不同的有机离子。
以上是几种常用的离子鉴别方法,不同的离子鉴别方法适用于不同类型的离子,选择合适的鉴别方法可以准确快速地确定离子的类型和性质。
阴阳离子的鉴定

阴阳离子的鉴定
阴离子和阳离子是化学中离子的两种基本类型。
阴离子带有负电荷,而阳离子带有正电荷。
在化学分析中,可以通过不同的实验方法来鉴定阴离子和阳离子。
阳离子的鉴定方法:
1.火焰试验:将待鉴定物质放入火焰中,观察火焰的颜色。
不同的阳离子会产生不同颜色的火焰。
例如,钠离子会产生黄色火焰,钾离子会产生紫色火焰。
2.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,钡离子通常通过加入硫酸钡溶液来鉴定,生成白色沉淀(硫酸钡)。
阴离子的鉴定方法:
1.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,氯离子可以通过加入银离子(硝酸银溶液)来鉴定,生成白色沉淀(氯化银)。
2.气体的鉴定:一些气体可以用来鉴定特定的阴离子。
例如,二氧化硫气体可以用于检测硫离子。
3.酸碱中性化反应:使用适当的酸或碱与待鉴定物质反应,观察是否发生中性化反应。
例如,用氢氧化钠溶液可以鉴定酸性溶液中的氢离子。
在实验室中,这些方法通常结合使用,以确保对离子的准确鉴定。
通过观察沉淀、颜色变化和气体产生等现象,可以得出关于阳离子和阴离子的信息。
如何鉴别各种离子

如何鉴别各种离子
K+:焰色反应紫色
Na+:焰色反应黄色
Ba2+:加入SO42-产生不溶于稀硝酸的白色沉淀。
Ca2+:焰色反应砖红色,加入Na2CO3后产生白色沉淀
Al3+:加入NaOH后先产生白色沉淀,后沉淀溶解。
Fe3+:加入KSCN(硫氰化钾)变为血红色或加苯酚变为紫色。
Fe2+:先检验原溶解液无Fe3+,先加强氧化剂(K2Cr2O7(重铬酸钾)、HNO3、H2O2酸性KMnO4、HclO(次氯酸)……)然后检验有没有Fe3+。
Cu2+:一般为蓝色溶液,加入OH-产生蓝色沉淀。
Ag+:加入Cl-产生不溶于稀HNO3的白色沉淀。
NH4+:加入OH-,加热产生无色气体,可使紫色石蕊试纸变蓝。
NO3-:加入H+、Fe产生红棕色气体,或无色气体与O2反应后显红棕色。
Cl-:加入Ag+产生不溶于稀HNO3的白色沉淀。
Br-:加入Ag+产生不溶于稀HNO3的浅黄色沉淀。
I-:加入Ag+产生不溶于稀HNO3的黄色沉淀。
SO42-:加入Ba2+产生不溶于稀HNO3的白色沉淀。
SO32-:加入Ca2+产生白色沉淀,加入H+产生气体,能使品红褪色。
HSO3-:加入Ca2+产生白色沉淀,加入H+产生气体,能使品红褪色。
CO32-:加入Ca2+产生白色沉淀,加入H+产生气体,不能使品红褪色。
HCO3-:加入Ca2+不产生白色沉淀,加入H+产生气体,不能使品红褪
S2-:加入Cu2+产生黑色沉淀。
常见离子检验方法

常见离子检验方法离子检验是一种常用的化学分析方法,用于确定物质中存在的离子种类和浓度。
通过离子检验,我们可以快速准确地分析出溶液中的离子组成,并判断样品的物质成分和性质。
下面将介绍一些常见的离子检验方法。
1.pH检验pH是指溶液的酸碱度,可通过酸碱指示剂或pH电极来测定。
常见的方法有酸碱指示剂比色法和pH电极法。
酸碱指示剂比色法是根据指示剂在不同pH范围内的颜色变化来判断溶液的酸碱性质;pH电极法是用pH电极测定溶液的pH值,通过电位变化计算出溶液的酸碱度。
2.盐酸试验盐酸试验主要用于检测碳酸根离子的存在。
在有HCl存在的条件下,碳酸根离子与HCl反应生成二氧化碳气体,从而产生气泡。
通过观察气泡的生成情况,可以判断溶液中是否含有碳酸根离子。
3.硫酸铜试验硫酸铜试验常用于检测硫酸根离子的存在。
在硫酸铜溶液中加入硫酸根离子含量较高的溶液,会观察到溶液由蓝色变为浑浊绿色,同时有沉淀物生成。
通过观察颜色变化和沉淀的生成情况,可以判断溶液中是否含有硫酸根离子。
4.硫化氢气体试验硫化氢气体试验用于检测金属离子,特别是有色金属离子的存在。
在含有金属离子的溶液中通入H2S气体,会观察到溶液的颜色变化,出现气味和沉淀物生成。
通过观察颜色的变化和沉淀的生成,可以判断溶液中是否含有特定金属离子。
5.水合物生成试验水合物生成试验可用于检测一些特定离子的存在。
当一些离子与水分子结合形成水合物时,会观察到溶液的颜色变化和沉淀物生成。
常见的水合物生成试验有硫酸铜与无水碱直接反应生成蓝色的CuSO4·nH2O、硝酸银与氢氯酸反应生成白色的AgCl·nH2O等。
6.火焰试验火焰试验用于检测阳离子的存在。
当一些金属离子通过加热放入火焰中时,会产生特定的颜色。
不同金属离子产生的颜色不同,通过观察火焰颜色可以判断溶液中的金属离子种类。
以上是一些常见的离子检验方法。
这些方法都比较简便易行,可以快速准确地检测离子的存在。
各种离子的鉴定方法

1.碳酸根离子:用稀盐酸当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了2.氯离子:用硝酸银和稀硝酸银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了3.硫酸根离子:1用硝酸钡和稀硝酸钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了 2用稀盐酸和氯化钡钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了 4.银离子:用氯化钠银离子会和氯离子结合成氯化银,生成沉淀 5.氢离子:1活泼金属有氢气生成,现象会产生气泡 2酸碱指示剂:紫色石蕊试剂石蕊变红 3金属氧化物:如带锈的铁钉铁锈会退去 6.氢氧根离子:酸碱指示剂:无色酚酞酚酞变红 7.铁离子:1溶液中呈淡黄色 2用氢氧化钠铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀8.亚铁离子:溶液中呈浅绿色 9.铜离子:1溶液中呈蓝色 2用氢氧化钠铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀10.铵根离子:用碱和和湿润的红色石蕊试纸铵根离子和碱反应生成呈碱性的氨气,使石蕊试纸变蓝 11.钡离子:用稀硫酸钡离子会和硫酸根离子结合成硫酸钡,生成沉淀化学高中化学所有离子的鉴别采用试剂:石蕊、酚酞和甲基橙操作步骤和反应现象: 含OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深 Cl-的检验采用试剂:AgNO3溶液、HNO3溶液操作步骤和反应现象: 滴加AgNO3溶液生成白色沉淀,再加稀HNO3沉淀不溶,有关的离子方程式: Ag++Cl- AgCl↓ Br-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象: 滴加AgNO3溶液生成浅黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水振荡后加几滴汽油,油层红棕色有关的离子方程式:Ag++Br- AgBr↓ Cl2+2Br- 2Cl-+Br2 I-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象: 滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水,振荡用CCl4萃取呈紫色有关的离子方程式: I-+Ag+ AgI↓ Cl2+2I- I2+2Cl- S2-的检验采用试剂:PbNO32或PbAc2 操作步骤和反应现象: 用玻璃棒蘸取被测液于PbNO32或PbAc2试纸上,试纸变为黑色有关的离子方程式: Pb2++S2- PbS↓ SO42-的检验采用试剂:BaCl2、HNO3溶液操作步骤和反应现象: 向被测溶液滴加BaCl2或BaNO32溶液,出现白色沉淀,再滴加稀HNO3沉淀不溶有关的离子方程式: Ba2++SO42- BaSO4↓ SO32-的检验采用试剂:稀HNO3、BaCl2、HCl溶液操作步骤和反应现象: 取含SO32-的溶液,滴加HCl溶液少量出现能使品红褪色的气体;如滴加BaCl2溶液生成白色沉淀;再加过量HCl 能溶解,但用硝酸白色沉淀则不溶有关的离子方程式: SO32-+2H+SO2↑+H2O SO32-+Ba2+ BaSO3↓ BaSO3+2H+ Ba2++H2O+SO2↑3BaSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2O CO32-的检验采用试剂:HCl溶液、CaOH2溶液操作步骤和反应现象: 取含CO32-溶液于试管中滴加HCl溶液,发生气泡,再将气泡通入CaOH2溶液中,溶液发浑浊有关的离子方程式: CO32-+2H+ CO2↑+H2O CO2+Ca2++2OH- CaCO3↓+H2O NO3-的检验采用试剂:Cu、浓H2SO4操作步骤和反应现象: 在Cu屑和浓H2SO4混合物的试管中加入少许含NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式:2NO3-+4H++Cu Cu2++2NO2↑+2H2O PO43-的检验采用试剂:AgNO3、稀HNO3 操作步骤和反应现象: 向含有PO43-溶液的试管中滴加AgNO3溶液,生成黄色沉淀,再加HNO3后沉淀溶解有关的离子方程式: PO43-+3Ag+ Ag3PO4↓ Ag3PO4+3H+ 3Ag++H3PO4。
各种离子的鉴定方法

1.碳酸根离子:用稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了)2.氯离子:用硝酸银和稀硝酸(银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了)3.硫酸根离子:1)用硝酸钡和稀硝酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了)2)用稀盐酸和氯化钡(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了)4.银离子:用氯化钠(银离子会和氯离子结合成氯化银,生成沉淀)5.氢离子:1)活泼金属(有氢气生成,现象会产生气泡)2)酸碱指示剂:紫色石蕊试剂(石蕊变红)3)金属氧化物:如带锈的铁钉(铁锈会退去)6.氢氧根离子:酸碱指示剂:无色酚酞(酚酞变红)7.铁离子:1)溶液中呈淡黄色2)用氢氧化钠(铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀)8.亚铁离子:溶液中呈浅绿色9.铜离子:1)溶液中呈蓝色2)用氢氧化钠(铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀)10.铵根离子:用碱和和湿润的红色石蕊试纸(铵根离子和碱反应生成呈碱性的氨气,使石蕊试纸变蓝)11.钡离子:用稀硫酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀)化学】高中化学所有离子的鉴别采用试剂:石蕊、酚酞和甲基橙操作步骤和反应现象:含OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深Cl-的检验采用试剂:AgNO3溶液、HNO3溶液操作步骤和反应现象:滴加AgNO3溶液生成白色沉淀,再加稀HNO3沉淀不溶,有关的离子方程式:Ag++Cl- AgCl↓Br-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成浅黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水振荡后加几滴汽油,油层红棕色有关的离子方程式:Ag++Br- AgBr↓Cl2+2Br- 2Cl-+Br2I-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水,振荡用CCl4萃取呈紫色有关的离子方程式:I-+Ag+ AgI↓Cl2+2I- I2+2Cl-S2-的检验采用试剂:Pb(NO3)2或Pb(Ac)2操作步骤和反应现象:用玻璃棒蘸取被测液于Pb(NO3)2或Pb(Ac)2试纸上,试纸变为黑色有关的离子方程式:Pb2++S2- PbS↓SO42-的检验采用试剂:BaCl2、HNO3溶液操作步骤和反应现象:向被测溶液滴加BaCl2或Ba(NO3)2溶液,出现白色沉淀,再滴加稀HNO3沉淀不溶有关的离子方程式:Ba2++SO42- BaSO4↓SO32-的检验采用试剂:稀HNO3、BaCl2、HCl溶液操作步骤和反应现象:取含SO32-的溶液,滴加HCl溶液(少量)出现能使品红褪色的气体;如滴加BaCl2溶液生成白色沉淀;再加过量HCl能溶解,但用硝酸白色沉淀则不溶有关的离子方程式:SO32-+2H+ SO2↑+H2OSO32-+Ba2+ BaSO3↓BaSO3+2H+ Ba2++H2O+SO2↑3BaSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2OCO32-的检验采用试剂:HCl溶液、Ca(OH)2溶液操作步骤和反应现象:取含CO32-溶液于试管中滴加HCl溶液,发生气泡,再将气泡通入Ca(OH)2溶液中,溶液发浑浊有关的离子方程式:CO32-+2H+ CO2↑+H2OCO2+Ca2++2OH- CaCO3↓+H2ONO3-的检验采用试剂:Cu、浓H2SO4操作步骤和反应现象:在Cu屑和浓H2SO4混合物的试管中加入少许含NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式:2NO3-+4H++Cu Cu2++2NO2↑+2H2OPO43-的检验采用试剂:AgNO3、稀HNO3操作步骤和反应现象:向含有PO43-溶液的试管中滴加AgNO3溶液,生成黄色沉淀,再加HNO3后沉淀溶解有关的离子方程式:PO43-+3Ag+ Ag3PO4↓Ag3PO4+3H+ 3Ag++H3PO4。
常见离子的定性鉴定方法

阳离子的鉴定方法Na+1.取2滴Na+试液,加8滴醋酸铀酰试剂:UO2(Ac)2+Zn(Ac)2+HAc,放置数分钟,用玻璃棒摩擦器壁,淡黄色的晶状沉淀出现,示有Na+:3UO22++Zn2++Na++9Ac-+9H2O=3UO2(Ac)2·Zn(Ac)2·NaAc·9H2O 1.在中性或醋酸酸性溶液中进行,强酸强碱均能使试剂分解。
需加入大量试剂,用玻璃棒摩擦器壁 2.大量K+存在时,可能生成KAc·UO2(Ac)2的针状结晶。
如试液中有大量K+时用水冲稀3倍后试验。
Ag+、Hg2+、Sb3+有干扰, PO43-、AsO43-能使试剂分解,应预先除去 ?μg250μg·g-1(250ppm)+试液与等体积的·L-1KSb(OH)6试液混合,用玻璃棒摩擦器壁,放置后产生白色晶形沉淀示有Na+: Na++Sb(OH)6-= NaSb(OH)6↓ ?Na+浓度大时,立即有沉淀生成,浓度小时因生成过饱和溶液,很久以后(几小时,甚至过夜)才有结晶附在器壁 ?1. 在中性或弱碱性溶液中进行,因酸能分解试剂 2. 低温进行,因沉淀的溶解度随温度的升高而加剧3. 除碱金属以外的金属离子也能与试剂形成沉淀,需预先除去K+ 1.取2滴K+试液,加3滴六硝基合钴酸钠(Na3[Co(NO2)6])溶液,放置片刻,黄色的K2Na[Co(NO2)6]沉淀析出,示有K+:2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓1. 中性微酸性溶液中进行,因酸碱都能分解试剂中的[Co(NO2)6]3- 2.NH4+与试剂生成橙色沉淀(NH4)2Na[Co(NO2)6]而干扰,但在沸水中加热1~2分钟后(NH4)2Na[Co(NO2)6]完全分解,K2Na[Co(NO2)6]无变化,故可在NH4+浓度大于K+浓度100倍时,鉴定K+4μg80μg·g-1(80ppm)2.取2滴K+试液,加2~3滴·L-1四苯硼酸钠Na[B(C6H5)4]溶液,生成白色沉淀示有K+:K++[B(C6H5)4]- = K[B(C6H5)4]↓1. 在碱性中性或稀酸溶液中进行2. NH4+有类似的反应而干扰,Ag+、Hg2+的影响可加NaCN消除,当PH=5,若有EDTA存在时,其他阳离子不干扰。
高中化学中常见离子的分析与鉴定方法总结

高中化学中常见离子的分析与鉴定方法总结化学是一门研究物质组成、性质和变化规律的科学,而离子则是化学反应中不可或缺的重要角色。
在高中化学教学中,学生需要了解常见离子的分析与鉴定方法,以便能够准确判断和分析不同物质中的离子成分。
本文将总结一些常见离子的分析与鉴定方法,帮助学生更好地理解和掌握这一知识点。
一、阳离子的分析与鉴定方法1. 铵离子的分析与鉴定:铵离子是一类带正电荷的离子,常见的有氨根离子(NH4+)。
铵离子可以通过加热试样并用红色湿润的红石蕊试纸接近试样蒸发处,如果试纸变蓝,则可以判断存在铵离子。
2. 钠离子的分析与鉴定:钠离子(Na+)是一种常见的碱金属离子,可以通过火焰试验进行鉴定。
将待测溶液滴在铂丝环上,然后放入蓝色火焰中加热,如果火焰变成黄色,则可以判断存在钠离子。
3. 铜离子的分析与鉴定:铜离子(Cu2+)是一种常见的过渡金属离子,可以通过加入氨水进行鉴定。
当氨水加入含铜离子的溶液中时,溶液会由蓝色变为深蓝色,这是因为铜离子与氨水形成了配合物。
二、阴离子的分析与鉴定方法1. 硫酸根离子的分析与鉴定:硫酸根离子(SO42-)是一种常见的阴离子,可以通过加入钡离子进行鉴定。
当钡离子与硫酸根离子反应时,会生成白色沉淀,这是硫酸钡(BaSO4)的产物。
2. 氯离子的分析与鉴定:氯离子(Cl-)是一种常见的阴离子,可以通过加入银离子进行鉴定。
当银离子与氯离子反应时,会生成白色沉淀,这是氯化银(AgCl)的产物。
3. 碳酸根离子的分析与鉴定:碳酸根离子(CO32-)是一种常见的阴离子,可以通过加入酸进行鉴定。
当碳酸根离子与酸反应时,会产生气体释放,这是因为碳酸根离子分解产生二氧化碳气体。
三、其他离子的分析与鉴定方法1. 硝酸根离子的分析与鉴定:硝酸根离子(NO3-)可以通过加入铁离子进行鉴定。
当硝酸根离子与铁离子反应时,会生成棕色沉淀,这是亚硝酸铁(Fe(NO2)3)的产物。
2. 硫酸根离子的分析与鉴定:硫酸根离子(HSO3-)可以通过加入酸进行鉴定。
几种离子的鉴别方法

几种离子的鉴别方法离子的鉴别方法是化学分析中常用的重要手段之一,可以根据其特定的物理化学性质进行判断和鉴别。
以下介绍几种常见的离子鉴别方法:一、常用的离子鉴别方法之一是溶液的反应性质。
1.阴阳离子的反应鉴别:阴离子通过与阳离子的反应形成沉淀或溶解现象来区分。
例如,将待鉴定离子添加到已知阳离子的溶液中,观察是否出现沉淀现象,通过沉淀的形成、颜色、形态等特征来判断鉴定离子的种类。
2.气体的反应鉴别:一些离子在接触特定的试剂时,会产生气体。
例如,CO3^2-与酸反应产生CO2气体,通过检测气体的产生来鉴别CO3^2-离子。
3.氧化还原反应鉴别:一些离子在氧化还原反应中具有特殊的性质。
例如,Fe3+在还原条件下可以被还原为Fe2+,通过观察颜色的变化来鉴别Fe3+离子。
二、离子鉴别的另一种方法是通过离子的酸碱性质进行鉴定。
1.酸碱反应鉴别:根据酸碱滴定的原理,向待鉴定离子溶液中逐滴加入已知浓度的酸或碱,通过观察溶液的酸碱指示剂的颜色变化,确定待鉴定离子的酸碱性质。
2.氢氧化物的沉淀鉴别:一些阳离子与氢氧化物反应时会生成沉淀。
例如,溴化铵试剂可以与Ba2+、Pb2+形成沉淀,通过沉淀的特征来鉴别阳离子的种类。
三、光谱分析是离子鉴别的又一重要方法。
1.紫外可见光谱:一些离子在紫外可见光谱中具有特定的吸收和发射特征,通过检测溶液在紫外可见光谱下的吸收曲线或发射光谱特征来鉴定离子。
2.火焰光谱:通过加热一些元素或化合物的溶液,利用其产生的特定颜色的火焰光谱线来鉴别元素或离子的种类。
3.原子吸收光谱:通过测量溶液中特定离子在特定波长处光的吸收程度,从而确定溶液中对应离子的浓度或存在状态。
以上是几种常见的离子鉴别方法,通过这些方法,在化学分析实验中可以根据不同离子的特性进行鉴定和分析。
化学教案:常见离子的测试与鉴定

化学教案:常见离子的测试与鉴定常见离子的测试与鉴定一、介绍在化学实验中,常常会遇到需要测试和鉴定特定离子的情况。
这些测试和鉴定方法能够帮助我们确定样品中是否存在特定离子,并进一步了解其性质和浓度。
本文将介绍几种常见离子的测试与鉴定方法。
二、阳离子的测试与鉴定1. 铅离子(Pb2+)的测试与鉴定:- 试剂:硫化氢溶液(H2S溶液)- 鉴定方法:加入硫化氢溶液,如产生黑色沉淀,则为铅离子的存在。
2. 铜离子(Cu2+)的测试与鉴定:- 试剂:羟肼盐溶液- 鉴定方法:加入羟肼盐溶液后,如产生蓝色沉淀,则为铜离子的存在。
3. 铁离子(Fe3+)的测试与鉴定:- 试剂:硫氰化钾溶液(KSCN溶液)- 鉴定方法:加入硫氰化钾溶液后,如产生红色沉淀,则为铁离子的存在。
4. 锌离子(Zn2+)的测试与鉴定:- 试剂:氢氧化钠溶液(NaOH溶液)- 鉴定方法:加入氢氧化钠溶液后,如产生白色沉淀,则为锌离子的存在。
三、阴离子的测试与鉴定1. 硫酸根离子(SO42-)的测试与鉴定- 试剂:巴尔酚蓝指示剂- 鉴定方法:将巴尔酚蓝指示剂加入样品中,如果颜色变成黄绿色,则为硫酸根离子的存在。
2. 氯离子(Cl-)的测试与鉴定:- 试剂:银硝酸溶液(AgNO3溶液)- 鉴定方法:加入银硝酸溶液后,如产生白色沉淀,则为氯离子的存在。
3. 碳酸根离子(CO32-)的测试与鉴定:- 试剂:盐酸溶液和食用苏打粉- 鉴定方法:先加入盐酸溶液,如果产生气泡,则说明有碳酸根离子。
接着加入食用苏打粉后,继续产生气泡,则可确认碳酸根离子的存在。
4. 硝酸根离子(NO3-)的测试与鉴定:- 试剂:巴氏液- 鉴定方法:加入巴氏液后,如产生红色瞬间反应,则为硝酸根离子的存在。
四、结论通过上述介绍,我们了解到了常见离子的测试与鉴定方法。
准确判断样品中是否存在特定离子对于化学实验和分析具有重要意义。
这些测试与鉴定方法不仅帮助我们明确样品中所含离子种类和浓度,还能够提供进一步分析和研究的基础。
初中化学常见离子鉴别方法

初中化学常见离子鉴别方法
初中化学常见离子的化学鉴别方法:
1.氢离子:(1)用石蕊试剂,遇酸变红;(2)用难溶性碱,
遇酸会消失;H++OH-=H2O
(3)用可溶性碳酸盐,遇酸会有气泡产生2H++CO32-=CO2↑+H2O(4)用氢前金属(除钾钙钠外)例:Zn+2H+=H2↑+Zn2+
2.氢氧根离子:(1)用酚酞试液,遇碱变红;(2)用可溶性铁
盐或可溶性铜盐,遇碱会产生红褐色沉淀或蓝色沉淀;
Fe3++3OH-=Fe(OH)3↓ Cu2++2OH-=Cu(OH)2↓(3)铵盐,会有刺激性气味的氨气产生。
NH4++OH-=NH3↑+H2O
3.铵根离子:可溶性的碱,会有刺激性气味的氨气产生。
NH4++OH-=NH3↑+H2O
4.钙离子:可溶性碳酸盐,会有白色沉淀产生;沉淀溶于酸。
Ca2++CO32-=CaCO3↓
5.碳酸根离子:(1)可溶性的钙盐,会有白色沉淀产生,沉淀溶
于酸;Ca2++CO32-=CaCO3↓
(2)酸,会有气泡产生。
2H++CO32-=CO2↑+H2O
6.硫酸根离子:可溶性钡盐,会有白色沉淀产生,沉淀不溶于稀
硝酸;常用氯化钡溶液鉴定。
Ba2++SO42-=BaSO4↓
7.钡离子:硫酸或可溶性的硫酸盐,会有白色沉淀产生,沉淀不
溶于稀硝酸。
Ba2++SO42-=BaSO4↓
8.氯离子:硝酸银溶液,有白色沉淀产生,且沉淀不溶于稀硝
酸。
Ag++Cl-=AgCl↓
9.银离子:盐酸或可溶性的盐酸盐,有白色沉淀产生,且沉淀不
溶于稀硝酸。
Ag++Cl-=AgCl↓。
高中化学15种离子鉴定

高中化学几种常见离子的鉴定1、铵根(NH4+)检验用浓NaOH 溶液,现象:有刺激性气味气体产生离子反应式:NH4(++OH(-=NH3 ↑+H2O2、钾离子(K+)试剂:使其盐溶液在无色火焰中灼烧,现象:透过蓝色的钴玻璃看见火焰是紫色,方程式:无(焰色反应是物理变化)3、钠离子(Na+)方法同上,火焰呈黄色4、亚铁离子(Fe2+试剂:氢氧化钠溶液,现象:产生白色沉淀,之后变为灰绿色,最后变成红褐色。
方程:Fe(2++2OH(-==Fe(OH2↓4Fe(OH2 + O2 +H2O==4Fe(OH3↓5、铁离子(Fe3+)试剂:氢氧化钠溶液,现象:红褐色沉淀生成,方程:Fe(3++3OH(-==Fe(OH3↓6、铝离子(Al3+)方法一:加氨水,现象产生白色沉淀,方程:Al(3++3NH3-H2O=Al(OH3↓+3NH4(+ 方法2:加氢氧化钠溶液,现象:产生白色沉淀,加入过量NaOH 溶液后沉淀溶解方程:Al(3++3OH(-=Al(OH3↓Al(OH3+NaOH==NaAlO2+2H2O7、铜离子(CU2+)方法一:加氨水,现象产生蓝色沉淀,方程:Cu(2++4NH3-H2O=[Cu(NH34](2++4H2O方法2:加氢氧化钠溶液,现象:产生BLUE 色沉淀,方程:CU(2++2OH(-=CU(OH2↓8、氯离子(Cl-)试剂:稀硝酸和硝酸银,现象:白色沉淀生辰,方程:Ag(++Cl(-=AgCl↓9、溴离子Br(-试剂同上,浅黄色沉淀生成,方程Br(++Cl(-=AgBr↓10、硫离子S(2-试剂硝酸铅,现象:黑色沉淀,方程:Pb(2++S(2-=PbS↓或者用稀盐酸,现象:臭鸡蛋气味气体放出,气体可以使乙酸铅、硝酸铅试纸变黑方程:2H(++S(2-=2H2S↑S(2-+Pb(2+=PbS↓11、硝酸根NO3(-试剂:浓硫酸和铜单质现象:产生红棕色气体,方程:Cu+2NO3(-+4H(+=CU(2++NO2↑+2H2O12、碳酸根CO3(2-试剂:稀盐酸,现象,声称使澄清石灰水变浑浊的气体方程:2H(++CO3(2-=H20+CO2↑C02+CA(0H2=CACO3↓+H2O13、硫酸根(SO42-试剂:稀盐酸和氯化钡,现象:白色沉淀生成,方程:Ba(2++SO4(2-=BaSO4↓此沉淀不溶于盐酸和稀硝酸14、磷酸根PO4(3-试剂:稀硝酸和硝酸银现象:黄色沉淀,方程:3Ag(++PO4(3-=Ag3PO4↓15、氟离子(F-)加入氯化钙溶液,产生白色的CaF2沉淀2F-+Ca(2+=CaF2↓。
离子检验方法

离子检验方法离子检验方法是一种常用的化学分析技术,通过检测离子的存在和浓度来确定物质的成分和性质。
离子检验方法广泛应用于环境监测、食品安全、医药卫生等领域,对于保障公共安全和健康具有重要意义。
本文将介绍几种常见的离子检验方法及其原理和应用。
首先,常见的离子检验方法包括离子色谱法、原子吸收光谱法、荧光光谱法等。
离子色谱法是利用离子在固定相和流动相之间的分配系数不同来进行分离和检测的方法,适用于无机阳离子、无机阴离子和有机酸根离子的分析。
原子吸收光谱法是利用原子对特定波长的光吸收特性进行分析的方法,适用于金属离子的测定。
荧光光谱法则是利用物质在激发光作用下发出的荧光进行分析的方法,适用于某些特定的离子浓度测定。
其次,这些离子检验方法都有各自的原理和特点。
离子色谱法的分离原理是利用固定相和流动相之间的亲疏性差异,使得不同离子在固定相和流动相之间的分配系数不同,从而实现分离。
原子吸收光谱法则是利用原子对特定波长的光吸收特性进行分析,当原子处于基态时,吸收特定波长的光,从而实现对离子的测定。
荧光光谱法则是利用物质在激发光作用下发出的荧光进行分析,通过测量荧光强度来确定离子的浓度。
最后,这些离子检验方法在环境监测、食品安全、医药卫生等领域有着广泛的应用。
在环境监测中,离子检验方法可以用于水质、大气、土壤等环境样品的离子成分分析,为环境保护和治理提供重要数据支持。
在食品安全领域,离子检验方法可以用于检测食品中的重金属离子、防腐剂离子等有害物质,保障食品安全。
在医药卫生领域,离子检验方法可以用于药物中的离子成分分析,保证药品的质量和安全性。
综上所述,离子检验方法是一种重要的化学分析技术,具有广泛的应用前景。
通过对离子检验方法的原理和应用进行深入了解,可以更好地应用这些方法于实际工作中,为社会发展做出贡献。
离子的鉴别方法

离子的鉴别方法一、引言离子是化学反应中不可或缺的研究对象。
准确鉴别离子的方法对于理解化学反应的机理以及进行定性、定量分析具有重要意义。
本文将介绍几种常用的离子鉴别方法,帮助读者更好地了解离子的性质及其分析方法。
二、化学反应法化学反应法是一种通过引发特定的反应来鉴别离子的方法。
下面将以几种常见的离子为例,介绍其鉴别方法:1. 氯离子(Cl-)鉴别方法氯离子可通过银离子(Ag+)反应生成白色沉淀物氯化银(AgCl)来进行鉴别。
若发生沉淀反应,则可以判断存在氯离子。
2. 碳酸根离子(CO3^2-)鉴别方法碳酸根离子可通过加入酸来进行鉴别。
当与酸反应产生气体释放时,可判断存在碳酸根离子。
常用的酸包括盐酸(HCl)和硫酸(H2SO4)。
3. 铁离子(Fe^3+、Fe^2+)鉴别方法铁离子可以通过与硫化氢(H2S)作用生成黑色沉淀物二硫化三铁(FeS2)来进行鉴别。
若产生黑色沉淀,则可判断存在铁离子。
三、物理性质法除了化学反应法外,还可以通过一些离子的物理性质来进行鉴别。
下面列举几种常见的方法:1. 颜色鉴别法某些离子溶液的颜色是其独特的物理性质,可以通过颜色的变化来鉴别离子。
例如,钴离子(Co^2+)溶液呈现粉红色,铜离子(Cu^2+)溶液呈现蓝色,铁离子(Fe^3+)溶液呈现黄色等。
2. 溶解度鉴别法不同离子的溶解度是不同的,可以通过溶解度的差异来鉴别离子。
例如,硫酸钙(CaSO4)溶液较难溶解,而氯化钠(NaCl)溶液较易溶解。
3. 电导率鉴别法不同离子溶液导电的能力也是不同的。
可通过测量电导率来鉴别离子。
例如,含有铵离子(NH4+)的溶液具有较高的电导率。
四、仪器分析法利用仪器分析是一种定量、准确鉴别离子的方法。
下面介绍两种常用的仪器分析法:1. 紫外可见分光光度法紫外可见分光光度法是通过物质吸收特定波长的光线来测定物质浓度的方法。
离子溶液对不同波长的光线吸收程度不同,通过测量吸光度可以鉴别离子。
2. X射线衍射法X射线衍射法是一种通过物质对X射线的衍射图样来鉴别物质的方法。
离子鉴定

高考中涉及物质检验的题目几乎每年都有,离子检验更是重中之重,关于高中化学常见的离子检验,你掌握了多少呢?(1)Na+:实验操作:首先将铂丝用盐酸(不能用硫酸,原因:硫酸是高沸点难挥发性酸.加热后不似盐酸易挥发且硫酸盐大多不易挥发,不能很好的达到完全清洗铂丝的目的,影响焰色反应现象)洗净后在火焰上灼烧至原火焰色相同,然后蘸取待测液,放在火焰上灼烧,观察火焰颜色。
实验现象:火焰呈黄色检验原理:焰色反应(物理变化)扩展:K+的检验方法与Na+类似,不同点是需透过蓝色钴玻璃观察,以排除Na+的干扰,可观察到淡紫色火焰。
(2)NH4+:实验操作:取少量待测溶液于试管中,加入NaOH浓溶液并加热,将湿润的红色石蕊试纸置于试管口。
实验现象:加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体实验的原理:强碱制备弱碱扩展:也可将蘸有浓盐酸的玻璃棒置于试管口,若观察到有白烟生成,则含有NH4+,反应原理:HC l+ NH3 =NH4Cl。
(3)Fe3+:方法一:取少量待测溶液于试管中,加入KSCN溶液,若溶液变红色(注意:不是红色沉淀),则说明溶液中有Fe3+。
实验原理:Fe3++3SCN-=Fe(SCN)3方法二:取少量待测溶液于试管中,加苯酚,若溶液变为紫色,则说明溶液中有Fe3+(苯酚的显色反应)。
方法三:取少量待测溶液于试管中,加NaOH溶液,若出现红褐色沉淀,则说明溶液中有Fe3+(Fe3++3OH-=Fe(OH)3↓)。
方法四:加入亚铁氰化钾(K4Fe(CN)6)产生蓝色沉淀。
(4)Fe2+:方法一:取少量待测溶液于试管中,先加入KSCN溶液,再加入新制的氯水。
实验现象:加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色实验原理:2Fe2++ Cl2=2Fe3++ 2Cl-,Fe3++3SCN-=Fe(SCN)3方法二:加入NaOH溶液,先产生白色沉淀,然后迅速变成灰绿色,最后变为红褐色。
方法三:加入铁氰化钾溶液(K3[Fe(CN)6]),产生蓝色沉淀。
离子检验方法

离子检验方法离子检验是一种常见的化学分析方法,通过对样品中离子的检测和分析,可以确定样品的成分和性质。
离子检验方法广泛应用于环境监测、食品安全、药物研发等领域。
下面将介绍几种常见的离子检验方法。
一、离子色谱法。
离子色谱法是一种通过色谱柱分离离子,并通过检测器检测的分析方法。
它可以对阳离子和阴离子进行分离和检测,具有分离效果好、灵敏度高、选择性强的特点。
离子色谱法广泛应用于水质分析、食品检测、药物分析等领域。
二、离子选择电极法。
离子选择电极是一种专门用于检测某种特定离子的电极。
通过将离子选择电极浸入待测样品中,可以测定样品中特定离子的浓度。
离子选择电极法具有操作简便、快速准确的特点,适用于实时监测和现场分析。
三、离子交换色谱法。
离子交换色谱法是一种利用离子交换树脂对离子进行分离和检测的方法。
它可以对不同价态的离子进行分离,并通过检测器进行定量分析。
离子交换色谱法在环境监测、生物医药、食品安全等领域有着广泛的应用。
四、离子选择性电极法。
离子选择性电极法是一种利用离子选择性电极对特定离子进行测定的方法。
它具有操作简便、灵敏度高、选择性强的特点,适用于对特定离子进行快速准确的测定。
五、离子色谱质谱联用法。
离子色谱质谱联用法是将离子色谱和质谱联用,通过色谱分离和质谱检测,可以对样品中的离子进行定性和定量分析。
它具有分离效果好、灵敏度高、选择性强的特点,适用于复杂样品的分析。
六、离子电泳法。
离子电泳法是一种利用电场对离子进行分离和检测的方法。
它具有分离效果好、操作简便、分析速度快的特点,适用于对离子进行快速准确的分析。
以上介绍了几种常见的离子检验方法,每种方法都有其特点和适用范围。
在实际应用中,可以根据样品的特点和分析要求选择合适的离子检验方法,以获得准确可靠的分析结果。
离子检验方法的不断发展和改进,将为化学分析领域带来更多的可能性和机遇。
常见离子的定性鉴定方法
阳离子的鉴定方法或 NH4++OH-=NH3+H2ONH4+浓度低时,没有沉淀产生,但溶液呈黄色或棕色溶解Mg2+ 1.取2滴Mg2+试液,加2滴2mol·L-1NaOH溶液,1滴镁试剂(Ⅰ),沉淀呈天蓝色,示有Mg2+ .对硝基苯偶氮苯二酚俗称镁试剂(Ⅰ),在碱性环境下呈红色或红紫色,被Mg(OH)2吸附后则呈天蓝色.1. 反应必须在碱性溶液中进行,如[NH4+]过大,由于它降低了[OH-].因而妨碍Mg2+的捡出,故在鉴定前需加碱煮沸,以除去大量的NH4+2. Ag+、Hg22+、Hg2+、Cu2+、Co2+、Ni2+、Mn2+、Cr3+、Fe3+及大量Ca2+干扰反应,应预先除去μg10μg·g-1(10ppm)2.取4滴Mg2+试液,加2滴6mol·L-1氨水,2滴2mol·L-1(NH4)2HPO4溶液,摩擦试管内壁,生成白色晶形MgNH4PO4·6H2O沉淀,示有Mg2+:Mg2++HPO42-+NH3·H2O+ 5H2O=MgNH4PO4·6H2O↓1. 反应需在氨缓冲溶液中进行,要有高浓度的PO43-和足够量的NH4+2. 反应的选择性较差,除本组外,其他组很多离子都可能产生干扰30μg10μg·g-1(10ppm)Ca2+ 1.取2滴Ca2+试液,滴加饱和(NH4)2C2O4溶液,有白色的CaC2O4沉淀形成,示有Ca2+1. 反应在HAc酸性、中性、碱性中进行2. Mg2+、Sr2+、Ba2+有干扰,但MgC2O4溶于醋酸,CaC2O4不溶,Sr2+、Ba2+在鉴定前应除去1μg40μg·g-1(40ppm)2.取1~2滴Ca2+试液于一滤纸片上,加1滴6mol·L-1NaOH,1滴GBHA.若有Ca2+存在时,有红色斑点产生,加2滴Na2CO3溶液不褪,示有Ca2+乙二醛双缩[2-羟基苯胺]简称GBHA,与Ca2+在PH=12~的溶液中生成红色螯合物沉淀:1. Ba2+、Sr2+在相同条件下生成橙色、红色沉淀,但加入Na2CO3后,形成碳酸盐沉淀,螯合物颜色变浅,而钙的螯合物颜色基本不变2. Cu2+、Cd2+、Co2+、Ni2+、Mn2+、UO22+等也与试剂生成有色螯合物而干扰,当用氯仿萃取时,只有Cd2+的产物和Ca2+的产物一起被萃取μg1μg·g-1 (1ppm)Ba2+ 1.取2滴Ba2+试液,加1滴·L-1K2CrO4溶液,有BaCrO4黄色沉淀生成,示有Ba2+在HAc-NH4Ac缓冲溶液中进行反应μg70μg·g-1(70ppm)Al3+ 1.取1滴Al3+试液,加2~3滴水,加2滴3mol·L-1NH4Ac,2滴铝试剂,搅拌,微热片刻,加6mol·L-1氨水至碱性,红色沉淀不消失,示有Al3+:1. 在HAc-NH4Ac的缓冲溶液中进行2. Cr3+、Fe3+、Bi3+、Cu2+、Ca2+等离子在HAc缓冲溶液中也能与铝试剂生成红色化合物而干扰,但加入氨水碱化后,Cr3+、Cu2+的化合物即分解,加入(NH4)2CO3,可使Ca2+的化合物生成CaCO3而分解,Fe3+、Bi3+(包括Cu2+)可预先加NaOH形成沉淀而分离μg2μg·g-1 (2ppm)2.取1滴Al3+试液,加1mol·L-1NaOH溶液,使Al3+以AlO2-的形式存在,加1滴茜素磺酸钠溶液(茜素S),滴加HAc,直至紫色刚刚消失,过量1滴则有红色沉淀生成,示有Al3+.或取1滴Al3+试液于滤纸上,加1滴茜素磺酸钠,用浓氨水熏至出现桃红色斑,此时立即离开氨瓶.如氨熏时间长,则显茜素S的紫色,可在石棉网上,用手拿滤纸烤一下,则紫色褪去,现出红色:1. 茜素磺酸钠在氨性或碱性溶液中为紫色,在醋酸溶液中为黄色,在pH=5~介质中与Al3+生成红色沉淀2. Fe3+,Cr3+,Mn2+及大量Cu2+有干扰,用K4[Fe(CN)6]在纸上分离,由于干扰离子沉淀为难溶亚铁氰酸盐留在斑点的中心,Al3+不被沉淀,扩散到水渍区,分离干扰离子后,于水渍区用茜素磺酸钠鉴定Al3+g3g·g-1 (3ppm)Cr3+ 1.取3滴Cr3+试液,加6mol·L-1NaOH溶液直到生成的沉淀溶解,搅动后加4滴3%的H2O2,水浴加热,溶液颜色由绿变黄,继续加热直至剩余的H2O2分解完,冷却,加6mol·L-1HAc酸化,加2滴·L-1Pb(NO3)2溶液,生成黄色PbCrO4沉淀,示有Cr3+:1. 在强碱性介质中,H2O2将Cr3+氧化为CrO42-Cr3+ + 4OH- == CrO2- + 2H2O2CrO2- + 3H2O2 + 2OH- == 2CrO42- + 4H2O Pb2+ + CrO42-== PbCrO4↓2. 形成PbCrO4的反应必须在弱酸性(HAc)溶液中进行2.按1法将Cr3+氧化成CrO42-,用2mol·L-1H2SO4酸化溶液至pH=2~3,加入戊醇、%H2O2,振荡,有机层显蓝色,示有Cr3+:Cr2O72- + 4H2O2 +2H+ == 2H2CrO6 + 3H2O 1. pH<1,蓝色的H2CrO6分解2. H2CrO6在水中不稳定,故用戊醇萃取,并在冷溶液中进行,其他离子无干扰g50g·g-1 (50ppm)Fe3+1.取1滴Fe3+试液放在白滴板上,加l滴K4[Fe(CN)6]溶液,生成蓝色沉淀,示有Fe3+1.K4[Fe(CN)6]不溶于强酸,但被强碱分解生成氢氧化物,故反应在酸性溶液中进行.2.其他阳离子与试剂生成的有色化合物的颜色不及Fe3+的鲜明,故可在其他离子存在时鉴定Fe3+,如大量存在Cu2+、Co2+、Ni2+等离子,也有干扰,分离后再作鉴定.g1g·g-1 (1ppm)2.取l滴Fe3+试液,加1滴·L-1NH4SCN溶液,形成红色溶液示有Fe3+.1.在酸性溶液中进行,但不能用HNO3.2.F-、H3PO4、H2C2O4、酒石酸、柠檬酸以及含有- 或 -羟基的有机酸都能与Fe3+形成稳定的配合物而干扰.溶液中若有大量汞盐,由于形成[Hg(SCN)4]2-而干扰,钴、镍、铬和铜盐因离子有色,或因与SCN-的反应产物的颜色而降低检出Fe3+的灵敏度.g5g·g-1 (5ppm)Fe2+1.取l滴Fe2+试液在白滴板上,加l滴K3[Fe(CN)6]溶液,出现蓝色沉淀,示有Fe2+.1.本法灵敏度、选择性都很高,仅在大量重金属离子存在而[Fe2+]很低时,现象不明显; 2反应在酸性溶液中进行.g2g·g-1 (2ppm)2.取l滴Fe2+试液,加几滴·L-1的邻菲罗琳溶液,生成桔红色的溶液,示有Fe2+. 1.中性或微酸性溶液中进行;2.Fe3+生成微橙黄色,不干扰,但在Fe3+、Co2+同时存在时不适用.10倍量的Cu2+、40倍量的Co2+、140倍量的C2O42-、6倍量的CN-干扰反应;3.此法比1法选择性高;4.如用1滴NaHSO3先将Fe3+还原,即可用此法检出Fe3+.g g·g-1Mn2+取l滴Mn2+试液,加10滴水,5滴2mol·L-1HNO3溶液,然后加固体NaBiO3,搅拌,水浴加热,形成紫色溶液,示有Mn2+.1. 在HNO3或H2SO4酸性溶液中进行;2.本组其他离子无干扰;g16g·g-1 (16ppm)3.还原剂(Cl-、Br-、I-、H2O2等)有干扰.Zn2+1.取2滴Zn2+试液,用2mol·L-l HAc酸化,加等体积(NH4)2Hg(SCN)4溶液,摩擦器壁,生成白色沉淀,示有Zn2+: Zn2+ + Hg(SCN)42- == ZnHg(SCN)4↓或在极稀的CuSO4溶液(<·L-1)中,加(NH4)2Hg(SCN)4溶液,加Zn2+试液,摩擦器壁,若迅速得到紫色混晶,示有Zn2+也可用极稀的CoCl2(<·L-1)溶液代替Cu2+溶液,则得蓝色混晶.1.在中性或微酸性溶液中进行;2.Cu2+形成CuHg(SCN)4黄绿色沉淀,少量Cu2+存在时,形成铜锌紫色混晶更有利于观察;3.少量Co2+存在时,形成钴锌蓝色混晶,有利于观察;4.Cu2+、Co2+含且大时干扰,Fe3+有干扰.形成铜锌混晶时g10g·g-1 (10ppm)2.取2滴Zn2+试液,调节溶液的pH=l0,加4滴TAA,加热,生成白色沉淀,沉淀不溶于HAc,溶于HCl,示有Zn2+.铜锡组、银组离子应预先分离,本组其它离子也需分离.Co2+1.取1~2滴Co2+试液,加饱和NH4SCN溶液,加5~6滴戊醇溶液,振荡,静置,有机层呈蓝绿色,示有Co2+.1.配合物在水中解离度大,故用浓NH4SCN溶液,并用有机溶剂萃取,增加它的稳定性;2.Fe3+有干扰,加NaF掩蔽.大量Cu2+也干扰.大量Ni2+存在时溶液呈浅蓝色,干扰反应.g10g·g-1 (10ppm)2.取1滴Co2+试液在白滴板上,加l滴钴试剂,有红褐色沉淀生成,示有Co2+.钴试剂为-亚硝基--萘酚,有互变异构体,与Co2+形成螯合物,Co2+转变为Co3+是由于试剂本身起着氧化剂的作用,也可能发生空气氧化.1.中性或弱酸性溶液中进行,沉淀不溶于强酸;2.试剂须新鲜配制;3.Fe3+与试剂生成棕黑色沉淀,溶于强酸,它的干扰也可加Na2HPO4掩蔽,Cu2+、Hg2+及其他金属干扰.g10g·g-1 (10ppm)Ni2+取l滴Ni2+试液放在白滴板上,加1滴6mol·L-l氨水,加1滴丁二酮肟,稍等片刻,在凹槽四周形成红色沉淀示有1.在氨性溶液中进行,但氨不宜太多.沉淀溶于酸、强碱,故合适的酸度pH=5~10;2.Fe2+、Pd2+、Cu2+、Co2+、Fe3+、Cr3+、Mn2+等干扰,可事先把Fe2+氧化成Fe3+,加柠檬酸或酒石酸掩蔽Fe3+和其他离子.g3g·g-1 (3ppm)Ni2+.Cu2+1.取l滴Cu2+试液,加1滴6mol·L-1HAc酸化,加l滴K4[Fe(CN)6]溶液,红棕色沉淀出现,示有Cu2+2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]↓1.在中性或弱酸性溶液中进行.如试液为强酸性,则用3mol·L-1NaAc调至弱酸性后进行.沉淀不溶于稀酸,溶于氨水,生成Cu(NH3)42+,与强碱生成Cu(OH)2;2.Fe3+以及大量的Co2+、Ni2+会干扰.g g·g-12.取2滴Cu2+试液,加吡啶(C5H5N)使溶液显碱性,首先生成Cu(OH)2沉淀,后溶解得[Cu(C5H5N)2]2+的深蓝色溶液,加几滴·L-1NH4SCN溶液,生成绿色沉淀,加氯仿,振荡,得绿色溶液,示有Cu2+:Cu2+ + 2SCN-+2C5H5N =[Cu(C5H5N)2(SCN)2]↓250g·g-1 (250ppm)Pb2+取2滴Pb2+试液,加2滴·L-1K2CrO4溶液,生成黄色沉淀,示有Pb2+.1.在HAc溶液中进行,沉淀溶于强酸,溶于碱则生成PbO22-;2.Ba2+、Bi3+、Hg2+、Ag+等干扰20g250g·g-1(250ppm)Hg2+1.取l滴Hg2+试液,加1 mol·L-1KI溶液,使生成沉淀后又溶解,加2滴KI-Na2SO3溶液,2~3滴Cu2+溶液,生成桔黄色沉淀,示有Hg2+: Hg2+ + 4I-= HgI42-2Cu2+ + 4I-=2CuI↓+I22CuI+HgI42-= Cu2HgI4 + 2I-反应生成的I2由Na2SO3除去.1.Pd2+因有下面的反应而干扰:2CuI+Pd2+ = PdI2+ 2Cu+产生的PdI2使CuI变黑;2.CuI是还原剂,须考虑到氧化剂的干扰(Ag+、Hg22+、Au3+、Pt IV、Fe3+、Ce IV等).钼酸盐和钨酸盐与Cul反应生成低氧化物(钼蓝、钨蓝)而干扰.g1g·g-1 (1ppm)2.取2滴Hg2+试液,滴加mol·L-1SnCl2溶液,出现白色沉淀,继续加过量SnCl2,不断搅拌,放置2~3min,出现灰色沉淀,示有Hg2+.1.凡与Cl-能形成沉淀的阳离子应先除去;2.能与SnCl2起反应的氧化剂应先除去;3.这一反应同样适用于Sn2+的鉴定.5g200g·g-1(200ppm)阴离子的鉴定方法沉淀,用玻璃棒摩擦器壁,放置片刻,析出白色晶状沉淀MgNH4PO4,示有PO43-淀能溶于酸,但碱性太强可能生成Mg(OH)2沉淀生成相似的沉淀(MgNH4AsO4),浓度不太大时不生成2.取2滴PO43-试液,加入8~10滴钼酸铵试剂,用玻璃棒摩擦器壁,黄色磷钼酸铵生成,示有PO43-PO43-+3NH4++12MoO42-+24H+= (NH4)3PO4·12 MoO3·6H2O↓+6H2O 1.沉淀溶于过量磷酸盐生成配阴离子,需加入大量过量试剂,沉淀溶于碱及氨水中2.还原剂的存在使MoⅥ还原成“钼蓝”而使溶液呈深蓝色.大量Cl-存在会降低灵敏度,可先将试液与浓HNO3一起蒸发.除去过量Cl-和还原剂有类似的反应.SiO32-也与试剂形成黄色的硅钼酸,加酒石酸可消除干扰4.与P2O74-、PO3-的冷溶液无反应,煮沸时由于PO43-的生成而生成黄色沉淀3μg40μg·g-1(40ppm)Cl-取2滴Cl-试液,加6mol·L-1HNO3酸化,加·L-1AgNO3至沉淀完全,离心分离.在沉淀上加5~8滴银氨溶液,搅动,加热,沉淀溶解,再加6mol·L-1HNO3酸化,白色沉淀重又出现,示有Cl-Br-取2滴Br-试液,加入数滴CCl4,滴入氯水,振荡,有机层显红棕色或金黄色,示有Br-如氯水过量,生成BrCl,使有机层显淡黄色50μg50μg·g-1(50ppm)I- 1.取2滴I-试液,加入数滴CCl4,滴加氯水,振荡,有机层显紫色,示有I- 1.在弱碱性、中性或酸性溶液中,氯水将I-→I22.过量氯水将I2→IO3-,有机层紫色褪去40μg40μg·g-1(40ppm)2.在I-试液中,加HAc酸化,加·L-1NaNO2溶液和CCl4,振荡,有机层显紫色,示有I-Cl-、Br-对反应不干扰μg50μg·g-1(50ppm)NO2- 1.取1滴NO2-试液,加6mol·L-1HAc酸化,加1滴对氨基苯磺酸,1滴α-萘胺,溶液显红紫色,示有NO2-1. 反应的灵敏度高,选择性好2. NO2-浓度大时,红紫色很快褪去,生成褐色沉淀或黄色溶液μgμg·g-12.同I-的鉴定方法2.试液用醋酸酸化,加·L-1KI和CCl4振荡,有机层显红紫色,示有NO2-NO3- 1.当NO2-不存在时,取3滴NO3-试液,用6mol·L-1HAc酸化,再加2滴,加少许镁片搅动,NO3-被还原为 NO2-,取2滴上层溶液,照NO2-的鉴定方法进行鉴定2.当NO2-存在时,在12mol·L-1H2SO4溶液中加入α-萘胺,生成淡红紫色化合物,示有NO3-3.棕色环的形成:在小试管中滴加10滴饱和FeSO4溶液,5滴NO3-试液,然后斜持试管,沿着管壁慢慢滴加浓H2SO4,由于浓H2SO4密度比水大,沉到试管NO2-、Br-、I-、CrO42-有干扰,Br-、I-可用AgAc除去,CrO42-用Ba(Ac)2μg40μg·g-1(40ppm)。
常见阴离子的分离、鉴定

常见阴离子的分离、鉴定1按照以下方式进行碳酸根离子的鉴定:试管中滴加几滴碳酸钠溶液、几滴盐酸溶液,将蘸取澄清石灰水的玻璃棒置于试管口,观察现象。
2按照以下方式进行硝酸根的鉴定:点滴板上滴加几滴硝酸钠溶液、硫酸亚铁颗粒、浓硫酸,观察现象。
3按照以下方式进行亚硝酸根的鉴定:点滴板上滴加亚硝酸钠溶液、醋酸溶液、对氨基苯磺酸、α-奈胺,观察现象。
4按照以下方式进行硫酸根的鉴定:试管中加几滴硫酸钠溶液、盐酸溶液,滴加氯化钡溶液,观察现象。
5按照以下方式进行亚硫酸根的鉴定:试管中加几滴亚硫酸钠溶液、硫酸溶液,滴加高锰酸钾溶液,观察现象。
6按照以下方式进行硫代硫酸根的鉴定:试管中加几滴硫代硫酸钠溶液、硝酸银溶液,观察现象。
7按照以下方式进行磷酸根的鉴定:试管中加几滴磷酸钠溶液、硝酸、钼酸铵,恒温水浴锅中微热,观察现象。
8按照以下方式进行硫离子的鉴定:试管中加硫化钠溶液、氢氧化钠溶液、硝酰铁氰化钠溶液,观察现象。
9按照以下方式进行氯离子的鉴定:离心管中氯化钠、硝酸、硝酸银溶液,微热、离心后倾倒出上清液,滴加氨水观察现象,滴加硝酸观察现象。
10按照以下方式进行碘离子的鉴定:试管中加碘化钾、硫酸、四氯化碳,滴加氯水,观察现象。
11按照以下方式进行溴离子的鉴定:试管中加溴化钾、硫酸、四氯化碳,滴加氯水,观察现象。
12按照以下方式进行氯离子、溴离子和碘离子的分离和鉴定:离心管中加氯化钠溶液、溴化钾溶液、碘化钾溶液,加硝酸酸化后,滴加硝酸银观察现象;离心后弃去上清液,离心管中滴加氨水观察现象,离心后分出上清液,上清液中滴加硝酸观察现象;离心管中加少量锌粉、硫酸,观察现象,再次离心分出上清液,上清液中加入四氯化,滴加氯水观察现象。
13按照以下方式进行硫离子、亚硫酸根离子和硫代硫酸根离子的分离和鉴定:1号和2号试管中均加入硫化钠溶液、亚硫酸钠溶液、硫代硫酸钠溶液,1号试管中加氢氧化钠溶液、亚硝酰铁氰化钠溶液观察现象,2号试管中加少量碳酸铬固体观察现象,2号试管离心后分出上清液至3号和4号试管中,3号试管中加入饱和硫酸锌溶液、亚硝酰铁氰化钠溶液、亚铁氰化钾溶液观察现象,4号试管中滴加硝酸银溶液观察现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.碳酸根离子:用稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了)
2.氯离子:用硝酸银和稀硝酸(银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了)
3.硫酸根离子:
1)用硝酸钡和稀硝酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了)
2)用稀盐酸和氯化钡(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了)
4.银离子:用氯化钠(银离子会和氯离子结合成氯化银,生成沉淀)
5. 氢离子:
1)活泼金属(有氢气生成,现象会产生气泡)2)酸碱指示剂:紫色石蕊试剂(石蕊变红)
3)金属氧化物:如带锈的铁钉(铁锈会退去)
6. 氢氧根离子:酸碱指示剂:无色酚酞(酚酞变红)
7. 铁离子:
1)溶液中呈淡黄色
2)用氢氧化钠(铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀)
8. 亚铁离子:溶液中呈浅绿色
9. 铜离子:
1)溶液中呈蓝色2)用氢氧化钠(铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀)
10. 铵根离子:用碱和和湿润的红色石蕊试纸(铵根离子和碱反应生成呈碱性的氨气,使石蕊试纸变蓝)
11. 钡离子:用稀硫酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀)
化学】高中化学所有离子的鉴别
采用试剂: 石蕊、酚酞和甲基橙
操作步骤和反应现象:
含OH的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深
Cl- 的检验
采用试剂:AgNO3容液、HNO3S液
操作步骤和反应现象:
滴加AgNO3溶液生成白色沉淀,再加稀HNO3%淀不溶, 有关的离子方程式:
Ag++CI- AgCI J
Br- 的检验
采用试剂:AgNO3 HNO溶液,CI2水操作步骤和反应现象:
滴加AgNO豁液生成浅黄色沉淀,沉淀不溶于稀HNO3滴加CI2水振荡后加几滴汽油, 油层红棕色
有关的离子方程式:
Ag++Br- AgBrJ
CI2+2Br- 2CI-+Br2
I- 的检验
采用试剂:AgNO3 HNO溶液,CI2水
操作步骤和反应现象:
滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3滴加CI2水,振荡用CCI4萃取呈紫色
有关的离子方程式:
I- +Ag+ AgI J
CI2+2I- I2+2CI-
S2-的检验
采用试剂:Pb(NO3)2 或Pb(Ac)2
操作步骤和反应现象:
用玻璃棒蘸取被测液于Pb(NO3)2或Pb(Ac)2试纸上,试纸变为黑色有关的离子方程式:
Pb2++S2- PbSJ
SO42■的检验
采用试剂:BaCI2、HNO溶液
操作步骤和反应现象:
向被测溶液滴加BaCI2或Ba(NO3)2溶液,出现白色沉淀,再滴加稀HNO沉淀不溶有关的离子方程式:
Ba2++SO42- BaSO4J
SO32的检验
采用试剂: 稀HNO3 BaCI2、HCI 溶液
操作步骤和反应现象:
取含SO32的溶液,滴加HCI溶液(少量)出现能使品红褪色的气体;如滴加BaCI2 溶液生成白色沉淀; 再加过量HCI
能溶解, 但用硝酸白色沉淀则不溶
有关的离子方程式:
SO32-+2H+ SO2T +H2O
SO32-+Ba2+ BaSO3J
BaSO3+2H+ Ba2++H2O+SO2
3BaSO3+2H++3NO33BaSO4 +2NCf +H2O
CO32的检验
采用试剂:HCI溶液、Ca(OH)2溶液
操作步骤和反应现象:
取含CO32溶液于试管中滴加HCI溶液,发生气泡,再将气泡通入Ca(OH)2溶液中, 溶液发浑浊
有关的离子方程式:
CO32+2H+ CO2T +H2O
CO2+Ca2++2OHCaCO3 +H20
N03的检验
采用试剂:Cu、浓H2SO4
操作步骤和反应现象:
在Cu屑和浓H2SO4昆合物的试管中加入少许含NO3物质的粉末或浓缩溶液,在加热条件下出现棕色气体
有关的离子方程式:
2NO3+4H++Cu Cu2++2NOt2+2H2O
PO43的检验
采用试剂:AgNO3稀HNO3
操作步骤和反应现象:
向含有PO43溶液的试管中滴加AgNO溶液,生成黄色沉淀,再加HNO3B沉淀溶解有关的离子方程式:
PO43-+3Ag+ Ag3PO4
Ag3PO4+3H+ 3Ag++H3PO4。
