实验2 溶液的配置
2溶液配制

计→量→溶→转→洗 →定→摇→装
配制500 mL 0.2 mol/LNaCl溶液 1.计算
需要称)〃V[NaCl(aq)]
=0.5L×0.2mol/L=0.1mol
m(NaCl)=n(NaCl) 〃M(NaCl) =0.1mol×58.5g/mol=5.8g
6.定 容
向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改 用洗瓶滴加去离子水至刻度线。 思考: 若定容时不小心液面超过了刻度 线,怎么办?能用胶头滴管把多 余的液体取出吗? 必须重新配制
7. 摇 匀
将容量瓶盖好塞子,如图示,把容量瓶反复倒转, 使溶液混合均匀。 思考: 摇匀后发现液面低于刻线,能否补 充水? 不能。因为是部分溶液在润湿容 量瓶瓶颈处所致。
俯 视
仰 视
课堂练习
配制100 ml 0.3 mol/L NaCl溶液
[随堂练习]
下列哪些仪器是本实验中用到的?
100ml 20℃
电子分析天平
电子天平是称量精度高 而迅速的电子测量仪器, 可以精确地称量到 0.0001g。电子天平是多 功能、上皿式常量分析 天平,感量为0.1mg,最 大载荷为 210g 。通常只 使用开/关键、除皮/ 调零键和校准/调整键 。
2. 称 量
仪器:称量纸、药匙 思考:NaOH能否直接放在称量纸上称量?为什么? 应如何操作?
称量方法
1.直接称量法 2.固定质量称量法 3.差减称量法
3. 溶 解
提问:除了烧杯外还需要哪些仪器?使用中应注意什么? 还需要玻璃棒。搅拌时沿着一定的方向,玻璃 棒不要碰烧杯底和烧杯壁,不要把玻璃棒放在 实验台上,以免弄脏。
5. 洗 涤
注意事项: 用少量蒸馏水洗涤2~3次,洗涤液要全部转移到 容量瓶中。 思考: 如果用量筒量取液体药品,量筒要洗涤吗? 如果用量筒量取液体药品,量筒不必洗涤。因为这是 量筒的“自然残留液”,若洗涤后转移到容量瓶中会 导致所配溶液浓度偏高。但是使用量筒时应注意选择 的量筒与量取液体的体积相匹配。
实验2溶液的配置

实验 2 溶液的配制一、实验目的1.学习溶液配制方法;2.练习量筒、移液管、容量瓶、密度计的使用,掌握其正确使用方法。
二、实验原理实验室常用的溶液根据其用途不同,可以粗略的分为一般溶液和标准溶液。
一般溶液不用于定量,不需知道其准确浓度,使用时只知道其大致浓度不会影响实验结果;标准溶液在物质的定量分析中使用,所以必须知道其准确浓度。
一般溶液的配制不需要用精密仪器,用精确度为1%天平以及量筒等仪器就可完成。
一些物质容易水解,在配制其溶液时,应先用相应的酸溶液溶解该物质,再加水稀释。
标准溶液的配制可采用直接配制和“粗配精标”两种不同方法。
“粗配精标”方法是如一般溶液的配制一样先粗略配制(尽可能接近目标浓度),然后用基准物质(或另一已知准确浓度的标准溶液)标定(又称为“粗配精标” )。
直接配制标准溶液必须采用分析天平、容量瓶和移液管等仪器。
无论是配制什么溶液,首先都需要根据溶液体积和浓度,计算所需试剂的用量,包括固体试剂的质量或者液体试剂的体积,然后再依法配制。
实验室使用的浓度表示方法很多,主要有质量分数、质量摩尔浓度和物质量浓度。
在配制溶液之前,必须熟悉有关计算和配制步骤。
1.由固体试剂配制溶液(1)质量分数溶质 A 的质量分数w为溶液L中溶质的质量m A与溶液的质量m L之比:w m A m LL A S A Lw (A S由于 m 为溶质质量 m 和溶剂S的质量m之和,所以,m =w m=m+ m ),即m A wm S w S V S 1 w 1 w式中ρρ为 1( 3.98°C 时水的密度值)。
和 V 为溶剂的密度和体积。
如果溶剂是水,取S S S根据计算结果,称取需要量的溶质A,转入烧杯中,用量筒量取需要量的溶剂S 也倒入烧杯中,搅拌溶解(必要时可加热),完全溶解后即为目标溶液。
将溶液倒入试剂瓶中,贴上标签备用。
( 2)物质量浓度若需要配制的溶液物质量浓度为c,体积为 V,则需要溶质 A 的质量m A为m A= cVM式中 M为溶质A的摩尔质量。
实验二 溶液的配制和稀释)

化学实验报告册课程名称:任课教师:学生姓名:班级:学号:日期:实验二溶液的配制与稀释一、实验目的:1、熟悉溶液浓度的计算并掌握一定浓度溶液的配制方法。
2、掌握溶液的配制和稀释的方法。
二、实验仪器与材料:台秤、100ml量筒、100ml容量瓶、10ml移液管(10ml吸量管)、100ml烧杯、50ml烧杯、500ml烧杯、玻璃棒、胶头滴管、药匙、毛刷、蒸馏水、浓盐酸(37%,比重12)、固体NaOH、固体NaCl、95%酒精。
三、实验内容:在配制溶液时,根据所配制溶液的浓度和体积来计算所需溶质的质量。
溶质如果是不含结晶水的纯物质,则计算比较简单。
如果是含有结晶水的纯物质,计算时一定要把结晶水计算在内,或把结晶水处理为一个反应方程式来进行计算。
1、一定质量浓度溶液的配制:溶液的质量浓度是指1L溶液中含溶质的克数。
在配制此溶液时,如需要配制溶液的体积和质量浓度已知,就可计算出所需溶质的克数。
然后用台秤称出所需克数的溶质,再将溶质溶解并加水至需要的体积。
如用已知质量的溶质配制一定质量浓度的溶液,则须计算出所配制溶液的体积,然后按上述方法配制溶液。
2、一定物质的量浓度溶液的配制:溶液的物质的量浓度是指1L溶液中所含溶质的物质的量。
在配制此种溶液时,首先要根据所需浓度和配制体积,正确计算出溶质的物质的量(包括结晶水),再通过摩尔质量计算出所需溶质的质量。
3、溶液的稀释:在溶液稀释时需掌握的一个原则是:稀释前后溶液中的溶质的量不变。
根据浓溶液的浓度和体积与所要配制的稀溶液的浓度和体积,利用稀释公式C1V1=C2V2或十字交叉法,计算出浓溶液所需体积并量出,然后加水稀释至所需稀溶液的体积。
四、注意事项:1、在配制溶液时,根据所配制溶液的浓度和体积来计算所需溶质的质量。
溶质如果不含结晶水的纯物质,则计算比较简单。
如果是含有结晶水的物质,计算时一定要把结晶水计算在内。
2、浓盐酸具有强腐蚀性,实验过程中注意切勿将浓盐酸滴到手或衣服中。
《无机化学实验》课件——实验二 溶液的配制

定量转移 容量瓶的拿法
溶液的配制—数据记录
1. 质量百分浓度溶液的配制
项目
CuSO4·5H 2O 水
质量/g
2、物质的量浓度溶液的配制 (1)配制0.5mol/L Na2CO3溶液50mL
Na2CO3的质量/g:
溶液的配制—数据记录
(2)配制0.1mol/L Na2CO3溶液502CO3溶液 水
(3)配制1.000mol/LNaCl溶液50.00mL
NaCl固体的质量/g:
(4)0.1000mol/LNaCl溶液250.0mL 1.000mol/LNaCl的体积/ mL:
Thank You!
21
溶液
生命科学学院应用化学系
要求准确
溶液的配制
3、实验仪器与试剂
(1)仪器
台秤,电子天平,250mL容量瓶一个,50mL容量瓶一个, 25mL移液管一支,10mL吸量管一支,10mL、50mL量筒各 一个,50mL、100mL烧杯若干
(2) 试剂
CuSO4•5H2O, 29%NaOH, 浓H2SO4,Na2CO3(s), NaCl(CR)
(3) 其它
称量用硫酸纸,洗耳球,称量瓶,纸带,药匙
溶液的配制
4、操作步骤
1 质量百分浓度溶液的配制─配制0.2%的硫酸铜溶液 100mL
2 物质的量浓度溶液的配制 ①配制0.5mol/L Na2CO3溶液50mL ②配制0.1mol/L Na2CO3溶液50mL(用① 溶液配制) ③配制1.000mol/LNaCl溶液50.00mL ④0.1000mol/LNaCl溶液250.0mL (用③溶液配制)
溶液的配制
5、主要技术操作
➢电子天平的使用 ➢移液管的使用 ➢容量瓶的使用
实验二.溶液的配制及分析

一、物质的量浓度
1、定义: 以单位体积溶液里所含溶质B的物质的量来
表示溶液组成的物理量,叫做溶质B的物质的量浓度。
2、符号:CB 3、表达式:物质的量浓度= nB CB = V 4、单位: 摩尔/升( mol/L) 5、注意:
①、体积指的是溶液的体积,而不是溶剂的体积。 ②、溶质用物质的量表示,而不是用质量表示。
能否将溶解的NaCl溶液立即注入容量瓶中?
答:不能,要在烧杯中溶解,待烧杯中溶液 的温度恢复到室温(或冷却室温)时,(特 别是溶解或稀释时有明显的热量变化)才 能溶液转移到容量瓶中.
溶解
①能否用容量瓶来溶解固体物质?
②除了烧杯外还需要什么仪器? ③溶质溶解后,溶液是否可马上移入容量瓶中呢? 思考:若量取的是浓硫酸需要稀释,应如何操作?
配制100ml 0.1mol/L氯化钠溶液
1.容量瓶的特点:①容量瓶上标有温度和容积 ②容量瓶瓶颈上有一道刻度线
2.注意事项:①使用前要检查是否漏水;②溶解不能 在容量瓶中进行;③溶液恢复至室温后才能转移入 容量瓶; ④转移溶液时要用玻棒进行引流
规格:50mL、100mL 、250mL 、 500mL、 1000mL等,一般标记的 温度为20℃ , 如右图所示:
5.定容时俯视观察液面;( ) 6.将溶液转移到容量瓶之前,容量瓶 中有少量蒸馏水;( ) 7.将配得的溶液从容量瓶转移到干燥、 洁净的试剂瓶中时,有少量溅出;
(
)
误差分析
能引起误差的一些操作
(以配制0.1mol/L的NaOH溶液为例)
称量前小烧杯内有水 称量时间过长
用滤纸称NaOH 向容量瓶注液时少量洒出
在溶液配制过程中哪些操作可能引起 溶液浓度的误差? ①固体药品的称量与液体药品的量取是否准确; ②把溶液向容量瓶中转移,溶液洒了; ③未洗涤烧杯和玻璃棒; ④定容时水加多了或加少了; ⑤定容时未平视刻度线,等。
实验二 酸碱标准溶液的配制与标定

实验二酸碱标准溶液的配制与标定一、实验目的:1.掌握间接法配制HCl、NaOH标准溶液的方法。
2. 熟练掌握差减称量法称取基准物的方法及滴定操作基本技能。
3.学习酸碱标准溶液的标定方法。
二、实验原理:在酸碱滴定法中,常用到盐酸或氢氧化钠标准溶液,它们都不宜直接配制,因为浓盐酸易挥发,浓度和纯度不一,固体氢氧化钠中常因吸收空气中的二氧化碳和水蒸气,而含有碳酸钠和水分,因此,只能先将它们配制成近似浓度的溶液。
然后通过标定来确定它们的准确浓度。
1.标定盐酸的基准物质:硼砂Na2B4O7·10H2O和无水碳酸钠Na2CO3。
(1)硼砂(四硼酸钠,Na2B4O7·10H2O):易制得纯品,不易吸水,性质比较稳定,而且摩尔质量较大(381.37g/mol),称量误差小,是标定HCl溶液常用的基准物质,但硼砂易风化失水,需保存在相对湿度为60%密闭容器中。
1︰2反应,其标定反应为:Na2B4O7·10H2O + 2HCI =2NaCI + 4H3BO3 + 5H2O 在化学计量点时,由于生成的硼酸是弱酸,溶液pH=5.1,可用甲基橙作指示剂。
(2)无水碳酸钠(Na2CO3):容易制得纯品,摩尔质量为105.99g/mol,但易吸湿,使用前应在3000C干燥1小时,保存在干燥器中,用时称量要快,以免吸水而引入误差。
1︰2反应,其标定反应为:Na2CO3 + 2HCI =2NaCI + CO2+ H2O计量点时,溶液pH =3.9,可用甲基红作指示剂。
本实验采用的方法是:称取硼砂后直接用盐酸滴定的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,求出盐酸溶液的准确浓度。
2.标定氢氧化钠的基准物质:邻苯二甲酸氢钾和草酸。
(1)邻苯二甲酸氢钾(KHC8H4O4):易制得纯品,在空气中不吸水,易保存,且摩尔质量较大(204.23g/mol),称量误差小,是标定NaOH溶液较为理想的基准物质。
实验二 盐酸标定溶液的配制和标定

实验二 盐酸标准溶液的配制和标定,NaOH 溶液浓度的测定一、原理首先配制约0.1mol/L 的盐酸溶液,然后以甲基橙作指标剂,用已知准确浓度的22CO Na 标准溶液来标定盐酸的准确浓度。
利用此HCl 溶液测定NaOH 溶液的浓度。
↑+++22222CO O H NaCl CO Na二、试剂22CO Na 基准物:分析纯; 浓盐酸(比重1.19,):分析纯; 0.1%甲基橙:称取0.1g 甲基橙,溶于100mL 蒸馏水中。
三、测定步骤(一)22CO Na 标准溶液的配制——直接法在分析天平上,用差减法称取22CO Na 约1.2g~1.4g (准确至0.0001g )于小烧杯中,加入约50mL 蒸馏水,用玻璃棒搅拌,使其完全溶解,然后全部转移到250mL 容量瓶中,用水稀释到刻度。
盖好瓶塞,摇匀。
NaCO3m 1000C M V⨯=(mol/L ) 式中: m ——22CO Na 的重量(g ) M ——22CO Na 的分子量;V ——22CO Na 的溶液的体积,即容量瓶的体积(mL ) (二)0.1mol/L HCl 溶液的配制及标定——间接法 HCl 溶液的配制:用小量筒量取浓盐酸约4.5mL 于500mL 清洁的试剂瓶,加蒸馏水至500mL 。
HCl 溶液浓度的标定:用移液管准确吸取25.00mL 已知准确浓度的22CO Na 溶液于250ml 锥形瓶中,加入甲基橙指标剂两滴,用HCl 溶液滴定至溶液颜色由黄色变为橙红色且摇动不消失即为滴定终点,记录滴定管的终点读数,终点读数与起始读数之差,即为滴定所用HCl 溶液的体积。
平行做三份,滴定的相对平均偏差不应超过0.2%。
(三)NaOH溶液的浓度的测定取25.00mlNaOH溶液三份分别置于250ml锥形瓶中,加入1~2滴甲基橙指示剂,用HCl标准溶液滴定至橙色即为终点。
滴定的相对平均偏差不应超过0.2%。
四、原始数据及数据处理1.HCl溶液浓度的计算2.NaOH溶液浓度的计算(要计算结果的平均值及相对平均偏差)请大家注意,做《HCl溶液的配制、标定及测定NaOH浓度》这个实验时,要求一个大桌四个组的数据(NaOH浓度,4*3=12个)集中起来做数据处理,计算结果包括平均值、标准偏差、置信区间,还要考虑可疑值的剔除。
溶液配制 (2)

欢迎共阅
甲醇-醋酸-水(35:4:61)取醋酸4ml,甲醇35ml,加入水61ml中,混匀,即得。
本液应临用新制。
甲醇-水-磷酸(47:53:0.2)取磷酸0.2ml、甲醇47ml,加入水53ml中,混匀,即得。
本液应临用新制。
甲醇-0.2mol/L醋酸溶液-冰醋酸(67:33:1)取3.3ml的醋酸加水至
100ml,混匀;取冰醋酸1ml,甲醇67ml,加入上述醋酸溶液33ml中,混匀,即
0.01mol/L、0.05mol/L、0.1mol/L、0.2mol/L盐酸液取0.01mol/L、0.05mol/L、0.1mol/L、0.2mol/L盐酸滴定液(检验标准操作规程附录
ZT-TS-02-04-042-01)。
1→2盐酸溶液取盐酸50ml,加入水中,使成100ml,混匀,即得。
1→4盐酸溶液取1→2盐酸溶液稀释,即得。
1→40盐酸溶液取1→4盐酸溶液稀释,即得。
4→10盐酸溶液取盐酸40ml,加入水中使成100ml,混匀,即得。
欢迎共阅
18→1000盐酸溶液取盐酸18ml,加入水中使成1000ml,混匀,即得。
1%盐酸溶液取盐酸10ml,加入水中使成1000ml,混匀,即得。
5%盐酸乙醇溶液取盐酸0.5ml,加入乙醇中使成100ml,混匀,即得。
本液应临用新制。
1.8→100盐酸甲醇溶液取盐酸1.8ml,加入甲醇中使成100ml,混匀,即得。
1mol/L硝酸溶液取硝酸91ml,加入水中使成1000ml,混匀,即得。
1→2硝酸溶液取硝酸50ml,加入水中使成100ml,混匀,即得。
实验2 缓冲溶液的配制与pH值的测定

实验2 缓冲溶液的配制与pH 值的测定一、实验目的1、理解缓冲溶液的定义及其特点。
2、理解缓冲溶液的缓冲原理。
3、掌握溶液的粗略配制方法和缓冲溶液的配制方法。
3、学习pH 计的使用方法。
二、实验原理在共轭酸碱对组成的混合溶液中加入少量强酸或强碱,溶液的pH 值基本上无变化,这种具有保持溶液pH 值相对稳定性能的溶液称为缓冲溶液。
缓冲溶液的特点是在适度范围内既能抗酸、又能抗碱,抵抗适度稀释或浓缩。
常见的缓冲体系有:HAc-NaAc 、NH 3-NH 4Cl 、Na 2B 4O 7·10H 2O-Na 2CO 3、KH 2PO 4- Na 2HPO 4等。
对于弱酸HB 及其共轭碱B -组成的缓冲溶液:对于弱碱B 及其共轭酸BH +组成的缓冲溶液:一般配制缓冲溶液时,常使c b =c a ,此时缓冲容量最大,缓冲能力最强。
三、实验用品 1、仪器PB-10酸度计、电子天平(常数双杰JJ600)b ac cHB pKa pH B c HB c HB pKa pH B c HB c Ka H c B O H O H HB lg )()()(lg)()()()(32-=-==+⇔+--+-+θθθab bc c pK pOH lg-=θ2、器材5mL量筒(1个)、10mL量筒(1个)、50mL烧杯(10个)、标签纸、玻璃棒(1根)3、试剂浓氨水(28%)、NHCl(s)、冰醋酸(99%)、NaAc(s)、KCl(3mol·L-1)4标准缓冲溶液(pH6.86;pH4.01)四、实验内容1、溶液的粗略配制Cl溶液的配制(1)0.1mol·L-1NH4Cl,倒入50mL带有刻度的用精度为0.01g的电子天平称取0.27g 固体NH4洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。
(2)0.1mol·L-1氨水溶液的配制用5mL量筒量取0.38mL浓氨水(28%),倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。
实验2溶液的配制

无 机 及 分 析 化 学
主讲教师: 王金观 主讲教师:
实验一 溶液的配制
实验目的: 实验目的:
1 、熟悉溶液浓度的计算, 熟悉溶液浓度的计算, 掌握一定浓度溶液的配制
无 机 及 分 析 化 学
2、 、 的 3、 、 液
、
、
的
实验原理
溶液配制的一般步骤 固体物质配制成溶液: 物质配制成溶液 固体物质配制成溶液:
实验报告要求
• 实验名称 • 实验日期 • 实验目的 • 实验原理
无 机 及 分 析 化 学
• 实验内容 • 实验现象或数据处理 • 实验结果和讨论(实验小结) 实验结果和讨论(实验小结) • 实验者签名
感谢各位同学的认真配合, 感谢各位同学的认真配合, 敬请提出宝贵的意见和建议! 敬请烧杯壁和玻璃 棒上的碳酸钠未被转移。 棒上的碳酸钠未被转移。因此 要用蒸馏水洗涤用过的烧杯和 玻璃棒。 玻璃棒。
5. 洗涤
用少量蒸馏水洗涤烧杯2~ 次 用少量蒸馏水洗涤烧杯 ~3次,洗涤液要全部转移 到容量瓶中。 到容量瓶中。
思考:如果用量筒量取液体药品, 思考:如果用量筒量取液体药品,量筒需 要洗涤吗? 要洗涤吗?
无 机 及 分 析 化 学
计算→称量 溶解 转移→洗涤 定容→摇匀 计算 称量→溶解 转移 洗涤 定容 摇匀 称量 溶解→转移 洗涤→定容 天 平 烧 杯 玻 璃 棒 少 量 多 次 容 量 瓶
实验原理
溶液配制的一般步骤 浓溶液稀释成稀溶液: 溶液稀释成稀溶液:
无 机 及 分 析 化 学
计算→量取 稀释 转移→洗涤 定容→摇匀 计算 量取→稀释 转移 洗涤 定容 摇匀 量取 稀释→转移 洗涤→定容 移 液 管 吸 量 管 或 烧 杯 玻 璃 棒 少 量 多 次 容 量 瓶
实验二 氢氧化钠溶液的配制与标定

实验二 氢氧化钠溶液的配制与标定内容:P190-192一、实验目的1. 掌握间接法配制溶液的方法2. 进一步学习碱式滴定管的洗涤和滴定操作方法3. 学习标定NaOH 溶液的方法4. 进一步掌握差减法称量的正确方法二、实验原理由于NaOH 易吸收空气中的水蒸气及CO 2,故它只能用间接法配制,然后用基准物质标定其准确浓度。
用邻苯二甲酸氢钾( )作基准物质标定NaOH 溶液浓度有以下几个优点:(1)该物质易得到纯品;(2)易干燥,不吸水;(3)摩尔质量大,称量误差小。
邻苯二甲酸氢钾与NaOH 溶液的反应式为:H 2O由于生成的邻苯二甲酸钾钠盐溶液呈弱碱性,溶液pH ≈9,故可选用酚酞作指示剂。
最后从邻苯二甲酸氢钾的质量和所消耗的NaOH 溶液体积,可以计算出NaOH 溶液的准确浓度(C NaOH )。
三、实验仪器与试剂1. 仪器碱式滴定管 烧杯(250 mL ) 量筒(100 mL ) 玻璃棒 电子天平 台秤 表面皿 2. 试剂邻苯二甲酸氢钾(KHC 8H 4O 4)(固体,A.R.,已烘干) 酚酞指示剂(0.2 %)NaOH 溶液(待测)四、实验内容1. 配制NaOH 溶液(0.1 mol ·L –1)(此步由实验室准备)用表面皿在台秤上迅速称取固体NaOH 2 g 放入烧杯中,加入50 mL 新鲜的蒸馏水,使之溶解,再稀释至500 mL ,倒入干净的细口试剂瓶中,用橡皮塞塞紧,以防NaOH 溶液吸收空气中的CO 2而改变浓度,贴上标签。
2. NaOH 标准溶液的标定在电子天平上用差减法准确称取0.4~0.6 g 邻苯二甲酸氢钾三份(质量尽可能接近,以利终点判断),分别放入三个做好标记的250 mL 烧杯中,然后分别加入30 mL 蒸馏水溶解(必要时可稍加热,使之完全溶解),再加入2滴0.2 %酚酞指示剂。
用待标定的NaOH 溶液滴定至溶液刚出现微红色,半分钟不褪色,即为终点。
记录所消耗的NaOH 溶液的体积V NaOH (mL),平行标定三份。
实验二 缓冲溶液的配制和性质
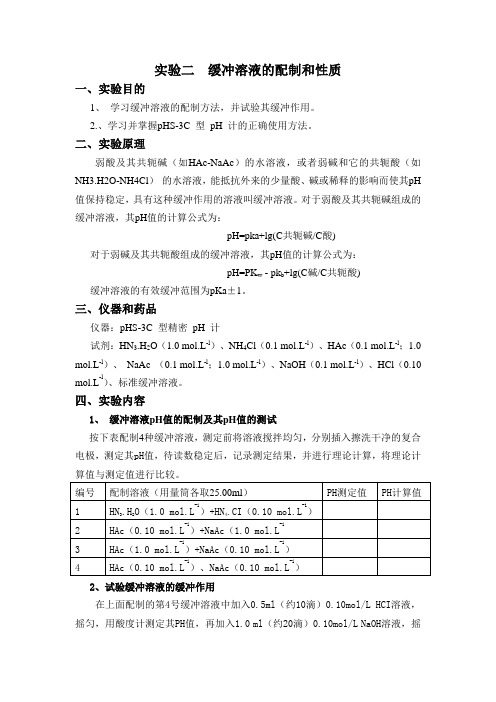
实验二缓冲溶液的配制和性质一、实验目的1、学习缓冲溶液的配制方法,并试验其缓冲作用。
2.、学习并掌握pHS-3C 型pH 计的正确使用方法。
二、实验原理弱酸及其共轭碱(如HAc-NaAc)的水溶液,或者弱碱和它的共轭酸(如NH3.H2O-NH4Cl)的水溶液,能抵抗外来的少量酸、碱或稀释的影响而使其pH 值保持稳定,具有这种缓冲作用的溶液叫缓冲溶液。
对于弱酸及其共轭碱组成的缓冲溶液,其pH值的计算公式为:pH=pka+lg(C共轭碱/C酸)对于弱碱及其共轭酸组成的缓冲溶液,其pH值的计算公式为:pH=PK w - pk b+lg(C碱/C共轭酸) 缓冲溶液的有效缓冲范围为pKa±1。
三、仪器和药品仪器:pHS-3C 型精密pH 计试剂:HN3.H2O(1.0 mol.L-l)、NH4Cl(0.1 mol.L-l)、HAc(0.1 mol.L-l;1.0 mol.L-l)、NaAc (0.1 mol.L-l;1.0 mol.L-l)、NaOH(0.1 mol.L-l)、HCl(0.10 mol.L-l)、标准缓冲溶液。
四、实验内容1、缓冲溶液pH值的配制及其pH值的测试按下表配制4种缓冲溶液,测定前将溶液搅拌均匀,分别插入擦洗干净的复合电极,测定其pH值,待读数稳定后,记录测定结果,并进行理论计算,将理论计算值与测定值进行比较。
2、试验缓冲溶液的缓冲作用在上面配制的第4号缓冲溶液中加入0.5ml(约10滴)0.10mol/L HCI溶液,摇匀,用酸度计测定其PH值,再加入1.0 ml(约20滴)0.10mol/L NaOH溶液,摇实验完成后,清洗电极,整理仪器。
三、设计和配制PH=3.9、PH=6.0的磷酸盐缓冲溶液和PBS缓冲溶液PH=3.9,配一个磷酸溶液(pH应该在1.8左右),用NaOH调到想要的pH即可PH=6.0,0.2 Mol/L Na2HPO4(12.2ml) 0.2Mol/L KH2PO4(87.8ml)五、思考题1、怎样根据缓冲溶液的PH值选定缓冲物质?2、为什么在通常情况下配制的缓冲溶液中酸(或碱)的浓度与其共轭碱(或共轭酸)的浓度接近?这种缓冲溶液的PH值主要决定于什么?3、将10mL0.2mol.L-1 HAc和10mL0.1mol.L-1 NaOH混合,问所得到溶液是否有缓冲作用?这个溶液的pH值在什么范围内?。
实验二 粗略配制50mL 0.1mol·L-1 CuSO4溶液

实验二 粗略配制50mL 0.1mol/L CuSO 4溶液
一、实验目的
1、熟练掌握配制一定物质的量浓度的溶液
2、加深对物质的量浓度概念的理解
二、实验原理
用胆矾晶体(CuSO 4·5H 2O )配制CuSO 4溶液
三、实验所需仪器及药品
电子天平、小烧杯、药匙、玻璃棒、量筒、蒸馏水、CuSO 4·5H 2O 固体、试剂瓶
四、实验步骤
1、计算
所需固体CuSO 4·5H 2O 的质量为4CuSO (m g 25.1mol /g 250L /mol 1.010mL 50O H 5·(324=⨯⨯⨯=-)CuSO m
2、称量
将CuSO 4·5H 2O 固体置于烧杯中,用电子天平称量1.25g CuSO 4·5H 2O 固体
3、溶解
将CuSO 4·5H 2O 固体置于100mL 烧杯中,加入50mL 蒸馏水,用玻璃棒搅拌并冷却到室温
4、装瓶
将配好的50mL 0.1mol/L CuSO 4溶液装入试剂瓶,并贴上标签
五、实验现象
CuSO 4·5H 2O 溶解在水中,为蓝色、透明液体,即CuSO 4溶液
六、注意事项
1、在溶解过程中,不能用玻璃棒剧烈搅拌,否则溶液易溅出。
实验二 酸碱标准溶液的配制和浓度比较

实验二酸碱标准溶液的配制和浓度比较一、实验目的1.巩固滴定管的使用,学习移液管的使用方法。
2.掌握NaOH、HCI标准溶液的配制、浓度的比较滴定。
3.初步掌握半滴操作和用甲基橙、酚酞指示剂确定终点的方法。
4.掌握滴定结果的数据记录和数据处理方法。
二、实验原理酸碱滴定中常用盐酸和氢氧化钠溶液作为标准溶液。
但由于浓盐酸易挥发,氢氧化钠易吸收空气中的水份和二氧化碳,不符合直接法配制的条件,因此只能用间接法配制盐酸和氢氧化钠标准溶液:即先配制近似浓度的溶液,然后用基准物质标定其准确浓度。
也可用酸碱溶液中已知其中之一的准确浓度,通过滴定得到它们的体积比,然后根据它们的体积比求得另一标准溶液的准确浓度。
强酸和强碱相互滴定,其pH突跃范围为 4.30~9.70 (化学计量点时pH=7.00),因此甲基橙(3.1~4.4)、甲基红(4.4~6.2)、中性红(6.8~8.0)、酚酞(8.0~9.6)等指示剂都可指示终点。
当指示剂一定时,用一定浓度的HCl和NaOH相互滴定,指示剂变色时,所消耗的体积比V HCl/V NaOH不变,与被滴定溶液的体积无关。
借此可检验滴定操作技术和判断终点的能力。
三、主要试剂和仪器1.HCI溶液:6mol.L-1。
2.固体NaOH 。
3.甲基橙指示剂:1g.L-1。
4.酚酞指示剂:1g.L-1 90%乙醇溶液。
5.500 ml试剂瓶2个(一个带玻璃塞, 另一个带橡胶塞)。
6.酸、碱滴定管(50ml),锥形瓶等四、实验步骤1、0.1 mol.L-1HCl溶液(500ml)的配制用10 ml的洁净量筒量取约6 mol.L-1HCl ml,倒入盛有400 ml水的试剂瓶中,加蒸馏水至500 ml,盖上玻璃塞,充分摇匀。
2、0.1mol.L-1NaOH溶液( 500ml)的配制用台秤迅速称取约2.1 g NaOH于100mL小烧杯中,加约30mL无CO的纯水溶解,2然后转移至棕色试剂瓶中,用纯水稀释至500mL,摇匀后,用橡皮塞塞紧。
实验二溶液的配置演示文稿

五、实验步骤
4.稀释溶解: 用电子天平称取固体氯化钠0.9g 放进小烧 杯加少量水溶解(约30 mL左右)、 5.转移:将4步骤中溶解好的氯化钠溶液用玻 璃棒转移到100mL容量瓶。 6.洗涤:用适量蒸馏水(溶剂)将烧杯和玻璃 棒洗涤2~3次,将洗涤液也转移到容量瓶。 注意洗涤液倒入后一定不能超过容量瓶刻度 线。否则溶液要重新配置。
五、实验步骤
7.定容: 向容量配中继续加水至刻度线1~2cm处, 改用胶头滴管加水。直至溶液凹液面与刻度 线平齐。 8.摇匀:盖好瓶塞,用食指顶紧,另一只手的 手指托住瓶底,上下颠倒,使溶液混合均匀。 9.储存:将溶液倒入试剂瓶中,贴签,保存、 备用。
六、注意事项
1、溶解或稀释溶质时,溶剂的量应 适当;若有放热现象或以加热促使溶 解,应使溶液冷却至室温再转移至容 量瓶。 2、搅拌或转移溶液时要缓慢,防止 溶液外溅,否则应重新配制溶液。
实验二、溶液的配制
2学时
一、实验目的
1、掌握溶液的配制方法。 2、熟悉容量瓶、烧杯、天平等 的使用。
二量瓶 2.烧杯 3.滴管 4.量筒 5.玻璃棒 6.天平等
四、实验内容
配置100mL 9g/L的NaCl溶液
五、实验步骤
1.仪器准备: 100mL容量瓶、小烧杯(100 mL左右)、 量筒(50 mL左右)、玻璃棒、滴管、天 平、称量纸等 2.试剂准备: 固体氯化钠 3.计算:
实验二、一般溶液的配制

实验二、一般溶液的配制【实验目的】1、学会台秤以及量筒等的使用方法;2、掌握一般溶液的配制方法和基本操作。
【实验原理】在化学实验中,常常需要配制各种溶液来满足不同实验成绩的要求。
如果实验对溶液浓度的准确性要求不高,一般利用台秤、量筒、带刻度烧杯等低准确度的仪器配制就能满足需要。
如果实验对溶液浓度的准确性要求较高,如定量分析实验,这就需要使用分析天平、移液管、容量瓶等高准确度的仪器配制溶液。
对于易水解的物质,在配制溶液时还要考虑先用相应的酸溶解易水解的物质,再加水稀释。
无论是粗配还是准确配制一定体积、一定浓度的溶液,首先要计算所需试剂的用量,包括固体试剂的质量或液体试剂的体积(称量或量取),然后再进行配制。
不同浓度的溶液在配制时的具体计算及配制步骤如下。
一、固体试剂配制溶液1. 质量分数(百分浓度)因为 m X m =溶质溶液所以 X1V X X 1X -=-=溶剂溶剂溶剂溶质ρm m如果溶剂为水(3.98℃时,ρ溶剂=1.0000g·mL-1)1X VmX⋅=-溶剂溶质式中X:溶质质量分数;m溶质:固体试剂的质量;m溶剂:溶剂质量;V溶剂:溶剂体积;ρ溶剂:溶剂的密度。
计算出配制一定质量分数的溶液所需固体试剂质量,用台秤称取,倒入烧杯,再用量筒取所需去离子水倒入烧杯,搅动,使固体完全溶解即得所需溶液,将溶液倒入试剂瓶中,贴上标签备用。
2. 物质的量浓度(摩尔浓度)m溶质= c.V.M式中C:物质的量浓度,单位为mol·L-1;V:溶液体积,单位为L;M:固体试剂摩尔质量,单位为g·mol-1(1)粗略配制算出配制一定体积溶液所需固体试剂的质量,用台秤称取所需试剂,倒入带刻度烧杯中,加入少量去离子水搅动使固体全部溶解,用去离子水稀释至刻度,即得所需溶液。
然后将溶液移入试剂瓶中,贴上标签,备用。
*(2)准确配制算出配制一定体积准确浓度溶液所需固体试剂的质量。
并在分析天平上准确称出它的质量,放在干净的小烧杯中,加适量去离子水搅动使固体全部溶解。
配置溶液实验报告步骤(3篇)

第1篇一、实验目的1. 掌握配置溶液的基本操作方法;2. 熟悉实验室常规仪器的使用;3. 了解溶液浓度的计算和配制。
二、实验原理溶液是由溶质和溶剂组成的均匀混合物。
溶液的浓度是指溶质在溶液中的质量分数或摩尔浓度。
配置溶液的目的是为了获得特定浓度的溶液,以满足实验需要。
三、实验仪器与试剂1. 仪器:电子天平、量筒、烧杯、玻璃棒、滴定管、移液管、容量瓶等。
2. 试剂:待配置溶液的溶质、溶剂、标准溶液等。
四、实验步骤1. 计算所需溶质的质量根据实验要求,计算所需溶质的质量。
例如,若需配置1000mL 0.1mol/L的NaCl 溶液,需计算NaCl的质量:n = c × V = 0.1mol/L × 1L = 0.1molm = n × M = 0.1mol × 58.44g/mol = 5.844g2. 称量溶质使用电子天平称取所需质量的溶质,准确到0.01g。
3. 溶解溶质将称取的溶质放入烧杯中,加入少量溶剂,用玻璃棒搅拌至溶质完全溶解。
4. 定容将溶解好的溶液转移到容量瓶中,用溶剂冲洗烧杯和玻璃棒,并将冲洗液一并转移到容量瓶中。
5. 加溶剂至刻度线继续向容量瓶中加入溶剂,直至溶液液面接近刻度线1-2cm处。
6. 调整液面至刻度线改用胶头滴管小心滴加溶剂,使溶液液面与刻度线相切。
7. 混匀溶液盖好容量瓶瓶盖,倒转容量瓶几次,使溶液充分混匀。
8. 配制标准溶液若需配制标准溶液,按照上述步骤,使用移液管准确量取一定体积的标准溶液,加入溶剂定容。
五、实验数据记录与处理1. 记录实验过程中所使用的仪器、试剂、溶质质量、溶剂体积等数据。
2. 根据实验数据,计算溶液的浓度。
3. 对实验结果进行分析,讨论实验误差来源。
六、实验结果与分析1. 实验结果根据实验数据,计算出所配置溶液的浓度。
2. 分析(1)实验误差分析:实验误差主要来源于称量误差、量筒读数误差、溶液体积测量误差等。
实验2 溶液的配置

实验2 溶液的配制一、实验目的1.学习溶液配制方法;2.练习量筒、移液管、容量瓶、密度计的使用,掌握其正确使用方法。
二、实验原理实验室常用的溶液根据其用途不同,可以粗略的分为一般溶液和标准溶液。
一般溶液不用于定量,不需知道其准确浓度,使用时只知道其大致浓度不会影响实验结果;标准溶液在物质的定量分析中使用,所以必须知道其准确浓度。
一般溶液的配制不需要用精密仪器,用精确度为1%天平以及量筒等仪器就可完成。
一些物质容易水解,在配制其溶液时,应先用相应的酸溶液溶解该物质,再加水稀释。
标准溶液的配制可采用直接配制和“粗配精标”两种不同方法。
“粗配精标” 方法是如一般溶液的配制一样先粗略配制(尽可能接近目标浓度),然后用基准物质(或另一已知准确浓度的标准溶液)标定(又称为“粗配精标”)。
直接配制标准溶液必须采用分析天平、容量瓶和移液管等仪器。
无论是配制什么溶液,首先都需要根据溶液体积和浓度,计算所需试剂的用量,包括固体试剂的质量或者液体试剂的体积,然后再依法配制。
实验室使用的浓度表示方法很多,主要有质量分数、质量摩尔浓度和物质量浓度。
在配制溶液之前,必须熟悉有关计算和配制步骤。
1. 由固体试剂配制溶液(1)质量分数溶质A 的质量分数w 为溶液L 中溶质的质量m A 与溶液的质量m L 之比:m w m =A L由于m L 为溶质质量m A 和溶剂S 的质量m S 之和,所以,m A = w m L = w (m A + m S ),即11S S S A wm w V m w wρ==-- 式中ρS 和V S 为溶剂的密度和体积。
如果溶剂是水,取ρS 为1(3.98 °C 时水的密度值)。
根据计算结果,称取需要量的溶质A ,转入烧杯中,用量筒量取需要量的溶剂S 也倒入烧杯中,搅拌溶解(必要时可加热),完全溶解后即为目标溶液。
将溶液倒入试剂瓶中,贴上标签备用。
(2)物质量浓度若需要配制的溶液物质量浓度为c ,体积为V ,则需要溶质A 的质量m A 为m A = cVM式中M 为溶质A 的摩尔质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验2 溶液的配制
一、实验目的
1.学习溶液配制方法;
2.练习量筒、移液管、容量瓶、密度计的使用,掌握其正确使用方法。
二、实验原理
实验室常用的溶液根据其用途不同,可以粗略的分为一般溶液和标准溶液。
一般溶液不用于定量,不需知道其准确浓度,使用时只知道其大致浓度不会影响实验结果;标准溶液在物质的定量分析中使用,所以必须知道其准确浓度。
一般溶液的配制不需要用精密仪器,用精确度为1%天平以及量筒等仪器就可完成。
一些物质容易水解,在配制其溶液时,应先用相应的酸溶液溶解该物质,再加水稀释。
标准溶液的配制可采用直接配制和“粗配精标”两种不同方法。
“粗配精标” 方法是如一般溶液的配制一样先粗略配制(尽可能接近目标浓度),然后用基准物质(或另一已知准确浓度的标准溶液)标定(又称为“粗配精标”)。
直接配制标准溶液必须采用分析天平、容量瓶和移液管等仪器。
无论是配制什么溶液,首先都需要根据溶液体积和浓度,计算所需试剂的用量,包括固体试剂的质量或者液体试剂的体积,然后再依法配制。
实验室使用的浓度表示方法很多,主要有质量分数、质量摩尔浓度和物质量浓度。
在配制溶液之前,必须熟悉有关计算和配制步骤。
1. 由固体试剂配制溶液
(1)质量分数
溶质A 的质量分数w 为溶液L 中溶质的质量m A 与溶液的质量m L 之比: m w m =A L
由于m L 为溶质质量m A 和溶剂S 的质量m S 之和,所以,m A = w m L = w (m A + m S ),即
11S S S A wm w V m w w
ρ==-- 式中ρS 和V S 为溶剂的密度和体积。
如果溶剂是水,取ρS 为1(3.98 °C 时水的密度值)。
根据计算结果,称取需要量的溶质A ,转入烧杯中,用量筒量取需要量的溶剂S 也倒入烧杯中,搅拌溶解(必要时可加热),完全溶解后即为目标溶液。
将溶液倒入试剂瓶中,贴上标签备用。
(2)物质量浓度
若需要配制的溶液物质量浓度为c ,体积为V ,则需要溶质A 的质量m A 为
m A = cVM
式中M 为溶质A 的摩尔质量。
溶液配制方法同(1)(一般不考虑固体引入的体积变化)。
(3)质量摩尔浓度
若需要配制的溶液质量摩尔浓度为m (单位为mol ·kg 1),体积为V ,则需要溶质A 的
质量m A 为
1000
A M m V m ⋅⋅= 溶液配制方法同(1)。
2. 由液体试剂(或浓溶液)配制溶液
由液体试剂(或浓溶液)配制溶液,需要知道溶液的相对密度或质量分数。
相对密度可用密度计测量,质量分数(或物质量浓度)依相对密度值从有关表中查得。
(1)质量分数
设一浓溶液质量分数为w o ,目标溶液质量分数和体积分别为w 和V ,则所需浓溶液体积V o 为wV /w o . 例如,用质量分数为36%的浓盐酸,配制质量分数为9%的盐酸溶液100 mL ,需要浓盐酸体积为(9 × 100 / 36 =)25 mL 。
这样,在具体配制时,用量筒量取25 mL 36%
的浓盐酸于烧杯中,再量取75 mL水也倒入烧杯中,搅拌均匀。
将溶液转入试剂瓶中,贴上标签备用。
(2)物质量浓度
若需要配制的溶液物质量浓度为c,体积为V,则需要浓度为c o的溶液体积V o为cV/c o. 溶液具体配制方法同2.(1)(一般不考虑可能引入的体积变化)。
注意;上述溶液配制步骤适用于一般溶液配制。
如果是配制标准溶液,则需要使用相应仪器和方法,请参考基本操作和相关实验的有关内容。
三、实验用品
天平、密度计、容量瓶(50、100 mL)、移液管(2、10 mL)、烧杯、量筒、试剂瓶、称量瓶
CuSO4·5H2O固体(AR)、SbCl3固体(AR)、NaCl固体(AR)、KCl固体(AR)、CaCl2固体(AR)、NaHCO3固体(AR)、浓H2SO4(AR)、醋酸溶液(2.00 mol·L1)
四、实验内容
1.溶液配制
(1)由CuSO4·5H2O固体配制50 mL 0.1 mol·L1 CuSO4溶液。
(2)由浓H2SO4配制50 mL 0.1 mol·L1 H2SO4溶液。
(3)由SbCl3固体配制50 mL 0.1 mol·L1 SbCl3溶液。
(4)用浓度为2.00 mol·L1的HAc溶液配制50 mL 0.200 mol·L1的HAc溶液。
(5)配制100 mL质量分数为0.90%的生理盐水。
生理盐水中含有NaCl、KCl、CaCl2、NaHCO3,它们的比例为45 : 2.1 : 1.2 : 1。
溶液配制好后需要消毒过程。
五、思考题
1.用容量瓶配制溶液时是否需要干燥?是否要用所配制溶液润洗三次?为什么?
2.一同学配制的SbCl3溶液是白色的,该结果正确吗?为什么?
3. 一同学在配制50 mL 0.1 mol·L1CuSO4溶液时应用到了50 mL容量瓶,用浓度为2.000 mol·L1的HAc溶液配制50 mL 0.2000 mol·L1的HAc溶液用到了量筒。
这些做法对吗?为什么?
4.若实验室现只有精度为0.01的天平,如何尽可能准确配制100 mL质量分数为0.90%的生理盐水?
5. 已知SnCl2容易水解,其溶液也容易被空气氧化。
请问如何配制和保存SnCl2水溶液?
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。
