高一化学氮及其化合物PPT教学课件
合集下载
高一化学氮及其化合物ppt课件.ppt
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮气
1、氮元素的存在及单质的物理性质
存 游离态形式存在于空气中 在 化合态形式存在于多种无机物及有机物中
物 理 无色无味的气体、密度比空气小; 性 难溶于水,1体积水溶解0.02体积的氮气。
思考题
1、1molMg在足量的氮气、空气、纯氧气、二
氧化碳气体中燃烧生成 的固体质量由大到小的 排列次序是_二__氧__化__碳__>__氧__气___>_空__气__>__氮__气_____.
点燃
2Mg + O2 →2MgO
点燃
3Mg + N2 → Mg3N2
(40g) (100/3g)
2Mg + CO2 →点燃2MgO +C (46g)
质
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
工业上怎样制取氮气?利用氮气的什么性质?
空气
液化
先气化 液态空气
氮气 b.p -195.8℃
后气化
氧气 b.p -183℃
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮的固定------把大气中的游离态氮转化为氮的化合物 1生物固氮
豆科作物根瘤中的固氮菌常温下将空气中的氮 气转化为硝酸盐。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮及其化合物ppt课件

无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气 体溶于水,若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
氮及其化合物(最新课件ppt)

不用KI淀粉试纸鉴别NO2与溴蒸气。
(3)因在常温常压下发生反应2NO2 N2O4,所以通 常“纯净”的NO2或N2O4并不纯.由于此可逆反应的发 生,通常实验测得NO2的相对分子质量大于它的实际 值。
2.氮的氧化物溶于水的计算 (1)方程式法 有关化学反应方程式 3NO2+H2O===2HNO3+NO① 4NO2+O2+2H2O=4HNO3② 4NO+3O2+2H2O===4HNO3③ 2NO+O2===2NO2④
3.氮的氧化物对大气的污染与防治 (1)
(2)
(3)
①无色
②无味
③不
④小
⑤N2+O2
放电 =====
2NO
⑥N2+3H2
高温高压 催化剂
2NH3
⑦N2+3Mg
点燃 =====
Mg3N2
⑧
合成氨 ⑨自然固氮 ⑩无 ⑪红棕色 ⑫无 ⑬刺激性
⑭ 有 ⑮ 有 ⑯ 大 ⑰ 大 ⑱ 不 溶 ⑲ 2NO+ O2===
一、氮气及氧化物
1.氮气
(1)物理性质
颜色 气味
溶解性
密度
①____ ②____ ③____溶于水 比空气④____
(2)化学性质
注意 (1)不能用向下排空气法收集N2, (2)N2化学性质不活泼,但N元素为活泼非金属元 素。
(3)氮的固定
2.氮的常见氧化物
思考1 如何鉴别NO2与溴蒸气? 【提示】 由于NO2和Br2在性质上有不少相似性: ①均具有氧化性;②溶于水均有酸生成;③均可与碱反 应;④均为红棕色等。所以不能用淀粉-KI试纸、pH 试纸、NaOH溶液来鉴别,但二者性质又有差别,可以 用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗 法。
A.NO2:17mL;O2:13mL B.NO2:27mL;O2:3mL C.NO2:15mL;O2:15mL D.NO2:25mL;O2:5mL
《氮及其化合物》 第1课时 教学PPT课件【高中化学必修2(新课标)】

具有氧化性、还原性,主要表 现强氧化性,能氧化SO2、KI 等物质
毒性
有毒(易结合血红蛋白使 有毒(刺激腐蚀呼吸道黏膜)
人中毒)
相互转化
2NO+O2===2NO2;3NO2+H2O===2HNO3+NO
三、一氧化氮和二氧化氮
【判断正误】 (1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用 排水法( √ ) (2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法
五、课堂检测
6.按图进行实验。试管中装有12 mL NO,然后间歇而又缓慢地通入8 mL O2, 下列是有关最终状态的描述:
①试管内气体呈红棕色 ②试管内气体呈无色 ③试管内
液面不变 ④试管内液面上升 ⑤试管内气体是O2 ⑥试 管内气体是NO。其中正确的是
A.①③
B.②④⑤
√C.②④⑥
D.②③⑤
解析
√C.氮的氧化物均有毒
D.氮的氧化物在空气中能稳定存在
解析 氮的氧化物包括NO、N2O、NO2、N2O3、N2O4、N2O5等,A项错误; NO、N2O4等均为无色气体,B项错误; 氮的氧化物均有毒,C项正确; NO在空气中易被O2氧化为NO2,D项错误。
五、课堂检测
5.对3NO2+H2O===2HNO3+NO反应的下列说法正确的是
三、一氧化氮和二氧化氮
2.在上述NO、NO2性质实验中 (1)如果要将注射器中的NO充分转化,应采取的措施是_继__续__通__入__过__量__的__空__气__。 (2)上述实验对工业上生产硝酸的启示是_在__用__水__吸__收__N__O_2_制_取__硝__酸__的__反__应__过_程___ _中__,__要__不__断__地__补__充__一__些__空__气__,__使__N_O__2尽__可__能__多__地__转__化__为__硝__酸___。
氮及其化合物课件-高一人教版(2019)化学必修第二册

3NO2 + H2O == 2HNO3 + NO 2NO + O2 ==2NO2 4NO2 + O2 + 2H2O == 4HNO3
NO2与O2的体积比 发生的化学反应
剩余气体
= 4:1
4NO2 + O2 + 2H2O =4HNO3
无
﹤4:1 ﹥4:1
4NO2 + O2 + 2H2O =4HNO3
O2
解得: V(NO2)=80mL V(O2)=20mL
(2) 若20mL剩余气体为O2,设参加反应的O2为x mL,则原 混合气体中NO2为100mL-(20+x)mL=(80-x)mL
由V(NO2):V(O2)=4:1 得 (80-x)mL=4x mL 解得:x=16 即V(O2)=20+16=36 ∴ V(NO2)=64 若20mL剩余气体为NO,则 3NO2 + H2O == 2HNO3 + NO 设生成20mLNO需NO2为z mL, 由此可得:z=3×20mL=60mL,即NO2和O2反应共消耗了 40mL,设O2为y mL,则NO2为(40-y)mL. 由V(NO2):V(O2)=4:1 (40-y)mL=4y mL 解得y=8
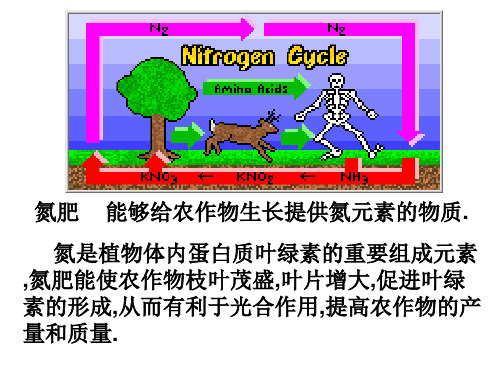
氮肥种类
氨水 (NH3▪H2O) 铵态氮肥 NH4Cl (NH4)2SO4 NH4HCO3 硝态氮肥: KNO3
有机氮肥: 尿素(CO(NH2)2)
N
高温、高压
N2 + 3H2 催化剂
人工固氮
N
大气中的氮
2NH3
氨或铵盐
N
自然界中氮的循环
硝酸盐
化合价
+5 +4
HNO3
NO2与O2的体积比 发生的化学反应
剩余气体
= 4:1
4NO2 + O2 + 2H2O =4HNO3
无
﹤4:1 ﹥4:1
4NO2 + O2 + 2H2O =4HNO3
O2
解得: V(NO2)=80mL V(O2)=20mL
(2) 若20mL剩余气体为O2,设参加反应的O2为x mL,则原 混合气体中NO2为100mL-(20+x)mL=(80-x)mL
由V(NO2):V(O2)=4:1 得 (80-x)mL=4x mL 解得:x=16 即V(O2)=20+16=36 ∴ V(NO2)=64 若20mL剩余气体为NO,则 3NO2 + H2O == 2HNO3 + NO 设生成20mLNO需NO2为z mL, 由此可得:z=3×20mL=60mL,即NO2和O2反应共消耗了 40mL,设O2为y mL,则NO2为(40-y)mL. 由V(NO2):V(O2)=4:1 (40-y)mL=4y mL 解得y=8
氮肥种类
氨水 (NH3▪H2O) 铵态氮肥 NH4Cl (NH4)2SO4 NH4HCO3 硝态氮肥: KNO3
有机氮肥: 尿素(CO(NH2)2)
N
高温、高压
N2 + 3H2 催化剂
人工固氮
N
大气中的氮
2NH3
氨或铵盐
N
自然界中氮的循环
硝酸盐
化合价
+5 +4
HNO3
新人教版高一化学必修第二册第五章第二节《氮及其化合物》精品教学课件

化学必修第二册第五章
第二节 氮及其化合物
第二节 氮及其化合物
第一部分 氮气与氮的固定
有句农谚“雷雨发庄稼”。你知道其中的 道理吗?
N2
氮元素的存在
①氮原子的结构 原子结构示意图: ________,一般通过_共__用__电__子__对__与 其他原子结合。
N2的电子式
N2的结构式
②自然界中,氮元素主要以氮气的形式存在于空气中,
3.与碱反应生成氨
△
NH4Cl +NaOH==NaCl+NH3↑+H2O
1.NH3的实验室制法
铵盐与碱反应的应用
△
2NH4Cl+Ca(OH)2 ==CaCl2+2NH3↑+H2O
2.铵离子的检验
化学性质 铵 盐 氨的制法 总结归纳
限时训练(5min)
1.下列有关氨气的性质的叙述中正确的是(B )
A.氨气不能在空气中燃烧,是因为O2不能将NH3氧化 B.氨气是非电解质,NH3·H2O是电解质 C.氨气和酸相遇都能产生酸雾 D.氨气呈碱性,能使石蕊试纸变蓝
(2)氨跟酸的反应
氨与氯化氢的反应
观看实验视频
28
(2)氨跟酸的反应
与
NH3+HCl=NH4Cl (白烟)
挥 发
性
NH3+HNO3=NH4NO3 (白烟)
的 酸
反
应
2NH3+H2SO4=(NH4)2SO4
有 白
烟
写出上述反应的离子方程式
NH3 + H+=NH4+
3)氨与氧气的反应
(还原性)
化合价升高,失5e-×4,氧化反应
实验 操作
第二节 氮及其化合物
第二节 氮及其化合物
第一部分 氮气与氮的固定
有句农谚“雷雨发庄稼”。你知道其中的 道理吗?
N2
氮元素的存在
①氮原子的结构 原子结构示意图: ________,一般通过_共__用__电__子__对__与 其他原子结合。
N2的电子式
N2的结构式
②自然界中,氮元素主要以氮气的形式存在于空气中,
3.与碱反应生成氨
△
NH4Cl +NaOH==NaCl+NH3↑+H2O
1.NH3的实验室制法
铵盐与碱反应的应用
△
2NH4Cl+Ca(OH)2 ==CaCl2+2NH3↑+H2O
2.铵离子的检验
化学性质 铵 盐 氨的制法 总结归纳
限时训练(5min)
1.下列有关氨气的性质的叙述中正确的是(B )
A.氨气不能在空气中燃烧,是因为O2不能将NH3氧化 B.氨气是非电解质,NH3·H2O是电解质 C.氨气和酸相遇都能产生酸雾 D.氨气呈碱性,能使石蕊试纸变蓝
(2)氨跟酸的反应
氨与氯化氢的反应
观看实验视频
28
(2)氨跟酸的反应
与
NH3+HCl=NH4Cl (白烟)
挥 发
性
NH3+HNO3=NH4NO3 (白烟)
的 酸
反
应
2NH3+H2SO4=(NH4)2SO4
有 白
烟
写出上述反应的离子方程式
NH3 + H+=NH4+
3)氨与氧气的反应
(还原性)
化合价升高,失5e-×4,氧化反应
实验 操作
第2讲 氮及其化合物(课件)高一化学下学期课件(人教版2019必修第二册)

无毒
有毒
有毒
氮气与氮气的氧化物
知识点2 氮气、一氧化氮和二氧化氮的物理性质 ①NO2气体同 Cl2等一样,因沸点较高,易液化 。②NO使人中毒的原理与CO相同,都是气体与血
液中的血红蛋白结合从而使其失去传输O2的功能; NO2的毒性是因其本身具有刺激性气味,可引起 气喘、干咳等,又因其能与水反应生成具有强氧
打开弹簧夹吸人空气后,有红 棕色气体生成;振荡注射器,红 棕色气体变浅,且注射器中最 后剩余气体为无色
该实验过程中发生的反应为2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,根据加入 物质的体积知,最后有 NO气体剩余。如果要将注射器中的NO全部转化,则加入
的NO、O2的物质的量之比为4∶3,即发生反应4NO+3O2+2H2O=4HNO3。该反应 可应用于工业上制硝酸,生产硝酸的过程中,要向吸收塔中通入足量的空气或氧
氮气与氮气的氧化物
典例分析
[典例7]氮及其化合物转化具有重要应用.下列说法正确的是 ( B )
A.工业制硝酸过程中的物质转化: NH3
O2 催化剂、△
NO
H2O
HNO3
B.人工固氮制备尿素的物质转化:
N2
H2 高温、高压、催化剂
NH3
CO2 一定条件
CO(NH2)2
C.用NaOH溶液吸收含有NO2尾气: 2OH-+2NO2=NO3-+NO↑+H2O
(1)NO2气体:NO2气体溶于水时仅涉及反应①,剩余气体为 NO。 (2)NO2和O2的混合气体:NO2和O2的混合气体溶于水时涉及反应③∶
0<x<4
X=4
x>4
反应情况
O2过量,剩余气体 恰好完全反应,无
人教版化学必修1第四章第四节氮及其化合物(共24张PPT)

化学性质: 3NO2 + H2O = 2HNO3 + NO
六.氮的氧化物对大气的污染
N2O NO N2O3 NO2 N2O4 N2O5
都是有毒气体,都是大气污染 物(NO、NO2),形成硝酸型酸雨 和光化学烟雾(氮氧化物和碳氢 化合物的排放)。
尾气NO2的处理:
2NO2+2NaOH=NaNO3+NaNO2+H2O
⑴不稳定性(受热易分解)
⑵与碱反应
NH4NO3+NaOH=△NaNO3+NH3↑+H2O
NH4++OH-=△NH3↑+H2O
3.NH4+的检验
四.氨气的实验室制法 1.反应原理:
2NH4Cl+Ca(OH)2△=CaCl2+2H2O+2NH3↑
2.制取装置:
3.收集:向下排空气法。 一般在管口塞一团棉花球, 可减小NH3与空气的对流速 度,收集到纯净的NH3。
42秒下午1时37分13:37:4221.11.9
(2)与酸反应
NH3 + HCl = NH4Cl
现象:产生大量的白烟(可用 于检验NH3) 强调:挥发性强酸(如HCl 、 HNO3等)与NH3相遇都产生 白烟。
(3)氨的催化氧化
3.用途
制铵盐
制纯碱
制硝酸
氨
制尿素
制医用氨水
作致冷剂
三. 铵盐
1.物理性质:都是白色晶体, 都易溶于水。 2.化学性质
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午1时37分21.11.913:37November 9, 2021 7、“教师必须懂得什么该讲,什么该留着不讲,不该讲的东西就好比是学生思维的器,马上使学生在思维中出现问题。”“观
六.氮的氧化物对大气的污染
N2O NO N2O3 NO2 N2O4 N2O5
都是有毒气体,都是大气污染 物(NO、NO2),形成硝酸型酸雨 和光化学烟雾(氮氧化物和碳氢 化合物的排放)。
尾气NO2的处理:
2NO2+2NaOH=NaNO3+NaNO2+H2O
⑴不稳定性(受热易分解)
⑵与碱反应
NH4NO3+NaOH=△NaNO3+NH3↑+H2O
NH4++OH-=△NH3↑+H2O
3.NH4+的检验
四.氨气的实验室制法 1.反应原理:
2NH4Cl+Ca(OH)2△=CaCl2+2H2O+2NH3↑
2.制取装置:
3.收集:向下排空气法。 一般在管口塞一团棉花球, 可减小NH3与空气的对流速 度,收集到纯净的NH3。
42秒下午1时37分13:37:4221.11.9
(2)与酸反应
NH3 + HCl = NH4Cl
现象:产生大量的白烟(可用 于检验NH3) 强调:挥发性强酸(如HCl 、 HNO3等)与NH3相遇都产生 白烟。
(3)氨的催化氧化
3.用途
制铵盐
制纯碱
制硝酸
氨
制尿素
制医用氨水
作致冷剂
三. 铵盐
1.物理性质:都是白色晶体, 都易溶于水。 2.化学性质
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午1时37分21.11.913:37November 9, 2021 7、“教师必须懂得什么该讲,什么该留着不讲,不该讲的东西就好比是学生思维的器,马上使学生在思维中出现问题。”“观
氮及其化合物-PPT课件

编号 A B C D
气体
NH3
CO2 NO NO2
a
浓氨水
盐酸 稀HNO3 浓HNO3
b
生石灰
碳酸钙 铜屑 铜屑
c
碱石灰
饱和NaHCO3 H 2O NaOH溶液
4、下面是实验室制取氨气的装置和选用的试剂,
其中错误的是
A.只有① C.①③
B.只有③ D.②③
【 解 析 】 实 验 室 制 备 NH3 的 方 法不 只 一 种 , 除 课 本 介 绍 的 由 NH4Cl与碱石灰反应制取之外,其他的只要合理亦可。①装置中 NH4Cl加热分解产生的NH3、HCl很容易在管口重新化合成NH4Cl, 而无法收集到NH3。③装置在加热时,管口应略向下倾斜,以防 止冷凝水倒流使试管底部破裂。
方法二:加热 没有沉淀生成 产生浅黄色沉淀 硝酸银溶液
方法三:用四 氯化碳溶解 无明显现象 得到橙红色四氯 化碳溶液
五.硝酸还原产物的确定 (1) 金属与一定量的浓硝酸反应时,随着反应进行,硝 酸浓度将降低,转化为稀硝酸时,还原产物也将从原 来的NO2转化为NO; (2) 定量分析:硝酸还原产物是什么,取决于硝酸得到 的电子数。假设每摩尔硝酸获得电子x mol,则有: ①若x=1,还原产物是NO2或N2O4; ②若x=2,还原产物是N2O3; ③若x=3,还原产物是NO; ④若x=4,还原产物是N2O; ⑤若x=5,还原产物是N2或NH4NO2; ⑥若x=8,还原产物是NH3或NH4NO3;
一、氨的制取及检验
1.氨气的实验室制取
(1)反应原理: 2NH4Cl+Ca(OH)2 加热 CaCl2+2NH3↑+2H2O
(2)装置原理(发生、净化、收集、尾气吸收)
《氮及其化合物》课件

模型方法
02 硝酸的强氧化性
关于硝酸氧化性的考查在高考中属于高频考点,如:硝酸与非 金属、金属(变价金属Fe)、还原性微粒的氧化还原方程式或 离子方程式的书写(书写依据电子守恒、电荷守恒、原子守恒 等);离子共存;利用守恒法(电子守恒、原子守恒)解答硝 酸氧化还原反应的计算。
真题演练
!
%
/ ˜ %# • O > @ • ‚ ƒ A ” • a Ž •
性 质
与H2O 反应
不反应
3NO2 + H2O = HNO3 + NO
知识梳理
02 氨气、铵盐
NH3 + H2O
NH3·H2O NH4+ + OH−
氨水成分:NH3·H2O、H2O、NH3、NH4+、OH−、H+
无色、有刺激性气味,密度比 空气小,易液化,极易溶于水
HCl + NH3 == NH4Cl
NH3
NH4+ + OH− === NH3↑ + H2O
NH4HCO3 === NH3↑ + CO2↑ + H2O NH4Cl === NH3↑ + HCl↑
知识梳理
03 硝酸
无色、易挥发的液体、 有刺激性气味。
①使指示剂变色: 稀硝酸使石蕊试液由紫色变红色; 浓硝酸使石蕊试液先变红(H+的作用)后褪色(强氧化性); ②与碱反应; ③与碱性氧化物反应; ④与盐反应(强酸制弱酸)。
(((345)))用 采 气在a.实样样虚碱验步酸线石室骤化灰框常的②中用加H画2仪热出O2器烟b该溶.无组道装液水装气置中C一的的,uO"套目7示)#&S使AÖO,%+装的意¼N4•XXr½O置是图:¿3s8x,_完«,Ö¨18_v$ž防p_其全标8_ìA+c8_作被止明.í˜_P»8_用氧气#2™NßHO_7°"O_与化体Éž5_8x3Ÿ_D9为的溶8_L(}%_N装流8I于¼_+BO8_$有向3›冷_/38−_ï碱¿及,_凝8»写_液试98_ó水出_})8剂相。+8N。同fYO7R,与0# $H13 2¨O8A2反应的,-%0 7777离>!%›e$.$子ðä.#ä!†@¨@方$³CÍò)!程´(©$$S³@T#M式ýBC6‰$u5/!°6¶$c£uò。Ë-CòËXXÎ!cŒ$ÝgC!#²-$'uò
第五章第二节氮及其化合物(第一课时)课件 高一化学下学期人教版(2019)必修第二册

是 1:3
。
3、将等体积NO2和O2充入试管,并倒立于水槽中,最后试管中剩余气体
为
O2
,剩余气体体积为原气体体积的 3/8 。
变式3:现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后剩余气体 2 mL(同温同压下),则原混合气体中氧气的体积可能是__4__m_L_或__1_._2_m__L__。
是什么? 4NO+3O2+2H2O===4HNO3
当V(NO):V(O2)=4:3时,恰好完全反应,无气体剩余; 当V(NO):V(O2)>4:3时,NO过量,剩余气体为NO; 当V(NO):V(O2)<4:3时,O2过量,剩余气体为O2。
【课堂练习】
1.将盛有60 mL NO2气体的试管倒立于水中,经过足够长的时间
后,试管内气体的体积缩小。则反应后剩余气体的体积
是 20 mL
。
2.现有NO2、N2的混合气体12 mL,通入足量水中,充分反应后剩余气体6 mL(同温
同压下),则原混合气体中氮气的体积是__3_m__L____,NO的体积是 9 mL
。
变式2:现有NO2、N2的混合气体,通入足量水中,充分反应后剩余气体的体积缩 小 为 原 来 的 一 半 ( 同 温 同 压 下 ) , 则 原 混 合 气 体 中 氮 气 与 NO 的 体 积 比
2.结合实验探究,了解一氧化氮与氧气反应、二氧化氮与水反应,感受化学 变化的奇妙。掌握NO、NO2的性质,掌握NO、NO2之间的相互转化关系。培 养学生“科学探究与创新意识”的核心素养。
任务一:氮气与氮的固定 1.氮在自然界中的存在
游离态的氮以N2形式存在于空气中,约占空气体积的78%
(78%) 氮气
放电
5.2 氮及其化合物(一)课件(共39张PPT)

能,但不能充满烧瓶。 3NO2+H2O = 2HNO3+NO
2. 化学性质
(2)与酸的反应:
现象: 有大量白烟产生
原因: 氨与氯化氢相遇迅速反应生成固体小颗粒
原理: NH3+HCl = NH4Cl
思 a 浓氨水遇浓硫酸、浓硝酸也会产生白烟吗?
考
浓硝酸 NH3+HNO3 = NH4NO3
b 氨与其它酸的反应:
1. 实验室制法 (1) 原料: NH4Cl与Ca(OH)2 (2) 原理:
≜ 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
(3) 制取装置: 固固加热装置 (4) 收集装置: 向下排空气法 (5) 棉花的作用:防止空气对流
(三)氨气的实验室制法
(6) 验满:
a. 湿润的红色石蕊试纸变蓝 b. 蘸有浓HCl的玻璃棒接近试管口产生白烟
的压强迅速减小,与外界大气形成较大的压强差,在压强差作用 下,液体迅速流动,通过带尖嘴的导管喷出来,形成喷泉。
(2)某同学做该实验时,打开止水夹后将胶头滴管内的水挤入烧瓶内, 可并未产生喷泉,试分析实验失败可能的原因是什么?
①装置气密性不好 ②收集的NH3纯度较低 ③烧瓶不干燥等 (3)若将NH3换为NO2,能否形成喷泉?若能形成,则实验后液体能否 充满烧瓶?
(2)取少许样品于试管中,加入碱后加热,用蘸有浓盐酸的玻 璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+ 。
思考与讨论
图5-13为实验室制取氨的简 易装置示意图。请仔细观察实验 装置,思考如何检验试管中已收 集满氨,如何吸收处理实验中多 余的氨。
图5-13实验室制取氨的简易装置示意图
(三)氨气的实验室制法
思考与讨论: 如果将注射器中的NO充分转化,可以采取什么措施? 上述实验对工业生产硝酸有什么启示?
2. 化学性质
(2)与酸的反应:
现象: 有大量白烟产生
原因: 氨与氯化氢相遇迅速反应生成固体小颗粒
原理: NH3+HCl = NH4Cl
思 a 浓氨水遇浓硫酸、浓硝酸也会产生白烟吗?
考
浓硝酸 NH3+HNO3 = NH4NO3
b 氨与其它酸的反应:
1. 实验室制法 (1) 原料: NH4Cl与Ca(OH)2 (2) 原理:
≜ 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
(3) 制取装置: 固固加热装置 (4) 收集装置: 向下排空气法 (5) 棉花的作用:防止空气对流
(三)氨气的实验室制法
(6) 验满:
a. 湿润的红色石蕊试纸变蓝 b. 蘸有浓HCl的玻璃棒接近试管口产生白烟
的压强迅速减小,与外界大气形成较大的压强差,在压强差作用 下,液体迅速流动,通过带尖嘴的导管喷出来,形成喷泉。
(2)某同学做该实验时,打开止水夹后将胶头滴管内的水挤入烧瓶内, 可并未产生喷泉,试分析实验失败可能的原因是什么?
①装置气密性不好 ②收集的NH3纯度较低 ③烧瓶不干燥等 (3)若将NH3换为NO2,能否形成喷泉?若能形成,则实验后液体能否 充满烧瓶?
(2)取少许样品于试管中,加入碱后加热,用蘸有浓盐酸的玻 璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+ 。
思考与讨论
图5-13为实验室制取氨的简 易装置示意图。请仔细观察实验 装置,思考如何检验试管中已收 集满氨,如何吸收处理实验中多 余的氨。
图5-13实验室制取氨的简易装置示意图
(三)氨气的实验室制法
思考与讨论: 如果将注射器中的NO充分转化,可以采取什么措施? 上述实验对工业生产硝酸有什么启示?
5.2氮及其化合物 课件 (共34张PPT) 高一下学期化学人教版必修第二册

NO2能使湿润的淀粉KI试纸变蓝
正确理解NO和NO2所属物质的类别 NO和NO2都不是酸性氧化物,NO与碱、酸都不能反应生成盐和水,属 于不成盐氧化物;NO2与碱溶液发生氧化还原反应生成两种盐,也不属 于酸性氧化物。2NO2+2NaOH=NaNO2+NaNO3+H2O。
雷雨发庄稼所涉及的反应:
放电 N2+O2=======2NO,2NO+O2===2NO2, 3NO2+H2O===2HNO3+NO。
②NO2→NO: ____3_N_O_2_+_H_2O_=_2_H__N_O_3+_N_O_(工业制取硝酸)。
思考与讨论:如何除去NO气体中混有的少量NO2气体 杂质?
提示:根据NO2与H2O反应能生成NO,既能除去NO2杂质,又不引入 其他杂质,故可将混合气体通入盛有水的洗气瓶,然后重新收集气体。
可表示为n(HNO3)酸性=x·n(Mx+)=n(转移电子)。
[关键能力]
金属与硝酸反应的计算——四个守恒
(1)得失电子守恒:金属失电子数=n(NO2)+3n(NO)。 (2) 氮 原 子 守 恒 : n(HNO3) 总 = x·n[M(NO3)x] + n(NO2) + n(NO) 。 (3)电荷守恒:反应后溶液中c(NO)=x·c(Mx+)+c(H+)。
密度
现象
浓H2SO4 放出大量热 黏稠状液体
稀H2SO4 无明显现象 黏稠度较小的液体
浓H2SO4密度较大,相同体积时,浓H2SO4 质量大
化学性质
铁片
因铁被钝化而无明 显现象
产生大量气泡
铜片(加热)
有气泡产生,溶液 变蓝
无明显现象
白纸 胆矾
立即变黑 蓝色变为白色
无明显现象 无颜色变化
正确理解NO和NO2所属物质的类别 NO和NO2都不是酸性氧化物,NO与碱、酸都不能反应生成盐和水,属 于不成盐氧化物;NO2与碱溶液发生氧化还原反应生成两种盐,也不属 于酸性氧化物。2NO2+2NaOH=NaNO2+NaNO3+H2O。
雷雨发庄稼所涉及的反应:
放电 N2+O2=======2NO,2NO+O2===2NO2, 3NO2+H2O===2HNO3+NO。
②NO2→NO: ____3_N_O_2_+_H_2O_=_2_H__N_O_3+_N_O_(工业制取硝酸)。
思考与讨论:如何除去NO气体中混有的少量NO2气体 杂质?
提示:根据NO2与H2O反应能生成NO,既能除去NO2杂质,又不引入 其他杂质,故可将混合气体通入盛有水的洗气瓶,然后重新收集气体。
可表示为n(HNO3)酸性=x·n(Mx+)=n(转移电子)。
[关键能力]
金属与硝酸反应的计算——四个守恒
(1)得失电子守恒:金属失电子数=n(NO2)+3n(NO)。 (2) 氮 原 子 守 恒 : n(HNO3) 总 = x·n[M(NO3)x] + n(NO2) + n(NO) 。 (3)电荷守恒:反应后溶液中c(NO)=x·c(Mx+)+c(H+)。
密度
现象
浓H2SO4 放出大量热 黏稠状液体
稀H2SO4 无明显现象 黏稠度较小的液体
浓H2SO4密度较大,相同体积时,浓H2SO4 质量大
化学性质
铁片
因铁被钝化而无明 显现象
产生大量气泡
铜片(加热)
有气泡产生,溶液 变蓝
无明显现象
白纸 胆矾
立即变黑 蓝色变为白色
无明显现象 无颜色变化
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应,不断反复,因此应该采用离子方程式进行分析:
3Cu+8H++2NO3−
3Cu2++2NOபைடு நூலகம்+4H2O。
溶液中n(H+)=0.8 mol,n(NO3−)=0.1 mol, n(Cu)=0.15 mol,
所以氢离子过量,硝酸根离子和铜粉均完全反应,产生
气体物质的量为0.1mol。
课前体验
4.已知A、B、C、D为气体,E、F为固体,G是氯化钙, 它们之间的转换关系如下图所示:
课前体验
2.76.8 mg Cu与一定量浓硝酸反应,铜作用完全后,
如果NO3−减少2×10−3mol,则溶液中H+同时下降
A .2.2×10−3mol
B. 3.2×10−3mol
C. 4.4×10−3mol
D. 4.8×10−3mol
【解析】76.8 mg Cu物质的量是1.2×10−3mol,消耗氢 离子物质的量就是参加反应的硝酸物质的量=被还原的 硝酸根离子物质的量=硝酸铜中硝酸根离子物质的量 =2×10−3mol+1.2×10−3mol×2=4.4×10−3mol。
第25讲
课前体验
1.铜粉放入稀硫酸溶液中,加热后无明显现象发 生。当加入一种盐后,铜粉的质量减少,溶液呈
蓝色,同时有气体逸出。该盐是
A. Fe2(SO4)3 C. KNO3
B. Na2CO3 D. FeSO4
【解析】加入硝酸钾后,溶液中相当于有硝酸生成, 可以将铜粉溶解并产生气体;加入碳酸钠有气体但是 铜片不溶解;加入硫酸铁,铜粉溶解但是没有气体生 成。
硝酸和16.2 g水以及另外一种气态物质,该气态物质
可能是
( D)
A.NO
B.N2O
C.N2O3
D.N2
【解析】解法一:0.5 mol硝酸铵中含有0.5 mol硝酸根 离子和0.5 mol铵根离子。依据题意有0.3 mol硝酸根离
子被还原、0.5 mol铵根离子被氧化。假设每个NO3−得 到x个电子,每个NH4+失去y个电子,因为电子得失相 等,则有:0.3 mol x=0.5 mol y,得出x∶y=5∶3,NO3− 和NH4+中的氮元素都转化为零价,所以产物是氮气。
( C)
A.0.28 mol
B.0.31 mol
C.(n+0.2)mol
D.(n+0.4)mol
【解析】反应生成硝酸铜物质的量为0.1 mol,溶液中含 NO3−的物质的量=剩余硝酸+硝酸铜中的硝酸根离子=n mol+0.1 mol×2=(n+0.2)mol。
典例精析
【例2】0.5 mol硝酸铵在一定条件下可分解成0.2 mol
(1)D的化学式(分子式)是 NH3 ,E的化学式(分子式) 是 NH4Cl 。
(2)A和B反应生成C的化学方程式是 H2+Cl2 点燃 2HCl
(3)E和F反应生成D、H和G的化学方程式是 2NH4Cl+Ca(OH)2 △ 2NH3↑+2H2O+CaCl2
课前体验
4.已知A、B、C、D为气体,E、F为固体,G是氯化钙, 它们之间的转换关系如下图所示:
典例精析
【例1】将0.1 mol铜与40 mL 10 mol·L−1HNO3充分反
应后,溶液中含a mol H+,由此可知
(C)
A.生成的气体在标准状况下的体积为4.48 L
B.生成的气体在标准状况下的体积为1.49 L
C.被还原的硝酸的物质的量为(0.2−a) mol
D.反应后溶液所含NO3−物质的量为0.2 mol
典例精析
【例2】0.5 mol硝酸铵在一定条件下可分解成0.2 mol
硝酸和16.2 g水以及另外一种气态物质,该气态物质
可能是
( D)
A.NO
B.N2O
C.N2O3
D.N2
【评注】确定氧化产物或是还原产物最基本的方法就是依据 元素化合价变化情况来分析。本例中方法二适用性不广,一 般不用。
典例精析
【例2】0.5 mol硝酸铵在一定条件下可分解成0.2 mol
硝酸和16.2 g水以及另外一种气态物质,该气态物质
可能是
( D)
A.NO
B.N2O
C.N2O3
D.N2
【解析】 解法二:反应物0.5 mol NH4NO3中含有N、H、 O元素物质的量分别为1 mol、2 mol、1.5 mol,产物水 为0.9 mol和0.2 mol硝酸中总共含有H、O物质的量分 别为2 mol、1.5 mol,所以另一种产物只含有氮元素, 故应该为氮气。
(C)
A.生成的气体在标准状况下的体积为4.48 L
B.生成的气体在标准状况下的体积为1.49 L
C.被还原的硝酸的物质的量为(0.2−a) mol
D.反应后溶液所含NO3−物质的量为0.2 mol
【解析】反应开始时是浓硝酸,随后浓度变稀,转化为 铜与稀硝酸反应。因此不能用铜与浓硝酸或稀硝酸的一 种反应进行计算;但是无论浓硝酸还是稀硝酸,铜片均 能反应完。根据氮元素守恒有:被还原的硝酸+硝酸铜中 的硝酸根离子+剩余硝酸=原有硝酸总量,即被还原的硝 酸+0.1 mol×2+a mol=0.4 mol,故被还原的硝酸=(0.2−a) mol。由于a不确定,所以不能计算产生气体物质的量。
【评注】硝酸在反应过程中浓度下降是事实,因此产物可能 发生变化,此时不能认为只发生了一种反应。计算的方法是 守恒原理:被还原的硝酸+硝酸铜中的硝酸根离子+剩余硝酸= 原有硝酸总量。
典例精析
变式1 6.4 g铜与过量硝酸(8 mol/L、60 mL)充分反应
后,硝酸的还原产物有NO、NO2,反应后溶液中所含 H+为n mol,此时溶液中所含NO3−的物质的量为
【解析】 E、F两种固体之间反应生成气体D同时有氯化 钙生成,应该就是Ca(OH)2和氯化铵反应制取氨气的反应; 又因为A和B两种气体反应产生生成气体C,C和D(氨气) 产生固体E,因此可以确定C是氯化氢。
典例精析
【例1】将0.1 mol铜与40 mL 10 mol·L−1HNO3充分反
应后,溶液中含a mol H+,由此可知
课前体验
3.向1 L 0.4 mol/L硫酸溶液中加入10.1 g KNO3和9.6 g 铜粉,充分反应后产生的气体在标准状况下的体积为
A. 2.24 L
B.1.12 L
C. 0.448 L
D.0.56 L
【 解 析 】 加入硝酸钾后相当于有硝酸,与铜反应后成硝
酸铜。如果含有氢离子存在,又相当于有硝酸,会继续
