初中化学竞赛专题辅导氢气和水
初中化学基础知识第2讲《水氢气》

第2讲 水 氢气
2 如图为电解水的实验装置图,请回答下列问题。
(1)试管__A__(填“A”或“B”)中产生的气体为氢气,试管 B 所连接的是电源的_正___(填 “正”或“负”)极。 (2)若试管 A 中产生气体的体积为 10 mL,则试管 B 中产生气体的体积为__5__mL。
第2讲 水 氢气
第2讲 水 氢气
④由生成氢气和氧气的体积比约为_2_∶__1_(图 1),推出生成氢气和氧气的质量比为 1∶8(图 2)。
第2讲 水 氢气
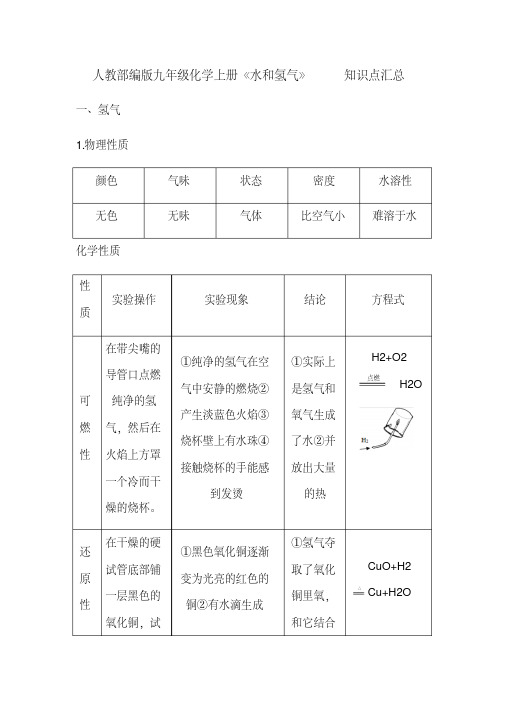
2.氢气(A 卷:5 年 2 考;B 卷:5 年 3 考) (1)物理性质:无色、无味、__难__溶于水的气体,密度比空气_小___。 (2)化学性质 ①可燃性:纯净的氢气在空气(或氧气)中安静地燃烧,产生__淡__蓝__色火焰,放出热
实验Ⅱ 通电
(2)实验Ⅱ为电解水制氧气,发生反应的化学方程式为_2_H__2O__=_=_=_=_=_2_H__2_↑__+__O_2_↑___, 气体 a 在电源的__负__(填“正”或“负”)极端产生。
第2讲 水 氢气
【特别提醒】a.经过蒸馏得到的水为纯净物。 b.长期饮用蒸馏水不利于人体健康。
第2讲 水 氢气
3.硬水与软水(A 卷:必考;B 卷:5 年 3 考)
(1)硬水与软水
硬水
软水
概念
含有①__较__多__可溶性钙、镁化合 ②_不__含__或__含__较__少___可溶性钙、镁化
物的水
合物的水
(5)电解水中有其他物质生成,发生的是_化__学___变化。
(6)电解水实验可获得氢气,该过程是将_电___能转化为_化__学___能,但实验室通常不
用该方法制取氢气的原因是不___便__于__操__作__且__耗__能__大__(合__理__即__可__)_。
【精选】人教版九级化学上册第四单元《水和氢气》知识点汇总
生成
加热⑦停止通入氢
气
问题小解答:
①如何检验氢气的纯度?
实验图
步骤
结论
①用拇指堵住满氢气 的试管②靠近火焰,
移开拇指点火
①听见尖锐的爆鸣 声,表示氢气不纯② 听见声音很小,表明
氢气纯净
②为什么要先通入氢气?
答:排除管内空气,防止爆炸 解析:因为氢气不纯的情况下,加热会使玻璃管爆炸,在通入氢气一 段时间的情况下,是氢气比较纯是才不至于爆炸
塞塞住试管口⑤用排水
氢
法或向下排空气法收集
气
氢气
①简易启普发生器: 优点:可以随时控制反应的发生或停止。
②氢气的用途:制备金属材料,合成氨,合成盐酸。
水
1.物理性质
颜色
气味
状态
密度
凝固点
沸点
无色
无味
液态
约 1g/cm3
0C。
化学性质
①与某些非金属氧化物反应: H2O+CO2==H2CO3
②与某些金属氧化物反应: H2O+CaO==Ca(OH)2
过滤
吸附
蒸馏
1:试剂:明 矾
2.净水原理: 利用明矾溶 于水形成的 胶状物对水
①适用范围:用于分离难溶 性固体与液体(或可溶性固
体)
②操作注意事项: “一贴二低 三靠 ”
“一贴 ”:滤纸紧贴漏斗的内壁
常用的吸 附剂:活 性炭(具 有吸附
性)
2.适用范
1.净水原 理:利用液 体沸点不 同将液体 分离的方
的情况下,闭
合开光关③一
段时间后,停 止闭合开关,
观察现象。
注意事项:( 1)电源种类 ---直流电
(2)加入硫酸或氢氧化钠的目的 ----增强水的导电性
九年级化学氢气、水资源知识精讲

初三化学氢气、水资源【本讲主要内容】氢气、水资源1. 认识水的组成,知道硬水与软水的区别。
2. 了解吸附、沉淀、过滤和蒸馏等净化水的常用方法;认识保护水资源的重要性;学会用化学知识解决生活中的问题。
3. 了解氢气的可燃性及用途。
【知识掌握】【知识点精析】2. 吸附、沉淀、过滤和蒸馏等净化水的方法利用吸附、沉淀、过滤和蒸馏等方法可以净化水,用前三种方法净化后的水仍为混合物,用蒸馏的方法可将不纯的水变为纯净水。
3. 纯水与自然水、硬水与软水的区别纯水是无色、无臭、透明的液体;自然水中常含有许多可溶性和不溶性杂质而常呈浑浊。
含有较多可溶性钙、镁化合物的水叫硬水,不含或含较少的水叫软水。
4. 爱护水资源爱护水资源一方面要节约用水,另一方面要防止水体污染。
(1)预防和消除水体污染的措施有:①减少污染物的产生。
②对被污染的水进行处理使之符合排放标准。
③农业上提倡使用农家肥,合理使用化肥和农药。
④生活污水集中处理后再排放。
(2)水体:是海洋、湖泊、河流、沼泽、水库、地下水的总称。
(3)水体污染。
①工业污染:废水、废渣倒入江河、地下,污染江河和地下水。
②农业污染:农药、化肥的不合理使用,也易造成水污染。
③生活污染:生活污水及生活垃圾的任意排放造成水污染。
(4)水体污染的危害。
影响工农业、生产和渔业生产,破坏水的生态平衡,直接危害人体健康。
5. 氢气的可燃性:(1)纯净的氢气在空气中安静燃烧,产生淡蓝色火焰。
发生的反应:氢气 + 氧气 −−→−点燃水 (H 2) (O 2) (H 2O )(2)氢气与空气混合点燃发生爆炸。
【解题方法指导】例1. 水对于人类生活、工农业生产都具有重要意义。
(1)保持水的化学性质的粒子是____________。
(2)通电可使水分解,在两电极可分别得氢气和氧气。
这一现象说明水是由____________元素和____________元素组成的。
(3)要确定某瓶无色气体是氧气的实验方法是____________。
水和氢气精品讲义

第十讲水一、水的组成和性质1.电解水的实验现象及气体的验证(1)正、负电极上有气泡放出.(2)正极产生的气体能使燃着的木条燃烧更旺,证明是氧气;负极产生的气体能燃烧,发出淡蓝色火焰,证明是氢气.(3)正极产生的气体与负极产生的气体的体积比为1∶2.2.表达式:水−−→−通电 2H2↑+O2↑−通电氢气+氧气 2H2O−−→3.此实验证明(1)从宏观上,水是由氢元素和氧元素组成.从微观上,水是由水分子构成,水分子是由氢原子和氧原子构成的.(2)在化学反应中分子可以分成原子,而原子不能再分.(3)分类:水属于纯净物中的化合物,化合物中的氧化物.2. 水的性质1.物理性质:通常情况下,水是一种无色、无味的液体,凝固点为0℃ ,沸点为100 ℃。
2、水的化学性质(1)通电分解 2H2O−−→−通电 2H2↑+O2↑(2)水可遇某些氧化物反应生成碱(可溶性碱),例如:H2O + CaO Ca(OH)2(3)水可遇某些氧化物反应生成酸,例如:H2O + CO2 H2CO33、水的污染:(1)水资源A.地球表面71%被水覆盖,但供人类利用的淡水小于 1%B.海洋是地球上最大的储水库。
海水中含有80多种元素。
海水中含量最多的物质是 H2O ,最多的金属元素是 Na ,最多的元素是 O 。
C.我国水资源的状况分布不均,人均量少。
(2)水污染A、水污染物:工业“三废”(废渣、废液、废气);农药、化肥的不合理施用生活污水的任意排放B、防止水污染:工业三废要经处理达标排放、提倡零排放;生活污水要集中处理达标排放、提倡零排放;合理施用农药、化肥,提倡使用农家肥;加强水质监测。
(3)爱护水资源:节约用水,防止水体污染4、水的净化(1)水的净化效果由低到高的是静置、吸附、过滤、蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭。
(2)硬水与软水 A.定义硬水是含有较多可溶性钙、镁化合物的水;软水是不含或含较少可溶性钙、镁化合物的水。
2023年初中化学竞赛专题辅导氢气和水

竞赛专题辅导二: 氢气和水[要点讲解]抓住旳互变关系, 掌握波及旳各物质旳性质, 转化条件, 从宏观现象到微观解释, 从自然现象到书本知识, 联络好, 分析透。
[内容综述]1. 有了水才有生命。
对旳认识自然界水与人类饮用水旳关系, 建立节水、爱水、防治水污染旳意识。
2. 掌握及旳化学性质;研究水构成旳试验;旳试验室制备及试验原理旳一般规律。
[要点讲解]1. 由自然界水旳存在提出多种问题, 如: 水旳特性, 水旳用途, 水旳污染、防治, 积累这些方面旳有关知识。
2.设计研究水构成旳试验, 训练动手制备氢气并研究氢气性质旳能力。
3.运用有关化学方程式, 处理综合性“量化”问题。
例1. 下列说法对旳旳是()A 氢气比空气轻, 是填充飞艇旳一种比较安全旳气体。
B 可燃气体点燃后产物有水, 则此气体一定为水。
C 用比较活泼旳金属与酸反应就可获得氢气。
D 凡可燃气体在加热条件下还愿氧化铜时, 都应试验前先通气体, 试验后冷却再撤气体。
解析: 与空气混合受热易爆炸, 填充飞艇不安全, A错。
可用氦气替代。
点燃后产物有水, 阐明原可燃气体含氢元素, 不一定是氢气, 如燃烧有水生成。
B错, 活泼金属与稀HCl,酸反应出, 与反应则无生成。
C错。
D对, 理由同。
例2. 我国旳四大发明中, 与化学关系亲密旳是________, _______, 其中用到水较多旳是_________。
与上述有关, 易导致水污染旳工业生产是___________。
解析: 对我国历史, 现代旳科学成绩要多关注并联络学过旳知识解释有关问题。
四大发明是①火药、②活字印刷、③指南针、④造纸。
其中与化学关系亲密旳为①、④。
④用水多, 其化工生产会排出大量污水。
例3.某同学在没有酒精灯旳条件下完毕了氢气还原氧化铜旳试验。
简答:⑴他怎样处理热源(不可增长其他可为热源旳仪器)。
⑵换成一氧化碳, 按相似试验过程合理吗?若有不一样, 明确比较优缺陷。
解析: 联络重要化学性质: 可燃性和还原性, 将通过试验装置过量引到氧化铜下部点燃运用其放出旳大量热, 第⑴个问题处理了。
初中化学竞赛辅导

初中化学竞赛辅导第二部分元素化合物知识(一)[复习指导]空气的成分:按体积计算空气中的氮气约占78%,氧气约占21%,稀有气体及其它成分约占1%,许多科学家都做过研究空气成分的实验,具有代表性的人物是舍勒、普利斯特里和拉瓦锡。
稀有气体的用途很广,根据稀有气体的性质,它被应用于生产和科学研究等方面。
空气的污染和防止:煤燃烧产生的烟,(含SO2)、石油化工厂排放的废气、汽车排出车的尾气(含NO2等)形成的烟雾会造成空气的污染,有害燃烧的污染、空气的污染、环境污染及其危害,由于大气中二氧化硫和二氧化氮的含量过高,遇水便形成了酸雨,应采取各种措施控制污染,保护环境,注意大气环境保护,特别要注意防止居室中的空气污染,要保护臭氧层。
氧气的物理性质:通常状态下氧气是无色、无味的气体,不易溶解水在标准状况下氧气密度是1.429g/L,比空气略大;降低温度氧气可变为淡蓝色液体雪花状淡蓝色固体.氧气的化学性质:氧气是一种化学性质比较活泼的气体,它可以与金属、非金属、化合物等多种物质发生氧化反应,反应剧烈程度因条件不同而异,可表现为缓慢氧化、燃烧、爆炸等,反应中放出大量的热。
(1)氧气与非金属反应①木炭在氧气里剧烈燃烧,发出白光,生成无色、无气味能使澄清石灰水变浑浊的气体;②硫在氧气里剧烈燃烧,产生明亮的蓝紫色火焰,生成无色、有刺激性气味的气体;③磷白磷可以与空气中的氧气发生缓慢氧化,达到着火点(40℃)时,引起自燃:白磷或红磷在氧气中燃烧,生成大量白烟;④氢气在氧气中燃烧,产生淡蓝色火焰,罩一干冷烧杯在火焰上方,烧杯中有水雾。
(2)氧气与金属反应①镁在空气中或在氧气中剧烈燃烧,发出耀眼白光,生成白色粉末状物质;②铁红热的铁丝在氧气中燃烧,火星四射,生成黑色固体物质。
(3)氧气与化合物反应①一氧化碳在氧气中燃烧产生蓝色火焰,产生使澄清石灰水变浑浊的气体;②乙炔(C2H2)在氧气中燃烧产生明亮火焰,氧炔焰温度可达3000℃;③甲烷(沼气)在氧气中燃烧产生使石灰水变浑浊的气体和水;④蜡烛在氧气中剧烈燃烧生成二氧化碳和水。
(化学)竞赛专题辅导2:氢气和水

竞赛专题辅导二:氢气和水[要点讲解]抓住的互变关系,掌握涉及的各物质的性质,转化条件,从宏观现象到微观解释,从自然现象到书本知识,联系好,分析透.[内容综述]1.有了水才有生命.正确认识自然界水与人类饮用水的关系,建立节水、爱水、防治水污染的意识.2.掌握及的化学性质;研究水组成的实验;的实验室制备及实验原理的一般规律.[要点讲解]1.由自然界水的存在提出各种问题,如:水的特性,水的用途,水的污染、防治,积累这些方面的有关知识.2.设计研究水组成的实验,训练动手制备氢气并研究氢气性质的能力.3.利用有关化学方程式,解决综合性“量化”问题.例1.下列说法正确的是()A 氢气比空气轻,是填充飞艇的一种比较安全的气体.B 可燃气体点燃后产物有水,则此气体一定为水.C 用比较活泼的金属与酸反应就可获得氢气.D 凡可燃气体在加热条件下还愿氧化铜时,都应实验前先通气体,实验后冷却再撤气体.解析:与空气混合受热易爆炸,填充飞艇不安全,A错.可用氦气代替.点燃后产物有水,说明原可燃气体含氢元素,不一定是氢气,如燃烧有水生成.B错,活泼金属与稀HCl,酸反应出,与反应则无生成.C错.D对,理由同.例2.我国的四大发明中,与化学关系密切的是________,_______,其中用到水较多的是_________.与上述有关,易造成水污染的工业生产是___________.解析:对我国历史,现代的科学成绩要多关注并联系学过的知识解释有关问题.四大发明是①火药、②活字印刷、③指南针、④造纸.其中与化学关系密切的为①、④.④用水多,其化工生产会排出大量污水.例3.某同学在没有酒精灯的条件下完成了氢气还原氧化铜的实验.简答:⑴他怎样解决热源(不可增加其它可为热源的仪器).⑵换成一氧化碳,按相同实验过程合理吗?若有不同,明确比较优缺点.解析:联系主要化学性质:可燃性和还原性,将通过实验装置过量引到氧化铜下部点燃利用其放出的大量热,第⑴个问题解决了.⑵与CO都为可燃性还原气体.是绿色能源,最大优点是生成水,无污染.CO必须对氧气进行处理,防止污染大气.例4.用给出的仪器:大试管、长颈漏斗、量筒、水槽、带孔胶塞、玻璃管、胶管,设计一套能随时记录产生体积的实验装置.⑴画出简图(不画铁架合)⑵若在标准善下,63克锌能产生22.4升氢气.实验中10克盐酸,用去一半时,产生224毫升,则盐酸溶质的质量分数为___________,⑶为随时可以控制产生,还需增加仪器_______、______.解析:熟悉实验室制的全部知识.①改进装置②利用反应原理及信息计算.答案:⑴⑵⑶止水夹,带孔隔板例5.有铜6.4克,锌6.5克,铁5.6克,铝2.7克与一定量充分反应后,还余固体9.2克,求:⑴共可产生多少升?(的密度0.0899克/升)解析:能和稀反应的是活泼金属,Cu不反应,活泼金属中按K、Ca、Na、Mg、Al、Zn、Fe、Sa、Pb,顺序,左边比右边反应速度快.反应比例:Al 1.5Zn Fe .余下9.2克固体中应有Cu6.4克,Fe 2.8克,Al、Zn无剩余.依此可计算,共生成0.6克合6.7升.生成7.6克.强化练习:★★★1:填空:(水的作用:①氧化剂②还原剂③溶济④催化剂⑤无氧化还原作用的反应物)⑴活泼金属钾、钠与水激烈反应放出可燃气体,水为_________.⑵电解水实验中,水为_______.⑶氧化钠投入水中,溶液PH>7,水为_________.⑷在反应中,水为_________.⑸配制食盐水时,水为__________.⑹无水遇水变盐,水为_________.⑺氟()和水反应放出,水为________.★2.已知同温同压下,气体体积比等于分子个数比.空气中混有占有体积含量为4%到74.2%范围点燃则会爆炸.若按理论计算,在空气中占体积比哪个数时,爆炸最猛烈_________.A 10%B 29%C 50%D 70%★3.为使电解水实验进行比较快,可加入稀增加导电性,若加入25克8%,电解一段时间,溶质质量分数变为10%,此时可在_____ 极产生氢气______克.★4.在托盘天平两个托盘上放两个完全一样地烧杯,里边盛完全一样的稀硫酸,天平平衡,加入相同质量的镁粉和锌粉,反应一段时间,天平仍平衡,可能的情况为_______A 镁粉、锌粉都溶解了.B镁粉、锌粉都有剩余.C 镁粉有剩余、锌粉全溶.D 镁粉全溶、锌粉有剩余.★★★5.已知:氢气与氧气,氢气与氯气都可以点燃化合.同样反应条件,气体体积比等于分子数之比.若在一密闭容器中将、、混合气点燃充分反应,三种气体均无剩余,冷却后测得容器内酸溶液的质量分数为28.9%,则原混气中体积比::为________.★★6.将氢气、氧气混合气a升,充分燃烧后,测得所剩气体为b升,已知:同温同压下,任何气体的分子个数比即为体积比,题中a升、b升均中0℃、一个标准大气压下测得.求原混合气的组成(体积比)参考答案:1.分析:依据有化合价变化,则发生的为氧化还原反应,有生成,水为氧化剂,有生成,水为还原剂⑴①;⑵①和②;⑶⑤;⑷因为变为和,、没变,为⑤;⑸③;⑹⑤;⑺②.2.分析:依据体积比:折合空气2:5,理论值占,答案B.3.依据,溶质不变,25×8%=x·10% ,解出x=20克, 电解水:25-20=5(克), 答案:阴极;0.56克4.分析:,若天平仍平衡,加入金属质量相同,跑走一样,则两种可能:①酸不足量②因同样产生耗Zn多,镁剩余答案:B、C.5.依据;;恰当反应后得盐酸,视为100克中有氯化氢28.9克,水100-28.9=71.1(g),换成分子个数比:约2:10含有原子比:H:O:Cl为22:10:2,再折成分子个数比:为11:5:1 6.依据由题已知水为液态,b则为多余或讨论:过量,则有,有过量:则有,有恰当量:b=0有,有符合①②情况组成体积比①(2a+b) (a-b)② (2a-2b) (a+b)。
中考化学总复习基础知识回顾与能力训练第12课时水和氢气省公开课一等奖百校联赛赛课微课获奖PPT课件

2
(选填“1”或“2”)。
(2)自来水厂净水过程中用到活性炭,其作用是 吸附
。
(3)海水淡化可缓解淡水资源匮乏问题。图2为太阳能海水淡
化装置示意图。
①水变成水蒸气过程中,不发生改变是
A(B 选填
字母)。 A.分子质量 B.分子种类 C.分子间隔
B
A.水资源能够循环利用,没必要担心淡水资源不足
B.蒸馏水中加入肥皂水,振荡后有较多泡沫产生
C.矿泉水是纯净物
D.硬水经过活性炭吸附后可变为软水
解题思绪:即使水是可再生资源,但能够供人类直接利 用淡水资源却是十分有限,而且现在水污染情况非常严 重,故说法错误;B、蒸馏水属于软水,蒸馏水中加入 肥皂水搅拌能够得到大量泡沫,故说法正确;C、矿泉 水是从地下开采出来天然水,含有较多矿物质,所以矿 泉水是混合物,故说法错误;D、活性炭含有吸附性, 吸附色素和异味,不能降低水硬度,故说法错误.故选: B.
②利用该装置将一定量海水暴晒一段时间后,剩下海水中氯化
钠质量分数会是
(选填“变大”“变小”或“不变”)。
第5页
解题思绪:(1)由电解水装置示意图可知,2试管里气 体是电源上正极产生气体,是氧气;(2)自来水厂净水 过程中用到活性炭,其作用是吸附作用;(3)水变成水 蒸气过程中是物理改变,分子质量和分子种类不变,分 子间隔改变;将一定量海水暴晒一段时间后,溶剂降低, 溶质不变,剩下海水中氯化钠质量分数会变大。
。
复习提醒:
书本上虽没有 专门单元介绍氢气, 但在各单元中已渗 透了相关氢气知识, 故应经过复习进行 归纳。注意了解点 燃氢气应注意问题 及正确操作方法。
关于氢气制法 书本上未介绍,但 经过进行 “CO2 制法研究”,基础 很好同学应能拓展、 迁移出氢气试验室 制法。
九年级化学复习4水和氢气教案

教案:水和氢气教学目标:1.了解水的化学性质和氢气的制备方法。
2.掌握水的电离反应和氢气的特性。
3.理解水和氢气在生活和工业中的应用。
教学重点:1.水的电离反应和酸碱性质。
2.氢气的制备方法和特性。
教学难点:1.掌握水的电离反应和理解产生的氢离子和氢氧根离子的性质。
2.理解电解水的原理和反应过程。
教学方法:1.讲授法:通过讲解理论知识,分析示例和实验结果,引导学生理解和掌握水和氢气的性质和应用。
2.实验法:进行一些简单的实验,观察和记录实验现象,促进学生对水和氢气的理解和掌握。
3.讨论法:通过提问和讨论,激发学生主动思考和参与,培养分析问题和解决问题的能力。
教学准备:1.实验器材和试剂:氢氧化钠、盐酸、锌粉、试管、酒精灯等。
2. ppt或黑板、粉笔等教学工具。
3.教材、练习册、教学参考资料。
教学过程:Step 1: 导入(5分钟)学生回顾前面学过的水的化学性质的知识,回答一些问题,如水的电离反应是什么?水的酸碱性质怎么样?Step 2: 知识讲解(30分钟)1.讲解水的电离反应和酸碱性质。
a. 水的电离反应:H2O(l) ⇌ H+(aq) + OH-(aq)b.水的酸碱性质:在水中存在了氢离子H+和氢氧根离子OH-,所以水同时表现出酸性和碱性特性。
2.讲解氢气的制备方法和特性。
a. 锌与酸的反应:Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)b.氢气的性质:无色、无味、不可燃,但能和氧气产生剧烈的反应。
Step 3: 实验演示(20分钟)进行以下实验演示,学生观察并记录实验现象:1.用盐酸和氢氧化钠反应制备氢气。
a.将一小块锌粉加入试管中。
b.加入适量的盐酸,观察并记录实验现象。
c.将试管置于水中,收集气体。
d.用火柴点燃收集到的气体,观察并记录实验现象。
2.用电解水制备氢气和氧气。
a.准备两个玻璃容器,分别装入盐水和纯净水。
b.在两个容器中分别放入两个导电棒。
c.将导电棒的另一头连接电源,通电。
【初中化学】水和氢气PPT课件 人教版

▪
密度比空气大—向上排空气法
排空气法
▪
密度比空气小—向下排空气法
▪ 注意:
▪ ①当气体的密度和空气相近且难溶于水一般采用排水法。
▪ ②空气的平均分子量为29,如果某气体的相对分子质量 >29,则密度比空气大,如果相对分子质量小于29,则密度 比空气小。
2、氢气的性质
(1—4)节复习
一、水
1、水的性质
问题:水有哪些物理性质呢?
物理性质:
水是无色无味液体,在4。C时水 的密度最大为1g/cm3,在101KPa 下水的凝固点为0。C,沸点为 100。C,水的导电能力较弱。
2、水资源的利用与保护
问题
▪ 看了以上图片你们有什么想法? ▪ 在你生活的周围有哪些水的污染源?请你
▪ 常用天然气或水煤气等做原料来制备氢气。
▪ 实验室制法:
▪ 反应原理:
锌+硫酸 硫酸锌+氢气
多孔隔板
A
B
装置的选择
发生装置
▪ 反应条件(是否需要加热、催化剂 等)
▪
固体和液体反应(如制H2)
▪ 反应物 状态
▪
固体和固体反应(如制O2)
一装置多用,多装置一用
▪ ▪A
BC
DE
A
B
C
收集装置
提出防治的设想或建议。 ▪ 下列各种标志中属于节水徽记的是
3、水的组成
练习
下图为通电分解水的简易装置。回答下列问题:
与试管A中的电极相连接的是电源的负 极,试管B中 收集到的气体是 氧气 ,它与试管A中的气体的体积 比约为 1∶2 。结论: 水是氢元素和氧元素组成
二、氢气
氢和水详细讲解专题

中学化学竞赛试题资源库——氢和水A组1.科学家在研究和探索中不断发现新的物质。
据报道,1996年科学家在宇宙中发现H3分子,那么H3和H2属于A 同位素B 同分异构体C 同系物D 氢的同素异形体2.下列单质中,最容易跟氢气发生反应的是A O2B N2C F2D Cl23.“在火星上找到水存在的证据”位居《science》杂志评出的2004年10大科技突破之首。
下列关于水的说法中错误的是A 水是生命活动必不可少的物质B 水是由极性健构成的极性分子C 水是一种极弱的电解质,温度越高电离程度越大D 高效催化剂可使水分解获得氢气,同时释放能量4.水资源非常重要,联合国确定2003年为国际淡水年。
下列关于水的说法中错误的是A 蒸馏法是海水淡化的方法之一B 0℃以上,温度越高,水的密度越小C 融化的雪水中矿物质含量比深井水中的少D 淡水的密度小于海水的密度5.商品“纯净水”、“太空水”、“蒸馏水”等作为日常饮用水,因缺少某些成分而不利于儿童身体健康发育,你认为制备上述商品饮用水时至少还需要添加的化学物质是A 钙、镁的碳酸氢盐B 含碳酸钾的食盐C 漂白粉消毒剂D 小苏打6.若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是A 加明矾使海水中的盐分沉淀而淡化B 利用太阳能将海水蒸馏淡化C 将海水缓慢降温凝固以获取淡化的饮水D 将海水通过离子交换树脂,以除去所含的离子7.水的状态除了气、液和固态外,还有玻璃态。
它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是A 水由液态变为玻璃态,体积缩小B 水由液态变为玻璃态,体积膨胀C 玻璃态是水的一种特殊状态D 玻璃态水是分子晶体8.《科学》杂志评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。
下列关于水的说法中正确的是A 水的电离过程是放热的过程B 盐的水解一定能促进水的电离C 催化剂能提高水分解的转化率D 金属的电化腐蚀与水无关9.下列各组物理量中,都不随取水量的变化而变化的是A 水的沸点;蒸发水所需热量B 水的密度;水中通入足量CO2后溶液的pHC 水的体积;电解水所消耗的电量D 水的物质的量;水的摩尔质量10.2002年6~7月间,我国部分地区发生洪涝灾害。
2020年中考化学复习 第2讲 水 氢气(共12张PPT)

硬水:含_较__多___可溶性钙、镁化合物的水 概念 软水:_不__含__(_或__含__较__少__)_可溶性钙、镁化合物的水
区分方法:加_等__量__的__肥__皂__水___搅拌,产生泡沫多、浮渣少的是_软__水___
,
硬水
反之是______,实验室______
返回首页
考点梳理(氢气) 考点特训营
验纯:混有一定空气或氧气的氢气遇明火会发生__爆__炸___ ,因此点燃氢气前一定要__验__纯___。检验 的方法如图Ⅰ、Ⅱ所示,若听见尖锐的爆鸣声表明气体不纯,声音很小则表明气体较纯
制取 氢气
a. 电解水(化学方程式,下同)_2_H_2O__=_=通_=电_=_=_2_H_2_↑__+__O_2_↑____________
b. 金属与酸反应(实验室通常用稀 H2SO4和Zn粒反应制取) __Z_n_+__H__2S__O_4_=_=_=__Z_n_S_O__4+___H_2_↑____
第2讲 水 氢气
易 错 易 混 点 判 断 考点特训营
下列有关水的说法中正确的是___①__④__⑤__⑫____。 ①地球上水资源丰富,但淡水相对短缺,一定要节约用水 ②水体有一定的自净功能,城市生活污水可直接排放 ③水中钙、镁离子过多会造成水体富营养化 ④自然界的水都不是纯水,天然水可以分为硬水和软水 ⑤蒸馏既能降低水的硬度,又能杀菌消毒 ⑥活性炭、明矾在净水过程中起着吸附和消毒的作用 ⑦天然水经过自来水厂净化后得到的是纯净物 ⑧生活中常用肥皂水将硬水转化成软水 ⑨电解水实验正、负极产生气体的质量比为1∶2 ⑩电解水实验产生氢气和氧气,说明水是由氢气和氧气组成的 ⑪电解水实验时,正极产生氢气,负极产生氧气 ⑫氢气在氧气中燃烧生成水,说明水是由氢元素和氧元素组成的
全国中学生化学竞赛预赛专题讲座-第一讲:差量法 1、用氢气还原10克

1、用氢气还原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,则参加反应CuO 的质量是多少克?2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比?3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反应的铁的质量?4、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。
把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,则原30mL中甲烷和氧气的体积比?5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反应,冷却称量固体质量为37克,求原混合物中铜元素的质量分数?答案:1、8克2、7∶ 53、11.2克4、8∶7 7∶235、28.89%6、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数?7、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。
现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5ml,则原混和气体中CO、O2、CO2的体积比?8、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。
求⑪原混合气体中CO的质量?⑫反应后生成的CO2与原混合气体中CO2的质量比?9、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数?10、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是()A FeB AlC Ba(OH)2D Na2CO311、P克结晶水合物A·nH20,受热失去全部结晶水后,质量为q克,由此可得知该结晶水合物的相对分子质量为()A、18Pn/(P—q)B、18Pn/q C、18qn/P D、18qn/(P—q)答案:6、96% 10、A 11、A1、一块质量为4克的合金,与足量的盐酸反应,产生0.2克氢气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
竞赛专题辅导二:氢气和水
[要点讲解]
抓住的互变关系,掌握涉及的各物质的性质,转化条件,从宏观现象到微观解释,从自然现象到书本知识,联系好,分析透。
[内容综述]
1.有了水才有生命。
正确认识自然界水与人类饮用水的关系,建立节水、爱水、防治水污染的
意识。
的化学性质;研究水组成的实验;2及.掌握的实验室制备及实验原理的一般规律。
[要点讲解]
1.由自然界水的存在提出各种问题,如:水的特性,水的用途,水的污染、防治,积累这些方面的有关知识。
2.设计研究水组成的实验,训练动手制备氢气并研究氢气性质的能力。
3.利用有关化学方程式,解决综合性“量化”问题。
例1.下列说法正确的是()
A 氢气比空气轻,是填充飞艇的一种比较安全的气体。
B 可燃气体点燃后产物有水,则此气体一定为水。
C 用比较活泼的金属与酸反应就可获得氢气。
D 凡可燃气体在加热条件下还愿氧化铜时,都应实验前先通气体,实验后冷却再撤气体。
解读:与空气混合受热易爆炸,填充飞艇不安全,A错。
可用氦气代替。
点燃后产物有燃烧有水生成。
B错,活泼金属与水,说明原可燃气体含氢元素,不一定是氢气,如
反应则无,酸,与C错。
D反应出对,理由同。
稀HCl生成。
例2.我国的四大发明中,与化学关系密切的是________,_______,其中用到水较多的是_________。
与上述有关,易造成水污染的工业生产是___________。
解读:对我国历史,现代的科学成绩要多关注并联系学过的知识解释有关问题。
四大发明是①火药、②活字印刷、③指南针、④造纸。
其中与化学关系密切的为①、④。
④用水多,其化工生产会排出大量污水。
例3.某同学在没有酒精灯的条件下完成了氢气还原氧化铜的实验。
简答:⑴他怎样解决热源(不可增加其它可为热源的仪器)。
⑵换成一氧化碳,按相同实验过程合理吗?若有不同,明确比较
优缺点。
主要化学性质:可燃性和还原性,将解读:通过实验装置过量引到氧化铜下联系都为可燃性还原气体。
CO与部点燃利用其放出的大量热,第⑴个问题解决了。
⑵是绿色能源,最大优点是生成水,无污染。
CO必须对氧气进行处理,防止污染大气。
例4.用给出的仪器:大试管、长颈漏斗、量筒、水槽、带孔胶塞、玻璃管、胶管,设计一
套能随时记录产生体积的实验装置。
⑴画出简图(不画铁架合)
1 / 4 克盐酸,用去一半时,产生10克锌能产生22.4升氢气。
实验中⑵若在标准善下,63
,⑶为随时可以控制产生,还需增加224毫升,则盐酸溶质的质量分数为___________ 。
、______仪器_______的全部知识。
①改进装置②利用反应原理及信息计算。
熟悉实验室制
解读:⑵答案:⑴
⑶止水夹,带孔隔板克与一定量2.7克,铝充分反应后,还余固体克,锌6.5克,铁
5.6例5.有铜
6.4/升)多少升?(的密度9.20.0899克,求:⑴共可产生克反应的是活泼金属,Cu不反应,活泼金属中按K、Ca解读:、能
和稀Na、Mg、 1.5Pb,顺序,左边比右边反应速度快。
反应比例:Al Zn、Fe、Sa、Fe Zn
Al、。
余下9.2克固体中应有Cu6.4克,Fe 2.8克,Al、Zn无剩余。
依此可计算,共生成
升。
生成7.6克。
6.7克合0.6
强化练习:
★★★1:填空:(水的作用:①氧化剂②还原剂③溶济④催化剂⑤无氧化还原作用的反应物)
⑴活泼金属钾、钠与水激烈反应放出可燃气体,水为_________。
⑵电解水实验中,水为_______。
⑶氧化钠投入水中,溶液PH>7,水为_________。
⑷在反应中,水为_________。
⑸配制食盐水时,水为__________。
⑹无水遇水变盐,水为_________。
)和水反应放出,水为________⑺氟(。
.已知同温同压下,气体体积比等于分子个数比。
空气中混有2占有体积含量为4%★范围
点燃则会爆炸。
若按理论计算,74.2%到在空气中占体积比哪个数时,爆炸最猛烈2 / 4
_________。
A 10%
B 29%
C 50%
D 70%
稀增加导电性,若加入进行比较快,可加入25克解★3.为使电水实验溶质
质量分数变为10%,此时可在8%,电解一段时间,_____ 极产生氢气______克。
★4.在托盘天平两个托盘上放两个完全一样地烧杯,里边盛完全一样的稀硫酸,天平平衡,加入相同质量的镁粉和锌粉,反应一段时间,天平仍平衡,可能的情况为_______
A 镁粉、锌粉都溶解了。
B镁粉、锌粉都有剩余。
C 镁粉有剩余、锌粉全溶。
D 镁粉全溶、锌粉有剩余。
★★★5.已知:氢气与氧气,氢气与氯气都可以点燃化合。
同样反应条件,气体体积比等、、于分子数之比。
若在一密闭容器中将混合气点燃充分反应,三种气体均无
28.9%:,则原混气中体积比剩余,冷却后测得容器内酸溶液的质量分数为:为________。
★★6.将氢气、氧气混合气a升,充分燃烧后,测得所剩气体为b升,已知:同温同压下,任何气体的分子个数比即为体积比,题中a升、b升均中0℃、一个标准大气压下测得。
求原混合气的组成(体积比)
参考答案:
.分析:依据有化合价变化,则发生的为氧化还原反应,有生成,水为氧化剂,有1
、没变为生成,水为还原剂⑴①;⑵①和②;⑶⑤;⑷因为和,变,为⑤;
⑸③;⑹⑤;⑺②。
,理论值22体积比:.分
析:依据:5折合空气B。
占,答案溶质不变,25×8%=x·10% ,解出x=20克,,3 .依据电解水:25-20=5(克),答案:阴极;0.56克
,若天平仍平衡,加入金属质量相同,跑走一样,则两种4.分析:Zn可能:①酸不足量②因同样产生耗多,镁剩余 3 / 4
答案:B、C。
;;恰当反应后得盐酸,视为5100.依据克中有氯化氢28.9克,水100-28.9=71.1(g),换成分
子个数比:约2:10含有原子比:H:O:Cl为22:10:2,再折成分子个数比:为11:5:1
或则为多余.依据由题已知水为液态,b6
,有讨论:过量,则有,有过量:则有
,有符合①②情况b=0有恰当量:组成体积比
①(2a+b) (a-b)
(2a-2b) (a+b)②
4 / 4。
