第五章 原子族化合物
高中化学第五章化工生产中的重要非金属元素2氮及其化合物第1课时教案2

氮及其化合物第1课时教学设计一、教学目标1.知识与技能(1)了解氮的固定及其类型;(2)掌握氮气、氨气、氮的氧化物的性质及其应用;(3)了解氮的氧化物对大气污染与防治方法.2.过程与方法(1)培养学生发现问题、分析问题、解决问题的综合能力。
(2)在构建氮及其化合物等有关知识网络的过程中,学会提炼化学知识的方法。
3.情感态度与价值观(1)逐步培养勤于思考,勇于探究的科学品质,严谨求实的科学态度。
(2)培养学生能主动关心与环境保护,资源综合利用等有关的社会热点问题,形成与环境和谐共处,合理利用自然资源的观念。
教学重难点1.教学重点氨的性质及制备、氮的氧化物溶于水的计算2.教学难点氮的氧化物溶于水的计算二、教学过程2NH高温、高压催化剂以前我们经常会听到这样一句话:雨发庄稼”,为什么雷雨天庄稼会长得好呢?这就涉及到氮的固定的知识了,高温、高压催化剂HNO3→硝培养学生总结归纳、辩证思O NH3NH4=NH4Cl=(NH4)4NO + 6H催化剂△【师】氨与水反应生成氢氧根,溶液显碱性所以可用湿润的红色石蕊试纸检验与氯化氢气体反应产生大量白烟。
【学生活动】学生进行实验并描述实验现象,归纳结论。
现象:烧杯中的溶液由玻璃管进入烧杯,形成喷泉,瓶内液体呈红色。
结论:氨极易溶于水,水溶液呈碱性.【师】除了氨还可以用哪些物质做喷泉实验?氯化氢气体与水或氢氧化钠溶液、氨气与水或盐酸、CO2(Cl2、H2S、或SO2)与氢氧化钠溶液、NO2和O2与水。
【师】氨有哪些用途?【学生】①氨是氮肥工业、有机合成工业、制造硝酸、铵盐和纯碱的原料。
②液氨可做制冷剂。
【板书】四、氨的制备【师】如何制备氨?我们有三种方法:【展示PPT】方法一铵盐与碱共热实验原理:2NH4Cl + Ca(OH)2 △CaCl2 + 2NH3↑ + 2H2O收集:氨的密度比空气小,且氨易溶于水。
可用向下排空气法。
检验:用湿润的红色石蕊试纸(变蓝)或蘸有浓硫酸的玻璃棒(有白烟)接近试管口。
原子簇化合物-10

a1g
a1g(σ)
6BH B6H62-
B6H62-的骨Байду номын сангаас分子轨道能级图
t1u
5.2 碳硼烷及金属碳硼烷衍生物
1.碳硼烷 CH与BH-基团是等电子体,故硼烷中部分BH-可被 CH基团取代,形成碳硼烷(carborane)。其中,硼、碳原 子共同组成多面体骨架。 C ~ BH 等电子,分子结构中C 取代 BH C BH, P BH (或BH2), S BH2 (或BH3) 碳硼烷 1,2- C2B10H12 1-SB9H9 相应的硼烷 ( B12H122– ) (B10H102)
第五章
原子簇化合物
5.0 概述
F. A. Cotton(1966年): 原子簇:含有直接而明显键合的两个或两个以上金属 原子的化合物。 美国化学文摘:
原子簇化合物:含有三个或三个以上互相键合或极大 部分互相键合的金属原子的配位化合物。
徐光宪院士(1982): 原子簇:为若干有限原子(三个或三个以上)直接键 合组成多面体或缺顶多面体骨架为特征的分 子或离子。
C2B9H112-
如果两个这样的 开式碳-硼烷阴离子 将一个金属离子夹起 来, 便得到一种夹心 型的金属碳硼烷。
如果金属还含有 空轨道,它还可接收 其他的配体。
CoIII(1,2-C2B9H11)2–
盆状二碳硼烷金属配合物
如果金属还含有 空轨道,它还可接 收其他的配体。
CuCl(CB11F11)2–
3 (蛛)网式(arachno)- 硼烷
通式:BnHn+6 结构:
由有n+2个顶点的闭式-硼烷阴离子多面体骨架去掉两个相 邻的顶衍生而来的结构,其“口”张得比巢式-硼烷更大, 是缺两 个顶的多面体。 三种结构不同的氢原子: ♥ n个外向端梢H原子;♥桥式H原子;♥切向端梢H原子 外向 切向氢 端梢H
高考化学大一轮复习展示 第5章第1讲 原子结构课件

本 _________________________________________________。
课
栏 (3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显
目 开
强酸性,该化合物的化学式为__________。
关 (4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素
W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M
栏 目
Z L 层电子数是 K 层和 M 层电子数之和
开 关
共用三对电子形成双原子分子,常温下
W
为气体单质
规律方法·解题指导
第1讲
(1)画出W原子结构示意图__________________________。
(2)元素X与元素Z相比,非金属性较强的是__________,写出
一个能表示X、Z非金属性强弱关系的化学反应方程式
开 关
②根据上述离子方程式,可以判断 C 与 B 结合质子的能力
大小是(用化学式或离子符号表示)__________________。
答案 (1)
(2)①HS-+OH-===S2-+H2O ②OH->S2-
规律方法·解题指导
第1讲
规律方法 识记 1-20 号元素的特殊电子层结构
(1)最外层有 1 个电子的元素:H、Li、Na、K;
()
本
A.16O2 与 18O2 互为同分异构体
课 栏
B.16O 与 18O 核外电子排布方式不同
目 开
C.通过化学变化可以实现 16O 与 18O 间的相互转化
关
D.标准状况下,1.12 L16O2 和 1.12 L18O2 均含 0.1NA 个氧
为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在
【高中化学】第五章整理与提升2022-2023学年高二化学同步精品课件(人教版2019选择性必修3)

C.合成酚醛树脂(
)的单体是苯酚和甲醇
D.合成顺丁橡胶(
)的单体是
CH2=CH—CH=CH2
考点二:有机合成与推断
典例2:苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应 可制得香料M和高分子N(部分产物及反应条件已略去)。
知合
识成
体
高 分
系子
加聚反应 合成方法 缩聚反应
塑料 ——聚乙烯、酚醛树脂
通用高分子 合成纤维 ——锦纶、涤纶
类别
功能高分子
合成橡胶 ——顺丁橡胶 高分子分离膜 高吸水性树脂
一:高分子的结构特点
1.比较高分子与一般小分子有机物
有机物 举例
结构简式
高分子 聚丙烯 一般有机 丙烯
小分子
[ CH CH2]n CH3 CH3CH=CH2
(2)根据特征现象进行推断
①溴水褪色:一般含碳碳双键、碳碳三键或醛基。 ②酸性高锰酸钾溶液褪色:含碳碳双键、碳碳三键、醛基或为苯的同系物( 与苯环相连的碳原子上连有氢原子)。 ③遇FeCl3溶液显紫色:含酚羟基。 ④加入新制的Cu(OH)2悬浊液(或银氨溶液),加热后出现砖红色沉淀(或银镜) 含醛基。 ⑤加入Na,产生H2:含羟基或羧基。物质可能为醇、酚、羧酸等。 ⑥加入NaHCO3溶液,产生气体:含羧基。 ⑦加入溴水产生白色沉淀:含酚羟基。 ⑧能水解的有机化合物可能含有酯基、酰胺基或是卤代烃。 ⑨能发生消去反应的可能是醇或卤代烃等
M
M+28
(关系式中 M 代表第一种有机物的相对分子质量)
(4)根据特征产物推断碳骨架结构和官能团的位置
高一化学第五章知识点梳理

高一化学第五章知识点梳理第一节:元素及元素周期表元素是指由具有相同原子序数(即原子核中的质子数)的原子组成的纯物质。
元素是构成物质的基本单位,目前已知的元素有118种。
元素周期表是化学元素按一定规律排列的表格,根据元素的原子序数从小到大排列,形成横行和纵列。
元素周期表的横行称为周期,纵列称为族。
元素周期表是化学基础知识的重要工具,可以通过元素周期表了解元素的特性、性质和周期规律。
第二节:钠和氯的化学性质钠是一种常见的金属元素,具有银白色、有光泽的外观。
在常温下,钠具有较低的密度,可以很容易地被切割成小片。
钠是一种具有较强还原性的金属,可以与非金属元素反应形成离子化合物。
氯是一种常见的非金属元素,呈黄绿色的气体,有刺激性气味。
氯是一种具有较强氧化性的元素,可以与金属元素反应形成离子化合物。
钠和氯反应生成氯化钠,是一种常见的化学反应。
氯化钠是一种无色结晶体,也被称为食盐,广泛应用于食品加工和调味。
第三节:金属性质和非金属性质根据元素的化学性质的不同,可以将元素分类为金属性和非金属性。
金属性元素具有良好的导电性、导热性和延展性,常常呈现出金黄色的外观。
金属性元素在化学反应中通常表现为容易失去电子而形成阳离子。
非金属性元素通常不具有良好的导电性和导热性,与金属性元素相比更容易获得电子形成阴离子。
非金属性元素在化学反应中通常表现出较强的氧化性。
第四节:原子价与化合价原子价是指原子在化合物中与其他原子结合时所能提供或接受的电子数目。
原子价决定了原子结合成化合物时的化合价。
化合价是指化合物中不同元素之间价电子的相对数目。
化合价决定了物质在化学反应中的性质和反应方式。
原子价和化合价的确定需要根据元素的电子结构和元素与其他元素之间的化学反应进行综合考虑。
第五节:离子化合物与共价化合物离子化合物是由带正电荷的金属离子和带负电荷的非金属离子通过电子转移形成的化合物。
离子化合物的特点包括熔点和沸点高,通常呈现结晶形态。
结构化学第五章3

氯
碘
S的同素异构体很多:
碳的一些结构
Conclusion:
(1)对于各种元素,尽管存在各种同素异构体,有的甚至数目很多 ,但是每种原子的成键方式、配位情况、键长、键角等数据却很一致 ,或出现有限的几种情况。 (2)非金属单质的成键规律,一般可按参与成键的价电子数及有关 的原子轨道来分析。 (3)在非金属的单质结构中,同一族元素随着原子序数的递增,金 属性也会相应地递增,分子间的界限会越来越模糊。 (4)对于P4,C60等具有封闭凸多面体的分子,凸多面体的面数(F )、棱数(E)和顶点数(V)之间的关系符合Euler(欧拉)公式
例如,SiF62-能稳定存在,而SiCl62-却不存在,原因是硅 原子的d轨道比s和p轨道离核较远,参与形成sp3d2杂化轨道 时,不能形成稳定的键;而SiF62-能稳定存在,是由于F原子 的电负性大,从Si拉走的电子较多,增加了Si核的有效电荷, 使d轨道收缩,Si—F键增强,同时,F原子半径较小,相互排 斥较小,使它适于成键。
F V E 2
8-N规则
5.8.2 非金属化合物的结构特征
1.分析各个原子d轨道是否参与成键
第一周期H、He只有1s轨道参与成键;第二周期元素只 能有2s、2p轨道参与成键;而从第三周期起,就有空的nd 轨道与ns、np轨道的能级接近,可使价层轨道扩充。由于有 d轨道参加,最高的配位数可超过4。但d轨道能否有效地参加 成键,还要看d轨道的分布情况;当d轨道分布弥散,离核较 远,成键效率下降,就不能利用d轨道成键。
反应的势能面
乙烯加氢的反应
丁二烯和乙烯环加成生成环己烯的反应
关于两者轨道对称性匹配的描述。
5.6.3分子轨道对称守恒原理
周公度第四版结构化学第五章_多原子分子的结构和性质总结

·价电子对互斥理论不能应用的化合物
·过渡金属化合物(具有全充满、半充满或全空的 d轨道除外)。
§5.2 杂化轨道理论
一、杂化概念的提出 1931年和Slater提出杂化概念,为了解
释键角的变化。
为了解释甲烷的正四面体结构,说明碳原子四个 键的等价性,鲍林在1928一1931年,提出了杂化轨道 的理论。
例:如右图:
A(1,2,3) 124.1 A(1,2,4) 124.1 A(3,2,4) 111.9
3. 成键电子对和孤对电子对的分布情况不同,前者受 到2个成键原子核的吸引,比较集中在键轴的位置, 而孤对电子对没有这种限制,显得比较肥大(空间 分布范围广),所以孤对电子对对相邻电子对的排 斥较大。
目录
1 价电子对互斥理论(VSEPR) 2 杂化轨道理论 3 离域分子轨道理论 4 休克尔分子轨道法(HMO法) 5 离域π键和共轭效应 6 分子轨道对称性和反应机理
5.1 价层电子对互斥理论(VSEPR)
VSEPR: (Valence Shell Electron Pair Repulsion) 判断多原子分子几何构型的近代学说。
三、判断分子几何构型的原则:
ALmEn
当中心原子A周围存在m个配位体L及n个孤 对电子对E(ALmEn)时,提出判断分子几何构型 的原则如下:
1.为使价电子对间斥力最小,可将价电子对看作等距 离地排布在同一个球面上,形成规则的多面体形式。
★ 当m+n=2 时,直线形; ★ 当m+n=3 时,三角形; ★ 当m+n=4 时,四面体形;★ 当m+n=5 时,三方双锥形; ★ 当m+n=6 时,八面体形。
2023年高一化学寒假复习第五章 化工生产中的重要非金属元素 第二节 氮及其化合物(解析版)

第五章 化工生产中的重要非金属元素第二节 氮及其化合物【学习目标】1.说明氮气与镁、氧气、氢气的化学反应及其条件。
了解氮的固定和自然界中氮的循环。
2.认识氮氧化物的性质与转化,熟知工业制硝酸的反应原理。
3.认识氨、铵盐的性质与转化,促进“证据推理与模型认知”化学核心素养的发展。
4.设计实验,如氨的性质实验、制备实验,铵盐的性质实验及铵离子的检验。
5.能从物质类别、氮元素化合价的角度认识硝酸的性质及含氮物质间的相互转化,促进“证据推理与模型认知”化学核心素养的发展。
6.认识二氧化硫、氮氧化物为大气污染物,了解酸雨的形成、危害及其防治,增强环保意识和社会责任感。
【基础知识】一、氮气与氮的固定1、氮元素的位置、结构与存在(1)氮元素位于元素周期表的 第二 周期、第 ⅤA 族。
氮原子的最外电子层有 5个 电子,既不容易得到3个电子,也不容易失去5个电子。
因此,氮原子一般通过 共用电子对 与其他原子相互结合构成物质。
(2)氮元素在自然界中主要以 氮分子 的形式存在于空气中,部分氮元素存在于动植物体内的 蛋白质中,还有部分氮元素存在于土壤、海洋里的 硝酸盐 和 铵盐 中。
2、氮气的物理性质N 2是一种 无色 、 无味 的气体,ρ(N 2)<ρ(空气), 难 溶于水。
3、氮气的结构与化学性质(1)N 2的结构:N 2的结构式为 N≡N ,氮氮键很难断裂,化学性质很稳定。
(2)化学性质N 2在 高温、放电 等条件下,N 2获得足够的能量,使 N≡N 断裂。
写出N 2与Mg 、H 2、O 2反应的化学方程式。
①3Mg +N 2=====点燃Mg 3N 2; ②N 2+3H 2高温、高压催化剂2NH 3; ③N 2+O 2=====高温或放电2NO 。
4、氮的固定:将大气中 游离态 的氮转化为 氮的化合物 的过程。
(1)自然固氮:大自然通过闪电释放的能量将空气中的氮气转化为含氮的化合物,或者通过豆科植物的根瘤菌将氮气转化成氨。
第五章 第二讲 元素周期表

较
微粒半径大小比较的常用规律
1.同周期元素的微粒 同周期元素的原子或最高价阳离子或最低价阴离子半径 随核电荷数增大而逐渐减小(稀有气体元素除外),如 Na>Mg>Al>Si,Na+>Mg2+>Al3+,S2->Cl-。 2.同主族元素的微粒 同主族元素的原子或离子半径随核电荷数增大而逐渐增大,如 Li<Na<K,Li+<Na+<K+。
序号 元素种数 0族原子序数 1 2 3 4 5 6 7 最多容纳32种元素,目 前排了32种元素
2 2
8 10
8 18
18 36
18 54
32
86
(3)族 ①主族:由 短周期 的族(第18列除外)
列序 1
ⅠA
元素和 2
ⅡA
长周期
元素共同组成 16
ⅥA
13
ⅢA
14
ⅣA
15
ⅤA
17
ⅦA
主族序 数
②副族:仅由 外) 3 列序 族序 数
高三化学第一轮复习
第五章 元素周期律 第二讲 元素周期表和元素周期律
1.了解元素周期表 2.了解元素周期律
一、元素周期表 1.原子序数 核电荷数 对于一个原子:原子序数= = 质子数 = 核外电子数 = 质量数 - 中子数 。 2.元素周期表形成 (1)编排原则: ①把 电子层数 相同的元素按 原子序数 递增顺序从左到右排 成一横行,共有 7 个横行。 最外层电子数 递增的顺 ②把不同横行中 电子层数 相同的元素按 18 纵行。 序从上到下排成一纵行,共有 (2)周期 短周期 长周期
3.A、B、C、D四种短周期元素,原子序数依次增 大,离子半径依次减小,A与C可形成原子个数比分别 为l∶1和1∶2的两种离子化合物,A与D的原子序数之 和等于B与C的原子数之和,请回答下列问题: (1)写出元素符号:B________,D________。 (2)A、C形成的离子化合物与CO2发生氧化还原反应 的化学方程式__________________。 (3)1 mol C的氢氧化物与1 mol B单质在一定条件 下恰好完全反应,生成一种盐、水及一种气体,写 出该反应的化学方程式______________。 (4)B、C形成的化合物溶于水时,溶液中所有离子 的物质的量浓度由大到小的顺序为 ______________________。
第五章第24讲原子结构核外电子排布2025年高考化学一轮复习

— 返回 —
— 22 —
— 返回 —
3.电子自旋 (1)电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(↑和↓)
表示自旋□1 相反 的电子。 (2)能量相同的原子轨道(简并轨道),箭头表示一种□2 自旋状态的电子,“↑↓”称电
子对电子称自旋□3 平行。
— 17 —
解析 答案
— 返回 —
4.(2024·青岛黄岛区期中)现有下列 9 种微粒:11H、21H、136C、146C、147N、5266Fe2+、5266Fe3 +、168O2、
168O3。按要求完成以下各题: (1)11H、21H 分别是氢元素的一种___核__素___,它们互称为_同__位__素___。 (2)互为同素异形体的微粒是_16_8O__2_和__16_8O__3______。 (3)5266Fe2+的中子数为___3_0____,核外电子数为___2_4____。 (4)上述 9 种微粒中有____7____种核素,含有___5_____种元素。 (5)136C、146C 的化学性质___相__同___。
— 14 —
答案
— 返回 —
【解析】 2HmX 分子含 N 个中子,则同位素 X 含中子数为(N-m),由同位素 X 的原子
质量数为 A 可知,质子数为(A-N+m),则每个 2HmX 分子含有质子数为(A-N+2m),a g 2HmX
的
物
质
的
量
为
a 2m+A
g g·mol-1
=
a 2m+A
mol , 故 含 有 质 子 物 质 的 量 为 2ma+A (A - N + 2m)
— 2—
考点一 原子结构、核素、同位素 考点二 原子核外电子排布
本科有机化学 第五章 醇和醚
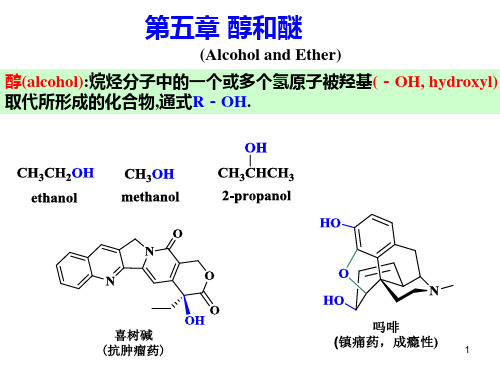
5
6
结构与化学性质
碳氧单键为极性键 (与碳卤单键类似) 亲核取代反应、消除反应
氢氧极共用电子对 碱性、亲核性 7
一元醇的化学性质
1. O-H键的断裂:酸性(acidity)
醇酸性的体现
酸性的度量 (酸解离常数)
8
9
• the acid-dissociation constants for alcohols vary according to their structures • the acidity decreases as the substitution on the alkyl group increases • substitution by electron-withdrawing halogen atoms enhances the acidity of alcohols
27
28
本反应的一个早期应用:Alcohol Breath Tester
用嘴吹气 玻璃管:内壁附着 涂有重铬酸钾和 硫酸的硅胶颗粒
气 球
29
(2)选择性氧化剂氧化: PCC(pyridinium chlorochromate)
特点:活性相对较低,故选择性强,适合由伯醇氧化制备醛和由仲 醇氧化制备酮,不影响碳碳重键
SN2
亲核试剂进攻质子 化的羟基,水离去, 形成产物
伯醇和仲醇与HCl的反应常需添加ZnCl2,以促进反应的进行 反应活性较低的原因:亲核性Cl- < Br- (如何解释?)
16
Lucas reagent (卢卡斯试剂) 浓盐酸+无水ZnCl2
活化的原因:Zn2+与羟 基配合能力较H+更强!
Lucas test:可粗略地通过醇与Lucas试剂反应的时间推测醇的 类型(伯、仲、叔醇)
第五章 第一节 硫及其化合物 第一课时 单质硫课件高一化学人教版(2019)必修第二册

2.从硫元素的价态:
-S2←氧――化―性――
0
S
―还――原―性→+S4
3.根据元素周期表:预测氧化性的强弱
O S Cl
(2)硫的化学性质
△ Fe+S====FeS
氧化性
△
2Cu+S====Cu2S
△ H2+S====H2S
还原性
点燃 S+O2======SO2
硫的氧化性较弱,与变价金属反应时,一 般生成低价态硫化物。
环节一 创设情境,了解硫元素在自然界中的存在形式
H2S
SO3
H2SO4
H2SO3
SO2
S
CaSO4∙2H2O FeS2
与铁、砷、 Na2SO4∙10H2O
汞等元素化合
CuFeS2
自然界中硫元素的存在示意图
自然界的硫单质
印尼东爪哇外南梦, 卡瓦伊真火山喷出的气体 通过火山口内的喷气孔形 成硫黄,当地很多青壮年 男子冒险去火山口采硫黄 矿谋生。这些硫矿被运到 当地工厂加工,在硫化橡 胶、漂白糖等工业步骤中 使用。
化合价
+6
SO3
H2SO4
Na2SO4
+4
SO2
H2SO3
Na2SO3
0
S
-2
H2S
Na2S
氢化物
单质
氧化物
酸
盐
物质类别
环节二:复习元素化合物的学习方法,自主探究硫的化学性质 小组讨论:根据物质类别、化合价和元素周期表推测单质硫的性质。
1.根据物质类别: 硫属于非金属元素。①可以与氧气、氢气等非金属反应 ②可以与金属反应;③可以与碱溶液反应
环节五 课堂小结
高等无机化学第五章第一节

第5章 新型无机化合物
高等无机化学
例题[5-2] 推断B4H10(n=4,m=6)的结构(成键方式)。 从s+t=n,由于t=0,则s=n=4 从m=x+s,有x=m-s=6-4=2 从m=2s-2y,y=s-m/2=4-6/2=1 styx=4012,即B2H6分子包含4个三中心二电子B-H-B键 和6个(即n+x)二中心二电子B-H键, 一个B-B键。
(*BnHn+2系列所有氢化物不能单独作为一类硼烷,在此只为便于理解而存在 ) 第5章 新型无机化合物
高等无机化学
(2)B-H共价键的成键方式总结 用styx数分析法分析成键方式: (适用于非封闭型硼烷) ① 外向B-H键,对于BnHn+m,等于B原子数n个 ② 除外向B-H键,还有 s个三中心双电子B-H-B键 y个双中心双电子B-B键 t个三中心双电子键 研究发现三中心双电子键 不存在
为缺顶的五角双锥型构型
第5章 新型无机化合物
高等无机化学
其中向外的B-H键数=n=6, 三中心双电子B-H-B键(氢桥键)s= 4, 三中心双电子键(BBB)t=0 双中心双电子B-B键 y= 5, 非外向双中心双电子B-H键x=0 styx=4050
第5章 新型无机化合物
高等无机化学
③网型硼烷 通式是BnHn+6 其骨架成键电子对数为 (2n+6)/2=n+3。
第5章 新型无机化合物
高等无机化学
3、分类:
(1)非金属原子簇合物 (2)金属原子簇合物
第5章 新型无机化合物
高等无机化学
二、非金属原子簇化学
(一)硼烷 (二)硼烷的衍生物
第5章 新型无机化合物
高等无机化学
周公度第三版结构化学第五章 多原子分子的结构和性质

R/a0
图5.2 碳原子的 sp3 杂化轨道等值线图
•杂化轨道最大值之间的夹角θ
根据杂化轨道的正交、归一条件
★两个等性杂化轨道的最大值之间的夹角θ满足:
cos 3 cos2 1 5 cos3 3 cos 0
例:VP( SO 24)=12 (6+4×0+2)=4
(2) 确定电子对的空间构型:
VP=2 直线形
:A:
:
: :: :
VP=3 VP=4 VP=5 VP=6
平面三:
:A :
:: :A:
::
(3) 确定中心原子的孤电子对数,推断分子的 空间构型:
① LP=0:分子的空间构型=电子对的空间构型
D∞h D3h Td
D4h D3h C4v Oh
CO2 , N3BF3 , SO3
CH4
Ni(CN)42PF5 IF5 SF6
• 杂化轨道满足正交性、归一性
例: i ais bi p
由归一性可得: i * id 1
ai2 bi2 1
由正交性可得: i * jd 0
i j
★根据这一基本性质,考虑杂化轨道的空间分布及 杂化前原子轨道的取向,就能写出杂化轨道中原子轨道的 组合系数。
b 0.55px 0.70py 0.45s
若不需区分 px 和 py ,只需了解杂化轨道中 s成分和 p 成分,
可按
cos 计算夹角。
对于 H2O 中的 O 原子只有 s 轨道和 p 轨道参加杂化。 设 s 成分为 α, p 成分β=1- α
则:
1cos 0
1cos104.5o 0
【创新设计】(江西版)2015届高考化学总复习 第五章 原子结构课件第1课时

解析
232Th、230Th的质量分别是232、230,A项错误;
元素的相对原子质量是由各种同位素的相对原子质量的 平均值,B项错误;同位素的物理性质不同,但化学性质 几乎相同,D项正确;化学变化是生成新物质的变化, 参加反应原子的原子核不变,而C项的原子核发生了变 化,错误。 答案 D
质子数-电荷数 ______________ 阳离子: 核外电子数 质子数+电荷数 阴离子: _______________
3.元素符号周围数字的意义
探究思考
1ቤተ መጻሕፍቲ ባይዱ填空
(1)48 22Ti 的质子数为 ________、中子数为 ________、电子数 为________、质量数为________。 + (2)27Al3 的质子数为________、中子数为________、电子 数为________、质量数为________。 (3)35Cl-的质子数为 ________、中子数为 ________、电子 数为________、质量数为________。
A.“中质和”相同的核素一定是同一元素
B.“中质差”相同的核素一定是同一元素 C.N2-P2=A×ΔZ
D.至2008年,人们发现108种元素有m种同位素,说明“
中质差”一定有m种
解析 “中质和”即质量数,质量数相同的核素不一定是同 14 一元素,例如14 C 和 6 7N, A 项错;“中质差”相同的核素不 2 14 一定是同一元素,例如1 H、12 C 和 6 7N,其“中质差”均为 0, B 项错;A×ΔZ=(N+P)×(N-P)=N2-P2,C 项对;有的 12 14 同位素其“中质差”相等,例如2 1H、 6C 和 7N,说明“ 中质 差”的数目小于同位素的数目,D 项错。
第五章原子结构与元素周期系ppt课件

1885年 巴尔默(J. J. Balmer) 上述五条谱线的波长可以用一个简单公式表示:
=B
n2 n2
4
n=3 n=4 n=5 n=6 n=7
= 656.210 nm = 486.074 nm = 434.010 nm = 410.120 nm = 397.007 nm
1890年 里德堡(J. R. Rydberg) 描画碱研讨微观粒子的运动时,不能忽略其动摇性 。 微观粒子具有波粒二象性。
粒子的德布罗依波长和半径
粒子 质量/ kg 速度/(m·s–1) 波长/ m
电 子 9×10–31
106 108
7×10–10 7×10–12
氢原子
1.6×10–
27
103 106
4×10–10 4×10–13
Bohr实际(三点假设):
①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量;〔量子化条件〕
②通常,电子处在离核最近的轨道上,能 量最低——基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态;
③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。
h E2 E1 E2 E1
5.3.2核外电子运动形状的近代描画 1.薛定谔方程
波函数 的几何图象可以用来表示微观粒 子活动的区域。
1926 年,奥地利物理学家薛定谔 〔Schodinger ) 提出用于描画核外电子运动 形状的一个动摇方程,被命名为薛定谔方程。 波函数 就是经过解薛定谔方程得到的。
薛定谔〔SchrÖdinger〕方程
〔1〕元素的最终组分称为简单原子,它们是不可分 割的微粒,在一切化学变化中均坚持其独特性质。
〔2〕同一元素的各个原子,其外形、分量等各种性 质那么各不一样。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 3、硼氢化反应
• CH3CH=CH2 +B2H6 →(CH3CH2CH2 )3B
四、硼烷的衍生物
• 1、硼烷阴离子 • (1)最简单的硼烷阴离子是BH4-,它具有四面体结构,其 主要应用是作为还原剂及H-离子的来源。它的衍生物有 [BH3CN]-, [BH(OCH3)3]-. • (2) BnHn2-(n=6-12):B10H102- B12H122- B7H72- B8H82- B9H92-其结 构具有多面体笼形结构,如B12H122-是由20个相等三角面构成 的规则二十面体,所有氢原子都是通过端梢B-H键与硼原子 结合。易发生亲电取代反应。 • 2、碳硼烷 • CH与BH-为等电子体,碳硼烷可看作CH代替BnHn2-离子中的BH -。即B H 2- →B n n n-2C2Hn • 分类:A、闭式-中性的二碳代碳硼烷,即闭式- BnC2Hn+2 (n=3-10,电子数为:2n+2); B、巢式-二碳代碳硼烷 阴离子,即巢式- BnC2Hn+3-(n=3-10,电子数为:2n+ 4); C、闭式-一碳代碳硼烷阴离子,即闭式- BnCHn+1- (n=4-11,电子数为:2n+2);
B4 H10 H 2
二、硼烷的结构和化学键 • 1、乙硼烷B2H6结构的成键要素
• 若与乙烷相似形成BH3BH3,有7 个共价单键,需14个 电子,但分子中只有12个电子。 • 在乙硼烷分子中B:2S22P1,采用SP3杂化,(1)每 个硼原子使用两个SP3杂化轨道和两个电子与氢原子形 成两个σ 键(2c-2e),两个硼原子形成了两个BH2基团, 且位于同一平面内.
•
•
•
•
2、判断M-M键存在的依据 (1)键长:若金属原子间距离和金属晶体中差不多或更少 时,可认为形成M-M键。 Mo-Mo Mo2Cl83Mo2Br83Mo2Cl93纯金属 键长/pm 238 243.9 265 273 (2)磁矩:如果多核分子的磁性比起单核的要小,那就可能 是因为形成M-M键后,电子配对的结果。 Co(CO)4末成 对电子数1 而Co2(CO)8末成对电子数0,说明分子中可能 存在Co -Co键; (3)键能:M-M键能>80KJ/mol才是簇状化合物(同 族中原子簇的M-M键能从上到下增大)
• Mn2(CO)10 Tc2(CO)10 Re2(CO)10 Fe3(CO)12 Ru3(CO)12 Os3(CO)12 104KJ/mol 180 187 82 117 130
• (4)其它:振动光谱、光电子能谱、电子能谱 • M-M键还存在如何确定键级问题,即如何确定M-M键是 单键、双键、叁键或四键?一般通过将键长、键能的实验 测定与理论素
• Lipscomb认为硼烷成键有5种类型:
• 例1:分析戊硼烷-9(B5H9)分子结构成键的情况 • 戊硼烷-9(B5H9)结构图如下: • B5H9 • • • • • (1) 价轨道数:4×5 + 1×9 = 29 5B 9H (2) 价电子数:3×5 + 1×9 = 24 5B 9H 5个 B-H 2c-2e: 2e×5 = 10e 4个 B-H-B 3c-2e: 2e×4 = 8e 1个 3c-2e: 2e×1 = 2e 2个 B-B 2c-2e:2e×2 = 4e 合计24e,成键分子轨道有12个,反键分子轨 道有12个,非键分子轨道有5个。
第五章
原子簇化合物
概述 • 1、定义:1966年F.A.Cotton提出,原子簇是“含有直 接而明显键合的两个或以上的金属原子的化合物”。 • 美国化学文摘CA的索引中提出, “原子簇化合物是含 有三个或三个以上互相键合或极大部分互相键合的金 属原子的配位化合物”。 • 1982年我国徐光宪提出,“原子簇为若干有限原子 (三个或三个以上)直接键合组成多面体或缺顶多面 体骨架为特征的分子或原子”。(包括了硼烷及杂硼 烷) • 2、特点:(1)存在M-M金属键 • (2)分子的立体结构一般都是三角多面体或欠完整的 三角多面体,骨架成键电子以离域多中心键形式存在。 (具有M-M键的两个核配合物并不算原子簇)
• 例2:分析己硼烷-10(B6H10)分子成键的情况 • (1) 价轨道数:4×6 + 1×10 = 34 6B 10H • (2) 价电子数:3×6 + 1×10 = 28 6B 10H • 6个 B-H 2c-2e: 2e×6 =12e • 4个 B-H-B 3c-2e: 2e×4 = 8e 2个 3c-2e: 2e×2 = 4e 2个 B-B 2c-2e:2e×2 = 4e • 共有价电子数为:24个,成键分子轨道 • 有12个,反键分子轨道有12个,非键分子轨道有10个。
§5-1
硼烷及其衍生物
• 一、硼烷的合成及其性质、命名
• 1、硼烷的命名 • A、硼原子在10个以内,用天干表示硼原子数;超过 10个,用数字标明; • B、分子中氢原子数用阿拉伯数字加园括号直接写在化 合物名称的后面;如B4H10丁硼烷(10) B6H12已硼烷(12) • C、用前缀表示结构类型;如B5H9戊硼烷(9) B10H14巢
• (2)每个硼原子还剩有一个价电子和两个杂化轨 道,且垂直于BH2平面,两个氢原子分布在剩下 的4个SP3杂化轨道组成的平面内,并将两个硼原 子桥联起来,(每个氢原子提供一个电子和一个 1s轨道,两个B原子提供两个SP3杂化轨道和一个 电子)形成两个B-H-B键( 3c-2e),且分别 位于BH2平面的上下方。
结构: 巢型 链式
(3)去桥式质子反应 • B10H14 + NaOH →NaB10H13 + H2O B10H14 + NaH →NaB10H13 + H2 B10H14 + N(CH3)4OH →[N(CH3)4][B10H13 ]+ H2O B10H14 + CH3MgI →B10H13MgI+ CH4 • 硼烷的酸强度规则:A、网式>巢式;B、骨架体积越 大,酸性越强。如网式: B6H12> B5H11 > B4H10 巢式: B18H22> B16H20 > B10H14 > B6H10 > B5H9 • 2、亲电取代反应 • 由于硼烷中的角顶带有较多的负电荷,所有硼烷的端 梢H原子可被亲电试剂所取代,如卤化反应。 • 如:在AlCl3催化剂存在下 B5H9 + Cl2 →1-Cl B5H8 +HCl 在无AlCl3催化剂存在下 B5H9 + Cl2 →1-Cl B5H8 + 2-Cl
• 3、多硼烷阴离子BnHn2- 和碳硼烷Bn-2C2Hn 骨架的Wade规则
• BnHn2- ①每个B原子贡献出一个价电子用于与氢形成B -H键; • ②其余2个电子用于形成多面体原子簇骨架,电子数为 2n+2(n为骨架原子数)(p195) • (1)当电子数为2n+2,骨架一定是闭合的多面体笼形 结构;如B6H62- 、B10H102- 、B12H122- 电子数符合 2n+2 B4C2H6≡(BH)4(CH)2 电子数=2*4+3 *2=14=2*6+2 ,B10C2H12≡(BH)10(CH)2 电子数= 2*10+3*2=26=2*12+2 ,B9C2H11≡(BH)9(CH)2 电子数=2*9+3*2=24=2*11+2
3、金属碳硼烷
• B9C2H12- B9C2H112- 夹心式化合物 [(B9C2H11)2M]n半心式化合物[(B9C2H11)Re(CO)3]-
§5-2金属原子簇
5.2.1 概述
• 1、金属-金属键的形成条件 • (1)金属原子处于低氧化态(羰基配合物中,金属原子常 呈0或-1价,低价过渡金属 卤化物 的簇状化合物中,金属 原子呈+2,+3价。) • (2)形成金属簇状化合物是第二、三过渡系元素的特点 。 如ⅤB: Nb Ta形成M6X122+,而V不能;ⅥB : Mo W形成 M2(CH3COO)4,而Cr不能;ⅦB :Tc Re形成M2X82-,而Mn不能. • (3)适宜配体。低价卤化物,硫、硒、碲化物只有前面几 族形成。 • 解释:(1)M-M键靠d轨道重叠,高氧化态, d轨道收缩, 不利于重叠;(2) M-M键靠d轨道重叠,4d、5d空间伸展 比3d大,有利于重叠;(3)金属价层电子太多,导致电子 占据反键轨道,妨碍M-M键的形成。
• 5.2.3卤素金属簇状化合物
• 1、双原子簇状化合物[Re2Cl8]2-, [Mo2Cl8]2- , Re2(RCO2)4X2 • (1) [Re2Cl8]2-的合成: 2Re3Cl9+6Et2NH2Cl→3(Et2NH2)2Re2Cl8 • (2) [Re2Cl8]2-的结构特点:1964年Cotton测定了其结构。 A、金属簇合物中Re-Re键距为224pm(金属中Re- Re键距为270pm); • B、重叠构型,上下氯原子对齐成四方柱形。Cl-Cl键距 为332pm小于范德华半径(约340-360pm)
式-癸硼烷(14)
• D、硼烷离子命名时,在其母体后括弧中指明离子所带 的电荷。如:B12H122-闭式-十二硼烷阴离子(2-)
2、硼烷的制备
●实验室里常用四氢硼钠或氟化硼-乙醚络合物在四氢呋喃中进行反应来制备
3NaBH4 + 4BF3.O(C2H5)2
THF
3NaBF4 + 2B2H6 + 4(C2H5)2O
三、硼烷的反应
• 1、与Lewis碱反应 • (1)碱裂解(对称和非对称裂解)反应 • 较大的Lewis碱易发生均裂即对称裂解 B2H6 + 2L → 2LBH3
B2H6 + 2NaH → 2NaBH4 • B2H6 + 2(CH3)2O → 2(CH3)2OBH3 B4H10 + 2N(CH3)3 → (CH3)3NBH3 + (CH3)3NB3H7 • B5H11 + 2CO → BH3CO + B4H8CO
