有机化学羧酸
有机化学羧酸ppt课件

•羧酸概述与结构特点•羧酸制备方法及反应机理•羧酸衍生物及其性质研究•羧酸及其衍生物在有机合成中应用目•实验部分:羧酸和它们衍生物性质实验•课程总结与拓展延伸录01羧酸概述与结构特点羧酸定义及分类定义分类结构特点与命名规则结构特点命名规则羧酸的命名通常以烃基为基础,将“酸”字加在烃基名称之后。
例如,甲酸、乙酸、苯甲酸等。
物理性质与化学性质物理性质化学性质02羧酸制备方法及反应机理伯醇氧化醛氧化烯烃臭氧化030201氧化法制备羧酸羧化反应及其机理探讨卤代烃的羧化烯烃的羧化芳烃的羧化其他制备方法简介酯的水解酯在酸性或碱性条件下,可发生水解反应生成羧酸和醇。
酰胺的水解酰胺在酸性或碱性条件下,可发生水解反应生成羧酸和胺。
腈的水解腈在酸性条件下,可发生水解反应生成羧酸和氨。
03羧酸衍生物及其性质研究酯酯是由羧酸与醇反应形成的一类衍生物,具有广泛的生物活性和化学应用。
酯类化合物在自然界中广泛存在,如油脂、蜡等。
酰卤酰卤是一类由羧酸与卤素反应形成的衍生物,具有较强的反应活性。
常见的酰卤有酰氯、酰溴等。
酰胺酰胺是由羧酸与胺反应形成的一类衍生物,具有良好的稳定性和广泛的应用。
酰胺类化合物在生物医药、农药等领域有重要应用。
酰卤、酯、酰胺等衍生物介绍各衍生物间相互转化关系探讨酯向酰胺的转化酰卤向酯的转化酯可以通过还原反应生成相应的酰胺。
这一转化在有机合成中具有一定的应用价值。
酰胺向羧酸的转化衍生物在合成中应用实例分析酰卤在合成中的应用01酯在合成中的应用02酰胺在合成中的应用0304羧酸及其衍生物在有机合成中应用酯化反应在有机合成中作用酯化反应的定义和机理01酯化反应在有机合成中的应用02酯化反应的实例031 2 3酰胺化反应的定义和机理酰胺化反应在有机合成中的应用酰胺化反应的实例酰胺化反应在有机合成中作用其他类型反应在有机合成中应用羧酸的还原反应羧酸的脱羧反应羧酸及其衍生物的其他反应05实验部分:羧酸和它们衍生物性质实验实验目的和原理步骤一步骤二步骤三步骤四注意事项一注意事项二清洗实验器具,整理实验报告注意事项三注意实验过程中的温度变化,避免发生危险注意事项四实验结束后要及时清洗实验器具,保持实验室整洁结果分析一通过红外光谱、核磁共振等手段对合成产物进结果分析二对比不同羧酸衍生物的物理和化学性质,探究其结果分析三讨论一讨论二讨论三实验结果分析和讨论06课程总结与拓展延伸羧酸分子中的羰基和羟基的结构特点,以及它们对羧酸物理和化学性质的影响。
有机化学_羧酸
的存在,氧原子上的负电荷则均匀地分散在两个原子
上,因而稳定容易生成。
O
1 2
RC
O
1 2
R C =O
O
O
R C= O
1
O2 RC 1
O2
1、电子效应对酸性的影响
1)诱导效应
1°吸电子诱导效应使酸性增强。
FCH2COOH > ClCH2COOH > BrCH2COOH >
ICH2COOH > CH3COOH
R CHCOOH + X OH
R C O + HCN
R'
R OH
C
R'
CN
水解 R OH C
R' COOH
3)列佛尔曼斯基(Reformatsky)反应 制备β-羟基
酸的方法。
CH2COOC2H5 + Zn Et2O CH2COOC2H5 R2C=O R2 C CH2COOC2H5
X
ZnX
OZnX
R2 C CH2COOC2H5 H2O / H OZnX
羧酸的来源和制备
来源: 羧酸广泛存在与自然界,常见的羧酸几乎都 有俗名。自然界的羧酸大都以酯的形式存在于油、脂、 蜡中。油、脂、蜡水解后可以得到多种羧酸的混合物。
制法: 一、氧化法 二、羧化法 三、水解法
(一)烃的氧化——有α-H的芳烃才能氧化为苯甲酸
CH3CH2CH2CH3 + O2
醋酸钴 90~100℃
不溶于水的羧酸既溶于NaOH也溶于NaHCO3, 不溶于水的酚能溶于NaOH不溶于NaHCO3, 不溶于水的醇既不溶于NaOH也溶于NaHCO3。
二、羧基上的羟基(OH)的取代反应
有机化学 羧酸

学习要求 学习内容
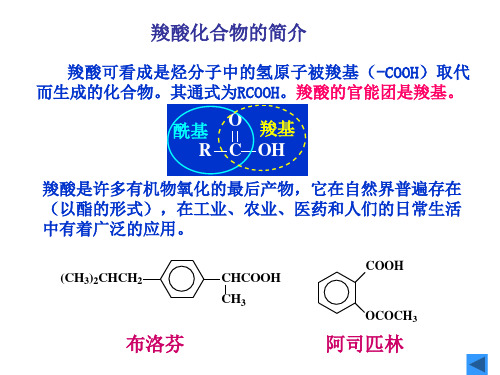
酸
羧酸化合物的简介 羧酸的分类、 羧酸的分类、命名和结构 羧酸的物理性质和光谱性质 羧酸的化学性质 羧酸的来源和 来源和制备 羧酸的来源和制备 重要的一元羧酸 二元羧酸 取代酸 酸碱理论 化学性质一览表
1
学习要求
1. 掌握羧基的结构和羧酸的化学性质 2. 掌握诱导效应和共轭效应对羧酸酸性的影响 3. 掌握羧酸的制备方法 4、 了解重要的羧酸的主要用途
9
羧酸的物理性质
O R C= O H O H H H R C= O H O O O H O H
=
C R
羧酸是极性分子,能与水形成氢键, 羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑ 在水中的溶解度↓ M↑, 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,> 的羧酸不溶于水。 ,>C 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。 物态: 有刺激性酸味的液体,溶于水。 物态:C1~C3 有刺激性酸味的液体,溶于水。 C4~C9 有酸腐臭味的油状液体(丁酸为脚臭味),难溶于水。 有酸腐臭味的油状液体(丁酸为脚臭味) 难溶于水。 腊状固体,无气味。 > C9 腊状固体,无气味。 相同的醇 b.p: 羧酸 > M 相同的醇。 : m.p: 随M↑呈锯齿形上升。偶数碳原子羧酸的 >相邻两 : 呈锯齿形上升。 羧酸的m.p> 呈锯齿形上升 偶数碳原子羧酸的 个同系物的m.p。 。 个同系物的
COOH G
COOH
G= -NO2 -OH pka 2.21 2.98
(4.20)
17
共轭碱分子内形成氢键,降低了共轭碱的碱性,增强了对 共轭碱分子内形成氢键,降低了共轭碱的碱性, 应的共轭酸的酸性。 应的共轭酸的酸性。
大学有机化学第十三章羧酸

CH3-C CH-COOH CH3
4
3
2
1
3-甲基-2-丁烯酸
取代酸
CH
CHCOOH
3-苯基丙烯酸(肉桂酸) ( -苯基丙烯酸)
◆ 羧酸的物理性质
O R C
=
O
H O
H H H
R C
=
O
H O O
O H
O H
=
C R
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。
O CH3C OH + NH3
CH3COOH + NH3
O
CH3C O.NH4 200℃CH C NH 3 2
CH3COONH4 Δ CH3CONH2 + H2O
-+
O
二元酸的二铵盐受热则发生分子内脱水兼脱氨,
生成五元或六元环状酰亚胺。
C H2C O O NH 4 C H2C O O NH 4
O
300℃
回流
ClCH2COOH
Cl2 , P
一氯乙酸
Cl2CHCOOH
回流
Cl2 , P Cl3CCOOH
二氯乙酸
回流
三氯乙酸
α-卤代酸是一种重要的取代酸,它可以发生与卤代烃相 似的亲核取代或消去反应,从而转变成其它的取代酸。
如:
CH3COOH Br2 ,P BrCH2COOH NaCN NCCH2COOH α-氰基乙酸
b.p: 羧酸 > M 相同的醇。
IR谱:
OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶剂的稀溶液)。 C=O伸缩振动——脂肪族羧酸:1700~1725cm-1 芳香族羧酸:1680~1700cm-1
有机化学 第11章 羧酸

C O C
2.两个羧基相隔2~3个碳原子的二元酸,不需要任 何脱水剂,加热就能脱水生成五元或六元环酐。
O H H C C C OH C OH O 150℃ H H C C O C O C O + H2 O
(三)酯的生成
酯化是可逆反应。为了提高酯的产率,通常采用加 过量的酸或醇。
§11-1 羧酸的分类和命名法
分子中含有羧基 一、分类
按照与羧基所连的烃基: (—COOH)的化合物。 脂肪酸和芳香酸。 通式:RCOOH和 按照分子中所含羧基数目: ArCOOH表示。
一元羧酸和多元羧酸。
二、命名
(一)脂肪酸
CH3 CH3CHCH2COOH 3-甲基丁酸 β-甲基丁酸
_ H3 O+
CH3(CH2)3CHCHO CH2CH3
KMnO4,OHH 2O
CH3(CH2)3CHCOO CH2CH3
CH3(CH2)3CHCOOH CH2CH3 (78%)
二、腈水解
HOCH2CH2Cl NaCN HOCH2CH2CN (1)OH-,H2O (2)H3O
+
HOCH2CH2COOH
α-C有强吸电子基时容易脱羧,二元羧酸也较容易 发生脱羧反应。芳基作为拉电子基,使芳酸的脱羧 比脂肪酸容易。
COOH O2N NO2 NO2 ~100℃ H2O O2N NO2 NO2 + CO2
五、烃基上的反应
(一)α-H卤化 羧基与羰基类似,能使α-H活化。但羧基的致活作 用比羰基小得多,必须在碘、硫或红磷等催化剂存 在下α-H才能被卤原子取代。
有机化学基础知识点羧酸的性质和反应

有机化学基础知识点羧酸的性质和反应羧酸是有机化学中的一类重要化合物,其具有独特的性质和反应。
本文将对羧酸的性质和反应进行分析,以帮助读者更好地理解有机化学中羧酸的基础知识点。
一、羧酸的基本结构和性质羧酸的化学式通常表示为R-COOH,其中R表示有机基团。
羧酸中的碳原子与一个羧基(-COOH)和一个有机基团R连接。
羧酸中的羧基是由一个碳氧化合物和一个羟基组成的。
羧酸具有一些基本的性质。
首先,羧酸是一类具有酸性的化合物。
其羧基上的氧原子带有负电荷,可以释放出质子(H+),从而使羧酸溶液具有酸性。
其次,羧酸中的羧基中的羟基(-OH)是极性的,使羧酸具有较高的溶解度。
此外,羧酸还可以形成氢键和其他分子进行相互作用,影响其物理性质。
二、羧酸的反应1. 羧酸与碱反应羧酸与碱反应会生成相应的盐和水。
这是因为碱可以中和羧酸中的质子,使羧酸中的羧基离子化,并与碱中的阳离子形成盐。
反应方程式如下所示:RCOOH + NaOH → RCOONa + H2O2. 羧酸与醇反应羧酸与醇反应会发生酯化反应,生成酯和水。
这是一种酸催化的反应,羧酸中的羧基与醇中的羟基发生缩合反应,并释放出水分子。
反应方程式如下所示:RCOOH + R'OH → RCOOR' + H2O3. 羧酸的脱羧反应羧酸的脱羧反应是指羧酸分子中的羧基失去碳原子,生成相应的酮或醛。
这是一种重要的羧酸反应,在实际有机合成中被广泛应用。
脱羧反应可以通过加热、用酸或碱催化来促进。
反应方程式如下所示:RCOOH → R'COR + CO24. 羧酸的酰氯化反应羧酸与反应的卤化酰可发生酰氯化反应,生成相应酰氯和HCl。
酰氯在有机合成中是一种重要的中间体,可以进一步参与其他反应。
反应方程式如下所示:RCOOH + SOCl2 → RCOCl + SO2 + HCl5. 羧酸与亲电试剂的反应羧酸可以与亲电试剂发生的有机反应,例如与醇、胺、卤代烷等反应,生成相应的酯、酰胺或酰化产物。
有机化学:第12章 羧酸

RCOONa + HCl RCOOH + NaCl
应用:用于羧酸的鉴别,分离,提纯。
另外,C12~18的RCOONa是肥皂的主要成份。
RCOOH > H2CO3 > C6H5OH > H2O >
pka: 4 ~ 5
6.38
10 15.74
RCH2OH > RNH2
16 ~ 19
~ 34
例如: 用化学方法鉴别(酸、酚、醇)
共轭效应的影响受到阻碍。
吸电子共轭效应
(-C )只能传递
到邻、对位。
• 卤素原子具有-I和+C效应,-I > +C。
COOH
COOH Cl
COOH
Cl
pKa: 4.2
2.92
3.82
• 羟基具有-I和+C效应,-I < +C。
COOH COOH OH
COOH OH
pKa: 4.2
2.98
4.08
COOH
O R C CH3
OH R CH CH3
X2 NaOH
RCOOH + CHX3
O CH3(CH2)4CCH3 I2/NaOH CH3(CH2)4COOH
4、由腈的水解制备:制备比原料多一个碳的羧酸
R CN
H
H2O,
OH
H
R COOH
H2O
CH3(CH2)4CN H2O/H+ CH3(CH2)4COOH
O CH2CH3
O
HOCCH2CHCH2CH2CHCH2COH
CH3
3–甲基–6–乙基辛二酸
(3-ethyl-6-methyloctanedioic acid)
羧酸的名词解释

羧酸的名词解释羧酸是一类有机化合物,其化学结构中含有羧基(-COOH)。
羧基由一个碳原子与一个氧原子以双键相连,并与一个氢原子以单键相连。
这个羧基使得羧酸具有许多特殊的化学性质和用途。
1. 羧酸的结构和命名羧基与一个碳原子及其它原子或基团相连形成的化合物被称为羧酸。
羧酸分子中的羧基可以与不同的基团(如烷基、芳基等)相连,从而得到不同的羧酸。
常见的羧酸包括甲酸、乙酸、苯甲酸等。
羧基与烷基相连形成羧酸的命名通常遵循“羧基前缀+烷基名+酸”这样的命名规则,例如,甲酸(HCOOH)是由甲基(-CH3)与羧基(-COOH)相连而成的羧酸。
2. 羧酸的性质羧酸的羧基是一个极性官能团,因此导致羧酸具有一些特殊的化学性质。
首先,羧酸具有明显的酸性。
羧酸的羧基可以给出氢离子,形成H+离子,因此是酸性物质。
例如,乙酸(CH3COOH)在水中可以与水反应,给出H+离子和乙酸根离子(CH3COO-),呈现酸性溶液。
其次,羧酸可与含有氢的化合物进行酯化反应,形成酯。
这是因为羧基中的羧碳向氧原子提供了部分正电荷,使得羧酸对亲核试剂更具亲和力。
酯广泛应用于食品、制药和化妆品等领域。
除此之外,羧酸还可发生其他一些重要的化学反应,如与胺反应形成酰胺、与醇反应生成酯等。
3. 羧酸的用途羧酸广泛应用于生活和工业生产中。
首先,羧酸常用作精细化工产品的原料。
例如,乙酸被广泛用于制作醋酸纤维和塑料,甲酸用于制作染料和鞣制皮革等。
其次,羧酸也被应用于医药领域。
羧酸衍生物具有良好的生物相容性和生物活性,因此用作药物载体、肿瘤治疗药物等具有巨大的潜力。
此外,羧酸还在食品和化妆品工业中得到广泛应用。
例如,羧酸可用作食品防腐剂,保持食品的新鲜和延长保质期;在化妆品中,羧酸可以作为护肤剂和抗氧化剂。
综上所述,羧酸是一类重要的有机化合物,具有多种特殊的化学性质和广泛的应用。
羧酸的命名以及其与其他化合物的反应和用途,使得羧酸成为化学研究和工业生产中不可或缺的一部分。
有机化学 第十二章 羧酸

王鹏
山东科技大学 化学与环境工程学院
12.3 羧酸的物理和波谱性质
二、1H-NMR:
-COOH: δ范围 10~14 邻近羧基的碳上的氢移向低场区, δ约2~2.6 O CH2 C O H
δ: 2~3
10~13
如p282 图13-2异丁酸的核磁图 羧酸核磁的另一特点是活性氢交换后低场区信号 减弱或消失
王鹏
12.4 羧酸的化学性质
酯化反应的亲核取代机理:
O R C OH + H
+
快
+OH
慢
OH R
快
R
快
C
OH
.. R'O H ..
C
+.. O R'
OH H O R C OR'
OH
快
+ OH OR'
H2O 快 慢
R
C
R
C
OR'
H
+
+ OH2
快
叔醇更倾向于酸碱中和机理,即酸失去H+,叔醇 失去OH-,剩余部分结合成酯
溶解性:
低级脂肪酸是极性分子,易溶于水(因为易与水成分子间 氢键)。随着碳原子数增加,水溶性逐渐降低
熔沸点:
羧酸的熔沸点比分子量相近的其他化合物高许多
王鹏
山东科技大学 化学与环境工程学院
12.3 羧酸的物理和波谱性质
一、IR:
O-H:3560~3500(单体)3000~2500(二聚) C=O:1720,C-O:1250 羧酸的红外特征是强而宽的羧基峰和羰基峰
王鹏
山东科技大学 化学与环境工程学院
12.2 羧酸的分类和命名
有机化学第十二章 羧酸

2020/1/31
C H 2C O O H
C H 2C O O H C H 3(C H 2)7C H =H C (C H 2)7C O O H
α -萘基乙酸 β -萘基乙酸 9-十八碳烯酸
也可以用△表示双键的位次,把双键碳 原子的位次写在△的右上角。例如 △9-十八 碳2、烯俗酸名法:根据来源命名
由于P-Π 共轭的结果,使得C=O双键与 C-OH单键的键长平均化:
羧基λ C=O 0.125nm 醛酮:λ C=O 0.122nm λ C-O 0.131nm 醇 :λ C-O 0.143nm
2020/1/31
醛 酮 中CO 键 长 0.122nm
醇 中 COH 键 长 0.143nm
O 0.1245nm HCOH0.1312nm
§12-2 羧酸的物理性质
一、物理性质 强调:
1、沸点:由于羧酸是极性化合物,它的 沸点比相应的醇高
甲酸(46):100.7
乙醇(46): 78.5
乙酸(60):bp. 118 丙醇(60): 97
2020/1/31
2、熔点:从丁酸开始,羧酸的熔点随分子 量的增大呈交替上升,一般偶数碳原子比相 邻的奇数的酸的熔点高,原因P3。例如
即HCOOH > 1°RCOOH > 2°RCOOH > 3°RCOOH 2.酰卤的生成 被卤素所取代生成酰卤
羧酸与PX3、PX5、SOCl2作用则生成酰卤
2020/1/31
(1) 与PX3作用
R C O O H+P X 3
R C O X+H 3 P O 320 D e 0 c .
此法适用于:低沸点的酰卤的制备。例如
(2)除去反应生成的水。可以用分水 器或202加0/1/31入浓硫酸吸水;
有机化学之羧酸

RCOONa + H2O
RCOONa + CO2 + H2O H+ 用于区别酸和其它化合物 RCOOH
此性质可用于醇、酚、酸的鉴别和分离: 1.
不溶于水的羧酸既溶于NaOH也溶于NaHCO3,
2.
3.
不溶于水的酚能溶于NaOH不溶于NaHCO3,
不溶于水的醇既不溶于NaOH也不溶于NaHCO3。
羧酸酸性的影响因素: 1. 电子效应对酸性的影响 1)诱导效应
CH2OH
4. -H的卤代反应 (赫尔- 乌尔哈-泽林斯基反应) -H活性:羧酸小于醛酮。 PCl3、PBr3 或红磷(P)等催化。 反应机理是卤化磷与羧酸作用的酰卤( -H活泼),
CH3CH2CH2COOH + Br2 CH3CH2COOH
Br2 / P
催化量 PBr3
CH3CH2CHCOOH Br
CH3CHCOOH
Br 芳香羧酸环的取代:羧基属于间位定位基
5. 羧酸的脱羧反应(含有β羰基的羧酸)
O R C CH2COOH
R C O CH2 C O O -CO2
O R C CH3 + CO2
R C CH2 OH R C CH3 O
H 形成分子内氢键
通常-碳上连有吸电子基的羧酸,加热容易脱羧。
b 间位取代基使其酸性增强。
c 对位上是第一类定位基时,酸性减弱;是第二类定位基时,酸性增 强。
芳香羧酸
COOH HCOOH (3.77) (4.20)
CH3COOH(4.75)
CH3CH2COOH(4.81)
取代芳香羧酸
COOH NO2 COOH 2.21 COOH OH OH 2.98 4.08 OH 4.57 3.49 COOH NO2 COOH COOH
有机化学羧酸H

氨
PhCO2H + H2NPh
铵盐
乙酰胺
PhCONHPh + H2O
苯胺
nH2N(CH2)6NH2 260-265C
苯甲酰苯胺
O O C(CH2)4CNH(CH2)6NH
nHO2C(CH2)4CO2H
n
己二酸
聚酰胺/ 尼龙-66
3、脱羧反应
羧酸分子失去羧基放出CO2的反应称为脱羧反
应。一元羧酸一般不易直接脱羧,但当其α-碳原
亲核加成
R C OH+ R'O
R C H2O
OH
-H2O
-H+
R C R'O O
OR' 消除
酯
在少数情况下,如叔醇的酯化,是按烷氧断裂的
方式进行的,为碳正离子历程(SN1)。
H+ R3C OH R3C OH2 R3C+ + H2O
碳正离子
R O C OH R3C
+
R O C OCR3 H
-H+
R O C OCR3
< C
D
CCH2CO2H
、 CH2 CHCH2CO2H
、 CH3(CH2)2CO2H
CO2H
6、 A 7、
Cl
NO2 、 NO2
>
B
OH C C-C O
>
、
C
>
Cl
D
OH C C-C O
A
>
B
2、羟基被取代的反应
2.1 成酯反应
在酸的催化下,羧酸与醇作用生成酯的反应称
为酯化反应。常用的酸有硫酸、苯磺酸、磷酸等。
O O
有机化学第9章 羧酸

芳香酸: 较易
COONa
Cu, △
喹啉
NO2
COONa NO2
△
NO2
NO2
H2O NO2 NO2
(七) 二元羧酸特有反应
乙二酸、丙二酸——脱羧
丁二酸、戊二酸——分子内失水,酸酐
己二酸、庚二酸——失水、脱羧 ,环酮
α-H的取代反应
H O C C O
加氢还原
H
酸性 亲核取代 脱羧反应
四.羧酸的来源和制备 (一)氧化法 1.烃氧化
沸点比较
乙酸 丙醇 丁烷 b.p./℃ 118 97 0.5
O R C O H O H O C R
双分子缔合的二聚体
High B.P
O
OH O
bp (1 atm)
31°C
80°C
OH 99°C 141°C
hydrogen bonding
Dimers
O CH —— Soluble in Water
种类
FCH2COOH
ClCH2COOH
BrCH2COOH
数目 强
Cl3COOH
Cl2CHCOOH
ClCH2COOH
ICH2COOH
CH3CH2COOH
弱
CH3COOH
远近
CH3CH2CHClCOOH
CH3CHClCH2COOH
CH2ClCH2CH2COOH
强
CH3CH2CH2COOH
弱
(三)羧基上羟基的取代反应
C O H
醇中C-O单键键长为1.43Å
O H C O
O H C O
-
1.27Å
α-H的取代反应
H O C C O
加氢还原
有机化学第十二章羧酸

——区别羧酸与苯酚; 分离提纯; 制备羧酸盐
(洗涤、萃取、蒸馏)
⑵ ▲取代基对酸性的影响 羧酸的酸性取决于羧基中H+ 离解的难易。
RCOOH →RCOO- + H+ H+离解的难易 -COOH 的电子云密度 -COO – 的稳定性
例:Y-CH2COOH 中
Y pKa CH3 4.87 H 4.76 CH=CH2 4.35 I 3.18 Br 2.94 Cl 2.86 F 2.57
α-C上连有强吸电基的羧酸受热易脱羧
例:-COOH , -CN ,-NO2 ,-Ar ,C=O, –CX3 …
CCl3COOH
O CH3CCH2COOH
O2 N COOH NO2 NO2
100 ~ 150 °C
CHCl3 + CO2
O CH3CCH3 + CO2
O2 N NO2 NO2
4、还 原 成 醇 羧酸较难还原 ♣ 特殊的还原剂:LiAlH4 , (BH3)2
COOH CH2 COOH
例:
CH3CH2 CHCOOH Br KOH/C2H5OH
CH3CH
CHCOOH
2- 丁 酸 烯 β (α , 不 饱和 酸 羧 )
6、二元酸的特性 ⑴ 二元酸的酸性 比同碳数的一元酸强;
pKa1 < pKa2 (电子效应、场效应、氢键)
例:CH3CH2COOH
HOOCCH2COOH pKa2 = 5.70 +I效应;氢键
–I:
+
NR3 > NO2 > SO2R > CN > SO2Ar >COOH > F> Cl > Br > I >OAr > COOR > OR > COR > SH > OH >
有机化学 21 第十四章 羧酸

+
(CH3)3CCH2COOH + CHBr3
(2) 腈水解
由腈水解是合成羧酸的重要方法之一.
RX + NaCN RCN
H2O/H+orOH-
RCOOH + NH3
增长碳链的方法之一,RCOOH比RX多一个碳!
例: CH2CN
苯乙腈
+ H 2O
O R-C-OH
H
+
+ OH
OH R-C-OH
+
R-C-OH
R'OH
OH R-C-OH OH R'
+
OH R-C-OH2 O R'
+
-H2O
OH R-C + O R'
+
OH
R-C O R'
-H
+
O R-C-OR'
这个机理可以概括为:酰氧断裂.即:
O R-C-O-H H-O-R'
叔醇的酯化反应经实验证实是按照烷氧断裂的方式进 行的:
H2SO4
CH2COOH
苯乙酸
+ NH3
CH2=CHCN + H2O
丙烯腈
2NaCN
H2SO4
CH2=CHCOOH + NH3
丙烯酸
H2O/H+orOH-
Br(CH2)3Br
1,3-二溴丙烷
NC(CH2)3CN
戊二腈
HOOC(CH2)3COOH
戊二酸
(3) Grignard试剂与 2作用 试剂与CO 试剂与
H3C COOH H3C COOH H3C
羧酸_精品文档

羧酸简介羧酸是一类化合物,其分子结构中包含一个或多个羧基(—COOH)。
它们是有机化学中的重要物质,被广泛应用于多个领域,如化学、医药、农业等。
本文将介绍羧酸的定义、结构、性质以及一些常见的羧酸及其应用。
定义和结构羧酸由一个羧基(—COOH)和一个或多个有机基团组成。
羧基是由一个碳原子和一个氧原子组成的功能团,被称为羧酸根(—COO^-)或羧离子。
羧酸的通式一般表示为R—COOH,其中R代表有机基团。
羧酸根可以通过去质子化羧酸形成。
去质子化是指在水溶液中羧酸根离子中的一个质子被取走的过程,形成无电荷的羧酸根。
羧酸根离子的带负电荷的氧原子与氢原子结合,形成羧酸分子中的羧基。
羧酸在空气中的化学结构通常是弯曲的,由于羧基螺旋构象的限制,使得羧基无法与羰基平面共面。
性质羧酸具有一些特殊的性质,下面列举了一些常见的性质:1.酸性:羧酸中的羧基可以释放质子(H^+),使其具有酸性。
不同的羧酸酸度不同,取决于羧基中的有机基团的电子效应。
2.水溶性:羧酸中的羧基可以与水分子发生氢键作用,因此大多数羧酸具有良好的水溶性。
3.反应性:羧酸可以发生多种反应,例如与醇发生酯化反应、与胺发生酰胺形成反应等。
这些反应使得羧酸在有机合成中具有广泛的应用。
常见的羧酸及其应用以下是一些常见的羧酸及其在不同领域中的应用:1.乙酸(醋酸):乙酸是最简单的羧酸,由于其良好的水溶性和低毒性,广泛应用于食品工业和制药工业中。
2.氨基乙酸(甘氨酸):甘氨酸是一种重要的氨基酸,在生物学中起着重要的作用,如合成蛋白质和调节代谢等。
3.氟乙酸:氟乙酸是一种强酸,常用于有机合成反应中作为催化剂和酸催化剂。
4.柠檬酸:柠檬酸是一种常见的酸味剂,广泛应用于食品和饮料工业中。
5.沙拉酸:沙拉酸是一种混合酸,常用于电镀工业中作为金属表面处理的蚀刻剂。
结论羧酸作为有机化学中的重要物质,具有丰富的结构和性质。
它们在化学、医药、农业等领域中扮演着重要的角色,并具有广泛的应用。
有机化学羧酸H

A
CO2H
<
OH 、
B
CO2H
<
C
CO2H 、
<
D
CO2H
3、
、 OH
OH
A
>
B
>
C
>
D
CH3(CH2)2CO2H 4、
、 CH2CH2CH2CO2H 、 CH3CHCH2CO2H 、 CH3CH2CHCO2H Cl Cl Cl
A 5、CH A
CO2H
<
B >
CO2H 、 NO2
< B
C >
CO2H 、
CH(CH2)7CH3 CH(CH2)7CO2H CH2CH=CH(CH2)4CH3 CH=CH(CH2)7CO2H
俗 名
草酸 缩苹果酸 琥珀酸 马来酸 富马酸 油酸 亚油酸
系统命名
乙二酸 丙二酸 丁二酸 顺-丁烯二酸 反-丁烯二酸 9-十八碳烯酸 9,12-十八碳二烯酸
2、系统命名法 选含有羧基的最长碳链为主链,根据主链的碳
C=O:1725~1700cm-1
C-O:~1250cm-1 2、核磁共振谱 -COOH (δ10.5~12) RCH2COOH (δ 2~2.7 )
三、化学性质
脱羧反应 羟基被取代
O R C H C O H
的反应
-H的 活性
酸性
羧酸和羧酸根的结构
sp2 O R C O H -H
+
O R C OR C
二、 命名 1、根据酸的来源命名(多用俗名) 品 名
HCO2H CH3CO2H CH3CH2CO2H CH3(CH2)2CO2H
俗 名
有机化学——羧酸

酯化和酯水解反应历程
+ O
R-C-OH
H-O18-R' -H2O H+
O R-C-O18-R'
O
H+
O+H R'-O:-H
R-C-OH
R-C-OH
OH
R-C-O-H H-O+-R'
O
- H+
R-C-O-R'
OH
-H2O
R-C+-O-R'
OH R-C-O+H2
O-R'
②还原反应(比羧酸易还原)
酰卤的还原:
+ CH3-CO-CH2-C-O-C2H5 C2H5OH
乙酰乙酸乙酯 O
其历程类似于羟醛缩合反应。P232
Ⅲ、取代酸:
羧酸分子中烃基上的H原子被其它原子 或基团取代后的产物,如卤代酸、羟基酸、 羰基酸等。含多个官能团,称复合官能团化 合物。
R-CH-COOH R-CH-COOH R-C-COOH R-CH-COOH
己内酰胺
CH3 H-C N
O
CH3
N,N-二甲基甲酰胺 (DMF)
2、化学性质
①水解、醇解和氨解反应(活性:酰卤>酸酐>酯)
O
R-C-Z +
H-O-H H-O-R'
O
R-C-OH + H-Z
O
R-C-OR' + H-Z
O
H-NH2
R-C-NH2 + H-Z
Z = -X、 -O-CO-R’、 -O-R’
(4)羧酸的还原反应
羧基是有机物中碳的最高氧化态,用催 化氢化或金属加酸方法都不能将羧基还 原,但用氢化铝锂可将羧基还原。
有机化学课件羧酸

3)、单分子酰氧断裂—酰基碳正离子历程
酰基碳正离子
2.成酰卤
常用卤化剂:PCl3 PCl5 SOCl2
3.形成酰胺:羧酸与氨作有生成铵盐,铵盐加热失水生成酰胺。
4 . 成酸酐
羧酸加热失水。脱水剂:醋酸酐或P2O5等。 对于能形成五六元环的二元羧酸加热后则易失水成酐沸点高的酸酐,一般用乙酐为脱水剂进行制备: 混酐通常由酰氯与羧酸钠作用制得:
氧化法 1o醇、醛和芳烃的氧化
烯烃、炔烃的氧化断裂
二、腈的水解
主要用于制备其它方法难于制备的羧酸。
甲基酮的卤仿反应
三、格氏试剂与CO2作用
格氏试剂与CO2进行亲核加成,然后水解,得到比原试剂多一个碳原子的羧酸
多数情况下腈的水解与格式试剂合成两种方法可以互换,但在有些情况下就不可互换了。
四、油脂的水解
酯化反应的最大特点是反应的可逆性,为提高转化率,通常采取的措施是: 1、增加某一原料的投料量; 2、不断移走反应的的生成物(除去水或移走反 应生成的酯)
酯化反应历程:
双分子酰氧断裂——加成~消除反应历程 ν=k[CH3COOH][H+]
单分子烷氧断裂——碳正离子历程 烷氧断裂 叔碳正离子
第一节 羧酸的命名、物理性质
系统命名法
脂肪族羧酸:选含羧基的最长连续碳链为主链,从羧基碳原子开始编号,根据主链上碳原子的数目称为某酸,以此作为母体,然后在母体名称前面加上取代基的名称和位置。
2)含碳环的羧酸:将碳环作为取代基命名。
B. 羧基与侧链相连:母体为脂肪酸 A. 母体为芳烃(或脂环烃)名称+甲酸.
01
02
03
2、α-羟基腈的水解
Reformatsky反应
二、化学反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
腈的碱催化水解机理
RC N OH
RC O
加成
H OH RC N
HO
OH H
NH
OH R C NH2
O
R C NH
O H OH
OH 加成
R C NH2 O
消除
O R C OH + NH2
O R C O + NH3
*有机锂试剂和CO2的反应
RLi + CO2
RCOOLi H2O RCOOH
RLi
R
1. 氧化法 2. Grignard试剂 + CO2 3. 腈类化合物的水解
* 有机锂试剂的羧化 4. 丙二酸酯合成法(见羧酸衍生物) 5. 酚酸的特殊制法 (见取代酸)
1. 氧化法
O RCH
R
H
CC
H
R
R CH2OH O
R C CH3
[O]
O
R C OH
➢ 用什么氧化剂? ➢ 氧化剂的选择性?
2. Grignard试剂 + CO2
COOH COOH
O O + H2O
O O
O + H2O O
正常反应: 形成环状酸酐
加热反应即发生
COOH COOH
COOH COOH
O + H2O + CO2 O + H2O + CO2
异常反应: 形成环状酮
2.3 生成酯(酯化反应)
O
H+
O
R C OH + HOR'
R C OR' + H2O
取代基具有给电子共轭效应时,酸性强弱顺序为: 邻>间>对
具体分析: 邻 位(诱导、共轭、场、氢键效应、空间效应 均要考虑。) 对 位(诱导很小、共轭为主。) 间 位(诱导为主、共轭很小。)
实例
O
OH H O
邻位
诱导吸电子作用大、 共轭给电子作用大、 氢键效应吸电子作用大。
COOH
OH
间位
诱导吸电子作用中、
(Z)-HOOCCH=CHCOOH 顺丁烯二酸
(E)-HOOCCH=CHCOOH 反丁烯二酸
普通命名 草酸 缩苹果酸 琥珀酸 马来酸 富马酸
含有二个羧基的羧酸称为二元酸。
Include as many functions as possible in stem
(Better than 4-acetylheptanoic acid)
第三节 羧酸的光谱特征
1HNMR IR光谱
R2CHCOOH HCR2COOH
羧酸中的C=O: RCOOH CH2=CHCOOH ArCOOH 羧酸中的OH: 羧酸中的C-O
单体 1770~1750cm-1
~ 1720 cm-1
~ 3550 cm-1 ~ 1250 cm-1
H: 10~12 H: 2~2.6
提示:逆过程为酯 的酸性水解机理
O
H
R C OH
OH R C OH
OH R C OH
OH 亲核加成
R C OH
HOR' H2O H
O
R C OR'
HOR' OH
R C OH OR' H
- H2O
O R C OR' + H3O
➢ H+先与羧基羰基氧结合(增强了羧基的亲电性) ➢ OR' 上的氧原子来自于醇
OLi CR
H2O
O R-C-R
OLi
讨论: (1)(2)(3)同格氏试剂。(4)(注意:投料比对产物的影响)
实例
C2H5
I
C=C
CH3
H
n-C4H9Li/Et2O -50 至 -60oC
C2H5
Li
C=C
CH3
H
CO2
H2O
C2H5
COOH
C=C
CH3
H
*有机锂化合物的烃基化反应在合成羧酸中的应用 实例一
酯化反应特点: ➢反应需要 H+ 催化,无催化剂时反应很慢。 ➢反应可逆(加大反应物用量或除去水使酯的产率提高)
酯化反应机理的讨论
机理须说明的问题: a. 反应可逆性 b. H+ 在反应中起什么的作用?先作用在哪? c. 酯中OR‘中氧的来自于酸还是醇?
两种可能的酯化反应机理
(i) 通过酰基上的亲核取代
a-羟基酸 -羟基酸
羧酸的化学性质 羧酸的结构及化学性质分析
羰基不饱和, 可加成、还原
O
R CH C H
羧基可脱去 CO2
OH
H有酸性
羰基 a-H,有弱 酸性,可取代
OH 可被取代
1. 羧酸的酸性
几种活泼氢的酸性比较
R COOH
羧酸 pKa ~ 5
ArOH 酚
~ 10
ROH
醇 ~ 16-19
羧酸根负离子的共振式与稳定性
共轭效应:
X= OH OCH3 CH3 H Cl NO2 pKa 4.57 4.47 4.38 4.20 3.97 3.42
3). 空间效应:
利于H+离解的空间结构酸性强,不利于H+离解的空间结构 酸性弱
CH3
COOH
CH CH
3.68
CH3 CH CH COOH
4.44
4). 氢键:分子内的氢键也能使羧酸的酸性增强。
Carboxylic acids take precedence over other groups:
第二节 羧酸的物理性质
低级脂肪酸是液体,可溶于水,具有刺鼻的气味。 中级脂肪酸也是液体,部分地溶于水,具有难闻的气味。 高级脂肪酸是蜡状固体。无味,在水中溶解度不大。
液态脂肪酸以二聚体形式存在。所以羧酸 的沸点比相对分子质量相当的烷烃高。 所有的二元酸都是结晶化合物。
O B:
R C OH
O RC
O
O RC
O
有两个完全 等价的共振式
O RC
O
吸电子基对羧酸酸性的影响
Cl
Cl
H
Cl C CO2H Cl C CO2H Cl C CO2H
Cl
H
H
H
H C CO2H
H
Ka 23200×10-5
5530×10-5
136×10-5
1.75×10-5
应用:利用羧酸的酸性分离和纯化化合物
(ii) 旋光性醇酯化法。
R1
O
C* OH + HO C R H
R3
R2
R1
O
* R3 C O C R
R2
有旋光,机理(i)
R1
O
() R3 C O C R
总结:
➢ 伯醇、仲醇酯化经机理 (i)。 ➢ 叔醇酯化经机理(ii) (关键 :R+ 稳
定,较易生成)
R2
无旋光,机理(ii)
羟基酸的酯化——形成内酯和交酯
系统命名 甲酸 乙酸 丙酸 丁酸
十八(碳)酸
普通命名 蚁酸 醋酸 初油酸 酪酸 硬脂酸
只含有一个羧基的羧酸称为一元酸。最常见的酸, 可根据它的来源命名。
Common Names (Vollhardt)
二元酸
系统命名
HOOCCOOH
乙二酸
HOOCCH2COOH
丙二酸
HOOC(CH2)2COOH
丁二酸
RCH2COOH + 2LiN(i-C3H7)2
R’X
H2O RR’CHCOOH
RCHCOO-Li+
Li+
实例二
(CH3)2CHCOOH + 2LiN(i-C3H7)2 THF, C6H14, 0oC
(CH3)2CLiCOOLi Br(CH2)nBr
CH2 CH2 H2O HOOCC(CH2)nCCOOH
二缔合体 ~1710cm-1 ~1690cm-1
1700-1690cm3000 ~2500cm-
羧酸的光谱性质
醇羟基、羧酸羟基、烷基IR吸收的比较
C4H8O
正己烷
乙酸
乙MR图
2-甲基丙酸MS图
第四节 羧酸的结构和酸性 一 羧酸和羧酸根的结构比较
两个碳氧键
第十四章 羧 酸
本章提纲
第一节 羧酸的分类和命名 第二节 羧酸的物理性质 第三节 羧酸的光谱特征 第四节 羧酸的结构和酸性 第五节 羧酸的制备 第六节 羧酸的反应 第七节 不饱和羧酸和取代羧酸
第一节 羧酸的分类和命名
一元酸 HCOOH CH3COOH CH3CH2COOH CH3CH2CH2COOH CH3(CH2)16COOH
混合物
R CO2H +
非酸性化合物
OH 有机溶剂萃取
水相 有机相
H+ R CO2
非酸性化合物
R CO2H
2. 羧基上羟基的取代
取代羟基生成羧酸衍生物
O R C OH
羧酸
O RC X
O
O
R C O CR
O R C OR'
O R C NH2(R)
羧酸衍生物
酰卤 酸酐 酯 酰胺
2.1 形成酰卤(下册,第13.6节)
共轭给电子作用小。
COOH
OH
对位
诱导吸电子作用小、 共轭给电子作用大。
pka 2.98
pka 4.08
pka 4.57
Ref. 苯甲酸的pka 4.20
应用:利用羧酸的酸性分离和纯化化合物
混合物
R CO2H +
非酸性化合物
OH 有机溶剂萃取
水相 有机相
H+ R CO2
