大学有机化学名词解释
大学有机化学知识点总结

有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3 2)锯架式:CH 3OHHHOH 2H 53)纽曼投影式:4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3)环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1.Z/E标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z构型,在相反侧,为E构型。
2、顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
3、R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R构型,如果是逆时针,则为S构型。
注:将伞状透视式与菲舍尔投影式互换的方法是:先按要求书写其透视式或投影式,然后分别标出其R/S构型,如果两者构型相同,则为同一化合物,否则为其对映体。
郑州大学远程教育有机化学(问答题)

各章练习题1.名词解释:(1)有机化学:研究有机化合物的结构、性能和合成方法的一门科学。
(2)有机化合物:碳的化合物。
(3)官能团:在有机化合物分子中能体现一类化合物性质的原子或基团。
(4)共价键的键长、键角、键能: 键长:成键两原子核间距离。
键角:两个共价键在空间的夹角。
键能:以共价键结合的双原子分子裂解成原子时所吸收的能量。
2.写出氯甲烷分子中碳氯键的异裂和均裂的化学反应式。
H 3CCH 3 + Cl CH 3 + ClClH 3CCl1.解释名词:(1)同系列:具有相同分子通式和结构特征的一系列化合物。
(2)构造异构:分子式相同,分子中原子间相互连接顺序和方式不同而产生的不同化合物。
(3)构象异构:由单键的旋转而产生的异构体。
2.写出含有7个碳烷烃的同分异构体的结构并用系统命名法命名。
CH 3CH 2CH 2CH 2CH 2CH 2CH 3CH 3CH 2CH 2CH 2CHCH 3CH 3CH 3CH 2CH 2CHCH 2CH 3CH 3庚烷 2-甲基己烷 3-甲基己烷CH 3CHCH 2CHCH 3CH 3CH 3CH 3CHCHCH 2CH 3CH 3CH 3CH 3CCH 2CH 2CH 3CH 3CH 32,4-二甲基戊烷 2,3-二甲基戊烷 2,2-二甲基戊烷CH 3CH 2CHCH 2CH 3CH 2CH 3CH 3CH 2CCH 2CH 3CH 3CH 3CH 3CHCCH 3CH 3CH 3CH 33,3-二甲基戊烷 2,2,3-三甲基丁烷 3-乙基戊烷第三章 烯烃和炔烃1.写出单烯烃C 5H 8的所有同分异构体,并用系统命名法命名。
CH 2=CHCH 2CH 2CH 3CH 3CH=CHCH 2CH 31-戊烯 2-戊烯CH 2=CCH 2CH 3CH 3CH 2=CHCHCH 3CH 3CH 3CH=CCH 3CH 32-甲基-1-丁烯 3-甲基-1-丁烯 2-甲基-2-丁烯2.完成下列反应(1)CH 3CH 2C=CH 2 + HBrCH 3CH 3CH 2CCH 3BrCH 3(2)CH 3CH=CCH 2CH 334,HCH 3COOH + O=CCH 2CH 33(3)CH 3CH=CHCH 3 + H 2PtCH 3CH 2CH 2CH 3(4)CH 3CH 2C CH + AgNO 3(NH 3)CH 3CH 2C CAg + NH 4NO 3 + NH 3(5)CH 3C CH + HCl CH 3C=CH 2ClClCH 3CCH 33、用简单的化学方法鉴别戊烷、1-戊烯、1-戊炔。
化学基础有机

化学基础有机一、有机化学简介有机化学,又称为碳化合物化学,是化学科学的一个重要分支。
它主要研究含碳元素的化合物的合成、结构、性质、反应机理以及相互转化的规律。
有机化学不仅是合成具有重要实用价值的有机化合物的基础学科,同时也是化学工业的重要组成部分。
二、有机化学发展历程有机化学的发展可以追溯到古代,人类在生产和生活实践中就已经开始接触和利用有机化合物。
然而,真正意义上的有机化学的研究是从18世纪后半叶开始的。
这一时期的化学家们开始对有机化合物的结构、性质和反应机理进行系统的研究。
进入20世纪后,随着科技的不断进步,有机化学的发展取得了巨大的突破。
特别是在20世纪70年代以后,随着计算机技术和谱学分析方法的快速发展,有机化学的研究进入了分子设计和功能化的新阶段。
三、有机化学基本概念1.有机化合物:通常是指含有碳元素的化合物,但不包括碳的氧化物、碳酸盐、碳酸等无机化合物。
2.有机化学反应:是指碳与碳原子之间进行的各种化学反应,主要包括取代反应、加成反应、消除反应、重排反应等。
3.共价键:原子之间通过共享电子而形成的化学键,是有机化合物结构的基础。
4.官能团:是指一种或多种活性原子的组合,可以决定有机化合物的性质。
5.手性:是指一个物体不能与其镜像相重合的性质。
在有机化合物中,手性通常是指分子中存在手性碳原子。
四、有机化学反应类型1.取代反应:有机化合物分子中的某一原子或基团被其他原子或基团取代的反应。
2.加成反应:有机化合物分子中碳碳双键或三键发生断裂,与其它原子或基团结合生成新的化合物的反应。
3.消除反应:在一定的条件下,一分子有机物脱去一分子水或卤化氢等小分子的反应。
4.重排反应:由于基团之间的迁移或交换,使得分子的原有结构发生改变的反应。
5.聚合反应:由小分子重复生成高分子化合物的反应。
6.水解反应:水分子与有机化合物反应,使其分解成两部分或更多部分的反应。
7.氧化还原反应:涉及电子传递的氧化和还原的有机反应。
大学有机化学知识点总结与归纳

大学有机化学知识点总结与归纳大学有机化学知识点总结与归纳1.酸性比较α-H存在于羰基的α-C上(这是句废话)它的酸性由旁边的吸电子基团的强弱决定一般的,相邻基团的吸电子效果越强其酸性越强相反则越弱如果连接了硝基之类的效果就相当不错了。
在强碱性环境的条件下可以类似于酸的电离一样从分子上解离被强碱捕获其母体分子形成了碳负离子碳负离子作为富电子基团作为亲核试剂具有很强的亲核活性对高度极化的基团的正电中心进行进攻常见的是羰基碳溶剂的碱性强可以促进这类反应的正反应方向进行可以促进脱质子嘛!比较弱的可以用氢氧化钾(这个太弱了很少用)也可以用乙醇钠LDA之类的强碱。
2.反应活性有很多有机化学反应,反应时对于不同的烷基或者比如卤代反应对于不同的卤代烃有不同的活性,那么活性的不同是由于什么引起的呢?其实化学反应就是电性相反的原子或者基团重新组合,因此,表面上看不同的,烃基或者卤素原子活性不同,其实就是电子云的疏密不一样,电负性也是这个原因。
比如卤代烃的反应活性R3H-x>R2CH-X>R-CH2-X而醚的碳氧键断裂(就是酸和醚反应先形成佯盐然后发生亲电取代反应)醚键断裂顺序刚好相反,因为有些是亲电的反应,要求电子云密度大的,活性高。
有些是亲核的,要求电子云密度小。
是由烷基或卤代基的给电子或吸电子能力不同引起的。
不同的机理,活性刚好是相反的因为烷基给电子而卤代基吸电子。
3.碳正离子碳正离子,也称作碳阳离子,是含有正电碳的活性中间体,通常碳为sp2杂化,与三个基团结合,留下一对垂直于平面的p轨道。
碳正离子在有机化学中具有很重要的地位,如SN1反应即经由碳正离子中间体。
一般具有能稳定正电荷的基团的碳正离子具有较高的稳定性。
一般而言,三级碳正离子的稳定性大于二级碳正离子;二级碳正离子大于一级碳正离子。
反应中间体涉及碳正离子者通常会发生重排,例如SN1反应及E1反应等。
重排的种类则有氢阴离子迁移(Hydrideshift)与甲基迁移(Methylshift)两种。
有机化学部分名词解释

目录前言 (2)烃 (2)烷烃 (2)烷基 (3)环烃 (4)环烷基 (5)芳香烃 (6)苯环 (7)芳基 (7)烯烃 (8)烯基 (9)单烯烃CnH2n (9)二烯烃CnH(2n-2) (10)环烯烃 (11)胺 (12)烃基 (12)胺 (13)酚 (14)苯环 (14)多环芳烃 (15)酚 (16)醇 (17)饱和醇 (18)醛 (19)羧suō酸 (20)羧基 (20)氨基酸 (21)羰tāng基 (23)酮 (23)吡啶 (23)前言环保是一门要上知天文,下知地理的专业。
尤其是从事废水相关的,很多专业都可以跟你抢饭碗,例如,给排水、化工、生物等。
在某些专业上比学环境工程的更加专业。
更新本文的主要目的是为了我近期在准备一篇“臭氧氧化”的文章。
学习这篇有机化学知识,更又利于你理解这篇文章。
烃只由碳、氢两种元素组成的碳氢化合物,称为烃。
其中包含烷烃、烯烃、炔烃、环烃及芳香烃,是许多其它有机化合物的基体。
烷烃分子中的碳原子都以(C-C)单键相连,其余的价键都与氢结合(C-H)而成的化合物。
通式为CnH2n+2,是最简单的一种有机化合物。
根据烃分子骨架的不同,烃可分为链烃、环烃、芳香烃。
链烃又可以分为饱和烃(烷烃)和不饱和烃(烯烃、炔烃)。
其中饱和烃就是烷烃,整体构造仅由碳、氢原子以碳碳单键C-C 与碳氢单键C-H组成的有机化合物,饱和意味着分子中的碳原子和其他原子的结合达到了最大限度。
烷基即饱和烃基,是烷烃分子中少掉一个氢原子而成的烃基。
例如,CH3-甲基(参考甲烷)、CH3CH2-乙基(参考乙烷);链烃:这类有机物最早从脂肪中提取,所以也叫做脂肪烃。
是分子中碳原子间通过共价键连接形成链状的碳架,两端张开而不成环的烃,叫做开链烃,简称链烃;环烃亦称闭链烃,结构式为多边形,有环状结构的碳氢化合物的总称。
分子中的碳原子相连,形成环状的烃。
按结构和性质可分为脂环烃和芳烃。
但一般环烃是指脂环烃。
根据环的数目,分为单环、双环、三环等环烃。
有机化学名词解释

一、化合物类名无机酸酯:醇与含氧无机酸反应失去一分子水后的生成物称为无机酸酯。
双烯烃:碳碳双键数目最少的多烯烃是二烯烃或称双烯烃。
可分为三类:两个双键连在同一个碳原子上的二烯烃称为累积二烯烃,两个双键被两个或两个以上单键隔开的二烯烃称为孤立二烯烃,两个双键被一个单键隔开的二烯烃称为共轭二烯烃。
内酯:分子内的羧基和羟基失水形成的产物称为内酯。
内酰胺:分子内的羧基和胺(氨)基失水的产物称为内酰胺。
四级铵碱:四级铵盐在强碱(KOH,NaOH)作用下生成的产物称为四级铵碱。
生物碱:从动植物体内得到的一类有强烈生理效能的含氮有机化合物。
游离生物碱绝大多数是固体,难溶于水,易溶于乙醇等有机溶剂。
天然的生物碱多半是有左旋光的手性化合物。
半缩醛或半缩酮:醇具有亲核性,在酸性催化剂如对甲苯磺酸、氯化氢的作用下,很容易和醛酮发生亲核加成,一分子醛或酮和一分子醇加成的生成物称为半缩醛或半缩酮。
有机化合物:除一氧化碳、二氧化碳、碳酸盐等少数简单含碳化合物以外的含碳化合物。
多肽:一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,形成一个酰氨键,新生成的化合物称为肽,肽分子中的酰氨键叫做肽键。
二分子氨基酸失水形成的肽叫二肽,多个氨基酸失水形成的肽叫多肽。
杂环化合物:在有机化学中,将非碳原子统称为杂原子,最常见的杂原子是氮原子、硫原子和氧原子。
环上含有杂原子的有机物称为杂环化合物。
分为两类,具有脂肪族性质特征的称为脂杂环化合物,具有芳香特性的称为芳杂环化合物。
因为前者常常与脂肪族化合物合在一起学习,所以平时说的杂环化合物实际指的是芳杂环化合物。
杂环化合物是数目最庞大的一类有机物。
多环烷烃:含有两个或多个环的环烷烃称为多环烷烃。
有机化学名词解释

一、化合物类名无机酸酯:醇与含氧无机酸反应失去一分子水后的生成物称为无机酸酯。
双烯烃:碳碳双键数目最少的多烯烃是二烯烃或称双烯烃。
可分为三类:两个双键连在同一个碳原子上的二烯烃称为累积二烯烃,两个双键被两个或两个以上单键隔开的二烯烃称为孤立二烯烃,两个双键被一个单键隔开的二烯烃称为共轭二烯烃。
内酯:分子内的羧基和羟基失水形成的产物称为内酯。
内酰胺:分子内的羧基和胺(氨)基失水的产物称为内酰胺。
四级铵碱:四级铵盐在强碱(KOH,NaOH)作用下生成的产物称为四级铵碱。
生物碱:从动植物体内得到的一类有强烈生理效能的含氮有机化合物。
游离生物碱绝大多数是固体,难溶于水,易溶于乙醇等有机溶剂。
天然的生物碱多半是有左旋光的手性化合物。
半缩醛或半缩酮:醇具有亲核性,在酸性催化剂如对甲苯磺酸、氯化氢的作用下,很容易和醛酮发生亲核加成,一分子醛或酮和一分子醇加成的生成物称为半缩醛或半缩酮。
有机化合物:除一氧化碳、二氧化碳、碳酸盐等少数简单含碳化合物以外的含碳化合物。
多肽:一个氨基酸的羧基与另一分子氨基酸的氨基通过失水反应,形成一个酰氨键,新生成的化合物称为肽,肽分子中的酰氨键叫做肽键。
二分子氨基酸失水形成的肽叫二肽,多个氨基酸失水形成的肽叫多肽。
杂环化合物:在有机化学中,将非碳原子统称为杂原子,最常见的杂原子是氮原子、硫原子和氧原子。
环上含有杂原子的有机物称为杂环化合物。
分为两类,具有脂肪族性质特征的称为脂杂环化合物,具有芳香特性的称为芳杂环化合物。
因为前者常常与脂肪族化合物合在一起学习,所以平时说的杂环化合物实际指的是芳杂环化合物。
杂环化合物是数目最庞大的一类有机物。
多环烷烃:含有两个或多个环的环烷烃称为多环烷烃。
共轭烯烃:单双键交替出现的体系称为共轭体系,含共轭体系的多烯烃称为共轭烯烃。
纤维二糖:是由两分子葡萄糖通过1,4 两位上的羟基失水而来的,纤维二糖是B-糖苷。
纤维素:由多个纤维二糖聚合而成的大分子。
多稀烃:含有多于一个碳碳双键的烯烃称为多稀烃。
大学有机化学知识点总结

大学有机化学知识点总结有机化学复总结一.有机化合物的命名1.能够用系统命名法命名各种类型化合物,包括烷烃、烯烃、炔烃、烯炔、脂环烃、芳烃、醇、酚、醚、醛、酮、羧酸、羧酸衍生物、多官能团化合物,并能够判断Z/E构型和R/S构型。
2.根据化合物的系统命名,写出相应的结构式或立体结构式,包括伞形式、锯架式、菲舍尔投影式、纽曼投影式。
立体结构的表示方法包括Z/E标记法、顺/反标记法和R/S标记法。
立体结构的标记方法1.Z/E标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z构型,在相反侧,为E构型。
2.顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
3.R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R构型,如果是逆时针,则为S构型。
有机化学反应及其特点有机化学反应可以分为不同的类型,包括自由基取代、自由基加成、亲电加成、亲电取代、亲核取代、离子型反应、亲核加成、消除反应、协同反应、还原反应和氧化反应。
每种类型的反应都有其特点和规律。
马氏规律是亲电加成反应的规律,即亲电试剂总是加到连氢较多的双键碳上。
过氧化效应是自由基加成反应的规律,即卤素加到连氢较多的双键碳上。
空间效应是体积较大的基团总是取代到空间位阻较小的位置。
定位规律是芳烃亲电取代反应的规律,包括邻、对位定位基和间位定位基。
查依切夫规律是卤代烃和醇消除反应的规律,主要产物是双键碳上取代基较多的烯烃。
休克尔规则是判断芳香性的规则,存在一个环状的大π键,成环原子必须共平面或接近共平面,π电子数符合4n+2规则。
霍夫曼规则是季铵盐消除反应的规律,只有烃基时,主要产物是双键碳上取代基较少的烯烃(动力学控制产物)。
当β-碳上连有吸电子基或不饱和键时,则消除的是酸性较强的氢,生成较稳定的产物(热力学控制产物)。
大学有机化学笔记

引言:有机化学是化学中的一个重要分支,研究有机物的结构、性质、合成方法和反应机理等,具有广泛的应用价值。
本文是《大学有机化学笔记(二)》的第二部分,将对有机化学中的五个大点进行详细阐述,并提供相关小点的解释和示例。
通过本文的阅读,读者将能够系统地了解有机化学的相关知识,并能够更好地理解和应用于实际生活和科学研究中。
概述:本文的五个大点将分别介绍有机化学中的化学键、官能团、芳香性、手性和反应类型。
这些内容是有机化学的基础,对于进一步学习有机化学和解决实际问题将起到重要的作用。
在每个大点下,我们将提供深入的解释和实例,以便读者更好地理解和运用。
正文内容:一、化学键1.有机化学中的化学键是指连接在有机分子中的原子之间的化学结合。
常见的化学键类型有共价键、极性键和离子键。
2.共价键是通过原子间共享电子而形成的化学键。
例如,碳原子常通过共价键与其他碳原子、氢原子和其他元素的原子连接。
3.极性键是指由于原子间电子云的不均匀分布而形成的化学键。
极性键中,电子云倾向于聚集在电负性较大的原子周围。
例如,氧原子的电负性较大,与碳原子之间的化学键就是极性键。
4.离子键是指由正负电荷之间的吸引力形成的化学键。
离子键常见于含有金属和非金属原子的化合物,如氯化钠(NaCl)。
5.化学键的强弱直接影响着有机分子的稳定性和反应性质。
在有机合成中,了解化学键的性质和特点对于选择适当的反应条件和控制反应过程至关重要。
二、官能团1.官能团指的是有机分子中具有特定化学性质和反应活性的一组原子。
不同的官能团赋予了不同的功能和反应特点。
2.以羰基官能团为例,其中碳和氧形成了一个双键,可以通过吸电子基团的作用而发生还原或亲电取代反应。
3.羟基官能团是一种由氧和氢原子组成的官能团。
氢原子在酸性条件下可被取代而产生相应的氧化还原反应。
4.胺官能团是由氮原子形成的官能团,具有强碱性。
它在有机合成中广泛应用于氨基化、缩合和胺氧化等反应中。
5.官能团的存在使得有机分子具有特定的性质和反应活性,对于有机化学反应和合成设计至关重要。
大学有机化学名词解释

亲核反应有机反应的一类,电负性高的亲核基团向反应底物中的带正电的部分进攻而芳环上亲核取代反应历程使反应发生,这种反应为亲核反应。
与之相对的为亲电反应。
即在相互作用的两个体系之间,由于一个体系对另一个体系的原子核的吸引所引起的化学反应。
这些反应属于离子反应。
反应试剂在反应过程中,对与之相互作用的原子或体系给予或共享其电子对者,称为亲核试剂。
由亲核试剂如HO、:NR3、CN、H2N、…等与有机分子相互作用而发生的取代反应,称为亲核取代反应(SN)。
在亲核取代反应中,亲核试剂Nu进攻被作用物中的饱和碳原子,取代此饱和碳原子上的一个原子团L芳环上亲核取代反应历程能量变化。
Nu供给碳原子一对电子,生成新的共价键,碳原子与L之间的共价键破裂,L带着一对电子离去:Nu:+RL─→NuR+:L式中R为烷基。
Nu:和L:都带有孤电子对,它们可以是负离子或中性分子。
由亲核试剂HCN、H2O、丙二酸二乙酯等与世轭不饱和醛或酮进行的加成反应称亲核加成反应。
例如共轭不饱和酮与HCN加成,形成氰酮:亲电反应electrophilic reaction亲电反应指缺电子(对电子有亲和力)的试剂进攻另一化合物电子云密度较高(富电子)区域引起的反应。
亲电反应属于离子型反应(ionic reaction)的一种,是有机化学的基本反应之一。
[1]在相互作用的两个体系之间,由于一个体系对另一个体系的电子的吸引所引起的化学反应。
这些反应属于离子反应。
反应试剂在反应过程中,从与之相互作用的原子或体系得到或共享电子对者,称为亲电试剂(E+)。
凡由亲电试剂如HNO3、H2SO4、Cl2、Br2等与有机分子相互作用而发生的取代反应,称为亲电取代反应(SE):E++RX─→RE+X+式中R为烷基。
上述类型的正离子取代反应属于SE类型反应。
例如,CH3:MgBr与溴反应时,溴分子的正电荷部分(相当于上式中的E+)与带着一对电子的甲基反应:CH3:|MgBr+Br+|:Br-─→CH3Br+MgBr2亲电反应在芳香族化合物亲电取代反应中,亲电试剂进攻芳香环,生成σ络合物,然后离去基团变成正离子离开,离去基团在多数情况下为质子:一般,第二步的速率比第一步高(k2》k1,k)。
有机化学术语(中英文对照)

1.有机化合物的官能团和重要的基团官能团functional group双键double bond三键triple bond烃基hydroxy group琉基mercapto硫轻基sulfhydryl group羰基carbonyl group氨基amino group亚氨基imino group硝基nitro group亚硝基nitroso group氰基cyano group羧基carboxyl group磺基sulpho group烷基alkyl group苯基phenyl group卡基benzyl group芳基aryl group烯基allyl group烷氧基alkoxyl group酰基acyl group活性亚甲基active methylene group2.有机化合物的类型烃hydrocarbon石蜡paraffin脂肪烃aliphatic hydrocarbon烷烃alkane烯烃alkene炔烃alkyne共扼二烯烃conjugated diene脂环烃alicyclic hydrocarbon螺环化合物spiro compound桥环化合物bridged ring compound芳烃aromatic hydrocarbon非苯芳烃nonbenzenoid aromatic hydrocarbon 稠环芳烃condensed aromatics卤代烃halohydrocarbon醇alcohol酚phenol醚ether环氧化合物epoxide冠醚crown ether硫醇thiol硫酚thiophenol硫醚sulfide二硫化物disulfide亚磺酸sulfinic acid磺酸sulfonic acid 亚砜sulfoxide砜sulfone醛aldehyde酮ketone半缩醛hemiacetaI半缩酮hemiketal缩醛acetal缩酮ketal西佛碱shiff's base肟oxime腙hydrozone缩氨脲semicarbazoneα,β-不饱和酮α,β--unsaturated ketone 醌quinone羧酸carboxylic acid酰卤acid halide酸酐acid anhydride酯ester酰胺amide內酯lactone内酰胺lactam月青nitrile取代酸substituted acid羟基酸hydroxy acid醇酸alcoholic acid酚酸phenolic acid酮酸keto acidB-酮酸酯B-ketone ester乙酰乙酸乙醋ethyl acetoacetate亚硝基化合物nitroso compound硝基化合物njtro compound亚胺imine胺amine伯胺primary amine仲胺secondary amine叔胺tertiary amine季铵盐quaternary ammonium salt季铵碱quaternary ammonium hydroxide 重氮盐diazonium salt偶氮化合物azo compound胍guanidine氨基酸amino acid磷phosphine磷酸酯phosphate亚磷酸酯phosphite膦酸酯phosphonate膦酸phosphonic acid3.杂环化合物吡咯pyrrol呋喃furane噻吩thiophone吲哚indole卟吩porphine咪唑imidazole噻唑thioazole吡啶pyridine喹啉quinoline异喹啉isoquinoline吡喃鎓盐pyrylium salts 黄酮flavone嘧啶pirimidine嘌呤purine4.有机天然产物肽peptide多肽polypeptide核酸nucleic acid核苷nucleoside核苷酸nucleotide生物碱alkaloid碳水化合物carbohydrate单糖monosaccharide醛糖aldoses酮糖ketosesD-核糖ribose D-2-脱氧核糖deoxyribose 葡萄糖glucose果糖fructose糖脎osazone糖苷glucoside低聚糖oligosaccharide 麦芽糖maltose蔗糖sucrose纤维二糖cellobiose环糊精cyclodextrin多糖polysaccharide淀粉starch纤维素cellulose类脂lipid萜类化合物terpenoid甾族化合物steroid脂肪fat油oil脂肪酸fatty acid甘油三羧酸酯triglyceride磷脂phospholipid磷脂酸phosphalidic acid蜡wax5.有机化合物的结构理论价键理论valence-bond theory分子轨道理论molecular orbital theory 共振论resonance theory凯库勒式Kekule formula路易斯式Lewis formulaσ键σ bondπ键π bond键能bond energy键角bond angle键长bond Iength成键轨道bonding orbital反键轨道antibonding orbital最高已占轨道HOMO highest occupied molecular orbital 最低末占轨道LUMO lowest unoccupied molecular orbital 诱导效应inductive effect共轭效应conjugated effectπ,π-共轭π,π- conjugationp,π-共轭p,π- conjugation超共轭作用hyperconjugation离域能delocalization energy共振能resonance energy给电子基团electron donating group吸电子基团electron withdrawing group芳性aromaticity休克尔规律Huckel's rule两性离子Zwitterion6.有机化学中的同分异构异构体isomer构造constitution构型configuration构象conformation构造异构constitutional isomerism立体异构stereo isomerism构型异构configurational isomerism顺反异构cis-trans isomerism次序规则sequence ruIe同侧Zugammen Z异侧Entgegen E顺式cis反式trans对映异构enantiomerism = 光学异构旋光异构optical isomerism旋光性optical activity旋光度optical rotation比旋光度specific rotation对称面plane of symmetry对称中心center of symmetry对称轴axis of symmetry手性chirality手性分子chiral molecules对映异构体,对映体enantiomer 非对映体diastereomer外消旋体raceme左旋体leveisomer右旋体dextroisomer内消旋体mesomer费歇尔投影式Fischer projection相对构型relative configuration绝对构型absolute configurationR -构型R -configurationS -构型S -configuration赤式erythro苏式threo外消旋化racemization拆分resolution光学纯度Optical Purity对映体过量百分数enantiomeric excess立体专一性反应stereospecific reaction 立体选择性反应stereoselective reaction不对称合成asymmetric synthesis构象异构conformational isomerism构象分析conformational analysis锯架式perspective formula 纽曼投影式Newman projection formula椅式chair form船式boat form直立键a键axial bond 平伏键e键equatorial bond互变异构tautomerism酮式keto-form烯醇式enol-form差向异构化epimerization变旋现象mutamerism哈武斯式Haworth form7.有机反应的名称取代反应substitution reaction加成反应addition reaction马尔科夫尼可夫规律Markovnikov rule 共轭加成conjugate addition消去反应elemination reaction查依采夫规律Saytzeff rule霍夫曼规律Hofmann rule硼氢化反应hydroboration催化加氢catalytic hydrogenation 聚合反应polymerization单体monomer聚合物polymer硝化反应nitration卤化反应halogenation磺化反应sulfonation烷基化反应alkylation酰基化反应acylation酯化反应esterification酯交换反应transesterification脱羧反应decarboxylation 氯甲基化反应chloromethylation傅列德尔-克拉夫茨反应Friedel-Crafts reaction格利雅反应Grignard reaction 格利雅试剂(格氏试剂) Grignard reagent赖默-梯曼反应Reimer-Tiemann reaction 卤仿反应haloform reaction水解反应hydrolysis reaction醇解反应alcoholysis reaction氨解反应ammonolysisi reaction皂化saponification插烯作用vinylogy缩合condensation克莱森缩合Claisen condensation安息香缩合benzoin condensation羟醛缩合aldol condensation列弗尔马茨基反应Reformatsky reaction迈克尔反应Michael reaction诺文格尔反应Knoevenagel reaction加布里反应Gabriel reaction乙酰乙酸乙酯合成法acetoacetic ester synthesis 丙二酸酯合成法malonic ester synthesis 威廉逊合成法William Son synthesis海森堡试验Hinsberg test重氮化反应diazotization reaction偶联反应coupling reaction脱氨基反应deamination reaction维悌希反应Wittig reaction氧化反应oxidation reaction还原反应reduction reaction周环反应pericyclic reaction环加成反应cycloaddition reaction电环化反应electrocyclic reaction坎尼扎罗反应Cannizzaro reaction齐齐巴宾反应Chichibabin reaction狄尔斯-阿德尔反应Diels-alder reaction斐林试剂Fehling reagent托伦试剂Tollens reagent沃克还原Wolff-Kishner reduction罗森蒙德还原Rosenmund reduction克莱门森还原Clemmenson reduction考普重排Cope rearrangement霍夫曼重排Hofmann rearrangement嚬哪醇重排pinacol rearrangement弗里茨重排Fries rearrangement克莱森重排Claisen rearrangement二烯体diene亲二烯体dienophile分子轨道对称守恒原理conversation of orbital symmetry8.有机反应机理均裂homolytic异裂heterolytic活性中间体active intermediate碳正离子carbocation碳负离子carbanion烯醇负离子enolate anion自由基,游离基free radical卡宾,碳烯carbene氮烯nitrene速度决定步骤rate-determining step哈蒙特假定Hammond postulate能线图energy profile过渡状态transition state邻基参与neighboring group participation动力学控制kinetic control热力学控制thermodynamic control离去基团leaving group底物substrate亲电试剂electrofphile亲核试剂nucleophile亲电加成反应electrophilic addition亲电取代反应electrophilic substitution定位规律orientation rule亲核取代反应nucleophilic substitutionSN2 反应机理SN2 reaction mechanismSN1 反应机理SN1 reaction mechanism瓦尔登转化Walden inversion亲核加成反应nucleophilic addition亲核加成-消去反应nucleophilic addition-elimination reaction 消去反应机理elimination reaction mechanismE1 反应机理E1 reaction mechanismE2 反应机理E2 reaction mechanism反式消去anti elimination重排反应机理rearrangement reaction mechanism 自由基反应free radical reaction链引发chain initation链增长chain propagation链终止chain termination9.有机化合物的光谱红外光谱IR Infrared spectra傅立叶变换Fourier Transform指纹区finger print region吸收频率absorption frequency紫外光谱UV Ultraviolet spectra电子跃迁elctronic transition吸光度absorbance摩尔消光系数molar extinction coefficient发色团chromophore助色团auxochrome核磁共振NMR Nuclear Magnetic Resonance1HNMR 谱1HNMR spectra13CNMR 谱13CNMR spectra屏蔽效应shielding effect化学位移chemical shift自旋偶合spin-spin coupling自旋裂分spin-spin splitting偶合常数coupling constant质子去偶proton spin decoupling 质子偏共振去偶proton off-resonance decoupling质谱Mass Spectra(MS)电子流轰击election impact (EI)快原子轰击fast atom bombarment (FAB)分子离子峰molecular ion peak同位素峰isotopic peak基峰base peak质荷比(m/z) mass-to-charge ratio10.分子间作用力氢键hydrogen bond色散力dispersion force 范德华力Van Der Waals force 偶极-偶极作用力dipole-dipole interraction force11.物理性质熔点melting point沸点boiling point密度density溶解度solubility偶极矩dipole moment12.有机化合物的酸碱性酸性acidity碱性basicity<HTML>本站材料仅为本院教师与学生教学所用,请勿它用!</HTML>有机化合物编辑[yǒu jīhuàhéwù]有机化合物主要由氢元素、碳元素组成,含碳的化合物,但是不包括一氧化碳、二氧化碳和以碳酸根结尾的物质。
大学有机化学名词解释

亲核反应有机反应的一类,电负性高的亲核基团向反应底物中的带正电的部分进攻而芳环上亲核取代反应历程使反应发生,这种反应为亲核反应。
与之相对的为亲电反应。
即在相互作用的两个体系之间,由于一个体系对另一个体系的原子核的吸引所引起的化学反应。
这些反应属于离子反应。
反应试剂在反应过程中,对与之相互作用的原子或体系给予或共享其电子对者,称为亲核试剂。
由亲核试剂如HO、:NR3、CN、H2N、…等与有机分子相互作用而发生的取代反应,称为亲核取代反应(SN)。
在亲核取代反应中,亲核试剂Nu 进攻被作用物中的饱和碳原子,取代此饱和碳原子上的一个原子团L芳环上亲核取代反应历程能量变化。
Nu供给碳原子一对电子,生成新的共价键,碳原子与L之间的共价键破裂,L带着一对电子离去:Nu:+RL─→NuR+:L式中R为烷基。
Nu:和L:都带有孤电子对,它们可以是负离子或中性分子。
由亲核试剂HCN、H2O、丙二酸二乙酯等与世轭不饱和醛或酮进行的加成反应称亲核加成反应。
例如共轭不饱和酮与HCN加成,形成氰酮:亲电反应electrophilic reaction亲电反应指缺电子(对电子有亲和力)的试剂进攻另一化合物电子云密度较高(富电子)区域引起的反应。
亲电反应属于离子型反应(ionic reaction)的一种,是有机化学的基本反应之一。
[1]在相互作用的两个体系之间,由于一个体系对另一个体系的电子的吸引所引起的化学反应。
这些反应属于离子反应。
反应试剂在反应过程中,从与之相互作用的原子或体系得到或共享电子对者,称为亲电试剂(E+)。
凡由亲电试剂如HNO3、H2SO4、Cl2、Br2等与有机分子相互作用而发生的取代反应,称为亲电取代反应(SE):E++RX─→RE+X+式中R为烷基。
上述类型的正离子取代反应属于SE类型反应。
例如,CH3:MgBr与溴反应时,溴分子的正电荷部分(相当于上式中的E+)与带着一对电子的甲基反应:CH3:|MgBr+Br+|:Br-─→CH3Br+MgBr2亲电反应在芳香族化合物亲电取代反应中,亲电试剂进攻芳香环,生成σ络合物,然后离去基团变成正离子离开,离去基团在多数情况下为质子:一般,第二步的速率比第一步高(k2》k1,k)。
《有机化学》课程作业

延安大学继续教育学院商洛函授站第二学期课程作业课程名称有机化学授课年级2014专业临床班级专升本姓名李金锋《有机化学》课程作业一、名词解释1、对映异构体:互为物体与镜像关系的立体异构体,称为对映异构体(简称为对映体). 对映异构体都有旋光性,其中一个是左旋的,一个是右旋的. 所以对映异构体又称为旋光异构体。
2、碘值:表示有机化合物中不饱和程度的一种指标。
指100g物质中所能吸收(加成)碘的克数。
主要用于油脂、脂肪酸、蜡及聚酯类等物质的测定。
3、酯化反应:酯化反应通常指醇或酚与含氧的酸类(包括有机酸和无机酸)作用生成酯和水的过程,也就是在醇或酚羟基的氧原子上引入酰基的过程, 也称为O-酰化反应.4、波谱分析:《波谱分析》由多位作者根据中国科学院长春应用化学研究所的讲义编写而成,系统地介绍了红外、拉曼、紫外、质谱和核磁共振方面的基础知识。
5、红外光谱:以波长或波数为横坐标以强度或其他随波长变化的性质为纵坐标所得到的反映红外射线与物质相互作用的谱图。
6、重氮化反应:首先由一级胺与重氮化试剂结合,然后通过一系列质子转移,最后生成重氮盐。
7、共振跃迁:“共振跃迁”是天文学专有名词。
来自中国天文学名词审定委员会审定发布的天文学专有名词中文译名,词条译名和中英文解释数据版权由天文学名词委所有。
8、伽特曼反应:以德国化学家路德维希·加特曼(Ludwig Gattermann)命名,可以指:芳香重氮盐中的重氮基,在新制铜粉和盐酸或氢溴酸作用下,被其他基团置换的反应9、中性氨基酸:所谓中性氨基酸是指分子中氨基和羧基的数目相等的一类氨基酸。
因其分子中碱性的“-NH2”与酸性的“-COOH”数目相等,故名。
包括甘氨酸、丙氨酸、亮氨酸、异亮氨酸、半胱氨酸、色氨酸、苏氨酸、丝氨酸、苯丙氨酸、甲硫氨酸、酪氨酸、缬氨酸。
其中,缬氨酸、甲硫氨酸、苯丙氨酸、色氨酸为必需氨基酸。
10、蛋白质:蛋白质是构成一切细胞和组织结构必不可少的成分。
有机化学名词解释

有机物-特点多数有机化合物主要含有碳、氢两种元素,此外也常含有氧、氮、硫、卤素、磷等。
部分有机物来自植物界,但绝大多数是以石油、天然气、煤等作为原料,通过人工合成的方法制得。
和无机物相比,有机物数目众多,可达几百万种。
有机化合物的碳原子的结合能力非常强,互相可以结合成碳链或碳环。
碳原子数量可以是1、2个,也可以是几千、几万个,许多有机高分子化合物甚至可以有几十万个碳原子。
此外,有机化合物中同分异构现象非常普遍,这也是造成有机化合物众多的原因之一。
有机化合物除少数以外,一般都能燃烧。
和无机物相比,它们的热稳定性比较差,有机物结构式电解质受热容易分解。
有机物的熔点较低,一般不超过400℃。
有机物的极性很弱,因此大多不溶于水。
有机物之间的反应,大多是分子间反应,往往需要一定的活化能,因此反应缓慢,往往需要催化剂等手段。
而且有机物的反应比较复杂,在同样条件下,一个化合物往往可以同时进行几个不同的反应,生成不同的产物。
有机物-历史“有机”这历史性名词,可追塑至19世纪,当时被认为有机化合物只能以生物经vis vitalis(life-force 生命力)合成。
此理论基于有机物与“无机”的基本分别,无机物是不会被生命力合成而来。
但后来这理论被推翻,Friedrich W?hler 以氰酸钾及硫酸铵合成尿素(一个有机物)。
一般而言,有机化合物定义为化合物中有碳氢键而无机化合物则没有。
因此碳酸(H2CO3)是无机化合物,但是蚁酸 (HCOOH 第一个脂肪酸)则是有机化合物。
有机物-分类按照碳链结合形式的不同,有机化合物基本可以分为:脂肪族化合物:(或开链族化合物):碳原子和碳原子之间形成一条开放的链,可以是直链也可以带支链;碳环族化合物:碳原子连接成环状脂环族:碳原子和碳原子之间形成一条封闭的环状链,也可以带支链;芳香族:碳原子和碳原子之间形成一条封闭的环状链,但各碳原子之间的结合是单键和双键互相交错的;杂环族:碳原子和碳原子之间形成一条封闭的环状链,但其中某些碳原子被其他元素的原子取代。
(完整版)大学有机化学知识点总结
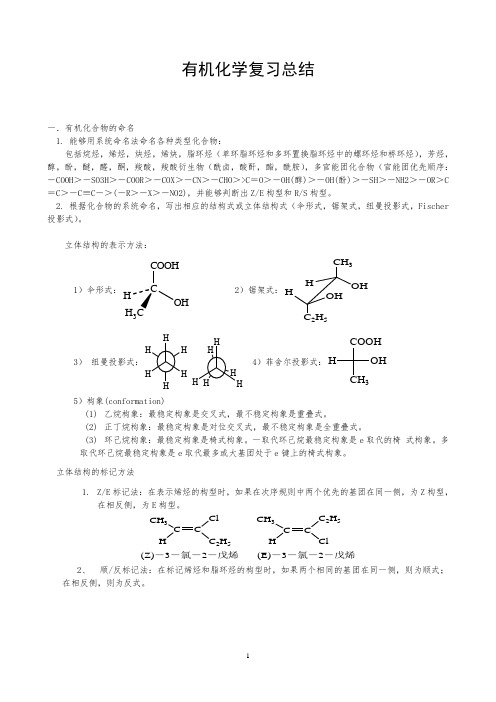
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3 2)锯架式:CH 3OH HHOH C 2H 53)纽曼投影式:H H 4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5CH 3C CH 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3C CHCH 3HCH 3CCH HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
有机热载体名词解释

有机化学:是研究有机化合物的组成、结构、性质、合成方法、应用以及变化规律的科学有机化合物:碳氢化合物及其衍生物的总称均裂:共价键断裂时,共用电子均等地分配给成键的两个原子的断键方式异裂:共用电子对完全转移给成键原子中的某个原子,形成了正、负离子的断键方式饱和烃:凡是分子结构中碳原子之间均以单键相互结合,其余碳价被氢原子所饱和的脂肪烃不饱和烃:分子中含有碳碳双键或碳碳三键的碳氢化合物自由基反应:通过化合物分子中的共价键均裂成自由基而进行的反应官能团:决定化合物主要性质的原子或原子团聚合反应:由单体合成聚合物的反应过程亲电反应:反应试剂很需要电子或“亲近”电子,容易与被反应的化合物中能供给电子的部分发生反应,由亲电试剂进攻而发生的反应石油炼制:是在热的作用下(不用催化剂)使重质油发生裂化反应,转变为裂化气(炼厂气的一种)、汽油、柴油的过程溶剂精制:利用某些溶剂对油品的理想组分和非理想组分或杂质的溶解度不同,选择性地从油品中除去非理想组分,从而改善油品的性质吸附精制:利用固体吸附剂如白土等对极性化合物有很强的吸附作用,脱除油品的颜色、气味,除掉油品中的水分、悬浮杂质、胶质、沥青质等极性物质加氢精制:是指在催化剂和氢气存在下,脱除油品中硫、氮、氧等杂原子及金属杂质,并使烯烃饱和,改善油品的使用性能蒸馏:指利用液体混合物中各组分挥发性的差异而将组分分离的传质过程分馏:分离几种不同沸点的挥发性成分的混合物的一种方法;混合物先在最低沸点下蒸馏:直到蒸气温度上升前将蒸馏液作为一种成分加以收集有机载体:作为传热介质使用的有机物质的统称矿物型有机热载体:是以石油为原料,利用经蒸馏和精制(溶剂精制和加氢精制)工艺得到的适当馏分生产的产品,其主要组分为烃类的混合物合成型有机热载体:以化学合成工艺生产的,具有一定化学结构和确定的化学名称的产品气相有机热载体:具有沸点或共沸点的合成型有机热载体可以在气相条件下使用液相有机热载体:具有一定馏程范围的合成型有机热载体和矿物油型有机热载体只能在液相条件下使用未使用有机热载体:特殊高热稳定性有机热载体:普通合成型有机热载体:在用有机热载体:开口闪点:用规定的开口闪点测定器所测得的结果,闪点就是可燃性液体或固体能放出足量的蒸气并在所用容器内的液体或固体表面处与空气组成可燃混合物的最低温度闭口闪点:酸值:残炭:初镏点:终镏点:镏程:低沸物:高沸物:自燃点:运动粘度:热稳定性:氧化安定性:倾点:铜片腐蚀:灰分:芳香烃:烷烃:不能蒸发产物:电位滴定:滴定曲线:突跃点:最高允许使用温度:最高工作温度:最高实际使用温度:液膜温度:最高允许液膜温度:最高设计液膜温度:系统回流温度:水溶性酸及碱:油品添加剂:化学污染:过热超温:氧化变质:开式循环系统:闭式循环系统:膨胀罐:有机热载体锅炉:液相有机热载体锅炉:气相有机热载体锅炉:强制循环有机热载体锅炉:自然循环有机热载体锅炉:有机热载体传热系统:气相有机热载体传热系统:液相有机热载体传热系统:有机热载体回收处理:显热:潜热:相变:有机热载安全流量:循环流量:最小流速:惰性气体覆盖:液封装置:热流密度:直接受火加热:间接加热:有机热载体变质物:。
大学有机化学课件

2、新理论、新概念日新月异。
1963年:[美] Pearson 提出软硬酸碱理论。 1965年:〔美〕Woodward & Hoffmann 提出
“分子轨道对称守恒原理”。
二十世纪70年代中期: 我国化学家蒋明谦提出 “同系线性规律”。
二十世纪80年代初: [美]赫尔顿(Herndon)提出“结构共振论, 使 得鲍林的共振论得以定量化。
(3) 许多有机化合物在常温下为气体 、液体 (4) 一般有机化合物的极性较弱或没有极性. (5) 有机物的反应多数不是离子反应,而是分子间的
反应.除自由基型反应外,大多数反应需要一定的时 间. (6) 有机反应往往不是单一反应.(主反应和副反应)
1.3 有机化合物中的共价键
碳元素:核外电子排布 1S22S22P2 , 不易获得或失去 价电子,易形成共价键。 (1) 路易斯结构式: 用共用电子的点来表示共价键的结 构式.
H—Cl
μ=1.03D
CH3—Cl
μ=1.87D
H—CC—H
μ=0
1.5 共价键的断裂--均裂与异裂 (1)均裂:
A:B A· B· + Cl : Cl (光照) Cl· Cl· + CH4 + Cl · CH3 · H : Cl +
定义:两个原子之间的共用电子对均匀分裂,两个原子各保留 一个电子的断裂方式.产生活泼的自由基(游离基).
+ NH4 CNO H2N C NH2
发现同分异构体现象!
inorganic
“我应当告诉您,我制出了尿素, 而且不求助于肾或动物-无论人或犬。 ” 既然你制出了尿素,那能不能在实验室 里“制造出一个小孩来”?
organic
大学有机化学知识点总结

有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3 2)锯架式:CH 3OH HHOH 2H 53)纽曼投影式:H H 4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5(Z)-3-氯-2-戊烯2、 顺/在相反侧,则为反式。
CH 3C CHCH 3HCH 3CCH HCH 3顺-2-丁烯反-2-丁烯顺-3、R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R构型,如果是逆时针,则为S构型。
aR型S型注:将伞状透视式与菲舍尔投影式互换的方法是:先按要求书写其透视式或投影式,然后分别标出其R/S 构型,如果两者构型相同,则为同一化合物,否则为其对映体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亲核反应有机反应的一类,电负性高的亲核基团向反应底物中的带正电的部分进攻而芳环上亲核取代反应历程使反应发生,这种反应为亲核反应。
与之相对的为亲电反应。
即在相互作用的两个体系之间,由于一个体系对另一个体系的原子核的吸引所引起的化学反应。
这些反应属于离子反应。
反应试剂在反应过程中,对与之相互作用的原子或体系给予或共享其电子对者,称为亲核试剂。
由亲核试剂如HO、:NR3、CN、H2N、…等与有机分子相互作用而发生的取代反应,称为亲核取代反应(SN)。
在亲核取代反应中,亲核试剂Nu 进攻被作用物中的饱和碳原子,取代此饱和碳原子上的一个原子团L芳环上亲核取代反应历程能量变化。
Nu供给碳原子一对电子,生成新的共价键,碳原子与L之间的共价键破裂,L带着一对电子离去:Nu:+RL─→NuR+:L式中R为烷基。
Nu:和L:都带有孤电子对,它们可以是负离子或中性分子。
由亲核试剂HCN、H2O、丙二酸二乙酯等与世轭不饱和醛或酮进行的加成反应称亲核加成反应。
例如共轭不饱和酮与HCN加成,形成氰酮:亲电反应electrophilic reaction亲电反应指缺电子(对电子有亲和力)的试剂进攻另一化合物电子云密度较高(富电子)区域引起的反应。
亲电反应属于离子型反应(ionic reaction)的一种,是有机化学的基本反应之一。
[1]在相互作用的两个体系之间,由于一个体系对另一个体系的电子的吸引所引起的化学反应。
这些反应属于离子反应。
反应试剂在反应过程中,从与之相互作用的原子或体系得到或共享电子对者,称为亲电试剂(E+)。
凡由亲电试剂如HNO3、H2SO4、Cl2、Br2等与有机分子相互作用而发生的取代反应,称为亲电取代反应(SE):E++RX─→RE+X+式中R为烷基。
上述类型的正离子取代反应属于SE类型反应。
例如,CH3:MgBr与溴反应时,溴分子的正电荷部分(相当于上式中的E+)与带着一对电子的甲基反应:CH3:|MgBr+Br+|:Br-─→CH3Br+MgBr2亲电反应在芳香族化合物亲电取代反应中,亲电试剂进攻芳香环,生成σ络合物,然后离去基团变成正离子离开,离去基团在多数情况下为质子:一般,第二步的速率比第一步高(k2》k1,k)。
由亲电试剂进攻所引起的加成反应称为亲电加成反应。
在没有光照和自由基引发的条件下,烯烃与卤素的加成反应是亲电加成反应,例如:CH3CH匉CH2+Br2─→CH3CHBrCH2Br反应在非极性溶剂中进行时,极性物质如极性容器壁,极性的溶质如氯化氢、水等都具有催化作用,使反应速率加快。
加成速率与烯烃的结构密切相关,双键连有给电子基团者加溴就快,连有吸电子基团者加溴就慢。
在大多数情况下,亲电加成反应是反式加成,加成中间体为溴桥正离子,反应是分步进行的:亲电反应编辑本段反应物亲电反应在亲电反应过程中,从与之相互作用的原子或体系得到或共享电子对的反应物,称为亲电试剂(electrophiles E);与亲电试剂作用的反应物称为亲核试剂(nucleophile Nu)。
最常见的亲电试剂是卤代烃(halohydrocarbon)和酰卤(acyl halide),亲电试剂是路易斯酸(Lewis acid),因而亲电试剂的亲电性与其酸性有关,一般而言,酸性强的亲电试剂亲电性强,但二者没有定量关系,特例也有不少。
纽曼投影式纽曼投影式是纽曼(Newman)于1995年提出来的。
它像锯架投影式一样,是表示相邻两个原子连接的原子或原子团之间的空间关系。
画这种投影式是把分子的立体模型(如乙烷)放在眼前,从C-C单键的延长线上去观察,用一个较大的圆圈(也可以不用圆圈)表示C-C单键上的碳原子,前后两个圆圈实际上是重叠的,故纸面上只能画出一个来。
圆圈前面的三个氢原子表示离眼睛较近碳原子上的三个氢原子,圆圈上面的三个氢原子表示离眼睛较远碳原子的三个氢原子。
前面和后面的三个C-H键之间的距离都是相等的,角距为120°。
这样所得乙烷的纽曼投影式如下:(Ⅷ)为乙烷的球棒模型。
由箭头指引的方向去观察得到纽曼投影式(Ⅸ)。
(Ⅹ)为简化的纽曼投影式,虚线表示后面碳原子上的C-H键。
分子轨道理论分子轨道理论是现代共价键理论的一个分支。
其与现代共价键理论的重要区别在于,分子轨道理论认为原子轨道组合成分子轨道,电子在分子轨道中填充、运动。
而现代共价键理论则讨论原子轨道,认为电子在原子轨道中运动。
2. 理论要点1) 分子轨道由原子轨道线性组合而成分子轨道的数目与参与组合的原子轨道数目相等。
H2中的两个 H 有两个1s,可组合成两个分子轨道。
两个s轨道只能只能“头对头”组合成σ分子轨道,MO和*MO, 能量总和与原来AO(2个)总和相等,σ*的能量比AO低,称为成键轨道,σ比AO高,称为反键轨道。
成键轨道在核间无节面,反键轨道有节面. 当原子沿 x 轴接近时,p x与 p x头对头组合成σP x和σP*x,同时p y和p y, p z和 p z分别肩并肩组合成π*p y , πp y和π*p z , πp z分子轨道,π轨道有通过两核连线的节面,σ轨道没有。
2) 线性组合三原则a) 对称性一致原则对核间连线呈相同的对称性的轨道可组合,除上述讲的 s-s,p-p 之外,还有:3) 分子磁学性质电子自旋产生磁场,分子中有不成对电子时,各单电子平行自旋,磁场加强。
这时物质呈顺磁性。
表现在外磁场中显磁性,在磁天平中增重。
若 s 和 p x沿 y 轴接近,对称不一致,不能组成分子轨道b) 能量相近原则H 1s -1312kJ/mol Na 3s - 496 kJ/mol Cl 3p -1251kJ/mol O 2p -1314 kJ/mol (以上数据按 I1值估算)左面 3 个轨道能量相近,彼此间均可组合, 形成分子, Na 3s 比左面 3 个轨道能量高许多,不能组合.(不形成共价键, 只为离子键) c) 最大重叠原理在对称性一致、能量相近的基础上,原子轨道重叠越大,越易形成分子轨道, 或说共价键越强. 3)分子轨道能级图分子轨道的能量与组成它的原子轨道能量相关,能量由低到高组成分子轨道能级图4)分子轨道中的电子排布分子中的所有电子属于整个的分子,在分子轨道中依能量由低到高的次序排布,同样遵循能量最低原理,保里原理和洪特规则。
3. 同核双原子分子1) 分子轨道能级图A图适用于 O2, F2分子, B图适用于N2, B2, C2等分子. 对于 N, B, C原子, 2s 和 2p 轨道间能量差小, 相互间排斥作用大, 形成分子轨道后, σ2s和σ2Px之间的排斥也大, 结果, 出现 B图中σ2Px的能级反比π2Py, π2Pz的能级高的现象. 2) 电子在分子轨道中的排布若分子中无成单电子时,电子自旋磁场抵消,物质显抗磁性(逆磁性或反磁性), 表现在于外磁场作用下出现诱导磁矩,与外磁场相排斥, 故使磁天平减重. 实验表明, 单质O2是顺磁性的. 用分子轨道理论解释,见 O2的分子轨道图和分子轨道式:按路易斯理论, 氧气分子电子构型为 :用路易斯理论,不能解释氧气分子无单电子. 用现代价键理论也解释不通, p x-p x成σ键,p y-p y成π键, 单电子全部成对, 形成共价键, 无单电子.分子轨道理论在解释O2的磁性上非常成功。
N2是抗磁性的. 4. 异核双原子分子电子只填充在成键轨道中, 能量比在原子轨道中低. 这个能量差, 就是分子轨道理论中化学键的本质. 可用键级表示分子中键的个数: 键级 = (成键电子数 - 反键电子数)/2 H2分子中, 键级 = (2 - 0)/2 = 1, 单键由于填充满了一对成键轨道和反键轨道,故分子的能量与原子单独存在时能量相等. 故 He2不存在,键级为零,He之间无化学键。
He2+的存在用价键理论不好解释,无两个单电子的成对问题。
但用分子轨道理论则认为有半键. 这是分子轨道理论较现代价键理论的成功之处。
非键轨道: 无对应的(能量相近, 对称性匹配)的原子轨道, 直接形成的分子轨道. 注意: 非键轨道是分子轨道, 不再属于提供的原子. H 的1s与 F的 1s, 2s 能量差大, 不能形成有效分子轨道. 所以F 的1s, 2s 仍保持原子轨道的能量, 对 HF 的形成不起作用, 称非键轨道, 分别为1σ和 2σ. 当 H 和 F 沿 x 轴接近时, H的 1s 和F 的 2p x对称性相同,能量相近 ( F 的 I1比 H 的 I1大, 故能量高), 组成一对分子轨道 3σ和4σ(反键), 而 2p y和 2p z由于对称性不符合, 也形成非键轨道, 即 1π和 2π.双烯合成反应双烯合成反应,也称为“狄尔斯(Diels)—阿德尔(Alder)反应” :共轭二烯烃和某些具有碳碳双键、三键的不饱和化合物进行1,4-加成,生成环状化合物的反应称为双烯合成反应。
获得1950年诺贝尔化学奖。
(1)双烯体是以顺式构象进行反应的,反应条件为光照或加热。
(2)双烯体(共轭二烯)可是连状,也可是环状。
如环戊二烯,环己二烯等。
(3)亲双烯体的双键碳原子上连有吸电子基团时,反应易进行。
常见的亲双烯体有:CH2=CH-CHO CH2=CH-COOH CH2=CH-COCH3 CH2=CH-NO2CH2=CH-CN CH2=CH-COOCH3 CH2=CH-CH2Cl(4)D-A反应的产量高,应用范围广是有机合成的重要方法之一,在理论上和生都占有重要的地位。
双烯合成反应既不是离子性反应,也不是自由基反应,而是不生成活性中间体且又一步完成的协同反应。
当双烯体2号位有推电子基,亲双烯体上有拉电子基,产物以两取代基处在1,4位为主;当双烯体1号位有推电子基,亲双烯体上有拉电子基,产物以两取代基处在邻位为主脂环烃alicyclic hydrocarbon具有脂肪族性质的环烃,分子中含有闭合的碳环,但不含苯环。
中文名称:旋光性英文名称:optical rotation;optical activity定义:当光通过含有某物质的溶液时,使经过此物质的偏振光平面发生旋转的现象。
可通过存在镜像形式的物质显示出来,这是由于物质内存在不对称碳原子或整个分子不对称的结果。
由于这种不对称性,物质对偏振光平面有不同的折射率,因此表现出向左或向右的旋光性。
利用旋光性可以对物质(如某些糖类)进行定性或定量分析。
离去基团leaving group离去基团(或称离去基)在化学反应中从一较大分子中脱离的原子或官能团,是亲核取代反应与消除反应中应用的术语。
在亲核取代反应中,被亲核试剂进攻的反应物称为底物(substrate),而从底物分子中带着一对电子断裂出去的原子或原子团称为离去基团,常用L表示。
