chapter02-吸附作用
植物生理学Chapter02 mineral nutrition

C→ CO2 ↑ O →H2O↑ →NOx ↑ H2S 、SO2↑
H、 N S→
灰分(灰分元素: 少量N,多数S ,全 部的金属元素和不 可挥发的非金属元 素共60余种)
• 灰分中的元素称灰分元素或矿质元素。
• 水生植物约占干重1%左右,
• 大部分陆生植物约为5-15%,
• 盐生植物高达45%以上;
系统行使第二信使功能。
Ca
Inactive
enzyme
Active CaM Inactive CaM Ca-CaM活化酶示意图
Active enzyme
Metabolic reaction
Physiological response
•
3) Ca takes part in photosynthesis。
• 砂基培养法(sand culture)
水培法和砂培法
• 注意事项:
• (1)选择合适的培养液;
• (2)定期更换培养液,调节pH;
• (3)通气;
• (4) 根系遮光。
• 应用:功能和吸收机制研究
•
大棚蔬菜、花卉甚至粮食生产。
Special techniques are used in nutritional studies
• Microelement (trace element微量元素)是 指植物需要量较少, 在植物体中含量较低 (<0.01%)的元素, Fe、Mn、B、Zn、Cu、 Mo、Cl、Ni。
Classification of nutrients according to biochemical function (Mengel and
Kirby,2001)
• Group 1 N and S.Nutrients are part of carbon compounds.
细胞膜的结构与功能

金属离子:主要是钙离子。
细胞膜结构模型
三、细胞膜的基本结构
目前细胞膜结构主要用Singer 和 Nicolson于1972年提出的流动镶嵌模型解释,下面我们以流动镶嵌模型为基础,总结细胞膜的结构的主要特征: 1. 脂类物质,主要是磷脂 构成生物膜的骨架,在膜中,磷脂以双分子层的形式存在,在双分子层中,磷脂的疏水基团(脂肪酸链),疏水基团向外。 2.生物膜中含有蛋白质,蛋白质有两种存在方式,一种吸附在脂类双层两侧,称为外在蛋白或周边蛋白,另一种镶嵌在脂类双层中,称为内在蛋白或整合蛋白,内在蛋白有的部分嵌入膜脂双层中,有的贯穿脂类双层。
3.膜中各种组分在膜上的分布是不对称的,具体表现在: (1) 膜脂分布的不对称性,脂质双层组成的不对称性。脂类双层的外层往往含有较多的磷脂酰胆碱(也称为卵磷脂),内层含磷脂酰乙醇胺(脑磷脂)和磷脂酰丝氨酸较多。 在脂类双层的不同区域所含有的脂类种类不完全相同,脂类两个单分子层中所含有的脂类的数量也不相同。 (2) 膜蛋白发布的不对称性: (3) 膜糖分布的不对称性,在质膜上主要分布在膜的外侧。
调节功能
调节细胞水势和维持细胞膨压 大多数植物细胞在生长时主要靠液泡大量地积累水分。中央液泡的出现使细胞与外界环境之间构成一个渗透系统,从而可调节细胞的吸水机能,维持细胞的挺度。
01
调节细胞的pH和离子稳态 液泡膜上存在的离子泵(proton pump,如H+-ATPase)可调节细胞内的pH和离子浓度,以维持细胞的正常代谢。
膜的流动性受很多因素的影响
膜的流动性受很多因素的影响 ① 脂肪酸种类的影响,含不饱和脂肪酸(亚油酸,亚麻酸)较多,流动性大,含饱和脂肪酸(软脂酸,硬脂酸)较多,流动性变小。 ② 蛋白质含量大流动性变小 ③ 胆固醇含量高,流动性变小。 ④ 缺少Ca2+,流动性变大 ⑤ 外界的温度 温度降低 温度升高 固态 液晶态 液态 流动性变小 流动性变大
经济学原理 曼昆Chapter_02_34902801

劳动,土地,资本
Wages, rent, and profit工资
of Production 生产要素市场
Income收入
13
、租金与利润
循环流向图
The Circular-Flow Diagram
企业Firms
生产和出售产品和服务Produce and sell goods and services
22
Cars Produced
坐标系中的双变量 Two Variables in the Coordinate System
• 理论预测变量之间的关系Theory predicts a causality relationship between variables
• 从数据中检验变量间的关系test the theory from data
20
Quantity of Computers Produced
4,000
3,000
2,100 2,000
The Production Possibiift in the production
possibilities frontier
生产可能性边界外移
对数据的经验(实证)分析 Empirical Analysis of Data
• How to present single variable data
圆形图Pie Chart 柱形图Bar Graph 时间序列图Time Series Graph
0
700 750 1,000
Quantity21of
假设应尽可能少 Fewer assumptions, the better
8
关于假设和结论 On Assumptions and Conclusions
《吸附法修改版》课件

总结词
利用吸附剂的吸附作用,将有机混合物中的一种或多种组分从混合物中分离出来,达到提纯的目的。
详细描述
吸附法在有机物分离与提纯中应用广泛,如利用活性炭、硅胶等吸附剂对有机混合物中的不同组分进行吸附,从而实现分离和提纯。该方法具有操作简便、分离效果好等优点。
VS
将催化剂负载在吸附剂上,提高催化剂的分散度和稳定性,从而提高催化反应的效率和选择性。
详细描述
在许多催化反应中,催化剂的分散度和稳定性对反应效果有很大影响。通过将催化剂负载在吸附剂上,可以有效地提高催化剂的分散度和稳定性,从而提高催化反应的效率和选择性。常见的催化剂载体有活性炭、硅胶、分子筛等。
总结词
利用吸附法实现药物的有效分离和纯化,提高药物的品质和产量。
在药物生产过程中,药物的分离和纯化是非常关键的环节。吸附法可以用于药物的分离和纯化,如利用特定的吸附剂将有效成分从复杂的药物混合物中分离出来,达到提高药物品质和产量的目的。该方法具有分离效果好、操作简便等优点。
吸附剂选择
针对不同废气成分和浓度,选择具有高吸附性能、耐热、耐腐蚀的吸附剂,以确保处理效果稳定可靠。
吸附剂再生
为了提高吸附剂的利用率和降低处理成本,可以采用热再生、化学再生等方法对吸附剂进行再生,延长其使用寿命。
废水处理
01
吸附法可用于处理工业废水中的重金属离子、有机污染物等有害物质。通过在废水中加入适量的吸附剂,如活性炭、树脂等,可以将有害物质吸附并从废水中分离出来,达到净化水质的目的。
总结词
利用吸附剂的吸附性能,实现煤层气的分离和提纯。
详细描述
煤层气是指煤层中蕴藏的天然气,其组分较为复杂,需要进行分离和提纯。吸附法利用吸附剂的吸附性能,将煤层气中的不同组分进行分离,从而实现煤层气的提纯和净化。这种方法具有较高的分离效率和较低的成本,是煤层气开发领域的重要技术手段。
吸附作用原理

吸附作用原理
吸附作用原理是一种物质分子间的相互作用现象,其机制主要包括物理吸附和化学吸附。
物理吸附是指物质分子在吸附位点附近形成松散的吸附层,吸附分子与吸附位点之间的相互作用主要通过范德华力实现。
这种作用力相对较弱,吸附分子与吸附位点间的结合较松散,吸附层易于移动和解吸。
物理吸附通常发生在低温和高压条件下。
化学吸附是指物质分子在吸附位点附近与表面原子或分子之间发生化学键结合,形成牢固的吸附层。
这种化学键结合是通过化学键的形成或断裂实现的,需要一定的能量。
化学吸附的吸附层附着力较强,不易移动和解吸。
化学吸附通常发生在高温和低压条件下。
吸附作用原理在很多领域有广泛应用。
在环境科学中,通过吸附作用可以去除水中的有机污染物、金属离子等。
在化工领域,吸附作用可以用于分离和提纯化工原料和产品。
在催化反应中,吸附作用是催化剂起作用的基础,通过吸附作用可以提高反应速率和选择性。
此外,吸附作用还在生命科学、材料科学等领域具有重要的应用价值。
总的来说,吸附作用原理是物质分子间相互作用的结果,物理吸附和化学吸附是其两种常见机制。
这些机制在各个领域中发挥着重要的作用,帮助人们解决不同的科学和工程问题。
血液吸附PPT课件

分类与应用
分类
血液吸附技术根据吸附剂的性质和应用可以分为不同的类型,如活性炭吸附、 树脂吸附、免疫吸附等。
应用
血液吸附技术在临床上广泛应用于治疗各种疾病,如急性中毒、脓毒症、免疫 性疾病等。
02 血液吸附技术的作用机制CHAPT来自R对炎症因子的吸附机制
炎症因子
在许多疾病过程中,体内会产生大量的炎症因子,如细胞因 子、急性反应蛋白等。这些炎症因子可能导致组织损伤和疾 病恶化。
与传统的透析相比,血液吸附技术对患者 的免疫系统影响较小,不易引起感染等并 发症。
缺点
01
02
03
04
成本高
血液吸附技术使用的灌流器通 常比透析器更昂贵,导致治疗
成本相对较高。
需要特殊设备
血液吸附技术需要特殊的设备 和仪器,这增加了治疗的难度
和成本。
可能引起过敏反应
部分患者可能对灌流器中的吸 附剂产生过敏反应,需要采取
吸附机制
血液吸附技术通过特定的吸附剂,能够有效地吸附血液中的 炎症因子。这种吸附作用可以迅速降低炎症因子的浓度,从 而减轻炎症反应,缓解病情。
对毒素的吸附机制
毒素
毒素是导致许多危重疾病的重要因素,如急性中毒、肝功能衰竭等。这些毒素可 能干扰正常的生理功能,导致严重的病理变化。
吸附机制
血液吸附技术利用对毒素的高亲和力吸附剂,能够有效地清除血液中的毒素。这 种清除作用可以迅速降低毒素浓度,减轻其对身体的损害。
血液吸附ppt课件
目录
CONTENTS
• 血液吸附技术概述 • 血液吸附技术的作用机制 • 血液吸附技术在临床的应用 • 血液吸附技术的优缺点及前景展望 • 血液吸附技术的研究进展
01 血液吸附技术概述
人体解剖学课件之呼吸道

气管与支气管的疾病
支气管炎
支气管炎是指气管、支气管粘膜及其周围组织的慢性非特异性炎 症,常继发于上呼吸道感染。
支气管扩张
支气管扩张是指支气管持久性扩张并伴有支气管壁结构破坏的疾病 ,常表现为慢性咳嗽、咳大量脓痰和反复咯血。
支气管哮喘
支气管哮喘是一种慢性气道炎症性疾病,以气道高反应性为特征, 表现为反复发作的喘息、气急、胸闷或咳嗽等症状。
人体解剖学课件之呼吸 道
CONTENTS
目录
• 呼吸道概述 • 鼻腔 •喉 • 气管与支气管 •肺
CHAPTER
01
呼吸道概述
呼吸道的定义
呼吸道是人体与外界环境进行气体交 换的通道,由鼻腔、喉、气管和各级 支气管组成。
呼吸道是人体的重要器官之一,负责 吸入氧气并排出二氧化碳,以维持生 命活动。
THANKS
感谢观看
清洁功能
共鸣功能
鼻毛能够过滤吸入的空气,减少灰尘和细 菌进入呼吸道,同时黏液也能吸附进入呼 吸道的灰尘和细菌,形成鼻涕排出体外。
鼻腔内部还有鼻窦,能够增加共鸣,提高 语音质量。
鼻腔的疾病
鼻炎
鼻炎是鼻腔内炎症的总称,包括过敏性鼻炎、慢 性鼻炎等。症状包括鼻塞、流涕、打喷嚏等。
鼻窦炎
鼻窦炎是指鼻窦内的炎症,通常由感冒或其他感 染引起。症状包括头痛、鼻塞、流脓鼻涕等。
呼吸道的功能
01
02
03
气体交换
呼吸道的主要功能是进行 气体交换,吸入氧气并排 出二氧化碳。
过滤和清洁
呼吸道具有过滤和清洁功 能,能够阻挡和清除进入 呼吸道的尘埃、细菌和其 他微粒。
调节温度和湿度
呼吸道能够调节吸入气体 的温度和湿度,以适应人 体的生理需求。
《神奇的磁铁》PPT课件大班科学

使用磁铁时,应注意保持环境 干燥,避免潮湿环境导致磁铁
氧化或失效。
不要将磁铁与易被磁化的物品 (如银行卡、电脑硬盘等)放
在一起,以免造成损坏。
若发现磁铁有破损或性能下降 等情况,应及时更换新的磁铁
。
06 总结与反思
CHAPTER
回顾本次课程重点内容
磁铁的基本性质
01
包括磁铁的吸引和排斥作用,以及磁铁的两极性质。
永磁材料
如铁氧体、钕铁硼等,具 有较高的剩磁和矫顽力, 用于制造永久磁铁。
软磁材料
如纯铁、硅钢等,磁导率 高,易于磁化和退磁,用 于制造电磁铁芯、变压器 铁芯等。
功能性磁性材料
如磁致伸缩材料、磁光材 料等,具有特殊的磁学效 应,应用于传感器、光通 信等领域。
磁悬浮列车技术简介
磁悬浮列车原理
利用磁场排斥力使列车悬浮于轨道之上,并通过 线性电机驱动列车运行。
04 磁铁应用拓展
CHAPTER
电磁铁原理及应用
01
02
03
电磁铁工作原理
通过电流在导线中产生磁 场,使铁芯磁化,实现吸 引或排斥功能。
电磁铁的应用
广泛应用于电器开关、电 动机、扬声器等领域。
电磁铁的优缺点
具有远程控制、易于实现 自动化等优点;但存在能 耗较高、易发热等缺点。
磁性材料种类及特点
磁化现象解释
磁化定义
磁化是指原来没有磁性的物体获 得磁性的过程。
磁化原理
磁化是由于物体内部的微小磁畴 在外磁场的作用下重新排列,使
得物体对外显示出磁性。
磁化分类
根据磁化后物体磁性的不同,磁 化可分为软磁化和硬磁化。软磁 化物体在去掉外磁场后磁性迅速 消失,而硬磁化物体则能长时间
Lecture-Chapter-02

态函数的数学表述
对于与态函数改变量相对应的恰当微分 dF: 定积分
12
dF
A
B
与A,B间的路径无关
即热力学量的改变量与变化 过程和途径无关
闭路积分
dF 0
即热力学量在系统经过变化 但又回到原点后没有变化
系统的变化过程
过程:系统从一个状态到另一个状态的途径
热力学量的改变量与变化过程无关 可能的过程:无限 如何计算热力学量的改变 ??? 设计简单的可逆过程来计算热力学量的变化: • 等温过程(Isothermal) • 等压过程(Isobaric) • 等容过程(Isochoric) • 绝热过程(Adiabatic) • … 可逆过程(Reversible):过程中系统保持热力学平衡
22
热
功
•
我们可以通过加热和做功来改变系统的能量!!!
热力学第一定律
• 对一个封闭系统,我们可以通 过加热和做功来改变系统的能 量!!!
23
•
人们很早就认识到热和功都能 改变系统的内能,但直到大约 1850年左右,才由Joule和 Kelvin (当时是Thomson)给出 了热力学第一定律的定量方程:
17
第二章 热力学第一定律
一些基本概念 (2.1-2.3, 2.5) 热力学第一定律 (2.4) • 焓 (2.6) • 热容 (2.7) • Joule 实验与绝热过程 (2.8) • Carnot循环 (2.9) • Joule-Thomson实验 (2.10) • 热化学与热效应 (2.11-2.13) • Kirchhoff定律 (2.14) • 绝热过程(2.15)
变化过程 Process #1
平衡态 #1
10
chapter-02MAXWELL方程
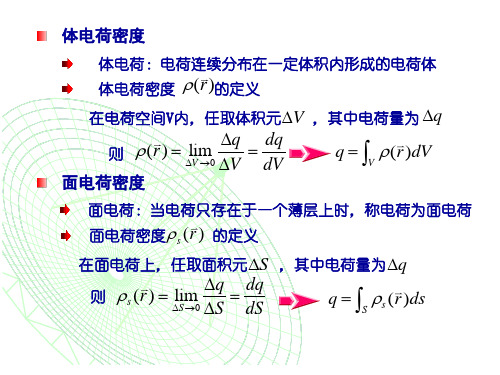
如图,设P为空间中的任意点,过P 取面积元dS。
i di
J
en
lim
S 0
S
en
dS
i
J • dS
S
dS P
方向:正电荷运动的方向
物理意义:
➢单位时间内通过垂直电流传播方向单位面积的电荷量
➢反映空间各点电流流动的物理量,形成一个空间矢量场
➢一般是时间t的函数,即J J(r , t)。恒定电流是特殊情况
实验证明:电场中电荷q0所受的电场力大小与自身所带电量成 正比,与电荷所在位置电场强度大小成正比,即
F
q0q
4 0 R 2
eR
q0q
4 0 R3
R
F E lim
q q0 0 0
对电场强度的进一步讨论
电场强度是单位点电荷受到的电场力,只与产生电场的电荷有关
对静电场和时变电场上式均成立
点电荷产生的电场
I2d l2
I1d l1 R12
C1
R132
再在C2上对上式积分,即得到回路C1对回路C2的作用力
式中: R R
R r2 r1
O
0 为真空中介电常数。0 4 107 H / m
讨论:dF12 ≠-dF21,这与库存仑定律不同。这是因为孤立的稳
恒电流元根本不存在,仅仅是数学上的表示方法而已
两个电流环的相互作用力
在回路C1上式积分,得到回路C1作用在电流元I2dl2上的力
dFC12
0 4
库仑定律内容:如图,电荷q1对
电荷q2的作用力为:
F12
q1q2
4 0 R 2
eR
q1q2
4 0 R3
R
《生物与环境组成生态系统》ppt课件

推广生态农业技术,减少化肥和农药的使 用,提高农产品质量,同时保护土壤和水 资源。
生态系统的可持续发展策略
绿色发展
推动绿色发展方式,促进经济、社会和环境的协调发展,实现经济效 益和生态效益的双赢。
低碳生活
倡导低碳生活方式,减少能源消耗和碳排放,降低对生态系统的压力 。
公众参与
加强公众教育和宣传,提高公众的环保意识和参与度,形成全社会共 同关注和参与生态保护的良好氛围。
如森林中树种的传播和繁殖需要依赖鸟类的传播。
意义
生态系统中的信息传递对于生物体的生存和繁衍具有重要意义。在自然界中,许多生物 需要通过信息传递来寻找食物、避免危险和繁殖后代。同时,信息传递也是生态系统平
衡和稳定的重要保障,对于保护生态系统和维护人类生存环境具有重要意义。
06
CHAPTER
生态系统保护与可持续发展
能量流动是指生态系统中能量输入、传递、转化和丧失的过程。
特点
单向流动、逐级递减、传递效率低。
能量流动的过程与途径
过程
生产者通过光合作用或化能作用将太 阳能转化为化学能,消费者通过摄食 获得能量,分解者通过分解有机物获 得能量。
途径
食物链和食物网是能量流动的途径, 食物链是指生态系统中各生物之间由 于摄食关系形成的结构,食物网是由 多个食物链相互交织形成的复杂结构 。
途径
信息传递的途径包括直接传递和间接传递。 直接传递是指信息发送者直接将信息传递给 接收者,如声音、肢体语言等;间接传递是 指信息发送者通过中介体将信息传递给接收
者,如通过蜜蜂传递花粉的信息。
信息传递的作用与意义
作用
生态系统中的信息传递在多个方面发挥着重要作用。首先,信息传递有助于生物体适应 环境,如蜜蜂通过采集花粉获得食物来源的信息;其次,信息传递有助于调节种间关系 ,如捕食者和被捕食者之间的相互调节;最后,信息传递还有助于维持生态系统平衡,
2024版傅献彩物理化学电子教案课件

01绪论Chapter物理化学概述物理化学的定义01物理化学的研究范围02物理化学在化学科学中的地位03物理化学的研究对象与任务研究对象研究任务实验方法通过实验手段观测和记录物质的物理现象和化学变化,获取实验数据。
理论方法运用数学、物理学等理论工具对实验数据进行处理和分析,揭示物质的基本规律。
计算方法利用计算机模拟和计算等方法,对物质的性质、结构和变化规律进行预测和研究。
物理化学的研究方法030201物理化学的学习方法与要求学习方法学习要求02热力学基础Chapter热力学基本概念与术语热力学系统状态与状态函数过程与途径热力学平衡态热力学第一定律能量守恒定律能量不能创造也不能消灭,只能从一种形式转化为另一种形式。
热力学能系统内能的变化等于传入系统的热量与外界对系统做功之和。
焓定义为系统的热力学能与体积的乘积,用于描述等压过程中的能量变化。
热力学第二定律热力学第二定律表述热力学温标熵增原理热力学函数与基本方程热力学函数热力学基本方程麦克斯韦关系式热力学在化学中的应用化学反应的热效应化学平衡相平衡03化学动力学基础Chapter化学反应速率的概念与表示方法化学反应速率表示方法摩尔浓度变化率、质量浓度变化率、气体分压变化率等化学反应速率理论简介碰撞理论过渡态理论01020304浓度越高,反应速率越快。
反应物浓度温度越高,反应速率越快。
温度催化剂可以降低反应的活化能,从而加快反应速率。
催化剂对于有气体参与的反应,压力的变化会影响反应速率。
压力影响化学反应速率的因素复杂反应动力学简介平行反应竞争反应连续反应根据反应条件(如温度、压力、浓度等)预测反应的速率。
预测反应速率通过调整反应条件(如温度、压力、催化剂等)来优化反应速率和选择性。
优化反应条件通过分析反应速率与各种因素的关系,可以推断出反应的机理和过渡态的性质。
研究反应机理化学反应速率理论的应用04电化学基础Chapter电化学基本概念与术语电化学电极电解质电离电导率将化学能转变为电能的装置。
《TLC点板教程》课件

CONTENTS 目录
• TLC点板基础知识 • TLC点板实验操作 • TLC点板数据处理 • TLC点板实验安全与注意事项 • TLC点板实验案例分析
CHAPTER 01
TLC点板基础知识
TLC点板定义
01 02
TLC点板定义
TLC点板技术是一种通过薄层色谱法进行分离和检测物质的方法。它通 过将样品涂布在玻璃板或塑料板上,然后用适当的溶剂进行展开,以达 到分离和检测的目的。
案例一:TLC点板在药物分离中的应用
总结词:应用广泛
详细描述:TLC点板技术在药物分离纯化中应用广泛,适用 于多种类型的化合物,如生物碱、黄酮、皂苷等,为药物研 发和质量控制提供有力支持。
案例二:TLC点板在食品检测中的应用
总结词:食品安全
详细描述:TLC点板技术可用于食品安 全检测,对食品中的添加剂、农药残 留、重金属等进行分离和鉴定,确保 食品质量和安全。
案例三:TLC点板在环境监测中的应用
总结词:广泛应用
VS
详细描述:TLC点板技术在环境监测 中应用广泛,适用于多种环境样品和 监测项目,为环境保护和治理提供有 力支持。
药物分析
TLC点板技术可用于药物分析领 域,如抗生素、维生素、激素 等药物的分离和检测。
食品添加剂分析
TLC点板技术可用于食品添加剂 分析领域,如色素、防腐剂、 抗氧化剂等食品添加剂的分离 和检测。
环境污染物分析
TLC点板技术还可用于环境污染 物分析领域,如农药、重金属 等污染物的分离和检测。
CHAPTER 02
案例二:TLC点板在食品检测中的应用
总结词:广泛应用
详细描述:TLC点板技术在食品检测中应用广泛,适用于 多种食品类型和检测项目,为食品安全监管提供有力支持 。
吸附等温线剖析课件

吸附剂性质的影响
01
02
03
04
比表面积越大:吸附量越大
孔径分布:影响吸附质的吸附 量
孔容:影响吸附质的吸附量
表面化学性质:影响吸附质的 吸附选择性
吸附质性质的影响
分子极性:影响吸附量 分子形状:影响吸附量
分子大小:影响吸附量 分子间的相互作用力:影响吸附量
吸附等温线剖析课件
等温线的测定方法 • 吸附等温线的解析方法 • 吸附等温线的影响因素 • 吸附等温线的应用实例
01
CHAPTER
吸附等温线概述
定义与分类
定义
吸附等温线是指在一定温度下, 吸附剂对气体分子的吸附量与气 体压力之间的关系曲线。
分类
根据吸附剂的特性和吸附机理, 吸附等温线可分为微孔吸附和表 面吸附等温线。
BET模型可以预测比表面积、孔径分 布和孔体积等参数,对于研究多孔材 料的吸附性能和表面积具有重要意义 。
BET模型假设表面存在多个不同的吸 附位,可以同时吸附多层分子。
Halsey模型
Halsey模型是一种经验模型, 用于描述非均匀表面上的吸附 行为。
该模型假设表面存在不同类型 的活性位点,具有不同的吸附 常数和容量。
在催化剂研究中的应用
总结词
催化剂研究是吸附等温线的又一重要应 用领域,通过吸附等温线可以研究催化 剂的表面性质和活性组分,进而实现催 化剂的优化和改性。
VS
详细描述
吸附等温线可以揭示催化剂表面活性位的 数量和性质,从而为催化剂的制备和改性 提供理论指导。通过调整催化剂的表面性 质,可以提高催化剂的活性和选择性。例 如,在石油工业中利用分子筛作为催化剂 进行烃类选择性氧化反应,就是基于吸附 等温线的应用。
Chapter02-1 海洋化学

2013-11-17
18
§2-1 海洋的形成和海水化学组成的演化 三、海水化学成分的演化
在星际聚集能和核素衰变能作用下,地 球内部温度升高导致内部物质分异,一 方面形成壳、幔、核,一方面形成大气 与水圈。
46亿年前由原始星云形成。 高温、雷电、辐射线多,大 气以水蒸气、氢、硫化氢、 甲烷等为主,没有生物。
2013-11-17
15
2013-11-17
16
●经脱气作用,地球内部挥发性物质 包括水蒸气、二氧化碳、氯、氮、氩 和氢气逸出地球表面。 ●逸出物质形成含水蒸气云的大气, 含有二氧化碳、甲烷、氨、硫化氢等。 ●随着地球冷却,水蒸气凝聚降落到 地球表面,汇聚成原始海洋。
H2S等气体(何以得知?),致使大气圈和水圈均呈强酸性和
还原性,早期地表冷凝出来的水必定是酸性的,pH值约为0.3, 温度也较高。
2013-11-17
20
§2-1 海洋的形成和海水化学组成的演化 三、海水化学成分的演化
2. 原始海水为什么是还原性的?
缺氧的证据主要有:
①20亿年以前的碳酸盐是很少见的,这个时代的碳质沉积主要以 石墨和油母岩的形式出现,证明当时缺少游离氧; ②18~20亿年以前的沉积岩中有许多易氧化矿物的碎屑,如黄铁 矿和沥青铀矿的碎屑等; ③距今32~20亿年的古老地层中广泛出现沉积韵律清晰的条带状 铁矿,它们是从水体中沉淀出来的化学沉积物。
蛋白质的基本机构和功能

壹
贰
物理因素
叁
高温、高压、紫外线、电离辐射、超声波等。
肆
化学因素
伍
强酸、强碱、有机溶剂、尿素、重金属盐等。
生物学活性丧失
01
溶解度降低,易于沉淀
02
粘度增加
03
结晶能力消失
04
易被蛋白酶水解
05
变性蛋白质的特点
大多数蛋白质变性后,空间构象严重破坏,不能恢复其天然状态,称为不可逆性变性;若蛋白质变性程度较轻,去除变性因素,有些可恢复其天然构象和生物活性,称为蛋白质的复性。
2
由一条多肽链形成的蛋白质其最高级结构为三
级,具有三级结构的蛋白质才具有生物学活性。 形成蛋白质的四级结构至少要有两条多肽链。 两条或两条以上的多肽链靠共价键连接的蛋白质没有四级结构。 由一条多肽链形成的蛋白质与亚基不同。
01
02
蛋白质结构中应注意的几个问题
01
02
白质一级结构与功能的关系
一级结构决定蛋白质的空间结构; 一级结构决定蛋白质的生物学功能。
PART 01
第一节 蛋白质的分子组成
一、蛋白质的元素组成
C 50~55% H 6~7% O 19~24% N 13~19% S 0~4% 有些蛋白质还含有P、Fe、Cu、Mn、Zn、Se等。 各种蛋白质含氮量接近,平均为16%;样品测定中1克氮相当于含6.25克蛋白质(凯氏定氮法) 。
Imino, Circular
Basic
Sulfur
Hydroxy
Aromatic
-C-C-C-N-C-N N+
=
C -C-C-C
C -C-C-C
C C -C
C C C HN C-COOH a
Chapter_02_review

Cell wall - The cell wall is a rigid structure composed of peptidoglycan that maintains the characteristic shape of the cell. • permeable to small molecules (<15,000)
• Problematic because can reduce availability of nitrogen to plants and hence limit CO2 fixation. Also may contribute significantly to the global production of nitrous oxide一氧化二氮.
Fig. 2.12
Gram negative
Membrane proteins Lipids Gram positive
How does the cell membrane fit into the cell envelope?
Cells can have flagella that allow them to move over short distances (um) either toward nutrients or away from inhibitory substances. Cells can have fimbriae that aid in attachment of cells to surfaces.
Lipoteichoic acid Teichoic acid Porins Lipopolysaccharide
Outer membrane Peptidoglycan
界面吸附过程热力学教学全解课件

低系统的总能量和熵值。
03
表面张力
表面张力是液体表面的一种物理性质,表示液体表面收缩的趋势。在界
面吸附过程中,表面张力会影响物质在界面上的吸附量和分布状态。
界面吸附热力学的应用
工业生产
界面吸附热力学在工业生产中有着广泛的应用,如石油工业中的油水分离、化学工业中的 气体吸收和液体萃取等。通过了解界面吸附热力学规律,可以优化生产工艺和提高产品质 量。
微分法
通过求解吸附动力学方 程的微分形式,得到吸
附量与时间的关系。
积分法
通过求解吸附动力学方 程的积分形式,得到吸
附量与时间的关系。
迭代法
通过不断迭代求解吸附 动力学方程,得到吸附
量与时间的关系。
数值解法
通过数值计算方法求解 吸附动力学方程,得到 吸附量与时间的关系。
05
CHAPTER
界面吸附过程的实验研究方 法
实施模拟计算方法需要遵循一定 的步骤,包括建立模型、设置参 数、运行模拟和结果分析等。
在结果分析时,需要运用统计方 法和技术,对模拟结果进行深入 分析和解释。
THANKS
谢谢
热力学第三定律
内容
热力学第三定律表述为绝对零度不能达到原理,即在一个封闭系统中,绝对零 度是不可能达到的最低温度。
应用
在界面吸附过程中,热力学第三定律指导我们理解物质吸附和解吸过程中的相 变现象,以及如何通过调控温度实现高效的吸附和解吸过程。
03
CHAPTER
界面吸附热力学
界面吸附热力学的定义与基本概念
实验研究方法的优缺点
每种实验研究方法都有其独特的优缺点,选择合适的实验方法需要考虑研究目的、实验 条件和资源等因素。
实验研究方法的分类与选择
血液灌流PPT课件

目录
CONTENTS
• 血液灌流简介 • 血液灌流原理 • 血液灌流的临床应用 • 血液灌流的并发症及处理 • 血液灌流的未来发展与展望
01 血液灌流简介
CHAPTER
定义与作用
定义
血液灌流是一种将患者的血液引入装有固态吸附剂的灌流器中,通过吸附作用 清除血液中的内源性或外源性毒素、药物、重金属等物质的血液净化技术。
急性中毒是血液灌流的重要应用领域之 一。通过灌流器中的吸附剂,可以快速 清除体内毒素,减轻中毒症状,为后续
治疗争取时间。
针对不同毒物,选择合适的灌流器,如 血液灌流在急性中毒救治中具有疗效显 活性炭灌流器适用于脂溶性毒物、大分 著、起效快等优点,尤其对于某些难以 子毒物等的吸附,而树脂灌流器则适用 通过常规手段清除的毒素,如药物、生
需要注意的是,血液灌流在治疗脓毒症时需根据患者具体情况选择合适的治疗时机和方案, 避免延误治疗。
其他临床应用
除了上述应用领域外,血液灌流还可用于治疗其他一些临床疾病,如自身免疫性疾 病、中毒性肾病、严重烧伤等。
在这些疾病的治疗中,血液灌流通过清除体内异常物质、调节免疫功能、减轻炎症 反应等作用机制,有助于缓解病情、改善预后。
提高患者生存率。
在治疗过程中,需密切监测患者肝功能、血氨水平等指标,及时调整治 疗方案,确保治疗效果。
脓毒症的治疗
脓毒症是由感染引起的全身炎症反应综合征,可导致多器官功能衰竭。血液灌流可以通过吸 附炎症介质、清除内毒素等作用,减轻全身炎症反应。
在脓毒症的治疗中,血液灌流可以作为辅助治疗手段,与抗生素、免疫调节药物等联合应用, 提高治疗效果。同时,对于某些难以控制的感染,如真菌感染、病毒感染等,血液灌流也有 一定疗效。
真空中的运动研究物体在真空中的运动行为

根据轨迹数据计算物体的速度、加速度等运动参数,进一步分析物体 在真空中的运动特性。
实验结果展示和讨论
实验结果展示
通过图表等形式展示实验结果,包括物体的运动轨迹图、速度-时间曲线、加速度-时间 曲线等。
结果讨论
根据实验结果,分析物体在真空中的运动行为,如是否存在空气阻力对运动的影响、物 体的运动是否遵循牛顿运动定律等。同时,将实验结果与理论预测进行比较,验证相关
环境。
吸附法
利用吸附剂(如活性炭 、硅胶等)对气体分子 的吸附作用,将气体分 子从容器中去除,从而 创建真空环境。这种方 法适用于对抽气速度要
求不高的情况。
CHAPTER 02
物体在真空中的运动规律
牛顿运动定律在真空中的应用
第一定律(惯性定律)
01
在真空中,一个不受外力的物体会保持其静止或匀速直线运动
角动量定义及其守恒原理
角动量定义
物体绕某点旋转时所具有的动量 ,等于物体质量与其到旋转中心 的距离平方和旋转角速度的乘积 。
角动量守恒原理
在没有外力矩作用的情况下,物 体绕某点旋转的角动量是守恒的 ,即角动量的大小和方向保持不 变。
角动量守恒的应用
利用角动量守恒原理可以解释和 预测许多自然现象和工程问题, 如陀螺仪的稳定性、天体运动的 规律等。
物体在真空中的自由落体运动
自由落体运动的定义
在真空中,一个只受重力作用的物体会以恒定的加速度进行直线 运动。
自由落体运动的加速度
在地球表面附近,自由落体运动的加速度约为9.8 m/s²,方向竖直 向下。
自由落体运动的规律
物体下落的高度与时间平方成正比,速度与时间成正比。
CHAPTER 03
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、化学吸附的分子轨道图 把金属-吸附质体系作为“表面分子”,其分子轨道由金属和 吸附分子轨道组成。 单原子的吸附 (a)强化学吸附键
(b)弱化学吸附键
(c)不能成键, 原子离开表面
原子在d-金属上化学吸附的简化轨道示意图
双原子分子的化学吸附
双原子分子(H2)在d-金属上化学吸附的轨道示意图
1)由HOMO组合新的分子轨道。 2)对LUMO做相同的处理。 3)观察这些轨道相对于金属Fermi能级的位置,并且找出哪 一个轨道被填充及填充的程度
脱附(desorption): 固体表面气体浓度的减小。 脱附过程:气体在表面上的浓度减小的过程。
体相原子配位数:12
表面原子配位数:9 面心立方最密堆积(FCC)
3 fold site 三重吸附位 桥位
4 fold site 四重吸附位
顶位
表面的吸附位
二、物理吸附(physisorption)与 化学吸附(chemisorption)
两个规律:
1、占有的分子轨道和占有的表面轨道之间的相互作用原 则上产生一个排斥作用。因为成键和反键的化学吸附轨道 两者都将使占据的。然而,如果反键轨道落在Fermi能级 轨道之上,这种排斥作用将会部分或者全部的被解除(如 CO在Rh金属上5轨道的相互作用)。 2、产生成键轨道的相互作用,它可能出现在Fermi能级之 上或之下。由于吸附分子所参与的LUMO轨道相对于分子 的原子间的相互作用是反键的,相应轨道的占据将导致分 子的解离。如果是部分的占据,则对分子和表面间的成键 贡献小,同时化学吸附分子内所涉及原子的相互作用减弱 (如CO在大多数VIII族金属上2*轨道的情况)。
t=0.17s
上:STM 图像(恒高模 式):0.09 ML O/Ru(0001)。T=300 K。 下:相应STM图像中氧原 子的位置。右下角示意图 中亮颜色点对应于位置发 生改变的氧原子。
From Wintterlin et al., Surface Science 394 (1997) 159.
CH2 M
CH2 M
CH2
CH2 M
CH2 M
烯丙基
烯丙基
协同式机理
丙烯在催化剂表面的吸附态
六、吸附粒子在表面上的运动 在平衡位置上垂直于表面方向的振动,以及在各吸附中心之 间的移动
均匀表面的位能变化
非均匀表面的位能变化
定位吸附:Eb>>RT,吸附粒子只能在势阱底附近作振动。 非定位吸附: EbRT,吸附粒子可直接在各吸附中心之间转 移。此时的吸附层可成为动态吸附层--更符合实际多相催化反 应的状况。
CO
CO2 NH3 C2H4
640
682 703 577 552 456 301 427 339 372 222
192
225 188 286
176
146 184 155 243 209
三、吸附位能曲线 物理吸附位能变化:通常用Lennard-Jones曲线来描述
A2分子在固体表面S上的物理吸附位能曲线
金属及其结构的多样性导致吸附态的多样性。
氢在W不同晶面上的程序升温脱附谱
*解离的氢原子能够溶入金属体相生成体相氢原子甚至氢化物。 2、氢分子在金属氧化物上发生化学吸附时,常常发生H-H键 不均匀断裂,例如,氢在氧化锌上的化学吸附,通常形成两 种表面吸附物种,这种断裂简称为异裂。
H
H
Zn2+ O
OH=3489 cm-1 Zn-H=1709 cm-1
CO吸附速率:Pt(110)> AgPt Interface >> Ag
240 a: CO + O(a) reaction 200
PCO=5.010-7 mbar
PCO =2.0*10-6mbar Ag
PCO=2.010-6 mbar
五、吸附态和吸附化学键 吸附物种/吸附态决定催化反应的最终产物,即催化剂的选择性。 5.1 氢的吸附:通常是解离吸附(dissociative adsorption) 1、氢分子在金属上吸附时,H-H键均匀断裂,即均裂,形成 两个氢原子的吸附物种。 H H2 + M M M H M 或 H M H M
第二章 吸附作用
[主要内容]
• • • • • • • • • • 概述 物理吸附和化学吸附 吸附位能曲线 化学吸附的分子轨道图 吸附态和吸附化学键 吸附粒子在表面上的运动 溢流效应 吸附热 吸附速率和脱附速率 吸附平衡
[目的要求] [重点难点]
第二章 吸附作用
一、概述 在气固多相催化反应过程中,都包含吸附步骤,至少有一种反 应物参与吸附过程。多相催化反应的机理与吸附的机理不可分 割。
化学吸附 吸附作用 吸附质分子和吸附中心之 间化学键的形成 物理吸附 分子间作用力,如永久性偶 极矩,诱导性偶极矩,四极吸引 作用等
吸附热
吸附速率
>80 kJ/mol
活化吸附,吸附速率慢
0-40 kJ/mol
非活化吸附,吸附速率快
脱附活化能 发生温度 选择性
吸附层 可逆性
化学吸附热 高温(>气体的液化点) 有选择性,与吸附质,吸附 剂本质有关
Langmuir-Hinshelwood Mechanism
Eley-Rideal Mechanism
固体表面(surface)原子与体相(bulk)原子的最大区别: 表面原子配位不饱和,从而表现出高的化学反应活性。 吸附(adsorption):气体在固体表面的累积。 吸收(absorption):体相的吸附。 吸附剂(adsorbent):吸附气体的固体物质。 吸附质(adsorbate):被吸附的气体。 吸附态:吸附质在表面吸附以后的状态。 吸附中心/吸附位:吸附剂表面发生吸附的局部位置。 吸附过程:固体表面上的气体浓度由于吸附而增加的过程。
七、溢流效应 (spillover effect) 溢流:在一个相(给体相)表面上吸附或产生的活性物种向另 一个在同样条件下不能吸附或产生该活性物种的相(受体相) 表面上迁移的过程。 溢流可以发生在金属-氧化物、金属-金属、氧化物-氧化物和氧 化物-金属各体系中。 目前发现的可能产生溢流的物种有H2、CO、O2和NCO。
5.2 氧的吸附:分子形式吸附的缔合吸附(associative adsorption),解离吸附,表面氧化物 氧在金属催化剂上缔合吸附的两种主要结构:
1)金属原子垂直于氧的O-O轴, 氧的占据轨道与金属原子的一个 空d轨道键合(图A)。 2)金属原子靠近一个氧原子(图 B)。氧原子的孤对电子轨道与金 属空d轨道成键,同时金属完全占 据的d轨道又可以将电子填充到O2 的空反键*轨道中去。这样稳定了 M-O键和削弱了O-O键。
氢溢流对催化剂稳定性的影响 (1)除表面积碳;(2)暴露 微镜直接观察Ag/Pt(110)双金属表面上的溢流过程
240 220 200 180 160 140 120 100 80 60 40 20 P =5.0x 10 mbar T =480K a b c
intensity (a.u.)
0s
4s
8s
16 s
1.0
0
50
100
150
200
250
300
350
time (s)
P =5.0x10 mbar T =480K a b c
norm alized intensity (a.u.)
0.8 0.6 0.4 0.2 0.0
30 s
98 s
198 s
298 s
0
50
100
150
200
250
等压线上A和B两个极大值对应于两种化学吸附,它 们发生在两种不同的吸附中心上。
二维等高的位能图来表示分子靠近固体表面时的能量变化情况
H2-金属表面的二维位能图
反应通道(虚线):开始H-H距离是恒定的,随着分子接近表面, 接着出现一个活化势垒,一直越过马鞍点(过渡态),虽然Z变 化较小,但H-H距离增加,最后分子解离成原子。
从吸附位能曲线还可得出以下两个结论: 1、由于表面的吸附作用,分子在表面上解离需要克服 Ea能垒,在气相中直接解离则需要D,分子在表面上活 化比在气相中容易,这是由于催化剂吸附分子改变了 反应途径的结果。 2、在数值上,脱附活化能等于吸附活化能与化学吸附 热之和。原则上,因为能量的守和性是这一关系具有 普遍性。
催化反应已发现的主要氧物种:O2,ads,O2-,O2-,O-
MgO上O2-(a),O-(b),O3-(c)物种的ESR信号 O-+O2
5.3 CO的吸附:主要有线式和桥式的缔合吸附,高温下解离 吸附 线式吸附,CO=2000cm-1 M C O M C M O
桥式吸附,CO=1900cm-1
QP:物理吸附热
活性原子在固体表面化学吸附位能变化:通常用Morse公式 近似计算
活性原子A在固体表面S上的吸附位能曲线
Qa:形成吸附物种S-A所释放的能量。 ra: 平衡距离。
一个分子靠近表面时的能量变化情况
D:解离能 Ea:吸附活化能 Qa:化学吸附热 Ed:脱附活化能 Y:物理吸附态/前驱态 X:化学吸附过渡态 Z:化学吸附态
300
350
time(s)
PEEM images (21 29 m) captured during CO adsorption
Brightness and normalized brightness profiles of different areas during CO adsorption.
9.12 14.64 24.01 23.26 44.22 18.41 20.9 33.5 37.7 37.7 58.6 35.6
某些气体的化学吸附热(kJ/mol)
气体 H2 O2 N2 586 Ti Ta 188 Nb W Cr 188 Mo 167 720 293 Mn 71 Fe 134 Co Ni Rh 117 494 293 Pt
