卤代酮的合成
卤代酮的合成

经典化学合成反应标准操作目录1.前言 (1)2. 直接卤化 (1)3.经重氮酮制备 (3)4.从weinreb 酰胺制备 (5)5.傅克酰基化合成卤代酮 (6)6 其他合成α-卤代酮的方法 (8)1.前言α-卤代酮的合成广泛应用于现代有机合成中, 多用于溴的烷基化、合成咪唑及噻唑等杂环类化合物,其合成方法常用直接卤化、经重氮酮制备、经Weinreb 酰胺制备、傅克酰基化等方法合成。
2. 直接卤化酮的α-氢易被取代,可以直接合成α-卤代酮。
一般操作是将酮与卤素于醋酸、氯仿、DMF 或水中反应。
除卤素外, 硫酰氯、五卤化磷、过溴化吡啶氢溴酸盐(C5H5NH.Br 3)、三卤化三甲基苄基铵盐等也可以做卤化试剂。
对称酮或只有一个取代方向的酮卤代时,可以良好产率(80~90%)生成α-卤代酮。
不对称酮卤代,往往生成α-及α’-卤代酮的混合物。
由于酮卤代的决定步骤是酮的烯醇化,因此,易形成烯醇的方向优先卤代。
例 2-甲基环己酮与亚硫酰氯作用, 多取代的α-氢优先氯代1。
OCH 3OCH 3Cl 2485%若利用双(二甲基乙酰胺基)三溴化氢做溴化剂,可使不对称酮在少取代一边溴代2。
OOBr[(Me 2NCOCH 3)2H]Br 3384%若将不对称酮首先转变成为一定构型的烯醇盐,继而卤代,是区域定向卤代的新方法3。
OH 3COH 3CCl1. i -Pr 2NLi, THFPhCOOEtO CH 3PhOCH 3Br 1. NaH, DMSO另外,甲基酮可用甲基格式试剂与相应的Weinreb 酰胺来制备, 如下例即是先合成甲基酮,后溴化来合成α-溴代酮的4。
NBocO HONBocONO NBocODCC, D MAP, N HMeOMe MeMgI , e t h er合成实例一 5OOOOOOBrBr 2, AcOH2B 2AA suspension of ketone 2A (700 mg, 2.17 mmol) in acetic acid (15 ml) was heated to 70℃, followed by addition of bromine (347 mg, 2.17 mmol). After the mixture was stirred at 70℃ for 3h, the solvent was evaporated and the residue was purified by column chromatography to give the compound 2B (591 mg, 68%).合成实例二6MeOO Br OMeMeOOBr232C2DBromine (7.99 g, 50 mmol) in CHCl 3 (20 ml) was added in a dropwise manner to a stirred solution of 2, 5-dimethoxy-4-bromoacetophenone 2C (12.95 g, 40 mmol) in CHCl 3 (100 ml) at 5℃. After the addition was completed, the reaction mixture was allowed to warm to room temperature and stirred for an additional 2 h. The mixture was poured onto crushed ice, the organic portion was separated and washed with water, saturated NaHCO 3 solution, and again with water. The solution was dried MgSO 4, and evaporated to dryness under reduced pressure to give a crude product. The product was recrystallized from MeOH to yield 14.70 g (87%) of the desired bromoacetophenone 2D as a white solid.合成实例三7ON NH 2NON NH 2NBr AcOH, 48% aq. HBr and Br 2To a solution of 1-(2-aminopyrimidin-4yl) ethanone (412 mg, 3 mmol) in glacial acetic acid (1 mL) and 48% aq. HBr (0.3 mL), bromine (0.153 mL) in acetic acid (0.4 mL) was added and the resulting orange solution was stirred at RT for1.5 hours. After diluting with ethyl acetate (15 mL), the precipitate was filtered and washed with ethl acetate thus affording the target compound as a whitish solid (580 mg, 65%).合成实例四8O OSiOOSi Br 2E 2FBenzyltrimethylammonium tribromide (4.17 g, 10.7 mmol) was added to a solution of Compound 2E (4.00 g, 10.7 mmol) in CH 2Cl 2-MeOH (5:2, 25 mL). The mixture was stirred at RT for 3 h. At this time the reaction mixture was concentrated in vacuo and H 2O (15 mL) was added. The mixture was extracted with diethyl ether (3 × 20 mL). The combined organic extracts were washed with brine (15 mL), dried over MgSO 4, filtered and concentrated in vacuo. The residue was purified by silica gel chromatography (hexanes:EtOAc, 3:1) to afford to afford Compound 2F (3.97 g, 8.8 mmol, 82%) as a thick yellow oil.3.经重氮酮制备不对称酮卤代时,有时无法得到单卤代产物。
α-卤代酮和羧酸盐 制 酯

请教:从卤代烷和羧酸根制备酯.
我做过一个α-溴代苯乙酮和甲酸钠的反应。
是在DMF里面做的,转化率近100%。
常温就行,其他什么都不要加。
反应很容易进行。
TLC检测反应进度。
收率一般都很高,几乎定量,前提是羧酸根要是羧酸盐,不是的话就得加碱了,碳酸钠之类的。
Originally posted by chembai at 2008-7-11 19:08:
DMF/CH3CN/丙酮均可,不过DMF效果最好,位阻小的话RT搅搅,大的话7、8十度,
收率一般都很高,几乎定量,前提是羧酸根要是羧酸盐,不是的话就得加碱了,碳酸钠之类的。
制备酯的经典反应.
Originally posted by chembai at 2008-7-11 19:08:
DMF/CH3CN/丙酮均可,不过DMF效果最好,位阻小的话RT搅搅,大的话7、8十度,收率一般都很高,几乎定量,前提是羧酸根要是羧酸盐,不是的话就得加碱了,碳酸钠之类
的。
碳酸钠在丙酮这类有机溶剂中不容.是不是需要相转移催化剂之类的东西啊。
卤代酮的制备

卤代酮的制备卤代酮是一类重要的有机化合物,它们在有机合成中具有广泛的应用。
卤代酮的制备方法有许多种,下面将介绍其中的几种常见方法。
一、酮的卤代反应酮的卤代反应是一种常见的制备卤代酮的方法。
酮分子中的羰基碳原子与卤素发生取代反应,从而得到卤代酮。
这种方法适用于活性较高的酮,例如酮中的氧化氢原子活性较高或酮分子中存在较强的共轭体系。
具体操作时,可以选择适量的卤素和有机溶剂,在适当的温度下进行反应。
反应完成后,通过适当的方法进行分离纯化,得到纯净的卤代酮产物。
二、酮的卤代还原反应酮的卤代还原反应是制备卤代酮的另一种常用方法。
这种方法首先进行酮的卤代反应,得到卤代酮,然后通过还原反应将卤素原子还原为氢原子,形成卤代酮。
这种方法适用于含有较多卤素的酮,例如三卤代酮。
在反应中,可以选择适量的还原剂和有机溶剂,在适当的温度下进行反应。
反应完成后,通过适当的方法进行分离纯化,得到纯净的卤代酮产物。
三、酮的卤化反应酮的卤化反应是制备卤代酮的另一种常见方法。
在这种反应中,酮分子中的氧化氢原子被卤素取代,形成卤代酮。
这种方法适用于活性较低的酮,例如酮中的氧化氢原子活性较低或酮分子中不存在共轭体系。
具体操作时,可以选择适量的卤素和有机溶剂,在适当的温度下进行反应。
反应完成后,通过适当的方法进行分离纯化,得到纯净的卤代酮产物。
四、酮的酸化卤化反应酮的酸化卤化反应是一种制备卤代酮的有效方法。
在这种反应中,酮分子首先与酸反应生成酸酯,然后再与卤素反应生成卤代酮。
这种方法适用于酮分子中存在较强的羰基活性或活性氢原子。
具体操作时,可以选择适量的酸和卤素,以及适当的有机溶剂,在适当的温度下进行反应。
反应完成后,通过适当的方法进行分离纯化,得到纯净的卤代酮产物。
总结起来,卤代酮的制备方法主要包括酮的卤代反应、酮的卤代还原反应、酮的卤化反应和酮的酸化卤化反应等。
这些方法各有优缺点,适用于不同类型的酮分子。
在实际应用中,可以根据具体情况选择最合适的方法进行制备。
药物合成反应-卤化反应
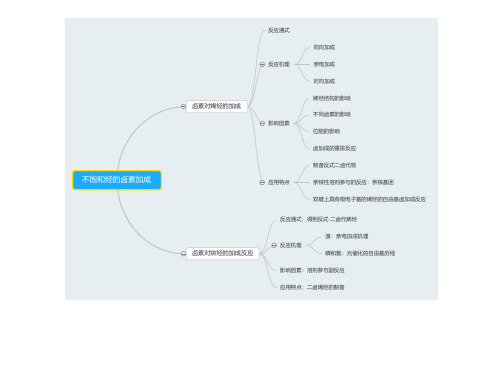
通式
烯醇酯的卤化反应
机理
应用特点
通式
烯醇硅烷醚的卤化反应
机理 应用特点
区域性卤化 制备α卤代醛
反应通式
烯胺的卤化反应
反应机理:卤化剂对烯胺双键的亲电加成
应用特点:选择性的α卤代反应
反应通式
机理:亲电取代机理
酰卤、酸酐、腈、丙二酸及其酯的α卤取代反应
应用
饱和脂肪酸酸的α卤取代反应
羧酸的α卤取代反应
反应通式
机理:亲核取代反应
影响因素:醇的结构,卤化剂的影响
将醇转化为响应的卤化物 Vilsmeier-Haack试剂
应用特点
反应通式
机理:醇和有机磷化物生成酯或加成物,卤素负离子SN2反应,构型反转
将光学活性的仲醇转化成构型反转的卤代烃
用于酸性条件下不稳定的化合物的卤化
适用于易重排醇的卤化 适用于甾体醇卤置换
醇的卤置换 酚的卤置换 醚的卤置换
醇、酚、醚的卤置换反应
羧羟基的卤置换 羧酸的脱羧卤置换反应
羧酸的卤置换反应
卤化物的卤素交换 磺酸酯的卤置换反应 芳香重氮盐化物的卤置换反应
其他官能团的卤置换
卤化反应
卤化反应机理
电子反应机理 自由基反应机理
亲电反应 亲核反应:亲核取代
自由基加成 自由基取代
不饱和烃的卤加成反应
制备碘代烃 制备氟代烃
磺酸酯的卤置换反应
反应通式
机理:亲核取代,卤化剂为亲核试剂
应用特点
醇的间接卤置换 磺酰化-卤置换反应常比卤素置换更有效
芳香重氮盐化合物的卤置换反应
通式:可将卤素原子引入到芳烃的位置上 机理:自由基反应 应用特点:芳香重氮盐化合物的氯置换和溴置换反应 芳香重氮盐化合物的碘置换反应 芳香重氮盐化合物的氟置换反应:希曼反应
卤代酮的合成-060123

经典化学合成反应标准操作α-卤代酮的合成目录1.前言 (2)2. 直接卤化 (2)3.经重氮酮制备 (4)4.从weinreb 酰胺制备 (6)5.傅克酰基化合成卤代酮 (7)6 其他合成α-卤代酮的方法 (9)1.前言α-卤代酮的合成广泛应用于现代有机合成中, 多用于溴的烷基化、合成咪唑及噻唑等杂环类化合物,其合成方法常用直接卤化、经重氮酮制备、经Weinreb 酰胺制备、傅克酰基化等方法合成。
2. 直接卤化酮的α-氢易被取代,可以直接合成α-卤代酮。
一般操作是将酮与卤素于醋酸、氯仿、DMF 或水中反应。
除卤素外, 硫酰氯、五卤化磷、过溴化吡啶氢溴酸盐(C5H5NH.Br 3)、三卤化三甲基苄基铵盐等也可以做卤化试剂。
对称酮或只有一个取代方向的酮卤代时,可以良好产率(80~90%)生成α-卤代酮。
不对称酮卤代,往往生成α-及α’-卤代酮的混合物。
由于酮卤代的决定步骤是酮的烯醇化,因此,易形成烯醇的方向优先卤代。
例 2-甲基环己酮与亚硫酰氯作用, 多取代的α-氢优先氯代1。
OCH 3OCH 3Cl 2485%若利用双(二甲基乙酰胺基)三溴化氢做溴化剂,可使不对称酮在少取代一边溴代2。
OOBr[(Me 2NCOCH 3)2H]Br 3384%若将不对称酮首先转变成为一定构型的烯醇盐,继而卤代,是区域定向卤代的新方法3。
OH 3COH 3CCl1. i -Pr 2NLi, THFPhCOOEtO CH 3PhOCH 3Br 1. NaH, DMSO另外,甲基酮可用甲基格式试剂与相应的Weinreb 酰胺来制备, 如下例即是先合成甲基酮,后溴化来合成α-溴代酮的4。
NBocO HONBocO NO NBocODCC, D MAP, N HMeOMe MeMgI , e t h er合成实例一 5OOOOOOBrBr 2, AcOH2B 2AA suspension of ketone 2A (700 mg, 2.17 mmol) in acetic acid (15 ml) was heated to 70℃, followed by addition of bromine (347 mg, 2.17 mmol). After the mixture was stirred at 70℃ for 3h, the solvent was evaporated and the residue was purified by column chromatography to give the compound 2B (591 mg, 68%).合成实例二6OMe MeOO Br OMeMeOOBr232C2DBromine (7.99 g, 50 mmol) in CHCl 3 (20 ml) was added in a dropwise manner to a stirred solution of 2, 5-dimethoxy-4-bromoacetophenone 2C (12.95 g, 40 mmol) in CHCl 3 (100 ml) at 5℃. After the addition was completed, the reaction mixture was allowed to warm to room temperature and stirred for an additional 2 h. The mixture was poured onto crushed ice, the organic portion was separated and washed with water, saturated NaHCO 3 solution, and again with water. The solution was dried MgSO 4, and evaporated to dryness under reduced pressure to give a crude product. The product was recrystallized from MeOH to yield 14.70 g (87%) of the desired bromoacetophenone 2D as a white solid.ON NH 2NON NH 2NBr AcOH, 48% aq. HBr and Br 2To a solution of 1-(2-aminopyrimidin-4yl) ethanone (412 mg, 3 mmol) in glacial acetic acid (1 mL) and 48% aq. HBr (0.3 mL), bromine (0.153 mL) in acetic acid (0.4 mL) was added and the resulting orange solution was stirred at RT for1.5 hours. After diluting with ethyl acetate (15 mL), the precipitate was filtered and washed with ethl acetate thus affording the target compound as a whitish solid (580 mg, 65%).合成实例四8O OSiOOSi Br 2E 2FBenzyltrimethylammonium tribromide (4.17 g, 10.7 mmol) was added to a solution of Compound 2E (4.00 g, 10.7 mmol) in CH 2Cl 2-MeOH (5:2, 25 mL). The mixture was stirred at RT for 3 h. At this time the reaction mixture was concentrated in vacuo and H 2O (15 mL) was added. The mixture was extracted with diethyl ether (3 × 20 mL). The combined organic extracts were washed with brine (15 mL), dried over MgSO 4, filtered and concentrated in vacuo. The residue was purified by silica gel chromatography (hexanes:EtOAc, 3:1) to afford to afford Compound 2F (3.97 g, 8.8 mmol, 82%) as a thick yellow oil.3.经重氮酮制备不对称酮卤代时,有时无法得到单卤代产物。
卤代化合物(Cl+..

构型保留
Cl + SO2 + Cl
OH
SOCl2 -HCl
O C O S Cl 4
pyridine Cl
外消旋混合物
Confidential We Are Determined To Serve You Better 8
Me2 NOCH SOCl2 Me2 N=CHCl Cl 7 SOCl2, DMF heat, 15 min (Me 2N)3 PO SOCl2 (Me 2N)2 PCl=NMe2 Cl 8
C 8H 7C 6H 4 (OCH 2CH2 )5 OH
Confidential
C 8H 7C 6H 4 (OCH 2CH2 )5 Cl
H+ OH 1 -H 2 O Br Br Br 48% HBr/-15o C 2 (86%) (79%) 3 (14%) (21%)
6
Br
饱和 HBr/0oC
Confidential
We Are Determined To Serve You Better
2. 醇和卤化氢或氢卤酸的反应
2.1 醇和氯化氢反应的方法示例
OH 5 5.6 mol SOCl2/Et 2O 0.7 mol SOCl2/Et 2O
Confidential
Cl (24%) (1%)
+ (76%) (99%)
9
We Are Determined To Serve You Better
3. 醇和卤化亚砜的反应
在氯化亚砜的反应中,若加入有机碱(如吡啶)作为催化剂,或者醇 本身分子内存在氨基等碱性基团,因能与反应中生成的氯化氢结合,故有 利于提高卤代反应速率。此外,该反应也适宜于一些对酸敏感的醇类的氯 置换反应。例如,2-羟甲基四氢呋喃(6)用二氯亚砜和吡啶在室温下反应, 可得到预期的2-氯甲基四氢呋喃,而不影响酯环醚结构.
卤代化合物的合成

1.1.1 醇和卤化氢或氢卤酸的反应
属于亲核取代反应 醇的活性顺序:
苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH 氢卤酸的活性顺序: HI>HBr>HCl>HF HBr常用NaBr-H2SO4;HI 用KI-H3PO4代替
反应式
反应机理
大多数1oROH按SN2机理进行反应。
改良方法 (1)Suarez改良法和Kochi改良法 Suarez改良法是将羧酸与二醋酸碘苯(PIDA)和单质碘
作用,在紫外光照下反应生成相应的碘代物; Kochi改良法是用四醋酸铅为氧化剂,与单质碘或卤化锂
在紫外下反应,生成相应卤代烷。
J. Org. Chem. 1986, 51, 402; Org. React. 1972, 19, 279
近期相关文献
J. Org. Chem., 2002, 67, 7861-7864 Synthesis, 2005, 1319-1325
1.5 氨基转化为卤素
Sandmeyer反应
• 制备芳氯或芳溴时,可用氯化亚铜或溴化亚铜在相应的 氢卤酸存在下分解重氮盐。 •制备芳基氟时,使用氟硼酸重氮盐,然后加热分解 • 制备芳碘时,不需加入铜盐,仅需将KI加入重氮盐即可
Cl
• 烯丙醇、苄醇生成相应的氯代物
卤硅烷体系
OH Me3SiCl/DCM Bu 30C, 1.5h
Cl (90%) [15]
Bu
• 加入LiBr、NaI等可生成相应的溴化物和碘化物
J. Org. Chem. 1980,45, 1638-1639
2)醇的溴代
Org. Lett., 2002, 4, 553-555 Tetrahedron, 2005, 61, 5699-5704
卤代化合物的合成

第二十九页,共60页
反应机理:
第三十页,共60页
实例:
Org. Syn. Coll. Vol 1955, 3, 578
• 需先制备羧酸银盐,干燥条件反应。
第十页,共60页
1.1.3 醇与卤化磷的反应
常用的卤化试剂:PCl3、PCl5、PBr3, P-I2等。 该类卤化剂活性比氢卤酸高,副产物也相对较少 适用范围:伯醇、仲醇的卤代
第十一页,共60页
1.1.4 醇与有机磷卤化物的反应
常用试剂:1) 三苯膦卤化物,如Ph3PX2, Ph3P+CX4 ; 2) 亚磷酸三苯酯卤化物, 如(PhO)3PX2、(PhO)3P+RX;3) PPh3/NXS(NCS、NBS、NIS)
100%
Br
3oROH 、大多数2oROH和空阻大的
1oROH按SN1机理进行反应。
第六页,共60页
H+
(CH3)3CCH2OH
CH3 (CH3)2C CH2
+
OH2
-H2O
邻基参与分
子内SN2
CH3
+
(CH3)2C CH2
+
(CH3)2CCH2CH3
Cl-
(CH3)2CClCH2CH3
第七页,共60页
第十五页,共60页
1.1.5 其它卤代试剂
1)醇的氯代
TCT/DMF体系
Org. Lett., 2002, 4, 553-555
• 在室温下可将醇、b-氨基醇转化为相应的氯代物,若加入
α-卤代酮的脱卤新方法

α-卤代酮的脱卤新方法石亚磊;李杨;朱锦桃【摘要】报道了一种以乙醇为溶剂,在锌粉和甲酸铵催化下的α-卤代酮的脱卤新方法.该体系也适用于α,α-二卤代酮和卤代苄的脱卤反应,产物结构结构经1H NMR, IR和MS(ESI)确证.%A new method for dehalogenation of α-haloketones was reported, using EtOH as the solvent, Zn and NH4CO2H as the catalysts.The method can also apply to the dehalogenation of α,α-dibromoacetophenones and benzyl chlorides.The structures were confirmed by 1H NMR, IR and MS(ESI).【期刊名称】《合成化学》【年(卷),期】2017(025)005【总页数】4页(P411-414)【关键词】脱卤;α-卤代酮;α,α-二卤代酮;卤代苄;合成【作者】石亚磊;李杨;朱锦桃【作者单位】浙江理工大学理学院,浙江杭州 310018;浙江理工大学理学院,浙江杭州 310018;浙江理工大学理学院,浙江杭州 310018【正文语种】中文【中图分类】O625.1α- 卤代酮的脱卤反应为重要的有机合成反应。
传统方法使用的脱卤试剂主要为:有机锡氢化物[1],TiCl3[2], LiI- BF3[3], Bi/NH4F[4], GeI3[5], NaTeH[6],Bu2Te/Et3N[7], Pd/C- B10H14[8]和GaI3[9]等。
上述脱卤试剂大多含有重金属或贵金属,成本较高,容易造成环境污染。
为实现绿色化学的目标,虽然研究人员开发了诸多脱卤新方法,如酶促进生物催化还原脱卤反应[10]和光催化还原脱卤[11],但受适用范围较窄的限制,无法广泛应用。
卤代烃的合成原理及应用

卤代烃的合成原理及应用1. 引言卤代烃是一类化学化合物,其分子中含有卤素(如氟、氯、溴、碘)取代了一些氢原子。
卤代烃具有广泛的应用领域,在医药、农药、有机合成和材料科学等领域发挥着重要作用。
本文将介绍卤代烃的合成原理和常见的应用。
2. 合成原理2.1 卤代烃的合成方法卤代烃可以通过不同的方法合成,其中最常用的方法有以下几种:•卤素直接取代反应:通过将卤素直接与有机物反应,使卤素取代有机物中的氢原子,从而得到卤代烃。
•卤代烯的卤化反应:通过将烯烃与卤素反应,使卤素取代烯烃中的氢原子,从而得到卤代烃。
•卤代烷的卤化反应:通过将烷烃与卤素反应,使卤素取代烷烃中的氢原子,从而得到卤代烃。
•光照卤化反应:利用紫外光或其他光源的照射,使有机物与卤素发生反应,从而合成卤代烃。
2.2 卤代烃的合成机理卤代烃的合成机理与所使用的合成方法有关。
下面以卤化反应为例,介绍其中的合成机理:1.亲核试剂的攻击:亲核试剂(如溴离子)攻击有机物中的氢原子,形成中间物。
2.中间物的离去:中间物中的卤化物离去,生成卤代烃。
3.溶剂的作用:溶剂可以促进反应的进行,并调节反应的速率和产物的产率。
3. 应用领域卤代烃在许多领域都有重要的应用。
以下列举几个常见的应用领域:3.1 医药卤代烃在医药领域有广泛的应用,其中最典型的应用是作为药物的活性成分。
一些卤代烃具有抗生素、抗肿瘤和抗炎等活性,被广泛应用于临床治疗。
此外,卤代烃还可以用作药物的前体,通过进一步的合成反应转化为更复杂的化合物。
3.2 农药卤代烃在农药领域也有重要的应用。
一些卤代烃具有杀虫、杀菌和除草的活性,被广泛应用于农业生产中。
卤代烃可以用作杀虫剂、杀菌剂和除草剂的活性成分,起到控制害虫、病菌和杂草的作用。
3.3 有机合成卤代烃在有机合成中也具有重要的地位。
卤代烃可以作为反应底物,参与多种有机合成反应,生成更复杂的有机化合物。
卤代烃的特殊结构和性质使得它们在合成重要有机化合物的过程中起到关键作用。
α卤代酮水解

α卤代酮水解
α卤代酮水解是一种常见的有机化学反应,用于将α卤代酮转化为相应的酮化合物。
这个反应在许多合成有机化合物的过程中起到至关重要的作用。
在α卤代酮水解反应中,α卤代酮与水反应生成酮和对应的卤化氢。
这个反应可以通过加热或者使用催化剂来促进。
一般来说,α卤代酮容易水解,因为碳正离子的稳定性较低,而水分子可以提供一个氢离子,促使水解发生。
这个反应对有机合成非常重要,因为它可以将含卤代基的酮转化为纯净的酮化合物。
这对于合成其他复杂的有机分子非常有用。
此外,α卤代酮水解反应还可以用于制备天然产物、药物和农药等有机化合物。
在实际应用中,α卤代酮水解反应需要注意一些问题。
首先,反应条件需要控制得当,以避免产生副反应和废物。
其次,对于不同的
卤代基和酮基,反应条件可能有所不同。
因此,需要在实验室中进行反应条件的优化,以获得最佳的反应结果。
总之,α卤代酮水解是一种重要的有机化学反应,广泛应用于有机合成中。
通过这个反应,可以将α卤代酮转化为纯净的酮化合物,为合成其他复杂的有机分子提供了重要的中间体。
在进行此反应时,需要合理选择反应条件,以提高反应效率和产物质量。
这个反应的研究和应用将进一步推动有机化学领域的发展。
由酸制备α-卤代酮

由酸制备α-卤代酮一般情况下,酸先转化为酰氯,一种方法是酰氯和重氮甲烷或TMS重氮甲烷反应得到重氮酮,用相应的卤化氢处理即可高产率得到α-卤代酮。
第二种方法是卤乙酰卤与N-甲氧基-N-甲基氯化铵反应得到weinreb酰胺,weinreb酰胺再和有机金属化物反应得到α-卤代酮。
一、重氮酮法To a solution of compound 3A (0.7 g, 4.3 mmol) in DCM (15 ml, 2 drops of DMF) was added oxalyl chloride (0.55 ml, 6.47 mmol). The reaction mixture was stirred at RT for 10 min, at reflux for 1 h. Then the solvent was removed in vacuo. The residue was dissolved in THF (8 ml), then the mixtu re was cooled to 0℃. Diazomethane in ether (42 ml, 21 mmol) was then added slowly, the reaction solution was stirred at 0℃ for 1 h, followed by 2 h at RT. The reaction mixture was cooled to 0℃ again, and 1.2 ml of 35% of HBr in acetic acid was added slowly. The reaction mixture was stirred at RT overnight. The reaction solution was poured into cooled water, and extracted with EtOAc. The organic layer was washed with water, saturated ammonium chloride and brine, dried over sodium sulfate. The solvent was concentrated under reduced pressure to afford 1 g of α-bromoketone 3B (yield 80%).由于重氮甲烷制备比较危险(后附制备方法),可以直接买到相对稳定的TMS重氮甲烷用于反应,操作方便。
最新α-卤代酮的合成

示例
2-甲基环己酮与亚硫酰氯(好象应为硫酰氯)作用, 多取代的α-氢优先氯代。
O C H 3 S O C l2 ,C C l4
O C l C H 3
8 5 %
用双(二甲基乙酰胺基)三溴化氢做溴化剂,可使不对称酮在少取代一边溴代。
O
[(M e2N C O C H 3)2H ]B r3
O
C H 3O H ,20~ 4 5'C B r
2.3 应用Br2/MeOH溴化示例
N
Br O
B r 2 , C H 3 O H O
B r O
4
2.4 应用Me3BnNBr3溴化示例
O S i
O BnM e3N Br3, C H 2C l2, M eO H
O Si
5
6
O Br
5
3.经重氮酮制备
不对称酮卤代时,有时无法得到单卤代产物。 此时,从酰氯或活泼酯经 重氮酮合成α-卤代酮可以顺利得到单卤代产物。 重氮酮常用重氮甲烷的 醚溶液加到相应的酰氯或活波酯中制得,也可以用三甲基硅重氮甲烷处理 相应的酰氯制得。 重氮酮用相应的卤化氢处理即可高产率得到α-卤代酮。
O HO
DCC,DMAP,NHMeOMe O
NBoc
ON
MeMgI,ether O NBoc
NBoc
LDA,TMSCl,thenNBS
O
NBoc
Br
3
2.1 应用Br2/AcOH直接溴化示例
O O
B r 2 , A c O H O
O
O
O B r
2.2 应用Br2,HBr, AcOH直接溴化示例
Br2, H Br, AcO H N
C l
O
卤代酮的合成

α-卤代酮的合成
编者:齐志奇
药明康德新药开发有限公司化学合成部
药明康德内部保密资料
经典合成反应标准操作—α-卤代酮的合成
目
录
药明康德新药开发有限公司
1.前言 ................................................................................................................. 2 2. 直接卤化 .......................................................................................................... 2 3.经重氮酮制备 ................................................................................................. 4 4.从 weinreb 酰胺制备 .................................................................................... 6 5.傅克酰基化合成卤代酮................................................................................. 7 6 其他合成 α-卤代酮的方法............................................................................ 9
法 3。
O H3C
1. i-Pr2NLi, THF
第四节 羰基化合物的卤取代反应3版
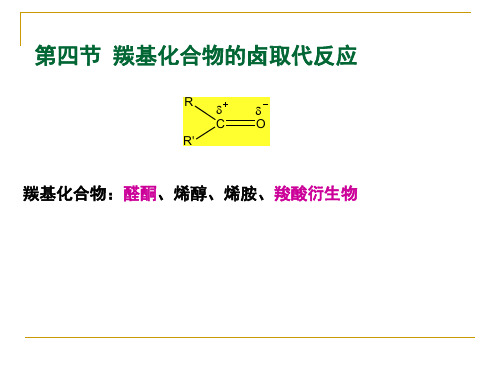
1、丙二酸酯的α-卤取代反应
COOC2H5 COOC2H5
Br2/CCl4
COOC2H5
Br
75%
COOC2H5
强碱作用,极性溶剂DMSO与CuCl2反应
COOC 2 H 5 COOC 2 H5
1 )NaH/DMS O 2)CuBr2
COOC 2 H5
Br
90%
COOC 2 H5
形成烯醇β-碳负离子的羧酸酯
Br
+
OH
CH2
CH2
CH3
-Br2
H2C
OH
CH2
CH2
CH3
OH
H3C
Br
Br
Br2 CH3
O
Br CH2
O
H3C
CH2
1. 5%
CH2
CH3
CH2
CH
CH3 58%
Br
热力学产物
*溴化剂或碘化剂/醋酸钠或吡啶等碱性物质(动力学控制产物)
*③ 羰基α-位取代基的电性效应的影响
酸催化反应:α-位有供电子基,利于反应。
CH2 H
X 2 or NBS (NCS ) H3C
O H3C
CH2X H
AcO
AcO
X=Br 70% X=Cl 25%
提高不对称酮区域选择性的一种方法 反应后生成的丙酮易于蒸馏除去 溴代产率高 烯醇酯形成
*2 烯醇硅烷醚的卤化反应
(1) 通式
R1 OSiMe 3 X2
R2
R3
(2)反应机理
X R1
(1)反应通式
O
H3C H3C CH3
CH3
1 )I 2 /Na OH/H2 O 2 )H +
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
示例
2-甲基环己酮与亚硫酰氯(好象应为硫酰氯)作用, 多取代的α-氢优先氯代。
O CH3 SOCl2, CCl4
O Cl CH3
85%
用双(二甲基乙酰胺基)三溴化氢做溴化剂,可使不对称酮在少取代一边溴代。
O
[(Me2NCOCH3)2H]Br3
O
CH3OH, 20~45'C
Br
84%
3
若将不对称酮首先转变成为一定构型的烯醇盐,继而卤代,是区域定向卤代的新方法。
5.1 酯与氯乙酸的双负离子反应制备α-氯代酮示例
Cl
Mg
+
OO N Cl
Cl O
10
6. 通过卤乙酰氯傅克酰基化合成卤代酮
与芳烃直接相连的α-卤代酮, 可以从卤乙酰卤与相应芳烃经傅克酰基化 合成α-卤代酮。 此类方法多以三氯化铝做催化剂, 在适宜的温度下反 应合成α-卤代酮。 但该方法后处理较为困难,且收率一般。
O Br
O O
7
8
4.酯与氯乙酸的双负离子或氯碘甲烷负离子反应制备α-氯代酮
通过氯乙酸的双负离子对酯的加成可以得到相应的α-氯代酮,这一方法有广 泛的通用性,也可以用于芳香酸酯。 另外通过氯碘甲烷负离子的负离子氯碘 甲烷负离子也可以得到相应的α-氯代酮。
4.1 酯与氯乙酸的双负离子反应制备α-氯代酮示例
2
2.直接卤化
酮的α-氢易被取代, 可以直接合成α-卤代酮。 一般操作是将酮与卤素 于醋酸、氯仿、DMF或水中反应。 除卤素外, 硫酰氯、五卤化磷、过溴 化吡啶氢溴酸盐(C5H5NH.Br3)、三卤化三甲基苄基铵盐等也可以做卤化 试剂。 对称酮或只有一个取代方向的酮卤代时,可以良好产率(80~90%) 生成α-卤代酮。 不对称酮卤代,往往生成α-及α’-卤代酮的混合物。 由于酮卤代的决定步骤是酮的烯醇化,因此,易形成烯醇的方向优先卤代。
经典化学合成反应讲座(?)
α-卤代酮的合成
化学合成部执行主任:马汝建
药明康德新药开发有限公司
药明康德版权所有
1
1.前言
α-卤代酮的合成广泛应用于现代有机合成中, 多用于溴的烷基化、 关环合成咪唑及噻唑等杂环类化合物,其合成方法常用的直接卤化、 经重氮酮制备、氯乙酸的双负离子与酯反应制备、经Weinreb 酰胺 制备、傅克酰基化合成等。
Br2, CH3OH O
Br O
5
2.4 应用Me3BnNBr3溴化示例
O
O
O
O
Si
BnMe3NBr3, CH2Cl2, MeOH
Si
Br
5
6
6
3.经重氮酮制备
不对称酮卤代时,有时无法得到单卤代产物。 此时,从酰氯或活泼酯经 重氮酮合成α-卤代酮可以顺利得到单卤代产物。 重氮酮常用重氮甲烷的 醚溶液加到相应的酰氯或活波酯中制得,也可以用三甲基硅重氮甲烷处理 相应的酰氯制得。 重氮酮用相应的卤化氢处理即可高产率得到α-卤代酮。
OO
H
+
NHBoc
HO Cl
O
LDA
O Cl
H NHBoc
4.2 酯与氯乙酸的双负离子反应制备α-氯代酮示例
OO
H
+
NHBoc
I Cl
LDA
O Cl
H NHBoc
9
5. 从Weinreb 酰胺制备
N-甲氧基-N-甲基酰胺做为易离去基团,可因与有机金属试剂在温和的条 件下反应,以良好的收率生成酮。 若以N-甲氧基-N-甲基-2-卤乙酰胺与 有机金属试剂作用就可以良好收率得到α-卤代酮。 N-甲氧基-N-甲基2-卤乙酰胺很容易由相应的卤乙酰卤与N-甲氧基-N-甲基氯化铵反应得 到。
3.1 应用重氮酮(由酰氯和重氮甲烷反应而来)合成α-溴化酮示例
(COCl)2 COOH
1. CH2N2/Et2O 2. HBr/AcOH COCl
Br O
3.2 应用重氮酮(由酰氯和TMSCHN2反应而来)合成α-溴化酮示例
O O
O Cl
1. (trimethylsilyl-diazomethane 2. HBr (30%) in acetic acid
6.1 通过卤溴酰氯傅克酰基化制备α-溴代酮示例
C8H17
Cl
+
Br
O
AlCl3, CH2Cl2ຫໍສະໝຸດ C8H17Br O
6.2 通过卤溴酰溴傅克酰基化制备α-溴代酮示例
Br O
BrCH2COBr, ACl3, CS2
Br O
O Br
O Br
11
6.2 酯与氯乙酸的双负离子反应制备α-氯代酮示例
N N
O O
O
MeMgI, ether O
NBoc
NBoc
NBoc
HO
ON
LDA, TMSCl, then NBS
O
NBoc
Br
4
2.1 应用Br2/AcOH直接溴化示例
O O
Br2, AcOH O
O O
O Br
2.2 应用Br2,HBr, AcOH直接溴化示例
Br2, HBr, AcOH N
N
Br O
2.3 应用Br2/MeOH溴化示例
O H3C
1. i-Pr2NLi, THF
O
2. p-TsCl, 0'C H3C
Cl
O Ph
CH3 COOEt
1. NaH, DMSO 2. CuBr
O CH3
Ph
Br
COOEt
另外,甲基酮可用甲基格式试剂与相应的Weinreb 酰胺来制备, 如下例即是先 合成甲基酮,后溴化来合成α-溴代酮的。
O
DCC, DMAP, NHMeOMe
TMEDA, BuLi
Li
N N
Li
O O
O O
N
Cl
6.3通过氯酰氯傅克酰基化制备α-氯代酮示例
Cl
O
NN
H
O
O
CO2Me
HO
OH
CO2Me O Cl
HO
OH
12
7.其他方法
对于吲哚的3-位等活性较高的反应有时直接应用氯酰氯即可制备相应 的α-氯代酮
O
Cl
N
H
N
H
13
The End
14
