间接碘量法测定硫酸铜中铜含量
实验24-硫酸铜的制备提纯及微量碘量法测铜

实验二十四五水硫酸铜的制备与提纯及碘量法测铜1.掌握利用废铜粉制备硫酸铜的方法;2.练习减压过滤、蒸发浓缩和重结晶等基本操作;3.掌握间接碘量法测定铜含量的原理和方法。
1.五水硫酸铜的制备和提纯铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。
在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu 2+,Cu 2+与SO 42-结合得到硫酸铜:Cu + 2HNO 3+ H 2SO 4=CuSO 4+ 2NO 2+ 2H 2O未反应的铜屑(不溶性杂质)用倾滗法除去。
利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。
硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。
在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。
滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
CuSO4·5H2O在水中的溶解度,随温度的升高而明显增大,因此粗硫酸铜中的其它杂质,可通过重结晶法使杂质在母液中,从而得到较纯的蓝色水合硫酸铜晶体。
水合硫酸铜在不同的温度下可以逐步脱水,其反应式为CuSO4·5H2O =CuSO4·3H2O + 2H2OCuSO4·3H2O = CuSO4·H2O + 2H2OCuSO4·H2O === CuSO4+ H2O2.铜含量的测定在酸性溶液中,Cu2+与过量的KI反应,析出的碘用Na2S2O3标准溶液滴定,用淀粉作指示剂,反应如下:2Cu2++4I-═2CuI↓+I2I2+2S2O32-═2I-+S4O62-反应需加入过量的KI ,一方面可促使反应进行完全,另方面使形成I 3-,以增加I 2的溶解度。
为了避免CuI 沉淀吸附I 2,造成结果偏低,须在近终点(否则SCN-将直接还原Cu 2+)时加入SCN -,使CuI 转化成溶解度更小的CuSCN ,释放出被吸附的I 2。
硫酸铜中铜含量的测定(实验报告)

硫酸铜中铜含量的测定【摘 要】本实验利用碘量法测定了硫酸铜中铜的含量。
最终,得到铜的含量为24.88% ±0.03%,实验的相对标准偏差为0.09% 。
【关键词】碘量法 ;硫酸铜 ;铜1 引言硫酸铜的分析方法有国家标准[1],该方法是在样品中加入碘化钾,样品中的二价铜离子在微酸性溶液中能被碘化钾还原,而生成难溶于稀酸的碘化亚铜沉淀。
以淀粉为指示剂用硫代硫酸钠标准溶液滴定,化学反应为:2+-22-2--223462Cu + 4I = 2CuI + I I + 2S O = S O + 2I矿石和合金中的铜也可以用碘量法测定。
但必须设法防止其他能氧化-I 的物质(如-3NO 、3+Fe 等)的干扰。
防止的方法是加入掩蔽剂以掩蔽干扰离子(比如使3+Fe 生成3-6FeI 配离子而被掩蔽)或在测定前将它们分离除去。
若有As (Ⅴ)、Sb (Ⅴ)存在,则应将pH 调至4,以免它们氧化-I 。
间接碘量法以硫代硫酸钠作滴定剂,硫代硫酸钠(Na 2S 2O 3·5H 2O )一般含有少量杂质,比如S 、Na 2SO 3、Na 2SO 4、Na 2CO 3及NaCl 等,同时还容易风化和潮解,不能直接配制准确浓度的溶液,故配好标准溶液后还应标定其浓度。
本实验就是利用此方法测定CuSO 4中铜的含量,以得到CuSO 4试剂的纯度。
2 实验部分2.1试剂与仪器Na 2S 2O 3·5H 2O ;Na 2CO 3(固体);纯铜(99.9%以上);6 mol·L -1HNO 3溶液;100 g·L -1KI 溶液;1+1和1 mol·L -1H 2SO 4溶液;100 g·L -1KSCN 溶液;10 g·L -1淀粉溶液电子天平;碱式滴定管;碘量瓶 2.2 实验方法2.2.10.05 mol·L -1Na 2S 2O 3溶液的配制:称取12.5 g Na 2S 2O 3·5H 2O 于烧杯中,加入约300 mL新煮沸后冷却的蒸馏水溶解,加入约0.2 g Na 2CO 3固体,然后用新煮沸且冷却的蒸馏水稀释至1 L ,贮于棕色试剂瓶中,在暗处放置1~2周后再标定。
无水硫酸铜中铜含量的测定

实验六无水硫酸铜中铜含量的测定—间接碘量法一、预习内容1、氧化还原滴定法—碘量法2、碘量法的应用示例——铜合金中铜的测定二、实验目的1、熟练掌握Na2S2O3溶液浓度的标定2、学习间接碘量法测定铜的含量三、实验原理在弱酸性介质中,Cu2+与过量的KI生成CuI沉淀,并定量析出I2,用标准Na2S2O3溶液滴定生成的I2,根据标准Na2S2O3溶液的浓度及消耗量可以计算出试样中铜的含量。
反应方程式如下:Cu2++4I-=2Cu I↓+I2I2+2S2O32-=2I-+S4O62-分析过程:HNO3 (1) H2SO4 过量KI CuI↓Na2S2O3铜试样——→Cu2+, NO————————→Cu2+———→I2 ————→I-△ (2)NaOH调至中性 pH=3~4 淀粉注意:(1)介质的pH=3~4,若pH太高,Cu2+会水解,若pH太低,I-易被空气氧化为I2,并且Cu2+对该氧化反应有催化作用,使测定结果偏高。
用NH4HF2调节pH,NH4HF2可分解为HF与F-,形成HF-F-缓冲溶液。
HF的PKa=3.18,HF-F-缓冲溶液的缓冲范围为 2.18~4.18,符合要求,同时,F-可与Fe3+形成FeF63-掩蔽了Fe3+,Fe3+能氧化I-。
(2)CuI 会吸附I2,为了使吸附的I2,近滴定终点时加入NH4SCN,使CuI 转化为溶解度更小的CuSCN(CuI:Ksp=10-11.96,CuSCN:Ksp=10-14.32。
),NH4SCN 不能过早加入,它会还原I2,使测定结果偏低。
(3)过量KI的作用:还原剂,沉淀剂,络合剂。
(4)Na2S2O3溶液的浓度要重新标定,标定方法同上次实验。
标定Na2S2O3溶液的浓度可用的基准物质有K2Cr2O7、KIO3、纯铜等。
若用纯铜标定,与测定时条件相同,可以抵消方法的系统误差。
四、实验步骤1、Na2S2O3溶液浓度的标定准确移取K2Cr2O7标准溶液25.00cm3置于碘量瓶中,加5cm3浓度为6mol dm-3的盐酸溶液,加10cm320%的KI溶液,加盖水封,于暗处放置5min。
硫酸铜中铜含量的测定间接碘量法

5.16 硫酸铜中铜含量的测定(间接碘量法)一、实验目的1. 掌握间接碘量法测定铜的基本原理。
2. 了解间接碘量法中误差的来源,掌握提高分析结果准确度的方法。
二、实验原理在弱酸性或中性条件下,Cu 2+ 与过量的I -作用生成不溶性的CuI 沉淀并定量析出I 2,生成的I 2用Na 2S 2O 3标准溶液滴定,以淀粉为指示剂,滴定至溶液的蓝色刚好消失即为终点。
反应式如下。
2Cu 2++5I -2CuI ↓3I -+ 2323I 2S O --+2463I S O --+ 在测定 Cu 2+ 时,通常用 NH 4HF 2 缓冲溶液控制溶液的酸度为 pH =3~4。
NH 4HF 2 同时也提供了 F -作为掩蔽剂,可以使共存的 Fe 3+ 转化为[36FeF -],以消除其对 Cu 2+ 测定的干扰。
CuI 沉淀表面易吸附少量 I 2,但其不与淀粉作用,引起终点提前。
因此需在临近终点时加入KSCN 溶液,使其转化为更稳定的CuSCN 沉淀,它不吸附 I 2,使 CuI 吸附的部分 I 2 释放出来,提高测定的准确度。
三、器材及试剂器材:托盘天平,锥形瓶(250 mL ),量筒(10 mL ),烧杯(100 mL ),碱式滴定管。
试剂:0.10 mol ・L -1 NaS 2O 3 标准溶液,100 g ・L -1 KI 溶液,100 g ・L -1 KSCN 溶液,1 mol ・L -1 H 2SO 4 溶液,5 g ・L -1 淀粉溶液,CuSO 4・5H 2O 试样。
四、实验内容准确称取 CuSO 4・5H 2O 试样 0.5~0.6 g 于 250 mL 锥形瓶中,加入 5 mL 1 mol ・L -1 H 2SO 4 溶液和 100 mL 水使其溶解。
加入 10 mL 100 g ・L -1 KI ,立即用 0.10 mol ・L -1 Na 2S 2O 3 标准溶液滴定至溶液呈浅黄色。
【知识点】间接碘量法测定胆矾中CuSO4含量

【知识点】间接碘量法测定胆矾中CuSO4含量[1] 间接碘量法测定胆矾中CuSO4含量解读五水硫酸铜也被称作硫酸铜晶体,为了与“无水硫酸铜”区别,通常读作“五水合硫酸铜”,相对分子质量为250。
俗称蓝矾、胆矾或铜矾。
将胆矾试样溶解后,加入过量KI,反应析出的I2用Na2S2O3标准溶液滴定,反应为:2Cu2++4I-==2CuI↓+I2S2O32-+I2==S4O62-+2I-以淀粉指示剂确定终点。
[2] 间接碘量法测定胆矾中CuSO4含量测定准确称取胆矾试样0.5~0.6g,置于碘量瓶中,加1mol/LH2SO4溶液5mL,蒸馏水100 mL使其溶解,加20%NH4HF2溶液10 mL,10% KI溶液10 mL,迅速盖上瓶塞,摇匀,放置3min。
此时出现CuI白色沉淀。
打开碘量瓶塞,用少量水冲洗瓶塞及瓶内壁,立即用c(Na2S2O3)=0.1mol/L 的Na2S2O3标准溶液滴定至呈浅黄色,加3mL淀粉指示液,继续滴定至浅蓝色,再加10%KSCN溶液10mL,继续用Na2S2O3标准溶液滴定至蓝色刚好消失为终点。
此时溶液为米色的CuSCN悬浮液。
记录消耗Na2S2O3标准溶液的体积。
平行测定两次。
[3]GB 437-2009 硫酸铜(农用)4.3 硫酸铜含量的测定4.3.1 方法提要试样用水溶解,在微酸性条件下,加入适量的碘化钾与二价铜反应,析出等摩尔碘,以淀粉为指示剂,用硫代硫酸钠标准溶液滴定析出的碘。
从消耗硫代硫酸钠标准溶液的体积,计算试样中硫酸铜含量。
反应式如下:2Cu 2++4I -==2CuI↓+I 2S 2O 32-+I 2==S 4O 62-+2I -4.3.2 试剂和济液碘化钾;硝酸;氟化钠:饱和溶液;乙酸溶液: %36)(3=COOH CH ϕ;淀粉指示液:5g/L 溶液;硫代硫酸钠)标准滴定溶液:c(Na 2S 2O 3)=0.2 mol/L 。
按照GB/T601配制和标定。
间接碘量法测定硫酸铜中铜含量

实验八—(2)间接碘量法测定硫酸铜中铜含量一实验目的掌握用碘法测定硫酸铜的原理和方法二.实验原理:[板书]2Cu2+ + 4I- = 2CuI ↓(白)+I2(红棕)I2 + I- = I3-I2+2S2O32- = S4O62-+2I-指示剂:淀粉近终点时加入近终点时加入KSCN:CuI + SCN- = CuSCN ↓(米色)+ I-终点:篮色突然消失(米色)[讲解] 滴定条件:1.过量的KI作用:○1增大I2的溶解度,降低I2的挥发性○2加快反应速度,提高反应的完全程度2.适当的酸度:⑴.酸度过高:Cu2+催化I-被空气氧化成I2的反应,结果偏高。
⑵.酸度过低:反应不完全,铜离子水解,终点拖长,结果偏低。
⑶.由于氯离子与二价铜离子络合,所以调节酸度不能用盐酸而用硫酸。
3.KSCN只能近终点时加入,否则:6Cu2++ 7SCN- + 4H2O = 6CuSCN ↓+SO42- + HCN +7H+4I2+ SCN- + 4H2O = SO42- +7I-+ ICN +8H+三.实验方法准确称取CuSO4试样0.3~0.4克(三份)于锥型瓶中→3mL 1 mol•L-1H2SO4→水30mL 溶解后→10% KI 7~8mL,♀Na2S2O3溶液滴定至浅黄色→1%淀粉1mL →♀Na2S2O3溶液滴定至浅兰色→5mL10%KSCN →♀Na2S2O3溶液滴定至溶液兰色突然消失即为终点。
四.数据处理Cu% =100%(M Cu=63.55)五.注意事项1.防止铜盐水解加硫酸,不能加盐酸。
2.一份一份加KI,防止I2挥发,开始时快滴、慢摇。
3.淀粉与KSCN的加入要适时,不能过早。
第一步:由菊黄—浅黄(小米粥)第二步:兰色略有紫色第三步:米色(悬浮物)六.思考题1. 硫酸铜易溶于水,为什么溶解时要加硫酸?2.用碘法测定钢含量时,为什么要加入KSCN溶液?如果在酸化后立即加入KSCN溶液,会产生什么影响?加入KSCN溶液,会产生什么影响?3,已知,EθCu2+/Cu+=0.158V,EθI2/I- =0.54V,为什么本法中Cu2+离子却能使I—离子氧化为I2 ?4.测定反应为什么一定要在弱酸性溶液中进行?5.如果分析矿石或合金中的铜,应怎样分解试样?试液中含有的干扰性杂质如Fe3+、NO3-;等离子,应如何消除它们的干扰?1.如果用Na2S2O3标准溶液测定铜矿或钢合金中的铜,用什么基准物标定Na2S2O3溶液的浓度最好?。
间接碘量法测定铜合金中铜含量实验报告

间接碘量法测定铜合金中铜含量实验报告一、实验目的二、实验原理间接碘量法是一种根据一定的分析方法,通过加热剂溶液通过蒸馏的方式使碘变成气体,再通过测量气体中的碘的含量来确定原液的浓度的一种分析方法。
其中,在铜合金实验中,先将铜合金中的干粉与63mL的硝酸混合,加热提取,经过滤分离以去除杂质,再加入碘酸将铜成分转化成铜碘,再通过真空蒸馏使铜碘分解,蒸发成无色无气体状的气体,最后通过对无色无气状的气体中的碘的测量含量,从而可以得到该样品中铜的浓度,以及样品中铜含量的值。
三、实验步骤1. 将1.2克的铜合金干粉加入滤瓶中,再加入70mL的稀硝酸中,加入搅拌棒混合;2. 将混合液定容至100mL,灌入石蜡封口的真空蒸馏收集管中,加热提取;3. 通过滤筛将提取液经过筛分由杂质;4. 将滤分后的液体容量调节至30mL,并加入3-3.5mL的碘酸;5. 用真空抽引真空蒸馏仪,真空蒸馏仪加热,使气体通过Co柱进行洗净;6. 将洗净后的气体浓度在Na柱上进行测定,记录碘浓度对应的原液碘浓度;7. 根据测定的碘浓度,计算实验样品中铜含量的含量。
四、实验结果实验结果如下所示:样品中铜含量:98.7 mg/L五、实验分析通过本次实验,可以得知样品中铜含量为98.7 mg/L,说明本次实验结果符合预期目标。
本次实验使用真空蒸馏装置,使铜碘分解蒸发,最后通过对无色无气状的气体中的碘的测量含量,从而可以得到该样品中铜的浓度,以及样品中铜含量的值。
六、讨论本次实验使用的真空蒸馏装置的操作非常简单,样品处理效率较高,实验结果符合预期,说明该实验是可靠的。
另外,此类实验有可能受到干扰因素的影响,从而影响实验结果的准确性,所以在实验中需要注意控制各个方面因素,以保证最终得出的实验结果准确可信。
五水硫酸铜制备与提纯及组成的测定铜含量的测定

五水硫酸铜制备与提纯及组成的测定铜含量的测定一、实验目的:1、掌握间接碘量法测铜含量的原理、方法。
2、掌握淀粉指示剂的使用方法。
3、掌握提高间接碘量法测铜含量滴定准确度的措施。
二、实验原理:1. Na2S2O3容液的配制与标定:⑴配制:由于结晶的Na2S2O3 5H2O—般都含有少量杂质,同时还易风化及潮解,所以Na2S2O际准溶液不能用直接法配制,而应采用标定法配制。
Na2S2O3 5H2O需用新沸(CO2T、O2T、杀菌)冷却水配制;加少量Na2CO以减少水中溶解的CO2使溶液呈弱碱性(Na2S2O3在碱中稳定,抑制水解、分解以及微生物生长);暗处置一周(与水中还原性物质反应完全),以减少由于Na2S2O3勺分解带来的误差,得到较稳定的Na2S2O溶液。
(2)标定:Cr2O72-+6l-+14H+===2Cr3++3l2+7H2O(橙)(绿)(黄,浓时棕红)析出的I2再用Na2S2O3§液滴定:I2+2Na2S2O3=S4O62-+2I-指示剂:淀粉终点:蓝(I2-淀粉)f透明绿(Cr3+)1molCr2O72-相当于3I2相当于6molS2O32-,I2与淀粉指示剂作用形成蓝色包合物,当滴下的Na2S2O3f I2按计量关系完全反应后,溶液的蓝色消失即为终点。
、,I •、、+ :注意:⑴12升华,反应应在碘量瓶[(锥形瓶+表面皿)代]中进行;⑵(Cr2O72-+6l-)反应慢,需在暗处(I2见光分解)置5分钟;⑶需过量的Kl(增大I2在水中的溶解度);⑷控制溶液的酸度0.20~0.23mol/L(酸高,I-易被空气氧化,Na2S2O:分解; 酸低反应不定量(Cr2O72- -Cr3+));⑸淀粉指示剂需临近终点时加(淀粉吸附I2)o(3)计算2. 铜含量的测定:⑴在微酸性(20%NH4HF2介质中(PH=3~4;酸度低Cu2+水解、且反应慢,反应不定量。
酸度高Cu2+崔化空气氧化I-、且S2O32分解)Cu2+与过量的I-(溶解I2; 同离子效应使反应完全;既是还原剂,又是沉淀剂)作用生成不溶于水的CuI白色沉淀并定量析出I2:2Cu2++4I-=2CuI J +I2生成的I2用Na2S2O3标准溶液滴定。
化学实验-硫酸铜试样中铜含量的测定

硫酸铜试样中铜含量的测定实验目的:1.掌握间接碘量法测定铜的原理和方法。
2.掌握Na2S2O3标准溶液的配制和标定方法。
实验原理:在酸性溶液中,CU+2与过量的KI反应生成I2,析出的I2用Na2S2O3标准溶液标定,用淀粉作指示剂。
反应如下:2CU+2 + 4I- = 2 CUI↓ + I2I2 + 2 S2O3 2- =2 I- + S4O62-反应需加入过量的IK,一方面可以促使反应完全,另一方面则可生成I3-,使加大I2的溶解度。
为了防止CUI沉淀吸附I-,造成结果偏低,须在反应接近终点时加入SCN-,使CUI转化成溶解度更小的CUSCN,释放出被吸附的I2。
溶液的PH值一般控制在3.0~4.0之间,酸度过高,空气中的氧会氧化I2,酸度过低,CU2+会分解,使反应不完全,且反应速速会变慢,终点拖长。
实验仪器和药品(1)仪器:容量瓶500ml 锥形瓶 250ml 滴定管50ml 量筒分析天平烧杯玻璃棒铁架台(2) Na2S2O3标准溶液1mol·L-1 H2SO4溶液;.10%KSCN溶液;10%KI溶液;1%淀粉溶液6mol/l HCL溶液实验内容及步骤1.Na2S2O3标准溶液的标定移取 K2Cr2O7标准溶液25.00ml于锥形瓶中,加入5ml 10% KI溶液 5ml6mol/l HCL溶液.轻轻摇均,放置在暗处5分钟,再加水稀释至100ml。
用待标定Na2S2O3标准溶液滴定至浅黄绿色时,加入5ml 1% 淀粉溶液,继续滴定至蓝色刚好消失,即为终点。
2.硫酸铜的测定准确称取硫酸铜试样0.5g,至于锥形瓶中,加入1mol/L H2SO4 5ml 蒸馏水40ml。
溶解后加入10%IK溶液5ml,立即用Na2S2O3标准溶液标定至土黄色,然后加入1%5ml淀粉指示剂,滴定至浅蓝色,再加入10%KSCN溶液10ml,摇均,继续用Na2S2O3 标准溶液滴定至蓝色刚好消失,此时溶液为肉的的CUSCN悬浊液,。
硫酸铜中铜含量的测定

硫酸铜中铜含量的测定实验目的:1熟悉分光光度法测定物质的含量的原理和方法2掌握吸收曲线和标准曲线的绘制3学习分光光度计的使用实验原理:硫酸铜的分析方法是在样品中加入碘化钾,样品中的二价铜离子在微酸性溶液中能被碘化钾还原,而生成难溶于稀酸的碘化亚铜沉淀。
以淀粉为指示剂用硫代硫酸钠标准溶液滴定,化学反应为:2+-22-2--223462Cu + 4I = 2CuI + I I + 2S O = S O + 2I矿石和合金中的铜也可以用碘量法测定。
但必须设法防止其他能氧化-I 的物质(如-3NO 、3+Fe 等)的干扰。
防止的方法是加入掩蔽剂以掩蔽干扰离子(比如使3+Fe 生成3-6FeI 配离子而被掩蔽)或在测定前将它们分离除去。
若有As (Ⅴ)、Sb (Ⅴ)存在,则应将pH 调至4,以免它们氧化-I 。
间接碘量法以硫代硫酸钠作滴定剂,硫代硫酸钠(Na 2S 2O 3·5H 2O )一般含有少量杂质,比如S 、Na 2SO 3、Na 2SO 4、Na 2CO 3及NaCl 等,同时还容易风化和潮解,不能直接配制准确浓度的溶液,故配好标准溶液后还应标定其浓度。
本实验就是利用此方法测定CuSO 4中铜的含量,以得到CuSO 4试剂的纯度。
试剂与仪器Na 2S 2O 3·5H 2O ;Na 2CO 3(固体);纯铜(99.9%以上);6 mol ·L -1HNO 3溶液;100 g ·L -1KI 溶液;1+1和1 mol ·L -1H 2SO 4溶液;100 g ·L -1KSCN 溶液;10 g ·L -1淀粉溶液电子天平;碱式滴定管;碘量瓶 实验步骤 0.05 mol·L -1Na 2S 2O 3溶液的配制:称取12.5 g Na 2S 2O 3·5H 2O 于烧杯中,加入约300 mL 新煮沸后冷却的蒸馏水溶解,加入约0.2 g Na 2CO 3固体,然后用新煮沸且冷却的蒸馏水稀释至1 L ,贮于棕色试剂瓶中,在暗处放置1~2周后再标定。
硫酸铜中铜含量的测定
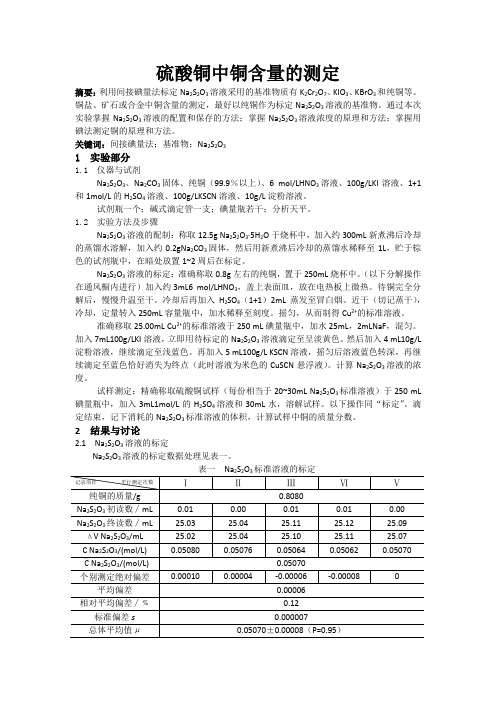
硫酸铜中铜含量的测定摘要:利用间接碘量法标定Na2S2O3溶液采用的基准物质有K2Cr2O7、KIO3、KBrO3和纯铜等。
铜盐、矿石或合金中铜含量的测定,最好以纯铜作为标定Na2S2O3溶液的基准物。
通过本次实验掌握Na2S2O3溶液的配置和保存的方法;掌握Na2S2O3溶液浓度的原理和方法;掌握用碘法测定铜的原理和方法。
关键词:间接碘量法;基准物;Na2S2O31实验部分1.1 仪器与试剂Na2S2O3、Na2CO3固体、纯铜(99.9%以上)、6 mol/LHNO3溶液、100g/LKI溶液、1+1和1mol/L的H2SO4溶液、100g/LKSCN溶液、10g/L淀粉溶液。
试剂瓶一个;碱式滴定管一支;碘量瓶若干;分析天平。
1.2 实验方法及步骤Na2S2O3溶液的配制:称取12.5gNa2S2O3∙5H2O于烧杯中,加入约300mL新煮沸后冷却的蒸馏水溶解,加入约0.2gNa2CO3固体,然后用新煮沸后冷却的蒸馏水稀释至1L,贮于棕色的试剂瓶中,在暗处放置1~2周后在标定。
Na2S2O3溶液的标定:准确称取0.8g左右的纯铜,置于250mL烧杯中。
(以下分解操作在通风橱内进行)加入约3mL6 mol/LHNO3,盖上表面皿,放在电热板上微热。
待铜完全分解后,慢慢升温至干。
冷却后再加入H2SO4(1+1)2mL蒸发至冒白烟、近干(切记蒸干),冷却,定量转入250mL容量瓶中,加水稀释至刻度。
摇匀,从而制得Cu2+的标准溶液。
准确移取25.00mLCu2+的标准溶液于250 mL碘量瓶中,加水25mL,2mLNaF,混匀。
加入7mL100g/LKI溶液,立即用待标定的Na2S2O3溶液滴定至呈淡黄色。
然后加入4 mL10g/L 淀粉溶液,继续滴定至浅蓝色。
再加入5 mL100g/L KSCN溶液,摇匀后溶液蓝色转深,再继续滴定至蓝色恰好消失为终点(此时溶液为米色的CuSCN悬浮液)。
计算Na2S2O3溶液的浓度。
实验9 间接碘量法测定铜盐中的铜(讲稿)

微生物实验九 间接碘量法测定铜盐中的铜一、实验目的1、掌握碘量法测定铜盐中铜的原理和方法。
2、掌握硫代硫酸钠标准溶液的配制与标定方法。
3、了解淀粉指示剂的作用原理。
二、实验原理在弱酸性条件下,Cu 2+与过量的 KI 作用生成难溶性的CuI 和I 2,反应方程式为: 2Cu 2+ + 5I - = 2CuI ↓ + I 3-生成的I 2以淀粉为指示剂,用Na 2S 2O 3标准溶液滴定,反应方程式为: I 3 - + 2S 2O 3 2- = 3 I - + S 4O 62-在测定Cu 2+时,通常控制溶液的酸度为pH=3~4。
酸度过低,由于二价铜离子的水解,使反应不完全,结果偏低,而且反应速度慢,终点拖长;酸度过高,则I - 被空气中的氧气氧化为I 2(Cu 2+催化此反应),使结果偏高。
市售的Na 2S 2O 3·5H 2O 试剂常含有少量杂质,且易风化和潮解,因此,Na 2S 2O 3标准溶液采用间接法配制。
Na 2S 2O 3溶液不够稳定,容易分解。
水中的CO 2、细菌和光照都能使其分解,水中的O 2也能将其氧化,发生下列反应:Na 2S 2O 3 Na 2SO 3 + S↓S 2O 32- + CO 2 + H 2O → HSO 3- + HCO 3- + S↓ S 2O 32- + 1/2 O 2 → SO 42- + S↓故配制Na 2S 2O 3溶液时,最好采用新煮沸并冷却的蒸馏水,以除去水中的CO 2和O 2并杀死细菌;加入少量Na 2CO 3使溶液呈弱碱性以抑制Na 2S 2O 3的分解和细菌的生长;储存于棕色瓶中,放置几天后再进行标定。
长期使用的溶液应定期进行标定。
标定Na2S2O3标准溶液的基准物质有K2Cr2O7和KIO3等,其中以K2Cr2O7最常用。
K2Cr2O7易提纯,不易吸湿,性质稳定。
在酸性条件下,基准物质与过量KI作用,析出的I2以淀粉为指示剂,用Na2S2O3溶液滴定。
硫酸铜中铜含量的测定(碘量法)

硫酸铜中铜含量的 测定(碘量法)
CuSCN吸附I2的倾向较小,因而可以提高测定结果的准确度。 根据Na2S2O3标准溶液的浓度、消耗的体积及试样的重量,计算 试样中铜的含量。
分析化学
硫酸铜中铜含量的 测定(碘量法)
一、 实验目的
掌握铜盐中铜 的测定原理和碘 量法的测定方法。
学习终点的判 断和观察。
硫酸铜中铜含量的 测定(碘量法)
二、 实验原理
在酸性介质溶液中(pH为3~4)Cu2+与过量的I-作用生成 难溶的CuI沉淀并定量析出I2:
生成的I2用Na2S2O3标准溶液滴定,以淀粉为指示剂,滴定 至溶液的蓝色刚好消失,即为终点。
一般采用间接碘量法Na2S2O3标准溶液标定。标定的基准物 质有纯铜、重铬酸钾、碘酸钾、溴酸钾等。本实验用重铬酸钾作 标定的基准物质,反应为
硫酸铜中铜含量的 测定(碘量法)
三、 仪器与药品
仪器:10 mL量筒三只、50 mL量筒一只, 酸式滴定管,锥形瓶,洗耳球
药品:H2SO4(1 mol·dm-3),KSCN溶 液(10%),KI溶液(10%),1%的淀粉溶 液,碳酸钠(固体,A.R),K2Cr2O7(基准物), Na2S2O3溶液(0.10 mol
七、 考题
(1)滴定到终点后,很快返蓝,可能的原因有哪 些?
(2)间接碘法的误差来源有哪些?如何减免? (3)配制Na2S2O3标准溶液时,为什么要用新煮 沸的冷蒸馏水?
硫酸铜中铜含量的 测定(碘量法)
一、 实验目的
硫酸铜中铜含量的测定

硫酸铜中铜含量的测定一.实验目的1. 掌握间接碘法测定铜含量的原理和方法。
2. 掌握Na2S2O3标准溶液的配制与标定。
二. 实验原理Cu2+离子在酸性溶液中与过量KI反应:2Cu2+ + 4 I– =2CuI↓+ I2形成CuI沉淀,并生成与铜量相当的I2,析出的I2用硫代硫酸钠标准溶液滴定,由此可以间接计算铜含量。
由于CuI沉淀表面容易吸附I2(I–离子),会造成测定结果偏低,故在终点到达之前加入KSCN,一则可以生成溶度积更小的CuSCN沉淀,释放出I–,减少了KI的用量;二则SCN–离子更容易被CuSCN所吸附,从沉淀表面取代出吸附的碘,促使测定反应趋于完全。
三. 仪器与试剂仪器:电子天平(0.1mg),酸式滴定管(50ml),移液管(25mL),容量瓶(250ml)。
试剂:Na2S2O3 5H2O (A.R),KBrO3 (基准试剂),Na2CO3 (s),H2SO4 (1mol L−1),KI (20%), KSCN(10%),淀粉溶液(0.2%)。
四. 实验步骤1. 硫代硫酸钠标准溶液的配制和标定硫代硫酸钠溶液的标定通常选用KBrO3作基准物,定量将I–氧化为I2,再按碘量法用Na2S2O3溶液滴定。
反应如下:BrO3–+ 6 I– + 6H+ =3 I2 + Br− + 3H2OI2 + 2S2O32− = 2I− + S4O62−除KBrO3外,也可选用KIO3或K2Cr2O7等氧化剂作基准物。
Na2S2O3 5H2O 通常都含有少量杂质,如S、Na2SO3、Na2SO4等,且易风化,潮解,因此不能直接配制成准确浓度的溶液。
Na2S2O3溶液易受空气和微生物的作用而分解,因此要用新煮沸冷却的去离子水配制溶液,并加入少量Na2CO3,保持微碱性,以防Na2S2O3在酸性溶液中分解。
标准溶液配制后亦要正确保存。
(1)0.1mol L−1 Na2S2O3溶液的配制称取Na2S2O3 5H2O12.5g置于小烧杯中,加入约0.1g Na2CO3,用新煮沸经冷却的蒸馏水溶解并稀释至500mL,保存于棕色瓶中,在暗处放置7天后再标定。
间接碘量法测CuSO4

间接碘量法测CuSO4•5H2O溶液中Cu2+含量的不确定度评定摘要:本实验采用间接碘量法测定CuSO4•5H2O溶液中铜含量,根据《化学分析中不确定度的评估指南》一书中的程序对测量结果的不确定度进行评定,并分析各参数对实验结果的不确定度的影响,进而提出减小测量结果不确定度的改进措施。
关键词:CuSO4•5H2O间接碘量法不确定度改进措施Indirectly Measured by Iodine V olume Method CuSO4 • 5 H2O Solution Cu2 + Levels of Uncertainty AssessmentZhang QingjieThe Secondary Middle School,Cheku,Xinjiang 842000Abstract: This experiment is used by iodine volume method to determine the indirect CuSO4 • 5 H2O solution copper content, according to the chemical analysis of uncertainty assessment guide a book of program on the uncertainty of measurement results is evaluated, and analysis of the test results the parameters uncertainty effects, and the paper puts forward a decreasing of uncertainty of improvement measures.Key Words: CuSO4•5H2O, indirectly measured by Iodine volume method, uncertainty, improvement measures.随着社会的进步,科技的发展,国际贸易间不断扩大,市场竞争日益激烈,人们对分析检测工作的质量要求也越来越高。
无机及分析化学实验-碘量法测硫酸铜中的铜含量

实验题目:碘量法测硫酸铜中的铜含量一、实验目的1. 掌握Na2S2O3标准溶液的配制方法;2. 了解K2Cr2O7标定Na2S2O3溶液的原理和方法;3. 掌握碘量法测铜的基本原理和操作条件;4. 了解碘量法的误差来源。
二、实验原理1. Na2S2O3标准溶液的标定标定基准物:K2Cr2O7标定反应:K2Cr2O7 + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2OI2 + 2S2O32- = 2I- + S4O62-计量比:K2Cr2O7 ~6Na2S2O3标定反应的条件:(1)开始滴定时酸度应控制在0.8~1.0 mol⋅L-1为宜,酸度高可提高反应速度,过高则I-易被氧化。
(2) K2Cr2O7与KI反应速率较慢,故应在暗处放置一定时间再滴。
(3)指示剂淀粉应在近终点时(溶液呈黄绿色时)加入,滴至蓝色恰好消失,否则大量的I2与淀粉结合成蓝色物质,不易与Na2S2O3反应。
2. 铜含量的测定测定反应:2Cu2+ + 4I- = 2CuI↓ + I2I2 + 2S2O32- = 2I- + S4O62-计量比:Cu2+~Na2S2O3测定反应的条件:(1)近终点时加入KSCN,发生反应CuI+SCN- =CuSCN ↓+ I-6Cu2++7SCN-+4H2O=6CuSCN↓+SO42-+HCN+7H+(2)溶液的pH应控制在3.3~4.0(3)加入NH4HF2,一方面掩蔽Fe3+,另一方面调节溶液的pH三、实验器材及药品(1)抽屉里物品详单(2)试剂架物品及药品四、实验内容1. 0.05mol/L Na2S2O3标准溶液的配制在边台称取5g Na2S2O3·5H2O加入到棕色瓶中,加400 mL去离子水中,盖紧盖子摇匀,待溶解后,备用。
2. 0.05mol/L Na2S2O3标准溶液的标定到304分析天平室,准确称取0.05-0.07g已烘干的重铬酸钾于250mL碘量瓶中,用约20mL水溶解,加入20%KI溶液5 mL,2mol/L H2SO4 5mL,混匀后,盖好磨口玻璃塞并向瓶塞周围吹入少量去离子水以密封,放于暗处5分钟。
实验十二间接碘量法测定铜盐中的铜

实验十二间接碘量法测定铜盐中的铜实验十二间接碘量法测定铜盐中的铜一、实验目的掌握用间接碘量法测定铜的原理和方法。
二、实验原理Cu2+离子在酸性溶液中与KI发生下列反应:2Cu2++4I- =2CuI↓+I2析出的I2再用Na2S2O3标准溶液滴定:I2+2S2O32-=S4O62-+2I-由此可以计算出铜的含量。
Cu2+与I-的反应是可逆的,为了促使反应趋于完全,必须加入过量的KI,但CuI沉淀强烈吸附I2,使测定结果偏低。
如果加入KSCN,使CuI(K SP=1.1?10-12)转化为溶解度更小的CuSCN(K SP=1.1?10-15),就可以使用较少的KI而能使反应进行得更完全,但是KSCN只能在接近终点时加入,否则较多的I2会明显地被KSCN所还原而使结果偏低:SCN-+4I2+4H2O =SO42-+7I-+ICN+8H+同时,为了防止铜盐水解,反应必须在酸性溶液中进行。
酸度过低,铜盐水解而使Cu2+离子氧化I-离子进行不完全,造成结果偏低,而且反应速度慢,终点拖长;酸度过高,则I-离子被空气氧化为I2(Cu2+离子催化下),使结果偏高。
因Cl-离子能与Cu2+离子络合,影响I-离子对络合物Cu(Ⅱ)的定量还原,所以最好用硫酸而不用盐酸调节测定用酸度。
三、实验仪器及试剂仪器:分析天平,滴定管,移液管,锥形瓶试剂:0.10 mol·L-1 Na2S2O3标准溶液,1 mol·L-1H2SO4,10%KI溶液,1%淀粉溶液,10%KSCN 溶液。
四、实验步骤准确称取硫酸铜试样(每份质量相当于20~30 mL 0.10 mol·L-1Na2S2O3标准溶液:0.5~0.7克)于250 mL锥形瓶中,加1 mol·L-1H2SO4溶液3 mL和水30 mL使之溶解。
加入10%KI 溶液7~8 mL,立即用Na2S2O3标准溶液滴定至呈浅黄色。
再加入1%淀粉溶液1 mL,继续滴定到呈浅蓝色。
实验五 硫酸铜中铜含量的测定

硫酸铜样品、10% KI(水溶液),10% KCNS,
0.5% 淀粉溶液,0.1 mol/L Na2S2O3标准溶液。
四、实验步骤
准确称取硫酸铜样品0.6克左右,置于250 mL锥形瓶 中,加5 mL 1 mol/L H2SO4,100 mL水,10 mL 10% KI溶 液,立即用Na2S2O3 标准溶液滴定至呈现浅黄色然后加入 5 mL 0.5% 淀粉溶液,继续滴定至浅兰色,再加入10 mL 10% KCNS 溶液,混匀后溶液又转为深蓝,最后用
实验五
硫酸铜中铜 含量的测定
一、实验目的
1.掌握间接碘量法测定铜的原理和方法; 2.巩固滴定分析的基本操作。
二、实验原理
在酸性溶液中,Cu2+ 与过量KI反应生成碘化亚铜 沉淀,并析出与铜量相当的碘,
2Cu2+ + 4I === 2CuI + I2
I2 + I === I3 用Na2S2O3标准溶液滴定析出的I2 ,由此可计算出 铜含量。 I2 + 2S2O32- = 2I- +S4O62-
3.如何确定终点到达?
七、注意事项
1.KSCN溶液只能在临近终点时加入,否则大量I2的存
在有可能氧化SCN-,从而影响测定的准确度。
2.淀粉指示剂不宜加入太早。否则I2与淀粉提前结合成
兰色物质,这部分I2不易与Na2S2O3反应,导致滴定分 析误差。
由于碘化亚铜沉淀表面容易吸附I3 ,使测定结果
偏低。通常需在终点到达之前加入硫氰酸钾,使CuI沉
淀转化为溶度积更小的CuSCN沉淀。 CuI + SCN === CuSCN + I CuSCN不吸附I2,从而使被CuI吸附的那部分I2释放 出来,提高了测定的准确度。
分析化学题库以及答案

三、计算题:1. 用0.1000 mol/LNaOH 溶液滴定20.00ml 0.1000 mol/LHCl 的水溶液,选用甲基橙作指示剂, pH 终=4.4; 若选用酚酞作指示剂, pH 终=9.0,终点误差TE 各为多少?2. 氨性缓冲溶液控制pH=9.0时,用EDTA 滴定同浓度的Zn 2+溶液,求ZnY 的条件稳定常数lgK ′。
(已知:[NH 3]=0.1mol/L,[Zn(NH 3)4]2+各累积稳定常数分别为lg β1=2.27,lg β2=4.61,lg β3=7.01,lg β4=9.06,lg αZn(OH)=0.2,lg αY(H)=1.29,lgK ZnY =16.50)3.间接碘量法测定硫酸铜中的铜含量,称取硫酸铜试样0.5102g, 用去0.1000mol/l 的Na 2S 2O 3标液20.10ml,求铜的百分含量。
(Cu的摩尔质量为63.54)4. 有一标准Fe 3+溶液,浓度为6μg/ml,显色后在最大吸收波长下测定其吸光度为0.304,而样品溶液在同一条件下测得吸光度为0.510,求样品溶液中Fe 3+的含量(μg/ml).1. 移取混合碱试液25.00ml,双指示剂法测定,用0.1000mol/L 的HCl 溶液滴定,酚酞变色时,用去HCl 溶液30.00ml, 甲基橙变色时,又用去HCl 溶液20.00ml,求试液中各碱组分的物质的量浓度。
(混合碱可能成分有Na 2CO 3 NaHCO 3 NaOH )2 . 计算pH=10.0时,[NH 3]=0.1mol/L 溶液中Zn 2+/Zn 电对的条件电极电位(忽略离子强度的影响)。
已知:Zn 2+/Zn 电对的标准电极电位为-0.763V,Zn(NH 3)42+的lg β1~lg β4分别为2.27,4.61,7.01,9.06。
3.用邻苯二甲酸氢钾标定氢氧化钠的浓度,称取邻苯二甲酸氢钾0.5023g,滴定时耗去氢氧化钠溶液27.63ml,计算NaOH溶液的浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验八—(2)间接碘量法测定硫酸铜中铜含量
一实验目的
掌握用碘法测定硫酸铜的原理和方法
二.实验原理:
[板书]2Cu2+ + 4I- = 2CuI ↓(白)+I2(红棕)
I2 + I- = I3-
I2+2S2O32- = S4O62-+2I-
指示剂:淀粉近终点时加入
近终点时加入KSCN:CuI + SCN- = CuSCN ↓(米色)+ I-
终点:篮色突然消失(米色)
[讲解] 滴定条件:
1.过量的KI作用:
○1增大I2的溶解度,降低I2的挥发性
○2加快反应速度,提高反应的完全程度
2.适当的酸度:
⑴.酸度过高:Cu2+催化I-被空气氧化成I2的反应,结果偏高。
⑵.酸度过低:反应不完全,铜离子水解,终点拖长,结果偏低。
⑶.由于氯离子与二价铜离子络合,所以调节酸度不能用盐酸而用硫酸。
3.KSCN只能近终点时加入,否则:
6Cu2++ 7SCN- + 4H2O = 6CuSCN ↓+SO42- + HCN +7H+
4I2+ SCN- + 4H2O = SO42- +7I-+ ICN +8H+
三.实验方法
准确称取CuSO4试样~克(三份)于锥型瓶中→3mL 1 mol•L-1H2SO4→水30mL溶解后→10% KI 7~8mL,♀Na2S2O3溶液滴定至浅黄色→1%淀粉1mL →♀Na2S2O3溶液滴定至浅兰色→5mL10%KSCN →♀Na2S2O3溶液滴定至溶液兰色突然消失即为终点。
四.数据处理
Cu% =
100%
(M Cu=
五.注意事项
1.防止铜盐水解加硫酸,不能加盐酸。
2.一份一份加KI,防止I2挥发,开始时快滴、慢摇。
3.淀粉与KSCN的加入要适时,不能过早。
第一步:由菊黄—浅黄(小米粥)
第二步:兰色略有紫色
第三步:米色(悬浮物)
六.思考题
1. 硫酸铜易溶于水,为什么溶解时要加硫酸
2.用碘法测定钢含量时,为什么要加入KSCN溶液如果在酸化后立即加入KSCN溶液,会产生什么影响加入KSCN溶液,会产生什么影响
3,已知,EθCu2+/Cu+=,EθI2/I- =,为什么本法中Cu2+离子却能使I—离子氧化为I2
4.测定反应为什么一定要在弱酸性溶液中进行
5.如果分析矿石或合金中的铜,应怎样分解试样试液中含有的干扰性杂质如Fe3+、NO3-;
等离子,应如何消除它们的干扰
1.如果用Na2S2O3标准溶液测定铜矿或钢合金中的铜,用什么基准物标定Na2S2O3溶液的浓度最好。
