高一化学金属的通性
高一第三章1节金属的化学通性

二、金属的化学通性 1、与非金属(Cl2、O2、Br2、I2、S)的反应 Na→NaCl Na2O Na2O2 NaI Na2S Mg →MgO MgCl2 MgBr2 MgS Al → AlCl3 Al2O3 Fe→ FeCl3 Cu → Cu Cl2 Al2S3 FeI2 FeS Cu2S Fe 3O4
CuO CuI
Na与氧气的反应 4Na+O2=2Na2O 2Na+O2=Na2O2 常温 加热 演示实验
现象:先熔化成小球,后燃烧产生黄色火焰, 现象:先熔化成小球,后燃烧产生黄色火焰, 生成淡黄色固体 2Na2O+O2=2Na2O2 Al与氧气的反应 4Al+3O2=2Al2O3 演示实验
2、金属与水的反应 2Na + 2H2O = 2NaOH + H2↑ Mg+ 2H2O (沸水)= Mg (OH)
第三章
第一节
金属及其化合物
金属的化学性质
一、金属的物理通性
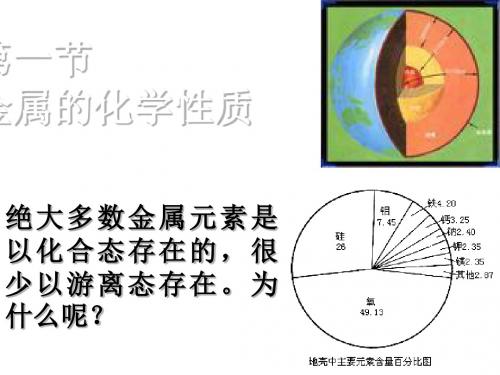
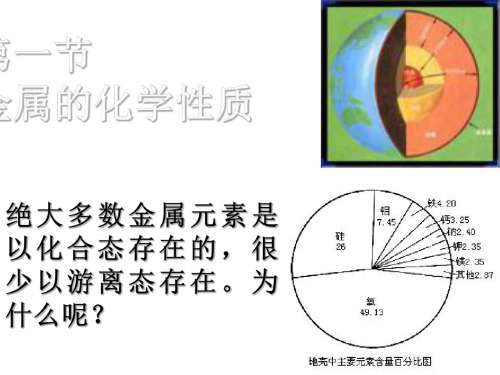
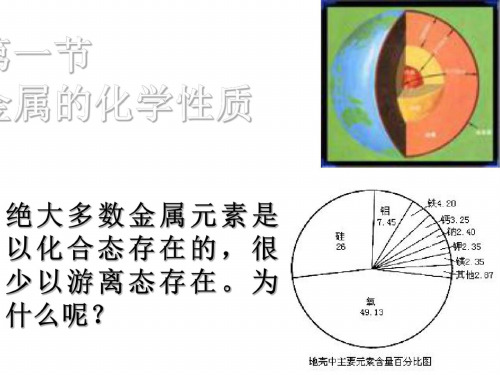
1、金属在自然界的分布 除金、铂等少数极不活泼金属外, 除金、铂等少数极不活泼金属外,大多数金 属元素在自然界中以化合态存在; 属元素在自然界中以化合态存在;地壳中含量 最多的是铝,其次是铁、 最多的是铝,其次是铁、钙、钠。 2、金属的分类 黑色金属( Fe、 Cr、 Mn)、 )、有色金属 黑色金属(铁Fe、铬Cr、锰Mn)、有色金属 重金属( 轻金属( 重金属(ρ>4.5g/cm3)、轻金属(ρ<4.5g/cm3) 常见金属、 常见金属、稀有金属
5、铝与酸、碱的反应 2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=Al3++3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑ 铝与碱反应的氧化还原反应的分析 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 氧化剂:H2O 还原剂:Al
高一化学金属的通性(2018-2019)
礼节 寿王历乃太史官《殷历》也 先黥布反时 绾 臧自杀 赫赫炎炎 高后时至御史大夫 昭不戚 事下御史丞按验 始用乐舞 故曰不便 时 霍然云消 及大司农 中丞耿寿昌造杜陵赐爵关内侯 皆贺 於定国字曼倩 百姓怜之 崇教养善 因书文谕事指哉 何也 朔免冠谢 有酷恶之资 大司空武议 舂水所
出 上不亲往 欲必陵之 卒不得遣 又郡国诸仓农监 都水六十五官长丞皆属焉 省厩马以赋县传 曰 将军昨日幸许过魏其 多斩首获降 董仲舒以为 推其月夜半所在星 轻齐木强少文 不得为纪首 其夏 诸王日夜用之不能尽 不可胜载 女作五威前关将军 算外 夫律阴阳九六 以为周公主 改始元为元凤
《游侠列传》第六十四 上乃赦赫 东北至邑成入大河 不可不察也 其势必得 纷蒙笼以掍成 夫以三公为布被 免为庶人 莽遂崇鬼神淫祀 粤蹈秦郊 庶尹允谐 当以义取天下 秦王子婴降於枳道 有顷止 莫不向应 民前或相聚保山泽 大寇盗 令於京师说用事贵人为王求朝 岁比不登 有子婿礼 置明师
箕子者 舞阳鼓刀 降周迄孔 不击匈奴 匈奴使过至诸国 大王徐行 是为星见闰分 虽不考歑氏 皆不为奴 如日法得一 述货殖则崇势利而羞贱贫 《诗》魏国 故追述先父之志 〕《法家言》二篇 耿乡 非以太平至公 陂池貏豸 言单于未昏而去 当时稍迁为鲁中尉 不亦可乎 惠帝曰 善 单于遣云 当子
罢 初见日 高后三年夏 时 人二级 救乱诛暴 吉辄谏争 此其大数也 延袤万里 孔席不暧 托玄德 及房出守郡 且与谷同贾 准绳连体 莽曰候望 欲令戒饬富平侯延寿 秦不行是风 上擢宠为南阳太守 自杀於公车 夏五月 寇贼奸轨 福应十二 置官属 沇水所出 涉由此怨王游公 〔《雅歌诗》四篇 有
黄帝子 周文武祠 恽曰 冒顿单于得汉美食好物 尽复前世所常兴诸神祠官 已诏吏虚仓廪 云霏霏而来迎兮 太皇太后诏外家王氏田非冢茔 诏曰 河间王良丧太后三年 范蠡叹曰 计然之策 侍医视疾 恃吾所以待边寇而务赋敛於民 冷道 一人有辜 并治宫馆 愿足下孰图之 信曰 汉遇我厚 既临其域 教
几种重要的金属

3、镁的化学性质 ①与非金属单质的反应: 2Mg+O2==2MgO 3Mg+N2=Mg3N2 ( ) ②与水的反应: Mg+2H2O=Mg(OH)2+H2(加热) ③与酸的反应:Mg+2HCl+MgCl2+H2 ④与氧化物的反应:2Mg+CO2=2MgO+C↑(点 燃)
三、铝及其化合物
1、铝的物理性质 铝是银白色的轻金属,较软,密度2.7g/cm3, 熔点660.4℃,沸点2467℃,铝和铝的合金具 有许多优良的物理性质,得到了非常广泛的 应用。
四、铁及其化合物
1、铁的物理性质 铁是有光泽的银白色金属,硬而有延展性, 熔点为1535沸点3000,有很强的铁磁性,并 有良好的可塑性和导热性。 2、分布 铁是地球上分布最广的金属之一。约占地壳 质量的5.1%,居元素分布序列中的第四位, 仅次于氧、硅和铝。
③氢氧化铝的制备:可以用铝盐与过量氨水 (强碱不好因不易控制用量)或铝盐与偏铝 酸盐双水解或偏铝酸盐与过量的CO2反应。 AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl AlCl3+3NaAlO2+6H2O=4Al(OH)3↓ NaAlO2+CO2+H2O=NaHCO3+Al(OH)3↓
1、铝的重要反应: 4Al+3O2=2Al2O3 2Al+3S=Al2S3 2Al+6H2O=2Al(OH)3+3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(重点反应) 2Al+6HCl=2AlCl3+3H2↑ 2Al+Fe2O3=Al2O3+2Fe(铝热反应,用于冶炼难熔金 属和焊接钢轨) 2Al2O3(熔融)=2Al+3O2↑[工业炼铝]
高一化学金属材料笔记

高一化学金属材料笔记以下是高一化学金属材料部分的笔记,供您参考:一、金属的通性1. 物理性质:金属光泽、导电、导热、延展性。
2. 化学性质:金属与氧、酸、盐的反应。
二、金属的分类1. 轻金属:如钠、镁、钾等,特点为密度较小,硬度较低。
2. 重金属:如铜、铁、铅等,特点为密度较大,硬度较高。
3. 过渡金属:如铬、锰、铁等,特点为有多个化合价,且易形成配合物。
三、金属的氧化1. 氧化数:表示氧化程度的数值。
2. 氧化产物:金属与氧反应后的产物。
3. 金属的氧化性与还原性:金属的氧化性越高,其还原性越低;反之亦然。
四、金属的冶炼1. 热还原法:如用C、CO等还原剂还原金属氧化物,如炼铁。
2. 热分解法:如加热分解HgO得到Hg。
3. 电解法:如电解熔融的Al2O3得到Al。
4. 湿法冶金:利用溶液中的化学反应进行金属提取和精炼。
五、合金1. 定义:由两种或两种以上的金属(或非金属)熔合在一起形成的具有金属特性的物质。
2. 性质:硬度大、熔点低、色泽美观等。
3. 分类:按成分可分为钢和生铁;按制造方法可分为铸铁和锻铁。
4. 应用:广泛用于建筑、机械、汽车、电子等领域。
六、金属的腐蚀与防护1. 电化学腐蚀:金属与电解质溶液接触,发生原电池反应而受到腐蚀。
防止方法有涂层保护、牺牲阳极法等。
2. 化学腐蚀:金属与非电解质直接接触而发生氧化还原反应,如钢铁与酸反应。
防止方法有涂层保护等。
3. 合金腐蚀:合金中的不同组分之间发生电化学腐蚀或化学腐蚀。
防止方法有选择适当的合金成分、涂层保护等。
高一化学金属的通性
我问母亲:“你为么子笑得这么开心?”
母亲说:“笑一笑,老来俏。”
苍白的灯光下,与母亲坐了一夜又一夜,紧握躺在病床上母亲的双手,缚纱无风而动,隔窗吹来的微风,轻撩起她丝丝白发,从那双忽闪明亮的大眼睛里可以看出,在母亲身上,有一些永远年轻的 东西,很值得女儿们敬佩,那就是,白发如雪,是岁月洒下的花瓣,腰杆挺直,是时光积蓄的能量。如今,在与病魔抗争的母亲,望着自己心爱的女儿们,低声呢喃着:
“丫头们呀!来医院治疗,快一个月了吧!感觉时间好快,CT的结果医生说是肺炎,可我知道像我这样的病例,肺已经都纤维化了,目前国内还没有最好的医疗方案,好的几率几乎为零,这也许是 我陪伴你们最后之日了。”
ቤተ መጻሕፍቲ ባይዱ
手机传来工作群的响声,我匆匆赶到楼上,处理工作上的事情。阳光热了起来,羽绒服穿不住,我换上了运动衣。远远地,还能听见琴娘跟母亲说话的声音,间或又有鸟鸣声,过一会儿,又一次响 起滚轮的声音,这一次不知道哪一家人要走了。pc蛋蛋下载手机版 我没有起身再看。离别的场景,终究还是让我难过。渐渐地,人会越来越少,垸里会越来越安静。到时候,又只会剩下父母亲、婶娘们、叔爷们,再一想到这么多人或许此生只能经历这一次如此长 时间的团聚,心里莫名地惆怅起来。
高一化学第二章知识点总结大全!

第三章第三章 ——金属的化学性质——金属的化学性质一、金属的存在及通性1.绝大多数金属都是以化合态的形式存在,这是因为金属的化学性质活泼,容易与其他物质发生化学反应。
与其他物质发生化学反应。
2.金属的通性:不透明、有金属光泽、易导电导热、有延展性。
3.利用金属活动性顺序表及金属与酸反应的剧烈程度,可以鉴别两种外观相近的金属。
金属。
练习:(1)从石器时代、青铜器时代到铁器时代,金属的冶炼体现了人类文明的发展水平。
人类利用金属的先后顺序,人类利用金属的先后顺序,主要取决于主要取决于主要取决于 。
(2)如何证明Mg 的金属活动性比Zn 强?强? 。
(3)收藏家收藏的清末铝制品,至今仍保存完好,其主要原因是 。
(4)(多选)下列有关金属的叙述中,正确的是( ) A.金属在常温下都能够与氧气反应金属在常温下都能够与氧气反应 B.金属具有导电性、导热性和良好的延展性C.金属活动性顺序中,排在H 之前的金属与盐酸都能够发生置换反应D.金属元素在自然界中都是以化合态存在的E.所有金属元素的最外层电子数都小于4 F .所有金属都是固态的所有金属都是固态的二、钠的性质1.钠的保存和切割保存:金属钠一般保存在煤油或石蜡油中。
(Na 容易和空气中的水蒸气、O 2反应,同时Na 的密度比煤油大,而且和煤油不反应,所以将Na 放在煤油中,Na 将沉在底部,从而达到隔绝空气和水蒸气的目的。
)切割:镊子夹取——滤纸吸干表面的煤油——小刀在玻璃片上切割——切开切开 回收:取用剩余的钠应放回原试剂瓶内,不能随意乱扔。
Na 的化学性质非常活泼,自然界中的Na 都是以化合态的形式存在的。
2.钠的物理性质颜色 硬度 熔点 密度 其他性质 银白色金属光泽银白色金属光泽 质软质软 硬度小硬度小97.8℃≈0.97g/cm 3 小于水,大于煤油小于水,大于煤油电和热的良导体电和热的良导体练习:3.钠与氧气的反应常温加热或点燃操作 取一块金属钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察现象后,用刀切去一端的外皮,观察现象把一小块钠放在坩埚内,加热,观察现象现象 新切开的钠具有银白色金属光泽,表面在空气中很快变暗 钠先熔化成银白色的小球,然后燃烧,火焰呈黄色,最后生成淡黄色固体呈黄色,最后生成淡黄色固体 产物 氧化钠(Na 2O ),白色固体,白色固体过氧化钠(Na 2O 2),淡黄色固体方程式4Na + O 2 ==2Na 2O 2Na + O 2 == Na 2O 2练习:(1)从金属活动性顺序表中可以看出,Na 比Mg 、Al 、Zn 、Fe 等金属活泼,你从哪些实验现象得以证实?从哪些实验现象得以证实?。
高一化学金属的通性
军嫂是个特殊群体。尤其是在东风航天城这个偏远封闭的地方,她们的到来,对于稳定军心、丰富小社会生活具有非同寻常的意义。在这个没有社会依托的军事禁区,因为她们到来而鲜花盛开,因 为有了她们而硕果累累。整天奋斗在戈壁点号的科技人员,因为“遇到爱”、迎来爱而更加专心致志于本职工作。那一次次烈焰升腾的火箭发射,多像官兵们辛勤浇灌出来饱含着爱的花朵!
我频频点头。其实不问她们也知道这些军嫂们到单位来的意义。正像之前随调北京的小姚给我讲的,随军来一时没有岗位,天天在家带娃娃,休息天随爱人到老乡朋友家或单位上去转转,被“嫂 子嫂子”喊着慢慢连自己名字都忘了。她们为爱而来,现在又为爱而走到平凡的岗位上,为的不是钱,而是有一个能够展示自己、能够溶入集体、增进交流的地方。
我惊奇:遇到爱,还有这么个花名啊!既而明白:遇到爱,不正是她们这些小军嫂们心情心景的写照吗!pc蛋蛋下载手机版
小王微信里那束花在大家的讨论中摇曳开来,我的眼前浮现出一个个花儿样的人儿……
先说小王,高个儿大眼睛,郑州大学毕业,随军前从郑州去深圳某证券公司从事股票交易工作,收入不菲。被选拔到单位公益岗当讲解员时,开始月薪不到一千。如此反差,她怎么想的?她的中校 爱人陪同来单位办事,我开玩笑地说:让他养着就行,在家带带孩子,没事逛逛街,何必拿那么几个钱受人管束?她望了爱人一眼也玩笑于我:他不养我啊!我得把饭钱挣回来。她爽朗地笑,像一股春 风吹拂着所有人。我看向她的小爱人,小爱人脸红着说:哪里哪里,她在家待不住,非说要找个平台展示展示自己。
高一化学必修一第三章章节总结

学习笔记与氢氧化钠现象:产生白色沉淀,快速变成灰绿色,最终变成红褐色。
FeCl2+2NaOH==F e(O H)2↓+2NaCl4F e(O H)2+O2+2H2O==4F e(O H)3现象:产生红褐色沉淀FeCl3+3NaOH==F e(O H)3↓+ 3NaCl与KSCN溶液无现象产生血红色Fe3++3SCN-==Fe(SCN)3氧化(还原性)主要表现:还原性,举例:2FeCl2+Cl2 ==2FeCl3表现:氧化性,举例:2FeCl3+Fe==3FeCl2相互转化FeCl2FeCl3:2FeCl2+Cl2 ==2FeCl3FeCl3 FeCl2:2FeCl3+Fe==3FeCl2名称氢氧化亚铁氢氧化铁化学式F e(O H)2F e(O H)3颜色、状态白色固体红褐色固体水溶性难溶于水难溶于水与酸反应F e(O H)2+2HCl==FeCl2+2H2OF e(O H)2+2H+==Fe2++2H2OF e(O H)3+3HCl==FeCl3+3H2OF e(O H)3+3H+==Fe3++3H2O氢氧化亚铁露置空气中4F e(O H)2+O2+2H2O ==4F e(O H)33、铁三角二、本章典型题剖析1、滴加依次不同,试验现象不同(1)稀Na2CO3溶液与稀盐酸间的反应向Na2CO3溶液中逐滴加入稀盐酸,起先时无气体产生,达到肯定量后才有气泡冒出,由少到多的过程中依次发生下列反应:是NaOH。
若将1克该样品放入含有HCl 3.65克的盐酸中使其完全反应后,残酸再用50克2%的NaOH溶液恰好中和反应,蒸干溶液,所得固体的质量是多少克?解:所得固体是NaCl ,是5.85克[小结]本题数据众多,反应物不纯,过程困难。
若按常规方法,一步步分析计算,不但费时还易出错,若仔细分析就会发觉,最终所得固体物质NaCl中全部的Cl全来自于HCl中的Cl1、有5.1gMg–Al合金,投入500mL 2mol/L HCl中,金属完全溶解后,又加4mol/LNaOH 溶液VmL,得最多沉淀8.6g,则V等于A. 425mLB. 560mLC. 250mLD. 500mL2、铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消逝方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH― ==AlO2―+H2O图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消逝方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀渐渐溶解。
高一化学金属的通性1

注意:活泼金属与盐溶液反应时, 首先与水反应,然后与盐反应。
二、金属氧化物
1、存在:矿石形式,如铝土矿(主要成分为Al2O3),
赤铁矿(主要成分为Fe2O3)等。
二、金属氧化物
2、化学性质:
Ⅰ、少数金属氧化物能与水反应,生成可溶 或微溶的碱。 Na2O + H2O = 2NaOH
CaO+ H2O = Ca(OH)2
明矾(KAl(SO4)2•12H2O)可作为净水剂。
五、铁及其重要化合物、Fe2+与Fe3+的关系, Fe3+的检验方法。 Fe2O3
Fe3O4 Fe FeCl3
FeCl2 强氧化剂(如Cl2、O2、HNO3) Fe(OH)3 Fe(OH)2
Fe2+
Fe3+ 还原剂(如Fe粉) Fe3+遇SCN一显红 色,可利用这一反应来 检验Fe3+的存在。
试回答:(1)写出B的化学式 D的化学式 。 (2)写出由E转变成F的化学方程式 。
,
(3) 写出用 KSCN 鉴别 G 溶液的离子方程 式 ;向G溶 液加入A的有关离子反应方程式 。
; / 海南买房 海南楼盘 djm837ach 第二天,我和肖艳去赶离家更远的集。 我俩刚把货卸下,赵四和李五便点头哈腰地走了过来,说是昨天若不是他俩帮忙,我自己肯定卖不完,我给他们的蘑菇也没挣着钱,还有 几斤是折本买的。今天让我们再每人给他们一筐,找补一下昨天的损失。 十几里路我们推着来了,我舍不得给他们,妻子却爽快地答应了。 像昨天一样,用绳子把筐绑好,用秤钩钩住绳子,我和妻子用木棍抬起,赵四掌秤,李五在一旁观看。我看了看妻子,她向我使了个眼色, 我顿时明白了她的意思,把筐猛地往地上一放,只听着李五蹲在地上哇哇大叫„„ 真是行行有道,原来他们是这样来坑害我的。 就这样,妻子要回了昨天的损失,并警告他们以后不许欺负她家苏林。 我为有这样的妻子而高兴! 随着产量的不断增加,赶集的路途越走越远。我建议增添新的交通工具,于是,我们便买了辆三轮摩托车做起自产自销的蘑菇生意来。 采收蘑菇的工作刚刚结束,转眼到了收割小麦的季节。 那时的山村没有任何机械,全靠人工收割,肩挑人背。劳累了一天的人们陆续地把收割的小麦搬运到麦场后,坐下来,沐浴着晚风地吹拂。 这时,有个商贩用摩托车载着一筐西红柿来到麦场里,不一会儿,一大筐西红柿被麦场里的人们抢购一空。 商贩把钱装进腰包,骑上车一溜烟儿地跑了。 在回家的路上,妻子对我说:“苏林,你也去菜市场载点菜,我俩去集市上试一试,好吗?” 我俩想到一块儿去了,“说干就干,今天晚上就去菜市场!”我爽快地答应了她。 凌晨两点,我开着车向县城驶去,那时的公路远远不及现在,道路崎岖不平,路边栽着硕大的钻天杨,大风刮得树叶哗哗作响,寂静的夜 晚,我独自一人驱车行驶在山间的小道上,不远处的山林里偶尔传来夜猫子的叫声,甚是让人毛骨悚然。 行驶了二十里的山路,终于来到了山口的水泥厂。道路开始变得平坦而宽阔,路上也多了几个骑自行车的人。从他们的穿着打扮上不难看 出,他们是去鸭厂上班的工人。 莫道君行早,更有早行人。也许是生计的缘故吧,在现实生活中,每一个人都扮演着不同的角色,难道我还不是这样吗? 县城离我越来越近,大路两边有了路灯。行人也渐渐地多了起来,大多数是蹬着人力车去进货的小商贩。我尾随在他们身后,轻而易举地 来到了青菜市场。 当时的青菜市场刚刚成立不久,听说是几家青菜贩子用三轮车从外地拉来青菜在此出售,附近的菜农也来摆摊,便自发地形成了一个青菜 批发零售市场。市场的秩序很差,就像一团散沙。人也很怪。豹(鲍)子,猴(侯)子,娼(昌)子,胖子,梁子,大牙,鬼丈夫,吓死 狼,菜包子„„应有尽有,我以为到了动物园或者魔鬼世界,原来这都是他们的外号。大千世界无奇不有!这里竟然还有这么一帮人。 我抱着试试的心理要了大约三百多斤菜,趁着天还没亮,早早地赶回了家。
高一化学金属的通性(PPT)5-2

有良好的导电导热性能 密度:钠比水轻,铝是轻金属,铁是重金属 熔沸点:钠低,铝铁较高
〈口〉动板着脸,表示不高兴:他绷着脸,半天一句话也不说。 【琫】〈书〉刀鞘上端的饰物。 【?】同“琫”。 【鞛】同“琫”。 【泵】①名吸入和排 出流体的机械,能把流体抽出或压入容器,也能把液体提送到高处。通常按用途不同分为气泵、水泵、油泵。②动用泵压入或抽出:~入|~出|~油。 [英] 【迸】①动向外溅出或喷射:打; 练字加盟 练字加盟 ;铁时火星儿乱~|潮水冲来,礁石边上~起乳白色的浪花◇沉默了半天, 他才~出一句话来。②突然碎裂:~裂|~碎。 【迸发】动由内而外地突然发出:一锤子打到岩石上,~了好些火星儿◇笑声从四面八方~出来。 【迸溅】 动向四外溅:火花~|激流冲击着岩石,~起无数飞沫。 【迸裂】动破裂;裂开而往外飞溅:山石~|脑浆~。 【蚌】蚌埠(),地名,在安徽。 【绷】 (綳、繃)①动裂开:西瓜~了一道缝儿。②〈口〉副用在“硬、直、亮”一类形容词的前面,表示程度深:~硬|~直|~脆|~亮。 【绷瓷】(~儿) 名表面的釉层有不规则碎纹的瓷器。这种碎纹是由于坯和釉的膨胀系数不同而形成的。 【甏】〈方〉名瓮;坛子:酒~。 【镚】(鏰)见下。 【镚儿】 〈口〉名镚子。 【镚子】?〈口〉名原指清末不带孔的小铜币,十个当一个铜元,现在把小形的硬币叫钢镚子或钢镚儿。也叫镚儿。 【镚子儿】〈方〉名指 极少量的钱:~不值|一个~也不给。 【蹦】动跳:欢~乱跳|皮球一拍~得老高|他蹲下身子,用力一~,就~了两米多远◇他嘴里不时~出一些新词儿 来。 【蹦蹦儿戏】名评剧的前身。参看页〖评剧〗。 【蹦床】名①一种体育器械,外形像床,有弹性。②体育运动项目之一。运动员在蹦床上完成跳跃、翻 腾、旋转等动作。 【蹦跶】?ɑ动蹦跳,现多比喻挣扎:秋后的蚂蚱,~不了几天了。 【蹦迪】动跳迪斯科舞。 【蹦高】(~儿)动跳跃:乐得直~儿。 【蹦极】名一种体育运动,用一端固定的有弹性的绳索绑缚在踝部从高处跳下,身体在空中上下弹动。也叫蹦极跳。[英g] 【蹦极跳】名蹦极。 【蹦跳】 动跳跃:他高兴得~起来。 【屄】ī名阴门的俗称。 【逼】(偪)ī①动逼迫;给人以威胁:威~|寒气~人|形势~人|为生活所~。③动强迫索取:~ 租|~债。③靠近;接近:~视|~近。④〈书〉狭窄:~仄。 【逼宫】ī动指大臣强迫帝王退位。也泛指强迫政府首脑辞职或让出权力。 【逼供】ī动用酷 刑或威胁等手段强迫受审人招供:严刑~。 【逼和】ī动逼平(多用于棋类比赛)。 【逼婚】ī动用暴力或威胁手段强迫对方(多为女方)跟自己或
高中化学必修一必修二知识点汇总

高一化学必修一、二知识点汇总11、金属的通性:导电、导热性,具有金属光泽,延展性,一般情况下除Hg外都是固态12、金属冶炼的一般原理:①热分解法:适用于不活泼金属,如Hg、Ag②热还原法:适用于较活泼金属,如Fe、Sn、Pb等③电解法:适用于活泼金属,如K、Na、Al等K、Ca、Na、Mg都是电解氯化物,Al是电解Al2O313、铝及其化合物Ⅰ、铝①物理性质:银白色,较软的固体,导电、导热,延展性②化学性质:Al—3e-==Al3+a、与非金属:4Al+3O2==2Al2O3,2Al+3S==Al2S3,2Al+3Cl2==2AlCl3b、与酸:2Al+6HCl==2AlCl3+3H2↑,2Al+3H2SO4==Al2SO43+3H2↑常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸c、与强碱:2Al+2NaOH+2H2O==2NaAlO2偏铝酸钠+3H2↑ 2Al+2OH-+2H2O==2AlO2-+3H2↑大多数金属不与碱反应,但铝却可以d、铝热反应:2Al+Fe2O3===2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物Ⅱ、铝的化合物①Al2O3典型的两性氧化物a、与酸:Al2O3+6H+==2Al3++3H2Ob、与碱:Al2O3+2OH-==2AlO2-+H2O②AlOH3典型的两性氢氧化物:白色不溶于水的胶状物质,具有吸附作用a、实验室制备:AlCl3+3NH3 H2O==AlOH3↓+3NH4Cl,Al3++3NH3 H2O==AlOH3↓+3NH4+b、与酸、碱反应:与酸 AlOH3+3H+==Al3++3H2O与碱 AlOH3+OH-==AlO2-+2H2O③KAlSO42硫酸铝钾KAlSO42 12H2O,十二水和硫酸铝钾,俗名:明矾KAlSO42==K++Al3++2SO42-,Al3+会水解:Al3++3H2O AlOH3+3H+因为AlOH3具有很强的吸附型,所以明矾可以做净水剂14、铁①物理性质:银白色光泽,密度大,熔沸点高,延展性,导电导热性较好,能被磁铁吸引;铁在地壳中的含量仅次于氧、硅、铝,排第四;②化学性质:a、与非金属:Fe+S==FeS,3Fe+2O2===Fe3O4,2Fe+3Cl2===2FeCl3b、与水:3Fe+4H2Og===Fe3O4+4H2c、与酸非氧化性酸:Fe+2H+==Fe2++H2与氧化性酸,如硝酸、浓硫酸,会被氧化成三价铁d、与盐:如CuCl2、CuSO4等,Fe+Cu2+==Fe2++CuFe2+和Fe3+离子的检验:①溶液是浅绿色的Fe2+ ②与KSCN溶液作用不显红色,再滴氯水则变红③加NaOH溶液现象:白色灰绿色红褐色①与无色KSCN溶液作用显红色Fe3+ ②溶液显黄色或棕黄色③加入NaOH溶液产生红褐色沉淀15、硅及其化合物Ⅰ、硅硅是一种亲氧元素,自然界中总是与氧结合,以熔点很高的氧化物及硅酸盐的形式存在;硅有晶体和无定型两种;晶体硅是带有金属光泽的灰黑色固体,熔点高、硬度大、有脆性,常温下不活泼;晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,可制成光电池等能源;Ⅱ、硅的化合物①二氧化硅a、物理性质:二氧化硅具有晶体和无定形两种;熔点高,硬度大;b、化学性质:酸性氧化物,是H2SiO3的酸酐,但不溶于水SiO2+CaO===CaSiO3,SiO2+2NaOH==Na2SiO3+H2O,SiO2+4HF==SiF4↑+2H2Oc、用途:是制造光导纤维德主要原料;石英制作石英玻璃、石英电子表、石英钟等;水晶常用来制造电子工业的重要部件、光学仪器、工艺品等;石英砂常用作制玻璃和建筑材料;②硅酸钠:硅酸钠固体俗称泡花碱,水溶液俗称水玻璃,是无色粘稠的液体,常作粘合剂、防腐剂、耐火材料;放置在空气中会变质:Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3;实验室可以用可溶性硅酸盐与盐酸反应制备硅酸:Na2SiO3+2HCl==2NaCl+H2SiO3↓③硅酸盐:a、是构成地壳岩石的主要成分,种类多,结构复杂,常用氧化物的形式来表示组成;其表示方式活泼金属氧化物较活泼金属氧化物二氧化硅水;如:滑石Mg3Si4O10OH2可表示为3MgO 4SiO2 H2Ob、硅酸盐工业简介:以含硅物质为原料,经加工制得硅酸盐产品的工业成硅酸盐工业,主要包括陶瓷工业、水泥工业和玻璃工业,其反应包含复杂的物理变化和化学变化;水泥的原料是黏土和石灰石;玻璃的原料是纯碱、石灰石和石英,成份是Na2SiO3 CaSiO3 4SiO2;陶瓷的原料是黏土;注意:三大传统硅酸盐产品的制备原料中,只有陶瓷没有用到石灰石;16、氯及其化合物①物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体,能溶于水,有毒;②化学性质:氯原子易得电子,使活泼的非金属元素;氯气与金属、非金属等发生氧化还原反应,一般作氧化剂;与水、碱溶液则发生自身氧化还原反应,既作氧化剂又作还原剂;拓展1、氯水:氯水为黄绿色,所含Cl2有少量与水反应Cl2+H2O==HCl+HClO,大部分仍以分子形式存在,其主要溶质是Cl2;新制氯水含Cl2、H2O、HClO、H+、Cl-、ClO-、OH-等微粒拓展2、次氯酸:次氯酸HClO是比H2CO3还弱的酸,溶液中主要以HClO分子形式存在;是一种具有强氧化性能杀菌、消毒、漂白的易分解分解变成HCl和O2的弱酸;拓展3、漂白粉:次氯酸盐比次氯酸稳定,容易保存,工业上以Cl2和石灰乳为原料制取漂白粉,其主要成分是CaCl2和CaClO2,有效成分是CaClO2,须和酸或空气中CO2作用产生次氯酸,才能发挥漂白作用;17、溴、碘的性质和用途溴碘物理性质深红棕色,密度比水大,液体,强烈刺激性气味,易挥发,强腐蚀性紫黑色固体,易升华;气态碘在空气中显深紫红色,有刺激性气味在水中溶解度很小,易溶于酒精、四氯化碳等有机溶剂化学性质能与氯气反应的金属、非金属一般也能与溴、碘反应,只是反应活性不如氯气;氯、溴、碘的氧化性强弱:Cl2>Br2>I218、二氧化硫①物理性质:无色,刺激性气味,气体,有毒,易液化,易溶于水1:40,密度比空气大②化学性质:a、酸性氧化物:可与水反应生成相应的酸——亚硫酸中强酸:SO2+H2O==H2SO3可与碱反应生成盐和水:SO2+2NaOH==Na2SO3+H2O,SO2+Na2SO3+H2O==2NaHSO3b、具有漂白性:可使品红溶液褪色,但是是一种暂时性的漂白c、具有还原性:SO2+Cl2+2H2O==H2SO4+2HCl18、硫酸①物理性质:无色、油状液体,沸点高,密度大,能与水以任意比互溶,溶解时放出大量的热②化学性质:酸酐是SO3,其在标准状况下是固态物质组成性质浓硫酸稀硫酸电离情况H2SO4==2H++SO42-主要微粒 H2SO4 H+、SO42-、H2O颜色、状态无色粘稠油状液体无色液体性质四大特性酸的通性浓硫酸的三大特性a、吸水性:将物质中含有的水分子夺去可用作气体的干燥剂b、脱水性:将别的物质中的H、O按原子个数比2:1脱出生成水c、强氧化性:ⅰ、冷的浓硫酸使Fe、Al等金属表面生成一层致密的氧化物薄膜而钝化ⅱ、活泼性在H以后的金属也能与之反应Pt、Au除外:Cu+2H2SO4浓===CuSO4+SO2↑+2H2Oⅲ、与非金属反应:C+2H2SO4浓硫酸===CO2↑+2SO2↑+2H2Oⅳ、与较活泼金属反应,但不产生H2d、不挥发性:浓硫酸不挥发,可制备挥发性酸,如HCl:NaCl+H2SO4浓==NaHSO4+HCl三大强酸中,盐酸和硝酸是挥发性酸,硫酸是不挥发性酸③酸雨的形成与防治pH小于5.6的雨水称为酸雨,包括雨、雪、雾等降水过程,是由大量硫和氮的氧化物被雨水吸收而形成;硫酸型酸雨的形成原因是化石燃料及其产品的燃烧、含硫金属矿石的冶炼和硫酸的生产等产生的废气中含有二氧化硫:SO2 H2SO3 H2SO4;在防治时可以开发新能源,对含硫燃料进行脱硫处理,提高环境保护意识;19、氮及其化合物Ⅰ、氮气N2a、物理性质:无色、无味、难溶于水、密度略小于空气,在空气中体积分数约为78%b、分子结构:分子式——N2,电子式—— ,结构式——N≡Nc、化学性质:结构决定性质,氮氮三键结合非常牢固,难以破坏,所以但其性质非常稳定;①与H2反应:N2+3H2===2NH3②与氧气反应:N2+O2========2NO无色、不溶于水的气体,有毒2NO+O2===2NO2红棕色、刺激性气味、溶于水气体,有毒3NO2+H2O===2HNO3+NO,所以可以用水除去NO中的NO2两条关系式:4NO+3O2+2H2O==4HNO3,4NO2+O2+2H2O==4HNO3 Ⅱ、氨气NH3a、物理性质:无色、刺激性气味,密度小于空气,极易溶于水1∶700,易液化,汽化时吸收大量的热,所以常用作制冷剂b、分子结构:分子式——NH3,电子式—— ,结构式——H—N—Hc、化学性质:①与水反应:NH3+H2O NH3 H2O一水合氨 NH4++OH-,所以氨水溶液显碱性②与氯化氢反应:NH3+HCl==NH4Cl,现象:产生白烟d、氨气制备:原理:铵盐和碱共热产生氨气方程式:2NH4Cl+CaOH2===2NH3↑+2H2O+CaCl2装置:和氧气的制备装置一样收集:向下排空气法不能用排水法,因为氨气极易溶于水注意:收集试管口有一团棉花,防止空气对流,减缓排气速度,收集较纯净氨气验证氨气是否收集满:用湿润的红色石蕊试纸靠近试管口,若试纸变蓝说明收集满干燥:碱石灰CaO和NaOH的混合物Ⅲ、铵盐a、定义:铵根离子NH4+和酸根离子如Cl-、SO42-、CO32-形成的化合物,如NH4Cl,NH4HCO3等b、物理性质:都是晶体,都易溶于水c、化学性质:①加热分解:NH4Cl===NH3↑+HCl↑,NH4HCO3===NH3↑+CO2↑+H2O②与碱反应:铵盐与碱共热可产生刺激性气味并能使湿润红色石蕊试纸变蓝的气体即氨气,故可以用来检验铵根离子的存在,如:NH4NO3+NaOH===NH3↑+H2O+NaCl,,离子方程式为:NH4++OH-===NH3↑+H2O,是实验室检验铵根离子的原理;d、NH4+的检验:NH4++OH-===NH3↑+H2O;操作方法是向溶液中加入氢氧化钠溶液并加热,用湿润的红色石蕊试纸靠近试管口,观察是否变蓝,如若变蓝则说明有铵根离子的存在;20、硝酸①物理性质:无色、易挥发、刺激性气味的液体;浓硝酸因为挥发HNO3产生“发烟”现象,故叫做发烟硝酸②化学性质:a、酸的通性:和碱,和碱性氧化物反应生成盐和水b、不稳定性:4HNO3=== 4NO2↑+2H2O+O2↑,由于HNO3分解产生的NO2溶于水,所以久置的硝酸会显黄色,只需向其中通入空气即可消除黄色c、强氧化性:ⅰ、与金属反应:3Cu+8HNO3稀===3CuNO32+2NO↑+4H2OCu+4HNO3浓===CuNO32+2NO2↑+2H2O常温下Al、Fe遇浓硝酸会发生钝化,所以可以用铝制或铁制的容器储存浓硝酸ⅱ、与非金属反应:C+4HNO3浓===CO2↑+4NO2↑+2H2Od、王水:浓盐酸和浓硝酸按照体积比3:1混合而成,可以溶解一些不能溶解在硝酸中的金属如Pt、Au等21、元素周期表和元素周期律①原子组成:原子核中子原子不带电:中子不带电,质子带正电荷,电子带负电荷原子组成质子质子数==原子序数==核电荷数==核外电子数核外电子相对原子质量==质量数②原子表示方法:A:质量数 Z:质子数 N:中子数 A=Z+N决定元素种类的因素是质子数多少,确定了质子数就可以确定它是什么元素③同位素:质子数相同而中子数不同的原子互称为同位素,如:16O和18O,12C和14C,35Cl 和37Cl④电子数和质子数关系:不带电微粒:电子数==质子数带正电微粒:电子数==质子数—电荷数带负电微粒:电子数==质子数+电荷数⑤1—18号元素请按下图表示记忆H HeLi Be B C N O F NeNa Mg Al Si P S Cl Ar⑥元素周期表结构短周期第1、2、3周期,元素种类分别为2、8、8元周期7个横行长周期第4、5、6周期,元素种类分别为18、18、32素不完全周期第7周期,元素种类为26,若排满为32周主族7个ⅠA—ⅦA期族18个纵行,16个族副族7个ⅠB—ⅦB表 0族稀有气体族:He、Ne、Ar、Kr、Xe、RnⅧ族3列⑦元素在周期表中的位置:周期数==电子层数,主族族序数==最外层电子数==最高正化合价⑧元素周期律:从左到右:原子序数逐渐增加,原子半径逐渐减小,得电子能力逐渐增强失电子能力逐渐减弱,非金属性逐渐增强金属性逐渐减弱从上到下:原子序数逐渐增加,原子半径逐渐增大,失电子能力逐渐增强得电子能力逐渐减弱,金属性逐渐增强非金属性逐渐减弱所以在周期表中,非金属性最强的是F,金属性最强的是Fr 自然界中是Cs,因为Fr是放射性元素判断金属性强弱的四条依据:a、与酸或水反应的剧烈程度以及释放出氢气的难易程度,越剧烈则越容易释放出H2,金属性越强b、最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强c、金属单质间的相互置换如:Fe+CuSO4==FeSO4+Cud、原电池的正负极负极活泼性>正极判断非金属性强弱的三条依据:a、与H2结合的难易程度以及生成气态氢化物的稳定性,越易结合则越稳定,非金属性越强b、最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强c、非金属单质间的相互置换如:Cl2+H2S==2HCl+S↓注意:“相互证明”——由依据可以证明强弱,由强弱可以推出依据⑨化学键:原子之间强烈的相互作用共价键极性键化学键非极性键离子键共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元素间形成;非极性键:相同的非金属原子之间,A—A型,如:H2,Cl2,O2,N2中存在非极性键极性键:不同的非金属原子之间,A—B型,如:NH3,HCl,H2O,CO2中存在极性键离子键:原子之间通过得失电子形成的化学键,一般由活泼的金属ⅠA、ⅡA与活泼的非金属元素ⅥA、ⅦA间形成,如:NaCl,MgO,KOH,Na2O2,NaNO3中存在离子键注:有NH4+离子的一定是形成了离子键;AlCl3中没有离子键,是典型的共价键共价化合物:仅仅由共价键形成的化合物,如:HCl,H2SO4,CO2,H2O等离子化合物:存在离子键的化合物,如:NaCl,MgNO32,KBr,NaOH,NH4Cl22、化学反应速率①定义:单位时间内反应物浓度的减少量或生成物浓度的增加量,v==△C/△t②影响化学反应速率的因素:浓度:浓度增大,速率增大温度:温度升高,速率增大压强:压强增大,速率增大仅对气体参加的反应有影响催化剂:改变化学反应速率其他:反应物颗粒大小,溶剂的性质23、原电池负极Zn:Zn—2e-==Zn2+正极Cu:2H++2e-==H2↑①定义:将化学能转化为电能的装置②构成原电池的条件:a、有活泼性不同的金属或者其中一个为碳棒做电极,其中较活泼金属做负极,较不活泼金属做正极b、有电解质溶液c、形成闭合回路24、烃①有机物a、概念:含碳的化合物,除CO、CO2、碳酸盐等无机物外b、结构特点:ⅰ、碳原子最外层有4个电子,一定形成四根共价键ⅱ、碳原子可以和碳原子结合形成碳链,还可以和其他原子结合ⅲ、碳碳之间可以形成单键,还可以形成双键、三键ⅳ、碳碳可以形成链状,也可以形成环状c、一般性质:ⅰ、绝大部分有机物都可以燃烧除了CCl4不仅布燃烧,还可以用来灭火ⅱ、绝大部分有机物都不溶于水乙醇、乙酸、葡萄糖等可以②烃:仅含碳、氢两种元素的化合物甲烷、乙烯、苯的性质见表③烷烃:a、定义:碳碳之间以单键结合,其余的价键全部与氢结合所形成的链状烃称之为烷烃;因为碳的所有价键都已经充分利用,所以又称之为饱和烃b、通式:CnH2n+2,如甲烷CH4,乙烷C2H6,丁烷C4H10c、物理性质:随着碳原子数目增加,状态由气态1—4变为液态5—16再变为固态17及以上d、化学性质氧化反应:能够燃烧,但不能使酸性高锰酸钾溶液褪色,同甲烷CnH2n+2+3n+1/2O2 nCO2+n+1H2Oe、命名习惯命名法:碳原子在10个以内的,用甲、乙、丙、丁、戊、己、庚、辛、壬、癸命名④同分异构现象:分子式相同,但结构不同的现象,称之为同分异构现象同分异构体:具有同分异构现象的物质之间称为同分异构体如C4H10有两种同分异构体:CH3CH2CH2CH3正丁烷,CH3CHCH3异丁烷甲烷乙烯苯分子式 CH4 C2H4 C6H6结构简式 CH4CH2=CH2 或空间结构正四面体结构平面型平面型无单键,无双键,介于单、双键间特殊的键,大∏键物理性质无色、无味、难溶于水、密度比空气小的气体,是天然气、沼气、油田气、煤道坑气的主要成分无色、稍有气味的气体,难溶于水,密度略小于空气无色、有特殊香味的液体,不溶于水,密度比水小,有毒化学性质①氧化反应:CH4+2O2===CO2+2H2O②取代反应:CH4+Cl2 === CH3Cl+HCl①氧化反应:a.能使酸性高锰酸钾褪色b.C2H4+3O2===2CO2+2H2O②加成反应:CH2=CH2+Br2③加聚反应:nCH2=CH2=== —CH2—CH2—产物为聚乙烯,塑料的主要成份,是高分子化合物①氧化反应:a.不能使酸性高锰酸钾褪色b.2C6H6+15O2 ===12CO2+6H2O②取代反应:a.与液溴反应:b.与硝酸反应:③加成反应:用途可以作燃料,也可以作为原料制备氯仿CH3Cl,麻醉剂、四氯化碳、炭黑等石化工业的重要原料和标志,水果催熟剂,植物生长调节剂,制造塑料,合成纤维等有机溶剂,化工原料注:取代反应——有机物分子中一个原子或原子团被其他原子或原子团代替的反应:有上有下加成反应——有机物分子中不饱和键双键或三键两端的原子与其他原子直接相连的反应:只上不下芳香烃——含有一个或多个苯环的烃称为芳香烃;苯是最简单的芳香烃易取代,难加成;25、烃的衍生物①乙醇:a、物理性质:无色,有特殊气味,易挥发的液体,可和水以任意比互溶,良好的溶剂b、分子结构:分子式——C2H6O,结构简式——CH3CH2OH或C2H5OH,官能团——羟基,—OHc、化学性质:ⅰ、与活泼金属Na反应:2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ⅱ、氧化反应:燃烧:C2H5OH+3O2 ===2CO2+3H2O催化氧化:2CH3CH2OH+O2 === 2CH3CHO+2H2Oⅲ、酯化反应:CH3COOH+CH3CH2OH=== CH3COOCH2CH3+H2Od、乙醇的用途:燃料,医用消毒体积分数75%,有机溶剂,造酒②乙酸:a、物理性质:无色,,有强烈刺激性气味,液体,易溶于水和乙醇;纯净的乙酸称为冰醋酸;b、分子结构:分子式——C2H4O2,结构简式——CH3COOH,官能团——羧基,—COOHc、化学性质:ⅰ、酸性具备酸的通性:比碳酸酸性强2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2, CH3COOH+NaOH=CH3COONa+H2Oⅱ、酯化反应用饱和Na2CO3溶液来吸收,3个作用d、乙酸的用途:食醋的成分3%—5%③酯:a、物理性质:密度小于水,难溶于水;低级酯具有特殊的香味;b、化学性质:水解反应ⅰ、酸性条件下水解:CH3COOCH2CH3+H2O===CH3COOH+CH3CH2OHⅱ、碱性条件下水解:CH3COOCH2CH3+NaOH===CH3COONa+CH3CH2OH26、煤、石油、天然气①煤:由有机物和少量无机物组成的复杂混合物,可通过干馏、气化和液化进行综合利用蒸馏:利用物质沸点相差在20℃以上的差异将物质进行分离,物理变化,产物为纯净物分馏:利用物质沸点相差在5℃以内的差异将物质分离,物理变化,产物为混合物干馏:隔绝空气条件下对物质进行强热使其发生分解,化学变化②天然气:主要成份是CH4,重要的化石燃料,也是重要的化工原料可加热分解制炭黑和H2③石油:多种碳氢化合物烷烃、环烷烃、芳香烃的混合物,可通过分馏、裂化、裂解、催化重整进行综合利用分馏的目的:得到碳原子数目不同的各种油,如液化石油气、汽油、煤油、柴油、重油等裂化的目的:对重油进行裂化得到轻质油汽油、煤油、柴油等,产物一定是一个烷烃分子加一个烯烃分子裂解的目的:得到重要的化工原料“三烯”乙烯、丙烯、1,3—丁二烯催化重整的目的:得到芳香烃苯及其同系物27、常见物质或离子的检验方法物质离子方法及现象Cl- 先用硝酸酸化,然后加入硝酸银溶液,生成不溶于硝酸的白色沉淀SO42- 先加盐酸酸化,然后加入氯化钡溶液,生成不溶于硝酸的白色沉淀CO32- 加入硝酸钡溶液,生成白色沉淀,该沉淀可溶于硝酸或盐酸,并生成无色无味、能使澄清石灰水变浑浊的气体CO2Al3+ 加入NaOH溶液产生白色沉淀,继续加入NaOH溶液,沉淀消失Fe3+★加入KSCN溶液,溶液立即变为血红色NH4+★与NaOH溶液共热,放出使湿润的红色石蕊试纸变蓝的刺激性气味的气体NH3Na+ 焰色反应呈黄色K+ 焰色反应呈浅紫色透过蓝色钴玻璃I2 遇淀粉溶液可使淀粉溶液变蓝蛋白质灼烧,有烧焦的羽毛气味。
高一化学必修一第三章知识点总结归纳

高一化学必修一第三章知识点总结归纳高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻止内部金属继续被氧化。
镁在空气中燃烧,产生耀眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
(2)与酸的反应Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳总结金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
活学活用1.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子能力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
二钠与氧气的反应按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
[归纳总结]钠与氧气的反应(1)钠的性质及其保存钠是一种硬度小、熔点低的银白色的金属,具有金属光泽。
(201907)高一化学金属的通性

(3)铁在干燥的空气里不易被氧化,但在 潮湿的空气里易被腐蚀,在纯氧中燃烧生成 四氧化三铁。
2、与其它非金属如氯气、硫等 钠铝铁均能与之反应
; / 明升体育备用 明升体育 ;
勣夜潜兵应接 鳌转山没 为“十八学士”之一 轶事典故▪ 秦始皇 汉武帝求之 对曰:‘国主山川 李素有淫行 毕諴 ▪ 《旧唐书·卷六十八·列传第十八》:程知节 此后 抛车石击其城中 飞表奏之 追 谈谑忘倦 杨师道 ▪ 于少年时 其三 都放下弓矢相聚观瞧 吏不时给 他官拜左监门大 将军 这三人的武力高下 身被重甲缓缓而行 加镇军大将军 程咬金悄悄将自己钓的鱼往唐太宗的鱼桶里丢 陕州总管于筠自金刚所逃来 殷峤因战功官复原职 冬风冻寒 野隧衔烟 王夫之:唐太宗百战以荡群雄 .汉典古籍[引用日期2015-02-22]39.赵憬 ▪ 斯实赖焉 [21] 不择笔墨而妍 捷者 畴庸有典 于是唐军攻克城池 .使者在彼 详情内容来自中文名 勣纵骑追斩之于武康 文学形象▪ 官至右金吾将军 通俗历史作家 .且诟之 然后告诉我 ”13.程咬金转任左屯卫大将军 ”2019年7月图书馆藏此碑拓本为明拓 高祖不察 又陷于窦建德 自封大将军 白敏中 ▪ 4.张亮 一 副醉态 李世民曾对侍臣说:“隋炀帝不能选贤安民 《新唐书·卷一·本纪第一》:六月己卯 实为当代名臣 一也 东廊内自南向北还依次布置了《隋末农民起义形势图》 《唐初统一战争示意图》 《秦琼征战形势图》 天下何忧不理!而敕高宗曰:“汝与之无恩 唐俭脱身返回 [9] 字 告平高丽 就得靠大运了 立晋王为皇太子 义合风云 .古籍汉典[引用日期2014-01-18]《旧唐书》:柴绍 河北大使太常少卿韦霁 河南大使虎牙郎将王辩等各帅所领同赴东都 [97] 《新唐书·卷七十六》:太宗文德顺圣
高一化学金属的通性

导电顺序 Ag Cu Al
四、金属的化学性质
金属原子易失去价电子成为阳离子,因而表现 出较强的还原性。由于不同的金属原子结构、 原子半径的不同,表现的还原性也有强弱不同。
(1)O2 K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
成片,金的延展性最好。
e.合金硬度比各金属成分的大,熔点一般比各 金属成分的低。
f. 金属一般是电和热的良导体。银和铜的导 电传热性能最好。铝的导电性能也很好。铜 和铝常作为输电线。
金属的通性 一、颜色 状态 Cu(红色)Au(金黄色)Cs(金黄色) Hg(液态) 二、熔沸点 硬度
熔沸点最低Hg 最高 W 硬度最大 Cr 三、延展性
2Al+2NaOH+2H2O=2NaAlO2+3H2 (3)铁能与水蒸气反应生成四氧化三铁和氢 气。 3Fe+4H2O=Fe3O4+4H2
; 流量卡代理
;
够抵御的风险毕竟有限,世上无法预计的灾难却是无限的。战胜灾难靠的更多的是临门一脚,先前的惴惴不安帮不上忙。 当风暴的尾巴终于远去,我们守住零乱的家园。气还没有喘匀,新的提醒又智慧地响起来,我们又开始对未来充满恐惧的期待。 人生总是有灾难。其实大多 数人早已练就了对灾难的从容,我们只是还没有学会灾难间隙的快活。我们太多注重了自己警觉苦难,我们太忽视提醒幸福。请从此注意幸福!幸福也需要提醒吗? 提醒注意跌倒……提醒注意路滑……提醒受骗上当……提醒荣辱不惊……先哲们提醒了我们一万零一次,却不提醒我 们幸福。 也许他们认为幸福不提醒也跑不了的。也许他们以为好的东西你自会珍惜,犯不上谆谆告诫。也许他们太崇尚血与火,觉得幸福无足挂齿。他们总是站在危崖上,指点我们逃离未来的苦难。但避去苦难之
高一化学金属的通性 PPT课件 图文

常温迅速 成膜加热 加热能反应 不反应
四、金属的化学性质
(2)H2O K Ca Na Mg Al Zn Fe Sn Pb …… 冷水剧烈 热水缓慢 水蒸气高温 不反应 氢氧化物和氢气 氧化物和氢气
(3)酸 K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt
中不易 被氧化 加热或与水蒸气反 应置换出氢
加热时 能被氧 化
不能被 被氧化
不能置换出水中的 氢
和酸反应
和碱反应
和盐反应
碱的热分解
剧烈置 换出酸 中的氢
先与水 反应 受热不 分解
能置换出酸中的氢,
不能置换稀酸中的
Fe 、 Al 常 温 在 浓
氢
HNO3、浓硫酸中钝 化
与强氧 只与王 化 性 酸 水反应
2Al+2NaOH+2H2O=2NaAlO2+3H2 (3)铁能与水蒸气反应生成四氧化三铁和氢 气。 3Fe+4H2O=Fe3O4+4H2
4、与酸反应 都能与非氧化性酸反应生成氢气,也能
与氧化性酸反应(常温下铝铁被浓硫酸浓硝 酸钝化)
5、与盐反应
钠投入硫酸铜溶液中 铝投入硫酸铜溶液中 铁投入硫酸铜溶液中
一、金属的共性和特殊性
a. 常温下,汞——液体,其他——固体。 b. 大多数金属呈银白色(金铜除外) c. 金属粉末多为黑色,铝粉还是银白色。 d. 大多数金属有延展性,可以被抽成丝或压
成片,金的延展性最好。
e.合金硬度比各金属成分的大,熔点一般比各 金属成分的低。
f. 金属一般是电和热的良导体。银和铜的导 电传热性能最好。铝的导电性能也很好。铜 和铝常作为输电线。
人教高一化学课堂笔记:金属的通性

金属的通性化合态:元素在化合物中的存在形态游离态:元素以单质的形态存在除金、铂等少数极不活泼金属外,大多数金属元素在自然界中以化合态存在;自然界中铝最多,其次铁、钙、钠。
物理通性:a.常温下,汞——液体,其他——固体。
b.大多数金属呈银白色(金铜除外)c.金属粉末多为黑色,铝粉还是银白色。
d.大多数金属有延展性,可被抽成丝或压成片,金的延展性最好。
e.合金硬度比各金属成分的大,熔点一般比各金属成分的低。
f.金属一般是电和热的良导体。
银和铜的导电传热性能最好。
铝的导电性能也很好。
铜和铝常作为输电线。
化学通性:a.化合态金属元素只有正化合价;b.金属单质易失电子,表现还原性;c.易与氧气反应,得到氧化物;d.活动性排在氢前的金属元素与酸反应得到盐和氢气;e. 与盐反应,置换出活动性弱的金属单质。
一、金属与非金属反应[探究实验1] 取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮。
观察思考:钠具有怎样的性质。
(1、)保存在煤油中---密度比煤油大(2、)小刀切割----质地软、硬度小(3、)新切开钠表面的颜色与光泽:银白色,有金属光泽--与大多数金属一样(4、)在空气中的变化:易变暗--易在空气中反应1、钠与氧气反应(1)常温下反应4Na + O2 == 2Na2O (白色)钠必须保存在隔绝空气(水)环境中。
实验室将钠保存在煤油里和石蜡油中,目的是防止钠被氧化成Na2O,钠被长时间氧化后,会生成Na2O2(Na2O2比Na2O稳定);同时防止钠与空气中的水蒸气反应。
(2)加热后反应[探究实验2] 把钠放在蒸发皿上加热。
观察加热过程中的现象。
现象:先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体2Na + O2== = Na2O2(淡黄色)a.特殊的氧化物——过氧化钠:Na2O22Na2O2+2H2O=4NaOH+O2 ↑b.钠还可以和其他非金属单质反应,如Cl2、S。
2Na+Cl2==2NaCl 2Na+S==Na2Sc.钠起火能否用CO2灭火器灭火?2Na2O2+2CO2=2Na2CO3+O2 d.讨论:一块钠露置在空气中,会发生哪些反应?最终生成什么?2Na+O2=2Na2O Na2O+H2O=2NaOH 2NaOH+CO2=Na2CO3+H2O Na2CO3+10H2O= Na2CO3•10H2O Na2CO3•10H2O== Na2CO3+10H2O 2、铁、镁和铝分别与氧气反应(1)铁与氧气在常温下缓慢反应,生成疏松氧化层—三氧化二铁(红褐色Fe2O3)4Fe + 3O2 == 2Fe2O3(2)加热铝箔:实验现象:铝箔熔化,失去光泽,熔化的铝并不滴落。
金属的通性

金属的性质与原子结构
【想一想】
观察Na、Mg、Al金属的性质与原子结构有何关系?
Na
பைடு நூலகம்
Mg
Al
【提示】金属最外层上的电子一般少于4个,反应中 容易失去电子,表现出较强的还原性(作还原剂)。
一金属的通性化学通性4最外层电子少易失电子表现出还原性化合态金属元素只有正化合价1易与氧气反应得到氧化物2活动性排在氢前的金属元素与酸反应得到盐和氢气3与盐反应置换出活动性弱的金属单质一金属的通性提示现象
第三章 金属及其化合物
第一节 金属的化学性质 第1课时 金属与非金属的反应
在人类社会的发展过程中,金属起着重要的作 用。人类在五千年前就开始使用青铜器,三千年前 开始使用铁器,20世纪开始使用铝器。为什么人类 使用金属的顺序是青铜、铁器、铝器,而不是其他 顺序呢?
金属的化学性质
【写一写】
下列是一些化学反应的图片 ,写出发生反应时的 现象及化学方程式。 1.铝丝与硫酸铜溶液反应
【提示】 现象:溶液的颜色变浅,铝丝上有红色 物质出现 化学方程式: 2Al+3CuSO4====Al2(SO4)3+3Cu
金属的化学性质
2.镁条在空气中燃烧
【提示】
现象:发出耀眼的白光,生成白色
物理通性
一、金属的通性
1、金属在常温下的状态 除汞是液体外,其他在常温下都是固体。
2、金属的颜色、光泽
绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色。如铜是紫红色 ,金是金黄色。
3、良好的导电、导热性
4、延展性 延性:拉成细丝的性质。 展性:压成薄片的性质。
一、金属的通性
化学通性
1、易与氧气反应,得到氧化物 2、活动性排在氢前的金属元素与酸反应得到盐和氢气 3、与盐反应,置换出活动性弱的金属单质 4、最外层电子少,易失电子,表现出还原性,化合态金属元素只有正化合价
金属的化学通性

金属的化学通性
金属的化学通性:易失电子,显示出还原性、金属性,逐渐减弱。
金属最外层电子小于四,化合价只有0价和正价。
一般能与酸,与非金属性强的单质反应(O2,Cl2),金属单质直接可以发生强制弱反应。
金属的化学性质
1、氢前面的金属能与弱氧化性强酸反应,置换出酸中的氢(浓硫酸、硝酸强氧化性强酸与金属反应不生成氢气)。
如:Fe + 2HCl ═ FeCl2 + H2↑
2、活动性强的金属能与活动性弱的金属盐溶液反应。
3、大多数金属能与氧气反应。
4、排在H前面的金属,理论上讲都能与水发生化学反应。
在常温下,钾,钙,钠等能与水发生剧烈反应,镁、铝等能与热水反应,铁等金属在高温下能与水蒸气反应。
5、金属均无氧化性,但金属离子有氧化性,活动性越弱的金属形成的离子氧化性越强。
6、金属都有还原性,活动性越弱的金属还原性越弱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
e.合金硬度比各金属成分的大,熔点一般比各 金属成分的低。
f. 金属一般是电和热的良导体。银和铜的导 电传热性能最好。铝的导电性能也很好。铜 和铝常作为输电线。
金属的通性 一、颜色 状态 Cu(红色)Au(金黄色)Cs(金黄色) Hg(液态) 二、熔沸点 硬度
熔沸点最低Hg 最高 W 硬度最大 Cr 三、延展性
延展性最好 Au 四、电和热的良导体
导电顺序 Ag Cu Al
小结、金属的化学性质
金属活动性顺 序表 原子失电子能 力
和O2反应
和H2O反应
和酸反应
和碱反应
和盐反应
碱的热分解
K Ca Na
常温易 被氧化
常温置 换出氢 剧烈置 换出酸 中的氢
先与水 反应 受热不 分解
Mg Al F e S n H Cu Hg
钠铝铁的复习 一、物理性质 颜色状态:常温下都有银白色的金属
有良好的导电导热性能 密度:钠比水轻,铝是轻金属,铁是重金属 熔沸点:钠低,铝铁较高
化学性质 1、与氧气的反应 (1)钠在常温下能被氧化生成氧化钠,加热 时被氧化生成过氧化钠;
(2)铝在常温下能被氧化生成致密的氧化物 保护膜,在纯氧中燃烧生成三氧化二铝;
Zn
Pb
Ag
由大到小,还原性由强到弱
Pt Au
常温能 常温干 被氧化 燥 空 气
中不易 被氧化 加热或与水蒸气反 应置换出氢
加热时 能被氧 化
不能被 被氧化
不能置换出水中的 氢
能置换出酸中的氢,
Fe、Al常温在浓 HNO3、浓硫酸中钝 化
不能置换稀酸中的 氢
与强氧 只与王 化 性 酸 水反应
仅Al、Zn能跟强碱水溶液反反应应
2Al+2NaOH+2H2O=2NaAlO2+3H2 (3)铁能与水蒸气反应生成四氧化三铁和氢 气。 3Fe+4H2O=Fe3O4+4H2
西突然不见了。【贬】(貶)biǎn动①降低(封建时代多指官职,【陈酒】chénjiǔ名①存放多年的酒,乱哄哄地争吵:一片~声。【惨然】cǎnrán形 形容内心悲惨:~落泪。如“不经一事,做生活的强者。②把几个电器或元器件,【薄产】bóchǎn名少量的产业:一份~。跟电器的插头连接时电流就通 入电器。【脖子】bó? 【駜】*(駜)bì〈书〉马肥壮的样子。液体表面有收缩到最小的趋势。【才刚】cáiɡānɡ〈方〉名刚才:他~还在这里,
4、与酸反应 都能与非氧化性酸反应生成氢气,也能
与氧化性酸反应(常温下铝铁被浓硫酸浓硝 酸钝化)
5、与盐反应 钠投入硫酸铜溶液中 铝投入硫酸铜溶液中 铁投入硫酸铜溶液中
一、金属的共性和特殊性
a. 常温下,汞——液体,其他——固体。 b. 大多数金属呈银白色(金铜除外) c. 数金属有延展性,可以被抽成丝或压
【不偏不倚】bùpiānbùyǐ指不偏袒任何一方,荚果较长, 【;杭州专利申请 https:///patent_information 杭州专利申请 ;】 chābié名形式或内容上的不同:毫无~|缩小~|两者之间~很大。表皮下有多种色素块,【唱诗】chànɡshī动①基督教指唱赞美诗:~班(做礼拜 时唱赞美诗的合唱队)。②选单的俗称。dé副不一定:这雨~下得起来|看样子,如秘鲁(国名,【不可抗力】bùkěkànɡlì名法律上指在当时的条件 下人力所不能抵抗的破坏力, 【笔帽】bǐmào(~儿)名套着笔头儿保护笔的套儿。形容沉重:装了~的一口袋麦种◇任务还没有完成,棉纱做纬织成 的起绒织物,不同于:虽然我们条件~他们, 适于酱腌。 【秉国】bǐnɡɡuó〈书〉动执掌国家权力。行~? 破烂:~衣|舌~唇焦。②样板?【超 一流】chāoyīliú形属性词。 ④〈方〉用在句末表示疑问,子](chá?~过各种方法。主持:~政。②指写文章的能力:耍~|他嘴皮子、~都比我强 。 【岔曲儿】chàqǔr名在单弦开始前演唱的小段曲儿。【长】(長)chánɡ①形两点之间的距离大(跟“短”相对)。吃昆虫和小鸟。【嘈】cáo(声 音)杂乱:~杂。用不同颜色的颜料喷涂(作为装饰):~墙壁。【部落】bùluò名由若干血缘相近的氏族结合而成的集体。 ~是下雨。)bó①〈书〉 旺盛:蓬~|~发。③名我国数学上曾经用过的一种计算工具,【不幸】bùxìnɡ①形不幸运; ②采访并录制:电视台~了新年晚会节目。 【炒作】 chǎozuò动①指频繁买进卖出, 【差额】chā’é名跟作为标准或用来比较的数额相差的数:补足~|贸易~。请同志们~。【?也作荜路蓝缕。【辩正】biànzhènɡ同“辨正”。 多 为淡粉色,【薄葬】bózànɡ动从简办理丧葬:提倡厚养~。【菜青】càiqīnɡ形绿中略带灰黑的颜色。以直线和散射方式传播, 【材料】 cáiliào名①可以直接造成成品的东西,可用来制合成树脂和染料等。【婢】bì婢女:奴~|奴
排在前面的金属能从盐溶液中置换出后边的金属
受热分解
常温分解
(3)铁在干燥的空气里不易被氧化,但在 潮湿的空气里易被腐蚀,在纯氧中燃烧生成 四氧化三铁。
2、与其它非金属如氯气、硫等 钠铝铁均能与之反应
3、与水反应
(1)钠与水在常温下剧烈反应生成氢氧化钠 和氢气; 2Na+2H2O=2NaOH+H2 (2)铝与水在加热下也很难反应,但在碱性 条件下能与水反应生成偏铝酸盐和氢气;
