大学无机化学分子结构共57页
合集下载
无机化学第六版第二章 分子结构

2.spd型杂化 能量相近的(n 1)d与ns、np轨道 或ns、np与nd轨道组合成新的dsp或spd型杂化轨
道的过程可统称为spd型杂化。
杂化类型 杂化轨道数
空间构型
dsp2
sp3d d2sp3 或sp3d2
4
5
6
正方形 三角双锥 正八面体
10:01
30
(二)等性杂化与不等性杂化:
原子轨道的杂化可分为等性和不等性杂化两类。
10:01
33
N原子:2s22p3 ,有3个单电子,可形成3个共价键
2p 2s
孤对电子
杂化
孤电子对占据的杂化轨道,不参与成键,电子 云密集在中心原子周围,s轨道成分相对增大,其余 3个杂化轨道p成分相对增大。
产生不等性杂化的原因:参与杂化的原子轨 道中电子数目多于轨道数目,出现孤电子对。
10:01
10:01
13
10:01
14
例如:N2分子的形成, N:1s22s2 2pX12pY12pZ1
10:01
15
σ键与π键的区别
1)σ键重叠程度大,键牢固,可单独存在;π 键电子云较松散,不稳定,只能与σ键共存。 2)以共价键结合的两原子间只能有一个σ键, 但可以有多个π键
单键:σ键 双键:σ+π 叁键:σ+π+π
(2)同一周期中电子层结构相同的阳离子的半径, 随离子的电荷数的增加而减小;而阴离子的半径 随离子的电荷数减小而增大。
(3)同一主族元素的离子半径自上而下随核电荷 数的增加而增大。
(4)相邻主族左上方和右下方两元素的阳离子半 径相近。
10:00
4
(三)离子的电子组态
离子的电子层组态有以下几种: (1)2 电子组态:离子只有 2 个电子,外层电子组态 为 1s2。 (2)8 电子组态:离子的最外电子层有 8 个电子,外
大学无机化学课件分子结构
π对称:绕 x 轴旋转180°,形状不变,ψ符号改变。例如:原子轨道pz,py,dxy,dxz,dyz为π对称。
(3) 原子轨道线性组合的类型
例如: A+B→AB
Ⅱ
Ⅱ
Ⅰ
-成键 -反键
① s – s 重叠
1s 原子轨道
1s 原子轨道
分子轨道
s1s *
s1s
②s – p 重叠
p – p 重 叠
③具有方向性:轨道最大重叠的方向。
8.2.2 共价键的类型
(1)σ键:两原子的成键轨道沿键轴(或两核间的连线)的方向,以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴呈圆柱型对称,这样形成的共价键叫σ键。
+
+
x
+
+
x
—
+
+
x
—
—
s-s
px-s
px- px
(2)π键:两个原子轨道沿键轴的方向,通过键轴的一个平面侧面,以“肩并肩”的方式发生轨道重叠,轨道重叠部分垂直于键轴呈镜面反对称,在键轴上下对称的电子云密度最大,这样形成的共价键叫π键。
价键理论
01
共价键的类型
02
杂化轨道理论
03
价层电子互斥理论(自学)
04
分子轨道理论
05
键参数
06
8.2 共价键
共价键: 分子中原子间通过共用电子对结合而成 的化学键
H· + ·H = H:H
:Cl· + ·Cl: = :Cl:Cl:
:N· + ·N: = :N N:
④ 杂化轨道成键时,满足原子轨道最大重叠原理
⑤杂化轨道成键时,满足化学键间最小排斥原理。
(4) 小结:p226,表9-5
无机化学 第六章 分子结构

随堂练习:
2.请应用现代价键理论合理地解释乙炔的成键情况,有几个σ
键?几个π 键?
HC≡CH
乙炔
随堂练习:
3.试用杂化轨道理论解释下面问题: (1) NH3、H2O 的键角为什么比 CH4 小?CO2 的键角为何是
180°?乙烯为何取120 °的键角?
(2)在 sp2 和 sp 杂化轨道中,是否也存在不等性杂化? 各举一例! 例如 SO2 和 CO
新轨道叫杂化轨道。
(线性组合)
(2)杂化轨道的数目等于参加杂化的原子轨道的数(遵循原则)
二、杂化轨道理论
1.杂化轨道理论基本要点
(3)杂化轨道在空间的伸展方向是尽可能取最大夹角,一般取对称
形,这样排斥力最小,形成的分子体才系稳定(数学理想建模)
杂化轨道的数目 理想模型 空间的最佳排布
直线型 正三角型 正四面体
一、价键理论(电子配对理论)VB法 3.共价键的特征 a.饱和性
基态原子的未成对电子数是一定的,因此它能形成的共价 键数 也是一定的。 3p 例如:N : 1S22S22P3
N: 1s 2s
3个单电子
2Px
2Py 2Pz
NH3分子的成键过程
一、价键理论(电子配对理论)VB法 3.共价键的特征: b.方向性
bonds (C).The hybride orbital considered were sp,sp2,sp3.
Bonds where the electron density is symmetrical about the bond axis are called sigma (σ) bonds; bonds in which the electron density is not symmetrical about the bond axis are called pi(π)bonds .
无机化学第九章 分子结构

1/ 2 cos 1 1 1/ 2
180
ο
2. spd型杂化
• sp3d杂化
PCl5(g)的几何构型为三角双锥。
P: 3s23p3
3p
3d
激发
3p
3d
3s
sp3d杂化
3s
sp3d
sp3d杂化
• sp3d2杂化
SF6的几何构型为八面体。 S: 3s23p4
3p
3d
3p
3d
3
I 属于AX2L3型离子,几何构型为直 线形。
3
思考题:
解释NO2+, O3, SnCl3-, OF2, ICl3, I3-, XeF5+, ICl4- 等离子或分子的空间构型,并
指出其中心原子的轨道杂化方式。
分子 或离子 NO2+ O3
价层 电子对 2(直线型) 3(平面三角形)
孤对 电子对 0 1
第九章
§9.1 §9.2 §9.3
分子结构
Lewis理论 价键理论 杂化轨道理论
§9.4
§9.5
价层电子对互斥理论
分子轨道理论
§9.6
键参数
化学键:分子或晶体中相邻原子(或离 子)之间强烈的吸引作用。 化学键种类:共价键、离子键、金属键。
共价键理论:
Lewis理论(1916年)
价键理论(1927年, 1930年)
a,b—原子轨道,
c1,c2 —系数
Ⅰ :成键分子轨道;Ⅱ:反键分子轨道。
3. 原子轨道组合方式不同,将分子 轨道分为σ轨道与π轨道。
* • s轨道与s轨道线性组合成 s 和 s
节面
* s
s
s
s
180
ο
2. spd型杂化
• sp3d杂化
PCl5(g)的几何构型为三角双锥。
P: 3s23p3
3p
3d
激发
3p
3d
3s
sp3d杂化
3s
sp3d
sp3d杂化
• sp3d2杂化
SF6的几何构型为八面体。 S: 3s23p4
3p
3d
3p
3d
3
I 属于AX2L3型离子,几何构型为直 线形。
3
思考题:
解释NO2+, O3, SnCl3-, OF2, ICl3, I3-, XeF5+, ICl4- 等离子或分子的空间构型,并
指出其中心原子的轨道杂化方式。
分子 或离子 NO2+ O3
价层 电子对 2(直线型) 3(平面三角形)
孤对 电子对 0 1
第九章
§9.1 §9.2 §9.3
分子结构
Lewis理论 价键理论 杂化轨道理论
§9.4
§9.5
价层电子对互斥理论
分子轨道理论
§9.6
键参数
化学键:分子或晶体中相邻原子(或离 子)之间强烈的吸引作用。 化学键种类:共价键、离子键、金属键。
共价键理论:
Lewis理论(1916年)
价键理论(1927年, 1930年)
a,b—原子轨道,
c1,c2 —系数
Ⅰ :成键分子轨道;Ⅱ:反键分子轨道。
3. 原子轨道组合方式不同,将分子 轨道分为σ轨道与π轨道。
* • s轨道与s轨道线性组合成 s 和 s
节面
* s
s
s
s
无机化学 分子结构PPT课件

●原子轨道为什么需要杂化?
●如何求得杂化轨道的对称轴间的夹角?
28
1.基本要点
(1)杂化 (Hybrid) 能量相近,类型不同的同一中心原
子轨道可以混合起来,重新组成一组新 的能量相同,类型相同的轨道。
(2)杂化轨道 (Hybrid Orbital)
n个能量相近,类型不同的原子轨道 可以组成n个能量相同,类型相同的杂化
范畴: pz-pz 重叠 py-py 重叠
25
特征:原子轨道以“肩并肩”的形式发生轨道重叠。
特点:电子云没有集中在两核间连线,所以,
π键重叠程度小于σ键, π键不及σ键
稳定。 举例:N2: 1s22s22p3
1s22s22p3
2px12py12pz1 2px12py12pz1
结论:(1)共价单键为σ键,π键几乎总是与σ键
● 具有饱和性(是指每种元素的原子能提供用于形成 共价键的轨道数是一定的)
例如: H Cl H OH NN
● 具有方向性(是因为每种元素的原子能提供用于形 成共价键的轨道是具有一定的方向)
18
共价键的类型
1. σ键
定义:两原子轨道沿键轴(两核间联 线)进行同号重叠而形成的共 价键称σ键。
范畴:
s~s
第二章 分子结构
(Structure of Molecule) 价键理论
价层电子对互斥理论
分子轨道理论
键参数
1
2-1路易斯结构式
路易斯用元素符号之间的小黑点表示分子中各原子 的键合关系,代表一对键电子的一对小黑点亦可用“- ”代替。路易斯结构式能够简洁地表达单质和化合物的 成键状况,其基本书写步骤如下:
空间构型:平面三角形 键 角:120
38
●如何求得杂化轨道的对称轴间的夹角?
28
1.基本要点
(1)杂化 (Hybrid) 能量相近,类型不同的同一中心原
子轨道可以混合起来,重新组成一组新 的能量相同,类型相同的轨道。
(2)杂化轨道 (Hybrid Orbital)
n个能量相近,类型不同的原子轨道 可以组成n个能量相同,类型相同的杂化
范畴: pz-pz 重叠 py-py 重叠
25
特征:原子轨道以“肩并肩”的形式发生轨道重叠。
特点:电子云没有集中在两核间连线,所以,
π键重叠程度小于σ键, π键不及σ键
稳定。 举例:N2: 1s22s22p3
1s22s22p3
2px12py12pz1 2px12py12pz1
结论:(1)共价单键为σ键,π键几乎总是与σ键
● 具有饱和性(是指每种元素的原子能提供用于形成 共价键的轨道数是一定的)
例如: H Cl H OH NN
● 具有方向性(是因为每种元素的原子能提供用于形 成共价键的轨道是具有一定的方向)
18
共价键的类型
1. σ键
定义:两原子轨道沿键轴(两核间联 线)进行同号重叠而形成的共 价键称σ键。
范畴:
s~s
第二章 分子结构
(Structure of Molecule) 价键理论
价层电子对互斥理论
分子轨道理论
键参数
1
2-1路易斯结构式
路易斯用元素符号之间的小黑点表示分子中各原子 的键合关系,代表一对键电子的一对小黑点亦可用“- ”代替。路易斯结构式能够简洁地表达单质和化合物的 成键状况,其基本书写步骤如下:
空间构型:平面三角形 键 角:120
38
大学无机化学分子结构

·· K·+ :Cl· →
K+[:C··l:]-
··
··
定义:正负离子间的静电吸引力叫做离子键。
特点:既没有方向性, 也不具饱和性。
NaCl 晶体
1.1 离子键的形成条件
1. 元素的电负性差比较大
X > 1.7,发生电子转移,产生正、负离子,形成离子键;
X < 1.7,不发生电子转移,形成共价键。(X > 1.7 ,实 际上是指离子键的成分大于 50 %)
第二章 分子结构
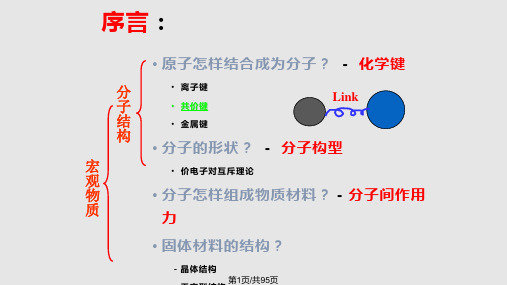
序言:
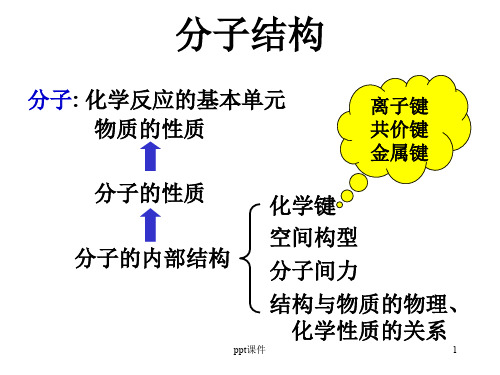
• 原子怎样结合成为分子? 化学键
• 离子键
Link
共价键
金属键
• 分子的形状? - 分子构型
–价电子对互斥理论
• 分子怎样组成物质材料?-分子间作用力
• 固体材料的结构?
-晶体结构
-无定型结构
化学键: 分子中原子间的强烈作用。
第一节 离子键
离子键及其特点
离子键及其特点· :
一、经典的共价键理论(G.N. Lewis, 1916, 美国) 1. 要点:
共价分子中的原子都有形成稀有气体电子结构(8 电子稳定结构)的趋势,求得自身的稳定。
原子通过共用电子对形成化学键。
——共价键
“-”单键 “=”双键“ ”三键,价键结构式如:NN
Lewis 的贡献,在于提出了一种不同于离子键的新的 键型,解释了电负性比较小的元素之间原子的成键事实。
1.2 离子键的特征
离子键的实质是静电引力 F q1 q2 / r 2,影响 离子键强度的因素有:离子的电荷 q 、离子的电子 层构型和离子半径 r (离子的三个重要特征) 。
第二节 共价键
针对一些非金属单质或电负性相差不大的元素间 形成的化合物中各原子之间的化学键。
大学无机化学《分子结构》 ppt课件
19
sp3杂化轨道示意图
CH4分子的空间结构
ppt课件
20
④ sp3d2杂化 1 ns + 3 np + 2 nd 6 sp3d2 六个sp3d2杂化轨道指向正八面体的六个顶点 sp3d2杂化轨道间的夹角 = 180或90
ppt课件
21
3p 3s
激发态
激发
SF6分子形成
杂化
3d
sp3d2杂化态
② 杂化前后轨道数目不变。
③ 杂化轨道可分为等性和不等性杂化轨道。 采用sp3杂化轨道成键的分子,其空间构型可 能为四面体型,V型或者三角锥型。
③ 单电子键 (如 H2+p)p,t课O件 2具有磁性
6
1927年, Heitler 和 London 应用量子力学研究 H2分子结构, 初步解答了共价键的本质.
1930年, Pauling 和 Slater 等发展出现代价键 理论(电子配对理论)、杂化轨道理论、 价层电子对互斥理论
1932年, 美国化学家密立根和德国化学家洪特 提出分子轨道理论
ppt课件
10
8.2.2 共价键的类型
(1)σ键:两原子的成键轨道沿键轴(或两 核间的连线)的方向,以“头碰头”的方式 发生轨道重叠,轨道重叠部分是沿着键轴呈 圆柱型对称,这样形成的共价键叫σ键。
++
x
s-s
—
++
x
px-s
—
++
—
x
ppt课件
px- px
11
(2)π键:两个原子轨道沿键轴的方向,通过键轴的
另一方有空轨道。
例:NH
4
H
HNH
H
BF4
CO
药学大一无机化学分子结构PPT课件
c. 离子的电子层结构
原子究竟能形成何种电子层构型的离子, 除决定于原子本身的性质和电子层构型本身 的稳定性外,还与其相作用的其它原子或分 子有关。
一般简单的负离子( F-、Cl-、O2-)等,其 最外层都具有稳定的8电子结构。
第17页/共95页
对正离子情况复杂得多。 ①、2电子构型: Li+,Be2+ ②、8电子构型: Na+,Mg2+ ③、18电子构型: Zn2+,Hg2+ ,Cu+,Ag+ ④、18+2电子构型: Pb2+,Sn2+ ⑤、9-17电子构型: Fe2+, Cr3+ ,Mn2+ 等。 离子的电子构型不同,其离子间的作用力不同。
xx px
++
绕键轴旋转
键轴
z
180°
++
第39页/共95页
例: N2 分子中两个原子各有三个单电子
px py pz
沿 z 轴成键时, px 与 px “ 头碰头” 形成一个 键 。此时, pz 和 pz , py 和 py 以 “ 肩并肩 ” 形式重叠,形成两个 键。
N2 分子的 3 键中,有 1 个 键, 2 个 键 。
第3页/共95页
1、离子键及其特点:
Na· +
·· :Cl·→
Na +[:C··l:]-
定义:正负离子间··的静电吸引·力· 叫做离子键。
特点:既没有方向性,也不具饱和性。
NaCl 晶体
第4页/共95页
离子键理论的基本要点:
a.活泼金属原子失去最外层电子,形成稳定电子结 构的带正电的子; b.活泼非金属原子得到电子,形成稳定电子结构的 带负电的离子; c.正、负离子之间由于静电引力作用而形成稳定的 结合体。
无机化学分子结构课件

分析酸碱分子的结构特点,讨论结构与酸碱强度 之间的关系。
3
酸碱反应机理
详细介绍酸碱中和反应的机理,包括质子的转移 和电子的重新排布等。
氧化还原反应与分子结构关系
氧化还原反应基本概念
解释氧化数、氧化态、氧化还原电对等基本概 念。
氧化还原反应与分子结构
探讨分子结构对氧化还原反应活性和选择性的 影响。
氧化还原反应机理
离子晶体的结构类型
包括简单离子晶体(如NaCl)、复杂离子晶体(如CsCl、CaF2) 等。
金属晶体结构
金属键的形成
自由电子与金属离子间的相互作用形成金属键,构成金属晶体。
金属晶体的特性
良好的导电性、导热性、延展性和塑性。
金属晶体的结构类型
包括简单立方堆积、体心立方堆积、面心立方堆积等。
共价晶体结构
分子构型
甲烷分子由一个碳原子和四个氢原子组成,呈正四面体构 型。
键合方式
甲烷分子中,碳原子与氢原子之间通过共价键连接。
物理性质
甲烷在常温下为无色、无味的气体,难溶于水。
化学性质
甲烷是一种稳定的烷烃,不易发生化学反应。但在特定条 件下,如高温或催化剂作用下,可以发生裂解反应生成碳 和氢气。
氯化氢分子结构及其性质
疏水相互作用和π-π堆积作用
疏水相互作用的定义
疏水相互作用是非极性分子之间 的一种相互吸引力,它是由于非 极性分子在水中相互聚集以降低 体系能量的结果。
π-π堆积作用的定义
π-π堆积作用是芳香环之间的一 种相互吸引力,它是由于芳香环 中π电子的离域作用而产生的。
疏水相互作用和π-π 堆积作用的影响
分子构型
氨分子由一个氮原子和三个氢原子组成, 呈三角锥形构型。
3
酸碱反应机理
详细介绍酸碱中和反应的机理,包括质子的转移 和电子的重新排布等。
氧化还原反应与分子结构关系
氧化还原反应基本概念
解释氧化数、氧化态、氧化还原电对等基本概 念。
氧化还原反应与分子结构
探讨分子结构对氧化还原反应活性和选择性的 影响。
氧化还原反应机理
离子晶体的结构类型
包括简单离子晶体(如NaCl)、复杂离子晶体(如CsCl、CaF2) 等。
金属晶体结构
金属键的形成
自由电子与金属离子间的相互作用形成金属键,构成金属晶体。
金属晶体的特性
良好的导电性、导热性、延展性和塑性。
金属晶体的结构类型
包括简单立方堆积、体心立方堆积、面心立方堆积等。
共价晶体结构
分子构型
甲烷分子由一个碳原子和四个氢原子组成,呈正四面体构 型。
键合方式
甲烷分子中,碳原子与氢原子之间通过共价键连接。
物理性质
甲烷在常温下为无色、无味的气体,难溶于水。
化学性质
甲烷是一种稳定的烷烃,不易发生化学反应。但在特定条 件下,如高温或催化剂作用下,可以发生裂解反应生成碳 和氢气。
氯化氢分子结构及其性质
疏水相互作用和π-π堆积作用
疏水相互作用的定义
疏水相互作用是非极性分子之间 的一种相互吸引力,它是由于非 极性分子在水中相互聚集以降低 体系能量的结果。
π-π堆积作用的定义
π-π堆积作用是芳香环之间的一 种相互吸引力,它是由于芳香环 中π电子的离域作用而产生的。
疏水相互作用和π-π 堆积作用的影响
分子构型
氨分子由一个氮原子和三个氢原子组成, 呈三角锥形构型。
大学无机化学第2章分子结构

sp 2个sp杂化轨道
sp杂化
上页
下页
回主目录
返回
hyzh@
BeCl2
Be:1s22s2
Cl:1s22s22p63s23p5
BeCl2 键角 θ=180° 直线型分子
上页 下页 回主目录 返回
hyzh@
(2)sp2杂化轨道:由1个s轨道和2个p轨道杂化得到 3个等同的sp2杂化轨道。每个轨道含有1/3 s和2/3 p的 成分,3个轨道处于同一平面,每个轨道间的夹角为 120º 。例如: BF3的形成 2p 2s 2 1 基态B价层电子排布: 2s 2p
1. s-p等性杂化 (1)sp杂化:1个s轨道和1个p轨道杂化得到两个等 同的sp杂化轨道。每个轨道含有0.5s和0.5p的成分,
两个轨道间的夹角为180º 。例如:BeCl2的形成
基态Be价层电子排布:2s2
2s
2p
在BeCl2分子形成中,Be原子轨道的杂化过程如下:
2s
2p
激发
2s
2p
激发态
第二章 分子结构 Molecular structure
新乡医学院化学教研室 范 秉 琳
E-mail: yaoxuejianyan@
Password: yaojian2015
物质的性质
分子的性质
分子的结构
化学键(chemical
bond)
分子中直接相邻的原子间强的相互作用 称为化学键。
2. 共价键的方向性:因为各原子轨道在空间分布方
向是固定的,为了满足轨道的最大程度重叠,原子 间形成的共价键,当然要具有方向性。
(三)共价键的类型
1.键: •成键轨道沿键轴方向头碰头重叠 •轨道重叠部分沿键轴呈圆柱形对称 •是最大重叠,可旋转,稳定性高
大学无机化学第二章 分子结构

2. 分子的极性与键的极性的关系
1. 对于双原子分子,键的极性就是分子的极性。 2. 多原子分子中,化学键无极性,分子便没有极 性。例如P4、S8 、金刚石等。
3. 多原子分子中,化学键虽然有极性,但由于分子
的几何构型恰当,使化学键的极性抵消,导致分
子无极性。
4 . 多原子分子中,化学键有极性,分子的几何构
杂化轨道理论的要点
• 1. 能量相近的轨道才能杂化。 • 2. 杂化轨道的数目与组成杂化轨道的各 原子轨道的数目相等。 • 3. 杂化轨道的成键能力比原来轨道加强。 Reasons 1) 杂化轨道的电子云形状改变; 2) 杂化轨道方向改变。
杂化轨道类型 —— sp杂化
BeCl2分子:直线形 键角为:180 °
(二) 氢键的特点: F F
H
H 134° H
F
H
F
F
H 这是氢键的饱和性
F
H
F
H H
F
这是氢键的方向性
(三) 氢键的类型
(1)分子间氢键 ● 同种分子之间氢键。如H2O分子之间、HF分 子之间、NH3分子之间、H3BO3分子之间等。 ●不同种分子之间氢键。如H2O与NH3之间、 甲醇与水之间、乙醇与水之间等。 H O (2)分子内氢键 如HNO3分子内的氢键
二、现代价键理论
-
+
x
二、现代价键理论
(三) 共价键的类型 σ 键(头碰头) • 按成键重叠方式: π 键(肩并肩)
普通共价键(双方)
• 按电子对来源: 配位共价键(单方)
二、现代价键理论
σ键:沿着键轴方向重叠--―头碰头” 重叠
将成键轨道沿着键轴旋转任意角度,图形及
符号均保持不变。
《无机化学》 化学键与分子结构

《无机及分析化学》 第三章 化学键与分子结构
山农大化学院 刘修堂 2013-2014-1
第三章 化学键与分子结构
化学键(中心问题) 分子结构 分子的空间构型
分子间的作用力
结构决定性质
2021-03-22
第1张共51 张
《无机及分析化学》 第三章 化学键与分子结构
山农大化学院 刘修堂 2013-2014-1
相同原子成键:χA-χB= 0 键无极性(χ为电负性)
不同原子成键:χA-χB≠0 键有极性。q+
q-
键极性大小度量:偶极矩μ
d
Q d 电量与距离的乘积
△χ>1.7时,一般为离子键,极性共价键是介于 离子键与非极性共价键之间的一种过渡状态。
⑴σ键: 原子轨道以“头碰头”方式重叠形成的键。 如 H2、 HC1。
⑵π键: 原子轨道以“肩并肩”方式重叠形成的键。 如:N2分子。
2021-03-22
第15张共51 张
《无机及分析化学》 第三章 化学键与分子结构
山农大化学院 刘修堂 2013-2014-1
σ键 与π键的比较
σ键
π键
参加成键的轨道 S、p 及各种杂化轨道 仅 p 轨道
2021-03-22
最外层为9~17个电子
第9张共51 张
《无机及分析化学》 第三章 化学键与分子结构
山农大化学院 刘修堂 2013-2014-1
问题:
活泼金属与活泼非金属以离子 键结合成分子,那么同核双原子分 子(如O2、Cl2 )或电负性相差不 大的原子形成分子(如CH4)原子间靠 什么结合?
山农大化学院 刘修堂 2013-2014-1
2021-03-22
第13张共51 张
山农大化学院 刘修堂 2013-2014-1
第三章 化学键与分子结构
化学键(中心问题) 分子结构 分子的空间构型
分子间的作用力
结构决定性质
2021-03-22
第1张共51 张
《无机及分析化学》 第三章 化学键与分子结构
山农大化学院 刘修堂 2013-2014-1
相同原子成键:χA-χB= 0 键无极性(χ为电负性)
不同原子成键:χA-χB≠0 键有极性。q+
q-
键极性大小度量:偶极矩μ
d
Q d 电量与距离的乘积
△χ>1.7时,一般为离子键,极性共价键是介于 离子键与非极性共价键之间的一种过渡状态。
⑴σ键: 原子轨道以“头碰头”方式重叠形成的键。 如 H2、 HC1。
⑵π键: 原子轨道以“肩并肩”方式重叠形成的键。 如:N2分子。
2021-03-22
第15张共51 张
《无机及分析化学》 第三章 化学键与分子结构
山农大化学院 刘修堂 2013-2014-1
σ键 与π键的比较
σ键
π键
参加成键的轨道 S、p 及各种杂化轨道 仅 p 轨道
2021-03-22
最外层为9~17个电子
第9张共51 张
《无机及分析化学》 第三章 化学键与分子结构
山农大化学院 刘修堂 2013-2014-1
问题:
活泼金属与活泼非金属以离子 键结合成分子,那么同核双原子分 子(如O2、Cl2 )或电负性相差不 大的原子形成分子(如CH4)原子间靠 什么结合?
山农大化学院 刘修堂 2013-2014-1
2021-03-22
第13张共51 张
