选修五【醇】PPT课件
合集下载
(人教)高中化学选修5课件:第3章第1节第1课时醇

• 【答案】 (1)组装仪器,检查装置的气密性 加热,使温度迅速升到170℃
• (2)乙中酸性KMnO4溶液紫色褪去 除去乙烯 中混有的SO2、CO2等酸性气体 不能,SO2 具有还原性,也可以使酸性KMnO4溶液褪色
• ●变式训练
2.实验室制取乙烯的装置如图所示,试回答:
导学号 06050377
成了________。 •逐②渐升饱高和一元醇随分子中碳原子个数的增加,
醇的沸点__________。
越高
• ③碳原子数目相同时,羟基的个数越多,醇 的沸点________。
• (2)溶解性
氢键
• 甲醇、乙醇、丙醇、乙二醇、丙三醇等低级
• 3.醇的化学性质
• 醇的化学性质主要由官能羟团基 ________决定, 由于氧原子吸引电子的能力比氢原子和碳原 子强,O—H键和C—O键的电子对偏向于氧原 子,使O—H键和C—O键易断裂。
C.6 种
D.7 种
解析:思维模式:
烷烃 ―→ 烷烃基 ―→ 烷烃的一取代物
C3H8(1 种)
—C3H7(2 种)
2种
C4H10(2 种)
—C4H9(4 种)
4种
C5H12(3 种)
—C5H11(8 种)
8种
能与金属钠反应且分子式为 C4H10O 的有机物为丁醇,因丁
基有 4 种结构,故答案为 A。
• 【解析】 (1)①制取气体的装置的气密性必 须良好,实验前需要检查。
• ③实验室制乙烯的反应条件是使反应混合物 的温度迅速升至170℃,而减少乙醚的生成。
• (2)乙烯具有还原性是根据氧化剂酸性KMnO4 溶液褪色来判断的。由于烧瓶中混合物变黑, 则说明生成了碳,联想浓H2SO4具有强氧化 性,推出在乙烯中含还原性气体SO2,由于 SO2也会使酸性KMnO4溶液褪色,会干扰验 证乙烯的还原性,所以检验乙烯的还原性前 必须除净SO2,则装置甲的作用是除去SO2。
人教版高中化学选修5课件:3.1.1 醇ppt

CH3CH2OCH2CH3 + H2O
科学视第野13 页
醇
总结感第悟14 页
3.取代反应 C2H5OH + HBr △ C2H5Br + H2O
4.氧化反应 有机物分子中加入氧原子或失去氢原子的反应
2CH3CH2OH+O2
催化剂
△
2CH3CHO+2H2O
CH3CH2OH 氧化 CH3CHO 氧化 CH3COOH
醇
二、醇的性质
1.与金属钠的反应 可测定分子中羟基个数
2Na + 2ROH
2RONa 醇钠
+
H2↑
断键处 钠置换的是羟基氢
CH2OH + 2Na CH2OH
CH2ONa CH2ONa
+ H2↑
温故知第新10 页
醇
乙醇的消去反应与溴乙烷的消去反应有区别吗?
视频导第学11 页
醇
2.消去反应(分子内脱水)
醇
当堂巩第固17 页
2、分子式为C3H8O的液态有机物A 1 mol,与足量的金属钠反应,可 以生成11.2 L H2(标准状况),则A分子中必含有一个__羟__基____(填官能
团的名称)。若该官能团位于碳链的一端,则A的结构简式为
__C_H__3C__H_2_C_H__2O__H______,A与浓硫酸共热170 ℃以上,发生消去反应的
官能团:—OH(醇羟基)
羟基具有亲水性,低级醇都可溶于水。
2.醇的分类 按烃基种类分类
脂肪醇 CH3OH
芳香醇 —CH2OH
甲醇
苯甲醇
醇
根据醇分子中羟基的个数分类
一元醇
二元醇
CH3OH 甲醇
人教版高中化学选修五课件第1课时醇

CH3CH2OH
乙醇
氧化
CH3CHO
乙醛
氧化
CH3COOH
乙酸
结论:羟基碳上有2个氢原子的醇被氧化成酸。
羟基碳上有1个氢原子的醇被氧化成酮。
羟基碳上没有氢原子的醇不能被氧化。
【练习与实践】
1.登录互联网,查阅乙醇的有关用途。
2.家庭小实验:制作酒酿
将糯米洗净,在锅中蒸熟,冷却至30℃左右,加入
研碎的酒曲,充分混合均匀,在30℃左右的环境
第三章烃的含氧衍生物
第一节醇酚
第1课时醇
自2011年5月1日起,醉酒驾驶被列入刑法,交警检测
司机是否酒后驾驶的原理是:
2K2Cr2O7+3CH3CH2OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O, K2Cr2O7溶液为橙红色溶液,遇到C2H5OH后颜色变为绿 色,据此,交警可让司机对填充了吸附有K2Cr2O7的硅
脂环醇OH
芳香醇OH
2.常见醇 CH2OH CH2OH CHOH CH2OH 丙三醇(三元醇)
CH2OH
乙二醇(二元醇)
乙二醇和丙三醇都是无色、黏稠、有甜味的液体, 都易溶于水和乙醇,是重要的化工原料。 乙二醇可用于汽车防冻液,丙三醇可用于配制 化妆品。
3.饱和一元醇的命名 (1)选主链:选含—OH的最长碳链为主链,称某醇
种无机物和有机物
状态:
挥发性: 密度:
溶解性: 跟水以任意比例互溶,能够溶解多
3.乙醇的化学性质 (1)消去反应:
浓硫酸
断键位置: 脱去—OH和与—OH相邻的碳原子上的1个H 浓硫酸的作用:催化剂和脱水剂
制乙烯实验装置:
乙醇
氧化
CH3CHO
乙醛
氧化
CH3COOH
乙酸
结论:羟基碳上有2个氢原子的醇被氧化成酸。
羟基碳上有1个氢原子的醇被氧化成酮。
羟基碳上没有氢原子的醇不能被氧化。
【练习与实践】
1.登录互联网,查阅乙醇的有关用途。
2.家庭小实验:制作酒酿
将糯米洗净,在锅中蒸熟,冷却至30℃左右,加入
研碎的酒曲,充分混合均匀,在30℃左右的环境
第三章烃的含氧衍生物
第一节醇酚
第1课时醇
自2011年5月1日起,醉酒驾驶被列入刑法,交警检测
司机是否酒后驾驶的原理是:
2K2Cr2O7+3CH3CH2OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O, K2Cr2O7溶液为橙红色溶液,遇到C2H5OH后颜色变为绿 色,据此,交警可让司机对填充了吸附有K2Cr2O7的硅
脂环醇OH
芳香醇OH
2.常见醇 CH2OH CH2OH CHOH CH2OH 丙三醇(三元醇)
CH2OH
乙二醇(二元醇)
乙二醇和丙三醇都是无色、黏稠、有甜味的液体, 都易溶于水和乙醇,是重要的化工原料。 乙二醇可用于汽车防冻液,丙三醇可用于配制 化妆品。
3.饱和一元醇的命名 (1)选主链:选含—OH的最长碳链为主链,称某醇
种无机物和有机物
状态:
挥发性: 密度:
溶解性: 跟水以任意比例互溶,能够溶解多
3.乙醇的化学性质 (1)消去反应:
浓硫酸
断键位置: 脱去—OH和与—OH相邻的碳原子上的1个H 浓硫酸的作用:催化剂和脱水剂
制乙烯实验装置:
选修5 醇 ppt课件

2. 用后拧紧瓶盖,当药品性状发生改变
膏 时禁止使用,尤其医是药色泽变红 后。
使 3.连续使用,一般使用一周,如仍末见好转,请向医师咨询, 用 如有瘙痒、灼伤红肿红症等症状,应停止使用,并用酒精洗净。
说 【不良反应】偶见皮肤刺激性。
明 书
【药物相用】 1. 不能与碱性药物并用 。
2. 如正在使用其他药品,使用本品前请咨询医师。
CH3
CH3 CH3-CH-OH
醇发生催化氧化条件:
连羟基的碳原子上要有氢
注意:
与羟基相连的碳上有2个氢原子的醇被催化氧化成醛。 与羟基相连的碳上有1个氢原子的醇被催化氧化成酮。 与羟基相连的碳上没有氢原子的醇不能被催化氧化。
ppt课件
38
c.可以被重铬酸钾、酸性高锰酸钾溶液氧化
实验3-2 现象:溶液变成绿色
7、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
ppt课件
30
思考:
能发生消去反应的醇的分子结构特点是什么?是 不是所有的醇都能发生消去反应?
CH3OH
它们能否发生像乙醇那样的消去反应?
醇能发生消去反应的条件: 与-OH相连的碳原子相邻的碳原子有氢原子。
ppt课件
31
③取代反应
(橙黄色)
(蓝绿色)
ppt课件
40
乙醇用途:
用作燃料,制造饮料和香精外,食品加工业, 重要的有机化工原料,如制造乙酸、乙醚等。又 是一种有机溶剂,用于溶解树脂,制造涂料。医 疗上常用75%(体积分数)的酒精作消毒剂。
ppt课件
41
烯烃 酯
本课小结
卤代烃
氢卤酸
醇
浓硫酸
醚
ppt课件
膏 时禁止使用,尤其医是药色泽变红 后。
使 3.连续使用,一般使用一周,如仍末见好转,请向医师咨询, 用 如有瘙痒、灼伤红肿红症等症状,应停止使用,并用酒精洗净。
说 【不良反应】偶见皮肤刺激性。
明 书
【药物相用】 1. 不能与碱性药物并用 。
2. 如正在使用其他药品,使用本品前请咨询医师。
CH3
CH3 CH3-CH-OH
醇发生催化氧化条件:
连羟基的碳原子上要有氢
注意:
与羟基相连的碳上有2个氢原子的醇被催化氧化成醛。 与羟基相连的碳上有1个氢原子的醇被催化氧化成酮。 与羟基相连的碳上没有氢原子的醇不能被催化氧化。
ppt课件
38
c.可以被重铬酸钾、酸性高锰酸钾溶液氧化
实验3-2 现象:溶液变成绿色
7、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
ppt课件
30
思考:
能发生消去反应的醇的分子结构特点是什么?是 不是所有的醇都能发生消去反应?
CH3OH
它们能否发生像乙醇那样的消去反应?
醇能发生消去反应的条件: 与-OH相连的碳原子相邻的碳原子有氢原子。
ppt课件
31
③取代反应
(橙黄色)
(蓝绿色)
ppt课件
40
乙醇用途:
用作燃料,制造饮料和香精外,食品加工业, 重要的有机化工原料,如制造乙酸、乙醚等。又 是一种有机溶剂,用于溶解树脂,制造涂料。医 疗上常用75%(体积分数)的酒精作消毒剂。
ppt课件
41
烯烃 酯
本课小结
卤代烃
氢卤酸
醇
浓硫酸
醚
ppt课件
《醇》人教版高中选修五化学PPT精品课件

人教版高中选修五化学课件
醇
第3章 烃的含氧衍生物 讲解人: 时间:
新知导入
问题1:醉酒的人为什么会脸红? 问题2:如何检测酒驾?
喝酒脸红的原因是什么呢?很多人以为是酒精导致的,其实不然,是乙醛引起的。乙醛具有让毛 细血管扩张的功能,而脸部毛细血管的扩张才是脸部变红的原因。所以喝酒脸红的人意味着能迅 速将乙醇转化成为乙醛。 为了你我安全,开车不饮酒,饮酒不开车!
HO 2H C C H + 2H2O
乙醛
H
二、乙醇
= =
(1). 2R—CH2—OH + O2
Cu △
O 2R—C—H + 2H2O
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛 O
R1
(2). + O2
2
R2
Cu CH—OH △
2R1—C—R2 +2H2O
仲醇(—OH在仲碳-中间碳上),去氢氧化为酮
H
OH
浓H2SO4 170 ℃
CH2=CH2↑(断+②H⑤2O )
分子内脱水 CH3OH
CH3 CH3−C−CH2OH
CH3
−CH2OH
结论:乙醇在不同温度下( 140 ℃、170 ℃ )生成不同的产物
二、乙醇
2)消去反应
CH|2CH2
浓H2SO4 | 170℃
H OH
CH2=CH2↑+ —H2O—常用于实验室制备乙烯
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
2 −OH ~ H2
小结:
①活泼金属:K/Ca/Na/Mg/Al
②乙醇与金属钠反应不如水与金属钠反应剧烈;羟基上的H原子的活泼性小于水
醇
第3章 烃的含氧衍生物 讲解人: 时间:
新知导入
问题1:醉酒的人为什么会脸红? 问题2:如何检测酒驾?
喝酒脸红的原因是什么呢?很多人以为是酒精导致的,其实不然,是乙醛引起的。乙醛具有让毛 细血管扩张的功能,而脸部毛细血管的扩张才是脸部变红的原因。所以喝酒脸红的人意味着能迅 速将乙醇转化成为乙醛。 为了你我安全,开车不饮酒,饮酒不开车!
HO 2H C C H + 2H2O
乙醛
H
二、乙醇
= =
(1). 2R—CH2—OH + O2
Cu △
O 2R—C—H + 2H2O
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛 O
R1
(2). + O2
2
R2
Cu CH—OH △
2R1—C—R2 +2H2O
仲醇(—OH在仲碳-中间碳上),去氢氧化为酮
H
OH
浓H2SO4 170 ℃
CH2=CH2↑(断+②H⑤2O )
分子内脱水 CH3OH
CH3 CH3−C−CH2OH
CH3
−CH2OH
结论:乙醇在不同温度下( 140 ℃、170 ℃ )生成不同的产物
二、乙醇
2)消去反应
CH|2CH2
浓H2SO4 | 170℃
H OH
CH2=CH2↑+ —H2O—常用于实验室制备乙烯
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
2 −OH ~ H2
小结:
①活泼金属:K/Ca/Na/Mg/Al
②乙醇与金属钠反应不如水与金属钠反应剧烈;羟基上的H原子的活泼性小于水
优质公开课选修五《醇》PPT课件名校精品共32页

优质公开课选修五《醇》PPT课件名 校精品
革如果不讲纪律,就难以成功。
3、道德行为训练,不是通过语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律 、颓废 等不良 行为。 4、学校没有纪律便如磨房里没有水。 ——夸 美纽斯
5、教导儿童服从真理、服从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
革如果不讲纪律,就难以成功。
3、道德行为训练,不是通过语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律 、颓废 等不良 行为。 4、学校没有纪律便如磨房里没有水。 ——夸 美纽斯
5、教导儿童服从真理、服从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
人教版高中化学选修五课件3-1-(1)醇.pptx

知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
2.醇类断裂C—O键,脱掉—OH时,可发生取代或消去反 应;若同时断裂C—O键和H—C键时可发生消去,若同时断 裂O—H键和C—H键则发生氧化反应,要注意分析体会。
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
变式训练2 二甘醇可用作溶剂、纺织助剂等,一旦进入人体 会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO— CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的 是
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
二、醇类的有关反应规律 1.醇的消去反应规律 (1)醇分子中,连有—OH的碳原子的相邻碳原子上必须连有
氢原子时,才能发生消去反应而形成不饱和键。
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
(2)若醇分子中与—OH相连的碳原子无相邻碳原子或其相邻 碳原子上无氢原子,则不能发生消去反应。如CH3OH、 (CH3)3CCH2OH不能发生消去反应生成烯烃。
2.加热混合液时,温度要迅速上升到并稳定于170℃左右, 因为在140℃时主要产物是乙醚。
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
3.由于反应物都是液体而无固体,所以要向烧瓶中加入碎 瓷片,以防液体受热时发生暴沸。
4.温度计的水银球要置于反应液的中央位置,因为需要测 量的是反应液的温度。
知识聚焦 难点突破
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
一、进行乙醇的消去反应实验时的注意事项
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
1.配制体积比为1∶3的乙醇与浓硫酸混合液时,要注意在 烧杯中先加入95%乙醇,然后滴加浓硫酸,边滴加边搅 拌,冷却备用(相当于浓硫酸的稀释),浓硫酸起催化剂和 脱水剂的作用。
化学选修五第三章第一节醇类(精品课件).ppt

CH3CHO
化学性质
H H
CO2和H2O
乙醛
H
C
C
O
H
H H 乙醇
CH2=CH2
乙烯
H
H
H
C
C
CH3CH2ONa Br 乙醇钠
H H
溴乙烷
乙醇的催化氧化反应
疑问探究 乙醇能否被强氧化剂酸性K2Cr2O7或酸性KMnO4氧 化呢?
少量酸性 K2Cr2O7 少量 乙醇 水浴 加热
实验结论
K2Cr2O7 (橙红色)
拓展练习:—— 醇的催化氧化产物书 写和条件
B
4.下列物质既能发生消去反应生成相应的烯烃, 又能氧化生成相应的醛的是( ) A.CH3OH C.(CH3)3OH B.CH2OHCH2CH3 D.(CH3)2COHCH2CH3
练 一练
1.下列混合物中,不能用分液漏斗分 离的是( A )
A.乙醇和水 C.溴苯和水
沸点/℃
1—丙醇 1,2—丙二醇 1,2,3—丙三醇
1 2 3
97.2 188 259
醇类
物理性质 分类和命名 分子结构
化学性质
醇
乙醇的结构
分子式 结构式
H H C2H6O H—C—C—O—H H H 结构简式 CH3CH2OH
官能团
—OH (羟基)
●
乙醇比例模型
乙醇球棍模型
: :
O:H
分子结构
卤代烃
烯
(
)
羧酸
乙醇钠
通过这节课,你能不能 分析一下化学家为什么非要 带着醇去荒岛呢?
醚
浓硫酸 加热
取代反应
卤代烃
烯
氧气 Na
醛
酸
化学性质
H H
CO2和H2O
乙醛
H
C
C
O
H
H H 乙醇
CH2=CH2
乙烯
H
H
H
C
C
CH3CH2ONa Br 乙醇钠
H H
溴乙烷
乙醇的催化氧化反应
疑问探究 乙醇能否被强氧化剂酸性K2Cr2O7或酸性KMnO4氧 化呢?
少量酸性 K2Cr2O7 少量 乙醇 水浴 加热
实验结论
K2Cr2O7 (橙红色)
拓展练习:—— 醇的催化氧化产物书 写和条件
B
4.下列物质既能发生消去反应生成相应的烯烃, 又能氧化生成相应的醛的是( ) A.CH3OH C.(CH3)3OH B.CH2OHCH2CH3 D.(CH3)2COHCH2CH3
练 一练
1.下列混合物中,不能用分液漏斗分 离的是( A )
A.乙醇和水 C.溴苯和水
沸点/℃
1—丙醇 1,2—丙二醇 1,2,3—丙三醇
1 2 3
97.2 188 259
醇类
物理性质 分类和命名 分子结构
化学性质
醇
乙醇的结构
分子式 结构式
H H C2H6O H—C—C—O—H H H 结构简式 CH3CH2OH
官能团
—OH (羟基)
●
乙醇比例模型
乙醇球棍模型
: :
O:H
分子结构
卤代烃
烯
(
)
羧酸
乙醇钠
通过这节课,你能不能 分析一下化学家为什么非要 带着醇去荒岛呢?
醚
浓硫酸 加热
取代反应
卤代烃
烯
氧气 Na
醛
酸
高中化学人教版选修五课件:醇PPT43张

第14页
第三章
第一节
课时作业1
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
③CH2===CH2↑+H2O (3)75% (4)96% 99.5% 新制的生石灰 蒸馏 二、 1.羟基 羟基 2.(1)所含羟基的数目 (2)二元醇 多元醇
第三章
第一节
课时作业1
第15页
RJ版· 化学· 选修5
C2H5OH +
第三章
第一节
课时作业1
第17页
RJ版· 化学· 选修5
第三章
第一节
课时作业1
第7页
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
①乙醇的密度随浓度的增加而减小(与氨水类似)。 ②在工业酒精中加入________,然后________便得到无水 乙醇。 二、醇的概念、分类、命名 1.概念 ________与烃基或苯环侧链上的碳原子相连的化合物。官 能团是________。
第16页
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
△ CH3CH2OH + HBr ――→ CH3CH2Br + H2O + HOCH2CH3 浓硫酸 ――→ 140℃
CH3CH2OH + H2O
CH3CH2—O—CH2CH3
Cu或Ag 2CH3CH2OH + O2 ――→ 2CH3CHO + 2H2O △ 点燃 3O2――→2CO2+3H2O
第3页
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
基础训练 课 前预习
第三章
第一节
课时作业1
第4页
RJ版· 化学· 选修5
一、乙醇
45分钟作业与单元评估
第三章
第一节
课时作业1
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
③CH2===CH2↑+H2O (3)75% (4)96% 99.5% 新制的生石灰 蒸馏 二、 1.羟基 羟基 2.(1)所含羟基的数目 (2)二元醇 多元醇
第三章
第一节
课时作业1
第15页
RJ版· 化学· 选修5
C2H5OH +
第三章
第一节
课时作业1
第17页
RJ版· 化学· 选修5
第三章
第一节
课时作业1
第7页
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
①乙醇的密度随浓度的增加而减小(与氨水类似)。 ②在工业酒精中加入________,然后________便得到无水 乙醇。 二、醇的概念、分类、命名 1.概念 ________与烃基或苯环侧链上的碳原子相连的化合物。官 能团是________。
第16页
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
△ CH3CH2OH + HBr ――→ CH3CH2Br + H2O + HOCH2CH3 浓硫酸 ――→ 140℃
CH3CH2OH + H2O
CH3CH2—O—CH2CH3
Cu或Ag 2CH3CH2OH + O2 ――→ 2CH3CHO + 2H2O △ 点燃 3O2――→2CO2+3H2O
第3页
RJ版· 化学· 选修5
45分钟作业与单元评估
二合一
基础训练 课 前预习
第三章
第一节
课时作业1
第4页
RJ版· 化学· 选修5
一、乙醇
45分钟作业与单元评估
高中化学人教版选修5课件:第三章 第一节 第一课时 醇(41张PPT)

提示:减少副反应的发生,因为在 140 ℃时乙醇分子 间脱水生成乙醚,而温度高于 170 ℃时,会产生大量 CO2、 SO2 气体。
(3)若将加热混合液所得气体直接通入 KMnO4 酸性溶 液中,溶液褪色,能否说明所得气体为乙烯?
提示:不能。因为浓硫酸具有强氧化性,加热时易将乙 醇氧化而生成 C、CO、CO2、SO2 等,SO2 能使 KMnO4 酸性 溶液褪色,故检验乙烯时应先通过 NaOH 溶液除去 SO2。
1.下列物质属于醇类的是
(
)
解析:醇是羟基与链烃基或苯环侧链上的碳原子相连形成的 化合物,A、C 中羟基直接与苯环相连,而 D 中有机物不含 羟基,不属于醇。 答案:B
2.下列关于醇的说法中,正确的是 A.醇类都易溶于水 B.醇就是羟基和烃基相连的化合物 C.饱和一元醇的通式为 CnH2n+1OH
(
)
D.甲醇和乙醇都有毒,禁止饮用 解析:A 项不正确,分子中碳原子数比较多的高级醇不溶于
水; B 项不正确, 醇是指羟基与烃基或苯环侧链上的碳原子相 连的化合物;C 项正确,饱和一元醇可以看成是烷烃分子中 的一个氢原子被羟基取代后的产物;D 项不正确,甲醇有毒, 乙醇可制成白酒等饮用。 答案:C
3.下列对醇的命名正确的是 A.2,2二甲基3丙醇 B.1甲基1丁醇 C.2甲基1丙醇 D.1,2二甲基乙二醇
5.几种重要的醇
名称 结构 简式
甲醇
CH3—OH __________
乙二醇
丙三醇(俗称甘油)
甲醇又称木精, 是无色透明液体, 都是无色、黏稠、有甜味的液 有剧毒,误服少 性质 体,都易溶于水和乙醇,是重 量使人眼睛失明, 要的化工原料 饮入量大造成死 亡
[特别提醒] (1)含羟基的化合物不一定属于醇。 (2)分子式符合 CnH2n+2O 的物质不一定是醇,也可能是醚。 (3)醇类命名时选择的最长碳链必须连有羟基。
选修五《醇》PPT课件

CH3—CH2OH
浓硫酸 170℃
CH2=CH2↑+H2O
浓硫酸作催化剂、脱水剂 需加沸石或碎瓷片防暴沸 温度计应放 在反应液中 乙烯中会混有哪些气体? CO2、SO2 、乙醇、乙醚
测反应液温度
混合液温度要 迅速升到170℃
140℃时乙醇 会生成乙醚
混合液颜色如何 变化?为什么?
除去SO2、CO2 、乙醇
CH2=CHCH3
CH3CH=CHCH3
C. CH3CH2CH2OH
CH2=CHCH3
CH3 D. CH3 C CH2OH CH3
②
①
H H
④
H—C—C—O—H
H
① ①③ ②④ ①
H
③
反应
与金属钠反应 Cu或Ag催化氧化 浓硫酸加热到170℃
断键位置
浓硫酸条件下与乙酸加热
置换反应 (与活泼金属) ABCD
COOH COOH
HO HO
CH2 CH2
Br CH2 CH2
原料分子
Br
C H 3C H性质
1) 与钠的置换反应——羟基氢
CH2OH
CH2OH CH2OH CH2OH
2
+ 2Na →2
CH2ONa
+ H 2↑
+ 2Na →
CH2ONa CH2ONa
+
H2↑
2CHOH + 6Na →2CHONa + 3 H2↑
CH2OH CH2ONa
CH2ONa
练
一
练
【例1】0.1 mol 某有机物完全燃烧后生成0.3molCO2, 同质量的该有机物与足量的金属钠反应生成 0.1molH2, 该有机物可能是( ) BC B.1,2-丙二醇 D.乙二醇
人教版选修5 3.1 .1醇(共53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
(2)同一个碳原子上不能连接两个以上的 羟基。
否则:发生分子内自动脱水,生成醛基。
如:二氯甲烷在氢氧化钠水溶液中发生反
应:
注意:
卤代烃
和醇在
同分异
构体上
的区别。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
方法:取一定质量的乙醇与足量的金属钠 反应,测量生成的气体的体积。 方程式:
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ 断键位置和接键形势 乙醇中羟基(—OH)中O—H键断裂,生 成乙醇钠和氢气。
反应类型 置换反应 还原反应 有时也说成取代反应
比较钠与水的反应:
分析乙醇与水分别与金属钠反应现象不 同的原因:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
醇(第三课时) 一、化学性质 1、羟基部分 (一)、与钠的反应, 通式:2R—OH+2Na 2R—ONa+H2↑ 写出乙二醇和甘油分别与足量金属钠反应 的化学方程式:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
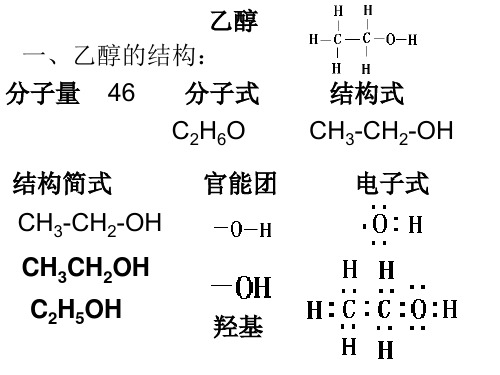
乙醇 一、乙醇的结构: 分子量 46 分子式
C2H6O
结构简式
官能团
CH3-CH2-OH
CH3CH2OH C2H5OH
羟基
结构式 CH3-CH2-OH
电子式
二、物理性质:
不用于鉴别
俗名 酒精 无色透明的液体,有特殊的香味,
比水轻,与水互溶, 沸点780C,易挥发。 乙醇在加热条件下发生反应常冷凝回流。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
(2)同一个碳原子上不能连接两个以上的 羟基。
否则:发生分子内自动脱水,生成醛基。
如:二氯甲烷在氢氧化钠水溶液中发生反
应:
注意:
卤代烃
和醇在
同分异
构体上
的区别。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
方法:取一定质量的乙醇与足量的金属钠 反应,测量生成的气体的体积。 方程式:
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ 断键位置和接键形势 乙醇中羟基(—OH)中O—H键断裂,生 成乙醇钠和氢气。
反应类型 置换反应 还原反应 有时也说成取代反应
比较钠与水的反应:
分析乙醇与水分别与金属钠反应现象不 同的原因:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
醇(第三课时) 一、化学性质 1、羟基部分 (一)、与钠的反应, 通式:2R—OH+2Na 2R—ONa+H2↑ 写出乙二醇和甘油分别与足量金属钠反应 的化学方程式:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
乙醇 一、乙醇的结构: 分子量 46 分子式
C2H6O
结构简式
官能团
CH3-CH2-OH
CH3CH2OH C2H5OH
羟基
结构式 CH3-CH2-OH
电子式
二、物理性质:
不用于鉴别
俗名 酒精 无色透明的液体,有特殊的香味,
比水轻,与水互溶, 沸点780C,易挥发。 乙醇在加热条件下发生反应常冷凝回流。
《醇》PPT课件

H3
CH3OH都属于与乙醇同类的烃的衍生物,它
们能否发生象乙醇那样的消去反应?
结论:醇能发生消去反应的条件:
与-OH相连的碳原子相邻的碳原子有氢原子。
2021
29
2.催化氧化断键剖析:
HH 2H — C—C—O—H +2O2
HH
HH 2H — C—C—O
H
+2H2O
启迪思考:
当--C上没有氢或只有 一个氢的情况又如何氧 化呢?
由于无水酒精和浓硫酸发生的氧化还原反应, 反应制得的乙烯中往往混有H2O、CO2、SO2等气 体。可将气体通过碱石灰。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密20度21 比空气密度略小。 28
开拓思考:1. CH3
—— ——
CH3
CH3
CH3-C-OH、CH3-C-CH2-OH
CH3H3
CCH3
分子羟基的氢原子间存在着相互吸引作用,
这种吸引作用叫氢键(分子间形成了氢键)
2.甲醇、乙醇、丙醇均可与水以任意比例混溶, 这是因为甲醇、乙醇、丙醇与水形成了氢键。
2021
9
二、乙醇
(一)乙醇的结构
分子式 结构式
结构简式 官能团
C2H6O
HH
CH3CH2OH
H—CH—CH—O—H2021或C2H5OH
氧化反应:有机物分子中失去氢原子或加 入氧原子的反应(去H或加O)
还原反应:有机物分子中加入氢原子或失去 氧原子的反应(加H或失O)
2021
20
(3)强氧化剂氧化
• 乙醇可被酸性高锰酸钾溶液或重铬酸钾酸 性溶液氧化生成乙酸。氧化过程可分为两 步:
氧化
氧化
CH3CH2OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羟基越多,氢键越多,沸点越高!
2)溶解性:碳数越多越难溶!
氢键作用
C1–C3与水任意比互溶; C4-C11部分溶于水;C12以上不溶于水。
3)状态:无气体;C11以下液体; C12以上蜡状固体。
乙醇化学性质:
想一想: 在必修2中,我们都学过乙醇的 哪些化学性质?
⑤ H ④H ② ① H C C OH
思考与交流
1、醇类的物理性质有何规律?
2、相对分子质量相近的醇和烷烃相比,谁的沸点更高, 为什么? 3、为什么甲醇、乙醇、丙醇均可与水以任意比例混溶?
4.醇的物理性质
1)沸点:碳数越多,沸点越高! ➢ Μ相近的醇与烷烃:醇 > 烷烃
醇中羟基形成氢键使沸点升高!
➢ 碳数相同的醇:羟基越多,沸点越高!
(4)若试管a中收集到的液体用紫色石蕊试纸检验,
试纸显红色,说明液体中还含有 乙 酸 。
CH3CH2OH 氧化 CH3CHO 氧化 CH3COOH
乙醇
乙醛
乙酸
5、醇的化学性质
5)被高锰酸钾或重铬酸钾氧化
CH3CH2OH
酸性高锰酸钾 或重铬酸钾
CH3COOH
现象:酸性高锰酸钾溶液褪色
应用:用重铬酸钾检验酒驾
乙醇 俗名:酒精
醇
※下列有机物属于醇类的是( AC )
CH2OH A
OH |
D
CH3
OH
OH B
C O C OH
E
一、醇
1.官能团:——羟基(-OH)
2.醇的分类
1) 根据羟基的数目
一元醇
二元醇
CH3OH
甲醇
CH2-OH CH2OH
乙二醇
工业酒精
有毒!
汽车 防冻剂
三元醇
CH2-OH
CH-OH
CH2OH
练一 练
A 下列醇能发生消去反应生成物有同分异构体的是( )
A. CH3CHCH2CH3 OH
CH2=CHCH2CH3 CH3CH=CHCH3
C. CH3CH2CH2OH
CH2=CHCH3
B. CH3CHCH3 OH
CH2=CHCH3
CH3 D. CH3 C CH2OH
CH3
②①
HH
H—C—C—O—H
丙三醇 俗称甘油 1,2,3-丙三醇
配制 化妆品
2.分类
一、醇
2.醇的分类
2)根据羟基所连烃基的种类
CH3 OH
脂肪醇
饱和 CH3CH2OH CH3-CH-CH2-CH-CH3 不饱和 CH2=CHCH2OH(4-甲基-2-戊醇)
脂环醇
OH
芳香醇
CH2OH (苯甲醇)
3.饱和一元醇通式:CnH2n+1OH或CnH2n+2O
H H③
5、醇的化学性质
1)与钠的置换反应
2CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
现象 结论
钠与乙醇的反应
钠与水的反应
水上醇下
沉慢且不熔 浮熔游响红
密度:ρ水> ρNa> ρ乙醇
氢原子活泼性:H-OH>C2H5-OH
5、醇的化学性质
1) 与钠的置换反应——羟基氢
2
CH2OH + 2Na →2
OH
不能被氧化
5. CH3CHCH2OH CH3CCHO
【例】某实验小组用下列装置进行乙醇的催化氧化实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应
的化学方程式:
2Cu + O2 △ 2CuO
△
CH3CH2OH + CuO
CH3CHO + Cu + H2O
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进
行,说明该反应是 放热 反应(填放热或吸热)。
【探究】某实验小组用下列装置进行乙醇的催化氧化实验。
(2)甲和乙两个水浴作用不相同。
甲的作用是:加热乙醇,使其挥发与空气中的氧气充分混合;
乙的作用是:冷却,使生成的乙醛冷凝成为液体
。
【探究】某实验小组用下列装置进行乙醇的催化氧化实验。
(3)反应进行一段时间后: 试管a中能收集到不同的物质,它们是 乙醛、乙醇、水 。 集气瓶中收集到的气体的主要成是 氮气(少量氧气等)。
K2Cr2O7 (橙红色)
Cr3+ (绿色)
5、醇的化学性质
6)醇的脱水反应
①分子内脱水(消去反应)脱去羟基与邻碳的氢
CH2—CH2
浓硫酸 170℃
CH2=CH2↑+H2O
H OH
②分子间脱水(取代反应)
浓硫酸
CH3CH2—OH + H—OC2H5 140℃ C2乙H5O醚C2H5 + H2O
甲醚 CH3—O—CH3 甲乙醚 CH3—O—C2H5
④
③
HH
反应 与金属钠反应 Cu或Ag催化氧化 浓硫酸加热到170℃ 浓硫酸条件下与乙酸加热
断键位置 ① ①③ ②④ ①
置换反应(与活泼金属) ABCD
醇 取代反应(酯化、分子间脱水、与HX) ABCD 消去反应(分子内脱水) ABD 氧化反应 催化氧化成醛 AC
催化氧化成酮 B
强氧化剂氧化成酸 AC
燃烧生成CO2和H2O ABCD
请推测下列醇能发生哪类反应?
A. CH3CH2CH2OH C.(CH3)3CCH2OH
B.(CH3)2CHOH D.(CH3)3COH
CH3—CH2OH
浓硫酸 170℃
2CH3CHO + 2H2O
变黑 △
2Cu+O2====2CuO
又变红且 有刺激性 气味气体
→△
CuO+CH3CH2OH CH3CHO+H2O+Cu
5、醇的化学性质
4)醇的催化氧化 去氢机理:失去羟基氢和羟基相连碳上的氢
O—H
O
CH3—C—H +
O2
Cu △
H 【思考】
去氢
CH3—C—H +H2O
该有机物可能是( )
BC
A.丙三醇
B.1,2-丙5、醇的化学性质
2)与酯的取代(酯化)反应 ----酸脱羟基醇脱氢
O
O
C2H5OH + CH3-C-OH 浓H2SO4 CH3-C-O-C2H5 + H2O
5、醇的化学性质
4)醇的催化氧化 2CH3CH2OH + O2 Cu
+ O2(足量)
Cu △
? CH3 C
CH3 C CHO
O OH
1. CH3OH
HCHO
2. CH3CH2CH2OH CH3CH2CHO
3. CH3CHCH3 OH
CH3CCH3 O
4. CH3CH2CHCH3 CH3CH2CCH3
OH
O
OH
O
6.
CH2OH CH2OH
CHO
CHO
CH3 7. CH3CCH3
CH2ONa+ H2↑
→ CH2OH + 2Na
CH2OH
CH2ONa +
CH2ONa
H2↑
CH2OH
CH2ONa
2CHOH + 6Na →2CHONa + 3H2↑
CH2OH
CH2ONa
练一 练
【例1】0.1 mol 某有机物完全燃烧后生成0.3molCO2,
同质量的该有机物与足量的金属钠反应生成0.1molH2,
2)溶解性:碳数越多越难溶!
氢键作用
C1–C3与水任意比互溶; C4-C11部分溶于水;C12以上不溶于水。
3)状态:无气体;C11以下液体; C12以上蜡状固体。
乙醇化学性质:
想一想: 在必修2中,我们都学过乙醇的 哪些化学性质?
⑤ H ④H ② ① H C C OH
思考与交流
1、醇类的物理性质有何规律?
2、相对分子质量相近的醇和烷烃相比,谁的沸点更高, 为什么? 3、为什么甲醇、乙醇、丙醇均可与水以任意比例混溶?
4.醇的物理性质
1)沸点:碳数越多,沸点越高! ➢ Μ相近的醇与烷烃:醇 > 烷烃
醇中羟基形成氢键使沸点升高!
➢ 碳数相同的醇:羟基越多,沸点越高!
(4)若试管a中收集到的液体用紫色石蕊试纸检验,
试纸显红色,说明液体中还含有 乙 酸 。
CH3CH2OH 氧化 CH3CHO 氧化 CH3COOH
乙醇
乙醛
乙酸
5、醇的化学性质
5)被高锰酸钾或重铬酸钾氧化
CH3CH2OH
酸性高锰酸钾 或重铬酸钾
CH3COOH
现象:酸性高锰酸钾溶液褪色
应用:用重铬酸钾检验酒驾
乙醇 俗名:酒精
醇
※下列有机物属于醇类的是( AC )
CH2OH A
OH |
D
CH3
OH
OH B
C O C OH
E
一、醇
1.官能团:——羟基(-OH)
2.醇的分类
1) 根据羟基的数目
一元醇
二元醇
CH3OH
甲醇
CH2-OH CH2OH
乙二醇
工业酒精
有毒!
汽车 防冻剂
三元醇
CH2-OH
CH-OH
CH2OH
练一 练
A 下列醇能发生消去反应生成物有同分异构体的是( )
A. CH3CHCH2CH3 OH
CH2=CHCH2CH3 CH3CH=CHCH3
C. CH3CH2CH2OH
CH2=CHCH3
B. CH3CHCH3 OH
CH2=CHCH3
CH3 D. CH3 C CH2OH
CH3
②①
HH
H—C—C—O—H
丙三醇 俗称甘油 1,2,3-丙三醇
配制 化妆品
2.分类
一、醇
2.醇的分类
2)根据羟基所连烃基的种类
CH3 OH
脂肪醇
饱和 CH3CH2OH CH3-CH-CH2-CH-CH3 不饱和 CH2=CHCH2OH(4-甲基-2-戊醇)
脂环醇
OH
芳香醇
CH2OH (苯甲醇)
3.饱和一元醇通式:CnH2n+1OH或CnH2n+2O
H H③
5、醇的化学性质
1)与钠的置换反应
2CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
现象 结论
钠与乙醇的反应
钠与水的反应
水上醇下
沉慢且不熔 浮熔游响红
密度:ρ水> ρNa> ρ乙醇
氢原子活泼性:H-OH>C2H5-OH
5、醇的化学性质
1) 与钠的置换反应——羟基氢
2
CH2OH + 2Na →2
OH
不能被氧化
5. CH3CHCH2OH CH3CCHO
【例】某实验小组用下列装置进行乙醇的催化氧化实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应
的化学方程式:
2Cu + O2 △ 2CuO
△
CH3CH2OH + CuO
CH3CHO + Cu + H2O
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进
行,说明该反应是 放热 反应(填放热或吸热)。
【探究】某实验小组用下列装置进行乙醇的催化氧化实验。
(2)甲和乙两个水浴作用不相同。
甲的作用是:加热乙醇,使其挥发与空气中的氧气充分混合;
乙的作用是:冷却,使生成的乙醛冷凝成为液体
。
【探究】某实验小组用下列装置进行乙醇的催化氧化实验。
(3)反应进行一段时间后: 试管a中能收集到不同的物质,它们是 乙醛、乙醇、水 。 集气瓶中收集到的气体的主要成是 氮气(少量氧气等)。
K2Cr2O7 (橙红色)
Cr3+ (绿色)
5、醇的化学性质
6)醇的脱水反应
①分子内脱水(消去反应)脱去羟基与邻碳的氢
CH2—CH2
浓硫酸 170℃
CH2=CH2↑+H2O
H OH
②分子间脱水(取代反应)
浓硫酸
CH3CH2—OH + H—OC2H5 140℃ C2乙H5O醚C2H5 + H2O
甲醚 CH3—O—CH3 甲乙醚 CH3—O—C2H5
④
③
HH
反应 与金属钠反应 Cu或Ag催化氧化 浓硫酸加热到170℃ 浓硫酸条件下与乙酸加热
断键位置 ① ①③ ②④ ①
置换反应(与活泼金属) ABCD
醇 取代反应(酯化、分子间脱水、与HX) ABCD 消去反应(分子内脱水) ABD 氧化反应 催化氧化成醛 AC
催化氧化成酮 B
强氧化剂氧化成酸 AC
燃烧生成CO2和H2O ABCD
请推测下列醇能发生哪类反应?
A. CH3CH2CH2OH C.(CH3)3CCH2OH
B.(CH3)2CHOH D.(CH3)3COH
CH3—CH2OH
浓硫酸 170℃
2CH3CHO + 2H2O
变黑 △
2Cu+O2====2CuO
又变红且 有刺激性 气味气体
→△
CuO+CH3CH2OH CH3CHO+H2O+Cu
5、醇的化学性质
4)醇的催化氧化 去氢机理:失去羟基氢和羟基相连碳上的氢
O—H
O
CH3—C—H +
O2
Cu △
H 【思考】
去氢
CH3—C—H +H2O
该有机物可能是( )
BC
A.丙三醇
B.1,2-丙5、醇的化学性质
2)与酯的取代(酯化)反应 ----酸脱羟基醇脱氢
O
O
C2H5OH + CH3-C-OH 浓H2SO4 CH3-C-O-C2H5 + H2O
5、醇的化学性质
4)醇的催化氧化 2CH3CH2OH + O2 Cu
+ O2(足量)
Cu △
? CH3 C
CH3 C CHO
O OH
1. CH3OH
HCHO
2. CH3CH2CH2OH CH3CH2CHO
3. CH3CHCH3 OH
CH3CCH3 O
4. CH3CH2CHCH3 CH3CH2CCH3
OH
O
OH
O
6.
CH2OH CH2OH
CHO
CHO
CH3 7. CH3CCH3
CH2ONa+ H2↑
→ CH2OH + 2Na
CH2OH
CH2ONa +
CH2ONa
H2↑
CH2OH
CH2ONa
2CHOH + 6Na →2CHONa + 3H2↑
CH2OH
CH2ONa
练一 练
【例1】0.1 mol 某有机物完全燃烧后生成0.3molCO2,
同质量的该有机物与足量的金属钠反应生成0.1molH2,
