材料科学基础作业解答
材料科学基础习题及参考答案复习过程

材料科学基础习题及参考答案材料科学基础参考答案材料科学基础第一次作业1.举例说明各种结合键的特点。
⑴金属键:电子共有化,无饱和性,无方向性,趋于形成低能量的密堆结构,金属受力变形时不会破坏金属键,良好的延展性,一般具有良好的导电和导热性。
⑵离子键:大多数盐类、碱类和金属氧化物主要以离子键的方式结合,以离子为结合单元,无方向性,无饱和性,正负离子静电引力强,熔点和硬度均较高。
常温时良好的绝缘性,高温熔融状态时,呈现离子导电性。
⑶共价键:有方向性和饱和性,原子共用电子对,配位数比较小,结合牢固,具有结构稳定、熔点高、质硬脆等特点,导电能力差。
⑷范德瓦耳斯力:无方向性,无饱和性,包括静电力、诱导力和色散力。
结合较弱。
⑸氢键:极性分子键,存在于HF,H2O,NF3有方向性和饱和性,键能介于化学键和范德瓦尔斯力之间。
2.在立方晶体系的晶胞图中画出以下晶面和晶向:(1 0 2)、(1 1 -2)、(-2 1 -3),[1 1 0],[1 1 -1],[1 -2 0]和[-3 2 1]。
(213)(112)(102) [111][110][120][321]3. 写出六方晶系的{1 1 -20},{1 0 -1 2}晶面族和<2 -1 -1 0>,<-1 0 1 1>晶向族中各等价晶面及等价晶向的具体指数。
{1120}的等价晶面:(1120)(2110)(1210)(1120)(2110)(1210){1012}的等价晶面:(1012)(1102)(0112)(1012)(1102)(0112)(1012)(1102)(0112)(1012)(1102)(0112)2110<>的等价晶向:[2110][1210][1120][2110][1210][1120]1011<>的等价晶向:[1011][1101][0111][0111][1101][1011][1011][1101][0111][0111][1101][1011]4立方点阵的某一晶面(hkl )的面间距为M /,其中M 为一正整数,为晶格常数。
材料科学基础章作业参考答案.
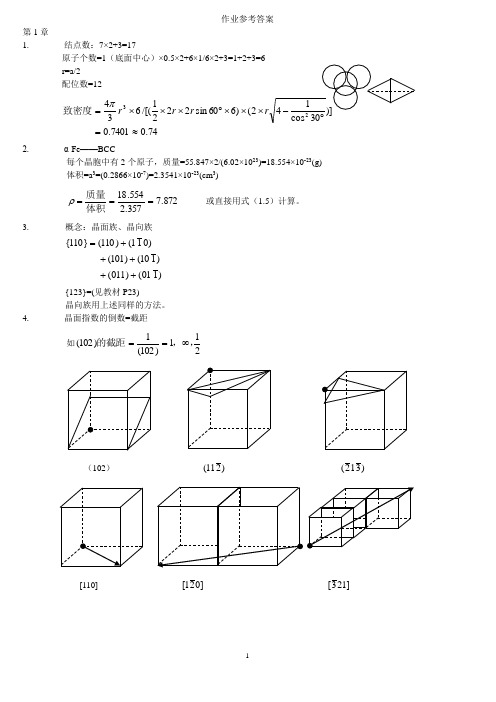
作业参考答案第1章1. 结点数:7×2+3=17原子个数=1(底面中心)×0.5×2+6×1/6×2+3=1+2+3=6r=a/2配位数=1274.07401.02()660sin2221/[(6343≈=⨯⨯⨯︒⨯⨯⨯=rrrπ致密度2. α-Fe——BCC每个晶胞中有2个原子,质量=55.847×2/(6.02×1023)=18.554×10-23(g)体积=a3=(0.2866×10-7)=2.3541×10-23(cm3)872.7357.2554.18===体积质量ρ或直接用式(1.5)计算。
3.概念:晶面族、晶向族)101()011()110()101()011()110(}110{+++++={123}=(见教材P23)晶向族用上述同样的方法。
4. 晶面指数的倒数=截距如211)102(1)102(,,的截距∞==(102))211()312( [110] ]021[]213[5.晶向指数:]101[和]011[6.7.8. 9. (略,不要求) 10.设晶格常数为a22100a =)面密度(785.048210022==⨯=ππr r )面致密度( 222110a=)面密度(555.02428211022==⨯=ππrr )面致密度(2234321111a r ==)面密度(906.03232111122==⨯=ππr r )面致密度( 11. (略,不要求)12. (略,不要求) 13. 6/2+12/4=614.立方晶系晶面间距计算公式:)011()110()112(]011[]2[]111[222lk h na d ++=① )nm (143.0286.02100121222100=⨯=++=ad)nm (202.0286.021011222110=⨯=++=a d)nm (0764.0286.0141321222123=⨯=++=a d②)nm (1825.0365.02100121222100=⨯=++=ad)nm (2107.0365.031111222111=⨯=++=a d)nm (09125.0365.042121121222112=⨯=++=ad③(略,不要求)15. (略,不要求) 16. (略,不要求)一、 单项选择题。
(完整版)材料科学基础第1-2章作业及解答彭

第一章作业——材料结构的基本知识1、简述一次键与二次键的差异及各键的特点。
2、简述三大类材料中的结合键类型及性能(物性、力性)特点。
3、为什么金属材料的密度比陶瓷材料及高分子材料密度高?4、用金属键的特征解释金属材料的性能-----①良好的导电;②良好的导热性;③正的电阻温度系数;④不透明性及具有金属光泽;⑤良好的塑性⑥金属之间的溶解性(固溶能力)。
5、简述晶体与非晶体的主要区别。
6、简述原子结构、原子结合键、原子的排列方式及显微组织对材料性能的影响。
第一章作业解答1、述一次键与二次键的差异及各键的特点。
解答:(1)一次键结合力较强,包括金属键、离子键、共价键;二次键结合力较弱,包括范德华键和氢键。
一次键主要依靠外壳层电子转移或共享以形成稳定的电子壳层;二次键是借原子之间的偶极吸引力结合而成。
(2)金属键电子共有化,没有方向性和饱和性;离子键没有方向性,但要满足正负电荷平衡要求;共价键有明显的方向性和饱和性;范德华键没有方向性、饱和性;氢键(X-H…Y)有饱和性、方向性。
2、简述三大类材料中的结合键类型及性能(物性、力性)特点。
解答:(1)三大类材料主要指金属材料、陶瓷材料和高分子材料。
(2)金属材料中的结合键主要是金属键,其次是共价键、离子键,使金属材料具有较高的熔点、密度,良好的导电、导热性能及较高的弹性模量、强度和塑性。
陶瓷材料中的结合键主要是离子键和共价键,使其熔点高、密度低,具有良好的绝缘性能和绝热性能,高的弹性模量和强度,但塑性差,脆性大。
高分子材料中分子链内部虽为共价键结合,但分子链之间为二次键结合,使其具有较低的熔点、密度,良好的绝缘性能、绝热性能及较低的弹性模量、强度和塑性。
3、为什么金属材料的密度比陶瓷材料及高分子材料密度高?金属材料的密度较高是因为①金属元素具有较高的相对原子质量,②金属材料主要以金属键结合,金属键没有方向性和饱和性,使金属原子总是趋于密集排列,达到密堆结构。
材料科学基础第1-2章例题、作业题及其解答

第2章 例 题(A )1. 在面心立方晶胞中画出[012]和[123]晶向。
2. 在面心立方晶胞中画出(012)和(123)晶面。
3. 右图中所画晶面的晶面指数是多少?4. 设晶面(152)和(034)属六方晶系的正交坐标表述,试给出其四轴坐标的表示。
反之,求(3121)及(2112)的正交坐标的表示。
5. (练习),上题中均改为相应晶向指数,求相互转换后结果。
答案:2. (2110) 4. (1562), (0334) 5. [1322] [1214] (123) (212)[033] [302]第2章 例题答案(A)4. (152) )2615(6)51()(⇒-=+-=+-=v u t(034) )4303(3)30()(⇒-=+-=+-=v u t(1213) ⇒ (123)(2112) ⇒ (212)5. [152] ]2231[22)51(31)(313)152(31)2(311)512(31)2(31⇒⎪⎪⎪⎭⎪⎪⎪⎬⎫==-=+-=+-==-⨯=-=-=-⨯=-=W w V U t U V v V U u [034] ]4121[41)30(31)(312)032(31)2(311)302(31)2(31⇒⎪⎪⎪⎭⎪⎪⎪⎬⎫==-=+-=+-==-⨯=-=-=-⨯=-=W w V U t U V v V U u]3121[]033[33)1(20)1(1⇒⎪⎭⎪⎬⎫===--=-==---=-=w W t v V t u U [2112]]302[20)1(13)1(2⇒⎪⎭⎪⎬⎫===---=-==--=-=w W t v V t u U第2章 例 题(B )1. 已知Cu 的原子直径为2.56A ,求Cu 的晶格常数,并计算1mm 3Cu 的原子数。
2. 已知Al 相对原子质量Ar (Al )=26.97,原子半径γ=0.143nm ,求Al 晶体的密度。
3. bcc 铁的单位晶胞体积,在912℃时是0.02464nm 3;fcc 铁在相同温度时其单位晶胞体积是0.0486nm 3。
材料科学基础习题与答案

第一章 原子排列与晶体结构1. fcc 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,把原子视为刚性球时,原子的半径r 与点阵常数a 的关系是 ;bcc 结构的密排方向是 ,密排面是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 ;hcp 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 。
2. Al 的点阵常数为0.4049nm ,其结构原子体积是 ,每个晶胞中八面体间隙数为 ,四面体间隙数为 。
3. 纯铁冷却时在912ε 发生同素异晶转变是从 结构转变为 结构,配位数 ,致密度降低 ,晶体体积 ,原子半径发生 。
4. 在面心立方晶胞中画出)(211晶面和]211[晶向,指出﹤110﹥中位于(111)平面上的方向。
在hcp 晶胞的(0001)面上标出)(0121晶面和]0121[晶向。
5. 求]111[和]120[两晶向所决定的晶面。
6 在铅的(100)平面上,1mm 2有多少原子?已知铅为fcc 面心立方结构,其原子半径R=0.175×10-6mm 。
第二章 合金相结构一、 填空1) 随着溶质浓度的增大,单相固溶体合金的强度 ,塑性 ,导电性 ,形成间隙固溶体时,固溶体的点阵常数 。
2) 影响置换固溶体溶解度大小的主要因素是(1) ;(2) ;(3) ;(4) 和环境因素。
3) 置换式固溶体的不均匀性主要表现为 和 。
4) 按照溶质原子进入溶剂点阵的位置区分,固溶体可分为 和 。
5) 无序固溶体转变为有序固溶体时,合金性能变化的一般规律是强度和硬度 ,塑性 ,导电性 。
6)间隙固溶体是 ,间隙化合物是 。
二、 问答1、 分析氢,氮,碳,硼在α-Fe 和γ-Fe 中形成固溶体的类型,进入点阵中的位置和固溶度大小。
已知元素的原子半径如下:氢:0.046nm ,氮:0.071nm ,碳:0.077nm ,硼:0.091nm ,α-Fe :0.124nm ,γ-Fe :0.126nm 。
《材料科学基础》作业-答案全

绪论一、填空题1、材料科学主要研究的核心问题是结构和性能的关系。
材料的结构是理解和控制性能的中心环节,结构的最微细水平是原子结构,第二个水平是原子排列方式,第三个水平是显微组织。
2. 根据材料的性能特点和用途,材料分为结构材料和功能材料两大类。
根据原子之间的键合特点,材料分为金属、陶瓷、高分子和复合材料四大类。
第一章材料的原子结构一、填空题1. 金属材料中原子结合以金属键为主,陶瓷材料(无机非金属材料)以共价键和离子键结合键为主,聚合物材料以共价键和氢键以及范德华键为主。
第二章材料的结构一、填空题1、晶体是基元(原子团)以周期性重复方式在三维空间作有规则的排列的固体。
2、晶体与非晶体的最根本区别是晶体原子排布长程有序,而非晶体是长程无序短程有序。
3、晶胞是晶体结构中的最小单位。
4、根据晶体的对称性,晶系有三大晶族,七大晶系,十四种布拉菲Bravais点阵,三十二种点群,230种空间群。
5、金属常见的晶格类型有体心立方、面心立方、密排六方。
6、fcc晶体的最密排方向为<110>,最密排面为{111},最密排面的堆垛顺序为ABCABCABCABC……。
7、fcc晶体的致密度为0.74,配位数为12,原子在(111)面上的原子配位数为6。
8、bcc晶体的最密排方向为<111>,最密排面为{110},致密度为0.68,配位数为8。
9、晶体的宏观对称要素有对称点、对称轴、对称面。
10、CsCl型结构属于简单立方格子,NaCl型结构属于面心立方格子,CaF2型结构属于面心立方格子。
11、MgO晶体具有NaCl型结构,其对称型是3 L44L36L29PC,晶族是高级晶族,晶系是立方晶系,晶体的键型是离子键。
12、硅酸盐晶体结构中的基本结构单元是硅氧四面体[SiO4]。
?13、几种硅酸盐晶体的络阴离子分别为[Si2O7]6-、[Si2O6]4-、[Si4O10]4-、[AlSi3O8]1-,它们的晶体结构类型分别为组群状,链状,层状,和架状。
材料科学基础习题与参考答案(doc 14页)(优质版)

第一章材料的结构一、解释以下基本概念空间点阵、晶格、晶胞、配位数、致密度、共价键、离子键、金属键、组元、合金、相、固溶体、中间相、间隙固溶体、置换固溶体、固溶强化、第二相强化。
二、填空题1、材料的键合方式有四类,分别是(),(),(),()。
2、金属原子的特点是最外层电子数(),且与原子核引力(),因此这些电子极容易脱离原子核的束缚而变成()。
3、我们把原子在物质内部呈()排列的固体物质称为晶体,晶体物质具有以下三个特点,分别是(),(),()。
4、三种常见的金属晶格分别为(),()和()。
5、体心立方晶格中,晶胞原子数为(),原子半径与晶格常数的关系为(),配位数是(),致密度是(),密排晶向为(),密排晶面为(),晶胞中八面体间隙个数为(),四面体间隙个数为(),具有体心立方晶格的常见金属有()。
6、面心立方晶格中,晶胞原子数为(),原子半径与晶格常数的关系为(),配位数是(),致密度是(),密排晶向为(),密排晶面为(),晶胞中八面体间隙个数为(),四面体间隙个数为(),具有面心立方晶格的常见金属有()。
7、密排六方晶格中,晶胞原子数为(),原子半径与晶格常数的关系为(),配位数是(),致密度是(),密排晶向为(),密排晶面为(),具有密排六方晶格的常见金属有()。
8、合金的相结构分为两大类,分别是()和()。
9、固溶体按照溶质原子在晶格中所占的位置分为()和(),按照固溶度分为()和(),按照溶质原子与溶剂原子相对分布分为()和()。
10、影响固溶体结构形式和溶解度的因素主要有()、()、()、()。
11、金属化合物(中间相)分为以下四类,分别是(),(),(),()。
12、金属化合物(中间相)的性能特点是:熔点()、硬度()、脆性(),因此在合金中不作为()相,而是少量存在起到第二相()作用。
13、CuZn、Cu5Zn8、Cu3Sn的电子浓度分别为(),(),()。
14、如果用M表示金属,用X表示非金属,间隙相的分子式可以写成如下四种形式,分别是(),(),(),()。
材料科学基础作业解答

材料科学基础作业解答第⼀章1.简述⼀次键与⼆次键各包括哪些结合键?这些结合键各⾃特点如何?答:⼀次键——结合⼒较强,包括离⼦键、共价键和⾦属键。
⼆次键——结合⼒较弱,包括范德⽡⽿斯键和氢键。
①离⼦键:由于正、负离⼦间的库仑(静电)引⼒⽽形成。
特点:1)正负离⼦相间排列,正负电荷数相等;2)键能最⾼,结合⼒很⼤;②共价键:是由于相邻原⼦共⽤其外部价电⼦,形成稳定的电⼦满壳层结构⽽形成。
特点:结合⼒很⼤,硬度⾼、强度⼤、熔点⾼,延展性和导电性都很差,具有很好的绝缘性能。
③⾦属键:贡献出价电⼦的原⼦成为正离⼦,与公有化的⾃由电⼦间产⽣静电作⽤⽽结合的⽅式。
特点:它没有饱和性和⽅向性;具有良好的塑性;良好的导电性、导热性、正的电阻温度系数。
④范德⽡⽿斯键:⼀个分⼦的正电荷部位和另⼀个分⼦的负电荷部位间的微弱静电吸引⼒将两个分⼦结合在⼀起的⽅式。
也称为分⼦键。
特点:键合较弱,易断裂,可在很⼤程度上改变材料的性能;低熔点、⾼塑性。
2.⽐较⾦属材料、陶瓷材料、⾼分⼦材料在结合键上的差别。
答:①⾦属材料:简单⾦属(指元素周期表上主族元素)的结合键完全为⾦属键,过渡族⾦属的结合键为⾦属键和共价键的混合,但以⾦属键为主。
②陶瓷材料:陶瓷材料是⼀种或多种⾦属同⼀种⾮⾦属(通常为氧)相结合的化合物,其主要结合⽅式为离⼦键,也有⼀定成分的共价键。
③⾼分⼦材料:⾼分⼦材料中,⼤分⼦内的原⼦之间结合⽅式为共价键,⽽⼤分⼦与⼤分⼦之间的结合⽅式为分⼦键和氢键。
④复合材料:复合材料是由⼆种或者⼆种以上的材料组合⽽成的物质,因⽽其结合键⾮常复杂,不能⼀概⽽论。
3. 晶体与⾮晶体的区别?稳态与亚稳态结构的区别?晶体与⾮晶体区别:答:性质上,(1)晶体有整齐规则的⼏何外形;(2)晶体有固定的熔点,在熔化过程中,温度始终保持不变;(3)晶体有各向异性的特点。
结构上,晶体原⼦排列有序,⾮晶体排列长程⽆序。
稳态与亚稳态结构的区别同种材料在不同条件下可以得到不同的结构,其中能量最低的结构称为稳态结构。
材料科学基础课后作业及答案(分章节)

第一章8.计算下列晶体的离于键与共价键的相对比例 (1)NaF (2)CaO (3)ZnS解:1、查表得:X Na =0.93,X F =3.98根据鲍林公式可得NaF 中离子键比例为:21(0.93 3.98)4[1]100%90.2%e ---⨯=共价键比例为:1-90.2%=9.8% 2、同理,CaO 中离子键比例为:21(1.00 3.44)4[1]100%77.4%e---⨯=共价键比例为:1-77.4%=22.6%3、ZnS 中离子键比例为:21/4(2.581.65)[1]100%19.44%ZnS e --=-⨯=中离子键含量共价键比例为:1-19.44%=80.56%10说明结构转变的热力学条件与动力学条件的意义.说明稳态结构与亚稳态结构之间的关系。
答:结构转变的热力学条件决定转变是否可行,是结构转变的推动力,是转变的必要条件;动力学条件决定转变速度的大小,反映转变过程中阻力的大小。
稳态结构与亚稳态结构之间的关系:两种状态都是物质存在的状态,材料得到的结构是稳态或亚稳态,取决于转交过程的推动力和阻力(即热力学条件和动力学条件),阻力小时得到稳态结构,阻力很大时则得到亚稳态结构。
稳态结构能量最低,热力学上最稳定,亚稳态结构能量高,热力学上不稳定,但向稳定结构转变速度慢,能保持相对稳定甚至长期存在。
但在一定条件下,亚稳态结构向稳态结构转变。
第二章1.回答下列问题:(1)在立方晶系的晶胞内画出具有下列密勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与 [111],(132)与[123],(322)与[236](2)在立方晶系的一个晶胞中画出(111)和 (112)晶面,并写出两晶面交线的晶向指数。
(3)在立方晶系的一个晶胞中画出同时位于(101). (011)和(112)晶面上的[111]晶向。
解:1、2.有一正交点阵的 a=b, c=a/2。
某晶面在三个晶轴上的截距分别为 6个、2个和4个原子间距,求该晶面的密勒指数。
材料科学基础作业解答

不能。结构相同,原子半径相差很小,是无限互溶的必要非充分条件 Ag的价电子数为1,Al为3,受极限电子浓度影响,理论溶解度仅18%, 所以在固态下它们不能无限互溶。
a 7. 立方ZnS的密度为4.1Mg/m3,试计算两离子的中心距离 ZnS: 结构 晶胞原子数:4Zn+4S 摩尔质量: m0 = 97.39 设:晶胞体积为V0 Zn+2 S-2
3.计算f.c.c <110>线密度,{111}面密度。 |a[110]| |a[110]|
<111>
<110>
<100>
晶体结构
原子线密度
晶向
{111}
{110}
{100}
晶体结构
原子面密度
晶面
4.在 面上绘出 晶向
z
x1
x3
x2
六方晶系中绘制晶向时,应先将四指数转化成三指数,按三指数绘制
可变,位于相图两端
成分
化合物
固溶体
作业3:
3、求电子浓度。
Cu3Al:
NiAl:
1.5
Fe5Zn21:
1.61
Cu3Sn:
1.75
MgZn2:
2
复杂立方
六方结构
电子化合物
Laves相
银和铝都具有面心立方结构,它们的原子半径分别为rAg=0.1441nm,rAl=0.1428nm,问它们在固态下能否无限互溶?
o
z
y
x
[100]
[111]
[110]
[001]
[010]
z
x1
x2
x3
[0001]
<100>晶轴 <110>面对角线 <111>体对角线
材料科学基础 张晓燕1-5章作业及题解.

第一章 作业题解1. 原子中一个电子的空间位置和能量可用哪四个量子数来决定?2. 在多电子的原子中,核外电子的排布应遵循哪些个原则?3. 在元素周期表中,同一周期或同一主族元素原子结构有什么共同特点?从左到右或从上到下元素结构有什么区别?性质如何递变?解、同一周期元素具有相同原子核外电子层数,但从左到右,核电荷依次增多,原子半径逐渐减小,电离能增加,失去电子的能力降低,得到电子能力增加,金属性减弱,非金属性增强,同一主族元素最外层电子数相同,但从上→下,电子层数最多,原子半径增大,电离能降低,失去电子能力增加,得到电子能力降低,金属性增加,非金属性降低。
4. 铬的原子序数为24,共有四种同位数:4.31%的Cr 原子含有26个中子,83.76%含有28个中子,9.55%含有29个中子,且2.38%含有30个中子。
试求铬的原子量。
解、=Ar 0.0431X (24+26)+0.8376X (24+28)+0.0955X (24+29)+0.0238X(24+30)=52.0575. 原子间的结合键共有几种?各自特点如何? 解、6. 按分子材料受热的表现分类可分为热塑性和热固性两大类,试从高分子链结构角度加以解释之。
解、热塑性;具有线性和枝化高分子链结构,加热后变软,可反复加工再成形;热固性;具有体型(立体网状)高分子链结构,不溶于任何溶剂,也不能熔融,一旦定型后不能再改变形状,无法再生。
第二章 作业题解1、归纳总结三种典型的晶体结构的晶体学特征。
解、2、试证明理想密排六方结构的轴比c/a=1.633。
解、见图所示,等边三角形的高 a h ⋅=43 氢键;分子间作用力,氢桥,具有饱和性结合键化学键;主价键 物理键;次价键,也称范德华健 金属键;电子共有化,无饱和性,无方向性。
离子键;以离子而不是以原子为结合单元,无饱和性,无方向性。
共价键;共用电子对,有饱和性方向性。
hd2c343222222a c h c d +=⎪⎭⎫⎝⎛+⎪⎭⎫ ⎝⎛= 理想密排六方晶体结构中a d = 故633.138==a c 3、Ni 的晶体结构为面心立方结构,其原子半径为r=0.1243nm ,试求Ni 的晶格常数和密度。
材料科学基础课后习题答案

材料科学基础课后习题答案材料科学基础课后习题答案第一章:晶体结构和晶体缺陷1. 什么是晶体?晶体的特点是什么?答:晶体是由有序排列的原子、离子或分子组成的固态材料。
晶体的特点包括有规则的、重复的、周期性的结构,具有明确的晶体面和晶面间角度。
2. 简述晶体中离子束缚以及普通共价键束缚的区别?答:晶体中离子束缚是指由电荷相反的离子通过电磁力相互吸引而形成的结合力,例如NaCl晶体。
普通共价键束缚是由共享电子对形成的,例如金刚石晶体。
离子束缚通常较为强烈,晶体具有高熔点和脆性;而共价键束缚相对较弱,晶体具有低熔点和韧性。
3. 什么是晶体缺陷?列举几种晶体缺陷并简要描述其影响。
答:晶体缺陷是指晶体中排列异常的原子、离子或分子。
常见的晶体缺陷包括点缺陷、线缺陷和面缺陷。
点缺陷指的是晶体中原子位置的缺失或替代,如空位、间隙原子和杂质原子;线缺陷是晶体中晶面上原子位置的错误,如位错和螺旋位错;面缺陷是指晶面之间的错配,如晶界和孪生界。
这些晶体缺陷会影响晶体的物理性质和力学性能。
4. 什么是晶体结构中的定义因素?它们的作用是什么?答:晶体结构中的定义因素包括晶胞和晶格参数。
晶胞是最小重复单元,由一定数量的晶体中的原子、离子或分子组成。
晶格参数描述晶胞的大小和形状。
晶胞和晶格参数共同定义了晶体的结构。
晶胞和晶格参数的作用是确定晶体的晶体面、晶面间角度以及晶体的物理性质。
5. 什么是晶格点?晶格点的种类有哪些?答:晶格点是位于晶体内部的原子、离子或分子的位置。
晶格点的种类包括普通晶格点、间隙晶格点和特殊晶格点。
普通晶格点是晶体中原子、离子或分子的晶格点,如AB型晶体中的A和B原子;间隙晶格点是晶体中没有原子、离子或分子的晶格点,如金刚石中的间隙晶格点;特殊晶格点是具有非普通晶格点性质的晶体中的晶格点,如晶体中的空位或杂质原子。
第二章:物质的结构与性能关系1. 简述晶体结构对物质性能的影响。
答:晶体结构直接影响物质的物理性质和化学性质。
材料科学基础1-8章例题、作业题及其解答

第2章 例 题(A )1. 在面心立方晶胞中画出[012]和[123]晶向。
2. 在面心立方晶胞中画出(012)和(123)晶面。
3. 右图中所画晶面的晶面指数是多少?4. 设晶面(152)和(034)属六方晶系的正交坐标表述,试给出其四轴坐标的表示。
反之,求(3121)及(2112)的正交坐标的表示。
5. (练习),上题中均改为相应晶向指数,求相互转换后结果。
答案:2. (2110) 4. (1562), (0334) 5. [1322] [1214] (123) (212)[033] [302]第2章 例题答案(A)4. (152))2615(6)51()(⇒-=+-=+-=v u t (034))4303(3)30()(⇒-=+-=+-=v u t (1213)⇒ (123) (2112) ⇒ (212)5. [152]]2231[22)51(31)(313)152(31)2(311)512(31)2(31⇒⎪⎪⎪⎭⎪⎪⎪⎬⎫==-=+-=+-==-⨯=-=-=-⨯=-=W w V U t U V v V U u [034]]4121[41)30(31)(312)032(31)2(311)302(31)2(31⇒⎪⎪⎪⎭⎪⎪⎪⎬⎫==-=+-=+-==-⨯=-=-=-⨯=-=W w V U t U V v V U u]3121[]033[33)1(20)1(1⇒⎪⎭⎪⎬⎫===--=-==---=-=w W t v V t u U[2112]]302[20)1(13)1(2⇒⎪⎭⎪⎬⎫===---=-==--=-=w W t v V t u U第2章 例 题(B )1. 已知Cu 的原子直径为2.56A ,求Cu 的晶格常数,并计算1mm 3Cu 的原子数。
2. 已知Al 相对原子质量Ar (Al )=26.97,原子半径γ=0.143nm ,求Al 晶体的密度。
3. bcc 铁的单位晶胞体积,在912℃时是0.02464nm 3;fcc 铁在相同温度时其单位晶胞体积是0.0486nm 3。
《材料科学基础》习题及参考答案

形核功,还是可以成核的。
答案
(7)测定某纯金属铸件结晶时的最大过冷度,其实测
值与用公式ΔT=0.2Tm计算值基本一致。
答案
(8) 某些铸件结晶时,由于冷却较快,均匀形核率N1
提高,非均匀形核率N2也提高,故总的形核率为N=
N1 +N2。
答案
返回
53
(9) 若在过冷液体中,外加10 000颗形核剂,则结晶
❖ ②比较Cu-10% Sn合金铸件和Cu-30%合金铸件的铸造性能 及铸造组织,说明Cu-10% Sn合金铸件中有许多分散砂眼的 原因。
③ω(Sn}分别为2%,11%和15%的青铜合金,哪一种可进行 压力加工?哪种可利用铸造法来制造机件?
答案
返7回8
❖ 9.如下图所示,已知A,B,C三组元固态完全不互溶,质量 分数分别84%A,,10%B,10%C的O合金在冷却过程中将进 行二元共晶反应和三元共晶反应,在二元共晶反应开始时, 该合金液相成分(a点)为60%A,20%B,20%C,而三元共 晶反应开始时的液相成分(E点)为50%A,10%B,40%C。
答案
返回
6
❖ 6.位错受力后运动方向处处垂直于位错线,在运动
过程中是可变的,晶体作相对滑动的方向应是什么
方向?
答案
❖ 7.位错线上的割阶一般如何形成?
答案
❖ 8.界面能最低的界面是什么界面?
答案
❖ 9. “小角度晶界都是由刃型位错排成墙而构成的”这
种说法对吗?
答案
返回
7
三、综合题
❖ 1. 作图表示立方晶体的(123)(0 -1 -2) (421)晶面及[-102][-211][346]晶向。 答案
❖ 9. 在Fe中形成1mol 空位的能量为104. 67kJ,
材料科学基础作业参考答案

《材料科学基础》作业参考答案第二章1.回答以下问题:(1)在立方晶系的晶胞内画出具有以下密勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(132)与[123],(322)和[236]。
(2)在立方晶系的一个晶胞中画出(111)和(112)晶面,并写出两晶面交线的晶向指数。
解答:(1)(2)第一求(111)和(112)的交线。
由式(2-7),即得u=k1l2-k2l1=1x2-1x1=1v=l1h2-l2h1=1x1-2x1=-1w=h1k2-h2k1=1x1-1x1=0因此,(111)和(112)两晶面交线的晶向指数为[110]或[110]。
如以下图所示。
3 立方晶系的{111}、{110}、{123}晶面族各包括多少晶面?写出它们的密勒指数。
解答:++++++++=)213()231()321()132()312()321()231()123(}123{+++++++)312()132()213()123()132()312()231()132()123()213()321()231()213()123()312()321(++++++++注意:书中有重复的。
如(111)与(111)应为同一晶面,只是位于坐标原点的位置不同。
6.(略)7.(题略) (1)(2)用公式 求。
(3) 用公式 求。
dd(显然,d(100)最大。
222hkl a d h k l =++显然,d(100)最大。
(3) d(1120)= nmd(10178nmd(1010nm显然,d(1010)最大。
由(1)、(2)、(3)得低指数的面间距较大,而高指数的晶面间距那么较小8.回答以下问题:(1)通过计算判定(110)、(132)、(311)晶面是不是属于同一晶带?(2)求(211)和(110)晶面的晶带轴,并列出五个属于该晶带的晶面的密勒指数。
解答提示:(1)第一求任两面的交线,即求晶面(h1 k1 l1)和(h2 k2 l2)的求晶带轴[uvw]u = k1 l2 - k2 l1、v = l1 h2-l2h1、w=h1 k2- h2 k1再判定该晶带轴是不是与另一面垂直,即是不是知足uh+vk+wl=0。
材料科学基础作业详细答案

材料科学基础练习题参考答案第一章原子排列1. 作图表示立方晶系中的(123),(012),(421)晶面和[102],[211],[346]晶向.附图1-1 有关晶面及晶向2. 分别计算面心立方结构与体心立方结构的{100},{110}和{111}晶面族的面间距, 并指出面间距最大的晶面(设两种结构的点阵常数均为a).解由面心立方和体心立方结构中晶面间的几何关系, 可求得不同晶面族中的面间距如附表1-1所示.附表1-1 立方晶系中的晶面间距晶面{100} {110} {111}面间距FCC2a24a33aBCC2a22a36a显然, FCC中{111}晶面的面间距最大, 而BCC中{110}晶面的面间距最大.注意:对于晶面间距的计算, 不能简单地使用公式, 应考虑组成复合点阵时, 晶面层数会增加.3. 分别计算fcc和bcc中的{100},{110}和{111}晶面族的原子面密度和<100>,<110>和<111>晶向族的原子线密度, 并指出两种结构的差别. (设两种结构的点阵常数均为a) 解原子的面密度是指单位晶面内的原子数; 原子的线密度是指晶面上单位长度所包含的原子数. 据此可求得原子的面密度和线密度如附表1-2所示.附表1-2 立方晶系中原子的面密度和线密度晶面/晶向{100} {110} {111} <100> <110> <111>面/线密度BCC21a22a233a1a22a233aFCC22a22a2433a1a2a33a可见, 在BCC中, 原子密度最大的晶面为{110}, 原子密度最大的晶向为<111>; 在FCC 中, 原子密度最大的晶面为{111}, 原子密度最大的晶向为<110>.4. 在(0110)晶面上绘出[2113]晶向.解详见附图1-2.附图1-2 六方晶系中的晶向5. 在一个简单立方二维晶体中, 画出一个正刃型位错和一个负刃型位错. 试求:(1) 用柏氏回路求出正、负刃型位错的柏氏矢量.(2) 若将正、负刃型位错反向时, 说明其柏氏矢量是否也随之反向.(3) 具体写出该柏氏矢量的方向和大小.(4) 求出此两位错的柏氏矢量和.解正负刃型位错示意图见附图1-3(a)和附图1-4(a).(1) 正负刃型位错的柏氏矢量见附图1-3(b)和附图1-4(b).(2) 显然, 若正、负刃型位错线反向, 则其柏氏矢量也随之反向.(3) 假设二维平面位于YOZ坐标面, 水平方向为Y轴, 则图示正、负刃型位错方向分别为[010]和[010], 大小均为一个原子间距(即点阵常数a).(4) 上述两位错的柏氏矢量大小相等, 方向相反, 故其矢量和等于0.6. 设图1-72所示立方晶体的滑移面ABCD平行于晶体的上下底面, 该滑移面上有一正方形位错环. 如果位错环的各段分别与滑移面各边平行, 其柏氏矢量b // AB, 试解答:(1) 有人认为“此位错环运动离开晶体后, 滑移面上产生的滑移台阶应为4个b”, 这种说法是否正确? 为什么?(2) 指出位错环上各段位错线的类型, 并画出位错移出晶体后, 晶体的外形、滑移方向和滑移量. (设位错环线的方向为顺时针方向)图1-72 滑移面上的正方形位错环 附图1-5 位错环移出晶体引起的滑移 解 (1) 这种看法不正确. 在位错环运动移出晶体后, 滑移面上下两部分晶体相对移动的距离是由其柏氏矢量决定的. 位错环的柏氏矢量为b , 故其相对滑移了一个b 的距离.(2) A ′B ′为右螺型位错, C ′D ′为左螺型位错, B ′C ′为正刃型位错, D ′A ′为负刃型位错. 位错运动移出晶体后滑移方向及滑移量见附图1-5.7. 设面心立方晶体中的(111)晶面为滑移面, 位错滑移后的滑移矢量为[110]2a .(1) 在晶胞中画出此柏氏矢量b 的方向并计算出其大小.(2) 在晶胞中画出引起该滑移的刃型位错和螺型位错的位错线方向, 并写出此二位错线的晶向指数.解 (1) 柏氏矢量等于滑移矢量, 因此柏氏矢量的方向为[110], 大小为2/2a .(2) 刃型位错与柏氏矢量垂直, 螺型位错与柏氏矢量平行, 晶向指数分别为[112]和[110], 详见附图1-6.附图1-6 位错线与其柏氏矢量、滑移矢量8. 若面心立方晶体中有[101]2a b =的单位位错及[121]6a b =的不全位错, 此二位错相遇后产生位错反应.(1) 此反应能否进行? 为什么?(2) 写出合成位错的柏氏矢量, 并说明合成位错的性质.解 (1) 能够进行.因为既满足几何条件:[111]3a b b ==∑∑后前,又满足能量条件: . 22222133b a b a =>=∑∑后前. (2) [111]3a b =合, 该位错为弗兰克不全位错. 9. 已知柏氏矢量的大小为b = 0.25nm, 如果对称倾侧晶界的取向差θ = 1° 和10°, 求晶界上位错之间的距离. 从计算结果可得到什么结论?解 根据bD θ≈, 得到θ = 1°,10° 时, D ≈14.3nm, 1.43nm. 由此可知, θ = 10° 时位错之间仅隔5~6个原子间距, 位错密度太大, 表明位错模型已经不适用了.第二章 固体中的相结构1. 已知Cd, In, Sn, Sb 等元素在Ag 中的固熔度极限(摩尔分数)分别为0.435, 0.210, 0.130, 0.078; 它们的原子直径分别为0.3042 nm, 0.314 nm, 0.316 nm, 0.3228 nm; Ag 的原子直径为0.2883 nm. 试分析其固熔度极限差异的原因, 并计算它们在固熔度极限时的电子浓度.答: 在原子尺寸因素相近的情况下, 熔质元素在一价贵金属中的固熔度(摩尔分数)受原子价因素的影响较大, 即电子浓度e /a 是决定固熔度(摩尔分数)的一个重要因素, 而且电子浓度存在一个极限值(约为1.4). 电子浓度可用公式A B B B (1)c Z x Z x =-+计算. 式中, Z A , Z B 分别为A, B 组元的价电子数; x B 为B 组元的摩尔分数. 因此, 随着熔质元素价电子数的增加, 极限固熔度会越来越小.Cd, In, Sn, Sb 等元素与Ag 的原子直径相差不超过15%(最小的Cd 为5.5%, 最大的Sb 为11.96%), 满足尺寸相近原则, 这些元素的原子价分别为2, 3, 4, 5价, Ag 为1价, 据此推断它们的固熔度极限越来越小, 实际情况正好反映了这一规律; 根据上面的公式可以计算出它们在固熔度(摩尔分数)极限时的电子浓度分别为1.435, 1.420, 1.390, 1.312.2. 碳可以熔入铁中而形成间隙固熔体, 试分析是α-Fe 还是γ-Fe 能熔入较多的碳.答: α-Fe 为体心立方结构, 致密度为0.68; γ-Fe 为面心立方结构, 致密度为0.74. 显然, α-Fe 中的间隙总体积高于γ-Fe, 但由于α-Fe 的间隙数量多, 单个间隙半径却较小, 熔入碳原子将会产生较大的畸变, 因此, 碳在γ-Fe 中的固熔度较α-Fe 的大.3. 为什么只有置换固熔体的两个组元之间才能无限互熔, 而间隙固熔体则不能?答: 这是因为形成固熔体时, 熔质原子的熔入会使熔剂结构产生点阵畸变, 从而使体系能量升高. 熔质原子与熔剂原子尺寸相差越大, 点阵畸变的程度也越大, 则畸变能越高, 结构的稳定性越低, 熔解度越小. 一般来说, 间隙固熔体中熔质原子引起的点阵畸变较大, 故不能无限互熔, 只能有限熔解.第三章 凝固1. 分析纯金属生长形态与温度梯度的关系.答: 纯金属生长形态是指晶体宏观长大时固-液界面的形貌. 界面形貌取决于界面前沿液相中的温度梯度.(1) 平面状长大: 当液相具有正温度梯度时, 晶体以平直界面方式推移长大. 此时, 界面上任何偶然的、小的凸起深入液相时, 都会使其过冷度减小, 长大速率降低或停止长大, 而被周围部分赶上, 因而能保持平直界面的推移. 长大过程中晶体沿平行温度梯度的方向生长, 或沿散热的反方向生长, 而其它方向的生长则受到限制.(2) 树枝状长大: 当液相具有负温度梯度时, 晶体将以树枝状方式生长. 此时, 界面上偶然的凸起深入液相时, 由于过冷度的增大, 长大速率越来越大; 而它本身生长时又要释放结晶潜热, 不利于近旁的晶体生长, 只能在较远处形成另一凸起. 这就形成了枝晶的一次轴, 在一次轴成长变粗的同时, 由于释放潜热使晶枝侧旁液体中也呈现负温度梯度, 于是在一次轴上又会长出小枝来, 称为二次轴, 在二次轴上又长出三次轴……由此而形成树枝状骨架, 故称为树枝晶(简称枝晶).2. 简述纯金属晶体长大机制及其与固-液界面微观结构的关系.答: 晶体长大机制是指晶体微观长大方式, 即液相原子添加到固相的方式, 它与固-液界面的微观结构有关.(1) 垂直长大方式: 具有粗糙界面的物质, 因界面上约有50% 的原子位置空着, 这些空位都可以接受原子, 故液相原子可以进入空位, 与晶体连接, 界面沿其法线方向垂直推移, 呈连续式长大.(2) 横向(台阶)长大方式: 包括二维晶核台阶长大机制和晶体缺陷台阶长大机制, 具有光滑界面的晶体长大往往采取该方式. 二维晶核模式, 认为其生长主要是利用系统的能量起伏, 使液相原子在界面上通过均匀形核形成一个原子厚度的二维薄层状稳定的原子集团, 然后依靠其周围台阶填充原子, 使二维晶核横向长大, 在该层填满后, 则在新的界面上形成新的二维晶核, 继续填满, 如此反复进行.晶体缺陷方式, 认为晶体生长是利用晶体缺陷存在的永不消失的台阶(如螺型位错的台阶或挛晶的沟槽)长大的.第四章 相图1. 在Al-Mg 合金中, x Mg 为0.15, 计算该合金中镁的w Mg 为多少.解 设Al 的相对原子量为M Al , 镁的相对原子量为M Mg , 按1mol Al-Mg 合金计算, 则镁的质量分数可表示为Mg MgMg Al Al Mg Mg 100%x M w x M x M =⨯+.将x Mg = 0.15, x Al = 0.85, M Mg = 24, M Al = 27代入上式中, 得到w Mg = 13.56%.2. 根据图4-117所示二元共晶相图, 试完成:(1) 分析合金I, II 的结晶过程, 并画出冷却曲线.(2) 说明室温下合金I, II 的相和组织是什么, 并计算出相和组织组成物的相对量.(3) 如果希望得到共晶组织加上相对量为5%的β初的合金, 求该合金的成分.图4-117 二元共晶相图附图4-1 合金I的冷却曲线附图4-2 合金II的冷却曲线解(1) 合金I的冷却曲线参见附图4-1, 其结晶过程如下:1以上, 合金处于液相;1~2时, 发生匀晶转变L→α, 即从液相L中析出固熔体α, L和α的成分沿液相线和固相线变化, 达到2时, 凝固过程结束;2时, 为α相;2~3时, 发生脱熔转变, α→βII.合金II的冷却曲线参见附图4-2, 其结晶过程如下:1以上, 处于均匀液相;1~2时, 进行匀晶转变L→β;2时, 两相平衡共存, 0.50.9L β;2~2′ 时, 剩余液相发生共晶转变0.50.20.9L βα+;2~3时, 发生脱熔转变α→βII .(2) 室温下, 合金I 的相组成物为α + β, 组织组成物为α + βII .相组成物相对量计算如下:αβ0.900.20100%82%0.900.050.200.05100%18%0.900.05w w -=⨯=--=⨯=- 组织组成物的相对量与相的一致.室温下, 合金II 的相组成物为α + β, 组织组成物为β初 + (α+β).相组成物相对量计算如下:αβ0.900.80100%12%0.900.050.800.05100%88%0.900.05w w -=⨯=--=⨯=- 组织组成物相对量计算如下:β(α+β)0.800.50100%75%0.900.500.900.80100%25%0.900.50w w -=⨯=--=⨯=-初 (3) 设合金的成分为w B = x , 由题意知该合金为过共晶成分, 于是有β0.50100%5%0.900.50x w -=⨯=-初 所以, x = 0.52, 即该合金的成分为w B = 0.52.3. 计算w C 为0.04的铁碳合金按亚稳态冷却到室温后组织中的珠光体、二次渗碳体和莱氏体的相对量, 并计算组成物珠光体中渗碳体和铁素体及莱氏体中二次渗碳体、共晶渗碳体与共析渗碳体的相对量.解 根据Fe-Fe 3C 相图, w C = 4%的铁碳合金为亚共晶铸铁, 室温下平衡组织为 P + Fe 3C II + L d ′, 其中P 和Fe 3C II 系由初生奥氏体转变而来, 莱氏体则由共晶成分的液相转变而成, 因此莱氏体可由杠杆定律直接计算, 而珠光体和二次渗碳体则可通过两次使用杠杆定律间接计算出来.L d ′ 相对量: d L 4 2.11100%86.3%4.3 2.11w '-=⨯=-. Fe 3C II 相对量: 3II Fe C 4.34 2.110.77100% 3.1%4.3 2.11 6.690.77w --=⨯⨯=--. P 相对量: P 4.34 6.69 2.11100%10.6%4.3 2.11 6.690.77w --=⨯⨯=--. 珠光体中渗碳体和铁素体的相对量的计算则以共析成分点作为支点, 以w C = 0.001%和w C = 6.69%为端点使用杠杆定律计算并与上面计算得到的珠光体相对量级联得到.P 中F 相对量: F P 6.690.77100%9.38%6.690.001w w -=⨯⨯=-. P 中Fe 3C 相对量: 3Fe C 10.6%9.38% 1.22%w =-=.至于莱氏体中共晶渗碳体、二次渗碳体及共析渗碳体的相对量的计算, 也需采取杠杆定律的级联方式, 但必须注意一点, 共晶渗碳体在共晶转变线处计算, 而二次渗碳体及共析渗碳体则在共析转变线处计算.L d ′ 中共晶渗碳体相对量: d Cm L4.3 2.11100%41.27%6.69 2.11w w '-=⨯⨯=-共晶 L d ′ 中二次渗碳体相对量: d Cm L 6.69 4.3 2.110.77100%10.2%6.69 2.11 6.690.77w w '--=⨯⨯⨯=--IIL d ′ 中共析渗碳体相对量: d Cm L 6.69 4.3 6.69 2.110.770.0218100% 3.9%6.69 2.11 6.690.77 6.690.0218w w '---=⨯⨯⨯⨯=---共析 4. 根据下列数据绘制Au-V 二元相图. 已知金和钒的熔点分别为1064℃和1920℃. 金与钒可形成中间相β(AuV 3); 钒在金中的固熔体为α, 其室温下的熔解度为w V = 0.19; 金在钒中的固熔体为γ, 其室温下的熔解度为w Au = 0.25. 合金系中有两个包晶转变, 即1400V V V 1522V V V (1) β(0.4)L(0.25)α(0.27)(2) γ(0.52)L(0.345)β(0.45)w w w w w w =+===+==℃℃解 根据已知数据绘制的Au-V 二元相图参见附图4-3.附图4-3 Au-V 二元相图第五章 材料中的扩散1. 设有一条直径为3cm 的厚壁管道, 被厚度为0.001cm 的铁膜隔开, 通过输入氮气以保持在膜片一边氮气浓度为1000 mol/m 3; 膜片另一边氮气浓度为100 mol/m 3. 若氮在铁中700℃时的扩散系数为4×10-7 cm 2 /s, 试计算通过铁膜片的氮原子总数.解 设铁膜片左右两边的氮气浓度分别为c 1, c 2, 则铁膜片处浓度梯度为7421510010009.010 mol /m 110c c c c x x x --∂∆-≈===-⨯∂∆∆⨯ 根据扩散第一定律计算出氮气扩散通量为722732410(10)(9.010) 3.610 mol/(m s)c J D x---∂=-=-⨯⨯⨯-⨯=⨯∂ 于是, 单位时间通过铁膜片的氮气量为 3-22-63.610(310) 2.5410 mol/s 4J A π-=⨯⨯⨯⨯=⨯最终得到单位时间通过铁膜片的氮原子总数为-62318-1A () 2.5410 6.02102 3.0610 s N J A N =⨯=⨯⨯⨯⨯=⨯第六章 塑性变形1. 铜单晶体拉伸时, 若力轴为 [001] 方向, 临界分切应力为0.64 MPa, 问需要多大的拉伸应力才能使晶体开始塑性变形?解 铜为面心立方金属, 其滑移系为 {111}<110>, 4个 {111} 面构成一个八面体, 详见教材P219中的图6-12.当拉力轴为 [001] 方向时, 所有滑移面与力轴间的夹角相同, 且每个滑移面上的三个滑移方向中有两个与力轴的夹角相同, 另一个为硬取向(λ = 90°). 于是, 取滑移系(111)[101]进行计算.222222222222k s 0101111cos ,30011110(1)00111cos ,2001(1)011cos cos ,60.646 1.57 MPa.m mϕλϕλτσ⨯+⨯+⨯==++⨯++⨯-+⨯+⨯==++⨯-++====⨯=即至少需要1.57 MPa 的拉伸应力才能使晶体产生塑性变形.2. 什么是滑移、滑移线、滑移带和滑移系? 作图表示α-Fe, Al, Mg 中的最重要滑移系. 那种晶体的塑性最好, 为什么?答: 滑移是晶体在切应力作用下一部分相对于另一部分沿一定的晶面和晶向所作的平行移动; 晶体的滑移是不均匀的, 滑移部分与未滑移部分晶体结构相同. 滑移后在晶体表面留下台阶, 这就是滑移线的本质. 相互平行的一系列滑移线构成所谓滑移带. 晶体发生滑移时, 某一滑移面及其上的一个滑移方向就构成了一个滑移系.附图6-1 三种晶体点阵的主要滑移系α-Fe具有体心立方结构, 主要滑移系可表示为{110}<111>, 共有6×2 = 12个; Al具有面心立方结构, 其滑移系可表示为{111}<110>, 共有4×3 = 12个; Mg具有密排六方结构, 主要滑移系可表示为{0001}1120<>, 共有1×3 = 3个. 晶体的塑性与其滑移系的数量有直接关系, 滑移系越多, 塑性越好; 滑移系数量相同时, 又受滑移方向影响, 滑移方向多者塑性较好, 因此, 对于α-Fe, Al, Mg三种金属, Al的塑性最好, Mg的最差, α-Fe居中. 三种典型结构晶体的重要滑移系如附图6-1所示.3. 什么是临界分切应力? 影响临界分切应力的主要因素是什么? 单晶体的屈服强度与外力轴方向有关吗? 为什么?答:滑移系开动所需的作用于滑移面上、沿滑移方向的最小分切应力称为临界分切应力.临界分切应力τk的大小主要取决于金属的本性, 与外力无关. 当条件一定时, 各种晶体的临界分切应力各有其定值. 但它是一个组织敏感参数, 金属的纯度、变形速度和温度、金属的加工和热处理状态都对它有很大影响.如前所述, 在一定条件下, 单晶体的临界分切应力保持为定值, 则根据分切应力与外加轴向应力的关系: σs= τk/ m, m为取向因子, 反映了外力轴与滑移系之间的位向关系, 因此, 单晶体的屈服强度与外力轴方向关系密切. m越大, 则屈服强度越小, 越有利于滑移.4. 孪生与滑移主要异同点是什么? 为什么在一般条件下进行塑性变形时锌中容易出现挛晶, 而纯铁中容易出现滑移带?答:孪生与滑移的异同点如附表6-1所示.锌为密排六方结构金属, 主要滑移系仅3个, 因此塑性较差, 滑移困难, 往往发生孪生变形, 容易出现挛晶; 纯铁为体心立方结构金属, 滑移系较多, 共有48个, 其中主要滑移系有12个, 因此塑性较好, 往往发生滑移变形, 容易出现滑移带.第七章 回复与再结晶1. 已知锌单晶体的回复激活能为8.37×104 J/mol, 将冷变形的锌单晶体在-50 ℃进行回复处理, 如去除加工硬化效应的25% 需要17 d, 问若在5 min 内达到同样效果, 需将温度提高多少摄氏度?解 根据回复动力学, 采用两个不同温度将同一冷变形金属的加工硬化效应回复到同样程度, 回复时间、温度满足下述关系:122111exp t Q t R T T ⎛⎫⎛⎫=-- ⎪ ⎪ ⎪⎝⎭⎝⎭ 整理后得到221111ln T t R T Q t =+.将41211223 K,/5/(172460),8.3710 J/mol, 8.314 J/(mol K)4896T t t Q R ==⨯⨯==⨯=⋅代入上式得到2274.7 K T =.因此, 需将温度提高21274.722351.7 T T T ∆=-=-=℃.2. 纯铝在553 ℃ 和627 ℃ 等温退火至完成再结晶分别需要40 h 和1 h, 试求此材料的再结晶激活能.解 再结晶速率v 再与温度T 的关系符合阿累尼乌斯(Arrhenius)公式, 即exp()Q v A RT=-再 其中, Q 为再结晶激活能, R 为气体常数.如果在两个不同温度T 1, T 2进行等温退火, 欲产生同样程度的再结晶所需时间分别为t 1, t 2, 则122112122111exp[()]ln(/)t Q t R T T RTT t t Q T T =--⇒=-依题意, 有T 1 = 553 + 273 = 826 K, T 2 = 627 + 273 = 900 K, t 1 = 40 h, t 2 = 1 h, 则58.314826900ln(40/1)3.0810J/mol 900826Q ⨯⨯⨯=⨯-3. 说明金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能特点与主要区别.答: 金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能特点与主要区别详见附表7-1.附表7-1 金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能第八章固态相变。
材料科学基础习题与答案

材料科学基础习题与答案材料科学基础习题与答案材料科学是一门研究材料的结构、性质和性能的学科,是现代工程技术的基础和支撑。
在学习这门学科的过程中,习题是不可或缺的一部分。
通过解答习题,我们能够更好地理解和掌握材料科学的基础知识。
下面将介绍一些常见的材料科学基础习题以及相应的答案。
一、材料的结构与性质1. 什么是晶体结构?答案:晶体结构是指由原子、离子或分子按一定的顺序和规则排列而成的固态物质的结构。
晶体结构的特点是具有长程有序性和周期性。
2. 什么是非晶体结构?答案:非晶体结构是指由原子、离子或分子按无规则排列而成的固态物质的结构。
非晶体结构的特点是缺乏长程有序性和周期性。
3. 金属的晶体结构有哪些?答案:金属的晶体结构主要有面心立方结构、体心立方结构和简单立方结构。
面心立方结构的特点是每个晶胞内有一个原子位于每个面的中心和每个边的中心,体心立方结构的特点是每个晶胞内有一个原子位于每个面的中心和每个体的中心,简单立方结构的特点是每个晶胞内只有一个原子位于每个角的中心。
4. 陶瓷的晶体结构有哪些?答案:陶瓷的晶体结构主要有离子晶体结构和共价晶体结构。
离子晶体结构的特点是由阳离子和阴离子按一定比例排列而成,共价晶体结构的特点是由共价键连接的原子或分子按一定的顺序排列而成。
5. 聚合物的晶体结构有哪些?答案:聚合物的晶体结构主要有单晶结构和非晶结构。
单晶结构的特点是聚合物链按一定的顺序排列而成,非晶结构的特点是聚合物链按无规则排列而成。
二、材料的性能与应用1. 什么是材料的力学性能?答案:材料的力学性能是指材料在外力作用下的变形和破坏行为。
包括强度、韧性、硬度、弹性模量等指标。
2. 什么是材料的热性能?答案:材料的热性能是指材料在高温下的稳定性和热传导性能。
包括热膨胀系数、热导率、热稳定性等指标。
3. 什么是材料的电性能?答案:材料的电性能是指材料在电场作用下的导电性和绝缘性能。
包括导电率、电阻率、介电常数等指标。
材料科学基础习题及参考答案

材料科学基础参考答案材料科学基础第一次作业1.举例说明各种结合键的特点。
⑴金属键:电子共有化,无饱和性,无方向性,趋于形成低能量的密堆结构,金属受力变形时不会破坏金属键,良好的延展性,一般具有良好的导电和导热性。
⑵离子键:大多数盐类、碱类和金属氧化物主要以离子键的方式结合,以离子为结合单元,无方向性,无饱和性,正负离子静电引力强,熔点和硬度均较高。
常温时良好的绝缘性,高温熔融状态时,呈现离子导电性。
⑶共价键:有方向性和饱和性,原子共用电子对,配位数比较小,结合牢固,具有结构稳定、熔点高、质硬脆等特点,导电能力差。
⑷范德瓦耳斯力:无方向性,无饱和性,包括静电力、诱导力和色散力。
结合较弱。
⑸氢键:极性分子键,存在于HF,H2O,NF3有方向性和饱和性,键能介于化学键和范德瓦尔斯力之间。
2.在立方晶体系的晶胞图中画出以下晶面和晶向:(1 0 2)、(1 1 -2)、(-2 1 -3),[1 1 0],[1 1 -1],[1 -2 0]和[-3 2 1]。
(213)3. 写出六方晶系的{1 1 -20},{1 0 -1 2}晶面族和<2 -1 -1 0>,<-1 0 1 1>晶向族中各等价晶面及等价晶向的具体指数。
{1120}的等价晶面:(1120)(2110)(1210)(1120)(2110)(1210){1012}的等价晶面:(1012)(1102)(0112)(1012)(1102)(0112) (1012)(1102)(0112)(1012)(1102)(0112)2110<>的等价晶向:[2110][1210][1120][2110][1210][1120]1011<>的等价晶向:[1011][1101][0111][0111][1101][1011][1011][1101][0111][0111][1101][1011]4立方点阵的某一晶面(hkl )的面间距为M /,其中M 为一正整数,为晶格常数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章1.简述一次键与二次键各包括哪些结合键?这些结合键各自特点如何?答:一次键——结合力较强,包括离子键、共价键和金属键。
二次键——结合力较弱,包括范德瓦耳斯键和氢键。
①离子键:由于正、负离子间的库仑(静电)引力而形成。
特点:1)正负离子相间排列,正负电荷数相等;2)键能最高,结合力很大;②共价键:是由于相邻原子共用其外部价电子,形成稳定的电子满壳层结构而形成。
特点:结合力很大,硬度高、强度大、熔点高,延展性和导电性都很差,具有很好的绝缘性能。
③金属键:贡献出价电子的原子成为正离子,与公有化的自由电子间产生静电作用而结合的方式。
特点:它没有饱和性和方向性;具有良好的塑性;良好的导电性、导热性、正的电阻温度系数。
④范德瓦耳斯键:一个分子的正电荷部位和另一个分子的负电荷部位间的微弱静电吸引力将两个分子结合在一起的方式。
也称为分子键。
特点:键合较弱,易断裂,可在很大程度上改变材料的性能;低熔点、高塑性。
2.比较金属材料、陶瓷材料、高分子材料在结合键上的差别。
答:①金属材料:简单金属(指元素周期表上主族元素)的结合键完全为金属键,过渡族金属的结合键为金属键和共价键的混合,但以金属键为主。
②陶瓷材料:陶瓷材料是一种或多种金属同一种非金属(通常为氧)相结合的化合物,其主要结合方式为离子键,也有一定成分的共价键。
③高分子材料:高分子材料中,大分子内的原子之间结合方式为共价键,而大分子与大分子之间的结合方式为分子键和氢键。
④复合材料:复合材料是由二种或者二种以上的材料组合而成的物质,因而其结合键非常复杂,不能一概而论。
3. 晶体与非晶体的区别?稳态与亚稳态结构的区别?晶体与非晶体区别:答:性质上,(1)晶体有整齐规则的几何外形;(2)晶体有固定的熔点,在熔化过程中,温度始终保持不变;(3)晶体有各向异性的特点。
结构上,晶体原子排列有序,非晶体排列长程无序。
稳态与亚稳态结构的区别同种材料在不同条件下可以得到不同的结构,其中能量最低的结构称为稳态结构。
而能量相对较高的结构称为亚稳态结构。
第二章1.布拉菲将晶体结构共分为哪几大晶系?试画出面心立方、体心四方、简单六方与简单三斜这四种布拉菲点阵的晶胞,并写出其棱边长度与夹角关系?答:分为七大晶系:立方晶系、四方晶系、菱方晶系、六方晶系、正交晶系、单斜晶系、三斜晶系。
面心立方:,a=b=c,α=β=γ= 90°体心四方:,a=b≠c,α=β=γ= 90°简单六方:,a=b≠c,α=β= 90°,γ=120 °简单三斜:,a≠b≠c,α≠β≠γ2. 画出立方晶系中下列晶面和晶向:(010),(011),(231),;[010],[111],。
3.针对体心立方(BCC)晶胞:(1)写出BCC晶体中的配位数(CN)、原子数(N)、原子半径r与点阵常数a的关系式;(2)在晶胞图上画出任一个四面体和八面体间隙的位置,并指出该四面体间隙和八面体间隙的中心位置。
(3)写出BCC晶胞中四面体间隙和八面体间隙的数量。
答:(1)配位数CN=8,致密度K=0.68,原子数N=2,r=31/2a/4。
(2)图中八面体间隙位于六面体的面中心,四面体间隙位于面平分线1/4处。
(3)四面体间隙和八面体间隙的数量分别为12,6。
(3分)4. 针对FCC和BCC晶胞:(1)分别在晶胞图上画出任一个四面体和八面体间隙的位置。
(2)指出该四面体间隙和八面体间隙的中心位置。
(3)写出每种晶胞中四面体间隙和八面体间隙的数量。
答:①P49 图2-15,图2-16②FCC:图中八面体间隙位于晶胞中心,四面体间隙位于晶胞体对角线上靠结点1/4处BCC:图中八面体间隙位于六面体的面中心,四面体间隙位于面平分线1/4处③FCC:四面体间隙和八面体间隙的数量分别为8,4;BCC:四面体间隙和八面体间隙的数量分别为12,65. 画出下述物质的一个晶胞,并指出5种物质的晶体结构所属的布拉菲点阵类型。
NaCl 金刚石闪锌矿纤锌矿CsCl答:NaCl、CsCl、闪锌矿、纤锌矿:课本P59图2-23(a),(b),(c),(d)金刚石:图2-25NaCl、CsCl、闪锌矿、纤锌矿、金刚石点阵为:面心立方、简单立方、面心立方、简单六方、面心立方点阵6.简述离子晶体的结构规则。
答:鲍林第一、第二、第三规则(书本P57-58)第三章1. 根据链节中主链化学组成的不同,高分子链可以分为碳链高分子、杂链高分子和元素有机高分子。
2.二元共聚物单体的连接方式包括无规共聚、交替共聚、嵌段共聚和接枝共聚。
3.高分子链的结构形态包括线型、支化、梳形、星形、交联和体型。
4.高分子链的构象是由于C-C单键内旋转引起的原子在空间据不同位置所构成的分子链的各种形象。
5. 影响高分子链柔顺性的主要因素有主链结构和侧基性质。
6. 按照高分子几何排列的特点,固体聚合物的聚集态结构分为晶态结构和非晶态结构 两种。
7. 高分子材料的玻璃化温度T g 指的是:当一块玻璃冷却到熔点温度以下时,在某一温度范围内它仍是塑性的.却到某个温度时,发生玻璃硬化,该温度称之为玻璃化温度 。
8. 热固性塑料和热塑性塑料的区别:热塑件塑料由于具有线型结构,因而具有较好的弹性和组件、易于加工成型和可反复使用等特性;热固性塑料不能进行塑性加工和反复使用。
第四章1. 已知某晶体在500℃时,每1010个原子中可以形成有1个空位,请问该晶体的空位形成能是多少?(已知该晶体的常数A=0.0539,玻尔兹曼常数k=1.381×10-23J/K )答:3.位错具有较高的能量,因此它是不稳定的,可能会发生位错反应。
请判断下列位错反应能否进行:]111[2]111[6]112[3a a a →+ 答:几何条件:反应后]111[2]111[6]112[3a a a =+,与反应前一致,满足几何条件能量条件:反应前 43))1(116()2113(2222222222a a ab =-+++++=∑ 反应后 反应前==++=∑43)1112(222222a ab 此反应不满足能量条件,只满足几何条件,故不能进行。
4. 试比较肖脱基缺陷与弗兰克尔缺陷的异同?答:相同:都是点缺陷,都会形成空位。
不同:弗兰克尔缺陷:原子离开平衡位置进入间隙,形成等量的空位和间隙原子。
肖脱基缺陷:由于热运动,晶体中阳离子及阴离子脱离平衡位置,跑到晶体表面或晶界位置上,只形成空位不形成间隙原子。
(构成新的晶面)。
5. 试比较刃位错和螺位错的滑移特征?书本P1076. 画图并叙述变形过程中位错增殖的机制。
书本P341 F-R 源7. 试列举金属的四种典型强化机制?这四种机制对材料韧性会产生什么影响? 答:(1)细晶强化,固溶强化,加工硬化,第二相强化。
(2)细晶强化可以提高韧性;第二相强化有时能提高,有时降低;其他强化不能提高。
第五章1.下图所示为经简化了的铁碳合金相图:(1)请在图中空白区域标出各相区的相(写在圆括号内);(2)写出A、G、S、P、C、E点各自代表的意义;(3)写出GS线、ES线、PSK线代表的含义;(4)分析w c=0.77%(虚线①)的铁—碳合金从液态平衡冷却至室温的结晶过程;分析w c=4.30%(虚线②)的铁—碳合金从液态平衡冷却至室温的结晶过程。
(5)计算45钢(含碳量0.45%)与T10钢(含碳量1%)的相组成物的相对量?并根据计算结果说明它们机械性能的差别。
答:(1)(2)课本P178(3)课本P179(4)①w c=0.77%②w c=4.30%(5)45钢的相组成物为F和Fe3C,其相对量为:Q F =(6.69-0.45)/(6.69-0.0218)ⅹ100% =93.6%Q Fe3C = 1-93.3% = 6.4%T10钢的相组成物为F和Fe3C,其相对量为:Q F =(6.69-1.0)/(6.69-0.0218)ⅹ100% =85.3%Q Fe3C = 1-85.1% = 14.7%计算结果表明:由于45钢中的F含量比T10钢高,因此,45钢的塑性、韧性比T10钢高;由于T10钢中的Fe3C含量比45钢高,因此,T10钢的硬度比45钢高。
第六章1.画图并指出典型铸锭(如钢水在砂模中)的组织,并指出其形成原因?要获得成分、性能、均匀的铸锭往往要扩大什么区?答:铸锭的典型组织特点为表层为细晶区,中心为等轴晶区,这两个晶区之间为柱状晶区。
形成的原因为,表面散热最快,过冷度最大,所以晶粒细小;心部各个方向上热量散失速度基本相同,故为等轴晶粒;在这两个晶区之间,热量沿垂直于铸模壁的方向散失最快,所以晶粒为柱状晶粒(晶粒在热量散失最快的方向上长得最快)。
扩大心部等轴晶区。
2.根据凝固理论,试讨论在凝固过程中细化晶粒的基本途径有哪些?答:根据凝固理论可知,在凝固过程中决定晶粒度的因素有形核率(N)和长大速度(G),且N/G越大,晶粒愈细小。
因此我们可以从以下几点着手:(1)增加过冷度:ΔT↑→N/G↑→晶粒愈细小,可以采用降低铸造温度的方法增加过冷度。
(2)提高冷却速度:冷却速度↑→ΔT↑→N/G↑→晶粒愈细小。
可以采用用金属型铸造代替砂型的方法提高冷却速度。
(3)变质处理:变质处理是在液态金属结晶前,加入一些细小高熔点的物质,促使非自发形核的方法。
如钢中加入Ti、V、Al,这种方法易实现、效果明显、最常用。
(4)振动,搅拌方法:破碎作用→提高形核率。
2.假设某纯金属液体按均匀形核方式结晶,晶胚呈半径为r的圆球形。
晶胚的单位面积表面能为σ,液固两相单位体积的吉布斯自由能差为ΔG V。
试问:①该形核过程的驱动力和阻力分别是什么?②临界形核半径r*的表达式③临界形核功ΔG V*的表达式答:(1)驱动力:体积自由能差;阻力:新增表面能(2)△G=驱动力(体积自由能差)+ 阻力(新增表面能)=-△Gv +△G S=-V*△Gv +σ*A=-(4/3)πr3△Gv + 4πr2σ两端对r求导,有△G‘=-4πr2△Gv+8πrσ令△G‘=0有r*=-2σ/△Gv(3)带入r*,有ΔG k*=16πσ3/[3(△Gv)2]第七章1. 简述固态相变的一般特点。
答:(1)相变阻力大。
相变阻力多出了应变能一项且扩散困难。
(2)新相晶核与母相之间存在一定的晶体学位向关系。
沿应变能最小的方向和界面能最低的界面发展。
(3)惯习现象:新相沿特定的晶向在母相特定晶面上形成。
(4)母相晶体缺陷促进相变。
缺陷处晶格畸变、自由能高,促进形核及相变。
(5)易出现过渡相。
因为固态相变阻力大,直接转变困难→协调性中间产物(过渡相)。
2.常用的热处理工艺有哪些?试列举出四种常用热处理工艺在机械制造中的目的或作用。
答:常见的热处理工艺有正火,退火,固溶,时效,淬火,回火,退火,渗碳,渗氮,调质,球化,钎焊等。
