(三)烷烃的氯代反应
有机化学—烷烃

例:用衍生命名法给下列烷烃命名
CH3CHCH2CH3 CH3
戊烷
烷烃
同分异构
同分异构的分类
构造异构
碳链异构(正丁烷和异丁烷) 官能团位置异构(1-丁烯和2-丁烯) 官能团异构(乙醇和二甲醚)
互变异构(乙酰乙酸乙酯酮式和烯醇式)
立体异构
构型异构
顺反异构(烯烃) 光学异构(旋光异构)
构象异构(烷烃,环己烷,糖类)
一、烷烃的构造异构 分子构造:分子中原子间互相连接的顺序和方式。
CH4
C2H6
C3H8
C4H10
H
HH
HHH
HHHH
H C HH C C HH C C C HH C C C C H
H 甲烷
HH 乙烷
HHH 丙烷
HHHH 丁烷
第一节 烷烃的命名
一、伯、仲、叔、季碳原子和伯、仲、叔氢原子
1 H(伯氢)
2 H(仲氢)
H3C CH2 CH2 CH3
1 C(伯碳,一级碳) 2 C (仲碳,二级碳)
➢同系列 同系差 同系物 具有同一通式,结构、性质相似,组成上相差一个或若干个CH2 的一系列化合物称为同系列。CH2称为系差,同系列中各化合物 互称为同系物。如甲烷,乙烷,丙烷等都属于烷烃系列,三者彼此 之间互称烷烃同系物。
CH4 甲烷
C2H6 乙烷
C3H7 丙烷
C4H8 丁烷
烷烃

♦烷烃的系统命名法;♦同系列和同分异构体的概念和书写方法;♦烷烃的构型和构象的表示和书写方法;♦烷烃的物理性质和化学性质。
♦烷烃的命名、性质,构型和构象;♦烷烃卤代反应的历程。
1烷烃的同系列系列差:CH 2称为同系列的系列差,也称系差。
烷烃的通式C n H 2n+2同系物:同系列中的各个化合物互称同系物。
CH 4C 2H 6C 3H 8C 4H 10C 5H 12 ……同系列:具有一个通式,结构相似,性质相似的化合物系列。
2同分异构现象构造异构:具有相同的分子式,而分子中原子或基团的顺序不同。
碳链异构,碳链的连结方式和次序不同;位置异构,取代基或官能团的位置不同;官能团异构,相同的原子组成不同的官能团。
立体异构:分子中原子的结合顺序相同,而原子或基团在空间的相对位置不同。
顺反异构,取代基在双键或环的方位不同;对映异构,互为镜像但不能重合的分子;构象异构,由单键旋转产生的不同的分子形象。
构型异构}构造(Constitution):分子中原子互相联结的方式和次序。
3构造式的书写方法构造简式 构造式 键线式CH3CH2CH2CH3CH3CH3CH CH3CH3CH(CH3)2CH3CH2CH2CH3CH3CH3 CH CH34写出烷烃的同分异构体CH3 CH2 CH2 CH2 CH2 CH3CH3 CH CH2 CH2 CH3 CH3CH3 CH2 CH CH2 CH3CH3CH3 CH CH CH333CH3 CH2 C CH3CH3CH35碳、氢原子的分类和伯、仲、叔碳原子相连的氢原子称为伯、仲、叔氢原子;伯、仲、叔、季碳原子;1º2º3º4ºCH 3 C CH 2 CH CH 3CH 3CH 3CH 3不同类型的氢原子反应性能是有一定差别的。
1普通命名法(习惯命名法)由碳原子的数目依次称为甲烷、乙烷……癸烷,自十一个碳原子以后依次称为十一烷、十二烷……丁烷C H 3CH 2CH 2CH 3CH 3(CH 2)10CH 3十二烷烷烃的英文词尾是-ane 。
第1章 烷烃 环烷烃.

CH3CH2CH2CH2— 正丁基 (CH3)2CHCH2— 异丁基
CH 3CH 2CH
(CH3)3C—
仲丁基
CH 3 (二级丁基)
叔丁基 1,1-二甲(基)乙基 (ter-Bu)
(三级丁基)
若烷烃分子从形式上消除两个氢原子而剩下的原子团 称为亚基。
(3)系统命名法规则
1)直链烷烃:
在系统命名法中,对于直链烷烃的命名和普通命名法是 基本相同的,只是不写 “正”字。 CH3CH2CH2CH2CH3普通命名法叫正戊烷,系统命名法叫戊烷
(3)环戊烷的结构
“信封式”构象:分子的张力不太大,因此环戊烷的 化学性质比较稳定。
CH2Cl + Cl2
CCl4 + Cl
c
CH3Cl + Cl CH3Cl + Cl CH Cl + HCl ClCH 2 2 3Cl + Cl c CH2 Cl + HCl c CH 3-CH3 CH ++ ClHCl c 2Cl 2 CH Cl 2 CH Cl 3 CH 2Cl2 + Cl CH Cl + Cl
CH 3 CH CH CH CH CH 3 CH 2 CH 3 CH 3
2
CH 3
主链
2,4-= 甲基-3-乙基己烷
④如果支链上还有取代基时,从与主链相连的碳原子开始,把 支链的碳原子依次编号,支链上取代基的位置就由这个编号 所得的号数来表示。这个取代了的支链的名称可放在括号中, 或用带撇的数字来表明支链中的碳原子。
2.烷烃分子的形成
C sp 3 C sp
3
C sp 3 C sp
3
3 (sp3-sp σσ 3 )3 (sp -sp )
烷烃与氯气的取代反应

烷烃与氯气的取代反应
烷烃与氯气的取代反应指的是一种化学反应,即烷烃分子中的氢原子被氯气中的氯原子取代的反应。
该反应通常发生在光照或高温下,生成的产物是氢氯酸和氯代烷烃。
反应示例:
CH4 + Cl2 →CH3Cl + HCl
C2H6 + Cl2 →C2H5Cl + HCl
C3H8 + Cl2 →C3H7Cl + HCl
反应机理:
该反应通常由自由基反应发生,可以分为以下几个步骤:
1. 氯分子在紫外光或高温下裂解为两个氯自由基。
Cl2 →2Cl·
2. 烷烃分子中的一个氢原子被氯自由基取代,生成烷基自由基。
RH + Cl·→R·+ HCl
3. 烷基自由基与氯分子发生取代反应形成氯代烷基自由基。
R·+ Cl2 →RCl + Cl·
4. 烷基自由基与氯代烷基自由基相遇形成产物和自由基。
R·+ R'Cl →RR' + Cl·
5. 自由基继续反应,生成氢氯酸和氯代烷烃。
Cl·+ H2 →HCl
RCl + Cl·→RCl2
总的反应方程式:
RH + Cl2 →RCl + HCl。
《有机化学》练习题与参考答案
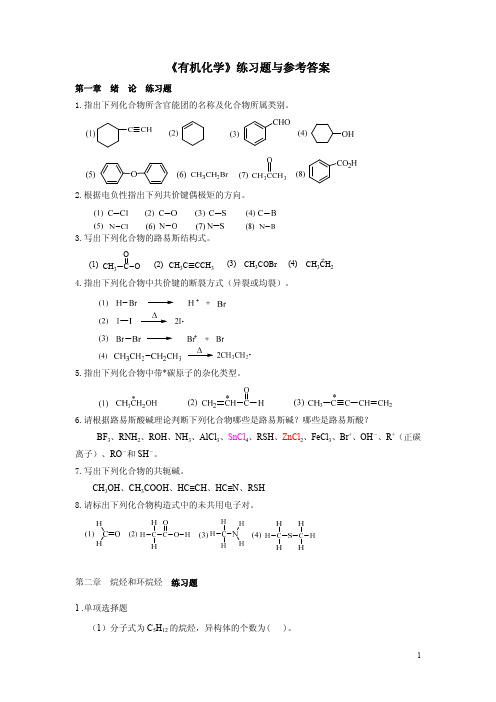
(4)苯酚分子中,羟基属于( )。 A.间位定位基 B.邻位定位基 C.对位定位基 D.邻、对位定位基
(5)苯分子中碳原子的杂化方式是( )。 A.sp 杂化 B.sp2 杂化 C.sp3 杂化 D.sp2d 杂化
6
(6)下列基团能活化苯环的是( )。 A.-NH2 B.-COCH3 C.-CHO D.-Cl
(7)
基团的名称是( )。
A.苄基 B.苯基 C.甲苯基 D.对甲苯基 (8)下列化合物中,在 Fe 催化下发生卤代反应最快的是( )。
A.乙苯 B.邻二硝基苯 C.苯酚 D.氯苯 (9)在苯分子中,所有的 C-C 键键长完全相同,是因为( )。
A.自由基加成反应 B.亲电取代反应 C.亲电加成反应 D.协同反应
2..判断题(对的打√,错的打×) (1)炔烃比烯烃的不饱和程度大,所以炔烃更容易发生加成反应。 (2)在卤化氢中,只有 HBr 与烯烃的加成才观察到过氧化物效应。 (3)凡是具有通式 CnH2n-2 的化合物一定是炔烃或环烯烃。 (4)顺-1,2-二氯-1-溴乙烯又可命名为(Z)-1,2-二氯-1-溴乙烯。
(7)
CC
H3CH2CH2C
CH3
4.写出下列化合物的结构式。
(2) CH3CH2CHCH2CH3 CH CH2
(4) H2C CH CH C(CH3)2
H
H
(6)
CC H
H3C
CC
H
CH2CH3
(1)3-甲基环戊烯
(2)3,3-二甲基-1-己炔
(3)2,4-二甲基-1,3-己二烯 (4)3-乙基-1-戊烯-4-炔
烷烃

第二章 烷烃一 . 基本内容1. 定义及命名法只含碳和氢两种元素且分子中只存在单键的饱和烃称为烷烃。
除简单的烷烃可以用普通命名法外,主要是掌握系统命名法,系统命名法的原则如下:(1)选取主链:选择最长的碳链作为母体,称为某烷。
当有一种以上的碳链可供选择时,应选择碳链上支链(支链可视为取代基)最多的碳链作母体。
(2)主链编号:编号的原则是从最靠近取代基的一端开始依次用阿拉伯数字编号,位次和取代基之间要用半字线“-”连接。
当首先出现的取代基所连碳原子的编号相同时,则尽可能使连有较多取代基的碳原子的编号最小,如CH 3CH 2CH(CH 2CH 3)C- (CH 3)2CH 2CH 3应命名为3,3-二甲基-4-乙基己烷。
主链上碳原子的编号有几种可能时,则采取“最低系列”的编号方法,即逐个比较两种编号中取代基位次的数字,最先遇到位次较低者,定为“最低系列”,如CH 3CH(CH 3)CH 2CH(CH 3)CH(CH 3)CH 3命名为2,3,5-三甲基己烷。
(3)取代基的名称写在母体名称之前,取代基的排列次序按“优先次序规则”排列,将较优的基团后列出。
2. 反应烷烃在常温下与强酸(如浓硫酸、浓硝酸),强碱(如熔化的氢氧化钠),强氧化剂(如重铬酸钾、高锰酸钾),强还原剂(如锌加盐酸、钠加乙醇)等都不起反应或反应速度很慢。
但在适当的温度、压力和催化剂的作用下可以起反应。
(1) 烷烃的燃烧:烷烃完全燃烧生成二氧化碳和水,同时放出大量的热。
反应的通式为:(2)烷烃的热解:烷烃热解时,碳-碳或碳-氢键断裂,生成含有未配对电子的烷基自由基,烷基自由基的反应活性很高,寿命很短,可发生如下反应: CH 3· + ·CH 2CH 3 → CH 3CH 2CH 3 ·CH 2CH 3 + ·CH 2CH 3 → CH 3CH 3 + CH 2=CH 2(3) 烷烃的卤化C H 2n +2+O 2n CO 2+n+1H 2On 3n +12烷烃的卤化产物通常是混合物。
烷烃卤代与氯气方程式

烷烃卤代与氯气方程式C2H6+CL2==C2H5CL+HCL,CH3CH2Cl。
取代反应是指化合物或有机物分子中任何一个原子或原子团被试剂中同类型的其它原子或原子团所替代的反应。
乙烷与氯气的取代反应方程式用通式表示为:R-L(反应基质)+A-B(进攻试剂)→R-A(取代产物)+L-B(离去基团)属于化学反应的一类。
取代反应在有机化学中非常重要,而无机化学中同样存在取代反应,并非只限于有机化学烷烃卤一、分类卤代烷可以根据卤原子所连接的碳原子的不同来分类。
当卤原子分别与伯、仲或叔碳原子相连时,分别称为伯、仲或叔卤代烷。
例如:CH3CH2CH2Cl1-氯丙烷(1°)根据卤原子数不同分为一卤代烷,二卤代烷,多卤代烷。
根据卤原子种类不同分为氟代烷,氯代烷,溴代烷,碘代烷。
根据烷基的不同分为饱和卤代烷,不饱和卤代烷,卤代芳烃。
二、命名规则一些简单常见的卤代烷通常用普通命名法命名,如甲基氯、异丙基溴、叔丁基氯等。
卤代烷的系统命名:(a)选择连有卤原子的碳原子在内的最长碳链作为主链,根据主链的碳原子数称为“某烷”;(b)支链和卤原子均作为取代基(c)将取代基的名称和位次写在主链烷烃名称之前,即得全名。
三、元素组成碳、卤素(氟、氯、溴、碘)、氢注:有些卤代烷不含氢,比如四氯化碳(CCl)四、物理性质在卤代烷(氟代烷除外)中,只有氯甲烷、氯乙烷、一氯乙烯和溴甲烷为气体,其余均为无色液体或固体。
但碘代烷和溴代烷,尤其是碘代烷,长期放置因分解产生游离碘和溴而有颜色。
一卤代烷有不愉快的气味,其蒸汽有毒。
它们均不溶于水,而溶于弱极性或非极性的乙醚、苯、烃等有机溶剂,某些卤代烷本身即是很好的有机溶剂,如二氯甲烷、四氯化碳等。
在卤代烷分子中,随卤原子数目的增多,化合物的可燃性降低。
卤代烷的沸点随分子中碳原子数的增加而升高。
碳原子数相同的卤代烷,沸点则是:碘代烷>溴代烷>氯代烷。
在异构体中,支链越多沸点越低。
烷烃可以发生的氧化反应方程式

烷烃可以发生的氧化反应方程式烷烃是由碳和氢组成的一类有机化合物,通式为CnH2n+2。
由于其分子结构中仅含有碳和氢元素,烷烃是一类饱和化合物,与其他有机化合物相比,其反应性较差。
然而,在一定条件下,烷烃仍然可以发生氧化反应。
本文将从烷烃的氧化反应机理、主要反应类型和具体反应方程式等方面进行详细论述。
首先,我们来了解一下烷烃的氧化反应机理。
烷烃的氧化反应是指其分子中的碳-碳和碳-氢键被氧化剂(例如氧气或过氧化氢等)氧化而断裂的过程。
在烷烃的氧化反应中,碳-碳键和碳-氢键的断裂可以进一步导致一系列的反应产物生成,包括醇、醛、酮、酸等。
烷烃的氧化反应主要可以分为以下几种类型。
1.燃烧反应:烷烃与氧气发生直接氧化反应产生二氧化碳和水。
这是烷烃最常见的氧化方式,也是烷烃起火和燃烧的基本过程。
燃烧反应可用以下方程式表示:烷烃+氧气→二氧化碳+水例如,甲烷(CH4)在氧气中燃烧的反应方程式为:CH4 + 2O2 → CO2 + 2H2O2.氧化剂氧化反应:除了燃烧反应外,烷烃还可以被氧化剂氧化,生成具有氧化剂氧原子的相应产物。
具体反应方程式如下:烷烃+氧化剂→氧化产物例如,甲烷可以与过氧化氢发生氧化反应,生成甲醇:CH4 + H2O2 → CH3OH + H2O3.单质氧氧化反应:烷烃可以与氧反应生成相应的氧化产物。
具体反应方程式如下:烷烃+ O2 →氧化产物例如,乙烷(C2H6)可以与氧气发生氧化反应,生成乙醛:2C2H6 + O2 → 2CH3CHO4.湿式氧化反应:烷烃可以通过与酸性过氧化氢(或酸性高价态氯)反应,发生一系列的氧化反应。
具体反应方程式如下:烷烃+酸性过氧化氢(或酸性高价态氯)→氧化产物例如,乙烷可以与高价态氯反应,生成乙醛:2C2H6 + Cl2 → 2CH3CHO + H2在实际的烷烃氧化反应中,反应条件对反应类型和产物选择有重要影响。
一般来说,高温、光照和催化剂等条件有助于促进烷烃的氧化反应。
第二章 烷烃

Ar—芳基 Ph—苯基 Ac—乙酰基; R—烷基
t-Bu—叔丁基(三级丁基)
2.2 烷烃的命名
一. 习惯命名法
•直链烷烃:根据碳原子数命名:甲烷,乙烷,丙烷..... •支链烷烃:(异构体) CH3 CH3CHCH2CH3 异戊烷 CH3 CH3-C-CH3 CH3 新戊烷
CH3CH2CH2CH2CH3
重叠式
重叠式
12.6kJ/mol
交叉式
交叉式
交叉式
乙烷分子各种构象的能量曲线:交叉式稳定
2.4.2丁烷的构象 ①丁烷的结构(模型)
键线式
构造式
Stuart模型
②丁烷的构象(看成乙烷的两个端氢被甲基取代)
丁烷C(2)-C(3)键旋转引起的各构象的能量变化
2.5 烷烃的物理性质
分子间的作用力(氢键、偶极-偶极作用、van der waals力)影响物质的沸点、熔点及溶解度等物理性质。
(二) 烃的分类
开链烃(链烃),又叫脂肪烃. 包括:烷烃 、烯烃 、二烯烃 、炔烃等 闭链烃(环烃). 包括:脂环烃和芳香烃两类.
2.1 烷烃的通式,同系列和构造异构
(1)烷烃的定义:分子中除C-C单键相连外,其它价键
都被氢原子所饱和的碳氢化合物,因此也叫饱和烃. 根据含C原子数目依次叫甲烷,乙烷,丙烷,丁烷 ...... 名称 分子式 构造式 构造简式 甲烷 乙烷 丙烷 丁烷 CH4 C2H6 C3H8 C4H10 CH4 CH3CH3 CH3CH2CH3 CH3(CH2)2CH3
(2)带有支链的烷烃的系统命名 *
第一步——选择主链: 把构造式中连续的最长碳链作为母体,以最长碳链 的碳原子数目称为某烷;若最长碳链不止一条,选择其 中含较多支链的为主链. 例1:
第三章 烷烃

丁烷:C4H10
CH3 CH2 CH2 CH3
正丁烷
CH3 CH3 CH CH3
异丁烷
戊烷:C5H12
CH3 CH3CH2CH2CH2CH3 CH3CHCH2CH3
正戊烷
异戊烷
CH3 CH3-C-CH3
CH3
新戊烷
6
★ 通常所说的分子结构是指分子构造、构型和构象的总称, 一个分子只有在它的构造、 构型和构象全部确定后,它 的结构才能确定;
CO2; ③甲烷的构型是正四面体,键角109.5°,C-H键键
长为107 pm
即:在绝大多数有机物中,碳都是+4价。
29
对实验事实的解释(sp3杂化):
激发
SP3杂化
2p 2s
2p 2s
sp3
每个sp3杂化轨道含1/4 s 成分和 3/4 p成分
sp3杂化轨道形状
30
碳原子的sp3杂化轨道
头碰头重叠 形成C—Hσ键
★构造是指分子中原子间键的性质和顺序,由于构造不同 引起的异构体成为构造异构体,如正丁烷和异丁烷;
★ 构型是指分子中原子在空间的排列顺序,但不计由单键 旋转而引起的不同排列;由于构型不同而引起的异构体 成为构型异构体,如(+)-酒石酸、(-) -酒石酸和 内消旋酒石酸;
★构象则是指由单键旋转而引起的分子中原子的不同空间 排列。由于构象不同而引起的异构体称为构象异构体, 如环己烷的椅式和船式。
4
32
1
CH3-CH2-CH2—CH—CH—C—CH2-CH3
CH2
CH2
CH2
CH3
CH3
3-甲基-3-乙基-5-丙基-4-异丙基辛烷
28
三、烷烃的结构
烷烃发生卤代反应的条件

烷烃发生卤代反应的条件烷烃是一类由碳和氢组成的有机化合物,分子中只含有单键,没有双键和环。
烷烃可以通过卤代反应引入卤素原子,从而得到卤代烷烃。
卤代烷烃在有机合成和化学工业中有着广泛的应用。
本文将介绍烷烃发生卤代反应的条件。
烷烃发生卤代反应的条件主要包括反应物的选择、卤素的选择和反应条件的控制。
首先,选择适当的烷烃作为反应物是十分重要的。
一般来说,仅含有碳和氢的烷烃更容易发生卤代反应。
而含有其他官能团的化合物可能会发生其他反应,因此需要选择合适的烷烃。
选择适当的卤素也是至关重要的。
常用的卤素包括氯、溴和碘。
不同的卤素有不同的反应活性和选择性。
一般来说,氯的反应活性最高,溴次之,碘的反应活性最低。
因此,在选择卤素时,需要考虑反应的速度和选择性。
在反应条件的控制方面,温度和反应时间是两个重要的因素。
一般来说,卤代反应是一个自发的过程,但需要提供足够的能量才能使反应发生。
因此,反应温度一般较高,可以通过加热的方式提供能量。
同时,反应时间也需要控制,以充分发生反应,但又不过度反应。
反应还需要合适的反应介质。
一般来说,有机溶剂是常用的反应介质,如乙醇、甲醇等。
有机溶剂可以提供反应所需的环境,并有助于反应物的溶解和反应的进行。
总结起来,烷烃发生卤代反应的条件包括合适的反应物选择、适当的卤素选择、控制好反应条件(包括温度、反应时间和反应介质)。
在实际操作中,还需要考虑一些具体的因素,如反应物的浓度、卤素的用量等。
以乙烷和氯气为例,乙烷和氯气反应可以得到氯代乙烷。
实验中,将乙烷和氯气以适当的摩尔比例通入反应容器中,加热至适当温度,反应一定时间后,收集产物。
产物可以通过分离和纯化得到纯净的氯代乙烷。
烷烃发生卤代反应的条件是多方面的,需要考虑反应物的选择、卤素的选择和反应条件的控制。
通过合理地选择和控制这些条件,可以得到高产率和高选择性的卤代烷烃。
卤代烷烃在有机合成和化学工业中有着广泛的应用,对于研究和应用有机化学具有重要的意义。
烷烃性质详细讲解

• 若将氯气照射后,在黑暗中放一段时间,然后与甲烷混合,反应不发生。
• 每吸收一个光子,就可生成几千个氯甲烷分子。
结果:1 甲烷与氯气在光照或加热时,才能反应。且反应复杂。
2 反应条件直接作用于氯气,由此引起反应。 3 只需少量的能量,就能发生大量的反应。
一 卤代反应机理: 游离基(自由基)链反应
一 根据键的离解能数据估计反应热
(一)甲烷氯代反应的反应热:
CH3-H + Cl - Cl
键能(kJ/mol) 435 243
→
Cl - CH3 + H - Cl
349 431
断裂键需吸收的能量:435 + 243 = 678 kJ/mol (ΔH > 0)
形成键放出的能量:-(431.0 + 349 = -780 kJ/mol (ΔH < 0) 反应热 ΔH = 678 - 780 = -102 kJ/mol
异丁烷的一元氯化反应:
取代伯氢 CH 3
CH3 CH3
64%
CH2Cl C H CH3
光 C H + Cl2 25℃ CH3
CH3
取代叔氢 36%
CH3
C Cl
CH3 叔氢与伯氢活性之比为: 叔氢 = 36/1 = 36 ≈ 64/9 7.1 伯氢
5 1
氢原子被卤化的次序(由易到难)为:
叔氢>仲氢>伯氢
(一)反应机理(反应历程):描述反应物如何逐步变成产 物的过程。 (二)链反应:一般来说,分为链引发、链增长和链终止 三个阶段。 烷烃的氯代是一个链反应,也叫连锁反应。
二 甲烷卤代反应机理
生成自由基,可见光波足以
引发
消耗旧自由基,生成 新自由基,反复循环
《有机化学》(济南大学)智慧树知到章节测试答案2024年

绪论单元测试1.1828年德国化学家()由氰酸铵的水溶液加热制成尿素,第一次冲击了有机化学的“生命力”学说?A:维勒(F. Wöhler)B:李比希(J.von Liebig)C:拉瓦锡(voisier)D:贝采里乌斯(J.J.Berzelius)答案:A2.价键理论认为,共价键是通过()形成的。
A:未成键电子对B:电子对C:共用电子对D:阴阳离子间的静电作用答案:C3.C5H12的构造异构体有()个。
A:2B:5C:3D:4答案:C4.多原子分子的偶极矩是()。
A:某个共价键偶极矩的代数和B:某个共价键的偶极矩C:各个共价键偶极矩的代数和D:各个共价键偶极矩的矢量和答案:D5.下列化合物哪个是极性分子?()A:CCl4B:CO2C: I2D:CH2Cl2答案:D6.共价键的偶极距指的是当成键原子电负性不同时,共用电子对会发生偏移,电负性大的原子带部分正电荷,电负性小的原子带有部分负电荷。
()A:错B:对答案:A7.一般相同类型的化学键键能越大,化学键越牢固,分子越稳定。
()A:对B:错答案:A8.分子轨道就是指分子本身运动的轨道()A:对B:错答案:B9.下列关于杂化轨道理论的描述不正确的是()。
A:杂化轨道在角度分布上,比单纯的原子轨道更为集中,因而重叠程度也更大,更有利于成键。
B:杂化指的是中心原子的任何不同轨道在外界的影响下会发生“混合”。
C:不同类型的杂化轨道,其空间取向不同D:原子轨道的杂化会形成同等数量、能量完全相同的新的轨道。
答案:B10.电子在分子轨道中排布时,遵守下列哪些原则()。
A:“洪特规则”B:“不守恒”C:“泡利不相容原理”D:“能量最低原理”答案:ACD第一章测试1.乙烷分子的优势构象(稳定构象)是()。
A:交叉式构象B:重叠式构象答案:A2.CH3CH(CH3)CH2CH3的命名不正确的是()。
A:异戊烷B:2-甲基丁烷C:3-甲基丁烷答案:C3.对烷烃的卤代反应描述不正确的是()。
杭州第十四中学高中化学选修三第二章《烃》基础练习(含答案解析)

一、选择题1.下列各组中的物质均能发生加成反应的是A.乙烯和乙醇B.苯和氯乙烯C.乙酸和溴乙烷D.丙烯和丙烷答案:B解析:A.乙烯中含有碳碳双键,能发生加成反应,乙醇中无不饱和键,不能发生加成反应,A与题意不符;B.苯可与氢气发生加成反应生成环己烷,氯乙烯中含有碳碳双键,能发生加成反应,B符合题意;C.乙酸和溴乙烷均不能发加成反应,C与题意不符;D.丙烷中无不饱和键,不能发生加成反应,D与题意不符;答案为B。
2.下列排序正确的是A.酸性:HClO<H2CO3B.熔点:MgBr2<CCl4C.碱性:Ca(OH)2<Mg(OH)2D.沸点:正丁烷<异丁烷答案:A解析:A.碳酸与NaClO反应生成HClO,酸性:HClO<H2CO3,A正确;B.MgBr2常温下为固体、CCl4常温下为液体,则熔点:MgBr2>CCl4,B错误;C.金属性Ca>Mg,则碱性:Ca(OH)2>Mg(OH)2,C错误;D.正丁烷与异丁烷互为同分异构体,正丁烷没有支链、分子间作用力大,异丁烷有支链、分子间作用力小,则沸点:正丁烷>异丁烷,D错误;答案选A。
3.下列关于有机化合物的说法正确的是A.的分子式为C5H12O B.C3H6Cl2有4种同分异构体C.氯乙烯和聚乙烯均能发生加成反应D.水可以用来分离溴苯和苯的混合物答案:B解析:A.的结构简式为HOCH(CH3)CH2CH3,分子式为C4H10O,A不正确;B.C3H6Cl2分子中,2个Cl连在同一碳原子上的异构体有2种,2个Cl原子连在不同碳原子上的异构体有2种,所以共有4种同分异构体,B正确;C.聚乙烯分子中只含有单键,没有双键,所以不能发生加成反应,C不正确;D.溴苯和苯互溶,加入水后,二者仍混溶在一起,要么都在水的上层,要么都在水的下层,D不正确;故选B。
4.下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是A.甲苯燃烧生成CO2B.甲苯与硝酸发生反应生成TNTC.甲苯能使酸性KMnO4溶液褪色D.光照下甲苯与Br2在侧链上发生取代反应答案:B【分析】甲苯中的侧链是甲基,甲基对苯环性质的影响应该表现在苯环上的剩余5个氢原子的活性,即发生的反应。
卤代烷烃的反应

乙醇 △
RCH=CH 2 + NaX + H 2O
β﹣氢原子由于卤原子的I效应而有一定的酸性。在强碱的作用下 ,卤代烷易于消除β﹣氢原子和卤原子。故这种消除反应称为β﹣ 消除。活性次序是:叔卤代烷>仲卤代烷>伯卤代烷。
注意
大多数情况下,卤代烷的消除与取代反应同时进行,相 互竞争,哪一种反应占优势,与分子结构及反应条件有关。例: 伯氯代烷与强碱的稀水溶液共热,主要发生取代生成醇;与强碱 的浓醇溶液共热,主要消除生成烯。
——按SN2,亲核试剂从离去基团的背面进攻碳原子,烷基结构如 对亲核试剂的接近起阻碍作用,反应速率变慢。(电子效应也如此: 甲基的供电使碳正离子电子云密度增大)故卤代烷SN2反应的活性 次序:卤甲烷>伯卤代烷>仲卤代烷>叔卤代烷。 例:在极性较弱的溶剂(丙酮)中,溴甲烷与碘化钾生成碘烷的速 2019/1/9 20 5 率是与叔丁基溴反应速率的1.510 倍
2019/1/9
9
3. 与金属镁反应 卤代烷与金属(锂、钠、镁)反应,生成金属原子与碳原子直
接相连的化合物,称金属有机化合物,最重要的是有机镁化合物。
格利雅试剂(Grignard reagent)——烷基卤化镁(RMgX)
——制备 种有机合成。 卤代烷在绝对乙醚(又称干醚,不含乙醇和水)中, 与金属镁反应生成烷基卤化镁。产物溶于乙醚,不分离即可用于各
(CH 3)3C Br + OH (CH 3)3C OH + Br -
υ 水解 = k [(CH 3)3CBr]
机理:叔丁基溴水解分两步进行,(下面三处加个C)
第一步: (CH 3)3C Br
慢
δ (CH ) Br [ ] 3 3 过渡态T 1
烷烃的卤代反应方程式总结

烷烃的卤代反应方程式总结烷烃是一类碳原子间仅存在单键的化合物。
它们通过卤代反应可以引入卤素原子到分子结构中,形成卤代烷烃。
卤代烷烃在有机合成领域具有广泛的应用。
本文将总结烷烃的卤代反应方程式,并探讨其中一些典型的反应类型。
一、氯代反应(氯代烷烃的合成)1. 氯化反应(氯化亲电取代反应):烷烃可以与氯气(Cl2)发生氯化反应,生成氯代烷烃。
例如:CH4 + Cl2 → CH3Cl + HCl2. 自由基氯化反应(自由基卤代反应):烷烃可以通过自由基机制与氯原子发生氯化反应,生成氯代烷烃。
例如:CH4 + Cl2 → CH3Cl + HCl(自由基链反应)二、溴代反应(溴代烷烃的合成)1. 溴化反应(溴化亲电取代反应):烷烃可以与溴发生溴化反应,生成溴代烷烃。
例如:CH4 + Br2 → CH3Br + HBr2. 自由基溴化反应(自由基卤代反应):烷烃可以通过自由基机制与溴原子发生溴化反应,生成溴代烷烃。
例如:CH4 + Br2 → CH3Br + HBr(自由基链反应)三、碘代反应(碘代烷烃的合成)1. 碘化反应:烷烃可以与碘发生碘化反应,生成碘代烷烃。
例如:CH4 + I2 → CH3I + HI四、总结通过以上总结,在卤代反应中,无论是氯代、溴代还是碘代反应,均可采用亲电取代反应和自由基反应的机制。
亲电取代反应通常发生在顺电子推动的条件下,而自由基反应则需要较高的温度或紫外光的激发。
在亲电取代反应中,碳原子与卤素原子之间形成了新的化学键,产物中的氢被丢失。
而在自由基反应中,以氯化反应为例,其中氯原子通过断裂C-H键并替代氢原子,形成了氯代烷烃。
虽然本文仅讨论了烷烃的卤代反应,但实际上,其他有机化合物也可以通过类似的反应与卤素发生化学反应,引入卤素原子。
这些反应在有机合成中具有重要的意义和应用,可以用于合成药物、染料等有机化合物。
总之,在有机化学领域,烷烃的卤代反应可以用于合成各种卤代烷烃,而这些卤代烷烃在化学和工业领域中有着广泛的用途。
烷烃的取代反应方程式

烷烃的取代反应方程式烷烃是一类碳氢化合物,由于其分子结构简单,化学性质稳定,因此在有机化学中具有重要的地位。
烷烃的取代反应是有机化学中的基础反应之一,本文将从反应类型、反应条件、反应机理及实际应用等方面进行全面的介绍。
一、取代反应的类型1. 氢代取代反应氢代取代反应是指在烷烃分子中,一个或多个氢原子被其他原子或基团所取代的反应。
例如甲烷和溴在紫外光作用下发生氢代溴代反应:CH4 + Br2 → CH3Br + HBr2. 单取代反应单取代反应是指一个分子中只有一个氢原子被其他原子或基团所取代的反应。
例如乙烷和卤素在紫外光作用下发生单取代反应:C2H6 + Cl2 → C2H5Cl + HCl3. 多取代反应多取代反应是指一个分子中有两个或两个以上的氢原子被其他原子或基团所取代的反应。
例如丙烷和卤素在紫外光作用下发生多取代反应:C3H8 + Cl2 → C3H7Cl + HCl二、取代反应的条件1. 温度温度是影响取代反应速率的重要因素之一。
在一定范围内,温度升高会使反应速率增加。
但是当温度超过一定范围时,反应速率会减慢或停止。
不同的取代反应需要不同的温度条件。
2. 光照光照可以促进某些取代反应的进行。
例如氢代溴代反应和单取代反应都需要紫外光照射才能进行。
3. 催化剂催化剂可以提高某些取代反应的速率,降低活化能。
例如氧化铝、氯化铝等催化剂可以促进芳香族烃的烷基化和芳基化。
三、取代反应机理1. 自由基机理自由基机理是指在一个分子中,一个氢原子被另一个原子或基团所取代时,中间产生了自由基并参与了整个反应过程。
以甲烷和溴为例,甲烷中一个氢原子被溴所取代:CH4 + Br2 → CH3Br + HBr其中CH3Br是中间产物,整个反应过程如下:2. 电子对机理电子对机理是指在取代反应中,一个原子或基团通过共价键与烷烃分子中的一个氢原子形成一个新的共价键,同时另外一个原子或基团通过孤对电子与该烷烃分子中的另一个碳原子形成新的共价键。
有机化学试题及答案

简单题目1.用括号内的试剂和方法除去下列各物质的少量杂质,不正确的是()A、苯中含有苯酚(浓溴水,过滤)B、乙酸钠中含有碳酸钠(乙酸、蒸发)C、乙酸乙酯中含有乙酸(饱和碳酸钠溶液、分液)D、溴乙烷中含有醇(水、分液)2.下列物质不能使酸性KMnO4溶液褪色的是()A、 B、C2H2 C、CH3D、 CH3COOH3.(CH3CH2)2CHCH3的正确命名是 ( )A、3-甲基戊烷B、2-甲基戊烷C、2-乙基丁烷D、3-乙基丁烷4.手性分子是指在分子结构中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。
下列分子中指定的碳原子(用*标记)不属于手性碳原子的是()A 、苹果酸 B、丙氨酸C H3CH COOHNH2C 、葡萄糖 D2OH OH5.某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代烃,此烷烃是()A、(CH3)2CHCH2CH2CH3B、(CH3CH2)2CHCH3C、(CH3)2CHCH(CH3)2D、(CH3)3CCH2CH36.有—CH3,—OH,—COOH,—C6H5四种基团,两两结合而成的有机化合物中,水溶液具有酸性的有()A、3种B、4种C、5种D、6种7.下列说法错误的是()A、C2H6和C4H10一定是同系物B、C2H4和C4H8一定都能使溴水退色C、C3H6不只表示一种物质D、单烯烃各同系物中碳的质量分数相同8.常见有机反应类型有:①取代反应②加成反应③消去反应④酯化反应⑤加聚反应 ⑥缩聚反应 ⑦氧化反应 ⑧还原反应,其中可能在有机分子中新产生羟基的反应类型是 ( )A 、①②③④B 、⑤⑥⑦⑧C 、①②⑦⑧D 、③④⑤⑥9.乙醛和新制的Cu (OH )2反应的实验中,关键的操作是 ( ) A 、Cu (OH )2要过量 B 、NaOH 溶液要过量 C 、CuSO 4要过量 D 、使溶液pH 值小于710.PHB 塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为:n OCHC 2H 5CO 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3Cl
Cl2
紫外光
CH2Cl2
Cl2
紫外光
6
CHCl3
Cl2
紫外光
CCl4
一氯甲烷 b.p. -24.2℃
二氯甲烷 b.p. 40.2℃
三氯甲烷 b.p. 61.2℃
四氯化碳 b.p. 76.8℃
6
(二)甲烷氯代反应的机理
化学反应从反应物到生成物所经过的途径与过程称为反
应机理(reaction mechanism)或反应历程
光
Cl
Cl 57%
CH3CHCH2Cl + CH3CCH3 CH3 CH3 64%
15
36%
36 64 0 : 3 0H :1 H =( 1 ) ( 9 )= 5.1:1
*烷烃卤代反应中,各种氢原子的反应活性次序为:
3 0H > 2 H > 10H > CH3 H
15
0
1. 反应活性与自由基稳定性的关系
7
7
1. 自由基取代反应机理 实验事实
(1)甲烷与氯气在室温和黑暗中长期保存,不反应 (2)甲烷经光照后与氯混合,不反应 (3)氯经光照后,与甲烷在黑暗中立即混合,立即反应; (4)反应需要光照或加热到450˚C才发生 (5)有少量氧存在会使反应延迟一段时间,即反应有一个诱 导期 (6)有少量乙烷副产物生成 8
H H C C C H HH C HH H H
.
C H
H H CH C H H
R1 R2
H H C H
.
C R3
CH2
H C H
CH3
17 自由基的稳定性
3 > 2 > 1 > 甲基自由基
17
各种氢原子的活性次序
3°H>2°H>1°H >甲基氢
18
18
2. 卤素的活性及反应选择性
CH3CH2CH3 + Br2 hv
研究反应过程中体系能量的变化,以反应进程为横坐标, 势能为纵坐标,得到反应体系的势能变化的位能图
在一个多步反应 中,整个反应的 速率决定于其中 最慢的一步
12
12
Hammond(哈蒙德)假说
“在基元反应(简单的一步反应)中,该步过渡态的 结构、能量与更接近的一端类似”。若过渡态与产物 相似,则产物越稳定,过渡态的能量也会越低,反应
烷烃化学性质稳定,在一定条件下C-C键、C-H键也 可断裂而发生各种化学反应 4
4
一、自由基取代反应
有机分子中的原子或原子团被其他原子或原子团替代的反应 叫做取代反应;被卤素原子取代的反应称为卤代反应或卤化反应
(一)甲烷的氯代反应
CH4 + Cl2
紫外光
5
CH3Cl + HCl
5
甲烷的卤代反应较难停留在一取代物阶段,生成的一氯 甲烷容易继续氯代生成二氯甲烷、三氯甲烷和四氯甲烷
也适用于甲烷的溴代和其他烷烃的卤代
10
2. 过渡态理论与活化能
过渡态理论认为:化学反应是一个反应物到产物逐渐过渡的连
续过程;反应物到产物的转变过程中,经历了原子的排列,并看
成是一个“真实分子”的状态,这个中间状态,就称为过渡态
δ
Cl + H CH3 Cl H
11
δ
CH3 Cl H
+
CH3
过渡态
11
CH3 RCH2
Hale Waihona Puke H HCH3 + H RCH2 + H R2CH + H R3C + H
解 离 能 kJ.mol / 434.7 405.5 392.9 376.2
-1
R2CH H R3C H
形成各种类型自由基所需要的能量 甲基自由基>1°自由基>2°自由基>3°自由基
16
16
Hammond假说
H H
8
提示
a. 甲烷与氯的反应条件需要光照或加热到450˚C才发生 b. 实验(2)不反应,而实验(3)反应,说明氯分子经光
照是反应关键的第一步
9
9
推测
Cl2 hv
或加热
Cl + Cl
链的引发
Cl + CH4
CH3 + HCl
链的增长
CH3 + Cl
CH3Cl
CH3 + CH3
链的终止
CH3CH3
10
127 C
0
CH3CH2CH2Br + CH3CHCH3
3%
CH3CHCH3 + Br2 CH3 hv
127 C
0
Br
97%
Br CH3CHCH2Br + CH3CCH3 CH3 CH3
< 1%
> 99%
溴代反应具有高度选择性
19
卤素与烷烃反应的相对活性次序:
F2>Cl2>Br2>I2
19
有机化学
第二章
烷烃
目录
第一节 第二节 第三节 第四节 第五节 第六节 烷烃的结构 烷烃同系列和同分异构体 烷烃的命名 烷烃的构象 烷烃的物理性质 烷烃的化学性质
第六节
烷烃的化学性质
烷烃分子中只含有C—C键和C—H键,且都是σ键,键能较大;
碳原子和氢原子的电负性差异不大,在C―H键中σ电子云均匀 地分布在两个原子核之间,所以烷烃中的C―H及C―C键都是非 极性键
的活化能也越低,反应速度越快
13
13
在甲烷氯代反应生成CH3Cl的反应中,生成甲基自由基的这一步是 决定速率的步骤,是吸热反应,过渡态的结构与产物甲基自由基 相似
14
14
(三)烷烃的氯代反应
光
CH3CH2CH3 + Cl2
25℃ / CCl4
CH3CH2CH2Cl + CH3CHCH3 43%
CH3CHCH3 + Cl2 CH3
