保健食品洁净厂房空气洁净度一般分为二个等级
空气洁净度分级标准

空气洁净度空气洁净度1.空气洁净度和级别空气洁净度是洁净环境中空气含悬浮粒子量的多少的程度。
通常空气中含尘浓度低则空气洁净度高,含尘浓度高则空气洁净度低。
按空气中悬浮粒子浓度来划分洁净室及相关受控环境中空气洁净度等级,就是以每立方米空气中的最大允许粒子数来确定其空气洁净度等级。
洁净度标准的制定以前有关国家都各自制定自己的标准,但基本上都是参照美国标准FS-209的各版进行,仅单位制及命名方法有所变换或改变。
在命名上基本可分为两类:一是以单位体积空气中大于等于规定粒径的粒子个数直接命名或以符号命名,这种命名方法以美国FS-209A~E版为代表,其规定粒径为0.5μm,以空气中≥0.5μm粒径的粒子浓度采用英制pc/ft3直接命名,如标准中的100级,表示空气中≥0.5μm粒径的粒子浓度为100pc/ft3直接命名,即每立方英尺的空气中≥0.5μm粒径的粒子数量为100个,(我们平时使用的是国际单位,即通常所指的是每立方米的空气中所含≥0.5μm粒径的粒子数量,因为1立方米≈35.2立方英尺,所以我们看到标准中100级对应≥0.5μm粒径的粒子数量不是100个,而是3520个,就是这个道理)。
二是以单位体积空气中大于等于规定粒径的粒子个数以10n表示,按指数n命名空气洁净度的等级,这种命名方法以日本JISB9920为代表,其规定粒径为0.1μm,以空气中≥0.1μm粒径的粒子浓度(采用国标单位制)10npc/m3命名为n级,如该标准2级,其表示≥0.1μm粒径的粒子浓度为100pc/m3,即102pc/m3。
俄罗斯的标准亦基本上采用此种命名方法。
现在国际标准ISO14644-1已发布实施,美国标准FS-2009E亦于2001年11月宣布停止使用。
按国际标准,空气中悬浮粒子洁净度等级以序数N命名,各种被考虑粒径D的最大允许浓度Cn 可用公式确定:式中:Cn--被考虑粒径的空气悬浮粒子最大允许浓度,pc/m3。
gmp洁净abcd分级标准

药厂洁净区可分为ABCD四个级别的区域,医药工业洁净区是以微粒和微生物为主要控制对象,同时还应对其环境温湿度、压差、照度、噪声等作出规定。
医药工业洁净厂房的空气洁净度等级见GMP(2010),规定为ABCD四个等级。
那么,药厂洁净区划分ABCD 级别的标准是什么呢?
A级:高风险操作区
如:灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域须均匀送风,风速为0.36-0.54m/s (指导值)。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级:指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级和D级:指生产无菌药品过程中重要程度较低的洁净操作区。
总结:A、B相当于百级洁净区,A的背景环境要高一些,要求更严一些。
C级相当于万级洁净区,D级相当于十万级洁净区。
为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米,A级洁净区空气悬浮粒子的级别为ISO4.8,以≥5.0um的悬浮粒子为限度标准。
B级洁净区(静态)空气悬浮粒子的级别为ISO5,同时包括表中两种粒径的悬浮粒子。
对于C级洁净区(静态和动态)而言,空气悬浮粒子的级别为ISO7和ISO8。
对于D级洁净区(静态)空气悬浮粒子的级别为ISO8。
测试方法可参照ISO14644-1。
洁净度等级划分

洁净度等级划分摘要:1.洁净度等级的定义与重要性2.洁净度等级的划分标准3.洁净度等级的具体分类4.各类洁净度等级的应用领域5.洁净度等级的检测与维护正文:一、洁净度等级的定义与重要性洁净度等级,顾名思义,是指一个空间或表面所含有的尘埃、微生物等污染物的浓度。
洁净度等级是对环境洁净程度的一种量化衡量,其重要性不言而喻。
在许多行业中,如半导体制造、生物医药、食品生产等,都需要保持一个高洁净度的环境,以确保产品质量和生产效率。
二、洁净度等级的划分标准洁净度等级的划分主要依据空气中的尘埃粒子数量、粒子尺寸和空气流动速度等因素。
目前,国际上通用的洁净度等级划分标准是由美国联邦标准209E 和欧洲洁净技术协会制定的。
在我国,洁净度等级划分主要参考GB 50073-2013《洁净厂房设计规范》。
三、洁净度等级的具体分类根据不同的洁净度要求,洁净度等级可以分为以下几类:1.GMP(Good Manufacturing Practice,良好生产规范)洁净区:主要应用于制药、生物制品、医疗器械等行业,要求洁净度等级在100 级至300,000 级之间。
2.ISO 5 级洁净区:主要应用于半导体制造、精密电子制造等行业,要求洁净度等级在100 级以下。
3.10 级洁净区:主要应用于光学、航空航天、核工业等行业,要求洁净度等级在10 级以下。
4.百级洁净区:主要应用于食品生产、化妆品生产等行业,要求洁净度等级在100 级左右。
四、各类洁净度等级的应用领域各类洁净度等级在各个行业中的应用领域如下:1.GMP 洁净区:在制药、生物制品、医疗器械等行业中,需要进行药品生产、质量控制、研发等活动。
2.ISO 5 级洁净区:在半导体制造、精密电子制造等行业中,需要进行芯片生产、封装测试等活动。
3.10 级洁净区:在光学、航空航天、核工业等行业中,需要进行精密仪器制造、科研实验等活动。
4.百级洁净区:在食品生产、化妆品生产等行业中,需要进行产品生产、质量检测等活动。
保健食品良好生产规范

03
进入生产区原辅料,必须经过物料通道进入。凡进入洁净车间的物料必须除去外包装,若外包装脱不掉则要擦洗干净或换成室内包装桶。
各项工艺参数符合工艺规程要求。 (*) 生产用的食品容器、包装材料、洗涤剂、消毒剂应要索证,符合相关卫生标准。并有检验验收记录。
1
2
直接接触产品的内包装材料(玻璃瓶、塑料瓶、瓶盖等)均应采取适当方法清洗、干燥、灭菌,灭菌。
03
洁净车间人流入口通过程序:脱鞋 —穿过渡鞋—脱外衣—穿工鞋、衣—洗手—穿洁净工作衣—手消毒。人员出入有制度和记录。
原料前处理场所(如提取、浓缩等)与其生产规模和工艺要求相适应,有通风、除尘、降温设施,并不得与成品生产使用同一生产厂房。
洁净厂房空气净化设施(初效、中效、高效过滤器)、设备定期检修更换,有制度、纪录。
有与生产保健食品相适应的具有医药学(或生物学、食品科学)等相关专业知识的技术、管理人员,技术人员的比例应不低于职工总数的5%。
主管技术的企业负责人必须具有大专以上或相应的学历,并具有保健食品生产及质量、卫生管理 2年以上的经验。
生产和品质管理人员要求
生产和品质管理部门的负责人能够按GMP的要求对保健食品生产和品质管理中出现的问题作出正确的处理。 (*)
保健食品生产企业必须有专职的质检人员,质检人员必须具有中专以上学历。
采购人员应掌握鉴别原料质量、卫生等知识和技能。
从业人员上岗前必须经过卫生法规、卫生知识培训,并建立培训及考核档案(**)。
01
企业负责人及生产、品质管理部门负责人应接受省级以上卫生监督部门有关保健食品的专业培训,并取得合格证书(*)。
运输工具专用,符合卫生要求。
成品仓库有收、发货检查制度和入出库记录。
(整理)空气洁净度标准和级别

空气洁净度1.空气洁净度标准和级别空气洁净度是洁净环境中空气含悬浮粒子量的多少的程度。
通常空气中含尘浓度低则空气洁净度高,含尘浓度高则空气洁净度低。
按空气中悬浮粒子浓度来划分洁净室及相关受控环境中空气洁净度等级,就是以每立方米空气中的最大允许粒子数来确定其空气洁净度等级。
洁净度标准的制定以前有关国家都各自制定自己的标准,但基本上都是参照美国标准FS-209的各版进行,仅单位制及命名方法有所变换或改变。
在命名上基本可分为两类:一是以单位体积空气中大于等于规定粒径的粒子个数直接命名或以符号命名,这种命名方法以美国FS-209A~E版为代表,其规定粒径为0.5μm,以空气中≥0.5μm粒径的粒子浓度采用英制pc/ft3直接命名,如标准中的 100级,表示空气中≥0.5μm粒径的粒子浓度为100pc/ft3直接命名,即每立方英尺的空气中≥0.5μm粒径的粒子数量为100个,(我们平时使用的是国际单位,即通常所指的是每立方米的空气中所含≥0.5μm粒径的粒子数量,因为1立方米≈35.2立方英尺,所以我们看到标准中100级对应≥0.5μm粒径的粒子数量不是100个,而是3520个,就是这个道理)。
二是以单位体积空气中大于等于规定粒径的粒子个数以10n表示,按指数n 命名空气洁净度的等级,这种命名方法以日本JISB9920为代表,其规定粒径为0.1μm,以空气中≥0.1μm粒径的粒子浓度(采用国标单位制)10n pc/m3命名为n级,如该标准2级,其表示≥0.1μm粒径的粒子浓度为100 pc/m3,即102pc/m3。
俄罗斯的标准亦基本上采用此种命名方法。
现在国际标准ISO14644-1已发布实施,美国标准FS-2009E亦于2001年11月宣布停止使用。
按国际标准,空气中悬浮粒子洁净度等级以序数N命名,各种被考虑粒径D 的最大允许浓度Cn可用公式确定:式中:Cn--被考虑粒径的空气悬浮粒子最大允许浓度,pc/m3。
洁净室(无菌室)分级
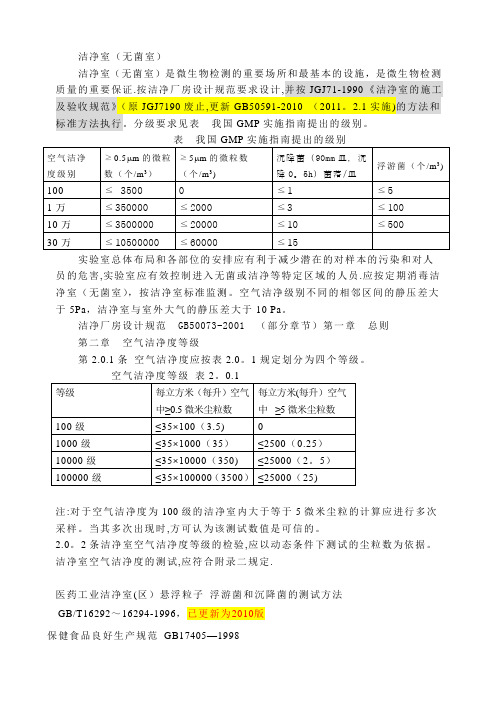
洁净室(无菌室)洁净室(无菌室)是微生物检测的重要场所和最基本的设施,是微生物检测质量的重要保证.按洁净厂房设计规范要求设计,并按JGJ71-1990 《洁净室的施工及验收规范》(原JGJ7190废止,更新GB50591-2010 (2011。
2.1实施)的方法和标准方法执行。
分级要求见表我国GMP实施指南提出的级别。
实验室总体布局和各部位的安排应有利于减少潜在的对样本的污染和对人员的危害,实验室应有效控制进入无菌或洁净等特定区域的人员.应按定期消毒洁净室(无菌室),按洁净室标准监测。
空气洁净级别不同的相邻区间的静压差大于5Pa,洁净室与室外大气的静压差大于10 Pa。
洁净厂房设计规范 GB50073-2001 (部分章节)第一章总则第二章空气洁净度等级第2.0.1条空气洁净度应按表2.0。
1规定划分为四个等级。
注:对于空气洁净度为100级的洁净室内大于等于5微米尘粒的计算应进行多次采样。
当其多次出现时,方可认为该测试数值是可信的。
2.0。
2条洁净室空气洁净度等级的检验,应以动态条件下测试的尘粒数为依据。
洁净室空气洁净度的测试,应符合附录二规定.医药工业洁净室(区)悬浮粒子浮游菌和沉降菌的测试方法GB/T16292~16294-1996,已更新为2010版保健食品良好生产规范GB17405—1998网上资料洁净室是一个超级洁净的环境,它不但要控制通风、过滤、温度、湿度、气压以及离子化等,还要同时对环境内的材料和其他参数进行控制。
洁净室的洁净度决定于空气中的悬浮微粒数量,微粒的首要计量单位是微米,即10—6米,大致相当于0。
000039英寸。
洁净室级别划分最为通行使用的方法来自ISO14644标准。
该标准以每立方米空气中0.1微米的微粒来划分洁净室级别,它取代了过去的美国国家标准209-1992(详见表1),而后者是以每立方英尺空气中0.5微米的微粒数来划分洁净级别的。
按照这两个标准规定,209标准中的100级洁净室中每立方英尺空气中大于等于的0.5微粒数不能超过100个,此级别相当于ISO14644标准中的5级洁净室。
无尘车间等级之间的划分及等级标准

无尘车间的发展与现代工业、尖端技术紧密的联系在一起。
目前在生物制药、医疗卫生、食品日化、电子光学、能源、精密器械等行业运用已经相当的普遍且成熟。
无尘车间分为几个等级,分别为1级≥百级级≥千级级≥万级≥十万级≥百万级,越排在前面,级别越高,1级是级别最高的。
最常见的是百级到十万级,不同等级还有着不同的等级标准。
一、空气洁净度等级洁净空间单位体积空气中,以大于或等于被考虑粒径的粒子最大浓度限值进行划分的等级标准。
国内按空态、静态、动态对无尘车间进行测试、验收,符合《GB50073-2013 洁净厂房设计规范》、《GB50591-2010 洁净室施工及验收规范》。
洁净度和控制污染的持续稳定性,是检验无尘车间质量的核心标准,该标准根据区域环境、洁净程度等因素,分为若干等级,常用的有国际标准和国内区域行业标准。
中国GMP(2010年修订)新版GMP附录1 无菌药品.第三章.第九条……洁净区各级别空气悬浮粒子的标二、无尘车间(洁净室)等级说明等级定义的模式如下:Class X (at Y μm )其中X是无尘室的等级,例如100或10000等等,Y是粒径如0.2μm , 0.5μm 等,可复选。
意思就是使用者规定,该无尘室微粒含量,在这些粒径必须满足该等级的限度。
这样可以减少纷争,以下是几个例子:Class1 (0.1μm, 0.2μm , 0.5μm)Class 100(0.2μm , 0.5μm )Class 100(0.1μm, 0.2μm , 0.5μm )在Classes 100 (M3.5) and Greater (Class 100,1000,10000....),一般看一个粒径即可。
在Classes Less than 100 (M3.5) (Class 10,1.... ),一般要看多几个粒径。
第二个技巧是规定无尘室的状态,例如:Class X (at Y μm ),At-rest供货商就很清楚知道无尘室要在At-rest状态下验收。
药品GMP洁净室车间空气洁净度等级要求

GMP洁净车间空气洁净度等级,“药品生产质量管理规范”(GMP)中规定:药品生产的洁净厂房内的生产环境参数如:温度和相对湿度以及压差等均是由生产工艺决定的,一般温度为18℃~24℃,相对湿度为45%~65%。
在“药品生产质量管理规范”(GMP)的实施指南中规定的比较具体。
即药品生产洁净厂房中的温度和相对湿度是以穿洁净工作服的操作人员不产生不舒服、不舒适为基准的。
无菌药品的生产所需的洁净区可以分为四个级别A 级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B 级:指无菌配制和灌装等高风险操作A 级洁净区所处的背景区域。
C 级和D 级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准与ISO14644-1中洁净度等级(以≥0.5μm和≥5μm 的悬浮粒子为限度标准)的关系制药GMP车间洁净度等级要求洁净区空气悬浮粒子的标准(用尘埃粒子计数器检测)洁净度等级空气中悬浮粒子最大允许浓度(个/m3)静态动态≥0.5 µm≥5.0 µm≥0.5 µm≥5.0 µmA级352020352020B级3520293520002900C级3520002900352000029000D级352000029000不作规定不作规定洁净区微生物监测的动态等级标准(可用浮游菌采样器检测)洁净度等级浮游菌cfu/m3沉降菌(φ90 mm)cfu/4h表面微生物接触(φ55 mm)cfu/碟5指手套cfu/手套A级<1<1<1<1B级10555C级1005025/D级20010050/注:此表摘自《药品生产质量管理规范2010版》● 洁净度A级用于高风险作业区,如:灌装区、放胶塞区、敞口包装容器区和无菌装配区等区域。
2010新版GMP洁净区(室)空气洁净度等级

2010新版GMP洁净区(室)空气洁净度等级,“药品生产质量管理规范”(GMP)中规定:药品生产的洁净厂房内的生产环境参数如:温度和相对湿度以及压差等均是由生产工艺决定的,一般温度为18℃~24℃,相对湿度为45%~65%。
在“药品生产质量管理规范”(GMP)的实施指南中规定的比较具体.即药品生产洁净厂房中的温度和相对湿度是以穿洁净工作服的操作人员不产生不舒服、不舒适为基准的.无菌药品的生产所需的洁净区可以分为4个级别:2010新版GMP洁净区等级划分A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36—0。
54m/s(指导值).应当有数据证明单向流的状态并经过验证.在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区中国GMP(2010修订)2010年版GMP附录1 无菌药品,第三章,第九条……洁净区各级别空气悬浮粒子的标准规定如下表:新版GMP洁净度等级A、B、C、DA级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%操作区的风速:水平风速≥0.54m/s垂直风速≥0.36m/s高效过滤器的检漏大于99。
97%照度:>300lx—600lx噪音:≤75db(动态测试)B级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h 压差:B级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。
高效过滤器的检漏大于99。
97%照度:>300lx-600lx噪音:≤75db(动态测试)C级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h 压差:C级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。
洁净室空气洁净度的级别——中国国家标准和有关规范

洁净室空气洁净度的级别——中国国家标准和有关规范SICOLAB整理!1、《空气洁净技术措施》我国于1979年3月由国家建委科教局批准实施的《空气洁净技术措施》,是我国正式公布的第1个洁净技术方面的文件,把洁净室的含尘浓度按每升环境空气中所含粒子数量,分为5个级别,即3级、30级、300级、3000级和30000级。
各级分别是每升空气中含粒径≥0·5μm的尘粒平均数不超过3粒、30粒、300粒、3000粒和30000粒。
该技术措施正式公布后,由于与实践中通常采用的“美国联邦标准209”在级别的表示方法上完全不同,使人们不习惯,所以未被真正实施和推广。
但我国一些版本的药剂学、工业药剂学、制药工程教材都采用了这一标准。
2、《洁净厂房设计规范》GBJ73-84这是中华人民共和国国家标准,这个标准参照美国联邦FS209标准,按每立方米(每升)空气中≥0·5μm微粒数的多少,将洁净度级别划分为4个等级,即100、1000、10000、100000级。
3、《药品生产质量管理规范》(GMP)1992年,卫生部制订的GMP和中国医药工业公司的GMP,是参照美国联邦标准FS209B 和国家标准GBJ73-84,将洁净度划分为4个等级(100级、1万级、10万级、30万级),100、1万、10万级别的无生命微粒规定与GBJ73-84一致,另外还对有生命微粒的含量作了规定。
1998年,对GMP进行了修订,称为《药品生产质量管理规范》(GMP),附录中空气洁净度级别划分仍为4个等级。
这个规范作为医药行业生物洁净室的标准一直沿用到今天。
2007-04-18,我国组织修订1998年版的GMP,第三讨论稿正文已在网上发布。
现在,国家食品药品监督管理局药品安全监管司《关于对药品GMP专家修订稿进行评估论证的函》已在网上公布,广泛征求意见,讨论稿附录中将空气洁净度级别分为A、B、C、D 4个等级。
4、《洁净厂房设计规范》GB50073-20012001年,根据国际化组织ISO关于空气净化制定的国际标准ISO14644-1:1999,公布了《洁净厂房设计规范》,代替国家标准GBJ73-84。
保健食品生产企业卫生知识培训题及答案

保健食品生产企业从业人员卫生知识培训题及答案保健食品生产企业从业人员卫生知识培训题一、单项选择题:在每小题列出的四或五个选项中有一个选项是最符合题目要求的,请将正确选项的字母填在括号内。
总70题。
1、保健食品良好生产规范本标准由中华人民共和国()提出。
A、国务院B、卫生部C、食品卫生监督检验所D、质量技术监督管理局2、保健食品良好生产规范规定了对生产具有特定保健功能食品企业的人员、()以及品质和卫生管理方面的基本技术要求。
A、设计与设施B、原料C、生产过程D、成品贮存与运输 E以上均是3、保健食品原料是指保健食品生产过程中使用的所有投入物,包括()。
A、加工助剂B、食品添加剂C、加工助剂和食品添加剂D、生产设备4、保健食品中所称批号用于识别“批”的一组数字或字母加数字。
用之可以追溯和审查该批保健食品的()。
A、质量B、生产历史C、生产厂家D、保质期限5、保健食品生产企业必须具有与所生产的保健食品相适应的具有()等相关专业知识的技术人员和具有生产及组织能力的管理人员。
A、医药学B、生物学C、食品科学D、以上均是6、保健食品生产企业中的专职技术人员的比例应不低于职工总数的()。
A、1%B、2%C、5%D、10%7、保健食品生产企业中的主管技术的企业负责人必须具有()以上或相应的学历,并具有保健食品生产及质量、卫生管理的经验。
A、初中B、高中C、大专D、本科8、保健食品生产和品质管理部门的负责人必须是()人员A、专职B、兼职C、专职或者兼职D、投资9、保健食品生产企业必须有专职的质检人员。
质检人员必须具有()以上学历A、初中B、中专C、大专D、本科10、保健食品生产企业从业人员上岗前必须经过(),企业应建立培训及考核档案A、卫生法规教育B、相应技术培训C、卫生法规教育及相应技术培训D、卫生法规教育或相应技术培训11、保健食品生产企业负责人及生产、品质管理部门负责人应接受()级以上卫生监督部门有关保健食品的专业培训,并取得合格证书。
医药洁净室的标准

GMP对洁净厂房的标准GMP的厂房设施原则:1)、空间面积适应生产需要,布局合理。
2)、能有效控制差错和污染。
3)、便于维护和清洁。
一,企业的生产环境应整洁;厂区地面、路面及运输等不应对药品生产造成污染;生产、行政、生活和辅助区总体布局应合理,不得互相妨碍。
●地面、路面硬化;绿化不起尘;设物流运输通道。
●生产区与生活区分开(倒班宿舍、工间食堂与行政管理为生产服务施,可设在行政区)。
●总布局洁净厂房置上风向,锅炉、提取、生物脏器处理、动物房等置下风向;危险品、化学品库独立设置。
二,厂房应按生产工艺流程及所要求的空气洁净度级别进行合理布局。
●厂房内按工艺中物流最短路线,顺流布局。
●辅助间位置合理,洁净生产区的级别划分应符合GMP附录的要求,布局尽可能做到“同一级别集中在同一个区,同一个级别在同一个平面。
”三,同一厂房内的生产操作和相邻厂房之间的生产操作不得相互防碍。
●厂房按洁污合理分隔(高致敏类产品设专用厂房;毒、麻类产品厂房;激素类、抗肿瘤类产品厂房;生物制品、血液制品厂房设专用车间或专用厂房)●厂房内应按工序合理分隔操作间原则:1)、对产尘、产湿及工艺对温、湿度有特殊要求的操作工序作重点分隔;2)、同一操作间内不得同时进行不同批次产品的生产操作。
四,厂房应有防止昆虫和其它动物进入的有效设施。
●厂房直通外界的门、窗设有防止昆虫、动物进入的有效设施●(防止进入有效设施:档鼠板h≥30mm、电驱鼠(20m有效)、风帘、金属沙窗、粘鼠胶×、鼠药×、捕鼠器×、灭蚊器)。
●厂房≠仓库1,洁净室(区)的内表面应平整光滑、无裂缝、接口严密、无颗粒物脱落、耐受清洗和消毒。
2,洁净室(区)的墙壁与地面的交界处应成弧形或采取其他措施,以减少积聚和便于清洁。
3,洁净室(区)的窗户、天棚及进入室内的管道、风口、灯具与墙壁或天棚的连接部位应密封。
●对洁净室(区)内表面要求:墙面、地面平整无缝、光滑耐磨、易清洁。
药厂洁净区划分ABCD

C级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h压差:C级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。高效过滤器的检漏大于99.97%照度:>300lx-600lx噪音:≤75db(动态测试)
D级洁净区洁净操作区的空气温度应为 18-26℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥15次/h压差:100,000级区相对室外≥10Pa,高效过滤器的检漏大于99.97%照度:>300lx-600lx所处的背景区域。
C级和D级:指生产无菌药品过程中重要程度较低的洁净操作区。 洁净度级别悬浮粒子最大允许数/m³静态动态≥0.5μm≥5μm≥0.5μm≥5μmA级352020352020B级3520293520002900C级3520002900352000029000D级352000029000不作规定不作规定
药厂洁净区划分ABCD
导读:药厂洁净区划分ABCD,医药工业洁净室和洁净区是以微粒和微生物为主要控制对象,同时还应对其环境温度、湿度、GMP (2010)压差、照度、噪声等作出规定。
医药工业洁净厂房的空气洁净度等级的划分见GMP(2010),规定为ABCD四个等级药厂洁净区划分ABCD:
A级:高风险操作区,如:.灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。通常用层流操作台(罩)来维持该区的环境状态。层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。应有数据证明层流的状态并须验证。在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
保健食品洁净厂房空气洁净度一般分为二个等级

辅助区(清洗、清洁工具、工作服洗涤等)
中间库(分散、集中) 工程区(机房、配电) 质检区 人物流通道、人员净化用室、物料净化用室。
1、仓储区
(1)仓储区必须有足够的面积和空间, 分别按物料的种类(原料、辅料、包装 材料、成品)、状态(待检、合格和不 合格)分别存放。有条件应将仓库作成 高架仓库。 (2)要求库内整洁、干燥、通风良好, 并维持在认可的温度、湿度限度之内。 (3)入口应设缓冲,防虫、鼠及尘土进
100万 250万 500~1000万 1500~3000万
厕 厕 所 所
浴 浴 室 室 洗 手
手
消 穿工 洁作 净服 毒
进 出
换 鞋
脱 外 衣
气空 闸气 室吹 或淋 室
洁 净 生
产
区
2、物料净化 生产中使用的原辅料、包装材料及 容器具等,进入洁净区前应有效地 清除外表面沾染的微粒和微生物。 物料净化用室应包括外包装清理室、 气闸室或传递窗(柜)。物料在外 包装清理室拆除外包装,装入洁净 容器内备用。外包装不能清除的应 清除或擦拭外包装上的尘土。
(四)人员与物料净化通道和设施 1、人员净化 2、物料净化
洁净室内微粒来源分析
7% 35%பைடு நூலகம்
8% 从空气中漏入 从原料中带入 从设备运转中产生 从生产过程中产生 由人员因素造成
25%
25%
人员动作时的发尘数
动作状态 没动作 轻微动作 发尘数 (粒径0.3~1μm)个/ 分 .人 10万 50万
全身动作 坐下、站起 行走60~120米/分 跳跃
2、GMP在国际的发展历史
食品GMP是从药品GMP中发展起来的。美 国 FDA 于 1963 年颁布了世界上第一部药品 的“良好操作规范( GMP )”,实现了药 品从原料开始直到成品出厂的全过程质量 控制。 1969 年 FDA 制定了“食品良好生产 工艺基本法”,从此开创了食品 GMP 的新 纪元。
药厂洁净区划分ABCD

药厂洁净区划分ABCD药厂洁净区划分ABCD导读:药厂洁净区划分ABCD,医药工业洁净室和洁净区是以微粒和微生物为主要控制对象,同时还应对其环境温度、湿度、GMP (2010)压差、照度、噪声等作出规定。
医药工业洁净厂房的空气洁净度等级的划分见GMP(2010),规定为ABCD四个等级药厂洁净区划分ABCD:A级:高风险操作区,如:.灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级:指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级和D级:指生产无菌药品过程中重要程度较低的洁净操作区。
洁净度级别悬浮粒子最大允许数/m³静态动态≥0.5μm≥5μm≥0.5μm≥5μmA级352020352020B级3520293520002900C级3520002900352000029000D级352000029000不作规定不作规定A、B相当于百级,A的背景环境要高一些,要求更严一些。
C级相当于万级D 级相当于十万级制药厂ABCD洁净区环境要求A级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%操作区的风速:水平风速≥0.54m/s 垂直风速≥0.36m/s高效过滤器的检漏大于99.97%照度:>300lx-600lx噪音:≤75db(动态测试)B级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h 压差:B级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。
高效过滤器的检漏大于99.97%照度: >300lx-600lx噪音:≤75db(动态测试)C级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h 压差:C级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(二)车间洁净分区 车间内应按生产工艺和卫生、质量 要求,划分洁净级别。原则上应分 为一般生产区、 30 万级区、 10 万级 区。
1、根据《保健食品良好生产规范审查方法和评价准 则》保健食品生产的洁净级别:
固体保健食品:片剂、胶囊剂、丸剂、颗粒剂、散 剂等固体制剂按三十万级要求。
液体保健食品:口服液、糖浆液、饮料等最终产品 可灭菌的按三十万级的要求,最终产品不灭菌的按 十万级的要求。 特殊保健食品如益生菌类等产品为十万级。酒类产 品应有良好的除湿、排风、除尘、降温等设施,人 员、物料进出及生产操作应参照洁净室(区)管理。
二、保健食品生产企业厂房设计与设施要求
根据《保健食品良好生产规范》,一个符合标准的保健食品生 产企业,必须符合下列各项要求: 训练有素的——生产人员、管理人员 合适的—— 厂房与设施 合格的—— 原材料、包装材料 GMP 严谨的—— 生产过程管理
可靠的—— 成品贮存与运输
完善的—— 品质管理(机构、制度、测量手段) 良好的—— 卫生管理
(一)总体设计与厂房布局
保健食品厂的总体设计应符合下列 要求:
1、远离严重污染源
新建、迁建或改建时,将厂址选择在环境良 好,周围无严重污染源的地方,这是建设保 健食品洁净厂房的必要前提。
国内室外大气含尘浓度
含尘浓度 (≥0.5μm微粒个/m3 ) 工业区 (15-35)×107 (8-20)×107 (4-8)×107 含菌浓度 (微生物个/m3) (2.5-5)×104 (0.1-7)×104 <0.1×104
2、厂房洁净级别及换气次数见下表
空气洁 净度等 级 10000级
含尘浓度 含菌浓度
尘粒数 尘粒 粒径 (个/m3) (μm)
≥0.5 ≥5 ≤350,000 ≤20,00
≤3,500,000
沉降 浮游 菌 菌 (φ9cm (个/m3) 碟0.5h)
≤3 ≤100
换气 次数 (次/h)
≥25
100000 级
2、GMP在国际的发展历史
食品GMP是从药品GMP中发展起来的。美 国 FDA 于 1963 年颁布了世界上第一部药品 的“良好操作规范( GMP )”,实现了药 品从原料开始直到成品出厂的全过程质量 控制。 1969 年 FDA 制定了“食品良好生产 工艺基本法”,从此开创了食品 GMP 的新 纪元。
市 郊
农 村
2、水源丰富,水质要好 3、交通运输要方便 4、能源要有保障 5、地形、地质等要符合要求
在保健食品企业总图布置中应注意几个原则:
1 、全厂总图布置应该符合生产工艺流程的需要,生 产作业线要短,并尽可能减少生产线的迂回或交叉。 同一厂房和邻近厂房进行的各项生产操作不得相互妨 碍。
2 、要妥善处理厂区内洁净厂房与非洁净厂房以及其 他严重污染源之间的相对位置。
3 、洁净厂房之间,由于产品各具特点,它们的相对 位置也应予以合理安排。 4 、符合消防安全要求。厂房间距、道路等应符合 《建筑设计防火规范》的要求。
5、安排好全厂的人员路线和货流路线,人流与货流应有不同 的出入口,避免人货混杂交叉。全厂水、电、汽、制冷等公 用工程系统的各类负荷中心要与供应来源靠近,使能量损失 最小,供应管线最短。 6、应考虑到今后工厂生产的发展。新产品的开发以及综合利 用的可能性等多种因素,为工厂发展留有余地。 7、要尽可能采用集中式布置方式,合理组合厂房。 8、绿化 厂房周围应绿化,采用组合厂房,可空出面积搞绿化。 对于绿化系数,地方和开发区都有指标,一般应为30.
对于保健食品:
卫生部1998年5月颁布国标《保 健 食 品 良 好 生 产 规 范 》 (GB174Fra bibliotek5-1998)。
卫生部2003年4月颁布《保健食 品良好生产规范审查方法和评 价准则》。
除《保健食品良好生产规范》外,卫生 部还颁布了《食品企业通用卫生规范》 (GB14881-94)和罐头厂、白酒厂、啤 酒厂、酱油厂、食醋厂、食用植物油厂、 蜜饯厂、乳品厂、肉类加工厂、饮料厂、 葡萄酒厂、果酒厂、黄酒厂、面粉厂、 饮用天然矿泉水厂、膨化食品厂等卫生 规范或良好生产规范。
3、我国GMP的发展历程
我国GMP体系首先在药品生产企业 中执行,继而扩展到保健食品的生 产。
对于药品:
中国医药工业公司: 1982年《药品生产管理规范(试行本)》 《药品生产管 理规范》(1985)、《药品生产管理规范实施指南》(1985)
《药品生产管理规范实施指南》(1992)
卫生部(国家药品监督管理局): 1988年3月《药品生产质量管理规范》 《药品生产质量管理规范》(1992年修订本) 《药品生产质量管理规范》(1998年修订)
保健食品生产企业厂房 设计与设施要求
我国《保健食品良好生产规范》 (简称《保健食品 GMP 》 1998 年颁布, 1999 年实施,它是为 保障保健食品安全、质量而制 定的贯穿于生产全过程中的一 系列措施、方法和技术要求。
一、GMP的基本概念及发展历程 1、基本概念
GMP是英文Good Manufacturing Practice 的缩写,中 文为“良好生产规范”。是在生产过程中特别注重食 品卫生安全管理的规程。GMP要求企业从人员、设计 与设施、原料、生产过程、成品贮存与运输、品质管 理等方面按国家有关法规达到卫生质量要求,形成一 套可操作的行为规范,改善卫生环境、及时发现生产 过程中的问题并加以改善。
300000 级
≥0.5
≥5 ≥0.5 ≥5
≤10
≤500
≥15
≤20,000
≤10000000
≥12
≤61800
(三)车间布置 l l 车间体型 有窗厂房和无窗厂房的考虑
l 车间布置要点: 1、 按工艺流程安排布置,合理安排各功能 区的关系。 2 、合理安排设备和材料,使之能有条不紊 地进行工作,防止混杂和交叉污染,防止遗漏 任何生产操作和控制步骤的事故发生。 3 、洁净级别相同的房间尽量组合在一起 (有利于风管布置,人、物流走向合理)。 4 、洁净级别和卫生要求不同的房间联系要有 防污染措施(气闸、传递柜、缓冲间等)。
5、合理安排人流、物流,应控制无关人员和 物料输送不得通过正在操作区。 6、全车间人流、货流入口应尽量减少,这样 有利于控制全车间的洁净度。 7、安排好各种暗敷管道的走向及竖井的布置。 8、合理存放待处理的不合格原材料和半成品。
