(完整word版)甲基化检测方法(亚硫酸氢盐修饰后测序法)
甲基化测序

DNA甲基化检测实验一、重亚硫酸盐的测序法实验流程(BSP)(Bisulfite Genomic Sequence)原理:结合重亚硫酸盐的测序法是一种灵敏的能直接检测分析基因组DNA甲基化模式的方法。
重亚硫酸盐处理后,用针对改变后的DNA序列设计特异性引物并进行聚合酶链式反应(PCR)。
PCR产物中原先非甲基化的胞嘧啶位点被胸腺嘧啶所替代,而甲基化的胞嘧啶位点保持不变。
PCR产物克隆后进行测序。
通过这个方法能得到特定位点在各个基因组DNA 分子中的甲基化状态。
该方法特点是:•特异性高,它能够提供特异性很高的分析结果,这是所有其他研究甲基化的分析方法所不能比拟的;•灵敏度高,可以用于分析少于100个细胞的检测样品。
用微量的基因组DNA进行分析就能得到各个DNA分子精确的甲基化位点分布图。
重亚硫酸盐测序法技术实验流程A.DNA制备用DNA抽提试剂盒(Promega, cat. no. A1125)抽提组织,细胞培养物,石蜡包埋组织切片样品中的基因组DNA。
B.重亚硫酸盐处理C.DNA纯化用Wizard DNA clean-up kit (Promega, cat. no. A7280)纯化重亚硫酸盐处理后的DNA样品。
D.PCR扩增E.PCR产物琼脂糖电泳后回收纯化F.PCR产物连接到pMD19-T (Takara) 载体中克隆及测序。
G.用分析软件对各样本测序结果进行甲基化程度分析二、甲基化特异性的PCR实验流程(methylation-specific PCR, MSP)原理:甲基化特异性的PCR是一种灵敏度高且操作相对简单的甲基化研究方法。
重亚硫酸盐处理DNA后,基因组DNA发生的由甲基化状态决定的序列改变。
随后进行引物特异性的PCR。
该方法引物设计是关键。
MSP中设计两对引物,即一对结合处理后的甲基化DNA链(引物对M),另一对结合处理后的非甲基化DNA链(引物对U)。
检测MSP扩增产物,如果用引物M能扩增出片段,则说明检测位点存在甲基化;若用引物U扩增出片段,则说明被检测的位点不存在甲基化(图3)。
二代测序检测甲基化的方法

二代测序检测甲基化的方法二代测序是一种高通量测序技术,可以快速、精准地分析DNA序列。
甲基化是一种重要的表观遗传修饰方式,可以对基因表达和细胞功能产生重要影响。
因此,通过二代测序检测甲基化状态成为了研究人员关注的焦点。
本文将介绍基于二代测序的甲基化检测方法。
一、甲基化的检测原理甲基化是指在DNA分子中加入甲基基团,可以影响DNA的结构和功能。
为了检测DNA中的甲基化状态,研究人员通常采用亚硫酸氢盐处理和二代测序相结合的方法。
亚硫酸氢盐可以将未甲基化的胞嘧啶(C)转化为尿嘧啶(U),而甲基化的胞嘧啶不受影响。
通过测序分析DNA中的U和C的比例,就可以确定DNA中的甲基化状态。
二、甲基化检测的实验流程1. DNA提取:从待检测的细胞或组织中提取DNA样本,保证样本的纯度和完整性。
2. 亚硫酸氢盐处理:将DNA样本与亚硫酸氢盐溶液反应,将未甲基化的C转化为U。
3. 文库构建:将经过亚硫酸氢盐处理的DNA样本进行文库构建,包括DNA片段的断裂、连接、文库扩增等步骤。
4. 二代测序:使用二代测序技术对DNA文库进行高通量测序,获得原始测序数据。
5. 数据分析:对原始测序数据进行质控、去除低质量序列和接头序列,然后将剩余的序列与参考基因组进行比对。
6. 甲基化位点鉴定:根据比对结果,统计序列中U和C的比例,确定甲基化位点的甲基化水平。
三、甲基化检测的数据分析甲基化检测的数据分析是整个过程中最关键的一步。
主要包括质控、比对、甲基化位点鉴定和甲基化水平分析等。
1. 质控:对原始测序数据进行质量控制,去除低质量的序列以及接头序列。
这一步骤可以保证后续分析的准确性和可靠性。
2. 比对:将质控后的序列与参考基因组进行比对。
通过比对可以确定序列的位置信息,为后续的甲基化位点鉴定提供基础。
3. 甲基化位点鉴定:根据比对结果,统计序列中U和C的比例。
如果某个位点的U和C比例明显偏差,即可判定该位点存在甲基化。
4. 甲基化水平分析:根据甲基化位点的甲基化水平,可以分析不同位点的甲基化状态。
(完整版)甲基化检测方法(亚硫酸氢盐修饰后测序法)

甲基化检测方法(亚硫酸氢盐修饰后测序法)第一部分基因组DNA的提取。
这一步没有悬念,完全可以购买供细胞或组织使用的DNA提取试剂盒,如果实验室条件成熟,自己配试剂提取完全可以。
DNA比较稳定,只要在操作中不要使用暴力,提出的基因组DNA应该是完整的。
此步重点在于DNA的纯度,即减少或避免RNA、蛋白的污染很重要。
因此在提取过程中需使用蛋白酶K及RNA酶以去除两者。
使用两者的细节:1:蛋白酶K可以使用灭菌双蒸水配制成20mg/ml;2:RNA酶必须要配制成不含DNA酶的RNA酶,即在购买市售RNA酶后进行再处理,配制成10mg/ml。
否则可能的后果是不仅没有RNA,连DNA也被消化了。
两者均于-20度保存。
验证提取DNA的纯度的方法有二:1:紫外分光光度计计算OD比值;2:1%-1.5%的琼脂糖凝胶电泳。
我倾向于第二种方法,这种方法完全可以明确所提基因组DNA的纯度,并根据Marker的上样量估计其浓度,以用于下一步的修饰。
第二部分亚硫酸氢钠修饰基因组DNA如不特别指出,所用双蒸水(DDW)均经高压蒸汽灭菌。
1:将约2ugDNA于1.5mlEP管中使用DDW稀释至50ul;2:加5.5ul新鲜配制的3M NaOH;3:42℃水浴30min;水浴期间配制:4:10mM对苯二酚(氢醌),加30ul至上述水浴后混合液中;(溶液变成淡黄色)5:3.6M亚硫酸氢钠(Sigma,S9000),配制方法:1.88g亚硫酸氢钠使用DDW稀释,并以3M NaOH滴定溶液至PH 5.0,最终体积为5ml。
这么大浓度的亚硫酸氢钠很难溶,但加入NaOH后会慢慢溶解,需要有耐心。
PH一定要准确为5.0。
加520ul至上述水浴后溶液中。
6:EP管外裹以铝箔纸,避光,轻柔颠倒混匀溶液。
7:加200 ul 石蜡油,防止水分蒸发,限制氧化。
8:50℃避光水浴16h。
一般此步在4pm开始做,熟练的话不到5pm即可完成,水浴16h正好至次日8am 以后收,时间上很合适。
甲基化原理及方法

甲基化检测方法(亚硫酸氢盐修饰测序法)基本原理在于:样本经亚硫氢酸盐处理后,甲基化的胞嘧啶(C)保持不变,但非甲基化的胞嘧啶被转化成脲嘧啶,因此在利用该处理产物作为模板的PCR产物中,甲基化的胞嘧啶还是胞嘧啶,但非甲基化胞嘧啶变成了脲嘧啶(胸腺嘧啶),此时检测到的胞嘧啶(C)即是样品中本身的甲基化位点.第一部分基因组DNA的提取。
DNA提取试剂盒,如果实验室条件成熟,自己配试剂提取完全可以。
DNA比较稳定,只要在操作中不要使用暴力,提出的基因组DNA应该是完整的。
此步重点在于DNA的纯度,即减少或避免RNA、蛋白的污染很重要。
因此在提取过程中需使用蛋白酶K及RNA酶以去除两者。
使用两者的细节:1:蛋白酶K可以使用灭菌双蒸水配制成20mg/ml;2:RNA酶必须要配制成不含DNA酶的RNA酶,即在购买市售RNA酶后进行再处理,配制成10mg/ml。
否则可能的后果是不仅没有RNA,连DNA也被消化了。
两者均于-20度保存。
验证提取DNA的纯度的方法有二:1:紫外分光光度计计算OD比值;2:1%-1.5%的琼脂糖凝胶电泳。
我倾向于第二种方法,这种方法完全可以明确所提基因组DNA的纯度,并根据Marker的上样量估计其浓度,以用于下一步的修饰。
第二部分亚硫酸氢钠修饰基因组DNA如不特别指出,所用双蒸水(DDW)均经高压蒸汽灭菌。
1:将约2ugDNA于1.5mlEP管中使用DDW稀释至50ul;2:加5.5ul新鲜配制的3M NaOH;3:42℃水浴30min;水浴期间配制:4:10mM对苯二酚(氢醌),加30ul至上述水浴后混合液中;(溶液变成淡黄色)5:3.6M亚硫酸氢钠(Sigma,S9000),配制方法:1.88g亚硫酸氢钠使用DDW稀释,并以3M NaOH滴定溶液至PH 5.0,最终体积为5ml。
这么大浓度的亚硫酸氢钠很难溶,但加入NaOH后会慢慢溶解,需要有耐心。
PH一定要准确为5.0。
加520ul至上述水浴后溶液中。
甲基化检测原理及步骤

DNA亚硫酸氢盐修饰和纯化操作步骤修饰设计:使用CpGenome TM kit使胞嘧啶转化为尿嘧啶的步骤如下。
中等温度碱性pH下使DNA变性成为单链形式暴露出碱基。
试剂一,一种包含亚硫酸氢根的钠盐,可使未甲基化的胞嘧啶磺化和水解脱氨,产生一种尿嘧啶磺酸盐中间产物。
然后DNA在另一种盐﹙试剂二﹚存在的条件下与一种微粒载体﹙试剂三﹚结合,并通过重复离心和在70%的乙醇中重悬浮脱盐。
向尿嘧啶的转化是通过在90%的乙醇中反复碱性脱磺酸基作用和脱盐完成的。
DNA最终在TE缓冲液中通过加热从载体上洗脱下来。
第一步:试剂准备(1)3 M NaOH原料(用前现配)把1g干NaOH片剂溶解在8.3mL水中。
使用此类腐蚀性碱,注意小心谨慎和实验操作。
(2)20 mM NaOH/90% EtOH(用前现配)配制1mL该溶液需:900μl 100%的乙醇,93.4μl水,6.6μl 3M的氢氧化钠。
(3)溶解试剂Ⅰ(用前现配)打开前将试剂瓶加温至室温。
对每份待修饰的样本,称取0.227g DNA修饰试剂Ⅰ加入0.571mL水中。
充分涡旋振荡混合。
使用该试剂时要小心谨慎,因为它对呼吸系统和皮肤有刺激性。
用大约20μl 3M NaOH调整pH至5.0,用pH试纸检测pH值。
试剂Ⅰ避光保存以免分解。
为了最佳效果,试剂应在配置后立即使用。
(4)溶解试剂Ⅱ打开前将试剂瓶加温至室温。
将1μl β-巯基乙醇加入20mL去离子水中。
每份待修饰的DNA样本需将750μl该溶液加入到1.35g DNA修饰Ⅱ。
充分混合确保完全溶解。
过量的试剂可用箔纸包裹的容器、2℃-8℃、避光保存长达6周。
第二步:DNA修饰程序1、在带有螺旋形瓶盖的1.5-2.0mL的微量离心管中:将7.0μl 3M NaOH加入到含有1.0 μg DNA的100μl水中(10ng/μl),混匀。
注意:如果样本含有的DNA量不到1.0μg,就向样本DNA中加入2 μl DNA修饰试剂Ⅳ并加水至总体积100μl。
甲基化检测方法精编WORD版

甲基化检测方法精编W O R D版IBM system office room 【A0816H-A0912AAAHH-GX8Q8-GNTHHJ8】甲基化检测(d e t e c t i o n o f m e t h y l a t i o n)概念:DNA甲基化是最早发现的基因表观修饰方式之一,真核生物中的甲基化仅发生于胞嘧啶,即在DNA甲基化转移酶(DNMTs)的作用下使CpG二核苷酸5'-端的胞嘧啶转变为5'-甲基胞嘧啶。
DNA甲基化通常抑制基因表达,去甲基化则诱导了基因的重新活化和表达。
这种DNA修饰方式在不改变基因序列前提下实现对基因表达的调控。
脊椎动物DNA的甲基化状态与生长发育调控密切相关,比如在肿瘤发生时,抑癌基因CpG岛以外的CpG序列非甲基化程度增加,CpG岛中的CpG则呈高度甲基化状态,导致抑癌基因表达的下降。
现有检测方法1.甲基化特异性的PCR(Methylation-specific PCR,MSP)用亚硫酸氢盐处理基因组DNA,所有未发生甲基化的胞嘧啶被转化为尿嘧啶,而甲基化的胞嘧啶不变;随后设计针对甲基化和非甲基化序列的引物进行PCR。
通过电泳检测MSP扩增产物,如果用针对处理后甲基化DNA链的引物能得到扩增片段,则说明该位点存在甲基化; 反之,说明被检测的位点不存在甲基化。
2.亚硫酸氢盐测序法(Bisulfite sequencing PCR,BSP)用亚硫酸氢盐处理基因组DNA,则未发生甲基化的胞嘧啶被转化为尿嘧啶,而甲基化的胞嘧啶不变。
随后设计BSP引物进行PCR,在扩增过程中尿嘧啶全部转化为胸腺嘧啶,最后对PCR产物进行测序就可以判断CpG位点是否发生甲基化称为BSP-直接测序方法。
将PCR 产物克隆至载体后进行测序,可以提高测序成功率,这种方法称为BSP-克隆测序法。
3.高分辨率熔解曲线法(High Resolution Melting,HRM)在非CpG岛位置设计一对针对亚硫酸氢盐修饰后的DNA双链的引物,这对引物中间的片段包含感兴趣的CpG岛。
甲基化检测方法(亚硫酸氢盐修饰后测序法)-2

甲基化检测方法(亚硫酸氢盐修饰后测序法)-2此步细节:1:在使用注射器时,一定要用力均匀且轻,如使用暴力,会将小柱内的薄膜挤破,失去作用。
2:乙酸铵、糖原不需新鲜配制,糖原配好后放在-20度保存,乙酸铵室温即可,因为这样浓度的乙酸铵非常难溶,一旦放在4度,取出用时也会有很多溶质析出。
3:异丙醇、70%乙醇都不需要新鲜配制,但如果用量大,现场配也很方便。
此步关键是在树脂与DNA的结合上,这就再次强调第二部分调亚硫酸钠PH值得重要性。
因为树脂与DNA结合需要有一个适当的PH,如前一步没做好,此步树脂不能与DNA很好结合,将会带来灾难性后果,即DNA随着液体被挤出了,洗脱时实际已没有任何DNA了。
第四部分修饰后DNA用于PCR这一步也没有悬念。
我主要谈一下这里面的几个比较棘手的问题:1:引物问题:我感觉自己设计引物有相当的难度,我曾设计过几对引物,并且试验了一下,但以失败告终。
如果时间充裕、作的又是比较新的基因文献不多,自己设计引物没有问题。
如果不是这样,还是参考文献更好些。
首先查阅SCI分值高的文献,然后是著名实验室的文献,如果国内有做的,更好了,可以直接联系咨询。
查到序列后,一定要和Genbank中的序列进行比对,防止有印刷错误造成的个别碱基的差别。
然后再到google上搜一下,看用的人多否,体系条件是否一样。
用的人多、体系条件一样,表明可重复性比较强。
我也是按此行事,算比较顺利。
2:Taq酶问题:有文献用高保真的金牌 Taq(Platinum),但我感觉只要体系正确、变性退火等条件合适,一般的热启动酶是可以的。
我开始使用的是Takara的LA Taq,很好用,配有10x含mg++的LA缓冲液。
有时候用没了,暂时以Takara 的普通Taq酶也可以。
如何选择,可以根据自己的情况。
初作者还是用好一点的酶。
3:PCR的条件:变性一般都选择95度,3min。
其余我感觉还是根据文献,退火可以根据你的引物的退火温度在小范围内尝试。
(完整版)甲基化检测方法(亚硫酸氢盐修饰后测序法)

(完整版)甲基化检测方法(亚硫酸氢盐修饰后测序法)甲基化检测方法(亚硫酸氢盐修饰后测序法)第一部分基因组DNA的提取。
这一步没有悬念,完全可以购买供细胞或组织使用的DNA提取试剂盒,如果实验室条件成熟,自己配试剂提取完全可以。
DNA比较稳定,只要在操作中不要使用暴力,提出的基因组DNA应该是完整的。
此步重点在于DNA的纯度,即减少或避免RNA、蛋白的污染很重要。
因此在提取过程中需使用蛋白酶K及RNA酶以去除两者。
使用两者的细节:1:蛋白酶K可以使用灭菌双蒸水配制成20mg/ml;2:RNA酶必须要配制成不含DNA酶的RNA酶,即在购买市售RNA酶后进行再处理,配制成10mg/ml。
否则可能的后果是不仅没有RNA,连DNA也被消化了。
两者均于-20度保存。
验证提取DNA的纯度的方法有二:1:紫外分光光度计计算OD比值;2:1%-1.5%的琼脂糖凝胶电泳。
我倾向于第二种方法,这种方法完全可以明确所提基因组DNA的纯度,并根据Marker的上样量估计其浓度,以用于下一步的修饰。
第二部分亚硫酸氢钠修饰基因组DNA如不特别指出,所用双蒸水(DDW)均经高压蒸汽灭菌。
1:将约2ugDNA于1.5mlEP管中使用DDW稀释至50ul;2:加5.5ul新鲜配制的3M NaOH;3:42℃水浴30min;水浴期间配制:4:10mM对苯二酚(氢醌),加30ul至上述水浴后混合液中;(溶液变成淡黄色)5:3.6M亚硫酸氢钠(Sigma,S9000),配制方法:1.88g亚硫酸氢钠使用DDW稀释,并以3M NaOH滴定溶液至PH 5.0,最终体积为5ml。
这么大浓度的亚硫酸氢钠很难溶,但加入NaOH后会慢慢溶解,需要有耐心。
PH一定要准确为5.0。
加520ul至上述水浴后溶液中。
6:EP管外裹以铝箔纸,避光,轻柔颠倒混匀溶液。
7:加200 ul 石蜡油,防止水分蒸发,限制氧化。
8:50℃避光水浴16h。
一般此步在4pm开始做,熟练的话不到5pm即可完成,水浴16h 正好至次日8am 以后收,时间上很合适。
亚硫酸氢盐甲基化测序

亚硫酸氢盐甲基化测序
亚硫酸氢盐甲基化测序是一种新的基因组学技术,它能更准确地测定 DNA 中的甲基化修饰。
该技术广泛应用于基因组学中,可以帮助研究者更深入地研究生物发育、疾病的发生和发展等问题。
下面我们就来详细了解一下亚硫酸氢盐甲基化测序的原理、优缺点等方面的内容。
一、原理
亚硫酸氢盐甲基化测序技术的原理就是使用亚硫酸氢盐来将未甲基化的胞嘧啶 (C) 转化为二氨基丙烷基胞嘧啶 (C)p,而甲基化的胞嘧啶 (5mC) 就不受影响,仍然保持甲基化状态。
然后可使用测序仪来分析 DNA 序列,得到甲基化的数据。
这种有选择性的形式可以更精确地测量基因组甲基化程度。
二、优点
亚硫酸氢盐甲基化测序技术的优点如下:
1. 可准确检测基因组中的甲基化修饰,与传统的甲基化测序技术相比,具有更高的敏感性和精度。
2. 可同时检测 DNA 上不同的甲基化状态,包括 CpG、非 CpG 和CHH 等。
3. 可将研究对象的多种甲基化状态一并检测,可以更全面地了解生物发育和疾病发生的机制。
三、缺点
亚硫酸氢盐甲基化测序技术的缺点如下:
1. 亚硫酸氢盐干扰可能会影响 DNA 的质量和浓度,以及测序数据的准确性。
2. 亚硫酸氢盐甲基化测序技术需要更长的时间和更高的成本。
四、结论
总体来说,亚硫酸氢盐甲基化测序技术是一种非常有用的基因组学技术,可以帮助研究者更好地研究生物发育和疾病的机制。
虽然该技术仍存在一些缺点,但许多专家认为,其优点远远超过其缺点。
我们期望亚硫酸氢盐甲基化测序技术能在未来得到更广泛的应用,以促进生物学、医学等领域的发展。
DNA甲基化原理
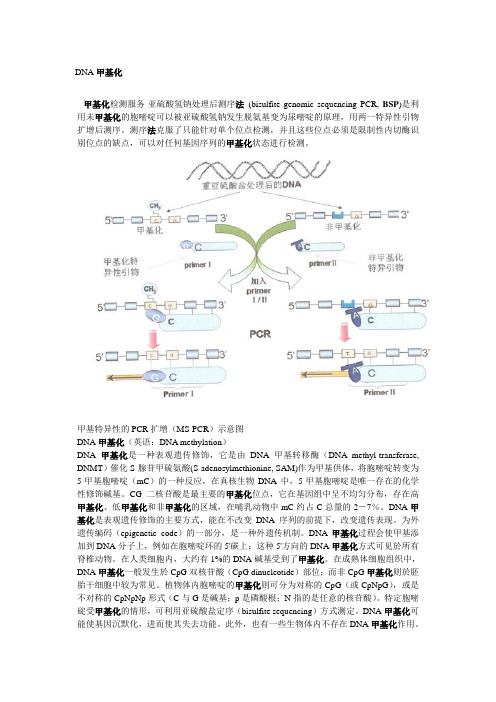
DNA甲基化甲基化检测服务-亚硫酸氢钠处理后测序法(bisulfite genomic sequencing PCR, BSP)是利用未甲基化的胞嘧啶可以被亚硫酸氢钠发生脱氨基变为尿嘧啶的原理,用两一特异性引物扩增后测序。
测序法克服了只能针对单个位点检测,并且这些位点必须是限制性内切酶识别位点的缺点,可以对任何基因序列的甲基化状态进行检测。
甲基特异性的PCR扩增(MS-PCR)示意图DNA甲基化(英语:DNA methylation)DNA甲基化是一种表观遗传修饰,它是由DNA甲基转移酶(DNA methyl-transferase, DNMT)催化S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)作为甲基供体,将胞嘧啶转变为5-甲基胞嘧啶(mC)的一种反应,在真核生物DNA中,5-甲基胞嘧啶是唯一存在的化学性修饰碱基。
CG二核苷酸是最主要的甲基化位点,它在基因组中呈不均匀分布,存在高甲基化、低甲基化和非甲基化的区域,在哺乳动物中mC约占C总量的2-7%。
DNA甲基化是表观遗传修饰的主要方式,能在不改变DNA序列的前提下,改变遗传表现。
为外遗传编码(epigenetic code)的一部分,是一种外遗传机制。
DNA甲基化过程会使甲基添加到DNA分子上,例如在胞嘧啶环的5'碳上:这种5'方向的DNA甲基化方式可见於所有脊椎动物。
在人类细胞内,大约有1%的DNA碱基受到了甲基化。
在成熟体细胞组织中,DNA甲基化一般发生於CpG双核苷酸(CpG dinucleotide)部位;而非CpG甲基化则於胚胎干细胞中较为常见。
植物体内胞嘧啶的甲基化则可分为对称的CpG(或CpNpG),或是不对称的CpNpNp形式(C与G是碱基;p是磷酸根;N指的是任意的核苷酸)。
特定胞嘧碇受甲基化的情形,可利用亚硫酸盐定序(bisulfite sequencing)方式测定。
DNA甲基化可能使基因沉默化,进而使其失去功能。
亚硫酸氢盐测序

亚硫酸氢盐测序介绍亚硫酸氢盐测序(Bisulfite sequencing)是一种用于研究DNA甲基化状态的测序技术。
DNA甲基化是一种常见的表观遗传修饰形式,它在基因组的调控、细胞分化和发育等过程中发挥重要作用。
亚硫酸氢盐测序通过对DNA进行特定的化学处理,可以将未甲基化的胞嘧啶(C)转化为尿嘧啶(T),而已甲基化的胞嘧啶不受影响。
通过测序这些转化后的DNA片段,可以确定原始DNA序列中的甲基化位点,从而获得DNA甲基化的信息。
测序过程亚硫酸氢盐测序包括以下几个主要步骤:DNA提取首先,需要从研究对象的细胞中提取DNA。
通常使用常规的DNA提取方法,例如酚/氯仿法或商用DNA提取试剂盒。
亚硫酸氢盐处理提取的DNA与亚硫酸氢盐溶液混合,在低pH条件下进行反应,使未甲基化的C转化为T。
这个处理过程是亚硫酸氢盐测序的关键步骤,确保只有未甲基化的C被转化。
PCR扩增经过亚硫酸氢盐处理后的DNA片段需要进行PCR扩增。
PCR扩增可以增加DNA数量,使得后续的测序实验能够顺利进行。
在PCR扩增过程中,可以添加特定的引物,以选择性地扩增亚硫酸氢盐处理后的DNA片段。
DNA测序扩增后的DNA片段需要进行测序。
目前可选择的测序方法很多,包括Sanger测序、Illumina测序等。
测序后可以得到大量的DNA序列数据。
数据分析最后,对测序得到的数据进行分析。
这包括对测序质量的评估、数据清洗、比对到参考基因组、甲基化位点检测等步骤。
应用领域亚硫酸氢盐测序技术在生物医学研究中有着广泛的应用。
以下是一些常见的应用领域:基因组甲基化研究亚硫酸氢盐测序可以用来研究基因组中的甲基化状态。
通过比较不同样品或不同组织中的甲基化水平,可以揭示基因组的甲基化模式与疾病或生理过程的关联。
癌症研究DNA甲基化异常在肿瘤中很常见。
亚硫酸氢盐测序可以通过检测肿瘤细胞中的甲基化变化,帮助我们理解肿瘤的发生和发展机制。
它还可以作为癌症早期诊断和预测预后的依据。
甲基化测序

DNA甲基化检测实验一、重亚硫酸盐的测序法实验流程(BSP)(Bisulfite Genomic Sequence)原理:结合重亚硫酸盐的测序法是一种灵敏的能直接检测分析基因组DNA甲基化模式的方法。
重亚硫酸盐处理后,用针对改变后的DNA序列设计特异性引物并进行聚合酶链式反应(PCR)。
PCR产物中原先非甲基化的胞嘧啶位点被胸腺嘧啶所替代,而甲基化的胞嘧啶位点保持不变。
PCR产物克隆后进行测序。
通过这个方法能得到特定位点在各个基因组DNA 分子中的甲基化状态。
该方法特点是:•特异性高,它能够提供特异性很高的分析结果,这是所有其他研究甲基化的分析方法所不能比拟的;•灵敏度高,可以用于分析少于100个细胞的检测样品。
用微量的基因组DNA进行分析就能得到各个DNA分子精确的甲基化位点分布图。
重亚硫酸盐测序法技术实验流程A.DNA制备用DNA抽提试剂盒(Promega, cat. no. A1125)抽提组织,细胞培养物,石蜡包埋组织切片样品中的基因组DNA。
B.重亚硫酸盐处理C.DNA纯化用Wizard DNA clean-up kit (Promega, cat. no. A7280)纯化重亚硫酸盐处理后的DNA样品。
D.PCR扩增E.PCR产物琼脂糖电泳后回收纯化F.PCR产物连接到pMD19-T (Takara) 载体中克隆及测序。
G.用分析软件对各样本测序结果进行甲基化程度分析二、甲基化特异性的PCR实验流程(methylation-specific PCR, MSP)原理:甲基化特异性的PCR是一种灵敏度高且操作相对简单的甲基化研究方法。
重亚硫酸盐处理DNA后,基因组DNA发生的由甲基化状态决定的序列改变。
随后进行引物特异性的PCR。
该方法引物设计是关键。
MSP中设计两对引物,即一对结合处理后的甲基化DNA链(引物对M),另一对结合处理后的非甲基化DNA链(引物对U)。
检测MSP扩增产物,如果用引物M能扩增出片段,则说明检测位点存在甲基化;若用引物U扩增出片段,则说明被检测的位点不存在甲基化(图3)。
亚硫酸盐处理甲基化测序

亚硫酸盐处理甲基化测序亚硫酸盐是一种常用的化学试剂,广泛应用于生物学研究中。
在甲基化测序中,亚硫酸盐可以用来去除DNA中的甲基化基团,从而实现对DNA甲基化水平的检测和分析。
本文将详细介绍亚硫酸盐处理甲基化测序的原理、方法和应用。
一、原理DNA甲基化是一种重要的表观遗传修饰方式,通过甲基化修饰可以调控基因的转录活性。
甲基化测序是研究DNA甲基化的一种常用方法。
在甲基化测序中,亚硫酸盐被用来去除DNA上的甲基化基团。
亚硫酸盐可以与甲基化的胞嘧啶发生化学反应,将甲基化胞嘧啶转化为脱氧胞嘧啶。
这样一来,在测序过程中就可以准确地检测到DNA中的甲基化位点。
二、方法亚硫酸盐处理甲基化测序的方法主要包括以下几个步骤:1. DNA提取:首先需要从待测样品中提取出DNA。
可以使用常规的DNA提取方法,如酚-氯仿法或商业化的DNA提取试剂盒。
2. 亚硫酸盐处理:将提取得到的DNA溶解在含有亚硫酸盐的反应缓冲液中,反应一段时间后,亚硫酸盐会与DNA中的甲基化胞嘧啶发生化学反应,将其转化为脱氧胞嘧啶。
3. 碱基修复:亚硫酸盐处理后的DNA需要进行碱基修复,以恢复DNA链的完整性。
可以使用商业化的DNA修复试剂盒进行修复反应。
4. 文库构建:修复后的DNA可以进行文库构建。
根据实验需求,可以选择不同的文库构建方法,如全基因组测序、甲基化敏感限制性酶测序等。
5. 测序:构建好的文库可以进行高通量测序。
根据测序平台的不同,可以选择Illumina、PacBio等不同的测序技术。
三、应用亚硫酸盐处理甲基化测序在生物学研究中有着广泛的应用。
它可以帮助研究人员了解DNA甲基化在基因表达调控中的作用机制,以及在疾病发生和发展中的重要作用。
具体应用包括:1. 甲基化位点鉴定:亚硫酸盐处理甲基化测序可以准确地鉴定DNA 中的甲基化位点,帮助研究人员了解甲基化在基因组中的分布情况。
2. 甲基化水平分析:通过亚硫酸盐处理甲基化测序,可以定量分析DNA中的甲基化水平,比较不同样品之间的甲基化差异。
(完整版)亚硫酸氢钠测序法

亚硫酸氢钠测序法(bisulfite genomic sequencing)直接测序法是建立在MSP基础上进一步深入研究CpG岛各个位点甲基化情况的方法.重亚硫酸盐使DNA中未发生甲基化的胞嘧啶脱氨基转变成尿嘧啶,而甲基化的胞嘧啶保持不变,行PCR扩增(引物设计时尽量避免有CpG,以免受甲基化因素的影响)所需片段,则尿嘧啶全部转化成胸腺嘧啶.最后,对PCR产物进行测序,并且与未经处理的序列比较,判断是否CpG位点发生甲基化.此方法一种可靠性及精确度很高的方法,能明确目的片段中每一个CpG位点的甲基化状态.在寻找有意义的关键性CpG位点上,有其他方法无法比拟的优点.测序法以CpG岛两侧不含CpG点的一段序列为引物配对区,所以能够同时扩增出甲基化和非甲基化靶序列.它的不足是耗费时间和耗资过多,至少要测序10个以上的克隆才能获得可靠数据,需要大量的克隆及质粒提取测序,过程较为繁琐、昂贵.第一部分基因组DNA的提取.这一步没有悬念,完全可以购买供细胞或组织使用的DNA提取试剂盒,如果实验室条件成熟,自己配试剂提取完全可以.DNA比较稳定,只要在操作中不要使用暴力,提出的基因组DNA应该是完整的.此步重点在于DNA的纯度,即减少或避免RNA、蛋白的污染很重要.因此在提取过程中需使用蛋白酶K及RNA酶以去除两者.使用两者的细节:1:蛋白酶K可以使用灭菌双蒸水配制成20mg/ml;2:RNA酶必须要配制成不含DNA酶的RNA酶,即在购买市售RNA酶后进行再处理,配制成10mg/ml.否则可能的后果是不仅没有RNA,连DNA也被消化了.两者均于-20度保存.验证提取DNA的纯度的方法有二:1:紫外分光光度计计算OD比值;2:1%-1.5%的琼脂糖凝胶电泳.我倾向于第二种方法,这种方法完全可以明确所提基因组DNA的纯度,并根据Marker的上样量估计其浓度,以用于下一步的修饰.第二部分亚硫酸氢钠修饰基因组DNA如不特别指出,所用双蒸水(DDW)均经高压蒸汽灭菌.1:将约2ugDNA于1.5mlEP管中使用DDW稀释至50ul;2:加5.5ul新鲜配制的3M NaOH;3: 42℃水浴30min;水浴期间配制:4:10mM对苯二酚(氢醌),加30ul至上述水浴后混合液中;(溶液变成淡黄色)5: 3.6M亚硫酸氢钠(Sigma,S9000),配制方法:1.88g亚硫酸氢钠使用DDW稀释,并以3M NaOH滴定溶液至PH 5.0,最终体积为5ml.这么大浓度的亚硫酸氢钠很难溶,但加入NaOH后会慢慢溶解,需要有耐心.PH一定要准确为5.0.加520ul至上述水浴后溶液中.6:EP管外裹以铝箔纸,避光,轻柔颠倒混匀溶液.7:加200 ul 石蜡油,防止水分蒸发,限制氧化.8:50℃避光水浴16h.一般此步在4pm开始做,熟练的话不到5pm即可完成,水浴16h正好至次日8am以后收,时间上很合适.这一步细节:1:基因组DNA的量不需十分精确,宁多勿少,因为在以后纯化回收步骤中会有丢失,且此方法修饰最多可至4ug.2:所有试剂均须新鲜配制,所以配液的技术要过关,既要快,又要精确.3:亚硫酸氢钠溶液呈强酸性,一定用碱将PH调制5.0,否则PH不合适会影响后续纯化吸收. 4:水浴最好达16小时,虽可以短至8小时,但后者修饰会有不完全.第三部分修饰后DNA纯化回收EP管如无特别说明均为高压蒸汽灭菌的.1. 将移液器枪头伸入石蜡油层下,先轻轻加压使其中一小段石蜡油排出,然后吸取混合液至一洁净1.5mlEP管中.2:以下使用Promega Wizard Cleanup DNA纯化回收系统(Promega,A7280)1)70℃水浴预热DDW;配制80%异丙醇;2)加1ml Promega’s Wizard DNA Clean-up resin,轻柔颠倒混匀,使DNA充分与树脂结合;3)由于该试剂盒中仅配备针筒没有针栓,如果有真空负压吸引器,使用起来很方便;如果没有,需要自备3ml-5ml注射器.将注射器针筒与试剂盒提供的回收小柱紧密连接后,将上述混合物用移液器移至针筒内,用2ml以上的EP管放置小柱下接收废液.加针栓,轻轻加压,将液体挤出,此时可见小柱内有白色的树脂沉积.4)将注射器与小柱分离后拔出针栓,再将针筒与小柱连接,向针筒内加入2ml 80%的异丙醇,插入针栓,轻轻加压,将异丙醇挤出.此为洗涤步骤.5)将注射器与小柱分离,将小柱置于洁净1.5ml洁净EP管上,离心12000rpm,2min,以甩去残余异丙醇成分,使树脂干燥.此时,修饰后DNA处于与树脂结合状态.6)将小柱取下置于另一洁净1.5mlEP管上,移液器加50ul预热好的DDW,室温放置5min. 7)离心12000rpm,20s,此为洗脱步骤,此时EP管内液体即为洗脱的修饰后DNA溶液,终体积为50ul.3:加5.5ul 新鲜配制的3M NaOH,室温放置15min.4:加33ul 10M乙酸铵,以中和NaOH,使溶液PH于7.0左右.5:加4ul 10mg/ml糖原,此作为沉淀指示剂,因为其与乙醇混合后可产生沉淀,便于以后离心后辨别回收物的位置,以防在吸取残余乙醇时将回收物吸走.其实,加入这些糖原究竟能起多大作用,不好说.不过有国产糖原卖,包装不大,也很便宜,买来一用,算严格遵守文献的步骤吧.6:加270ul 冰无水乙醇,置于-20度,过夜沉淀.有人为沉淀最短可至2小时,但我认为时间长些可能会更好.并且做到此步骤时,一般会到中午,如果样本多的话要到下午,不妨放置过夜,日程可以轻松些,顺便做些其他试验.如果想当天做完,没有问题,但我认为最好多沉淀些时候,至少6小时吧(这是经验,我做过最少6小时,也是可以的,再短就不敢发表意见了)7:4度,12000rpm离心,30min,倒去上清液,收集沉淀.不必吸净.8:加500ul 70%乙醇,不要将沉淀吹打起来,只要把乙醇加上即可.轻柔倾斜EP管,旋转一圈,再次离心,4度12000rpm,5min.离心后倒掉上清,再加同量乙醇,同样再做一遍.此为洗涤步骤,共2次.9:倒掉上清,并常温简短离心后,将附壁乙醇离至EP管底,移液器小心将残余液体吸净,室温干燥5min,或沉淀由不透明变为半透明或透明时,加入20ul- 30ulDDW,溶解沉淀.至此,已完成了修饰后DNA的纯化回收,所得为修饰后DNA溶液,可用于此后的进一步实验.10:-20℃保存DNA溶液.此步细节:1:在使用注射器时,一定要用力均匀且轻,如使用暴力,会将小柱内的薄膜挤破,失去作用. 2:乙酸铵、糖原不需新鲜配制,糖原配好后放在-20度保存,乙酸铵室温即可,因为这样浓度的乙酸铵非常难溶,一旦放在4度,取出用时也会有很多溶质析出.3:异丙醇、70%乙醇都不需要新鲜配制,但如果用量大,现场配也很方便.此步关键是在树脂与DNA的结合上,这就再次强调第二部分调亚硫酸钠PH值得重要性.因为树脂与DNA结合需要有一个适当的PH,如前一步没做好,此步树脂不能与DNA很好结合,将会带来灾难性后果,即DNA随着液体被挤出了,洗脱时实际已没有任何DNA了.第四部分修饰后DNA用于PCR这一步也没有悬念.我主要谈一下这里面的几个比较棘手的问题:1:引物问题:我感觉自己设计引物有相当的难度,我曾设计过几对引物,并且试验了一下,但以失败告终.如果时间充裕、作的又是比较新的基因文献不多,自己设计引物没有问题.如果不是这样,还是参考文献更好些.首先查阅SCI分值高的文献,然后是著名实验室的文献,如果国内有做的,更好了,可以直接联系咨询.查到序列后,一定要和Genbank中的序列进行比对,防止有印刷错误造成的个别碱基的差别.然后再到google上搜一下,看用的人多否,体系条件是否一样.用的人多、体系条件一样,表明可重复性比较强.我也是按此行事,算比较顺利.2:Taq酶问题:有文献用高保真的金牌 Taq(Platinum),但我感觉只要体系正确、变性退火等条件合适,一般的热启动酶是可以的.我开始使用的是Takara的LA Taq,很好用,配有10x含mg++的LA缓冲液.有时候用没了,暂时以Takara 的普通Taq酶也可以.如何选择,可以根据自己的情况.初作者还是用好一点的酶.3:PCR的条件:变性一般都选择95度,3min.其余我感觉还是根据文献,退火可以根据你的引物的退火温度在小范围内尝试.一般和文献报道差别不大.只是扩增片断特异性的问题.建议根据文献.4:做PCR的EP管最好选择进口的,壁薄且厚度均匀,这可以保证温度的迅速变化可以及时传递给管内的反应液,使体系真正在所设定的温度下运行.5:PCR仪:如果在某一个仪器上作出来了,最好一直用此仪器继续.不同的仪器“脾气”也不一样,但EP管必要和仪器内的插孔紧密结合方好,留有空隙,我认为会影响温度的传递. 这一部分有些啰嗦,只是个人一些不成熟经验.有疑问处,请大家指出,交流.今天先到这里,现写一些内容,比较费劲,总是不能一挥而就.望见谅.歇息一会准备写最后蓝白斑筛选克隆这一部分.第五部分 PCR产物的凝胶回收这一步比较简单,可以购买一个凝胶PCR产物回收试剂盒,国产的就很好、价格也合理,比如TIANGEN的产品(用过).把切下来的胶按说明书操作即可.几个细节:1:PCR产物进行琼脂糖凝胶电泳,要使用新配的电泳液.凝胶浓度1%-2%均可.2:凝胶DNA回收时在300nm紫外灯下观察条带位置,切取目的片断所在位置的凝胶,尽量小,保证特异性.3:紫外照射时间不能过长,否则对DNA有损伤.4:回收后的DNA如不马上用就储存于-20度,在数月内是很稳定的.第六部分 PCR产物与T载体的连接和转化、蓝白斑筛选1:连接T载体(本实验使用的是Promega的试剂盒)15ul体系T-easy 1ulLigase 1ul2xbuffer 7.5ulDNA 5.5ul4度,过夜.2:连接产物的转化1)-70度冰箱内取出感受态细菌,融化后置于冰上;2)连接产物15ul 全部加入,至于冰上30分钟;3)42度, 90秒钟;4)冰上2分钟;5)800ul LB培养基;6)280rpm,37度,摇床45分钟(将管放水平了摇,保证菌液摇匀);7)8000rpm,1分钟;在超净台内去上清,留100-150ul;8)涂板:37度孵箱过夜;(板为含有氨苄青霉素的固体LB培养基)先涂:X-gar 35ulIPTG 25ul后涂:混悬液过夜后可见板上长出很多蓝色或白色斑点,取白色斑点,尤其是蓝色斑点周围的白色斑点,此处自联率较低.3:取白斑,划种于新板上新板:先涂:X-gar 35ulIPTG 25ul然后于板底划出分区,进行标记.根据需要,一般一板作50个克隆没有问题.针头挑白斑划2道于板上相应区域内.37度,孵箱过夜.4:联系测序公司送测序.一般一个克隆在35-45元.这一部分的细节:1:涂板要均匀,保证Xgar和IPTG均匀分布在板面上;2:不要让蓝白斑长得太满,否则选取克隆时容易一下挑2个.。
甲基化检测方法

甲基化检测方法甲基化是一种通过在DNA分子中结合甲基基团来添加化学修饰的过程。
这种化学修饰可以影响基因表达模式,从而对细胞功能和发育过程产生深远影响。
因此,甲基化检测方法在研究生物学、遗传学以及疾病发生机制等方面具有重要意义。
亚硫酸氢盐修饰后测序法是一种被广泛应用于甲基化检测的方法之一,本文将对其原理、步骤和应用进行详细介绍。
亚硫酸氢盐修饰后测序法的原理基于DNA中的甲基化位点与亚硫酸氢盐发生化学反应的特性。
亚硫酸氢盐可以与未甲基化的胞嘧啶碱基形成二硫键结合,而与甲基化的胞嘧啶碱基则不能发生此反应。
利用这个原理,可以将未甲基化的胞嘧啶通过亚硫酸氢盐修饰转化为胞嘧啶-4-亚硫酸酯(CMPS),而甲基化的胞嘧啶则保持不变。
然后,通过测序技术对DNA进行测序,可以得知胞嘧啶碱基是否甲基化。
该方法的具体步骤如下:1.DNA提取:从待测样品中提取DNA,可以使用常规的DNA提取方法来纯化DNA。
2.亚硫酸氢盐修饰:将DNA与亚硫酸氢盐(如亚硫酸氢钠)反应,使未甲基化的胞嘧啶碱基发生亚硫酸化修饰。
通过调整反应条件,可以使甲基化的胞嘧啶碱基保持原样。
3.水解:在亚硫酸氢盐修饰后,将DNA进行水解反应,以将DNA降解成较小的核苷酸片段。
4. 测序:将水解后的DNA片段进行测序,可以使用传统的Sanger测序技术或者高通量测序技术(如二代测序)来完成。
通过测序结果的比对分析,可以确定甲基化位点。
总结起来,亚硫酸氢盐修饰后测序法是一种常用的甲基化检测方法。
通过将DNA中的未甲基化胞嘧啶进行化学修饰,然后通过测序技术分析甲基化位点,可以揭示基因组中的甲基化特征以及其在生物学和疾病中的作用。
在未来,随着测序技术的不断发展和改进,亚硫酸氢盐修饰后测序法还将为我们提供更多深入的甲基化信息。
(完整版)基因甲基化检测

基因甲基化检测甲基化是在DNA甲基转移酶(DNA Methyltransferase, DNMT)催化作用下, 利用S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)提供甲基,在CpG二核苷酸中胞嘧啶嘧啶环的五号碳原子上加上甲基的共价修饰过程.DNA甲基化是表观遗传修饰的主要方式,它不改变DNA的一级结构,却在细胞的发育、基因的表达、及基因组的稳定性中起着重要的作用。
CpG岛的高甲基化是肿瘤中存在的普遍现象,而启动子CpG 岛的高甲基化是除突变和缺失外肿瘤中抑癌基因失活的第三种机制。
因此,基因启动子甲基化检测在临床诊断(如甲基化检测与低剂量CT相结合)、药物敏感性检测等方面具有很高的应用价值。
目前甲基化特异性PCR(Methylmion Specific PCR,MSP)及其改进方法是检测基因甲基化的经典方法.MSP法的原理是首先用亚硫酸氢钠修饰处理基因组DNA,所有未发生甲基化的胞嘧啶都被转化为尿嘧啶,而甲基化的胞嘧啶则不变。
然后设计针对甲基化和非甲基化序列的引物并进行聚合酶链反应(PCR)扩增,最后通过琼脂糖凝胶电泳分析,确定与引物互补的DNA 序列的甲基化状态。
MSP法灵敏度较高,应用范围广。
一. MSP实验流程:1.基因组抽提;2.基因组DNA定量;3.重亚硫酸盐转化(C转化为U),本步实验至关重要,转化效率高低直接影响实验结果,所以,需要实验者在实验过程中不断摸索合适的实验条件以确保较高的转化效率;4.引物设计(每个基因设计两对引物,分别为:甲基化引物M,非基因化引物U,对应扩增甲基化和非甲基化的目的片段),有时需设计巢式引物;5.PCR扩增:对甲基化和非甲基化的目的片段分别扩增,此时尽可能使用梯度PCR仪,可以同时使用不同的退火温度,以筛选合适的退火温度;6.PCR产物电泳;7.电泳结果分析(定性即有无甲基化,半定量即甲基化程度高低)。
图1:MSP PCR产物电泳图二. qMSP实验流程:1.基因组抽提;2.基因组DNA定量;3.重亚硫酸盐转化(C转化为U),本步实验至关重要,转化效率高低直接影响实验结果,所以,需要实验者在实验过程中不断摸索合适的实验条件以确保较高的转化效率;4.引物和探针设计(每个基因设计一对引物和两条条探针),定量引物和探针的设计难度是比较大的,设计好的引物和探针既需要理论上的分析验证(软件),又需要通过实验验证和筛选,所以一个目的基因有时需设计几对不同引物和探针以供筛选;5.标准品制备:1.完全非甲基化DNA的制备:筛选合适的基因组DNA,确保其完全没有甲基化,作为阴性对照;2.完全甲基化DNA的制备:用甲基转移酶对完全非甲基化的DNA进行甲基化修饰,目的是把DNA中所有的CG中的C甲基化,修饰后的DNA是完全甲基化的,作为阳性对照;3.把A作为0%甲基化,B作为100%甲基化,对A和B进行不同比例的混合,形成梯度甲基化的标准品;4.对C步的系列标准品进行Realtime PCR扩增,制备多个不同的标准曲线;5.根据标准曲线的相关系数,对D步的标准曲线进行筛选,选择合适的标准曲线用于后续的实验.6. PCR扩增:对实验样本进行PCR扩增,此时尽可能使用梯度PCR仪,可以同时使用不同的退火温度,以筛选合适的退火温度.7. Realtime PCR扩增:对实验样品进行定量PCR扩增,同时扩增标准曲线;8. 结果分析:通过PCR结果可以直观的看出每个样本的甲基化程度(百分比)。
甲基化测量方法

甲基化测量方法
基甲基化检测主要几种:
甲基化特bai异性PCR(Methylation-specific PCRMSP)
用亚硫酸氢盐处理基组DNA所未发甲基化胞嘧啶转化尿嘧啶甲基化胞嘧啶变;随设计针甲基化非甲基化序列引物进行PCR通电泳检测MSP扩增产物用针处理甲基化DNA链引物能扩增片段则说明该位点存甲基化;反说明检测位点存甲基化
2、亚硫酸氢盐测序(Bisulfite sequencing PCRBSP)
用亚硫酸氢盐处理基组DNA则未发甲基化胞嘧啶转化尿嘧啶甲基化胞嘧啶变随设计BSP引物进行PCR扩增程尿嘧啶全部转化胸腺嘧啶PCR产物进行测序判断CpG位点否发甲基化称BSP-直接测序PCR产物克隆至载体进行测序提高测序功率种称BSP-克隆测序
3、甲基化敏扩增态性
(Methylation-Sensitive Amplified Polymorphism,MSAP)
MSAP利用DNA甲基化敏两种同裂酶Hpa IIMsp I基组DNA进行酶切连接由于两种酶能够识别相同限制性酶切位点即CCGG位点DNA序列CCGG位点现同程度甲基化状态别两种酶识别产物式体现
4、焦磷酸测序(Pyrosequencing)
通准确定量单连续CpG 位点甲基化频率焦磷酸测序能检测并定量甲基化水平细微改变序列延伸程根据CT掺入量定量确定单位点C-T比例同位点甲基化变异能准确检测由于焦磷酸测序提供真实序列数据甲基化状态序列形式呈现。
甲基化分析流程过程

甲基化分析流程过程
甲基化分析流程涉及多个步骤,以下是一个基本的分析流程:
1. 样本准备:首先需要收集和分析的样本,如基因组DNA。
确保样本的质量和数量满足分析要求。
2. 甲基化检测:
* 电泳检测MSP扩增产物:通过针对处理后甲基化DNA链的引物进行电泳检测,若能得到扩增片段,则说明该位点存在甲基化;反之则不存在甲基化。
* 亚硫酸氢盐测序法(Bisulfite sequencing PCR,BSP):使用亚硫酸氢盐处理基因组DNA,使未甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶保持不变。
设计BSP引物进行PCR,在扩增过程中尿嘧啶全部转化为胸腺嘧啶。
最后对PCR产物进行测序,可以判断CpG位点是否发生甲基化。
此外,将PCR产物克隆至载体后进行测序可以提高测序成功率。
3. 甲基化芯片分析:利用甲基化芯片(如EPIC和450K)进行高通量甲基化检测。
这需要厂商提供注释文件信息,以便准确分析甲基化位点。
4. 差异甲基化区域(DMR)鉴定及统计:使用权威期刊发表的metilene软件进行DMR检测。
该软件首先进行基因组预分段,排除不包含CG位点的片段。
然后利用二元分隔算法递归缩小检测范围,搜索得到组间累积平均甲基化差异最大的区域作为可能的DMR。
最后,结合双重统计学检验得到准确的DMR。
这些步骤涵盖了甲基化分析的主要过程,但具体的实验条件和参数可能因实验室和研究目的的不同而有所调整。
此外,甲基化分析涉及复杂的生物学和统计学原理,需要专业知识和技能来准确解释结果。
因此,在进行甲基化分析时,建议与经验丰富的科研人员或专业实验室合作,以确保结果的准确性和可靠性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲基化检测方法(亚硫酸氢盐修饰后测序法)第一部分基因组DNA的提取。
这一步没有悬念,完全可以购买供细胞或组织使用的DNA提取试剂盒,如果实验室条件成熟,自己配试剂提取完全可以。
DNA比较稳定,只要在操作中不要使用暴力,提出的基因组DNA应该是完整的。
此步重点在于DNA的纯度,即减少或避免RNA、蛋白的污染很重要。
因此在提取过程中需使用蛋白酶K及RNA酶以去除两者。
使用两者的细节:1:蛋白酶K可以使用灭菌双蒸水配制成20mg/ml;2:RNA酶必须要配制成不含DNA酶的RNA酶,即在购买市售RNA酶后进行再处理,配制成10mg/ml。
否则可能的后果是不仅没有RNA,连DNA也被消化了。
两者均于-20度保存。
验证提取DNA的纯度的方法有二:1:紫外分光光度计计算OD比值;2:1%-1.5%的琼脂糖凝胶电泳。
我倾向于第二种方法,这种方法完全可以明确所提基因组DNA的纯度,并根据Marker的上样量估计其浓度,以用于下一步的修饰。
第二部分亚硫酸氢钠修饰基因组DNA如不特别指出,所用双蒸水(DDW)均经高压蒸汽灭菌。
1:将约2ugDNA于1.5mlEP管中使用DDW稀释至50ul;2:加5.5ul新鲜配制的3M NaOH;3:42℃水浴30min;水浴期间配制:4:10mM对苯二酚(氢醌),加30ul至上述水浴后混合液中;(溶液变成淡黄色)5:3.6M亚硫酸氢钠(Sigma,S9000),配制方法:1.88g亚硫酸氢钠使用DDW稀释,并以3M NaOH滴定溶液至PH 5.0,最终体积为5ml。
这么大浓度的亚硫酸氢钠很难溶,但加入NaOH后会慢慢溶解,需要有耐心。
PH一定要准确为5.0。
加520ul至上述水浴后溶液中。
6:EP管外裹以铝箔纸,避光,轻柔颠倒混匀溶液。
7:加200 ul 石蜡油,防止水分蒸发,限制氧化。
8:50℃避光水浴16h。
一般此步在4pm开始做,熟练的话不到5pm即可完成,水浴16h正好至次日8am 以后收,时间上很合适。
这一步细节:1:基因组DNA的量不需十分精确,宁多勿少,因为在以后纯化回收步骤中会有丢失,且此方法修饰最多可至4ug。
2:所有试剂均须新鲜配制,所以配液的技术要过关,既要快,又要精确。
3:亚硫酸氢钠溶液呈强酸性,一定用碱将PH调制5.0,否则PH不合适会影响后续纯化吸收。
4:水浴最好达16小时,虽可以短至8小时,但后者修饰会有不完全。
第三部分修饰后DNA纯化回收EP管如无特别说明均为高压蒸汽灭菌的。
1. 将移液器枪头伸入石蜡油层下,先轻轻加压使其中一小段石蜡油排出,然后吸取混合液至一洁净1.5mlEP管中。
2:以下使用Promega Wizard Cleanup DNA纯化回收系统(Promega,A7280)1)70℃水浴预热DDW;配制80%异丙醇;2)加1ml Promega’s Wizard DNA Clean-up resin,轻柔颠倒混匀,使DNA充分与树脂结合;3)由于该试剂盒中仅配备针筒没有针栓,如果有真空负压吸引器,使用起来很方便;如果没有,需要自备3ml-5ml注射器。
将注射器针筒与试剂盒提供的回收小柱紧密连接后,将上述混合物用移液器移至针筒内,用2ml以上的EP管放置小柱下接收废液。
加针栓,轻轻加压,将液体挤出,此时可见小柱内有白色的树脂沉积。
4)将注射器与小柱分离后拔出针栓,再将针筒与小柱连接,向针筒内加入2ml 80%的异丙醇,插入针栓,轻轻加压,将异丙醇挤出。
此为洗涤步骤。
5)将注射器与小柱分离,将小柱置于洁净1.5ml洁净EP管上,离心12000rpm,2min,以甩去残余异丙醇成分,使树脂干燥。
此时,修饰后DNA处于与树脂结合状态。
6)将小柱取下置于另一洁净1.5mlEP管上,移液器加50ul预热好的DDW,室温放置5min。
7)离心12000rpm,20s,此为洗脱步骤,此时EP管内液体即为洗脱的修饰后DNA溶液,终体积为50ul。
3:加5.5ul 新鲜配制的3M NaOH,室温放置15min。
4:加33ul 10M乙酸铵,以中和NaOH,使溶液PH于7.0左右。
5:加4ul 10mg/ml糖原,此作为沉淀指示剂,因为其与乙醇混合后可产生沉淀,便于以后离心后辨别回收物的位置,以防在吸取残余乙醇时将回收物吸走。
其实,加入这些糖原究竟能起多大作用,不好说。
不过有国产糖原卖,包装不大,也很便宜,买来一用,算严格遵守文献的步骤吧。
6:加270ul 冰无水乙醇,置于-20度,过夜沉淀。
有人为沉淀最短可至2小时,但我认为时间长些可能会更好。
并且做到此步骤时,一般会到中午,如果样本多的话要到下午,不妨放置过夜,日程可以轻松些,顺便做些其他试验。
如果想当天做完,没有问题,但我认为最好多沉淀些时候,至少6小时吧(这是经验,我做过最少6小时,也是可以的,再短就不敢发表意见了)7:4度,12000rpm离心,30min,倒去上清液,收集沉淀。
不必吸净。
8:加500ul 70%乙醇,不要将沉淀吹打起来,只要把乙醇加上即可。
轻柔倾斜EP管,旋转一圈,再次离心,4度12000rpm,5min。
离心后倒掉上清,再加同量乙醇,同样再做一遍。
此为洗涤步骤,共2次。
9:倒掉上清,并常温简短离心后,将附壁乙醇离至EP管底,移液器小心将残余液体吸净,室温干燥5min,或沉淀由不透明变为半透明或透明时,加入20ul-30ulDDW,溶解沉淀。
至此,已完成了修饰后DNA的纯化回收,所得为修饰后DNA溶液,可用于此后的进一步实验。
10:-20℃保存DNA溶液。
此步细节:1:在使用注射器时,一定要用力均匀且轻,如使用暴力,会将小柱内的薄膜挤破,失去作用。
2:乙酸铵、糖原不需新鲜配制,糖原配好后放在-20度保存,乙酸铵室温即可,因为这样浓度的乙酸铵非常难溶,一旦放在4度,取出用时也会有很多溶质析出。
3:异丙醇、70%乙醇都不需要新鲜配制,但如果用量大,现场配也很方便。
此步关键是在树脂与DNA的结合上,这就再次强调第二部分调亚硫酸钠PH值得重要性。
因为树脂与DNA结合需要有一个适当的PH,如前一步没做好,此步树脂不能与DNA很好结合,将会带来灾难性后果,即DNA随着液体被挤出了,洗脱时实际已没有任何DNA了。
第四部分修饰后DNA用于PCR这一步也没有悬念。
我主要谈一下这里面的几个比较棘手的问题:1:引物问题:我感觉自己设计引物有相当的难度,我曾设计过几对引物,并且试验了一下,但以失败告终。
如果时间充裕、作的又是比较新的基因文献不多,自己设计引物没有问题。
如果不是这样,还是参考文献更好些。
首先查阅SCI 分值高的文献,然后是著名实验室的文献,如果国内有做的,更好了,可以直接联系咨询。
查到序列后,一定要和Genbank中的序列进行比对,防止有印刷错误造成的个别碱基的差别。
然后再到google上搜一下,看用的人多否,体系条件是否一样。
用的人多、体系条件一样,表明可重复性比较强。
我也是按此行事,算比较顺利。
2:Taq酶问题:有文献用高保真的金牌Taq(Platinum),但我感觉只要体系正确、变性退火等条件合适,一般的热启动酶是可以的。
我开始使用的是Takara的LA Taq,很好用,配有10x含mg++的LA缓冲液。
有时候用没了,暂时以Takara 的普通Taq酶也可以。
如何选择,可以根据自己的情况。
初作者还是用好一点的酶。
3:PCR的条件:变性一般都选择95度,3min。
其余我感觉还是根据文献,退火可以根据你的引物的退火温度在小范围内尝试。
一般和文献报道差别不大。
只是扩增片断特异性的问题。
建议根据文献。
4:做PCR的EP管最好选择进口的,壁薄且厚度均匀,这可以保证温度的迅速变化可以及时传递给管内的反应液,使体系真正在所设定的温度下运行。
5:PCR仪:如果在某一个仪器上作出来了,最好一直用此仪器继续。
不同的仪器“脾气”也不一样,但EP管必要和仪器内的插孔紧密结合方好,留有空隙,我认为会影响温度的传递。
第五部分PCR产物的凝胶回收这一步比较简单,可以购买一个凝胶PCR产物回收试剂盒,国产的就很好、价格也合理,比如TIANGEN的产品(用过)。
把切下来的胶按说明书操作即可。
几个细节:1:PCR产物进行琼脂糖凝胶电泳,要使用新配的电泳液。
凝胶浓度1%-2%均可。
2:凝胶DNA回收时在300nm紫外灯下观察条带位置,切取目的片断所在位置的凝胶,尽量小,保证特异性。
3:紫外照射时间不能过长,否则对DNA有损伤。
4:回收后的DNA如不马上用就储存于-20度,在数月内是很稳定的。
第六部分PCR产物与T载体的连接和转化、蓝白斑筛选1:连接T载体(本实验使用的是Promega的试剂盒)15ul体系T-easy 1ulLigase 1ul2xbuffer 7.5ulDNA 5.5ul4度,过夜。
2:连接产物的转化1)-70度冰箱内取出感受态细菌,融化后置于冰上;2)连接产物15ul 全部加入,至于冰上30分钟;3)42度,90秒钟;4)冰上2分钟;5)800ul LB培养基;6)280rpm,37度,摇床45分钟(将管放水平了摇,保证菌液摇匀);7)8000rpm,1分钟;在超净台内去上清,留100-150ul;8)涂板:37度孵箱过夜;(板为含有氨苄青霉素的固体LB培养基)先涂:X-gar 35ulIPTG 25ul后涂:混悬液过夜后可见板上长出很多蓝色或白色斑点,取白色斑点,尤其是蓝色斑点周围的白色斑点,此处自联率较低。
3:取白斑,划种于新板上新板:先涂:X-gar 35ulIPTG 25ul然后于板底划出分区,进行标记。
根据需要,一般一板作50个克隆没有问题。
针头挑白斑划2道于板上相应区域内。
37度,孵箱过夜。
4:联系测序公司送测序。
一般一个克隆在35-45元。
这一部分的细节:1:涂板要均匀,保证Xgar和IPTG均匀分布在板面上;2:不要让蓝白斑长得太满,否则选取克隆时容易一下挑2个。
甲基特异性的PCR扩增(MS-PCR)示意图。
DNA经重亚硫酸盐处理后,以处理后的产物作为模板,加入甲基化特异性的引物(primerⅠ)或非甲基化的引物(primerⅡ),进行特异性的扩增(如图所示),只有结合完全的甲基化或非甲基化特异性引物的片段才能扩增出产物。
这种方法的优点是:1.避免了使用限制性内切酶及其后续相关问题;2.敏感性高;可用于石蜡包埋样本[12];缺点是:1.要预先知道待测片段DNA的序列;2.引物设计至关重要;3.若待测DNA中5-甲基胞嘧啶分布极不均衡,则检测时较为复杂;4.这种方法只能作定性研究,即只能明确是否存在甲基化;若要求定量,则需用其他的方法进行进一步检测;5.存在重亚硫酸盐处理不完全导致的假阳性。
