第2章传质分离过程的热力学基础
化工分离工程第2章 单级平衡过程

FLGC
• 活度系数法通式
fˆi L
i
xi
fiL
i
xi
is
Pi s
expVi L
(P RT
Pi s
)
yiˆiv
P
i
xiis Pi s
expVi L
(P RT
Pi s
)
i 1,2,, N
低压至中压
expVi
L
(P RT
Pi
s
)
1
yiˆiv P
xi
s
ii
Pi
s
i 1,2,, N
(2-7)
11
FLGC
两种常用的汽液相平衡关系表达式:
(2-5)式和(2-6)式代入(2-4),得 ˆiV yi p ˆiL xi p (2-5)式和(2-7)式代入(2-4),得 ˆiV yi p i xi fiOL
12
FLGC
二、相平衡关系的表示方法:
1. 相图 yi
主要用来表示二元组分体系的相 平衡关系,包括恒压下的t-x图和 y-x图,以及恒温下的p-x图。
i
④判定 | 1 S y | 是否接近0,是,得到Tb=T和Ki;否,按以下方式调整
T。
⑤ S y 1,T偏大,调小; S y 1,T偏小,调大;调整后返回②。
FLGC
一、泡点温度的计算
1. Ki与组成无关: Ki f (T, P)
泡点方程:
f
T
C
Ki xi
1
0
i 1
假定T
已知P 得到Ki 调整T
3
FLGC
• 相平衡,是研究多相平衡体系的状态如何随温度、 压力、组成的变化的科学。
第二章 2.3 闪蒸

(0) T TB
TD TB
(2-61)
可采用Newton-Raphson法迭代 :
(k1) (k ) f (k) f (k)
(2-62)
f
(
(k)
)
C i1
(Ki 1)2
[1 (k) (Ki
zi 1)]2
Iteration equation
Specified variables: F, TF, PF, z1, z2,……, zC, TV,PV Steps:
(1) Solve
C
f ( )
(Ki 1)zi 0
i1 1 (Ki 1)
(2) V F
(3)
xi
zi
1 (Ki
1)
(4)
yi
Ki xi
Ki zi
部分冷凝 露点气体
过热气体
例1
• 进料流率为1000kmol/h的轻烃混合物,其 摩尔组成为:丙烯(1)30%,丙烷(2)35%, 异丁烷(3)35%。在900kPa和40℃下闪蒸问 题是否成立?
过热蒸气, 闪蒸不成立!
练习1
• 进料流率为1000kmol/h的轻烃混合物,其 摩尔组成为:丙烯(1)30%,丙烷(2)35%, 异丁烷(3)35%。在1000kPa和40℃下闪蒸 问题是否成立?
下次上课时交上节内容总结露点温度计算已知p结束输出ty调整t结束输出tx调整t本节内容闪蒸及部分冷凝概念闪蒸设计变量及分类等温闪蒸和部分冷凝绝热闪蒸和部分冷凝一闪蒸及部分冷凝概念闪蒸是连续单级蒸馏过程该过程使进料混合物部分气化或冷凝得到含易挥发组分角度的蒸汽和含难挥发组分较多的液体
泡点和露点计算
正丁烷 (1)
2.1
0.315
正戊烷 (2) 0.71
0.284
正己烷 (3) 0.25
0.1125
∑ 0.7115
传质分离过程
设温度为60℃,查P-T-K 图得K,将K值列于下表
组分 正丁烷 正戊烷 正己烷
∑
Ki
2.8
0.93
0.36
Kixi
0.42
0.372 0.162 0.954
yi
0.42
Ki f T, P, xi , yi
计算步骤:
L i
Pi S
iS
ˆ Vi P
exp ViL
P PiS RT
已知p,假设T 求出(或查出)各组分的相应参数
由已知的 x按i 理想状态求出Ki,初步算出 yi
求出 Ki,由已知的xi yi Ki xi
Ki xi 1 (通常取为0.005) 泡点T
如果 Ki xi 1 ; 升高T,重新计算。 Ki xi 1 ; 降低T,重新计算。
传质分离过程
开始 Y
输入P、y及有关参数
设T并令 1 作第一次迭代
计算PiS ,ViL ,iS ,ˆiV
调整T
计算 K i和xi 计算 xi
是否第一次迭代
圆整 xi
计算 i
Y
N
xi有无变化
N
xi 1 N
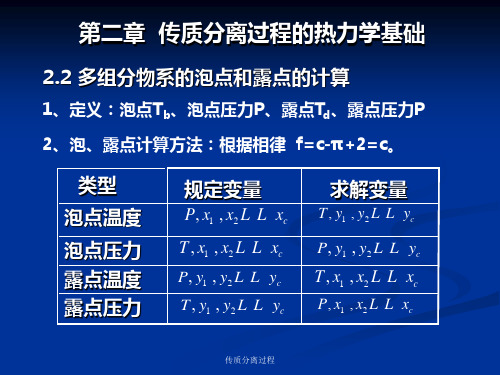
第二章 传质分离过程的热力学基础
2.2 多组分物系的泡点和露点的计算
1、定义:泡点Tb、泡点压力P、露点Td、露点压力P 2、泡、露点计算方法:根据相律 f=c-π+2=c。
类型 泡点温度
泡点压力 露点温度 露点压力
规定变量
P, x1 , x2 L L xc
分离模拟考题

模拟考试试题 (1)卷一、填空(每空2分,共20分)1、气液传质分离过程的热力学基础是( )。
如果所有相中的温度压力相等、每一组分的逸度也相等,则此时达到了 。
2、精馏塔计算中每块板温度变化是由于 改变,每块板上的温度利用 确定。
3、多组分精馏根据指定设计变量不同可分为 型计算和 型计算。
4、只在塔顶或塔釜出现的组分为 。
5、 超滤是以 为推动力,按( )选择分离溶液中所含的微粒和大分子的膜分离操作。
6、吸收操作在传质过程上的主要特征是 二、推导分析(20分)1. 由物料衡算,相平衡关系式推导图1单级分离基本关系式。
1(1)0(1)1ci i i i z K K ψ=-=-+∑ 式中: K i ——相平衡常数;ψ——气相分率(气体量/进料量)。
2. 一烃类混合物送入精馏装置进行分离,进料组成和相对挥发度a 值如下,现有A 、B 两种方案可供选择(见下图),你认为哪种方案合理?为什么?异丁烷 正丁烷 戊烷 异丁烷 正丁烷 戊烷摩尔% 25 30 45 相对挥发度:1.24 1.00 0.34三、简答(每题5分,共25分)1. 在萃取精馏中,萃取剂在何处加入?为何?2. 从热力学角度和工艺角度简述萃取精馏中萃取剂选择原则?3. 在吸收过程中,塔中每级汽、液流量为什么不能视为恒摩尔流?4. 试分析吸附质被吸附剂吸附一脱附的机理?5. 精馏过程全回流操作的特点?四、计算(1、2题10分,3题15分,共35分)1. 将含苯0.6(mol 分数)的苯(1)—甲苯(2)混合物在101.3kPa 下绝热闪蒸,若闪蒸温度为94℃,用计算结果说明该温度能否满足闪蒸要求? 已知:94℃时 P 10=152.56kPa P 20=61.59kPa2. 已知某乙烷塔,塔操作压力为28.8标准大气压,塔顶采用全凝器,并经分析得塔顶产品组成为:组 分 甲烷. 乙烷. 丙烷. 异丁烷. 总合组成x iD 1.48 88 10.16 0.36 100%(摩尔) 相平衡常数: 5.4 1.2 0.37 0.18 (20℃) 5.6 1.24 0.38 0.19 (22℃) 试计算塔顶温度。
传质分离过程_绪论

●采用生产装置的闭路循环技术;
●处理生产中的副产物和废物,使之减少和消除 对环境的危害; ●研究、开发和采用低物耗、低能耗、高效率的 “三废”治理技术。
闭路循环系统: 将过程所产生的废物最大限度地回收和循环 使用。
原 料 产品 1 废 物 1 废 物 1
2
2
2
排除
1—单元过程;2—处理
实现分离与再循环系统使废物最小化的方 法: ●废物直接再循环
超滤(UF):
目的:溶液脱大分子,大分子溶液脱小分子,大 分子分级。
进料
胶体大分子
溶剂、水
推动力:压力差(100~1000kPa)
传递机理:筛分
反渗透(RO):
目的:溶剂脱溶质,含小分子溶质溶液浓缩。
进料
溶质、盐 溶剂、水
推动力:压力差(1000~10000kPa) 传递机理:扩散模型
渗析(D):
先修课程:
物理化学、化工热力学、化工原理
同时进行的课程:
化工工艺学、化工过程分析与模拟
教材:
刘家祺 主编.传质分离过程.高等教育出版社,2005.
参考书:
邓修,吴俊生.化工分离工程. 科学出版社,2000.
陈洪纺 刘家祺.化工分离过程。化学工业出版社, 1995.
刘家祺 主编. 分离过程。化学工业出版社, 2002.
第7章 分离过程的节能优化与集成
第1章 绪论
1.1 概述 1.2 分离因子 1.3 分离过程的集成化 1.4 过程开发及方法 1.5 分离方法的选择
第1章 绪论
基本要求: 1)了解分离操作在化工生产中的重要性; 2)熟悉分离过程的分类; 3)掌握分离因子的概念及意义; 4)了解分离方法的选择;
大学化工分离工程教案

课程名称:化工分离工程授课班级:化学工程与工艺专业授课教师:[教师姓名]授课时间:[具体日期]课时安排:2课时教学目标:1. 让学生了解化工分离工程的基本概念、分类和重要性。
2. 掌握常见分离方法的原理、操作特点和设备。
3. 理解分离过程的热力学平衡、传质与扩散的基本理论。
4. 培养学生分析和解决实际化工分离工程问题的能力。
教学内容:一、绪论1. 化工分离工程的基本概念、分类和重要性2. 常见分离方法简介二、传质与分离过程的热力学基础1. 热力学平衡2. 传质与扩散的基本理论三、常见分离方法1. 吸收法- 原理、操作特点、设备- 气液吸收、气固吸收2. 蒸馏法- 原理、操作特点、设备- 简单蒸馏、精馏3. 萃取法- 原理、操作特点、设备- 液-液萃取、液-固萃取4. 膜分离法- 原理、操作特点、设备- 微滤、超滤、纳滤、反渗透教学过程:一、导入1. 提问:什么是化工分离工程?它在化学工业中的重要性是什么?2. 回答并总结化工分离工程的基本概念、分类和重要性。
二、讲授新课1. 传质与分离过程的热力学基础- 讲解热力学平衡、传质与扩散的基本理论,结合实例进行分析。
2. 常见分离方法- 吸收法、蒸馏法、萃取法、膜分离法- 分别介绍每种方法的原理、操作特点、设备,并举例说明。
三、课堂讨论1. 学生分组讨论:针对一个实际化工分离工程问题,分析并选择合适的分离方法。
2. 各组汇报讨论结果,教师点评并总结。
四、课堂小结1. 回顾本节课所学内容,强调重点知识。
2. 布置课后作业,巩固所学知识。
教学评价:1. 学生对化工分离工程的基本概念、分类和重要性的掌握程度。
2. 学生对常见分离方法的原理、操作特点和设备的理解程度。
3. 学生分析和解决实际化工分离工程问题的能力。
教学资源:1. 教材:《化工分离工程》2. 课件:化工分离工程相关课件3. 网络资源:化工分离工程相关网站、文献资料教学反思:本节课通过理论讲解、实例分析和课堂讨论,使学生掌握了化工分离工程的基本概念、分类和重要性,了解了常见分离方法的原理、操作特点和设备。
第二章 2.1相平衡基础20120925

课内作业
1. 相平衡准则有哪几条? 2. 相平衡常数定义。 3. 什么是分离因子?在精馏过程中,分离因子 有什么特点?
4.说明逸度、活度及逸度系数、活度系数的定 义及物理意义。
目录
• • • • 2.1 一些基本概念 2.2 状态方程法 2.3 活度系数法 2.4 相平衡常数计算方法选择
2.1 相平衡基本概念
ˆ bi lnZ 1 b ln Φi m vt b vt 2 aai RTvt
计算得到气相和液相逸度系数:
ˆ ΦV 0.8405
ˆ Φ L 1.68587
ˆ yi Φ L K V 2.0 ˆ xi Φ
2.2 状态方程法
yi---Concentration of any component in vapor xi---Concentration of any component in liquid
For the liquid-liquid case(eg. Extraction), the constant is referred to as the distribution coefficient (分配系数)or liquid-liquid equilibrium ratio(液液平衡常数).
相对挥发度对温度和压力变化不敏感,常视为常数,以简化计算。
For the liquid-liquid case, relative selectivity is
K Di ij K Dj
分离因子与1的偏离程度表示组分间分离的难易程度。
2.2 状态方程法(PVT equation-of-state model)
(2)不凝性组分(non- condensed component) p14
泡点和露点计算课件

1. Ki与组成无关:if Ki f(T,P)
泡点方程:
C
fTKixi 10
i1
计算过程:
已知p 设T
计算或查图 得Ki
计算
C
f (T ) Ki xi 1 i 1
调整T
f (T )
是
结束 输出T,y
否
例题2-3
• 例2-3
• 三种组分含量 相差不大,取 分子量居中的 正戊烷在该压 力下的沸点为 初值
?定义哪些变量
称为设计变量
一、气液平衡系统设计 变量
多组分泡点、露点 计算的类型
二、泡露点计算重点、难点
相平衡常数Ki
• 与系统T、p有关
• 对非理想体系,还与气液相组成x,y
有关
• 计算的重点、难点:Ki的计算
(1)列线图 法求K值
p12
部分轻烃 忽略组成变化 对K值的影响
T升高,K如何变化? P增加,K如何变化?
计算中,如何适当的调整试差的温度(或压力)?
本节内容
• 气液平衡系统的设计变量 • 泡露点计算的重点、难点 • 泡点温度计算 • 露点温度计算
2.2 多组分物系的泡点和露点计算 Bubble-point and Dew-point Calculation for Multicomponent Systems
Kx yii iˆpV iis pisexV piL(R pT pis)
(2)活度系数、逸度系数法计算K值
Liquid
Gas
Ideal solution Real solution
Ideal gas
Ki
Pi s P
Ki
i Pi s
P
Ideal solution Real gas
分离课后习题和答案解析

【注意事项】1.因时间关系,详细复习总结的电子版没时间做了,大家抽空多看看课本,考试以课本基础知识为主,书上找不到答案的不会考。
2.这里主要总结了老师上课讲的课后题 参考 答案,以及部分往届复习的名词解释整合,大家参考记忆。
3.考试题型:6-7个名词解释,6-7个选择题(考察细节掌握,一个两分),填空,简答论述(接近50分)。
4.不考计算题,但依然会考公式的其他应用,复习时自己注意。
5.【P22】【P24】【P44-45】【P216-217】这几页的图和表必须会解读,【P191-192】这两页表必须背过,必考重点!考试没有画图题,但可能有读图题,常见的重点图示必须熟悉。
6.抓紧时间好好复习,今年监考比历届都要严,不要因小失大!!!7.最后,祝都过。
***感谢冯晓博、马阿敏、张雪琴三位热心的好学霸肯抽出时间为大家整理资料***第一章 绪论1.分离技术的三种分类方法各有什么特点?答:(1)按被分离物质的性质分类分为物理分离法、化学分离法、物理化学分离法。
(2)按分离过程的本质分类分为平衡分离过程、速度差分离过程、反应分离过程。
(3)场流分类法2.分离富集的目的?答:①定量分析的试样通常是复杂物质,试样中其他组分的存在常常影响某些组分的定量测定,干扰严重时甚至使分析工作无法进行。
这时必须根据试样的具体情况,采用适当的分离方法,把干扰组分分离除去,然后才能进行定量测定。
②如果要进行试样的全分析,往往需要把各种组分适当的分离,而后分别加以鉴定或测定。
③而对于试样中的某些痕量组分,进行分离的同时往往也就进行了必要的浓缩和富集,于是就便于测定。
因此物质的化学分离和测定具有同样重要意义。
3.什么是直接分离和间接分离?答:直接分离是将待测组分从复杂的干扰组分分离出来;间接分离是将干扰组分转入新相,而将待测组分留在原水相中。
4.阐述浓缩、富集和纯化三个概念的差异与联系?答:富集:通过分离,使目标组分在某空间区域的浓度增大。
化工分离过程第二章

(2) 逸度与组成的关系 气相逸度与气相组成yi的关系为:
fˆiV
fi0V
V i
yi
Pi0V
V i
yi
PˆiV yi
式中:fi0V 在系统温度和压力下纯组分i的气相逸度 γiV 组分i的气相活度系数 φi0V在系统温度和压力下,纯组分i的气相逸度系数 φiV 在系统温度和压力下,组分i的气相分逸度系数且
ˆiL
i0L
L i
平衡时,汽液两相逸度相等,通过平衡常数Ki的定义式可求 出相平衡常数。
10
1. 汽液平衡关系(Vapor-liquid phase equilibrium)
fˆiV fˆi L
(2-4)
引入逸度系数 :
ˆ i
,汽相中组分i的逸度系数 ˆ Vi 定义为
ˆ iV fˆiV / yiP
ZM
PVt RT
RT (Vt b
a Vt2
)Vt
RT
Vt Vt
b
a RTVt
2
④计算汽相逸度系数
将(2—15)积分后代入以上结果:
ln
) i
bi Vt b
ln[ZM
(1
b Vt
)]
2 aai RTVt
3
25
⑤用xi代替yi,按照②~④步骤求各组分的液相逸度 系数
⑥由式(2-14)求Ki值。
fi L
Pi S iS
exp[ViL (P PiS )] RT
(2-21)
33
由式(2—21)可知,纯液体i在T、P下的逸度等于饱和 蒸汽压乘以两个校正系数。
S i
为校正处于饱和蒸汽压下的蒸汽对理想气体的偏离,
而指数校正项也称普瓦廷(Poynting)因子,是校正压
授课教案 (Teaching plan)

授课教案(Teaching plan)培养目标作为现代高等教育的发端,天津大学在一百一十多年的办学实践中,秉承“实事求是”校训和“严谨治学、严格教学要求”的双严方针,牢固树立学校以育人为本、育人以教育为先、质量是学校的生命线、教学工作在学校具有优先地位的理念。
强化教学管理,深化教学改革,逐步构建了具有天大特色的本科创新人才培养体系。
努力培养专业口径宽、理论基础厚、实践能力强、综合素质高,具有创新精神和国际视野的高层次人才,使之成为推动科技创新、经济发展、社会进步的栋梁。
本课程是高等学校化学工程及工艺专业(本科)的一门专业基础课,是学生在具备了物理化学、化工原理、化工热力学等技术基础知识后的一门专业主干课。
本课程主要讲授化工生产实际中复杂物系的分级、分离、浓缩、提纯等技术。
通过该课程的学习,使学生掌握各种常用分离过程的基本理论,操作特点,简捷和严格计算方法以及强化改进操作的途径,并对一些新型分离技术有一定的了解,能够根据具体的分离任务和分离要求,选择适宜的分离方法,设计合理的分离序贯。
围绕本课程的实验教学、仿真实习、工程案例教学环节使分离理论与实践有机结合,显著增强了课程的工程实践特色,符合工科创新性人才的培养目标。
重点难点(1)课程的重点、难点化工分离过程属于理论性较强的课程,综合运用化工原理、物理化学、化工热力学、传递过程等课程的理论知识,针对化工生产中经常遇到的多组分非理想性物系,从分离过程的共性出发,讨论各种分离方法的特征。
本课程着重基本概念的理解,为分离过程的选择、特性分析和计算奠定基础。
在以基础知识、基本理论为重点的基础上,强调将工程与工艺相结合的观点,以及设计和分析能力的训练;强调理论联系实际,以提高解决实际问题的能力。
另外,在讲授传统分离技术的同时,还不断引进新型分离技术的有关内容,并逐渐加强其重要性,以拓宽学生在分离工程领域的知识面,从而适应多种专业化方向的要求。
难点在于本课程中应用到很多化工热力学和传递过程理论,内容较为深奥和抽象。
其它课程-分离课后习题及答案_1

分离课后习题及答案第一章绪论1.分离技术的三种分类方法各有什么特点?答:(1)按被分离物质的性质分类分为物理分离法、化学分离法、物理化学分离法。
(2)按分离过程的本质分类分为平衡分离过程、速度差分离过程、反应分离过程。
(3)场流分类法2.分离富集的目的?答:①定量分析的试样通常是复杂物质,试样中其他组分的存在常常影响某些组分的定量测定,干扰严重时甚至使分析工作无法进行。
这时必须根据试样的具体情况,采用适当的分离方法,把干扰组分分离除去,然后才能进行定量测定。
②如果要进行试样的全分析,往往需要把各种组分适当的分离,而后分别加以鉴定或测定。
③而对于试样中的某些痕量组分,进行分离的同时往往也就进行了必要的浓缩和富集,于是就便于测定。
因此物质的化学分离和测定具有同样重要意义。
3.什么是直接分离和间接分离?答:直接分离是将待测组分从复杂的干扰组分分离出来;间接分离是将干扰组分转入新相,而将待测组分留在原水相中。
4.阐述浓缩、富集和纯化三个概念的差异与联系?答:富集:通过分离,使目标组分在某空间区域的浓度增大。
浓缩:将溶剂部分分离,使溶质浓度提高的过程。
纯化:通过分离使某种物质的纯度提高的过程。
根据目标组分在原始溶液中的相对含量(摩尔分数)的不同进行区分:(方法被分离组分的摩尔分数)富集0.9。
5.回收因子、分离因子和富集倍数有什么区别和联系?答:(1)被分离物质在分离过程中损失量的多少,某组分的回收程度,用回收率来表示。
待测组分A 的回收率,用RA 表示,QA °---为富集前待测物的量;QA---富集后待测物的量。
%100?= AA A Q Q R (2)分离因子:两组分的分离程度。
用SA ,B 表示。
BA B A B A B ,//R R Q Q Q Q S A =??= A —待测组分;B —干扰组分。
如果待测组分A 符合定量要求,即可认为QA ≈ Q oA ,SA,B ≈ Q oB/QB = 1/RB ,常量组分测定:SA,B ≈103;分离因子越大,分离效果越好。
(NEW)贾绍义《化工传质与分离过程》(第2版)笔记和考研真题详解

目 录绪 论0.1 复习笔记0.2 名校考研真题详解第1章 传质过程基础1.1 复习笔记1.2 名校考研真题详解第2章 气体吸收2.1 复习笔记2.2 名校考研真题详解第3章 蒸 馏3.1 复习笔记3.2 名校考研真题详解第4章 气液传质设备4.1 复习笔记4.2 名校考研真题详解第5章 液-液萃取5.1 复习笔记5.2 名校考研真题详解第6章 固体物料的干燥6.1 复习笔记6.2 名校考研真题详解第7章 其他传质与分离过程7.1 复习笔记7.2 名校考研真题详解绪 论0.1 复习笔记一、传质分离方法的分类依据物理化学原理的不同,传质分离过程可分为平衡分离和速率分离两大类。
1平衡分离过程平衡分离过程是指借助分离媒介(如热能、溶剂、吸附剂等),使均相混合物系统变为两相体系,再以混合物中各组分在处于平衡的两相中分配关系的差异为依据而实现分离的过程。
根据两相状态的不同,平衡分离过程可分为:(1)气液传质过程,如吸收(或脱吸)、气体的增湿和减湿。
(2)汽液传质过程,如液体的蒸馏和精馏。
(3)液液传质过程,如萃取。
(4)液固传质过程,如结晶(或溶解)、浸取、吸附(脱附)、离子交换、色层分离、参数泵分离等。
(5)气固传质过程,如固体干燥、吸附(脱附)等。
在平衡分离过程中,i组分在两相中的组成关系常用分配系数(又称相平衡比)K i来表示,即K i值的大小取决于物系特性及操作条件(如温度和压力等)。
组分i和j的分配系数K i和K j之比称为分离因子αij,即通常将K值大的当作分子,αij一般大于1。
当αij偏离1时,可采用平衡分离过程使均相混合物得以分离,a ij越大越容易分离。
2速率分离过程速率分离过程是指借助某种推动力,如浓度差、压力差、温度差、电位差等的作用,某些情况下在选择性透过膜的配合下,利用各组分扩散速度的差异而实现混合物分离操作的过程。
速率分离过程可分为:(1)膜分离;(2)场分离。
二、传质设备1对传质设备性能要求(1)单位体积中,两相的接触面积应尽可能大,两相分布均匀,避免或抑制短路及返混;(2)流体的通量大,单位设备体积的处理量大;(3)流动阻力小,运转时动力消耗低;(4)操作弹性大,对物料的适应性强;(5)结构简单,造价低廉,操作调节方便,运行可靠安全。
传质分离过程

本课程是高等学校化学工程及工艺专业(本科)的一门专业基础课,是学生在具备了物理化学、化工原理、化工热力学等技术基础知识后的一门专业主干课。
本课程主要讲授化工生产实际中复杂物系的分级、分离、浓缩、提纯等技术。
通过该课程的学习,使学生掌握各种常用分离过程的基本理论,操作特点,简捷和严格计算方法以及强化改进操作的途径,并对一些新型分离技术有一定的了解,能够根据具体的分离任务和分离要求,选择适宜的分离方法,设计合理的分离序贯。
围绕本课程的实验教学、仿真实习、工程案例教学环节使分离理论与实践有机结合,显著增强了课程的工程实践特色,符合工科创新性人才的培养目标。
(1)课程的重点、难点化工分离过程属于理论性较强的课程,综合运用化工原理、物理化学、化工热力学、传递过程等课程的理论知识,针对化工生产中经常遇到的多组分非理想性物系,从分离过程的共性出发,讨论各种分离方法的特征。
本课程着重基本概念的理解,为分离过程的选择、特性分析和计算奠定基础。
在以基础知识、基本理论为重点的基础上,强调将工程与工艺相结合的观点,以及设计和分析能力的训练;强调理论联系实际,以提高解决实际问题的能力。
另外,在讲授传统分离技术的同时,还不断引进新型分离技术的有关内容,并逐渐加强其重要性,以拓宽学生在分离工程领域的知识面,从而适应多种专业化方向的要求。
难点在于本课程中应用到很多化工热力学和传递过程理论,内容较为深奥和抽象。
(2)解决办法1)采用多媒体课件与传统教学方式相结合的方法授课2)注重启发式教学,课堂上与学生互动,开展讨论式教学,培养学生的思维能力。
3)安排专门的实验教学和工程案例教学,加深学生对课程内容的理解和体会。
4)开发CAI教学课件,将课程中的重点、难点形象化,动画,兴趣化,帮助和有利于学生学习、掌握课程重、难点内容。
5)让学生走进教授实验室,进行科技创新实践,学以致用。
教学大纲课程名称:化工分离过程英文名称:Chemical Separation Processes学分:3学时:48教学对象:化学工程与工艺专业四年级本科生预修课程:物理化学、化工原理、化工热力学、传递过程。
化工分离过程重点

化工分离过程重点1、相平衡:指混合物或溶液形成若干相,这些相保持着物理平衡而共存的状态,从热力学上看,整个物系的自由焓处于最小的状态;从动力学看,相间表观传递速率为零。
2、区域熔炼:是根据液体混合物在冷凝结晶过程中组分重新分布的原理,通过多次熔融和凝固,制备高纯度的金属、半导体材料和有机化合物的一种提纯方法。
3、独立变量数:一个量改变不会引起除因变量以外的其他量改变的量。
4、反渗透:是利用反渗透膜选择性地只透过溶剂(通常是水)的性质,对溶液施加压力克服溶液的渗透压,使溶剂从溶液中透过反渗透膜而分离出来的过程。
5、相对挥发度:溶液中的易挥发组分的挥发度与难挥发组分的挥发度之比。
6、理论板:是一个气、液两相皆充分混合而且传质与传热过程的阻力皆为零的理想化塔板。
7、清晰分割:若馏出液中除了重关键组分外没有其他的重组分,而釜液中除了轻关键组分外没有其他轻组分,这种情况为清晰分割。
8、全塔效率:完成给定任务所需要的的理论塔板数与实际塔板数之比。
默弗里板效率:实际板上的浓度变化与平衡时应达到的浓度变化之比。
9、泡点:在一定压力下,混合液体开始沸腾,即开始有气泡产生时的温度。
露点:在一定压力下,混合气体开始冷凝,即开始出现第一个液滴时的温度。
10、设计变量:设计分离装置中需要确定的各个物理量的数值,如进料流率,浓度、压力、温度、热负荷、机械工的输入(或输出)量、传热面大小以及理论塔板数等。
这些物理量都是互相关联、互相制约的,因此,设计者只能规定其中若干个变量的数值,这些变量称设计变量。
简答题:1、分离操作的重要意义答:分离操作一方面为化学反应提供符合质量要求的原料,清除对反应或者催化剂有害的杂质,减少副反应和提高收率;另一方面对反应产物起着分离提纯的作用,已得到合格的产品,并使未反应的反应物得以循环利用。
此外,分离操作在环境保护和充分利用资源方面起着特别重要的作用。
2、精馏塔的分离顺序答:确定分离顺序的经验法:1)按相对挥发度递减的顺序逐个从塔顶分离出各组分;2)最困难的分离应放在塔序的最后;3)应使各个塔的溜出液的摩尔数与釜液的摩尔数尽量接近;4)分离很高回收率的组分的塔应放在塔序的最后;5)进料中含量高的组分尽量提前分出。
泡点和露点计算-PPT

1. Ki与组成无关:if Ki f(T,P)
泡点方程:
C
fT Kixi 10
i1
计算过程:
已知p 设T
计算或查图 得Ki
计算
C
f (T ) Ki xi 1 i 1
调整T
f (T )
是
结束 输出T,y
否
12
例题2-3
• 例2-3 • 三种组分含量
相差不大,取 分子量居中的 正戊烷在该压 力下的沸点为 初值 • 从p-T-K图上 查得T0=62’C
当汽相为理想气体,液相为非理想溶液时:
c
pb i pis xi i1
当Ki=f(T,p,x,y)时,用活度系数法(压力不太高)或 状态方程法(压力较高)计算泡点压力。
28
开始
输入T,x及有关参数 估计p,并令iV=1,作第一次迭代
计算pis、ViL、is、i
调整p
N
计算Ki和yi
计算 yi
是否第一次迭代
RCoalucnudlateyiˆ Vi
Whether first Y iteration or not
N
yi Change Y
or not N
n yi
Output p, y
活 度 系 数 法 计 算 泡 点 压 力 的 框 图
End
29
输入T, x及有关参数, p和y估计值
求iV和iL
计算Ki
N
Ln yi
Y
输出T,y
圆整yi,计算iV
Y
Y
结束
Adjust T
Start Input p, x
Set T and ˆ Vi 1 as first iteration
热力学知识:热力学热力学传热和传质

热力学知识:热力学热力学传热和传质热力学是研究能量转换和传递的科学,其中包括热力学传热和传质。
热力学传热和传质在热力学中具有重要的地位,是许多重要领域的基础。
本文将介绍热力学传热和传质的概念、原理和应用。
一、热力学传热1.概念热力学传热是指在温度不同的两个物体之间,由高温物体向低温物体传递热量的过程。
在热力学传热中,热的流动是通过传导、对流和辐射等方式进行的。
2.传导传导是指热量通过物体内部的分子迁移方式传递,也就是热的共振传递。
热传导和绝缘材料,例如玻璃,陶瓷和聚合物等密切相关。
绝缘材料具有极低的导热系数,能够起到很好的隔热作用。
3.对流对流是指热量通过物体内部的流体(气体或液体)传递,也就是流体自然或强迫对流传热。
热的对流传递在许多工业和环境应用中具有重要的意义。
4.辐射辐射是指物体通过空气和真空传达热量,这种方式通过辐射能量传热。
热辐射传递在许多工业和环境应用中都是非常重要的。
二、热力学传质1.概念热力学传质是指由浓度高的物质向浓度低的物质传递的质量过程。
在热力学传质中,质量的流动是通过扩散和对流等方式进行的。
2.扩散扩散是指物质通过分子的自发传递方式来传递,在很多环境中都是非常重要的,例如水体中的营养物质或污染物。
3.对流对流是指物质通过携带物质的流体(气体或液体)传递,这是一种较快的传质方式。
对流过程在许多领域都具有重要的应用,例如化学工程和污水处理等。
三、应用1.工业领域热力学传热和传质在许多工业领域都是非常重要的。
例如,化学过程需要控制化学反应速率和温度,而这些都需要通过对热力学传热和传质的控制来实现。
2.环境领域热力学传热和传质也在环境领域中具有重要的意义,例如大气污染和水资源管理。
热力学传热和传质可以用来控制污染物和营养物的传递,从而控制环境中的化学和生物反应。
3.生物领域热力学传热和传质在生物领域中也有着广泛的应用,例如生物反应器和药物传递等。
它们可以用来控制生物反应器中的温度和营养物传递,从而增加生物反应器的效率和稳定性。
第二章 2.2泡点和露点计算概要

练习2
• 求含乙烷(1)0.1、丙烯(2)0.35、丙烷(3)0.4、 异丁烷(4)0.15(摩尔百分比)的烃类混合 物在400kPa时的泡点温度
五、泡点、露点压力计算
• 与泡点、露点温度计算类似,只是矫正的 是压力 • 注意:用p-T-K图计算时,如果p增加,Ki值 减少,因此在试差计算过程中要注意p的调 整方向
Output p, y
输出p,y
结束
活 度 系 数 法 计 算 泡 点 压 力 的 框 图
End
输入T, x及有关参数, p和y估计值
输出 p 和 y
Y
求iV和iL
调整p
N
Kixi=1
N
计算Ki
归一化yi
Y
Y
Kixi是否变化
计算 Kixi
第一次迭代
N
状 态 方 程 法 计 算 泡 点 压 力 的 框 图
f (T ) yi / K i 1
i 1
C
f (T )
是
结束 输出T,x
调整T
否
参见例[2-6]
(二)露点压力计算
• 类似泡点压力计算,仅泡点压力方程不同
本章总结
• 泡点方程 • 泡点温度计算过程
已知p 设T 计算或查图 得Ki 计算
f (T ) K i xi 1
i 1
C
f (T )
是
结束 输出T,y
调整T
否
• 露点方程 • 露点温度计算
已知p 设T 计算或查图 得Ki 计算
Round yi ˆV Calculate i
计算 yi
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
纯组分i在一定温度的饱 和蒸汽压下的逸度系数。
纯液体组分 i 在系统温度下的 摩尔体积,与压力无关。
L s f i L pis is exp V ( p p i ) / RT i
校正饱和蒸汽压下的蒸 汽对理想气体的偏离。
Poynting因子,校正压力 对饱和蒸汽压的偏离。
Henry’s law
不凝组分的逸度:
ˆ L * Hx f i i i
不对称型标准化方法 对于由一个溶质(不凝性组分)和一个溶剂(可凝性组分) 构成的两组分溶液,通常,
0L L f f x 1 , 1 i i i 溶剂的活度系数基准态定义为: i
ˆ iL yi Ki V ˆ xi i
以V和T为独立变量:
ˆ f ˆ ln i 1 ln i pyi RT
V
[(
p RT )T ,V ,n j ]dVt ln Z m ni Vt
以p和T为独立变量:
ˆ f 1 i ˆ ln i ln pyi RT
equilibrium ratio(气液平衡常数).
yi Ki xi
yi---Concentration of any component in vapor xi---Concentration of any component in liquid
For the liquid-liquid case(eg. Extraction), the constant is referred
.
Dalton’s law
pi yi p
Case 3---真实混合物
用逸度系数或活度系数计算逸度
For a real mixture, partial fugacity coefficients are defined by
ˆV ˆVy p f i i i
and
ˆL ˆ Lx p f i i i
ˆL f i i 0L ˆ x f
i i
Fugacity under standard state 通常取纯组分 i的液体在系统温 度和压力下的逸度。
ˆL x f ˆ 0L f i i i i
ˆV ˆVy p f i i i
0L
yi i f i Ki V ˆ p xi i
V L ˆ ˆ fi fi
Therefore,
ˆVy p ˆ Lx p i i i i
ˆ iL yi Ki V ˆ xi i
应用状态方程分别计算汽、液两相的逸度系数。
At vapor-liquid equilibrium,
V L ˆ ˆ fi fi
Activity coefficient of i species in a liquid phase is defined by:
(1)可凝性组分 For condensed component, the standard state is selected as the pure species at the same pressure and phase condition as the mixture. xi 1, i 1 ˆL 0L L f i f f i i i xi f i 0 L Lewis-Randall
混合物所形成的若干相保持物理平衡而共存的状态。 热力学:整个物系的自由能最小
动力学:相间表观传递速率为零 相平衡条件(准则): 各相的温度相等、压力相等,每个组分的化学位、逸度等。
T T T ......
P P P ......
i ˆ f i C exp RT
For the liquid-liquid case, relative selectivity is
K Di ij K Dj
selectivity coefficient (选择性系数) for Extraction
选择性系数与1的偏离程度表示组分间分离的难易程度。
2.1.1 汽液平衡 Vapor-liquid equilibrium
基准态逸度
活度系数等于1的状态
基准态逸度是与系统具有相同T、p和同一相态的纯i组分的逸度。
以p和T为独立变量:
ˆ f 1 i ˆ ln i ln pyi RT
用于计算纯组分的逸度:
Vt RT p0 [( ni )T , p,n j p ]dp
p
fi 1 ln p RT
p
xi(2)---Concentration of any component in raffinate
Ki 的计算:
Case 1---理想体系的吸收过程
亨利定律(Henry’s Law)
Case 2---理想体系的精馏过程
拉乌尔定律(Raoult’s Law)
Case 3---非理想体系
用气相逸度和液相活度系数来计算
At vapor-liquid equilibrium,
V L ˆ ˆ fi fi
Case 1—纯组分
fugacity,
逸度等于纯组分的逸度
For a pure component, the partial fugacity,
ˆ f i
, becomes the pure-component
fi .
to as the distribution coefficient ( 分 配 系 数 ) or liquid-liquid equilibrium ratio(液液平衡常数).
K xi(1)---Concentration of any component in extract
分离因子
Separation Factor
yi /y j
平衡分离过程,常采用分离因子表示平衡关系。
For the vapor-liquid case, separation facor is
Ki ij xi /x j K j
relative volatility(相对挥发度) for Distillation 相对挥发度对温度和压力变化不敏感,常视为常数,简化计算。
3. 分离因子:
Separation Factor
平衡常数
Equilibrium Ratio
For the vapor-liquid case ( eg Distillation and Absorption ) , the constant is referred to as the K-value ( K 值 ) or vapor-liquid
第二章 传质分离过程的热力学基础
?
极限程度 ---- 热力学 分离速率 ---- 动力学
本章主要知识点
1. 相平衡常数计算:状态方程法,活度系数法 2. 泡点、露点计算 (1)泡点计算:在一定p(或T)下,已知xi,确 定Tb(或pb)和yi。 (2)露点计算 3. 等温闪蒸和绝热闪蒸计算:给定物料的量与组成, 计算在一定p和T下闪蒸得到的汽相量与组成,以 及剩余的液相量与组成。
2.1 相平衡基础
常见的化工单元操作,如精馏、吸收、萃取、结晶等 都是有相变化的过程,其研究和设计基础是相平衡、物料 平衡和传递速率。相平衡在传质分离过程中占有重要地位, 实际系统与平衡状态的差距是相间传质过程的推动力。相 平衡是阐述混合物分离原理和计算传质推动力的基础数据。
相平衡关系
什么是相平衡?
Vt RT p0 [( ni )T , p,n j p ]dp
p
状态方程法的关键 适合于气相、液相和固相溶液
选择一个既适用于气相,又适用于液相的状态方程
Useful Equations of State
Name Ideal gas law Equation
p RT V
Equation constants and function
与实际体系相差较大
(2)用范德华方程计算
2 aai b b i ˆ ln Φ ln Z m 1 i Vt b Vt RTVt
RT 2 a ab Vt b Vt Vt 0 p p p
3
ˆ V 0.8405 Φ
R 2 Tc a 0.4278 pc
5
2
b 0.0867
RTc pc
p
RT a V b V (V b)
0.5 1 (1 Tr0.5 )(0.480 1.574 0.176 2 )
R 2 Tc a 0.4278 pc
5 2
b 0.0867
RTc pc
逸度等于组分的分压
Case 2---理想气体混合物
For a pure ideal gas, fugacity is equal to the pressure, and for a component in an ideal gas mixture, the partial fugacity is equal to its partial pressure,
(2)不凝性组分 (non- condensed component)
ˆL f i
xi 0, i 1
*
i
xi f i
0L
fi
0L
ˆL f H lim i xi 0 x i
基准态下组分i的逸度是在系统T和p下估计的亨利系数。 当T、p 一定,xi → 0时:
ˆ L Hx f i i
0
RT Vi p dp
对气、液、固组分均适用
p fi L 1 pis RT RT ln dp s Vi dp 0 Vi pi p RT p p L s V (p p p s i i ) ln i ln s RT pi
