欧盟食品添加剂法规04
欧盟食品添加剂法规04

理事会指令89/107/EEC使各成员国食品添加剂法律趋于一致的指令(OJ L40,11.2.1989,P.27)Ml的生效日期为:1994年9月10日。
M2的生效日期为:2003年11月20日。
欧洲共同体理事会,考虑到建立欧洲经济共同体的条约,特别是其第100a条,考虑到委员会的提案,为与欧洲议会合作(OJ No C 99,13.4.1987,p.65和OJ No C 12,16.1.1989),考虑到经济与社会委员会的意见(OJ No C 328,22.12.1986,p.5),鉴于各国食品添加剂的法律和使用条件的差异阻碍了食品的自由流通;鉴于这些差异可能会为不公平的竞争创造条件,进而会对共同市场的建立或机能产生直接影响;鉴于有必要使这些法律趋于一致;鉴于这些要求应包含在一项全面综合性的指令中,而该指令有必要分阶段起草;鉴于一个指令所涵盖的食品添加剂种类的清单,根据条约第100a条规定的程序,是由理事会做出决定;鉴于属于上述种类的食品添加剂的使用,只有建立在与理事会规定的科学技术标准一致的基础上,才应被批准;鉴于在起草食品添加剂清单和它们的使用条件时,在采用很可能会影响公众健康的规定之前,应与依据委员会74/234/EEC(OJ No L 136,20.5.1974,p.1),决议成立的食品科学委员会磋商;鉴于采用认可的添加剂清单必须就科学技术的发展而言是可行的;有鉴于此,除了条约规定程序的规则外,为了寻求共同体的解决方法,通过采用临时的国家措施来建立允许各成员国发挥作用的体制也可能是适当的;鉴于上述食品添加剂纯度标准的测定以及分析和取样方法的制定都是委托委员会处理的技术问题;鉴于任何情况下理事会都会授权委员会实施有关食品的规则,应制订条款规X个成员国与委员会间就食品常务委员会依据委员会决议69/414/EEC(OJ No L 29l,19.11.1969,p.9)设立)业务X围内紧密合作的程序;兹通过本指令:第1条1.本指令应适用于附录中列出的、在食品加工或制备过程中用作或打算用作配料且在最终产品中仍然存在(尽管改,变了存在的形式)的各种食品添加剂。
欧盟添加剂限量标准[整理版]
![欧盟添加剂限量标准[整理版]](https://img.taocdn.com/s3/m/a46eff9ca32d7375a41780fc.png)
欧盟添加剂限量标准[整理版]No L61/1?欧盟议会和理事会指令95/2/EC1995年2月20除了色素和甜味剂的食品添加剂欧盟议会和理事会考虑到欧盟缔结的条约,尤其是第100a条,考虑到委员会的提议,考虑到经济和社会委员会的提议,根据条约第189b制定的程序进行,考虑到1998年12月21理事会指令89/107/EEC,成员国关于为人类消费而在食品中授权使用的食品添加剂的近似法律,尤其是第3(2)条,鉴于国家之间关于防腐剂、抗氧化剂和其它添加剂和它们的使用条件的不同,鉴于这可能造成不公平的竞争。
鉴于主要考虑这些食品添加剂和它们的使用条件应当必须保护消费者的规定,鉴于普遍公认未加工的食品和某些其它食品应当远离食品添加剂,鉴于考虑到最近关于这些物质的科学和毒理学信息,一些仅允许用于某些食品和在某些条件下使用,鉴于必须制定严格的制度在婴儿配方、成长配方及断奶食品中使用食品添加剂,象在1989年3月3日理事会指令89/398/EEC中提到的,有关成员国用于特殊营养使用的食品的相近法律,尤其是第4(1)(e),鉴于本指令不影响涉及甜味剂和色素的规定,鉴于依据1991年7月15日理事会指令91/414/EEC涉及的植物保护产品投放市场,依据1990年11月27日理事会指令90/642/EEC附的在某些植物原始产品中农药残留的最高标准,包括水果和蔬菜,属于此种类的物质暂时包括在本指令中,鉴于向食品科学委员会咨询有关那些物质不是联盟规定的科目,鉴于当决定一个特殊的食品属于食物的某个种类,最好跟随向食品标准委员会咨询的程序,鉴于除色素和甜味剂外的食品添加剂的现存纯标准和那些没有纯标准存在的的新规范的修改将采纳指令89/107/EEC第11条规定的相应程序,鉴于食品科学委员会还没有提出关于面粉处理剂的的建议,鉴于那些试剂将在一个单独的指令中规定,鉴于本指令取代指令64/54/EEC、70/357/EEC、74/329/EEC和83/463/EEC,鉴于那些指令特此废除,兹采纳如下指令:第1条1( 本指令是一个构成综合指令的特定的指令,在89/107/EEC指令的第3条的内涵之内,适用于除色素和甜味剂和面粉处理剂外的添加剂。
欧盟修订食品添加剂规则

欧盟修订食品添加剂规则
佚名
【期刊名称】《中国动物保健》
【年(卷),期】2004(000)011
【摘要】欧盟已经提议修改食品添加剂的使用,其中包括肉类亚硝酸盐规定水平的减少,防止使用凝胶成形的食品添加剂等。
欧盟已经提议批准将乙基纤维素、赤藻糖醇、4己基雷琐酚和大豆半纤维素作为食品添加剂使用。
【总页数】1页(P43-43)
【正文语种】中文
【中图分类】TS2
【相关文献】
1.欧盟修订含铝食品添加剂的使用条件及限量 [J],
2.欧盟修订食品添加剂的相关使用规则 [J],
3.欧盟修订食品添加剂规则 [J],
4.欧盟修订食品添加剂规则 [J],
5.欧盟修订食品添加剂标准将婴幼儿食品单列 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
原创欧盟食品添加剂法规概述

原创欧盟食品添加剂法规概述2008年12月16日欧洲议会和欧盟理事会通过了欧盟食品添加剂法规(EC)No 1333/2008,该法规于2010年1月20日实施,食品伙伴网信息服务中心通过研究法规,对该法规做简要介绍:首先我们来了解下欧盟对食品添加剂的定义,欧盟食品添加剂法规(EC) No 1333/2008中规定“食品添加剂”是指本身不作为食品使用,也不是正常食品的某种特征成分,不论其是否具有营养价值,为了某种技术目的,在食品制造、加工、配制、处理、包装、运输和储存过程中人为加入食品中,会导致或者可以预期该食品添加剂或其副产物会直接或间接成为食品一部分的物质。
欧盟食品添加剂法规中不包括加工助剂、酶制剂和香料。
食品伙伴网经查找发现,欧盟没有专门的食品法规管理除食品用酶和提取溶剂以外的加工助剂,欧盟一些成员国制定了本国的法律对食品加工助剂进行管理。
欧盟法规《REGULATION (EC) No.1332/2008》规定只有列入共同体目录(现称联盟目录)的食品用酶才能在市场销售及在食品中使用,目前欧盟的食品用酶目录暂未发布。
批准用于食品内部和表面的香料列于法规《REGULATION (EC) No.1334/2008》,只有列入联盟目录的香料才能在市场销售和按照其规定的使用条件在食品内部和表面使用。
欧盟食品添加剂法规主要内容共包括五个附件,以下为各个附件中的具体内容。
附件一:列出了欧盟食品添加剂的功能分类,食品添加剂按功能分为27类,包括甜味剂、着色剂、防腐剂、抗氧化剂、载体、酸、酸度调节剂、抗结剂、消泡剂、疏松剂、乳化剂、乳化盐、固化剂、增味剂、发泡剂、胶凝剂、上光剂、保湿剂、变性淀粉、包装气体、推进剂、膨松剂、螯合剂、稳定剂、增稠剂、面粉处理剂、对比增强剂。
附件二:批准在食品中使用的食品添加剂目录及使用条件,包括A、B、C、D、E五部分。
A部分介绍了法规的构成、食品添加剂目录和使用条件,B部分为全部食品添加剂的目录,C部分为食品添加剂的分组定义,D部分为食品分类系统,E部分为批准的食品添加剂在允许使用的食品中的使用条件。
欧盟允许使用的食品添加剂

欧盟允许使用的食品添加剂欧盟允许使用的食品添加剂欧洲委员会的立法对食品添加剂有以下3个粗略的分类:(1)甜味剂(94/35/EC法令);(2)着色剂(94/36/EC法令);(3)除甜味剂和着色剂以外的添加剂(95/2/EC法令)——“多种”添加剂法令。
欧盟的食品添加剂分类及定义见下表:欧盟添加剂种类定义酸增加食物酸度的物质以及赋予食物酸味的物质酸度调节剂调节和控制食物酸碱性的物质抗结剂能减少食物颗粒黏附到一起的物质消泡剂能阻止或减少泡沫形成的物质膨松剂能增加食品的体积,而对其能量值没有明显影响的物质载体以及载体溶剂用于溶解、稀释食物或用其他物理手段以改变食物状态的添加剂,以方便操作、应用或使用着色剂增加或恢复食物颜色的物质,包括食物的天然成分和天然来源的物质,这些物质不能作为食物来消费,也不能作为食物的特征成分乳化剂将两种或两种以上互不相容的物质如食物中的油和水形成均匀混合物或能维持混合物均匀状态的物质乳化盐将乳酪中的蛋白质转化为分散的形式,从而使脂肪和其他成分呈均匀分布状态的物质固定剂使水果和蔬菜组织保持新鲜状态的物质或者可与凝胶剂作用形成和增强凝胶的物质增味剂增强食物原有口味或/和风味的物质面粉处理剂(FTA)添加到面粉和面团,改善面团烘焙质量的物质(与乳化剂不同)上光剂涂抹到食物外表面后,可赋予食物光泽外观或能给食物提供保护层的物质水分保持剂能防止食物在低湿度的空气中变干的物质,或促进粉状物在水溶液中溶解的物质改性淀粉将食用淀粉进行一种或多种化学处理,如物理处理、酶处理、酸处理或碱处理后得到的物质填充气体除了空气以外的,在将食物放入容器前、放入时或放入后充入到容器中的气体推进气体除了空气以外的,将食物从容器中排出的气体发泡剂本身或混合后可释放出气体,从而增大生面团或面糊体积的物质发泡剂本身或混合后可释放出气体,从而增大生面团或面糊体积的物质螯合剂可与金属离子形成化合物的物质稳定剂能维持食物物理状态的物质,能使食物中两种或两种以上互不相容的物质呈均匀分散状态的物质,能使食物已有色泽保持稳定的物质甜味剂能赋予食物甜味的物质增稠剂能增加食物黏度的物质欧盟食品添加剂列表酸编码添加剂名称270 乳酸296 苹果酸297 富马酸330 柠檬酸334 酒石酸338 磷酸353 偏酒石酸355 己二酸363 琥珀酸507 盐酸513 硫酸574 葡萄糖575 葡糖酸一δ一内醋酸度调节剂编码添加剂名称327 乳酸钙331 柠檬酸钠:(1)柠檬酸一钠;(2)柠檬酸二钠;(3)柠檬酸三钠332 柠檬酸钾:(1)柠檬酸一钾;(2)柠檬酸三钾333 柠檬酸钙:(1)柠檬酸一钙;(2)柠檬酸二钙;(3)柠檬酸三钙339 磷酸钠:(1)磷酸一钠;(2)磷酸二钠;(3)磷酸三钠340 磷酸钾:(1)磷酸一钾;(2)磷酸二钾;(3)磷酸三钾341 磷酸钙:(1)磷酸一钙;(2)磷酸二钙;(3)磷酸三钙343 磷酸镁:(1)磷酸一镁;(2)磷酸二镁350 苹果酸钠:(1)苹果酸钠;(2)苹果酸氢钠351 苹果酸钾352 苹果酸钙:(1)苹果酸钙;(2)苹果酸氢钙354 酒石酸钙356 己二酸钠357 己二酸钾380 柠檬酸三铵450 二磷酸二钙500 碳酸钠:(1)碳酸钠;(3)碳酸氢三钠501 碳酸钾:(1)碳酸钾;(2)碳酸氢钾503 碳酸铵:(1)碳酸铵;(2)碳酸氢铵504 碳酸镁:(1)碳酸镁;(2)碳酸氢镁514 硫酸氢钠515 磷酸氢钾522 硫酸钾铝523 硫酸饺铝524 氢氧化钠525 氢氧化钾526 氢氯化钙527 氢氧化铵528 氢氧化镁529 氧化钙577 葡糖酸钾578 葡糖酸钙抗结剂编码添加剂名称530 氧化镁535 亚铁氰化钠536 亚铁氰化钾538 亚铁氰化钙551 二氧化硅552 硅酸钙553 硅酸镁:a(1)硅酸镁;(2)1硅酸镁(合成) 、2三硅酸镁b 滑石粉554 硅酸铝钠555 硅酸铝钾556 硅酸铝钙558 膨润土559 硅酸铝(高岭土)消泡剂编码添加剂名称900 甲基聚硅氧烷1521 聚乙二醇6000膨松剂编码添加剂名称1200 聚糊精着色剂编码添加剂名称100 姜黄素101 核黄素:(1)核黄素;(2)核黄素-5’-磷酸102 柠檬黄104 喹啉黄110 日落黄;柑橘黄120 胭脂虫红,胭脂红酸,洋红122 偶氮玉红,酸性红123 苋菜红124 胭脂红,洋红A127 赤藓红128 红色2G129 诱惑红131 专利蓝V132 靛蓝133 亮蓝140 叶绿素和叶绿酸:(1)叶绿素;(2)叶绿酸141 叶绿素和叶绿酸的铜盐:(1)叶绿素铜盐;(2)叶绿酸铜盐142 绿色S150 焦糖色:a 不加氨生产;b 苛性亚硫酸法;c加氨生产; d 亚硫酸铵法151 亮黑.黑色PN153 植物炭154 棕色FK155 棕色HT160 胡萝卜素:a 胡萝卜素(1)复合胡萝卜素;(2)β-胡萝卜素b 胭脂橙红,胭脂树橙,降胭脂树橙c 红辣椒提取物,辣椒红素,辣椒玉红素d 番茄红素e β-阿朴-8’-胡萝卜醛(C30)f β-阿朴-8’-胡萝卜酸(C30)乙酯161 b 叶黄素;g 斑蝥黄质162 甜菜红,甜菜苷163 花青素苷类170 碳酸钙171 二氧化钛172 铁的氧化物和氢氧化物173 铝174 银175 金180 立素玉红BK(Litholrubine BK)乳化剂编码添加剂名称322 卵磷脂431 聚氧乙烯硬脂酸酯432 聚氧乙烯山梨醇酐433 聚氧乙烯山梨醇酐油酸酯434 聚氧乙烯山梨醇酐单棕榈酸酯435 聚氯乙烯山梨醇酐单硬脂酸酯436 聚氧乙烯山梨醇酐三硬脂酸酯442 磷脂酸铵444 酸异丁酸葡糖酯445 木松香甘油酯460 纤维素:(1)微晶纤维素;(2)粉状纤维素470 a 脂肪酸钠、钾、盐;b 脂肪酸镁盐471 脂肪酸单、双甘油酯472 脂肪酸单、双甘油酸酯:a 脂肪酸单、双甘油乙酸酯b 脂肪酸单、双甘油乳酸酯c 脂肪酸单、双甘油柠檬酸酯d 脂肪酸单、双甘油酒石酸酯e 脂肪酸单、双甘油单、双乙酰化酒石酸酯f 脂肪酸单、双甘油混合乙酸和酒石酸酯481 硬脂酰乳酸钠482 硬脂酰乳酸钙491 单硬脂酸山梨醇酐酯492 三硬脂酸山梨醇酐酯493 单月桂酸山梨醇酐酯494 单油酸山梨醇酐酯495 单棕榈酸山梨醇酐酯473 蔗糖脂肪酸酯474 蔗糖甘油酯475 脂肪酸聚甘油酯476 聚甘油聚蓖麻醇酸酯477 脂肪酸丙二醇单、双酯479 b 热氧化大豆油与脂肪酸单、双甘油酯的交联物乳化盐编码添加剂名称450 二磷酸盐:(2)二磷酸三钠;(3)二磷酸四钠;(5)二磷酸四钾(7)二磷酸二氢酐452 聚磷酸盐:(1)2聚磷酸钠(不溶);(2)聚磷酸钾;(3)聚磷酸钠钙;(4)聚磷酸钙固定剂编码添加剂名称520 硫酸铝521 硫酸钠铝增味剂编码添加剂名称515 (1)硫酸钾620 谷氨酸621 谷氨酸一钠622 谷氨酸一钾623 谷氨酸钙624 谷氨酸一铵625 谷氨酸镁626 鸟苷酸627 鸟苷酸二钠628 鸟苷酸二钾629 鸟苷酸钙630 肌酐酸631 鸟苷酸二钠632 鸟苷酸二钾633 鸟苷酸钙634 5’一核糖核苷酸钙635 5’一核糖核苷酸二钠640 甘氨酸及其钠盐面粉处理剂编码添加剂名称483 硬脂酰酒石酸酯517 硫酸铵541 酸性磷酸铝钠920 L一半胱氨酸927 b 尿素516 硫酸钙抛光剂编码添加剂名称469 酶水解的羧甲基纤维素904 虫胶905 结晶石蜡901 蜂蜡,白色和黄色902 小烛树蜡903 巴西棕榈蜡水分保持剂编码添加剂名称422 甘油1518 三乙酸甘油酯(甘油三乙酸酯) 1520 丙烷一1,2—二元醇填充气体编码添加剂名称938 氩939 氦948 氧推进气体编码添加剂名称290 二氧化碳941 氮942 一氧化二氮发泡剂编码添加剂名称450 (1)二磷酸二钠500 (2)碳酸氢钠999 皂树皮提取物螯合剂编码添加剂名称350 EDTA钙钠451 (2)三磷酸五钾452 (1)1 聚磷酸钠(可溶)451 (1)三磷酸五钠576 葡糖酸钠稳定剂编码添加剂名称335 酒石酸钠盐:(1)酒石酸一钠;(2)酒石酸二钠336 酒石酸钾盐:(1)酒石酸一钾;(2)酒石酸二钾337 酒石酸钾钠468 交联羧甲基纤维素钠1201 聚乙烯毗咯烷酮1505 柠檬酸三乙酯570 脂肪酸甜味剂编码添加剂名称420 &nb, sp;&nbs, p; 山梨醇:(1)山梨醇;(2)山梨醇糖浆421 甘露醇953 异麦芽糖醇965 麦芽糖醇:(1)麦芽糖醇;(2)麦芽糖醇糖浆966 乳糖醇967 木糖醇950 乙酰磺胺酸钾(安赛蜜)951 天门冬酰苯丙氨酸甲酯(阿斯巴甜)952 环己基氨基磺酸,环己基氨基磺酸钠/钙(用量以环己基氨基磺酸计) 954 糖精,糖精钠/钾/钙(以游离酰亚胺的量表示) 957 索马甜959 新橙皮苷防腐剂编码添加剂名称200 山梨酸202 山梨酸钾203 山梨酸钙210 苯甲酸211 苯甲酸钠212 苯甲酸钾213 苯甲酸钙214 对羟基苯甲酸乙酯215 对羟基苯甲酸乙酯钠216 对羟基苯甲酸丙酯217 对羟基苯甲酸丙酯钠218 对羟基苯甲酸甲酯219 对羟基苯甲酸甲酯钠220 二氧化硫221 亚硫酸钠222 亚硫酸氢钠223 偏亚硫酸钠224 偏亚硫酸钾226 亚硫酸钙227 亚硫酸氢钙228 亚硫酸氢钾230 联(二)苯231 邻苯基苯酚232 邻苯基苯酚钠234 乳酸链球菌素235 纳他霉素239 六亚甲基四胺242 焦磷酸二甲酯249 亚硝酸钾250 亚硝酸钠251 硝酸钠252 硝酸钾260 乙酸261 乙酸钾262 乙酸钠:(1)乙酸钠;(2)乙酸氢钠263 乙酸钙280 丙酸281 丙酸钠282 丙酸钙283 丙酸钾284 硼酸285 四硼酸钠(硼砂)912 二十九烷酸酯914 氧化聚乙烯蜡1105 溶菌酶助色剂及保色助剂编码添加剂名称514 (1)硫酸钠512 氯化锡579 葡糖酸亚铁585 乳酸亚铁1202 聚乙烯聚吡咯烷酮。
欧盟食品接触材料法规解读及应对

欧盟食品接触材料法规解读及应对近年来,食品中农兽药残留、重金属、生物毒素等已引起全世界的普遍关注和重视。
但是,随着科学技术的不断发展和人们对于食品接触材料安全性认识的提高,与食品接触材料的安全性也正被发达国家所重视。
欧盟、美国、德国、法国、英国、韩国、日本中国等都先后发不了相应的指令法规。
.进入21世纪初的2005年起,欧盟最新颁布了针对于食品级接触材料和物质的1935/2004/EC指令又取代了89/109/EEC指令,并于2006年1月1日起正式强制实施。
所以,常规上所说的欧盟食品级接触材料和制品的法规是指1935/2004/EC指令。
食品接触材料测试的欧盟1935/2004/EC法规规定的产品范围:欧盟1935/2004/EC法规规定,传统上对食品级接触材料的定义凡作为食品生产、包装、运输或支持材料的成分不会对食品产生任何影响者,则称为食品接触材料(须通过1935/2004/EC测试)。
食品接触材料测试法规里常规食品级接触材料的分类:欧盟食品级接触材料测试1935/2004/EC法规规定食品级接触材料常规上大致可以区分为以下十七项:活性及智能型物质、黏着剂、陶瓷、软木塞、橡胶、玻璃、离子交换树脂、金属及合金、纸及纸板、树胶、影印墨水、再生纤维素(如人造丝或玻璃纸)硅化物、纺织品、油漆、蜡、木头,也包括它们的复合物。
食品级接触材料和制品物质须符合以下条件:欧盟1935/2004/EC法规(食品级接触材料测试)规定,当产品接触食品时,不可:1、释出对人体健康构成危险的成分2、导致食品的成分产生不能接受的改变3、降低食品所带来的感官特性(使食品的味道,气味,颜色等改变)1、出口欧盟的食品接触材料(简称FCM)需要注意那些要求?需要重点考虑以下的要求:1). 欧盟层面制定的法规或指令,例如(EU)1935/2004(框架性法规)、84/500/EEC指令等2). 欧盟成员国本国的立法,例如法国的DGCCRF 2004-643). 欧洲理事会颁布的涉及FCM的决议和有关技术文件,如针对纸和纸板的决议ResAP(2002)2、欧盟FCM的法规体系架构?欧盟FCM的法规可分为三类:框架性法规、特定材料指令和特定化学物质指令。
欧盟食品接触材料法规ap(2004)2

欧盟食品接触材料法规ap(2004)2标题:欧盟食品接触材料法规AP(2004)2一、介绍欧盟食品接触材料法规AP(2004)2是欧盟委员会于2004年发布的一项法规,旨在保护消费者的食品安全和健康。
该法规针对食品接触材料,制定了一系列标准和规定,以确保这些材料与食品接触时不会对食品质量造成危害。
二、法规内容欧盟食品接触材料法规AP(2004)2主要包含以下几个方面的内容:1.承诺和定义该法规要求食品接触材料制造商、进口商和分销商必须承诺符合法规的要求。
定义了食品接触材料的范围,包括塑料、橡胶、金属和纸张等。
2.材料安全性评估该法规要求食品接触材料必须进行安全性评估,以确定其是否对食品安全造成风险。
评估包括物质的迁移和可接受剂量等方面的考虑。
3.限制物质迁移该法规对食品接触材料中的化学物质迁移进行了限制,以确保食品不受到有害物质的污染。
禁止使用一些有害物质,对其他物质的使用进行了限制。
4.标签和包装要求该法规要求食品接触材料必须标明相关信息,如材料成分、使用限制和安全使用指南等。
包装必须保持完整和清洁,以确保食品的卫生安全。
5.检验和监督该法规规定了对食品接触材料进行检验和监督的要求,包括取样和分析等。
违反法规的企业将面临罚款和其他法律责任。
三、实施和影响欧盟食品接触材料法规AP(2004)2于2004年12月生效,并实施到欧盟各成员国。
该法规的实施对食品接触材料生产商和相关行业带来了影响。
1.淘汰有害物质该法规的实施促使企业淘汰使用有害物质的食品接触材料,改用更安全的替代品,从而保护消费者的健康。
2.加强监管和安全性评估该法规的实施加强了监管部门对食品接触材料的监督和检验工作,确保企业的生产符合法规要求。
安全性评估的引入有助于提高食品接触材料的质量,减少食品安全风险。
3.提高消费者信心该法规的实施增强了消费者对食品接触材料安全性的信心,保障了其在购买食品和使用相关产品时的安全和健康。
四、结论欧盟食品接触材料法规AP(2004)2是欧盟为保护消费者食品安全和健康而制定的一项重要法规。
欧盟食品添加剂法规
欧洲议会和欧盟理事会, 考虑到建立欧洲共同体的条约,特别是其第100a条; 考虑到委员会的提案(OJ No C 206,13.8.1992,p.12,和OJ No C 189,13.7.1993, p.11), 考虑到经济与社会委员会的意见(OJ No C 108,19.4.1993,p.26), 按照条约第189b条(1993年5月26日欧洲议会意见(OJ NoCl76,28.6.1993,p.117), 批准于1993年12月2日(OJ NoC 342,20.12.1993),1994年3月10日理事会共同立场(OJ No C 172,24.6.1994,p.4))以及1994年11月16日欧洲议会 决议(OJ NoC 341,5.12.1994) 规定的程序采取措施, 考虑到理事会1988年12月21日关于使各成员国食品添加剂法律趋于一致的指令89/107 /EEC(OJ No L 40,11.2.1989,p,27),特别是其中的第3条第2款,
M5
L 284 1 2003—10—
(EC)No 1882/2003
3l
M6 2003 年 12 月 22 日欧洲议会和理事会指令 2003/ L 24
58 2004—01
114/EC
—29
注:文中凡被修订的条款均加注了M1,M2,M3,M4,M5,M6的上标.修订指令的生效日 期如下:
M1的生效日期为:1997年4月4日。 M2的生效日期为:1998年11月4日。符合该指令的产品将最迟于2000年5月4日获准 销售。不符合该指令 的产品将自2000年11月4日起禁止销售,不过在此日期前已投放市场或已加贴标签 的产品可以继续销售直 至售完为止。 M3的生效日期为:2001年2月24日。 M4的生效日期为:2003年?月l?日。 M5的生效日期为:2003年11月20日。 M6的生效日期为:2004年1月29日。符合该指令的产品将最迟于2005年?月27日获准 销售和使用。不符合该指令的产品将自2006年1月27日起禁止销售和使用,不过在此日 期前已投放市场或已加贴标签的产品可以继续销售直到售完为止。
欧盟食品添加剂标准

欧盟食品添加剂标准欧盟食品添加剂标准是指欧盟对食品中使用的添加剂所制定的一系列规定和要求。
添加剂是指为了改变食品的色、香、味、形态和保质期等特征而向食品中添加的物质。
欧盟对食品添加剂的使用进行了严格的管理和监督,旨在保障消费者的健康和权益,确保食品的安全和质量。
首先,欧盟对食品添加剂的使用进行了明确的限制和规定。
根据欧盟的相关法规,食品添加剂必须经过严格的安全评估和批准程序,才能被允许在食品中使用。
欧盟对食品添加剂的种类、用量和使用范围等方面都做出了详细的规定,以确保食品的安全性和可靠性。
其次,欧盟对食品添加剂的标签和说明也做出了严格的要求。
根据欧盟的法规,食品添加剂必须在食品包装上进行清晰的标注,并提供详细的使用说明和安全警示。
消费者在购买食品时,可以通过查看食品包装上的标签信息,了解食品中是否含有添加剂以及添加剂的种类和用量,从而做出更加明智的消费选择。
此外,欧盟还对食品添加剂的监督和检测进行了严格的规定。
欧盟成员国必须建立健全的食品安全监管体系,对食品添加剂的使用进行全程监督和抽检。
一旦发现食品添加剂使用不当或超过规定的用量,将会采取严厉的处罚措施,以确保食品的安全和合法性。
总的来说,欧盟食品添加剂标准的制定和执行,旨在保障消费者的健康和权益,确保食品的安全和质量。
消费者在购买食品时,可以通过查看食品包装上的标签信息,了解食品中是否含有添加剂以及添加剂的种类和用量,从而做出更加明智的消费选择。
同时,食品生产企业也应当严格遵守欧盟的相关法规,确保食品添加剂的使用符合规定,为消费者提供安全、健康的食品产品。
欧盟食品添加剂标准的不断完善和执行,将为食品安全和消费者权益保驾护航。
欧盟食品级EC1935-2004中英文11

REGULATION (EC) No 1935/2004 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCILof 27 October 2004on materials and articles intended to come into contact with food and repealing Directives 80/590/EECand 89/109/EEC2004年10月27日发布关于食品接触类原料和物料的欧盟1935/2004指令,同时撤销原欧洲共同体80/590和89/109指令THE EUROPEAN PARLIAMENT AND THE COUNCIL OF THE EUROPEAN UNION,欧洲议会与理事会Having regard to the Treaty establishing the European Community,and in particular Article 95 thereof,注意到建立欧洲共同体的《条约》,特别是第96条Having regard to the proposal from the Commission,注意到委员会的提案Having regard to the opinion of the European Economic andSocial Committee (1),注意到欧洲经济和社会委员会的意见(1)Acting in accordance with the procedure laid down in Article 251of the Treaty (2),按照《条约》第251条规定的程序(2)Whereas:鉴于(1) Council Directive 89/109/EEC of 21 December 1988 on the approximation of the laws of the Member States relating to materials and articles intended to come into contact with foodstuffs (3) established general principles for eliminating the differences between the laws of the Member States as regards those materials and articles and provided for the adoption of implementing directives concerning specific groups of materials and articles (specific directives). This approach was successful and should be continued.理事会1988年12月21日的指令89 /109 /EEC关于统一各成员国材料和制品用于接触食品的法律,为消除各成员国关于这些原料和物料制定的差异,以及为特定材料和物品(具体指令)提供通过执行的指令而建立的一般原则。
{合同法律法规}欧盟食品添加剂法规.

{合同法律法规}欧盟食品添加剂法规为实现某些技术目的在处理或加工过程中有意添加用于处理原料、食品或其成分的任何物质。
它们的使用可能会导致无意但在技术上又不可避免的这些物质或其衍生物在最终产品中的残留,条件是这些残留的存在即不会引起任何健康风险,也不会对成品产生任何技术上的影响。
);(b)按照有关植物卫生的共同体规则用于保护植物和植物产品的物质;(c)属88/388/EEC(OJNoL184,15.7.1988,p.61)理事会指令适用范围的,用于食品的调味品;(d)作为营养物(例如矿物质,微量元素或维生素)添加到食品中的物质。
第2条1.就根据第3条第3款起草的附录中清单中列出的任何种类食品添加剂而言,只有列人上述清单的食品添加剂才可用于食品的生产或制备并且只能在清单中规定的使用条件下使用。
2.附录I中任何种类的食品添加剂的内含物通常应基于具体食品添加剂种类的主要功能。
然而,对于特定种类的添加剂内含物的配置不排除认定其具有数种功能的可能性。
3.食品添加剂应包括在基于附录Ⅱ规定的通用标准而确定的清单中。
第3条1.应在一个综合指令中制定有关附录I中各种类的添加剂的详细规定,并包括有关现有特定添加剂种类的特定指令的规定。
但此类指令可分阶段起草。
2.按照条约第100a条规定的程序,针对委员会的提案理事会应通过:(a)食品添加剂清单,只有该表中列出的食品添加剂才被准许使用;(b)这些食品添加剂可以添加的食品清单,可以添加的条件,适用时还有基于技术目的的使用限制;(c)添加剂作为载体物质和溶剂时的规则,必要时包括它们的纯度标准。
3.根据第11条规定的程序应通过下列内容:(a)文讨论的添加剂的纯度标准;(b)必要时,用来验证是否满足(a)中所述纯度标准所需的分析方法;(c)必要时,食品中或食品表面的食品添加剂抽样程序和定性定量分析方法;(d)为确保符合第2条规定所必须的其他规则。
第3a条M11.作为对第3条第2款(a)和(b)的部分废除,理事会应按照条约第100a条规定的程序就委员会提交的提案,授权各成员国保留对在某些传统食品生产中禁用食品添加剂的规定,条件是:一一禁用的规定在1992年1月1日前颁布;一一有关成员国认可在其境内不作为传统食品的生产和销售遵循第3条中规定。
欧盟及主要成员国食品接触材料法规介绍
欧盟及主要成员国食品接触材料法规介绍目前,欧盟密切关注食品接触材料的安全性,不断出台更新关于食品接触材料的法律法规,标准限量,检测方法等。
截至到目前,欧盟涉及食品接触材料和制品的指令或法规累计有三十几项。
一、欧盟食品接触材料法规1. EC/1935/2004 法规欧盟有关食品接触材料的立法始于上一世纪70 年代,最早的指令是76/893/EC,该指令是一项框架性指令,目的是协调各成员国在该领域的立法,使各国的强制性技术要求趋向一致。
2004 年底欧盟又发布了EC/1935/2004——《欧洲议会和理事会关于拟与食品接触的材料和制品的废除指令890/EC 89/109/EC 的法规》,是欧盟最新的关于与食品接触材料和制品的基本框架法规。
与以往不同的是过去的框架规定形式是指令,需要各成员国进行转换,而此次是直接以法规形式颁布的。
这意味着各成员国不需任何转换,应直接完整地遵守本法规。
在某种意义上可以说其法律效力更强更直接了。
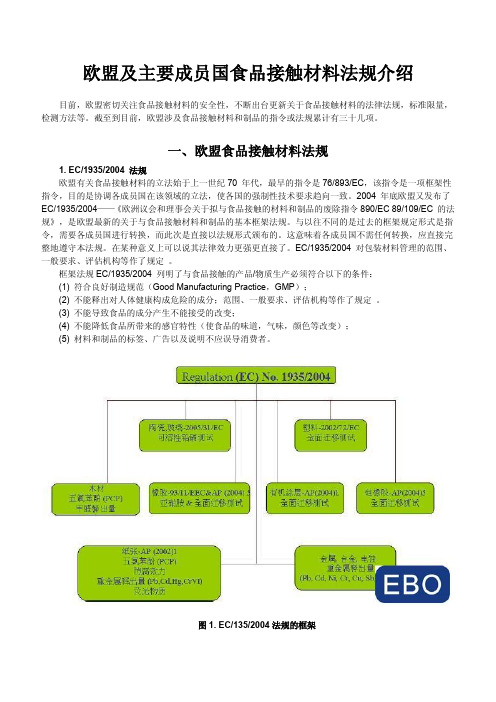
EC/1935/2004 对包装材料管理的范围、一般要求、评估机构等作了规定。
框架法规EC/1935/2004 列明了与食品接触的产品/物质生产必须符合以下的条件:(1) 符合良好制造规范(Good Manufacturing Practice,GMP);(2) 不能释出对人体健康构成危险的成分;范围、一般要求、评估机构等作了规定。
(3) 不能导致食品的成分产生不能接受的改变;(4) 不能降低食品所带来的感官特性(使食品的味道,气味,颜色等改变);(5) 材料和制品的标签、广告以及说明不应误导消费者。
图1. EC/135/2004法规的框架2. 法规适用范围框架法规适用于所有最终状态将要与食品相接触的材料和物品(可能包括诸如印刷用墨水和粘性标签之类)。
但是,它特别不适用于作为食品的一部分并在食用时会吃到的那些表面层物质(如香肠的外衣);它也不适用于一些在公共场合和消费者供水系统中使用的材料和物品,因为他们实施其各自的法律。
各国食品法律规定(3篇)

第1篇一、引言食品是人类生存和发展的基本需求,保障食品安全是各国政府的重要职责。
随着全球化的推进,食品贸易日益频繁,各国在食品法律法规方面的建设也日益完善。
本文将对各国食品法律规定进行概述,旨在为我国食品法律法规的制定和实施提供借鉴。
二、美国食品法律规定1. 食品安全法(Food Safety Modernization Act,FSMA)FSMA是美国食品安全法规的核心,于2011年1月4日由奥巴马总统签署生效。
该法案旨在通过预防措施,降低食品安全风险,保障公众健康。
2. 药品、食品和化妆品法案(Food, Drug, and Cosmetic Act,FDCA)FDCA是美国食品法律的基本法,于1938年颁布。
该法案赋予食品药品监督管理局(FDA)对食品、药品和化妆品的监管权力。
3. 营养标签法(Nutrition Labeling and Education Act,NLEA)NLEA要求食品标签必须包含营养信息,以便消费者在购买食品时作出明智的选择。
4. 食品添加剂法规(Food Additives)食品添加剂法规规定了食品添加剂的使用标准、评价程序和审批程序。
三、欧盟食品法律规定1. 食品安全基本法规(General Food Law,GFL)GFL是欧盟食品法律的核心,于2002年1月1日生效。
该法规规定了食品安全的基本原则、责任分配和监管机构。
2. 食品基本法规(Food Hygiene Regulation,FHR)FHR规定了食品生产、加工、储存、运输和销售过程中的卫生要求。
3. 食品添加剂法规(Food Additives Regulation,FAR)FAR规定了食品添加剂的使用标准、评价程序和审批程序。
4. 营养和健康声明法规(Nutrition and Health Claims Regulation,NHCR)NHCR规定了营养和健康声明的使用条件、评价程序和审批程序。
欧盟食品标签及其具体要求

五、产品标签要求
含奎宁和咖啡因食品的标签: 2002/67/EC指令中做出规定,应当在含奎宁和咖啡因食品的标签上配料清单 中标示出奎宁和咖啡因的含量;禁止过量食用或者单独食用。 饮料中咖啡因的含量超过150mg/L,应在食品的标签上与食品的名称在同一 视野内标示:“咖啡因含量高”
五、产品标签要求
具有药用特性的信息 强制标示的内容:食品名称、配料清单、某些配
料得质量或类别、预包装食品的净含量、保质期、 特别的贮藏条件或使用条件、生产商、包装商、 销售商的信息、食品原产地或来源、使用说明、 酒精度超过1.2%的饮料的实际酒精
三、通用要求
修订内容: ——食品配料的标示,增加了附件Ⅲa,以紧跟科学知识的发展和进步,保护 消费者避免新的过敏原危害。
——将“羽扇豆及其制品”和“软体动物及其制品”添加入附件Ⅲa。
四、营养标签要求
理事会指令(90/496/EEC)及其修正924/2006号法规,是对营养食品标签的基本要求
适用于除了供人饮用的天然矿泉水或其他水和强化食品或补品之外的所有市 场上的食品的营养标签。
品的成分和标签 —— 1760/2000牛肉标签法规 ——酒类标签 ——转基因食品标签 ——(EC) No 834/2007 有机生产及有机产品
标签法规 ——(EC)2065/2001 关于渔产品和水产品标
签法规
三、通用要求
食品标签通则2000/13/EC 指令,多次修订 适用于所有市场上的食品 不应标示的内容:误导消费者的有关内容或食品
含甾醇类物质的食品的标签: EC(No)608/2004号法规对添加有植物甾醇、
植物甾醇酯、植物甾烷醇和植物甾烷醇酯的食品 和食品配料的标签进行了针对性的规定
应在食品名称同一视野内标示:“含植物甾醇/ 植物甾烷醇”;添加的含量应标示在配料清单中;
美国、欧盟、日本食品添加使用

美国、欧盟、日本食品添加剂的监管一、美国食品添加剂管理美国食品和药品管理法规第201款规定,食品添加剂是直接或间接进入食品并成为食品一部分的任何物质。
所谓直接食品添加剂,是指直接加入到食品中的物质。
所谓间接食品添加剂,是指包装材料或其他与食品接触的物质,在合理的预期下,转移到食品中的物质。
根据这个定义,食品配料也是食品添加剂的一部分,这是美国与大多数国家对食品添加剂定义的不同之处。
美国法律规定,由FDA(食品药物管理局)直接参与食品添加剂法规的制定和管理。
因肉类由美国农业部(USDA)管理,用于肉和家禽制品的添加剂需得到FDA和USDA双方的认证;而酒和烟由酒烟草税和贸易局(TTB)管理,用于酒、烟的食品添加剂也实行双重管理。
食品添加剂立法的基础工作往往由相应的协会承担。
如食品香精立法的基础工作由FEMA(美国食品香料和萃取物制造者协会)担任,其安全评价结果得到FDA认可后,以肯定的形式公布,并冠以GRAS (一般公认安全)的FEMA号码。
随着科技进步和毒理学资料的积累,以及现代分析技术的提高,每隔若干年后,食品添加剂的安全性会被重新评价和公布。
美国食品和药品管理法第402款规定,只有经过评价和公布的食品添加剂才能生产和应用,否则会被认定为不安全。
含有不安全食品添加剂的食品则“不宜食用”,不宜食用的食品禁止销售。
美国规定,食品中公认为可安全使用的物质不属于食品添加剂范畴,但对这类物质的使用也实行严格管理。
FDA已推行一项新的公认安全物质的通报系统,即由生产企业向FDA提交其产品,根据其用途属于公认安全物质的报告,FDA在一定时间内(通常为180天),向申请人发信确认或否认申请的物质的公认安全性。
二、欧盟食品添加剂管理由于欧盟是一个统一的市场,因此食品添加剂产品一旦进入某一欧盟成员国市场,原则上即可在其他成员国自由销售。
和其他国家相同,欧盟也有专项法规对食品添加剂进行管理。
欧盟食品添加剂的使用原则是食品中只能含有欧盟允许使用的食品添加剂和成员国允许使用的香料,即使用食品添加剂必须符合欧盟的相关规定和一般卫生法规的要求。
欧盟食品添加剂标准法规(食品添加、食品酶制剂和食品用香料的通用许可程序)

I(Acts adopted under the EC Treaty/Euratom Treaty whose publication is obligatory)REGULATIONSREGULATION(EC)No1331/2008OF THE EUROPEAN PARLIAMENT AND OF THE COUNCILof16December2008establishing a common authorisation procedure for food additives,food enzymes and food flavourings(Text with EEA relevance)THE EUROPEAN PARLIAMENT AND THE COUNCIL OF THE EURO-PEAN UNION,Having regard to the Treaty establishing the European Commu-nity,and in particular Article95thereof,Having regard to the proposal from the Commission,Having regard to the opinion of the European Economic and Social Committee(1),Acting in accordance with the procedure laid down in Article251 of the Treaty(2),Whereas:(1)The free movement of safe and wholesome food is anessential aspect of the internal market and contributes sig-nificantly to the health and well-being of citizens,and totheir social and economic interests.(2)A high level of protection of human life and health shouldbe assured in the pursuit of Community policies.(3)In order to protect human health,the safety of additives,enzymes and flavourings for use in foodstuffs for humanconsumption must be assessed before they are placed onthe Community market.(4)Regulation(EC)No1333/2008of the European Parlia-ment and of the Council of16December2008on foodadditives(3),Regulation(EC)No1332/2008of the Euro-pean Parliament and of the Council of16December2008on food enzymes(4)and Regulation(EC)No1334/2008of the European Parliament and of the Council of16December2008on flavourings and certain food ingre-dients with flavouring properties for use in and on foods(5)(hereinafter referred to as the sectoral food laws)lay downharmonised criteria and requirements concerning theassessment and authorisation of these substances.(5)It is envisaged,in particular,that food additives,foodenzymes and food flavourings,to the extent that the safetyof food flavourings must be assessed in accordance withRegulation(EC)No1334/2008[on flavourings and certainfood ingredients with flavouring properties for use in andon foods],must not be placed on the market or used infoodstuffs for human consumption,in accordance with theconditions laid down in each sectoral food law,unless theyare included on a Community list of authorised substances.(6)Ensuring transparency in the production and handling offood is absolutely crucial in order to maintain consumerconfidence.(7)In this context,it appears appropriate to establish for thesethree categories of substances a common Communityassessment and authorisation procedure that is effective,time-limited and transparent,so as to facilitate their freemovement within the Community market.(1)OJ C168,20.7.2007,p.34.(2)Opinion of the European Parliament of10July2007(OJ C175E,10.7.2008,p.134),Council Common Position of10March2008 (OJ C111E,6.5.2008,p.1),Position of the European Parliament of 8July2008(not yet published in the Official Journal)and Council Decision of18November2008.(3)See page16of this Official Journal.(4)See page7of this Official Journal.(5)See page34of this Official Journal.(8)This common procedure must be founded on the prin-ciples of good administration and legal certainty and mustbe implemented in compliance with those principles.(9)This Regulation will thus complete the regulatory frame-work concerning the authorisation of the substances bylaying down the various stages of the procedure,the dead-lines for those stages,the role of the parties involved andthe principles that apply.Nevertheless,for some aspects ofthe procedure,it is necessary to take the specific character-istics of each sectoral food law into consideration.(10)The deadlines laid down in the procedure take into accountthe time needed to consider the different criteria set in eachsectoral food law,as well as allowing adequate time forconsultation when preparing the draft measures.In par-ticular,the nine-months deadline for the Commission topresent a draft regulation updating the Community listshould not preclude the possibility of this being donewithin a shorter period.(11)Upon receipt of an application the Commission should ini-tiate the procedure and where necessary seek the opinionof the European Food Safety Authority(hereinafter referredto as the Authority)established by Regulation(EC)No178/2002of the European Parliament and of the Coun-cil of28January2002laying down the general principlesand requirements of food law,establishing the EuropeanFood Safety Authority and laying down procedures in mat-ters of food safety(1)as soon as possible after the validityand applicability of the application have been assessed.(12)In accordance with the framework for risk assessment inmatters of food safety established by Regulation(EC)No178/2002,the authorisation to place substances on themarket must be preceded by an independent scientificassessment,of the highest possible standard,of the risksthat they pose to human health.This assessment,whichmust be carried out under the responsibility of the Author-ity,must be followed by a risk management decision takenby the Commission under a regulatory procedure thatensures close cooperation between the Commission andthe Member States.(13)The authorisation to place substances on the market shouldbe granted pursuant to this Regulation provided that thecriteria for authorisation laid down under the sectoral foodlaws are satisfied.(14)It is recognised that,in some cases,scientific risk assess-ment alone cannot provide all the information on which arisk management decision should be based,and that otherlegitimate factors relevant to the matter under consider-ation may be taken into account,including societal,eco-nomic,traditional,ethical and environmental factors andthe feasibility of controls.(15)In order to ensure that both business operators in the sec-tors concerned and the public are kept informed of theauthorisations in force,the authorised substances shouldbe included on a Community list created,maintained andpublished by the Commission.(16)Where appropriate and under certain circumstances,thespecific sectoral food law may provide for protection ofscientific data and other information submitted by theapplicant for a certain period of time.In this case,the sec-toral food law should lay down the conditions under whichthese data may not be used for the benefit of anotherapplicant.(17)Networking between the Authority and the Member States’organisations operating in the fields within the Authority’smission is one of the basic principles of the Authority’soperation.In consequence,in preparing its opinion,theAuthority may use the network made available to it byArticle36of Regulation(EC)No178/2002and by Com-mission Regulation(EC)No2230/2004(2).(18)The common authorisation procedure for the substancesmust fulfil transparency and public information require-ments while guaranteeing the right of applicants to pre-serve the confidentiality of certain information.(19)Protecting the confidentiality of certain aspects of an appli-cation should be maintained as a consideration in order toprotect the competitive position of an applicant.However,information relating to the safety of a substance,includ-ing,but not limited to,toxicological studies,other safetystudies and raw data as such,should under no circum-stances be confidential.(20)Pursuant to Regulation(EC)No178/2002,Regulation(EC)No1049/2001of the European Parliament and of theCouncil of30May2001regarding public access to Euro-pean Parliament,Council and Commission documents(3)applies to documents held by the Authority.(1)OJ L31,1.2.2002,p.1.(2)Regulation(EC)No2230/2004of23December2004laying downdetailed rules for the implementation of European Parliament and Council Regulation(EC)No178/2002with regard to the network of organisations operating in the fields within the European Food Safety Authority’s mission(OJ L379,24.12.2004,p.64).(3)OJ L145,31.5.2001,p.43.(21)Regulation(EC)No178/2002establishes procedures fortaking emergency measures in relation to foodstuffs ofCommunity origin or imported from third countries.Itauthorises the Commission to adopt such measures in situ-ations where foodstuffs are likely to constitute a seriousrisk to human health,animal health or the environmentand where such risk cannot be contained satisfactorily bymeasures taken by the Member State(s)concerned.(22)In the interests of efficiency and legislative simplification,there should be a medium-term examination of the ques-tion whether to extend the scope of the common proce-dure to other legislation in the area of food.(23)Since the objectives of this Regulation cannot be suffi-ciently achieved by the Member States on account of dif-ferences between national laws and provisions and cantherefore be better achieved at Community level,the Com-munity may adopt measures,in accordance with the prin-ciple of subsidiarity as set out in Article5of the Treaty.Inaccordance with the principle of proportionality,as set outin that Article,this Regulation does not go beyond what isnecessary in order to achieve those objectives.(24)The measures necessary for the implementation of thisRegulation should be adopted in accordance with CouncilDecision1999/468/EC of28June1999laying down theprocedures for the exercise of implementing powers con-ferred on the Commission(1).(25)In particular the Commission should be empowered toupdate the Community lists.Since those measures are ofgeneral scope and are designed to amend non-essential ele-ments of each sectoral food law,inter alia,by supplement-ing it with new non-essential elements,they must beadopted in accordance with the regulatory procedurewith scrutiny provided for in Article5a of Decision1999/468/EC.(26)On grounds of efficiency,the normal time-limits for theregulatory procedure with scrutiny should be curtailed forthe addition of substances to the Community lists and foradding,removing or changing conditions,specifications orrestrictions associated with the presence of a substance onthe Community lists.(27)When,on imperative grounds of urgency,the normal time-limits for the regulatory procedure with scrutiny cannot becomplied with,the Commission should be able to applythe urgency procedure provided for in Article5a(6)ofDecision1999/468/EC for the removal of a substancefrom the Community lists and for adding,removing orchanging conditions,specifications or restrictions associ-ated with the presence of a substance on the Communitylists,HAVE ADOPTED THIS REGULATION:CHAPTER IGENERAL PRINCIPLESArticle1Subject matter and scope1.This Regulation lays down a common procedure for the assessment and authorisation(hereinafter referred to as the com-mon procedure)of food additives,food enzymes,food flavour-ings and source materials of food flavourings and of food ingredients with flavouring properties used or intended for use in or on foodstuffs(hereinafter referred to as the substances),which contributes to the free movement of food within the Community and to a high level of protection of human health and to a high level of consumer protection,including the protection of con-sumer interests.This Regulation shall not apply to smoke flavour-ings falling within the scope of Regulation(EC)No2065/2003of the European Parliament and of the Council of10November 2003on smoke flavourings used or intended for use in or on foods(2).2.The common procedure shall lay down the procedural arrangements for updating the lists of substances the marketing of which is authorised in the Community pursuant to Regulation (EC)No1333/2008[on food additives],Regulation(EC) No1332/2008[on food enzymes]and Regulation(EC) No1334/2008[on flavourings and certain food ingredients with flavouring properties for use in and on foods](hereinafter referred to as the sectoral food laws).3.The criteria according to which substances can be included on the Community list provided for in Article2,the content of the regulation referred to in Article7and,where applicable,the transitional provisions concerning ongoing procedures are laid down in each sectoral food law.Article2Community list of substances1.Under each sectoral food law,substances that have been authorised to be placed on the Community market shall be included on a list the content of which is determined by the said law(hereinafter referred to as the Community list).The Commu-nity list shall be updated by the Commission.It shall be published in the Official Journal of the European Union.2.‘Updating the Community list’means:(a)adding a substance to the Community list;(1)OJ L184,17.7.1999,p.23.(2)OJ L309,26.11.2003,p.1.(b)removing a substance from the Community list;(c)adding,removing or changing conditions,specifications orrestrictions associated with the presence of a substance on the Community list.CHAPTER IICOMMON PROCEDUREArticle3Main stages of the common procedure1.The common procedure for updating the Community list may be started either on the initiative of the Commission or fol-lowing an application.Applications may be made by a Member State or by an interested party,who may represent several inter-ested parties,in accordance with the conditions provided for by the implementing measures referred to in Article9(1)(a)(herein-after referred to as the applicant).Applications shall be sent to the Commission.2.The Commission shall seek the opinion of the European Food Safety Authority(hereinafter referred to as the Authority),to be given in accordance with Article5.However,for the updates referred to in Article2(2)(b)and(c),the Commission shall not be required to seek the opinion of the Authority if the updates in question are not liable to have an effect on human health.3.The common procedure shall end with the adoption by the Commission of a regulation implementing the update,in accor-dance with Article7.4.By way of derogation from paragraph3,the Commission may end the common procedure and decide not to proceed with a planned update,at any stage of the procedure,if it judges that such an update is not justified.Where applicable,it shall take account of the opinion of the Authority,the views of Member States,any relevant provisions of Community law and any other legitimate factors relevant to the matter under consideration.In such cases,where applicable,the Commission shall inform the applicant and the Member States directly,indicating in its letter the reasons for not considering the update justified.Article4Initiating the procedure1.On receipt of an application to update the Community list, the Commission:(a)shall acknowledge receipt of the application in writing to theapplicant within14working days of receiving it;(b)where applicable,shall as soon as possible notify the Author-ity of the application and request its opinion in accordance with Article3(2).The application shall be made available to the Member States by the Commission.2.Where it starts the procedure on its own initiative,the Com-mission shall inform the Member States and,where applicable, request the opinion of the Authority.Article5Opinion of the Authority1.The Authority shall give its opinion within nine months of receipt of a valid application.2.The Authority shall forward its opinion to the Commission, the Member States and,where applicable,the applicant.Article6Additional information concerning risk assessment1.In duly justified cases where the Authority requests addi-tional information from applicants,the period referred to in Article5(1)may be extended.After consulting the applicant,the Authority shall lay down a period within which this information can be provided and shall inform the Commission of the addi-tional period needed.If the Commission does not object within eight working days of being informed by the Authority,the period referred to in Article5(1)shall be automatically extended by the additional period.The Commission shall inform the Member States of the extension.2.If the additional information is not sent to the Authority within the additional period referred to in paragraph1,the Authority shall finalise its opinion on the basis of the informa-tion already provided.3.Where applicants submit additional information on their own initiative,they shall send it to the Authority and to the Com-mission.In such cases,the Authority shall give its opinion within the original period without prejudice to Article10.4.The additional information shall be made available to the Member States and the Commission by the Authority.Article7Updating the Community list1.Within nine months of the Authority giving its opinion,the Commission shall submit to the Committee referred to in Article14(1)a draft regulation updating the Community list,tak-ing account of the opinion of the Authority,any relevant provi-sions of Community law and any other legitimate factors relevant to the matter under consideration.In those cases where an opinion of the Authority has not been requested,the nine-month period shall start from the date the Commission receives a valid application.2.In the Regulation updating the Community list,the consid-erations on which it is based shall be explained.3.Where the draft regulation is not in accordance with the opinion of the Authority,the Commission shall explain the rea-sons for its decision.4.The measures,designed to amend non-essential elements of each sectoral food law,relating to the removal of a substance from the Community list,shall be adopted in accordance with the regulatory procedure with scrutiny referred to in Article14(3).5.On grounds of efficiency,the measures designed to amend non-essential elements of each sectoral food law,inter alia,by supplementing it,relating to the addition of a substance to the Community list and for adding,removing or changing conditions, specifications or restrictions associated with the presence of the substance on the Community list,shall be adopted in accordance with the regulatory procedure with scrutiny referred to in Article14(4).6.On imperative grounds of urgency,the Commission may use the urgency procedure referred to in Article14(5)for the removal of a substance from the Community list and for adding, removing or changing conditions,specifications or restrictions associated with the presence of a substance on the Community list.Article8Additional information concerning risk management1.Where the Commission requests additional information from applicants on matters concerning risk management,it shall determine,together with the applicant,a period within which that information can be provided.In such cases,the period referred to in Article7may be extended accordingly.The Commission shall inform the Member States of the extension and shall make the additional information available to the Member States once it has been provided.2.If the additional information is not sent within the addi-tional period referred to in paragraph1,the Commission shall act on the basis of the information already provided.CHAPTER IIIMISCELLANEOUS PROVISIONSArticle9Implementing measures1.In accordance with the regulatory procedure referred to in Article14(2),within a period of no longer than24months from the adoption of each sectoral food law,the implementing mea-sures for this Regulation shall be adopted by the Commission,and shall concern in particular:(a)the content,drafting and presentation of the applicationreferred to in Article4(1);(b)the arrangements for checking the validity of applications;(c)the type of information that must be included in the opinionof the Authority referred to in Article5.2.With a view to the adoption of the implementing measures referred to in paragraph1(a),the Commission shall consult the Authority,which,within six months of the date of entry into force of each sectoral food law,shall present it with a proposal concerning the data required for risk assessment of the substances concerned.Article10Extension of time periodsIn exceptional circumstances,the periods referred to in Article5(1)and Article7may be extended by the Commission on its own initiative or,where applicable,at the Authority’s request, if the nature of the matter in question so justifies,without preju-dice to Article6(1)and Article8(1).In such cases the Commis-sion shall,where appropriate,inform the applicant and the Member States of the extension and the reasons for it.Article11TransparencyThe Authority shall ensure the transparency of its activities in accordance with Article38of Regulation(EC)No178/2002.In particular,it shall make its opinions public without delay.It shall also make public any request for its opinion as well as any exten-sion of period pursuant to Article6(1).Article12Confidentiality1.Among the information provided by applicants,confiden-tial treatment may be given to information the disclosure of which might significantly harm their competitive position.Information relating to the following shall not,in any circum-stances,be regarded as confidential:(a)the name and address of the applicant;(b)the name and a clear description of the substance;(c)the justification for the use of the substance in or on specificfoodstuffs or food categories;(d)information that is relevant to the assessment of the safety ofthe substance;(e)where applicable,the analysis method(s).2.For the purposes of implementing paragraph1,applicants shall indicate which of the information provided they wish to be treated as confidential.Verifiable justification must be given in such cases.3.The Commission shall decide after consulting with the applicants which information can remain confidential and shall notify applicants and the Member States accordingly.4.After being made aware of the Commission’s position, applicants shall have three weeks in which to withdraw their application so as to preserve the confidentiality of the informa-tion provided.Confidentiality shall be preserved until this period expires.5.The Commission,the Authority and the Member States shall,in accordance with Regulation(EC)No1049/2001,take the necessary measures to ensure appropriate confidentiality of the information received by them under this Regulation,except for information which must be made public if circumstances so require in order to protect human health,animal health or the environment.6.If an applicant withdraws,or has withdrawn,its application, the Commission,the Authority and the Member States shall not disclose confidential information,including information the con-fidentiality of which is the subject of disagreement between the Commission and the applicant.7.The implementation of paragraphs1to6shall not affect the circulation of information between the Commission,the Authority and the Member States.Article13EmergenciesIn the event of an emergency concerning a substance on the Com-munity list,particularly in the light of an opinion of the Author-ity,measures shall be adopted in accordance with the procedures referred to in Articles53and54of Regulation(EC)No178/2002.Article14Committee1.The Commission shall be assisted by the Standing Commit-tee on the Food Chain and Animal Health established by Article58 of Regulation(EC)No178/2002.2.Where reference is made to this paragraph,Articles5and7 of Decision1999/468/EC shall apply,having regard to the pro-visions of Article8thereof.The period laid down in Article5(6)of Decision1999/468/EC shall be set at three months.3.Where reference is made to this paragraph,Article5a(1) to(4)and Article7of Decision1999/468/EC shall apply,having regard to the provisions of Article8thereof.4.Where reference is made to this paragraph,Article5a(1) to(4)and(5)(b)and Article7of Decision1999/468/EC shall apply,having regard to the provisions of Article8thereof.The time-limits laid down in Article5a(3)(c)and(4)(b)and(e)of Decision1999/468/EC shall be two months,two months and four months respectively.5.Where reference is made to this paragraph,Article5a(1),(2), (4)and(6)and Article7of Decision1999/468/EC shall apply, having regard to the provisions of Article8thereof.Article15Competent authorities of the Member StatesNot later than six months after the entry into force of each sec-toral food law,Member States shall forward to the Commission and to the Authority,in relation to each sectoral food law,the name and address of the national competent authority for the purposes of the common procedure,as well as a contact point therein.CHAPTER IVFINAL PROVISIONArticle16Entry into forceThis Regulation shall enter into force on the20th day following its publication in the Official Journal of the European Union.For each sectoral food law,it shall apply from the date of appli-cation of the measures referred to in Article9(1).Article9shall apply from20January2009.This Regulation shall be binding in its entirety and directly applicable in all Member States. Done at Strasbourg,16December2008.For the European ParliamentThe PresidentH.-G.PÖTTERING For the Council The President B.LE MAIRE。
欧盟允许使用的食品添加剂

欧盟允许使用的食品添加剂对物质进行分类是一个比较复杂的过程,食品添加剂的分类也不例外,欧盟是从使用功能上对添加剂进行分类的。
从功能方面对食品添加剂进行分类是一种比较好的方法,由于添加剂的功能取决于其加入量的多少,所以它与摄入量是有密切联系的,在评价消费者可能的摄入量时,功能以及添加剂量是需要考虑的两个重要方面。
欧洲委员会的立法对食品添加剂有以下3个粗略的分类:(1)甜味剂(94/35/EC法令);(2)着色剂(94/36/EC法令);(3)除甜味剂和着色剂以外的添加剂(95/2/EC法令)——“多种”添加剂法令。
欧盟的食品添加剂分类及定义见下表:欧盟添加剂种类定义酸增加食物酸度的物质以及赋予食物酸味的物质酸度调节剂调节和控制食物酸碱性的物质抗结剂能减少食物颗粒黏附到一起的物质消泡剂能阻止或减少泡沫形成的物质膨松剂能增加食品的体积,而对其能量值没有明显影响的物质载体以及载体溶剂用于溶解、稀释食物或用其他物理手段以改变食物状态的添加剂,以方便操作、应用或使用着色剂增加或恢复食物颜色的物质,包括食物的天然成分和天然来源的物质,这些物质不能作为食物来消费,也不能作为食物的特征成分乳化剂将两种或两种以上互不相容的物质如食物中的油和水形成均匀混合物或能维持混合物均匀状态的物质乳化盐将乳酪中的蛋白质转化为分散的形式,从而使脂肪和其他成分呈均匀分布状态的物质固定剂使水果和蔬菜组织保持新鲜状态的物质或者可与凝胶剂作用形成和增强凝胶的物质增味剂增强食物原有口味或/和风味的物质面粉处理剂(FTA) 添加到面粉和面团,改善面团烘焙质量的物质(与乳化剂不同)上光剂涂抹到食物外表面后,可赋予食物光泽外观或能给食物提供保护层的物质水分保持剂能防止食物在低湿度的空气中变干的物质,或促进粉状物在水溶液中溶解的物质改性淀粉将食用淀粉进行一种或多种化学处理,如物理处理、酶处理、酸处理或碱处理后得到的物质填充气体除了空气以外的,在将食物放入容器前、放入时或放入后充入到容器中的气体推进气体除了空气以外的,将食物从容器中排出的气体发泡剂本身或混合后可释放出气体,从而增大生面团或面糊体积的物质发泡剂本身或混合后可释放出气体,从而增大生面团或面糊体积的物质螯合剂可与金属离子形成化合物的物质稳定剂能维持食物物理状态的物质,能使食物中两种或两种以上互不相容的物质呈均匀分散状态的物质,能使食物已有色泽保持稳定的物质甜味剂能赋予食物甜味的物质增稠剂能增加食物黏度的物质欧盟食品添加剂列表酸编码添加剂名称270 乳酸296 苹果酸2330 柠檬酸334 酒石酸338 磷酸353 偏酒石酸355 己二酸363 琥珀酸507 盐酸513 硫酸574 葡萄糖575 葡糖酸一δ一内醋酸度调节剂编码添加剂名称327 乳酸钙331 柠檬酸钠:(1)柠檬酸一钠;(2)柠檬酸二钠;(3)柠檬酸三钠332 柠檬酸钾:(1)柠檬酸一钾;(2)柠檬酸三钾333 柠檬酸钙:(1)柠檬酸一钙;(2)柠檬酸二钙;(3)柠檬酸三钙339 磷酸钠:(1)磷酸一钠;(2)磷酸二钠;(3)磷酸三钠340 磷酸钾:(1)磷酸一钾;(2)磷酸二钾;(3)磷酸三钾341 磷酸钙:(1)磷酸一钙;(2)磷酸二钙;(3)磷酸三钙343 磷酸镁:(1)磷酸一镁;(2)磷酸二镁350 苹果酸钠:(1)苹果酸钠;(2)苹果酸氢钠351 苹果酸钾352 苹果酸钙:(1)苹果酸钙;(2)苹果酸氢钙354 酒石酸钙356 己二酸钠357 己二酸钾380 柠檬酸三铵450 二磷酸二钙500 碳酸钠:(1)碳酸钠;(3)碳酸氢三钠501 碳酸钾:(1)碳酸钾;(2)碳酸氢钾503 碳酸铵:(1)碳酸铵;(2)碳酸氢铵504 碳酸镁:(1)碳酸镁;(2)碳酸氢镁514 硫酸氢钠515 磷酸氢钾522 硫酸钾铝523 硫酸饺铝524 氢氧化钠525 氢氧化钾526 氢氯化钙527 氢氧化铵528 氢氧化镁529 氧化钙577 葡糖酸钾3抗结剂编码添加剂名称530 氧化镁535 亚铁氰化钠536 亚铁氰化钾538 亚铁氰化钙551 二氧化硅552 硅酸钙553 硅酸镁:a(1)硅酸镁;(2)1硅酸镁(合成) 、2三硅酸镁b 滑石粉554 硅酸铝钠555 硅酸铝钾556 硅酸铝钙558 膨润土559 硅酸铝(高岭土)消泡剂编码添加剂名称900 甲基聚硅氧烷1521 聚乙二醇6000膨松剂编码添加剂名称1200 聚糊精着色剂编码添加剂名称100 姜黄素101 核黄素:(1)核黄素;(2)核黄素-5’-磷酸102 柠檬黄104 喹啉黄110 日落黄;柑橘黄120 胭脂虫红,胭脂红酸,洋红122 偶氮玉红,酸性红123 苋菜红124 胭脂红,洋红A127 赤藓红128 红色2G129 诱惑红131 专利蓝V132 靛蓝133 亮蓝140 叶绿素和叶绿酸:(1)叶绿素;(2)叶绿酸141 叶绿素和叶绿酸的铜盐:(1)叶绿素铜盐;(2)叶绿酸铜盐142 绿色S150 焦糖色:a 不加氨生产;b 苛性亚硫酸法;c加氨生产;d 亚硫酸铵法151 亮黑.黑色PN153 植物炭4154 棕色FK155 棕色HT160 胡萝卜素:a 胡萝卜素(1)复合胡萝卜素;(2)β-胡萝卜素b 胭脂橙红,胭脂树橙,降胭脂树橙c 红辣椒提取物,辣椒红素,辣椒玉红素d 番茄红素e β-阿朴-8’-胡萝卜醛(C30)f β-阿朴-8’-胡萝卜酸(C30)乙酯161 b 叶黄素;g 斑蝥黄质162 甜菜红,甜菜苷163 花青素苷类170 碳酸钙171 二氧化钛172 铁的氧化物和氢氧化物173 铝174 银175 金180 立素玉红BK(Litholrubine BK)乳化剂编码添加剂名称322 卵磷脂431 聚氧乙烯硬脂酸酯432 聚氧乙烯山梨醇酐433 聚氧乙烯山梨醇酐油酸酯434 聚氧乙烯山梨醇酐单棕榈酸酯435 聚氯乙烯山梨醇酐单硬脂酸酯436 聚氧乙烯山梨醇酐三硬脂酸酯442 磷脂酸铵444 酸异丁酸葡糖酯445 木松香甘油酯460 纤维素:(1)微晶纤维素;(2)粉状纤维素470 a 脂肪酸钠、钾、盐;b 脂肪酸镁盐471 脂肪酸单、双甘油酯472 脂肪酸单、双甘油酸酯:a 脂肪酸单、双甘油乙酸酯b 脂肪酸单、双甘油乳酸酯c 脂肪酸单、双甘油柠檬酸酯d 脂肪酸单、双甘油酒石酸酯e 脂肪酸单、双甘油单、双乙酰化酒石酸酯f 脂肪酸单、双甘油混合乙酸和酒石酸酯481 硬脂酰乳酸钠482 硬脂酰乳酸钙491 单硬脂酸山梨醇酐酯492 三硬脂酸山梨醇酐酯493 单月桂酸山梨醇酐酯494 单油酸山梨醇酐酯5495 单棕榈酸山梨醇酐酯473 蔗糖脂肪酸酯474 蔗糖甘油酯475 脂肪酸聚甘油酯476 聚甘油聚蓖麻醇酸酯477 脂肪酸丙二醇单、双酯479 b 热氧化大豆油与脂肪酸单、双甘油酯的交联物乳化盐编码添加剂名称450 二磷酸盐:(2)二磷酸三钠;(3)二磷酸四钠;(5)二磷酸四钾(7)二磷酸二氢酐452 聚磷酸盐:(1)2聚磷酸钠(不溶);(2)聚磷酸钾;(3)聚磷酸钠钙;(4)聚磷酸钙固定剂编码添加剂名称520 硫酸铝521 硫酸钠铝增味剂编码添加剂名称515 (1)硫酸钾620 谷氨酸621 谷氨酸一钠622 谷氨酸一钾623 谷氨酸钙624 谷氨酸一铵625 谷氨酸镁626 鸟苷酸627 鸟苷酸二钠628 鸟苷酸二钾629 鸟苷酸钙630 肌酐酸631 鸟苷酸二钠632 鸟苷酸二钾633 鸟苷酸钙634 5’一核糖核苷酸钙635 5’一核糖核苷酸二钠640 甘氨酸及其钠盐面粉处理剂编码添加剂名称483 硬脂酰酒石酸酯517 硫酸铵541 酸性磷酸铝钠920 L一半胱氨酸927 b 尿素516 硫酸钙抛光剂6编码添加剂名称469 酶水解的羧甲基纤维素904 虫胶905 结晶石蜡901 蜂蜡,白色和黄色902 小烛树蜡903 巴西棕榈蜡水分保持剂编码添加剂名称422 甘油1518 三乙酸甘油酯(甘油三乙酸酯)1520 丙烷一1,2—二元醇填充气体编码添加剂名称938 氩939 氦948 氧推进气体编码添加剂名称290 二氧化碳941 氮942 一氧化二氮发泡剂编码添加剂名称450 (1)二磷酸二钠500 (2)碳酸氢钠999 皂树皮提取物螯合剂编码添加剂名称350 EDTA钙钠451 (2)三磷酸五钾452 (1)1 聚磷酸钠(可溶)451 (1)三磷酸五钠576 葡糖酸钠稳定剂编码添加剂名称335 酒石酸钠盐:(1)酒石酸一钠;(2)酒石酸二钠336 酒石酸钾盐:(1)酒石酸一钾;(2)酒石酸二钾337 酒石酸钾钠468 交联羧甲基纤维素钠1201 聚乙烯毗咯烷酮1505 柠檬酸三乙酯570 脂肪酸甜味剂编码添加剂名称420 山梨醇:(1)山梨醇;(2)山梨醇糖浆7953 异麦芽糖醇965 麦芽糖醇:(1)麦芽糖醇;(2)麦芽糖醇糖浆966 乳糖醇967 木糖醇950 乙酰磺胺酸钾(安赛蜜)951 天门冬酰苯丙氨酸甲酯(阿斯巴甜)952 环己基氨基磺酸,环己基氨基磺酸钠/钙(用量以环己基氨基磺酸计) 954 糖精,糖精钠/钾/钙(以游离酰亚胺的量表示)957 索马甜959 新橙皮苷防腐剂编码添加剂名称200 山梨酸202 山梨酸钾203 山梨酸钙210 苯甲酸211 苯甲酸钠212 苯甲酸钾213 苯甲酸钙214 对羟基苯甲酸乙酯215 对羟基苯甲酸乙酯钠216 对羟基苯甲酸丙酯217 对羟基苯甲酸丙酯钠218 对羟基苯甲酸甲酯219 对羟基苯甲酸甲酯钠220 二氧化硫221 亚硫酸钠222 亚硫酸氢钠223 偏亚硫酸钠224 偏亚硫酸钾226 亚硫酸钙227 亚硫酸氢钙228 亚硫酸氢钾230 联(二)苯231 邻苯基苯酚232 邻苯基苯酚钠234 乳酸链球菌素235 纳他霉素239 六亚甲基四胺242 焦磷酸二甲酯249 亚硝酸钾250 亚硝酸钠251 硝酸钠252 硝酸钾260 乙酸8262 乙酸钠:(1)乙酸钠;(2)乙酸氢钠263 乙酸钙280 丙酸281 丙酸钠282 丙酸钙283 丙酸钾284 硼酸285 四硼酸钠(硼砂)912 二十九烷酸酯914 氧化聚乙烯蜡1105 溶菌酶助色剂及保色助剂编码添加剂名称514 (1)硫酸钠512 氯化锡579 葡糖酸亚铁585 乳酸亚铁1202 聚乙烯聚吡咯烷酮9。
欧盟防腐剂标准

欧盟防腐剂标准1. 范围本标准规定了欧盟内销售的食品中防腐剂的使用要求,包括食品添加剂和营养强化剂的使用要求、食品标签和营养标签的要求、食品安全性评估程序等。
2. 规范性引用文件本标准引用了以下文件:(1)欧盟委员会(EC)No 1333/2008号条例,关于食品添加剂的使用范围和限量;(2)欧盟委员会(EC)No 1169/2011号条例,关于食品标签和营养标签;(3)欧盟委员会(EC)No 2273/2006号条例,关于食品中微生物限量;(4)欧盟委员会(EC)No 852/2004号条例,关于食品卫生的一般要求。
3. 术语和定义本标准规定了以下术语和定义:(1)防腐剂:用于防止或延缓食品腐败变质的一类物质。
(2)最大使用量:在食品中添加的防腐剂的最大限量。
(3)食品标签:在食品包装上标明食品成分、营养信息、使用方法等信息的说明。
4. 通用要求(1)防腐剂的使用应符合欧盟相关法规的规定。
(2)在食品中添加防腐剂时,应考虑其化学性质、作用机制、使用量等因素,确保其安全性。
(3)防腐剂的使用应结合食品的成分、含量、质量等因素,以确保其有效性。
5. 食品添加剂和营养强化剂的使用要求(1)在食品中添加防腐剂时,应按照规定的种类、浓度和用量使用,不得超过最大使用量。
(2)在食品中添加营养强化剂时,应按照规定的种类、浓度和用量使用,不得影响食品的安全性和质量。
6. 食品标签和营养标签的要求(1)在食品包装上应清晰标注食品的成分、含量、质量等信息,以便消费者了解食品的详细情况。
(2)在食品包装上应标注防腐剂的使用情况,包括种类、浓度和用量等信息,以便消费者了解食品中的防腐剂情况。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
理事会指令89/107/EEC使各成员国食品添加剂法律趋于一致的指令(OJ L40,11.2.1989,P.27)Ml的生效日期为:1994年9月10日。
M2的生效日期为:2003年11月20日。
欧洲共同体理事会,考虑到建立欧洲经济共同体的条约,特别是其第100a条,考虑到委员会的提案,为与欧洲议会合作(OJ No C 99,13.4.1987,p.65和OJ No C 12,16.1.1989),考虑到经济与社会委员会的意见(OJ No C 328,22.12.1986,p.5),鉴于各国食品添加剂的法律和使用条件的差异阻碍了食品的自由流通;鉴于这些差异可能会为不公平的竞争创造条件,进而会对共同市场的建立或机能产生直接影响;鉴于有必要使这些法律趋于一致;鉴于这些要求应包含在一项全面综合性的指令中,而该指令有必要分阶段起草;鉴于一个指令所涵盖的食品添加剂种类的清单,根据条约第100a条规定的程序,是由理事会做出决定;鉴于属于上述种类的食品添加剂的使用,只有建立在与理事会规定的科学技术标准一致的基础上,才应被批准;鉴于在起草食品添加剂清单和它们的使用条件时,在采用很可能会影响公众健康的规定之前,应与依据委员会74/234/EEC(OJ No L 136,20.5.1974,p.1),决议成立的食品科学委员会磋商;鉴于采用认可的添加剂清单必须就科学技术的发展而言是可行的;有鉴于此,除了条约规定程序的规则外,为了寻求共同体的解决方法,通过采用临时的国家措施来建立允许各成员国发挥作用的体制也可能是适当的;鉴于上述食品添加剂纯度标准的测定以及分析和取样方法的制定都是委托委员会处理的技术问题;鉴于任何情况下理事会都会授权委员会实施有关食品的规则,应制订条款规范个成员国与委员会间就食品常务委员会依据委员会决议69/414/EEC(OJ No L 29l,19.11.1969,p.9)设立)业务范围内紧密合作的程序;兹通过本指令:第1条1.本指令应适用于附录中列出的、在食品加工或制备过程中用作或打算用作配料且在最终产品中仍然存在(尽管改,变了存在的形式)的各种食品添加剂。
下文简称“食品添加剂”。
2.就本指令的目的而言“食品添加剂“是指本身通常不作为食品消费,也不是食品的特有成分的任何物质,而不论其是否具有营养价值。
它们在食品的生产、加工、制备、处理、包装、运输或存储的过程中,由于技术的目的有意加入食品中会成为或者可合理地预期这些物质或其副产物会直接或间接地成为食品的组成部分。
3.本指令不应适用于:(a)加工助剂(就本指令的目的而言,“加工助剂”是指本身不作为食品成分消费,而是为实现某些技术目的在处理或加工过程中有意添加用于处理原料、食品或其成分的任何物质。
它们的使用可能会导致无意但在技术上又不可避免的这些物质或其衍生物在最终产品中的残留,条件是这些残留的存在即不会引起任何健康风险,也不会对成品产生任何技术上的影响。
);(b)按照有关植物卫生的共同体规则用于保护植物和植物产品的物质;(c)属88/388/EEC(OJ No L 184,15.7.1988,p.61)理事会指令适用范围的,用于食品的调味品;(d)作为营养物(例如矿物质,微量元素或维生素)添加到食品中的物质。
第2条1.就根据第3条第3款起草的附录中清单中列出的任何种类食品添加剂而言,只有列人上述清单的食品添加剂才可用于食品的生产或制备并且只能在清单中规定的使用条件下使用。
2.附录I中任何种类的食品添加剂的内含物通常应基于具体食品添加剂种类的主要功能。
然而,对于特定种类的添加剂内含物的配置不排除认定其具有数种功能的可能性。
3.食品添加剂应包括在基于附录Ⅱ规定的通用标准而确定的清单中。
第3条1.应在一个综合指令中制定有关附录I中各种类的添加剂的详细规定,并包括有关现有特定添加剂种类的特定指令的规定。
但此类指令可分阶段起草。
2.按照条约第100a条规定的程序,针对委员会的提案理事会应通过:(a)食品添加剂清单,只有该表中列出的食品添加剂才被准许使用;(b)这些食品添加剂可以添加的食品清单,可以添加的条件,适用时还有基于技术目的的使用限制;(c)添加剂作为载体物质和溶剂时的规则,必要时包括它们的纯度标准。
3.根据第11条规定的程序应通过下列内容:(a)文讨论的添加剂的纯度标准;(b)必要时,用来验证是否满足(a)中所述纯度标准所需的分析方法;(c)必要时,食品中或食品表面的食品添加剂抽样程序和定性定量分析方法;(d)为确保符合第2条规定所必须的其他规则。
第3a条M11.作为对第3条第2款(a)和(b)的部分废除,理事会应按照条约第100a条规定的程序就委员会提交的提案,授权各成员国保留对在某些传统食品生产中禁用食品添加剂的规定,条件是:一一禁用的规定在1992年1月1日前颁布;一一有关成员国认可在其境内不作为传统食品的生产和销售遵循第3条中规定。
2.对(EEC)No 2081/92(1992年7月14日理事会关于农产晶和食品原产地地理迹象和名称保护的(EEC)No 2081/92法规 OJ No L 208,24.7.1992,p.1)和(EEC)No 2082/92(1992年7 月14日理事会关于农产品和食品具体特性证书的(EEC)No 2082/92法规( OJ No L 208,24.7.1992,p.9)不产生任何影响,在1994年7月1日前,各成员国应向委员会通报各自认定的传统食品的清单,并给出详细的理由,以及在上述食品中禁止使用某些添加剂的相关立法规定。
1995年4月1日之前,委员会应向理事会递交关于适用于确定产品是否为传统食品的标准以及按照这些标准各成员国可保留的禁用规定的提案。
理事会应在1996年4月1-日前就该提案做出决定。
3.理事会一旦对第2款所述内容做出了裁决,各成员国便可保留那些已按照第2款第1段的规定向委员会通报的禁用规定,条件是它们符合第l款规定的通用条件。
第4条1.当某成员国,在本指令或第3条提及的综合指令通过后,由于新出现的情况或对现有情况重新评估的结果,有详细的依据认为食品中添加剂的使用危及人类的健康时,尽管符合本指令或符合第3条规定的任一清单,该成员国仍可临时延缓或限制问题条款在其境内的应用。
该成员国应立即就此通报其他成员国和委员会并给出做此决定的理由。
2.委员会应就第I款提及的某成员国给出的理由尽快地在食品常务委员会内展开调查,随后应立即发表自己的意见并采取适当的措施。
3.如果委员会认为有必要修订本指令或第3条提及的综合性指令以解决第I款所述的困难并确保人类的健康,它应启动第11条规定的程序采用这些修订;已采取了安全措施的成员国则可保留相应的规定,直至上述修订被采用。
第5条1.考虑到按照第3条通过的名单确认之后科学技术的发展,成员国可临时批准在其境内经营和使用属附录I所列种类,但并未包括在随后规定了其需要符合的条件的相关清单内的某种添加剂:(a) 批准的最大期限应为两年;(b)该成员国应确保含有已批准添加剂的食品接受正式的监控;(c) 该成员国在授权中可以要求使用了被质疑的添加剂的食品应带有特别的标志。
2.该成员国应就其根据第l款所通过的任何授权决定的文本,在决定生效之日后两个月内,通报其他成员国和委员会。
3.在第I款(a)规定的两年期满之前,该成员国可以要求委员会将其按照本条第l款在本国已批准使用的添加剂纳入按照第3条通过的清单中。
与此同时,该成员国应提供按其观点支持上述内容的证据并应指明该添加剂应如何使用。
如果委员会认为要求是正当的,它应启动条约第]OOa条规定的程序来修订按照第3条通过的食品添加剂清单。
理事会应就委员会提案,在其提交后的18个月内做出决定。
4.在第l款规定的两年内,如果委员会没有按照第3款的规定递交提案或理事会没有按照第3条规定,在1.8个月内采取行动,那么成员国的国家授权必须取消。
同时,其他成员国针对同一添加剂使用的批准授权也必须取消。
5.按照第4款规定取消授权后,除非有新的科学技术进展证明是正当的,否则不得对同一添加剂的使用有新的授权。
第6条可能影响公众健康的条款规定,应与食品科学委员会磋商之后再行通过。
第7条1.不打算出售给最终消费者的食品添加剂,只有在其包装或容器上带有明显,清晰不能拭除的下列信息时,才可以销售:(a)——对于单独或混合后出出售的每种食品添加剂,要标注由共同体适用条款规定的名称以及它的EEC编号,或者如果没有适用的上述条款时,要标注足够精确的描述,以确保难与其他可能与其混淆的添加剂区分开,标注顺序应按所占重量比例的降序排列,——为便于某种食品添加剂的贮藏、销售、标准化、稀释或分解,在其中混合有其他物质或原料或食品成分或食品添加剂时,要按照上一段的要求标注出添加剂的名称,并应按所占重量的比例以递减的顺序标出每种成分;(b)——或标注“用于食品”,——或标注“仅限用于食品“,——或标注出更多具体的用于食品的信息;(c) 必要时,标注特殊的贮藏和使用条件;(d) 如果省略使用说明会妨碍添加剂的正确使用,则标注出使用说明;(e) 生产批号(可辨别其生产批次的标记);(f) 生产商或包装商或共同体内的销售商的名称或企业名称和地址;(g) 标明在食品中有限量规定的任何成分的百分比或恰当的成分信息,以使购买者能遵循共同体的条款,或没有国家规定时使其用于食品。
当对单独使用或复合使用的一组成分适用的限量相同时,可以给出一个组合的百分比数字;(h) 净含量;(i) 第3条提及的综合指令规定的任何其他信息。
2.作为对第I款的简化,(a)中第2段和(d)至(g)所要求的信息可以只出现在将要发送的发货单上或发运前的相关文件上,条件是要在相应的产品包装或容器上的显著部位标“用于加工食品不得零售”的字样。
第8条只有其包装或容器上标注有以下信息,且必须是显著、清晰不可拭除时,方可经营准备销售给最终消费者的食品添加剂:(a) 产品销售时使用的名称。
该名称应由共同体适用于相关产品的条款规定的名称和EEC编号组成,或当没有适用的上述条款时,其名称应给出足够精确的描述,为的是能与其他;丁能与其混淆的产品进行区分;(b) 第7条第l款(a)至(f),以及(h)所要求的信息;(c) 理事会指令79/112/EEC(OJ No L 33,8.2.1979,p.1)第9条规定的最短耐用期;(d) 第3条提及的综合性指令规定的任何其他信息。
第9条第7条和第8条不应影响更详细或更广泛性的有关计量方面,或适用于危险物质的说明、分类、包装和标签以及上述物质的制备或运输的法律、法规或管理规定。
第10条各成员国应避免制定比第7和第8条中有关规定更详细的要求。
第7和第8条规定的细节应使用购买者易于理解的语言,除非采取了其他措施以确保告知购买者相关的信息。
