CD4T磁珠分选
NDV7793促进人CD4+T细胞表达TRAIL的实验研究

NDV7793促进人CD4+T细胞表达TRAIL的实验研究目的:研究新城疫病毒(Newcastle disease virus,NDV)弱毒株NDV7793能否促进人CD4+ T细胞表达肿瘤坏死因子相关凋亡因子诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)。
方法:首先用免疫磁珠分选法(magnetic activated cell sorting,MACS)分选外周血静止CD4+ T细胞,然后加抗CD3抗体、抗CD28抗体和白细胞介素-2(interleukin-2,IL-2)使之成为能被NDV激活的CD4+ T细胞。
用流式细胞技术(flow cytometry,FCM)检测NDV刺激的CD4+ T细胞的TRAIL的表达水平。
结果:MACS法分选外周血得到的CD4+ T 细胞纯度达到(97.38±0.28)%;能被NDV激活的CD4+ T细胞表面分子CD25和CD69双阳性表达率可达(29.30±1.08)%,与PBS阴性对照组(2.40±1.30)%相比,差异有统计学意义(P<0.05);FCM检测结果显示,与对照组比较,NDV7793刺激的CD4+ T细胞TRAIL表达水平均有显著升高,且在NDV7793效价为25 HU时达到最大值。
结论:NDV7793可刺激CD3抗体、CD28抗体和IL-2预先活化的CD4+ T细胞表达TRAIL。
标签:新城疫病毒;CD4+ T细胞;TNF相关凋亡诱导配体NDV是经过临床评估后可以作为载体用于溶瘤治疗、基因治疗和免疫激活的五种病毒之一[1-3]。
全身治疗时,只有少部分NDV能到达肿瘤组织,其发挥直接的溶瘤作用十分有限[4]。
然而NDV在抗肿瘤中却仍能发挥重要作用,这与NDV刺激免疫细胞而发挥抗肿瘤效应有关,这些细胞包括NK细胞、巨噬细胞、树突状细胞以及T细胞等[5-8]。
已有实验证明,NDV可刺激NK细胞和巨噬细胞诱导TRAIL的产生而杀伤肿瘤[5-6]。
阿托伐他汀对人CD4+T淋巴细胞microRNA-21表达的影响

阿托伐他汀对人CD4+T淋巴细胞microRNA-21表达的影响刘洋;李浪;周游;王江友;苏强;孙羽涵【期刊名称】《中国老年学杂志》【年(卷),期】2013(33)9【摘要】目的研究阿托伐他汀在体外对人CD4+T淋巴细胞miRNA-21表达的影响.方法取12例健康志愿者的新鲜外周血,免疫磁珠分选出CD4+T淋巴细胞,分为空白组、PHA+(0、1、5、10 μmol/L)阿托伐他汀组,体外培养48 h后收集各组细胞及培养基上清液,荧光定量PCR检测miRNA-21及PDCD4mRNA表达水平,Western印迹检测PDCD4蛋白表达,ELISA检测培养基上清液TNF-α及IL-10浓度.结果①与空白组比较:PHA刺激后,CD4+T淋巴细胞miRNA-21 、PDCD4 mRNA、PDCD4蛋白表达及上清液TNF-α浓度均升高(均P<0.05).②与PHA+0μmol/L他汀组比较:加入不同浓度阿托伐他汀后,CD4+T淋巴细胞miRNA-21相对表达量和上清液IL-10浓度增加(P<0.05),而PDCD4蛋白表达和上清液TNF-α浓度明显降低(P<0.05).结论阿托伐他汀能促进PHA刺激的人CD4+T淋巴细胞miRNA-21的表达增加,从而抑制靶蛋白PDCD4,促进抗炎因子IL-10分泌和抑制促炎因子TNF-α.【总页数】4页(P2056-2059)【作者】刘洋;李浪;周游;王江友;苏强;孙羽涵【作者单位】广西医科大学第一附属医院心内科,广西南宁 530021;广西医科大学第一附属医院心内科,广西南宁 530021;广西医科大学第一附属医院心内科,广西南宁 530021;广西医科大学第一附属医院心内科,广西南宁 530021;广西医科大学第一附属医院心内科,广西南宁 530021;广西医科大学第一附属医院心内科,广西南宁 530021【正文语种】中文【中图分类】R966【相关文献】1.强化阿托伐他汀对不稳定性心绞痛患者冠状动脉介入治疗术后CD4+T淋巴细胞微小核糖核酸-21表达的影响 [J], 刘洋;李浪;苏强;周游;王江友;孙羽涵;杨栋2.阿托伐他汀对人CD4+T淋巴细胞程序性细胞死亡因子4基因表达的影响 [J], 王江友;李浪;周游;苏强;刘洋3.阿托伐他汀对人CD4+T淋巴细胞Sprouty2基因表达的影响 [J], 王江友;李浪;苏强;周游;刘洋;黄伟强4.阿托伐他汀对脑血管疾病介入治疗围手术期患者CD4+T淋巴细胞PTEN表达的影响 [J], 张贺;初照成5.阿托伐他汀对人CD4+T淋巴细胞张力蛋白同源第10染色体丢失的磷酸酶基因表达的影响 [J], 王江友;李浪;苏强;周游;刘洋;黄伟强因版权原因,仅展示原文概要,查看原文内容请购买。
磁珠分选说明书

磁珠分选说明书磁珠分选是一种利用磁性原理进行分选的方法,通常用于分离微小颗粒或细胞等。
下面是一份磁珠分选的简单说明书:一、原理磁珠分选基于磁性原理,通过磁场作用将磁珠与目标颗粒或细胞结合,再利用磁力的差异将磁珠与目标物分离,从而实现分选。
二、操作步骤1. 准备所需试剂和磁珠:根据实验需求准备相应的缓冲液、抗体或特异性配体,以及磁珠。
确保磁珠经过充分混匀。
2. 磁珠与目标物的结合:将磁珠与目标物(如抗体、核酸或其他配体)混合,使其充分结合。
通常需要在适当的缓冲液中进行孵育。
3. 磁力分选:将结合了目标物的磁珠转移到磁场中进行分离。
通常需要将磁珠与目标物混合物加入到特制的分离柱或管中,然后施加磁场。
4. 洗涤:为了去除未结合的目标物和其他杂质,进行洗涤操作。
将磁珠从磁场中取出,用缓冲液冲洗。
5. 洗脱和收集:最后,通过改变磁场或加入特定的洗脱液,将目标物从磁珠上洗脱下来并收集。
三、注意事项1. 确保所有操作在适当的缓冲液中进行,以维持磁珠和目标物的稳定性。
2. 根据实验需求选择合适的磁珠和特异性配体,以确保最佳的结合效果。
3. 注意磁力分选时的操作,避免磁珠吸附到容器壁或其他杂质上。
4. 在进行洗涤和洗脱时,要确保操作步骤准确,避免损失目标物。
5. 保持操作环境的清洁,避免污染。
四、应用领域磁珠分选广泛应用于生物医学研究、药物筛选、基因测序等领域,尤其在单细胞分析、蛋白质组学和核酸研究中发挥着重要作用。
以上是一份简单的磁珠分选说明书,具体操作步骤和细节可能因实验需求和试剂而有所不同。
在进行实验前,建议仔细阅读相关文献和试剂说明书,并遵循实验室安全规范。
肠道t细胞研究方法

肠道t细胞研究方法全文共四篇示例,供读者参考第一篇示例:肠道T细胞是一类在肠道内发挥重要免疫功能的T淋巴细胞。
它们在肠道粘膜上形成一个密集的网络,与肠道菌群和外界环境相互作用,为维持肠道免疫平衡和抵御病原微生物起着至关重要的作用。
肠道T细胞的研究对于理解肠道免疫系统的调控机制、疾病发生发展以及开发相关药物具有重要意义。
肠道T细胞的研究方法主要包括以下几个方面:1. 流式细胞术(flow cytometry):流式细胞仪是一种用来精确测定细胞表面抗原和细胞内分子的工具。
通过流式细胞术可以对肠道T 细胞的表型进行详细分析,如CD4、CD8、CD3等受体的表达情况、细胞的活化状态等。
流式细胞术还可以用来筛选和鉴定特定功能的肠道T细胞亚群。
2. 细胞培养技术:肠道T细胞通常以组织标本或者外周血中获得,需要进行细胞培养以扩增细胞数量。
通过细胞培养技术可以模拟体内肠道环境,研究肠道T细胞在不同刺激条件下的功能和分化情况。
3. 免疫组化技术(immunohistochemistry):免疫组化技术用于检测组织切片中的特定抗原。
通过免疫组化技术可以在肠道组织切片中定位和分析肠道T细胞的分布和数量,了解它们在肠道内的作用和相互关系。
4. 基因敲除和转基因动物模型:通过基因敲除和转基因技术可以构建特定基因表达缺陷或过表达的动物模型,研究这些基因对肠道T细胞功能和免疫相互作用的影响。
这种方法对于揭示肠道T细胞在肠道疾病发生发展中的作用至关重要。
5.深度测序技术(next-generation sequencing):深度测序技术可以对肠道T细胞中的基因组、转录组和表观遗传组进行高通量测序分析,揭示肠道T细胞的遗传变异和转录调控机制,从而为研究肠道T细胞的功能提供全面的信息。
肠道T细胞研究方法涉及到多个层面的技术手段和方法,通过这些方法的综合应用可以全面、深入地研究肠道T细胞的功能、机制以及在疾病中的作用,为开发新的治疗手段和药物提供重要的参考和指导。
t细胞分选和流式鉴定

t细胞分选和流式鉴定T 细胞分选和流式鉴定T 细胞是免疫系统中非常关键的一部分,它们在抵御病原体、监控自身细胞以及调节免疫反应等方面发挥着至关重要的作用。
为了更深入地研究T 细胞的功能和特性,T 细胞分选和流式鉴定技术应运而生。
T 细胞分选是将特定类型的 T 细胞从复杂的细胞混合物中分离出来的过程。
这一过程的实现依赖于多种方法和技术。
其中一种常见的方法是基于细胞表面标志物的特异性抗体进行分选。
这些标志物就像是T 细胞的“身份证”,通过识别这些标志物,我们能够将目标 T 细胞挑选出来。
例如,CD4 和 CD8 是常见的 T 细胞表面标志物。
CD4+T 细胞在辅助免疫反应方面发挥重要作用,而 CD8+T 细胞则主要负责细胞毒性功能。
利用针对这些标志物的抗体,结合特定的分选技术,如磁珠分选或流式细胞分选,可以有效地分离出我们所需要的 T 细胞群体。
磁珠分选的原理相对简单易懂。
首先,将与特定标志物结合的磁珠与细胞混合物孵育,使磁珠与目标细胞结合。
然后,通过磁场将结合了磁珠的细胞分离出来,从而实现分选的目的。
这种方法操作相对简便,成本也较低,但分选的纯度可能会受到一定的影响。
流式细胞分选则是一种更为精确和灵活的方法。
在流式细胞仪中,细胞会逐个通过一个狭窄的通道,同时受到激光的照射。
激光会激发细胞上结合的荧光染料,产生特定的荧光信号。
根据这些荧光信号的强弱和组合,我们可以准确地识别出目标 T 细胞,并通过电子控制系统将其分选到不同的收集容器中。
接下来,让我们来了解一下流式鉴定。
流式鉴定是一种用于分析细胞特性的强大技术。
在 T 细胞的研究中,它可以帮助我们了解 T 细胞的表型、活化状态、细胞周期等多个方面的信息。
在进行流式鉴定时,首先需要对 T 细胞进行荧光标记。
这通常通过将特异性抗体与荧光染料偶联来实现。
这些抗体可以识别 T 细胞表面的各种标志物,如 CD3、CD4、CD8、CD25、CD69 等。
当抗体与细胞表面的标志物结合后,荧光染料会发出相应的荧光信号。
原代SD大鼠CD4+T细胞的分离纯化及鉴定

原代SD大鼠CD4+T细胞的分离纯化及鉴定杨艳华;戴迟兵【摘要】目的:建立一种获得高质量、数量多的原代CD4+T细胞的有效可靠的方法.方法:依次采用密度梯度离心(procell density Centrifugation)和免疫磁珠分选法从SD大鼠新鲜脾脏中分选出CD4+T细胞,CD4+T细胞生长状况及特点采用倒置相差显微镜观察、提取细胞的纯度以流式细胞术鉴定.结果:流式细胞术鉴别CD4+T细胞纯度为96%,其中(CD4+T+CD62 L双标)初始CD4+T细胞纯度为60.7%,与密度梯度离心收集的单核细胞(CD4+T细胞纯度为0.2%)比较,差异均有统计学意义(P<0.01).通过形态学观察从原代SD大鼠脾脏中分离的CD4+T细胞,表现为透明圆颗粒状悬浮生长,48h内活性最高.结论:采用密度梯度离心分离,免疫磁珠分选纯化原代大鼠初始CD4+T细胞具有数量多、活性好、纯度高、生物学特性稳定的优点,可用于相关研究.【期刊名称】《医学理论与实践》【年(卷),期】2018(031)021【总页数】4页(P3161-3164)【关键词】原代初始CD4+T细胞;CD4+T细胞;细胞分选;密度梯度离心;免疫磁珠分选纯化【作者】杨艳华;戴迟兵【作者单位】恩施土家族苗族自治州中心医院消化内科,湖北省恩施市 445000;三峡大学仁和医院消化内科【正文语种】中文【中图分类】R310.14+34CD4+T细胞是人体免疫系统中重要的免疫细胞,在差异的细胞因子及环境作用下初始CD4+T细胞可分化成功能各异的亚型:Th1、Th2、Th17、Treg。
在免疫学相关研究中CD4+T细胞有着显著的研究价值,但CD4+T细胞原代提取以及体外培养存活难度较大,因此需建立一套快捷、高效的体外分离,培养,纯化方法。
本研究在常规提取T细胞的基础上,提出一套高效率的提取CD4+T细胞的方法,得到纯度高、细胞数多、生物活性稳定的CD4+T细胞,为进一步深入相关研究提供稳定的初始细胞。
【国家自然科学基金】_cd4 t细胞_期刊发文热词逐年推荐_20140729
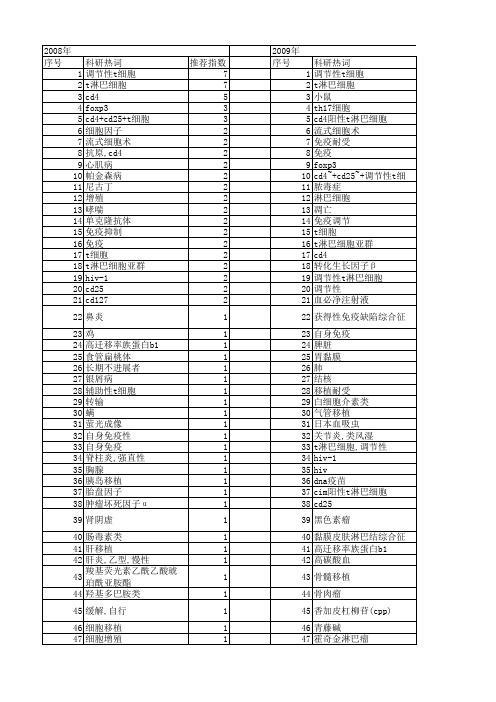
盲肠扁桃体 1 53 白细胞介素17 1 54 白细胞介素-2 1 55 痣,色素 1 56 环孢菌素a 1 57 炎症 1 58 活化 1 59 树突细胞,未成熟 1 60 来氟米特 1 61 抗肿瘤免疫 1 62 抗原,cd 1 63 抗体生成细胞 1 64 心肌疾病 1 65 幽门螺杆菌 1 66 大鼠 1 67 大肠癌 1 68 壳聚糖 1 69 基因疗法 1 70 垂直传播 1 71 吲哚胺2,3-双加氧酶 1 72 变应性 1 73 受体,烟碱 1 74 发育 1 75 卵巢浆液性癌 1 76 凋亡 1 77 六味地黄汤生物制剂 1 78 免疫逃逸 1 79 免疫赦免 1 80 免疫磁珠分选 1 81 克隆清除 1 82 信号转导 1 83 体外扩增 1 84 他克莫司 1 85 人类白细胞抗原a2 1 86 亚群 1 87 t细胞免疫球蚩白功能区和黏液素样功能区-1(tim-1) 1 88 t细胞,调节性 1 89 stgf-β rⅱ基因 1 90 rna干扰 1 91 rapamycin 1 92 neuropilin-1 1 93 icos 1 94 cxcr4 1 95 cin阳性t淋巴细胞 1 96 cim 1 97 cd8+t细胞 1 98 cd4阳性t淋巴细胞 1 99 cd4+cd25+treg 1 100 cd28 1 101 cd152 1 102 ccr5 1 103 6-羟基多巴胺 1 104 105 106
107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160
磁珠分选t细胞

磁珠分选t细胞1. 磁珠分选t细胞的原理和方法磁珠分选是一种常见的细胞分选技术,通过利用磁性的珠子特异性地结合到特定的细胞表面标记物上,然后通过磁力的作用将目标细胞分离出来。
在T细胞分选中,可以利用特殊的抗体来标记T细胞表面上的CD3、CD4、CD8等抗原,然后再使用特定的磁珠将标记物和目标细胞结合。
最后,利用磁力分离,就可以获得高纯度的T细胞。
2. T细胞分选的研究进展随着近年来免疫治疗和细胞治疗的兴起,T细胞分选技术也得到了广泛应用。
特别是在肿瘤免疫治疗中,利用CAR-T细胞和TCR-T细胞等细胞治疗手段,可以得到很好的临床疗效。
因此,T细胞分选技术的研究也变得越来越重要。
目前,针对T细胞的分选技术已经有了很多进展,如流式细胞仪、磁珠分选、微流控芯片、光学分选等。
其中,磁珠分选技术在T细胞体外扩增和临床治疗等领域得到了广泛应用。
3. 磁珠分选在T细胞治疗中的应用磁珠分选技术在T细胞治疗中的应用主要包括两个方面:一是体外扩增中的分选,二是治疗细胞产品的分选。
体外扩增中的分选:在体外扩增T细胞时,需要从淋巴细胞中选择和分离出T细胞,同时排除其他免疫细胞。
磁珠分选技术可以帮助实现高效分选,并获得高纯度的T细胞,从而提高体外扩增的效率和规模。
治疗细胞产品的分选:在CAR-T细胞和TCR-T细胞等治疗细胞产品中,需要分离出目标T细胞并通过磁珠分选获得高纯度的治疗细胞。
此外,治疗细胞产品的分选也可以用于排除其他污染物,如病毒、细菌等。
4. 磁珠分选T细胞的优缺点优点:1.高效、快速:磁珠分选技术可以非常迅速地获得纯度较高的目标细胞,从而节省时间和成本。
2.高纯度:使用磁珠分选技术可以获得高度纯化的细胞,从而提高了治疗效果和安全性。
3.对细胞活性无影响:分选过程中不需要进行细胞培养等处理,从而保证了目标细胞的活性和功能。
缺点:1.标记物有限:目前可以使用的标记物数量有限,不能针对所有细胞进行磁珠分选。
2.影响细胞表面:磁珠分选的过程可能会对细胞表面结构产生不良影响,从而影响细胞的功能。
cd4tnaive细胞流式分选策略

CD4+Tn本人ve细胞是指未被激活的CD4+T淋巴细胞,它们在免疫应答中扮演着重要角色。
在免疫应答过程中,CD4+Tn本人ve细胞可以分化成多种功能不同的效应T细胞,包括Th1、Th2、Th17和Treg细胞等。
对CD4+Tn本人ve细胞的分选和研究对于理解免疫应答的调控机制具有重要意义。
1. CD4+Tn本人ve细胞的特征CD4+Tn本人ve细胞具有CD45RO-、CD45RA+、CD62L+、CCR7+等标记特征,这些标记使得CD4+Tn本人ve细胞在外周血和淋巴组织中具有明显的表型特征。
2. 流式细胞术的应用流式细胞术是一种通过检测细胞表面标记物来分析和分选细胞的技术,通过流式细胞仪可以高效地对CD4+Tn本人ve细胞进行分选,并获取高纯度的CD4+Tn本人ve细胞裙。
3. CD4+Tn本人ve细胞的流式分选策略(1)初步筛选:根据CD4+T淋巴细胞的特征标记CD4,初步筛选出CD4+T细胞裙。
(2)识别CD45RO-:采用CD45RO-的抗体识别技术,筛选出CD45RO-细胞亚裙。
(3)分选CD45RA+细胞:通过CD45RA+标记特征筛选出CD4+Tn 本人ve细胞。
(4)进一步提纯:使用CD62L+、CCR7+等标记进行二次筛选和提纯,获取高纯度的CD4+Tn本人ve细胞。
4. CD4+Tn本人ve细胞的功能研究CD4+Tn本人ve细胞的功能研究包括分化潜能、免疫应答调控、自身免疫疾病相关机制等方面。
通过对CD4+Tn本人ve细胞的功能研究,可以为免疫相关疾病的治疗和预防提供重要的理论依据。
5. CD4+Tn本人ve细胞在临床应用上的意义CD4+Tn本人ve细胞在免疫耐受、移植免疫和免疫治疗等临床应用中具有重要意义。
研究CD4+Tn本人ve细胞的特性和功能,有助于开发新型的免疫治疗策略,提高治疗效果和降低患者的免疫排斥反应风险。
6. 结语CD4+Tn本人ve细胞的流式分选策略对于免疫应答调控及相关疾病机制研究具有重要意义。
CD4+T细胞分离、纯化及鉴定技术

CD4+T细胞分离、纯化及鉴定技术.doc
CD4+T细胞分离、纯化及鉴定
1. 主要实验材料:MRL/lpr狼疮小鼠;免疫磁珠;CD3-CY5抗体;CD4-FITC 抗体
2. 实验设置:
(一) CD4+T细胞分离
取MRL/lpr狼疮小鼠(18周龄),颈椎脱臼处死,小心剪开小鼠的腹部外皮,再打开腹腔,无菌条件下取出脾脏,在培养皿中加人EZ-SepTM Mouse 1X淋巴细胞分离液,用镊子把尼龙网固定在皿上,然后用注射器活塞轻轻研磨小鼠脾脏,使得分散的单细胞透过尼龙网进入淋巴细胞分离液中,把悬有脾脏细胞的分离液转移到离心管中,800×g离心30min ,离心结束后,淋巴细胞漂浮,吸出淋巴细胞层,250g离心10min,弃上清,0.5mlPBS重悬细胞,加入CD4+标记磁珠,每1×107个细胞加入10ul,4℃避光孵育15min后,300×g离心10min,弃上清,加入0.5ml缓冲液重悬细胞,置LS分离柱于Midi MACS分选器中,1ml缓冲液冲洗LS 分离柱,将细胞悬液加入分离柱中,滴干净后洗柱3次,每次3ml缓冲液,将LS分离柱移出磁场,将滞留在LS分离柱中的CD4+T细胞缓慢冲出,加入PBS洗涤,300×g离心10min,弃上清,细胞沉淀冻存于液氮备用。
(二)分离前后CD4+T细胞纯度鉴定
取上述经MACS分离前后的细胞1×105,离心,弃上清,加入80ul PBS、10ul抗CD3 mAb-CY5和10ul抗CD4 mAb-FITC,混匀,室温避光放置30min 后上流式细胞仪检测分析。
体外扩增CD4CD25Treg细胞的效果比较及体外免疫抑制功能鉴定[1]
![体外扩增CD4CD25Treg细胞的效果比较及体外免疫抑制功能鉴定[1]](https://img.taocdn.com/s3/m/77a01f47c850ad02de80410b.png)
the Treg cells from
all the three groups
rate
expanded significantly after culture for 2 weeks.In the CD4+T cells group.the proliferation
folds with
a
was(77.8±5.32)
decreased
from(76.92±1.72)%to(75.33±2.11)%during the culture,there
were not
significant differences in the cell purity showed that the expanded CIM+ cell dose—dependent manner.It is
(regulatory
T
好的细胞悬液进入磁珠自动分选仪的磁场,阴性选 择出CIM+T细胞;将收集的CD4+T细胞(CD25+T 标有PE)加入抗PE的磁珠,所有CD25+T细胞都 标记有磁珠,细胞悬液经过磁珠自动分选仪的磁场 阳性选择CIM+CD25+Tmg细胞,阴性选择CD4+ CD25一T细胞。具体按CD4l+CD25+Treg细胞的分 选试剂盒说明书进行操作。0.4%台盼蓝染色后检 测细胞活性,流式细胞术检测细胞纯度及表型标记
Yat-Sen 1Department
o
o,FANG Jian.Pei.XU Lgt—Hong
Memorial Hospital,Sun Yat-Sen University,Guangzhou 510120,Guangdong Province,China;
Hospital
ofPediatrics,砌P豫f坩Affiliated
白芍总苷对系统性红斑狼疮CD4+T细胞ITGAL基因表达和启动子甲基化修饰的影响

me s r db o c t m erca ay i; au e yf w y o ti n lss DNA eh lto tt swa sa e ybiuft e u n i g l m t yai nsau sas y db s l es q e cn . i
e t m t u (L ) r h a ssSE. ye o
M e hod : t s CD4 T el r s lt d b stv ee to i g CD4be d . c lswe eio ae ypo ii es lci n usn a s CD4 T el r c l we e s
AB TR C S AT
O jci : oi et ae h f c o tllcs e o en T ) nepes na d A bet e T v sgt tee et foa g oi s f o y( GP o x r i v n i t u d p s o n DN me ya o a s fT A e e C i D4 T cl o a e twi s milp s t l ins t G L gn ( D1 a nC e srm pt ns t s t c u u h t tu oI ) l lf i hy e
亚硫 酸 盐 测序 法 分析 IG L 因启 动 子 甲基化 水 平 。结 果 :T P 理 4 后 ,各 浓度 组 C 4 T细胞 活 力无 明显 差 TA 基 G 处 8h D
异 。与对照组相 比,高浓度组 ( 6 . m /) G L基因 m N 1 2 g I A 5 5 LT R A表达水平显著降低 f 0 ,C 4 T细胞表 面 C 1a P . < 叭) D D l
DNA e h lton s a u fI m t y a i t t so TGAL g n n CD4+T e l o e ei c l f s
cd4t细胞亚群流式分选

cd4t细胞亚群流式分选
CD4+T细胞亚群是人体免疫系统中的重要组成部分,它们在维持免疫平衡和抵御疾病方面发挥着关键作用。
流式分选技术是一种高效、精确的方法,用于分离和鉴定这类细胞。
在流式分选中,首先需要收集所需的细胞样本,通常是外周血或淋巴结穿刺液。
样本经过适当的处理后,会被标记上荧光抗体,这些抗体能够特异结合CD4+T细胞表面的抗原。
抗体标记的细胞通过流式细胞仪进行检测和分析,该仪器能够快速分析大量细胞,并根据荧光信号将它们分成不同的亚群。
流式分选的关键在于抗体标记的选择,以及流式细胞仪的参数设置。
针对CD4+T细胞的不同亚群,需要选择相应的特异性抗体,以便准确地区分不同的细胞类型。
此外,还需要调整流式细胞仪的参数,包括激光波长、滤片、电压等,以确保最佳的检测效果。
通过流式分选,我们可以获得高纯度的CD4+T细胞亚群,这对于研究免疫细胞的生理和病理功能、开发新的治疗方法具有重要的意义。
例如,某些疾病如艾滋病、风湿性关节炎等与CD4+T细胞的功能异常有关,通过流式分选可以深入了解这些疾病的发病机制。
此外,流式分选技术还可以用于监测疾病的进展和治疗反应。
例如,在艾滋病治疗中,通过监测CD4+T细胞亚群的动态变化,可以评估治疗效果和调整治疗方案。
总之,CD4+T细胞亚群的流式分选技术是一种强大的工具,有助于我
们深入了解免疫系统的功能和疾病的发生发展机制。
随着技术的不断进步和应用领域的拓展,流式分选将在未来的医学研究中发挥更加重要的作用。
大鼠CD4 +CD25 +调节性T细胞的分选和提取

A src: bet e T oa n xrctertpenadl p oe I C 2 rgl o es n e c b tatO jcv : oi lt adet th le m hnd s M D 5 eua r TcU ddt t i s e a as n y C ty a e
细胞百分率大于 9% 。结论 通过 免疫磁珠分选 能够提取高纯度高活性 的 C 4 C 2 调节性 T细胞 。 7 D D5 关键词 : 鼠; D C 2 调节性 T细胞 ; 大 C4 D5 免疫磁珠分选
中图分类号 : 3 2 文献标识码 : 文章编号 :0 47 1 (0 2 0 -350 R9 A 10 -15 2 1 )50 2 -3
细胞 , 并对其进行流式检测和细胞活性检测。
1 材料和 方法
C 2 (L一 D 5 I 2受体 O链 ) C 4 T细胞。其可 以分 / 的 D . 为 天然调 节性 T细胞 ( a rl rg n rg 和获 得性 nt aTe , Te) u 调节 性 T细胞 (dpv rg a rg ,Te aateTe , Te ) n r i g主要 指 胸腺 髓质 T细胞 发育 成熟 后 进入外 周 的 Te 细胞 , rg 在 预防病理 性 自身免疫 反应 中发 挥作 用 ;Te 是 由 arg 感染 、 移植、 癌症等抗原诱导 C 4 T细胞转化形成, D 在感染 和移植 免疫 等 发挥 重 要 作用 … 。 由于 C 4 D C 2 调 节性 T细 胞 约 占正 常人 或 大 小 鼠外 周 血 D5 C 4 T细胞的 5 一 0 , D % 1% 由于其数量少 , 极大限制 了其 在 多种疾病 中的临床应 用 。本 实验通 过近 年发 展较 快 的免疫磁 性 分选 技 术 , 用 免 疫 磁 珠 两步 法 应 分 离纯化 大 鼠脾 脏 和淋 巴结 C 4 D 5 节 性 T D C 2 调
糖尿病肾病小鼠CD4+T_细胞的脂质组学研究

糖尿病肾病小鼠CD4+T细胞的脂质组学研究张小雨谭海波黄敏仪贝伟剑杨祎琦(广东药科大学中医药研究院,广州 510006)中图分类号R392.6 文献标志码 A 文章编号1000-484X(2024)03-0471-07[摘要]目的:初步探讨糖尿病肾病(DKD)小鼠CD4+T免疫细胞在脂质组学方面的差异,筛选出具有生物学意义的差异代谢产物。
方法:先采用CD4 (L3T4) MicroBeads免疫磁珠法分离BKS.Cg-Dock7m+/+Lepr db/J自发性DKD小鼠脾脏CD4+T免疫细胞;流式细胞术鉴定CD4+T免疫细胞纯度,LC-MS/MS技术检测CD4+T免疫细胞非靶向脂质组学,对差异代谢产物进行分析。
结果:LC-MS法检测出463个代谢产物;PCA和OPLS-DA分析显示代谢组分明显分离;筛选出24种差异代谢物。
KEGG及富集分析可知差异代谢物涉及甘油磷脂代谢紊乱。
结论:CD4+T细胞磷脂类代谢与DKD的发生密切相关,靶向DKD CD4+T细胞的磷脂类代谢可能是DKD治疗的新方向。
[关键词]CD4+T细胞;糖尿病肾病;脂质组学;磁珠分选;流式细胞术Study on lipidomics of CD4+T cells in mice with diabetic kidney diseaseZHANG Xiaoyu, TAN Haibo, HUANG Minyi, BEI Weijian, YANG Yiqi. Institute of Traditional Chinese Medicine,Guangdong Pharmaceutical University, Guangzhou 510006,China[Abstract]Objective:To investigate the lipidomics differences of CD4+T immune cells in diabetic kidney disease (DKD)mice,and screen out the differential metabolites with biological significance. Methods:CD4 (L3T4)MicroBeads immunomagnetic beads were used to isolate CD4+T immune cells from spleen of BKS. Cg-Dock7m+/+Lepr db/J mice with spontaneous DKD; the purity of CD4+T cells were identified by flow cytometry. The non-targeted lipidomics of CD4+T cells were detected by LC-MS/MS, and the differ‑ential metabolites were analyzed. Results:A total of 463 metabolites were detected by LC-MS. PCA and OPLS-DA analysis showed that the metabolic components were significantly separated; twenty-four differential metabolites were screened out. KEGG and enrich‑ment analysis showed that the differential metabolites involved in the disorder of glycerol phospholipid metabolism. Conclusion:Phos‑pholipid metabolism of CD4+T cells is closely related to the occurrence of DKD. Phospholipid metabolism targeting DKD CD4+T cells in DKD may be a new direction of DKD treatment.[Key words]CD4+T cells;Diabetic kidney disease;Lipidomics;Magnetic bead sorting;Flow cytometry糖尿病肾病(diabetic kidney disease,DKD)是糖尿病最严重的微血管并发症之一,也是终末期肾病的主要病因[1]。
磁珠分选原理及应用

磁珠分选原理及应用磁珠分选是一种利用磁性微珠与目标分子的相互作用来实现分离和富集的方法。
磁珠是一种具有高度磁响应性的微珠,通常由磁性材料(如硅酸铁)和聚合物(如聚丙烯酸)复合而成。
通过磁性微珠与目标分子之间的特异性结合,可以实现目标分子的高效分离和富集。
磁珠分选的原理基于磁性微珠的特异性结合。
磁性微珠可以通过特异性抗体、寡核苷酸、亲和配体等多种方式与目标分子结合。
当磁性微珠与目标分子结合后,可以通过外加磁场将磁性微珠与非结合物质分离开来。
通过控制磁场的力度和方向,可以调控磁性微珠与目标分子的相互作用,实现目标分子的分离和富集。
磁珠分选的应用领域非常广泛。
其中,生物医学领域是磁珠分选的主要应用之一、通过将磁性微珠与特异性抗体结合,可以实现对生物样品中特定目标分子的高效分离和富集。
例如,在肿瘤标志物的检测中,可以通过磁珠分选技术快速富集肿瘤标志物,提高检测敏感性。
此外,磁珠分选还可以应用于基因诊断、药物筛选、蛋白质纯化等领域。
另外,环境监测和食品安全领域也是磁珠分选的重要应用领域。
通过将磁性微珠与污染物或有害物质的特异性结合,可以实现对环境水样、土壤样品以及食品样品中有害物质的高效分离和富集。
例如,通过将磁性微珠与重金属离子结合,可以实现对水样中重金属的高效富集和分离。
此外,磁珠分选还可以应用于工业领域。
在化学合成中,可以利用磁珠分选技术对产物进行分离和富集,提高产物纯度和产率。
在纳米材料合成中,可以通过磁珠分选技术实现纳米颗粒的分离和富集,提高纳米材料的制备效率和品质。
总之,磁珠分选是一种利用磁性微珠与目标分子的特异性结合来实现分离和富集的方法。
它具有高效、快速、灵活等特点,广泛应用于生物医学、环境监测、食品安全等领域。
随着技术的不断发展和完善,磁珠分选在各个领域的应用前景将会更加广阔。
分离纯化t淋巴细胞的方法

分离纯化t淋巴细胞的方法分离纯化T淋巴细胞的方法T淋巴细胞是一类重要的免疫细胞,对于机体的免疫防御起着关键作用。
因此,对于T淋巴细胞的分离纯化技术也备受关注。
本文将介绍几种常用的T淋巴细胞分离纯化方法。
一、梯度离心法梯度离心法是将含有T淋巴细胞的血样加入到密度梯度液中,并进行高速离心分层,从而实现对T淋巴细胞的分离纯化。
常用密度梯度液包括Ficoll-Paque和Percoll等。
具体操作步骤如下:1. 准备含有T淋巴细胞的血样,并加入到密度梯度液中。
2. 进行高速离心分层,使得不同密度的免疫细胞沉积在不同位置。
3. 采集上清液中的T淋巴细胞并进行后续处理。
该方法优点是操作简单、可扩展性强,但缺点是需要大量血样,并且可能会影响到部分免疫细胞的活性。
二、磁珠分离法磁珠分离法是利用表面标记有特定抗体的磁珠,结合T淋巴细胞表面的特定抗原进行分离纯化。
该方法通常需要先对T淋巴细胞进行表面标记,例如利用CD3或CD4等抗体进行表面标记。
具体操作步骤如下:1. 对T淋巴细胞进行表面标记。
2. 加入含有特定抗体的磁珠,并进行充分混合。
3. 利用磁力将带有T淋巴细胞的磁珠集中到一侧,从而实现对T淋巴细胞的分离纯化。
该方法优点是对于其他免疫细胞不会产生影响,但缺点是需要进行表面标记,并且可能会影响到部分免疫细胞的活性。
三、流式细胞术流式细胞术是利用流式细胞仪对不同免疫细胞进行快速、高通量的检测和排序。
该方法通常需要先对T淋巴细胞进行表面标记,并通过流式仪对其进行检测和排序。
具体操作步骤如下:1. 对T淋巴细胞进行表面标记。
2. 加入含有特定抗体的荧光素,并进行充分混合。
3. 利用流式仪对不同荧光素标记的免疫细胞进行检测和排序,从而实现对T淋巴细胞的分离纯化。
该方法优点是快速、高通量,但缺点是需要昂贵的设备和专业技能,并且可能会影响到部分免疫细胞的活性。
总结以上三种方法都是常用的T淋巴细胞分离纯化技术,各有优缺点。
