实验五-人类染色体标本制备
染色体标本的制备及组型观察实验报告

染色体标本的制备及组型观察实验报告细胞生物学实验报告染色体标本的制备及组型观察1.实验目的:掌握染色体标本制作的基本方法;认识不同生物的染色体的状态,学会做染色体组型图。
2.实验用品:(1)仪器及器材:显微镜、载玻片、盖玻片、镊子、手术剪、解剖盘、胶头滴管、离心管、离心机、小烧杯、冰箱、酒精灯、小烧杯(1)实验药品:蒸馏水、0.9% NaCl溶液、0.3% KCl溶液,固定液(甲醇:冰醋酸=3:1)、秋水仙素(2)实验材料:小鼠3.实验原理:(1)制作染色体标本的意义:了解染色体的特征(形态、大小、数目)——绘制染色体组型图染色体组型:把真核动物一个体细胞各染色体按长度、形状、着丝粒位置排列成一定顺序。
染色体核型:某一物种特有的一组或一套染色体的形态特征。
(2)染色体组型图的应用①鉴别生物种类:兔44条;小鼠40条;大鼠42条;鸡78条;猫38条;狗78条;马64条②遗传病的诊断和研究:三体综合征(含三条21号染色体)、卵巢退化症(含45条染色体,比正常人缺少一条性染色体)、睾丸退化症(含47条染色体,比正常人多一条X或Y染色体)等因此,我们可以给孕妇抽取羊水检查器胎儿的染色体,做遗传病早期诊断。
(3)染色体标本的制作①观察:由于分裂期中期的染色体染色体凝集程度最高,因而我们应尽量使细胞停留在分裂期中期以便观察。
②细胞:为尽量看到多的染色体,我们应当选取具有旺盛分裂能力的细胞,这样的细胞可以来自:胸腺、骨髓、睾丸、小肠等。
我们在此实验中使用的是小鼠的精巢细胞。
在做人的染色体标本时,我们使用的是血液里的淋巴细胞。
③药物:PHA(植物细胞凝集素):PHA具有促进细胞凝集和分裂的作用。
PHA可以使血液中的淋巴细胞还原至淋巴母细胞(只存在于骨髓中)秋水仙素:秋水仙素可以破坏微管的组装,纺锤体不能形成,细胞分裂停在中期。
与秋水仙素作用相同的药物还有长春花碱、鬼臼素、苯环己烯等。
可以促进胃管组装的药物有紫杉酚、重水等。
人类染色体分析外周血培养制备染色体标本

2.各种试剂的配制、稀释过程
3.培养基的配制
• RPMI1640 体积分数80% 小牛血清 体 积分数20% PHA40ug/mL
• 青霉素 100单位/L培养基 链霉素 100 单位/mL培养基
• 卡那霉素 100单位/mL培养基
操作流程
• 操作
人中期细胞染色体(染色体数目2N=46)
•人
六、作业及思考题
1.将分散良好的标本进行显微镜照相。 2.观察人类染色体的形态、结构特点。 3.总结做好本实验的关键因素。 4.对比男性和女性的染色体标本,比较异
同。
五、实验注意事项
。 2.培养中成败的关键,除了至为重要的PHA的效价
外。培养的温度和培养液的酸碱度也十分重要。 3.培养过程中,如发现血样凝集,可将培养瓶轻
轻振荡,使凝块散开,继续放回37℃恒温箱内 培养。 4.制片过程中,如发现细胞膨胀得不大,细胞膜 没有破裂,染色体聚集一团伸展不开,可将固 定时间延长。
一、实验目的
• 学习外周血淋巴细胞悬浮培养的原理和 方法,利用培养后进行分裂的细胞制备 人类染色体标本。
• 了解人类染色体的基本形态特点,为核 型分析和原位杂交实验提供良好的染色 般血 情中 况下的是淋不巴分细裂胞的几。乎当都在是培处养在基G0中期加或入G1植期物, 血凝素(phytohemagglutinin PHA)时,这种小 淋巴细胞受到刺激后转化为淋巴母细胞,并开始 进行有丝分裂。经过短期培养后,用秋水仙素处 理、低渗、固定、滴片和染色,就可获得大量中 期分裂相的细胞,制片后可以清楚地对染色体进 行观察。这种培养方法是Moorhead于1960年建 立的。在人类遗传分析中普遍采用外周血培养的 方法获取分裂的细胞,进而开展临床和基础遗传 学的研究,这对于遗传疾病的检出以及遗传咨询 等工作发挥了重要作用。
中山大学人类X染色质标本的制备与观察报告

人类X染色质标本的制备与观察张皓予15335203一、实验目的1.掌握人体口腔黏膜上皮细胞制备的方法。
2.正确识别巴氏小体的特征及其所在位置。
3.说明人体细胞中核内X染色体的数目和性染色体数目之间存在的关系。
二、实验原理X染色质呈现于女性体细胞间期细胞核内。
在口腔黏膜细胞、羊水脱落细胞、皮肤结缔组织等细胞中均可检出。
用苯酚品红改良染液染色后,便可观察到染色较浓,多位于核膜内侧缘,呈凸平形、卵圆形、扁平或三角形,直径约1μm大小的小体。
女性细胞核中出现率为40%~60%。
Barr和Bertram首先(1949)在雌性猫的神经细胞核中发现,在多数核中部有一个小的深染的小体,而在雄性猫的同样细胞中只能偶而观察到这种小体,此后许多人的研究指出这种与性别有关的两型现象在有袋类、偶蹄类、食肉类和灵长类等动物的多数组织细胞中存在,而在噬齿类中只在少数组织中可以观察到。
这种染色质小体现在称为“性染色质”(sex chromatin),或称为“巴氏小体”(Barr body)。
这种小体常位于核膜的内表面,呈Feulgen阳性反应,表明是DNA的成分,有证据表明,性染色质的存在是由于在雌性哺乳动物核中存在两个X染色体,其中一个X染色体处于失活状态。
雄性个体只有一个X染色体。
因此原则上男性不应有性染色质。
但如果一个男人有XXY染色体,那就会有一个性染色质,虽然表现为男性。
同样,XXX的三体应当有两个巴氏小体。
因此,性染色质实质上是一个失活的X 染色体。
为什么失活的X染色体会以巴氏小体的形式显示出来?目前,已有许多证据证明,在雌性个体中那根失活的X染色体已经异染质化,成为功能性异染质。
使用放射自显影的方法已经证明,失活的X染色体的固缩周期与其它染色体是不同步的,它在S期是晚复制的。
此外,人们也已发现,晚复制的这根X染色体常位于核的边缘,这个位置也正好是巴氏小体出现的位置。
三、实验仪器与试剂1.仪器与用具显微镜,水浴锅,牙签,载玻片,盖玻片,镊子,吸水纸。
人类外周血染色体标本制备

14、染色( Giemsa staining) Giemsa染液染色8分钟,玻片用自来水冲洗,晾干。 15、镜检(microscopic examination)
四、试剂和药品 1、 培养液的配制 RPMI1640培养基(含L-谷氨酰胺和碳酸氢钠) 80%
小牛血清(56℃水浴灭活30分钟)
植物血凝素PHA (主要成分是粘多糖和蛋白质) 青霉素终浓度 链霉素终浓度
10、再固定: 加入固定液(甲醇︰冰醋酸 = 1︰3),固定 20分钟。
11、再离心
1000转/分离心10分钟,弃去上清液,留沉淀。
12、再固定 加入固定液(甲醇︰冰醋酸 = 1︰1)打匀,固定 20分钟。
13、制片
固定后, 1000rpm离心10分钟,留下 0.2ml 沉淀物,吸取细胞 悬液滴在已用冰水浸泡的洁净载玻片上,立即用嘴吹散,在洒精灯 焰上通过几次,使细胞平铺于载玻片上,空气干燥(dir drying)。
5、 甲醇 ( methanol )
6、 冰醋酸 (acetic glacid)
二者以不同比例配合使用
新鲜配制
7、吉姆沙染液(Giemsa)
吉姆沙由天青、伊红和甲基蓝组成 先将0.5克吉姆沙粉未干研磨,加33毫升60℃预热的纯甘油,在研钵 中研磨,在60℃水浴中保温90分钟。冷却后,再加入33毫升甲醇,滤纸 过滤,收集在棕色瓶中保存。原液要提前半年配制。原液中按比例加入 磷酸缓冲液即可染染色体标本。
1份Giemsa原液+ 9份磷酸缓冲液
8、磷酸缓冲液(pH 6.8)
溶液A:磷酸二氢钾 (KH2PO4.2H2O) 9.078克溶于1000毫升蒸馏水中。 溶液B:磷酸氢二钠 (Na2HPO4.2H2O) 11.876克溶于1000毫升蒸馏水中。 100毫升缓冲液:需溶液A50.8毫升,溶液B49.2毫升。
实验五-人类染色体标本制备

实验五-人类染色体标本制备实验目的了解人类染色体的结构和形态,学习制备人类染色体标本的方法。
实验原理人类染色体是由DNA和蛋白质组成的细胞核内生物大分子。
它们是非常细小的、线性的、染色体形态因不同的染色体而异。
人的细胞内共有46条染色体,其中,44条是自动对应的配对染色体,男性有一对性染色体(XY),女性有两条同源性的性染色体(XX)。
制备人类染色体标本需要对细胞进行处理,使其在显微镜下展示出明显的染色体结构。
常用的制备方法是细胞悬液滴落法,即将细胞悬液滴于载片上,在经过一系列的处理后,使其形成明显的染色体结构。
实验步骤1.取合适数量的细胞悬液,滴在已经清洗干净的载片上;2.将载片在干燥器中干燥1小时左右;3.取三瓶试剂,分别为80%乙醇、95%乙醇、细胞色素,放置在洁净的台面上备用;4.将载片沉于80%乙醇中,浸泡5分钟;5.将载片取出,去除乙醇,挥干后,再将载片沉于95%乙醇中,浸泡5分钟;6.将载片取出,去除乙醇,挥干后,将其浸泡在细胞色素溶液中15-30秒;7.将载片在流动自来水下快速漂洗干净,挥干,然后在100%乙醇中固定3-5分钟;8.将载片气干(可用酒精灯),涂两三滴甘油,再覆盖薄玻璃片即可。
实验结果制备好的人类染色体标本可以用显微镜观察到细胞核内的染色体。
成品的标本应该能够清晰地显示出染色体的结构和形态,如下图所示:chromosome1.jpg实验注意事项1.操作时要注意卫生和安全;2.选择细胞悬液的质量对制备染色体标本的质量会有影响;3.操作中需要用到一次性手套;4.操作时尽可能避免离心过度,避免对细胞造成破坏。
实验通过本次实验,我们学习了制备人类染色体标本的方法,掌握相关的操作技巧,对人类染色体的结构和形态有了更深入的了解。
在实验过程中,需要注意卫生和安全,避免对实验者本身和实验环境造成不必要的伤害。
人类染色体的制备

第3讲
人类外周血淋巴细胞染色体标本制备
5)固定 : 加入6ml固定液,混匀,室温放置10min。
6) 2000r/m 6min, 吸弃上清液。
7) 再固定: 重复5,6 步一次。
第3讲
染色体处于中期
第3讲
人类外周血淋巴细胞染色体标本制备
试剂: 植物血凝素 (PHA ) 刺激外周血淋巴细胞从G0期返回正常细胞周
期。
秋水仙素(colchicine) 作用:阻止微管组装。 1)中期染色体无法排列赤道板。 2)抑制姐妹染色体的分离,将细胞停留在中
第3讲
人类外周血淋巴细胞染色体标本制备
其他试剂:
低渗液 (0.075 mol/L 氯化钾):能使细胞膨胀,便于染色体 分散而易于观察和计数
固定液 (甲醇与冰醋酸按3: 1配制) :稳定染色体的形态结 构,清除染色体外层物质对染色体在玻片上展开的影 响,通过更换固定液2-3次,清除红细胞的碎片,使标 本片的背景更为清晰,现用现配。
。Giemsa染液
第3讲
人类外周血淋巴细胞染色体淋巴细胞的培养
提取血液在含PHA、血清的培养基中培 养 72小时。 1)大多数细胞进入第二细胞周期。 2)实验前4小时加入秋水仙素。 3)实验时,多数细胞停留在中期。
第3讲
人类外周血淋巴细胞染色体标本制备
2.染色体标本制备 1)摇匀培养物,吸取培养物于离心管中。 2)2000r/m 离心 6min(注意配平), 吸弃上清液
。
第3讲
人类外周血淋巴细胞染色体标本制备
3)低渗: 加入预温37℃的 6ml KCl (0.075 M ), 吹打混匀沉淀, 37℃ 水浴 15min,以达到红细胞破裂、淋巴细胞膨胀和染 色体分散的目的。
人类染色体G显带标本的制备

注意事项
良好的培养效果为,标本片上中期分裂相要多, 且染色体分散要好。
染色体长度应能适应显带分析技术的要求。
G显带成败之关键取决于胰酶液的浓度和处理时间 之搭配。
实验结果
低倍镜下可看到中期分裂相,进而转至高倍 镜及油镜下观察,可见23对染色体较为饱 满,分布均匀,着色较好,沿染色体长轴可 显出深浅不同的G带横纹。
试剂及器材
试剂:胰蛋白酶、0.4%酚红、5% NaHCO3、 Giemsa原液、pH7.4磷酸盐缓冲液,0.85%生理 盐水。
器材: 37℃恒温水浴箱、染色缸、刻度吸管、滴 头。
实验步骤
取胰酶25mg,溶解于盛有50 ml0.85%生理盐水的 染色缸中,置37℃恒温水浴箱中,加入0.4%酚红2 滴,混匀,以5% NaHCO3调节pH为6.6-7.0。
Байду номын сангаас
Giemsa染料是噻嗪--曙红染料,染色体的着色有赖 于在原位形成噻嗪--曙红(2∶1)的沉淀物。着色 首先取决于二个噻嗪分子同DNA结合,在此基础 上再结合一个曙红分子,其次取决于一个疏水环 境,以利于染料沉淀而着色。通过胰酶的显带预 处理可除去阴性G带区的疏水蛋白,或使它们的结 构变成更亲水状态。由此可知,在G显带中抽取的 蛋白往往是疏水的,且主要来自阴性G带区。
原理
常规制备的染色体标本经烤片后,用热碱、各 种蛋白酶、尿素、去垢剂或其它溶液等预处理 再以Giemsa 染色,在油镜下可看到染色体两 臂显示出着色深浅不同的横纹。最常用的是胰 蛋白酶法。
可能的机理是:G带区含有较丰富的A-T 对, 在间期核呈固缩状态,而且是DNA晚复制区之 一。Giemsa染料在G带区是与DNA结合,而且 与结合DNA的染色质非组蛋白有关。
人类染色体标本制备经验

第一部分人类染色体研究的实验室建设一、实验室要求1、准备室(约30平方米):供清洗玻璃仪器、配制试剂仪器包装消毒及制片场所,还必需配置耐酸碱水池、实验操作台、药橱等设施。
并能合理放置冰箱、电热干燥箱、离心机、纯水器、消毒锅、天平等仪器,以方便使用。
2、无菌室(约25平方米):用作细胞的接种培养、配备培养基。
分为更衣室(约4平方米)、缓冲室(约6平方米)、接种室(约15平方米)。
配备空调机、传递窗、离心机、倒置显微镜、超净工作台、臭氧发生器或紫外灯、培养箱等设备仪器。
3、分析室(约15平方米):为观察分析核型、整理资料场所。
配备高清晰度带照相装置的显微镜,电脑、打印机、办公桌等。
二、设备仪器(一)仪器1、超净工作台一台2、光学显微镜二台(可以安装染色体软件分析系统)倒置显微镜与带照相装置的正立显微镜各一台。
倒置显微镜用作细胞培养;正立显微镜用作核型分析,有条件的单位可配备染色体分析软件、电脑、打印机等。
3、隔水式恒温培养箱一台开展产前检查的单位,最好购买二氧化碳培养箱。
4、电热干燥箱一台5、冰箱二台:普通冰箱和低温冰箱各一台6、酸度计一台(可略)7、纯水器(电阻率18兆欧姆)一台;(可略)8、高压灭菌锅一台(可略)9、电热磁力搅拌器一台(可略)10、真空泵(无油)一台(可略)11、电子天平二台(万分之一天平与普通天平各一台)12、水平式离心机二台转速0-4000转/分,10毫升/管,大容量与小容量各一台。
大容量的供制片用,小容量的放置无菌室供细胞培养用。
13、可调移液器若干支:规格从5-5000微升若干支14、超声波清洗器一台(可略)15、水浴箱(0-100℃可调)(二)玻璃器皿与耗材1、培养瓶:15毫升链霉素瓶,25毫升小方瓶(建议采用一次性培养瓶)。
2、刻度离心管(10毫升)50支3、量筒(10-1000毫升):各种规格各一个。
4、不锈钢滤器(各种规格各一个)及滤膜(孔径中0.25微米)一盒5、注射器(1-20毫升)若干6、盐水瓶(100-500毫升)若干7、试剂瓶(磨口)10个8、蒸馏水瓶(3万或5万毫升)2个9、染色缸1个10、研钵1个11、酒精灯2盏12、滴管(带吸头)50支13、载玻片若干14、试管架和离心管架各2个15、各种镊子与剪刀若干16、铝饭盒(供盛培养瓶滴管等器械消毒时使用)17、烧杯(容量50-2000毫升)各一个18、抽滤瓶(1000-2000毫升)一个19、各种规格的可调移液器吸头若干20、载波片盒(50-100片)若干* 玻璃器材的材质应采用中性硬质玻璃或硼硅玻璃三、常用药品及试剂1、培养基(RPMI 1640、HamF10)2、植物凝集素(phytohemagglutinin简称PHA)3、肝素钠(抗凝剂,医用级)4、血清(小牛血清、胎牛血清)5、抗菌素(青霉素、链霉素)医用级6、秋水仙素(秋水仙碱)7、氧化钾(分析纯)8、碳酸氢钠(分析纯)9、磷酸二氢钾和磷酸氢二钠(分析纯)10、乙二胺四乙酸二钠(EDTA,分析纯)11、三羧甲基氨基甲烷(Tris,分析纯)12、胰蛋白酶13、酚红14、姬姆沙染料(Giemsa)15、甲醇(分析纯)16、冰醋酸(冰乙酸)(分析纯)17、重酪酸钾(化学纯)18、浓硫酸(工业级)19、香柏油20、甘油(分析纯)21、乙醇(无水和纯度95%,化学纯)22、乙醚(无水,化学纯)23、生长因子(碱性成纤维细胞因子bFGF、表皮细胞生长因子EGF)24、氢氧化钠(分析纯)25、柠檬酸钠(分析纯)(注:达晖生物全套提供上述仪器和试剂产品,并提供完善的技术支持和服务)第二部各类器械清洗与常用试剂配置一、各类器械清洗处理1、清洗液配置清洗液配方方法:先将重酪酸钾溶于水中,再慢慢加入工业浓硫酸。
人类性染色质标本的制备和观察

内容步骤
实验一
(二)X染色质标本的制备与观察
1、制作过程: 取材(漱口后用牙签刮取口腔黏膜上皮细胞标
本) → 涂片 → 染色(滴1~2滴染液) → 盖片(染色5-8min) → 压片(吸去多余染液) → 镜下观察
2、观察(高倍镜)
实验一
1、几对基本概念 2、X染色质形成机制——Lyon假说
实验一
X染色质
实验一
Lyon假说:
(1)正常女性体细胞内仅有1条X染色体有活性,另 一条X染色体在遗传上是失活的,在间期细胞 核中高度螺旋化而呈异固缩的X染色质。
(2)X染色体失活发生在胚胎早期。 (3)X染色体失活的随机性和恒定性。
实质:失活的X染色体 意义:X染色体的剂量补偿 X染色质的数目=X染色体数-1
(2)识别X染色质的标准:(高倍镜下) 位置:紧贴核膜内侧缘,轮廓清楚,唯一深染的小体 大小:直径为1-1.5um,即小于核直径的1/10 形态:一般为平凸形,三角形或为卵圆形
实验一
内容步骤
实验一
(二)X染色质标本的制备与观察
1、制作过程: 取材(漱口后用牙签刮取口腔黏膜上皮细胞标
本) → 涂片 → 染色(滴1~2滴染液) → 盖片(染色5-8min) → 压片(吸去多余染液) → 镜下观察
人类性染色质标本的制备、 分析和PTC尝味实验
实验一
目的与要求
1. 掌握:人类间期细胞核中性染色质的形成 机制。(重点,难点)
2.熟悉:X染色质标本的制作方法;熟悉人类 间期细胞核中性染色质的形态特征和分布。
3.了解: PTC尝味实验方法及这种单基因遗传 性状的遗传规律。
内容步骤
人类染色体标本的制备及G显带核型分析

液,轻轻混匀,制成磨砂状悬液。 11.制片:取上述悬液1~2滴,滴至沾有冰水或干燥的
洁净载玻片上,吹散,过火,空气干燥。 12.37℃温箱放置3~4天或70℃烘烤2 h进行老化处
理,以备显带分析用。
【(二实)人验类染方色法体和的G步显带骤】
染色体的带纹是染色体标本经过特殊处理后,每条 染色体上沿纵轴显示出的一定数量、着色程度不同、 宽窄不等的横纹。染色体带是染色体固有的、稳定 的特征。染色体G显带是多种显带技术中的一种,是 将染色体标本经胰蛋白酶处理后再用吉姆萨 (Giemsa)染液染色。G显带技术因其方法简便, 重复性好,带纹清晰且可长期保存而应用最为广泛。
2. 超净工作台内将抗凝血加入RPMI-1640培养液中,
每 瓶加0.3~0.5 ml全血。轻轻混匀。 3. 37℃恒温培养箱静置培养72 h左右(培养24 h后水平 轻摇培养瓶一次,以悬浮混匀血细胞)。 4. 培养至68~72 h(即终止培养前2~4 h),每瓶加秋 水仙素(20 μg/ml)至终浓度0.1~0.2 μg/ml,轻摇 培养瓶混匀,继续培养2~4 h。 5. 终止培养,将培养物吹打混匀后转移到10 ml玻璃离 心管,配平,1800 rpm 离心6 min。
2. G显带过程中的关键因素包括胰蛋白酶的作用时间、 温度、pH等。其中胰蛋白酶溶液应37℃充分预热,溶 液pH应维持在6.8~7.2,以保证酶活性的发挥。另外 消化要适度,消化不足则带纹不清晰或不显示,消化过 度则带纹模糊甚至损失。
[作业与思考题]
1.简述人类染色体制备的操作过程和基本原理。 2.总结人类染色体制备过程中的关键步骤及注意
植 物血凝素(PHA)、秋水仙素(20μg/ml)、 0.075 mol/L氯化钾低渗液、0.85%生理盐水、 固定液(甲醇:冰醋酸=3:1,现配现用)、 Giemsa原液、0.25%胰蛋白酶溶液、磷酸盐缓冲 液。
人类染色体标本制备及核型分析(1)

图像分析
核型描述与命名
将观察到的染色体图像进行数字化处理, 利用计算机图像分析技术对染色体进行自 动或半自动的识别、测量和分类。
根据染色体的形态、结构和数量特征,对 核型进行描述和命名,建立核型数据库。
数据解读与报告生成
数据解读
通过对核型数据的解读,可以了解待测生物体的遗传特征、染色体变异情况以及与疾病的关系等信息 。
更好的分裂相。此外,对于某些难以染色的标本,可以尝试使用不同的
染色方法和染色剂。
结果判读和数据分析方法
要点一
结果判读
根据染色体的形态、大小和着丝粒位置等特征进行识别。 对于异常染色体核型,需结合临床信息进行综合判断。
要点二
数据分析
采用专业的染色体核型分析软件对实验结果进行统计分析 。通过比较正常和异常核型的比例、染色体变异类型及频 率等指标,评估标本的质量和实验结果的可靠性。
伦理道德审查
在应用染色体标本制备及核型分析技术时,应进行严格的 伦理道德审查。这包括评估实验目的、样本来源、数据使 用等方面的合规性和合理性,确保技术的使用符合伦理道 德要求。
保护个人隐私和权益
在染色体标本制备及核型分析过程中,应严格保护个人隐 私和权益。这包括确保样本信息的保密性、限制数据使用 和共享范围、尊重个人知情权和选择权等方面的措施。
人类染色体标本制备及核型分析
汇报人:XX
目录
• 染色体标本制备基础 • 核型分析原理及方法 • 人类染色体异常类型及影响 • 实验操作技巧与经验分享 • 临床应用前景与挑战
01
染色体标本制备基础
染色体概念及结构
染色体定义
染色体是细胞核内具有遗传信息 的线性结构,由DNA、蛋白质和 少量RNA组成。
人类染色体标本制备

人类染色体标本制备
标题大纲
大纲1 外周血非显带染色体标本的制作 大纲2 染色体显带技术 大纲3 高分辨染色体制片
【掌握】1.染色体标本制作的主要步骤 2.染色体不同显带技术的检测目的
【了解】其余内容
大纲1 外周血非显带染色体标本的制作
显微镜下所见的染色体
染色体制备原理及主要步骤 人外周血小淋巴细胞,通常都处在G1期(或G0期 ),一般情况下不进行分裂。如在培养液中加入植 物血凝素(PHA),这种小淋巴细胞受到刺激可转 化为淋巴母细胞,进入有丝分裂。短期培养后,经 秋水仙素处理,低渗和固定,即可得到大量的有丝 分裂细胞。
四. R显带
其与G显带的带纹相反,即G带显示为深带,R带显示为 浅带 。主要用于检测染色体末端的异常。
大纲3 高分辨染色体制片
原理:人外周血淋巴细胞,在有丝分裂刺激剂(PHA) 作用下,转化为淋巴母细胞,进行有丝分裂。当细胞增殖 到一定数量时,加入5-氟尿嘧啶和尿嘧啶核苷从而抑制 DNA的合成,将其同步在S期,17个小时后加入胸腺嘧啶 核苷(TDR)释放细胞,使细胞有丝分裂继续,进入分裂 期后加入染色体缩短抑制剂溴化乙锭(EB),并加入秋水 仙胺破坏纺锤丝的形成。同步化使细胞处于相同的阶段, EB使DNA的螺旋化程度降低,通过这种方法制备的染色 体有较多条带,最高可达上千条带,能够更好地显现染色 体细微的结构,提高人类染色体分辨率,特别有益于智力 低下、反复流产等病因分析。
8.弃上清液,再重复两次上述的固定步骤。
9.弃上清液,将两管离心管中剩下的细胞合成一管,并加入 适量固定液调成细胞悬液。
四.滴片:取出在4℃冰水中预冷的清洁玻片,对玻片进行标 识,把玻片置于滴片板上 ,用吸管吸取细胞悬液约0.3ml 在20cm~25cm的高度滴于玻片上,玻片的头体尾各一 滴即可 。
人类染色体标本制备及核型分析

人类染色体标本制备及核型分析引言:一、人类染色体标本制备步骤:1.收集样本:收集需要研究的人类标本,可以是血液、组织、胎儿细胞等。
2.细胞培养:将收集的样本进行细胞培养,通常采用体外培养的方式,如使用无菌培养皿和细胞培养基。
3.处理样本:细胞培养达到一定数量后,可以使用震荡器等设备将细胞从培养皿上剥离下来,制备成单细胞悬液。
4.固定细胞:将细胞悬液进行固定处理,一般使用醋酸乙酯等有机溶剂将细胞固定在载玻片上。
5.染色:染色是核型分析的关键步骤,可以使用吉姆萨染色法、G显带染色法等多种染色方法,使染色体可见并呈现出特定的形态和颜色。
6.干燥和贴片:将染色的载玻片进行干燥处理,然后使用透明胶带将玻片贴到载玻片上。
二、核型分析方法:1.显微镜观察法:使用光学显微镜对染色体进行观察和分析,直接通过目视的方式判断染色体的形态和数量。
2.数字图像分析法:使用计算机图像分析系统对染色体图像进行数字化处理,通过计算机算法分析染色体的长度、形态、染色体异常等指标。
3.荧光原位杂交法(FISH):利用标记有特定荧光标记物的探针与染色体特定区域发生互补结合,从而通过荧光显微镜观察染色体的特定区域。
4.光学显微镜配合显影法:使用特定的显影剂,使染色的染色体呈现出明亮的色带,详细观察和分析色带的大小、位置及形态等。
三、核型分析的意义:1.遗传病诊断:染色体核型异常与一些遗传疾病有关,通过核型分析可以确定染色体异常和遗传病的关联。
2.胎儿异常筛查:通过对孕妇的羊水或绒毛进行染色体核型分析,可以早期发现胎儿的染色体异常,如唐氏综合征等。
3.种群遗传学研究:核型分析可以用于研究人类群体的遗传多样性和进化关系,了解不同人群间的遗传差异。
4.基因定位:核型分析可以帮助确定染色体上的基因位置,进而研究与之相关的遗传疾病或性状。
结论:人类染色体标本制备及核型分析是一项重要的遗传学研究手段,通过制备标本和观察分析染色体,可以了解人类的遗传信息和与染色体异常相关的疾病。
人类外周血染色体标本制备
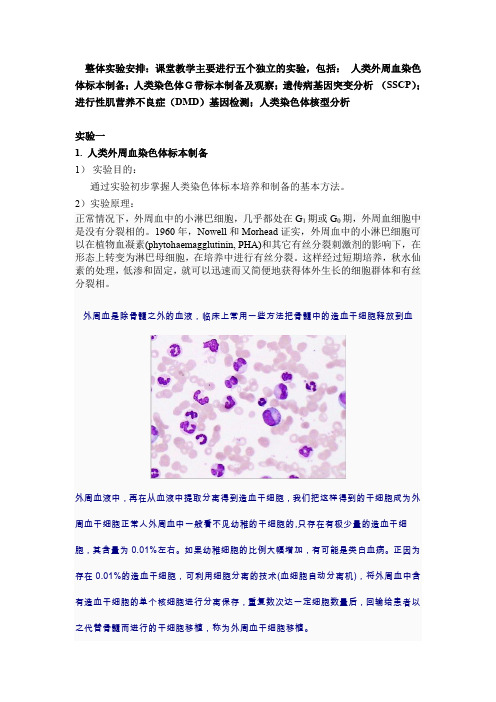
整体实验安排:课堂教学主要进行五个独立的实验,包括:人类外周血染色体标本制备;人类染色体G带标本制备及观察;遗传病基因突变分析(SSCP);进行性肌营养不良症(DMD)基因检测;人类染色体核型分析实验一1. 人类外周血染色体标本制备1)实验目的:通过实验初步掌握人类染色体标本培养和制备的基本方法。
2)实验原理:正常情况下,外周血中的小淋巴细胞,几乎都处在G1期或G0期,外周血细胞中是没有分裂相的。
1960年,Nowell和Morhead证实,外周血中的小淋巴细胞可以在植物血凝素(phytohaemagglutinin, PHA)和其它有丝分裂刺激剂的影响下,在形态上转变为淋巴母细胞,在培养中进行有丝分裂。
这样经过短期培养,秋水仙素的处理,低渗和固定,就可以迅速而又简便地获得体外生长的细胞群体和有丝分裂相。
外周血是除骨髓之外的血液,临床上常用一些方法把骨髓中的造血干细胞释放到血外周血液中,再在从血液中提取分离得到造血干细胞,我们把这样得到的干细胞成为外周血干细胞正常人外周血中一般看不见幼稚的干细胞的,只存在有极少量的造血干细胞,其含量为0.01%左右。
如果幼稚细胞的比例大幅增加,有可能是类白血病。
正因为存在0.01%的造血干细胞,可利用细胞分离的技术(血细胞自动分离机),将外周血中含有造血干细胞的单个核细胞进行分离保存,重复数次达一定细胞数量后,回输给患者以之代替骨髓而进行的干细胞移植,称为外周血干细胞移植。
外周血培养基配制一、配制用水培养基的大部分是水,所以水的质量直接影响培养基的质量。
按Waymouth标准,水的电阻应为200万欧姆,一般实验室里以玻璃蒸馏器制备的双蒸水或三蒸水可以符合使用条件。
二、培养基培养基有天然、人工两种。
一般实验室使用的是RPMI-1640粉末培养基,以双蒸或三蒸水配制。
NaHCO3(或HCl)调pH至7.2~7.4,若pH值超过7.6或远低于6.8,则大多数细胞不能生长。
实验五人类染色体标本制备

实验五人类染色体标本制备【目的要求】1 •熟悉人外周血淋巴细胞培养的原理。
2.初步掌握人类外周血淋巴细胞染色体标本的制备方法。
3•了解正常人非显带染色体核型特征及核型分析方法。
【实验原理】人类间期细胞核中的遗传物质染色质,在细胞进入分裂期时,经逐级螺旋形成染色体。
在分裂期的中期,染色体达到最大程度的凝集,表现为短而粗的典型结构。
人外周血的有形成分中,只有白细胞有核,而白细胞中只有淋巴细胞(主要是小淋巴细胞)具有潜在的细胞分裂能力。
培养液中加入有丝分裂刺激剂植物血凝素(PHA)可使处于G期、具有潜在分裂能力的淋巴细胞转化为具有分裂能力的淋巴母细胞,并进入旺盛的有丝分裂周期;加入纺锤体抑制剂秋水仙素可使处于分裂过程的淋巴细胞停滞在分裂中期,在收获细胞时,用低渗剂0.075mol/L KCI对细胞进行低渗处理,可使胞膜胀破,染色体均匀分散;经离心、固定、制片等过程,最终可获得便于观察分析的染色体标本。
制备的染色体标本片,不经特殊处理,直接染色,在显微镜下观察识别,并进行核型分析的过程称为染色体非显带核型分析。
【实验用品】(一)材料:人外周静脉血。
(二)器材:吸管、刻度离心管、量筒、5ml注射器、6号针头、台式离心机、试管架、冷藏载玻片(一端磨砂)、铅笔、酒精灯、超净工作台、恒温水浴箱、载玻片、止血带、酒精棉球、显微镜、废液缸。
(三)试剂1. RPMI1640 培养液(1) RPMI1640 : RPMI1640固体培养基10.4 g,溶于1000 ml双蒸水中,抽滤除菌。
(2) RPMI1640培养液:每100 ml RPMI1640培养液中含RPMI 1640 80 ml、灭活的小牛血清20 ml、PHA 50 mg 青霉素(终浓度100 U/ml)、链霉素10000卩g (终浓度100卩g /ml), 15磅、20min高压灭菌的NaHCO调pH至7.2〜7.4,分装20小瓶,每瓶5 ml。
(3)配制方法配制过程所需的玻璃器具先用浅水洗刷干净,烘干,放入清洁液中浸泡2d,取出后用自来水冲洗15次,蒸馏水冲洗3次,双蒸水冲洗1次,烤干后包装,15磅20 min高压灭菌。
人类染色体标本制备及核型分析

显微镜使用与图像采集
显微镜类型
用于核型分析的显微镜主要有光学显微镜和电子显微镜两种 。
图像采集方法
通过显微镜观察染色体标本,使用相机或图像采集卡等设备 获取染色体图像。
染色体识别与计数
染色体识别
根据染色体的形态、大小、着丝粒位置等特征进行识别。
染色体计数
对识别出的染色体进行计数,得到细胞内的染色体数目。
遗传病预防
通过基因编辑等技术手段,对某些遗传病进行预防,降低后代患病 风险。
生育能力评估
对不孕不育患者进行染色体核型分析,评估其生育能力。
案例分析:成功解决遗传问题案例分享
案例一
一对夫妇因多次自然流产寻求遗传咨询,通过染色体核型分析发现女方存在染色体平衡易位,经过遗传咨询和辅助生 殖技术治疗,成功生育健康宝宝。
人类染色体标本制备及核型 分析
汇报人:XX
目录
• 染色体标本制备基础 • 人类染色体标本制备步骤 • 核型分析基本知识与技术 • 人类染色体异常类型与识别 • 临床应用与案例分析 • 实验注意事项与质量控制
01
染色体标本制备基础
染色体概念及结构
染色体定义
染色体是细胞核中容易被碱性染料染成深色的物质,主要是由DNA和蛋白质组 成,在细胞分裂间期呈染色质状态,进入分裂期则高度螺旋化呈短棒状的染色 体。
异常染色体识别技巧
01
观察染色体形态
异常染色体可能表现出形态上的 不规则,如断裂、缺失或重复等 。
02
分析核型图像
通过核型分析软件对染色体进行 排序和比对,识别异常染色体的 存在。
03
应用荧光原位杂交 技术
利用特定序列的荧光探针与染色 体上的目标序列进行杂交,从而 准确识别异常染色体。
染色体标本制备实训报告

一、实验目的1. 掌握人类外周血淋巴细胞染色体标本的制备方法。
2. 熟悉染色体标本制备过程中的各项操作步骤。
3. 了解染色体标本的观察与分析方法。
二、实验原理染色体是生物细胞在有丝分裂过程中出现的结构,是遗传信息的载体。
染色体标本的制备是进行遗传学研究和临床诊断的重要基础。
通过制备染色体标本,可以观察染色体的形态、结构和数目,从而判断个体的遗传状况。
三、实验材料与仪器1. 实验材料:外周血、RPMI 1640液体培养基、小牛血清、肝素(500 U/ml)、植物血凝素(PHA)、秋水仙素(10mg/ml)、KCl低渗液(0.075mol/L)、甲醇、Giemsa染料、载玻片、盖玻片、显微镜等。
2. 实验仪器:恒温培养箱、超净工作台、离心机、刻度离心管、乳头吸管、试管架、量筒、试剂瓶、吹风机、托盘天平、显微镜、镜油、二甲苯、擦镜纸、镊子、烧杯、记号笔、玻片架、火柴、10ml注射器等。
四、实验方法与步骤1. 采集外周血:抽取受试者外周静脉血5ml,加入肝素抗凝。
2. 细胞培养:将采集的外周血加入含有RPMI 1640液体培养基的培养瓶中,加入小牛血清和PHA,置于37℃、5%CO2的培养箱中培养72小时。
3. 加入秋水仙素:在培养72小时后,加入秋水仙素(终浓度为0.4μg/ml),继续培养4小时。
4. 收集细胞:用离心机以1000r/min离心5分钟,收集沉淀。
5. 低渗处理:向沉淀中加入KCl低渗液(0.075mol/L),使细胞膨胀,室温下放置10分钟。
6. 固定:将膨胀后的细胞用甲醇:醋酸(3:1)固定,室温下放置15分钟。
7. 洗涤:用蒸馏水冲洗细胞,去除固定液。
8. 制片:将细胞均匀涂布在载玻片上,自然干燥。
9. 染色:用Giemsa染料染色,室温下染色10-15分钟。
10. 洗涤:用蒸馏水冲洗载玻片,去除染料。
11. 干燥:将载玻片放在吹风机上吹干。
12. 观察与分析:用显微镜观察染色后的染色体标本,记录染色体形态、结构和数目。
染色体标本制作与观察实验报告

染色体标本制作与观察实验报告一、引言染色体是细胞核中的遗传信息携带体,它是由DNA和蛋白质组成的长丝状结构。
染色体的数目、形态和大小等特征在不同物种和个体中是有差异的。
本实验旨在通过染色体标本制作和观察,了解染色体的基本结构和分类。
二、实验材料1.新鲜的玉米幼苗2.醋酸3.高锰酸钾4.盐酸5.电镜滴管6.镜片和盖玻片7.显微镜8.实验室用具:手套、显微刀、移液器等三、实验步骤1.将新鲜的玉米幼苗准备好材料摆放在实验台上;2.取一片净玻片,滴加一滴醋酸,然后用电镜滴管吸取一点玉米根尖细胞悬浮液,滴在玻片上;3.将盖玻片慢慢压在悬浮液上,使悬浮液扩散均匀;4.把制作好的染色体标本放在带有千倍放大倍数的显微镜下观察。
四、实验结果将制作好的染色体标本放在显微镜下观察,可以清晰地观察到悬浮液中的染色体结构。
在玉米根尖细胞中,染色体呈为长条状丝状物,一般成双出现。
根据染色体的位置和大小可以将其分为四组,分别为A、B、C、D组。
五、实验分析根据观察结果可以得出以下结论:1.染色体是由DNA和蛋白质组成的长丝状结构;2.染色体的数目、形态和大小等特征在不同物种和个体中是有差异的;3.在玉米根尖细胞中,染色体大多数成对出现,有些物种的染色体可能会出现多倍体现象。
六、实验总结通过本实验,我们成功制作了染色体标本并观察到了染色体的基本结构和分类。
染色体是细胞核中的遗传信息携带体,对于了解生物遗传学、进化与变异等方面具有重要意义。
然而,本实验只观察了玉米根尖细胞中的染色体,染色体在不同组织和细胞中可能会有差异,需要进一步研究和探索。
同时,在制作染色体标本的过程中需要注意操作规范,以免对实验环境和个人健康造成危害。
以上是本次染色体标本制作与观察实验的实验报告,通过本实验,我们对染色体的结构和分类有了一定的了解,并为进一步的研究提供了基础。
实验过程中需注意操作规范,确保安全性和准确性的同时保证结果的可靠性。
实验五 人类染色体标本制备

实验五人类染色体标本制备【目的要求】1.熟悉人外周血淋巴细胞培养的原理。
2.初步掌握人类外周血淋巴细胞染色体标本的制备方法。
3.了解正常人非显带染色体核型特征及核型分析方法。
【实验原理】人类间期细胞核中的遗传物质染色质,在细胞进入分裂期时,经逐级螺旋形成染色体。
在分裂期的中期,染色体达到最大程度的凝集,表现为短而粗的典型结构。
人外周血的有形成分中,只有白细胞有核,而白细胞中只有淋巴细胞(主要是小淋巴细胞)具有潜在的细胞分裂能力。
培养液中加入有丝分裂刺激剂植物血凝素(PHA)可使处于G0期、具有潜在分裂能力的淋巴细胞转化为具有分裂能力的淋巴母细胞,并进入旺盛的有丝分裂周期;加入纺锤体抑制剂秋水仙素可使处于分裂过程的淋巴细胞停滞在分裂中期,在收获细胞时,用低渗剂0.075mol/L KCl对细胞进行低渗处理,可使胞膜胀破,染色体均匀分散;经离心、固定、制片等过程,最终可获得便于观察分析的染色体标本。
制备的染色体标本片,不经特殊处理,直接染色,在显微镜下观察识别,并进行核型分析的过程称为染色体非显带核型分析。
【实验用品】(一) 材料:人外周静脉血。
(二) 器材:吸管、刻度离心管、量筒、5ml注射器、6号针头、台式离心机、试管架、冷藏载玻片(一端磨砂)、铅笔、酒精灯、超净工作台、恒温水浴箱、载玻片、止血带、酒精棉球、显微镜、废液缸。
(三)试剂1. RPMI1640培养液(1) RPMI1640:RPMI1640固体培养基10.4 g,溶于1000 ml双蒸水中,抽滤除菌。
(2) RPMI1640培养液:每100 ml RPMI1640培养液中含RPMI 1640 80 ml、灭活的小牛血清20 ml、PHA 50 mg、青霉素(终浓度100 U/ml)、链霉素10000 μg (终浓度100 μg /ml),15磅、20min高压灭菌的NaHCO3调pH至7.2~7.4,分装20小瓶,每瓶5 ml。
(3) 配制方法配制过程所需的玻璃器具先用浅水洗刷干净,烘干,放入清洁液中浸泡2 d,取出后用自来水冲洗15次,蒸馏水冲洗3次,双蒸水冲洗1次,烤干后包装,15磅20 min高压灭菌。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验五人类染色体标本制备
【目的要求】
1.熟悉人外周血淋巴细胞培养的原理。
2.初步掌握人类外周血淋巴细胞染色体标本的制备方法。
3.了解正常人非显带染色体核型特征及核型分析方法。
【实验原理】
人类间期细胞核中的遗传物质染色质,在细胞进入分裂期时,经逐级螺旋形成染色体。
在分裂期的中期,染色体达到最大程度的凝集,表现为短而粗的典型结构。
人外周血的有形
成分中,只有白细胞有核,而白细胞中只有淋巴细胞(主要是小淋巴细胞)具有潜在的细胞分
裂能力。
培养液中加入有丝分裂刺激剂植物血凝素(PHA)可使处于G0期、具有潜在分裂能力的淋
巴细胞转化为具有分裂能力的淋巴母细胞,并进入旺盛的有丝分裂周期;加入纺锤体抑制剂
秋水仙素可使处于分裂过程的淋巴细胞停滞在分裂中期,在收获细胞时,用低渗剂0.075
mol/L KCl对细胞进行低渗处理,可使胞膜胀破,染色体均匀分散;经离心、固定、制片等
过程,最终可获得便于观察分析的染色体标本。
制备的染色体标本片,不经特殊处理,直接染色,在显微镜下观察识别,并进行核型分
析的过程称为染色体非显带核型分析。
【实验用品】
(一) 材料:人外周静脉血。
(二) 器材:吸管、刻度离心管、量筒、5ml注射器、6号针头、台式离心机、试管架、
冷藏载玻片(一端磨砂)、铅笔、酒精灯、超净工作台、恒温水浴箱、载玻片、止血带、酒
精棉球、显微镜、废液缸。
(三)试剂
1. RPMI1640培养液
(1) RPMI1640:RPMI1640固体培养基10.4 g,溶于1000 ml双蒸水中,抽滤除菌。
(2) RPMI1640培养液:每100 ml RPMI1640培养液中含RPMI 1640 80 ml、灭活的小牛血
清20 ml、PHA 50 mg、青霉素(终浓度100 U/ml)、链霉素10000 μg (终浓度100 μg /ml),
15磅、20min高压灭菌的NaHCO3调pH至7.2~7.4,分装20小瓶,每瓶5 ml。
(3) 配制方法
配制过程所需的玻璃器具先用浅水洗刷干净,烘干,放入清洁液中浸泡2 d,取出后用自来水冲洗15次,蒸馏水冲洗3次,双蒸水冲洗1次,烤干后包装,15磅20 min高压灭菌。
新瓶塞等橡胶类制品用水洗刷后,用0.5mol/L NaOH煮沸20min,自来水冲洗;用0.5mol/L HCl煮沸20 min,自来水冲洗,蒸馏水冲洗,在双蒸水中浸泡24h;浸泡后取出晾干,包装后高
压灭菌。
使用过的橡胶制品用肥皂液洗后,再用自来水,蒸馏水、双蒸水冲洗,晾干包装后高压灭菌。
无菌室用紫外灯消毒2 h。
进入无菌室前用肥皂彻底洗手,双手在新洁而灭溶液中浸泡20 min,然后穿隔离衣,戴口罩、帽子,进入无菌室操作时,再用75%酒精擦手。
在无菌室内,将RPMI l640粉剂10.4 g,溶于1000 ml双蒸水中,(RPMI1640粉剂较难溶,可用酒精灯微火稍加热,或通入CO2使pH降至6.0左右可溶解)。
液体呈透明状说明已完全溶解,倒入细菌滤器中过滤除菌。
在无菌室的超净工作台内,取适量已抽滤的RPMI1640加入成比例的灭活小牛血清、PHA、青霉素和链霉素,混匀,用经过15磅20 min高压灭菌的5% NaHCO3调至pH7.2,分装成每瓶5 ml,冰冻保存。
已除菌过滤、未分装的RPMI1640也需冷冻保存。
2.无菌肝素(500 U/ml):肝素注射液1支2 ml(含12500 U),加23 ml无菌生理盐水
混匀(或肝素粉剂,用时配成0.2%肝素液),经8磅15 min高压灭菌,置4℃冰箱保存备用。
3.其他试剂:0.01%秋水仙素、0.075 mol/L KCl低渗液、Carnoy固定液、10% Giemsa
染液。
【实验操作】
(一) 染色体标本制备
1.取材培养
(1) 采血:用无菌注射器吸取约0.2 ml肝素液,来回抽动针筒,使肝素湿润针筒,戴上
针头套;彻底消毒采血处皮肤,抽取静脉血约2 ml,戴上针头套,转动针筒,使肝素与血液
混匀,防止血液凝固(采血过程中严格执行无菌操作)。
在超净工作台内,去掉针头套,用无菌棉球擦除针头上的血迹;用酒精棉球消毒盛有5 ml
培养液的培养瓶瓶塞,并将瓶塞在酒精灯火焰上过一下;在酒精灯火焰旁,将采血的注射器
针头经培养瓶皮塞插入培养瓶中,每瓶接种血液约0.3 ml,轻轻摇匀。
(2) 培养:培养瓶置37℃恒温箱中培养,当培养至68 h,取出培养瓶,在超净工作台内,
用注射器(5号针头)向培养瓶中加入0.01%秋水仙素1滴,轻轻摇匀,放回37℃恒温箱继续培
养至72 h。
2.气干法制片
(1) 收集细胞:将培养瓶中的培养物用吸管移入刻度离心管内,离心8~10 min(1000
r/min),弃上清液,为防沉淀物中细胞丢失,可适当留点上清液。
(2) 低渗:向离心管中加6m1预温37℃的0.075 mol/L KCl低渗液,用吸管向离心管底部
充气,轻轻将细胞沉淀冲散打匀,离心管放入37℃水浴箱中低渗处理15 min。
(3) 预固定:低渗处理后,加Carnoy固定液约0.5~1 ml,用吸管轻轻冲打混匀,预固
定;然后离心8~10 min(1000 r/min),弃上清液。
预固定可防止细胞在固定时集聚成块。
(4) 固定:在沉淀物中加Carnoy固定液5 m1,用吸管将沉淀物轻轻冲打均匀,室温下静
置固定20 min,离心8~10 min(1000r/min),弃上清液。
固定有利于染色体在载玻片上展开,保持染色体结构完整;如固定不充分,则染色体形象模糊,染色体周围有胞浆背景。
为提高制片质量,此步操作可重复一次。
(5) 制备细胞悬液、制片:弃上清,留下0.5ml左右的固定液,打匀,用滴管滴在干净的载玻片上,空气干燥,Giemsa染色5~15min。
空气干燥已染好色的标本后可镜下观察。
