韭菜中吡虫啉和啶虫脒残留的微波处理逆固相分散法净化及液相色谱检测
固相萃取-液相色谱同时测定鲜烟叶中吡虫啉及啶虫脒的残留量

固相萃取-液相色谱同时测定鲜烟叶中吡虫啉及啶虫脒的残留量陈兴江;蔡凯;汪汉成;曹毅;孟见玉;商胜华【摘要】为同时检测鲜烟叶中啶虫脒及吡虫啉的残留量,提高烟叶农残检测效率,采用甲醇∶水(50∶50,V/V)超声提取烟叶样品,经过液液萃取和弗罗里硅土固相萃取净化后,用液相色谱-紫外检测器对2种农药同时进行检测.结果表明:该方法能同时检测到吡虫啉与啶虫脒的残留,检测限达到相关限量标准要求,方法操作简便,准确性和重复性均较好.【期刊名称】《贵州农业科学》【年(卷),期】2013(041)011【总页数】4页(P78-81)【关键词】吡虫啉;啶虫脒;共检测;液相色谱【作者】陈兴江;蔡凯;汪汉成;曹毅;孟见玉;商胜华【作者单位】贵州省烟草科学研究院,烟草行业烟草分子遗传重点实验室,贵州贵阳550081;贵州省烟草科学研究院,烟草行业烟草分子遗传重点实验室,贵州贵阳550081;贵州省烟草科学研究院,烟草行业烟草分子遗传重点实验室,贵州贵阳550081;贵州省烟草科学研究院,烟草行业烟草分子遗传重点实验室,贵州贵阳550081;贵州省烟草科学研究院,烟草行业烟草分子遗传重点实验室,贵州贵阳550081;贵州省烟草科学研究院,烟草行业烟草分子遗传重点实验室,贵州贵阳550081【正文语种】中文【中图分类】S481+.8新烟碱类杀虫剂是作为后突触烟碱乙酰胆碱受体(nAChRs)的激动剂,作用于昆虫中枢神经系统,具有高效、安全、高选择性等特点[1]。
常用来替代烟草中常用的传统杀虫剂拟除虫菊酯、有机磷及氨基甲酸酯类,主要用于防治刺吸式口器的烟草害虫,如烟蚜、烟草粉虱、烟草叶蝉、烟蓟马、烟盲蝽等[2-3]。
烟草作为一种吸食产品,其安全性越来越受到人们的关注,而农药残留是影响烟叶安全性的主要因素之一,新烟碱类杀虫剂虽然安全性高,但是其对人体的危害不容忽视,此外,近来欧盟由于担心新烟碱类农药对蜜蜂等授粉昆虫造成的潜在风险而有可能提高该类杀虫剂的残留标准或禁止其使用,尤其是噻虫胺、吡虫啉和噻虫嗪。
农药残留论文 蔬菜中吡虫啉农药残留检测方法的研究进展

蔬菜中吡虫啉农药残留检测方法的研究进展医药化工学院 化学工程与工艺专业 学生:朱健健 学号:0932210078摘要:吡虫啉是常用的烟碱类农药。
其检测方法有气相色谱法,液相色谱法,电化学法等等。
本文的主要是介绍蔬菜中吡虫啉农药残留检测的研究的新进展。
为新方法的建立提供技术保障。
关键词:农药残留 农药检测技术 吡虫啉1、引言果蔬中的农药残留是目前影响食品安全的主要因素之一,特别是中国加入WTO以来,由于果蔬中农药残留超出标准而影响产品出口的事件时有发生,这严重地阻碍了我国对外贸易的发展;另外,农药及其残留也会对人体产生毒害作用,严重危害国民健康。
化学农药在作物病虫害的综合防治中具有不可替代的作用。
但是,由于长期和大量地使用化学农药,致使一些性质较为稳定,对人畜具有积累性、慢性毒害的化学成分,在动植物体内,甚至在人体内不断积累。
烟碱类杀虫剂是目前不断涌现的一类新兴高效的杀虫剂,用于防治刺吸式口器害虫,应用于蔬、果、稻谷等作物。
2003年,烟碱类杀虫剂在世界农药市场的销售量超过了氨基甲酸酯类,上升到杀虫剂市场的第三并有逐年上升的趋势。
吡虫啉(Imidcaloprid)是烟碱类广谱杀虫剂的代表(结构如图1所示),其中吡虫啉的销售额位居所有杀虫剂的首位和所有农药的第二位(仅低于草甘膦)。
该类农药的残留问题越来越受到重视,如日本开始实施“肯定列表制度”,对蔬菜中上述两种农药的限量进行了严格规定并重点监控。
但目前对于这两种农药在蔬菜中残留量的近红外光谱检测方法未见研究和报道。
图 1 吡虫啉杀虫剂的结构2、国内吡虫啉研究进展:烟碱类杀虫剂是目前不断涌现的一类新兴高效的杀虫剂,用于防治刺吸式口器害虫,应用于蔬、果、稻谷等作物。
而吡虫啉是其中应用较多的一种,它的残留问题已经引起了许多科研人员的关注。
在黄瓜、甘蓝、毛豆、大蒜、金银花、苹果、茶叶等样品中的残留检测方法已有报道。
吡虫啉残留检测技术1、气相色谱法:固相萃取(SPE)-气相色谱( GC)-质谱联用(MS) 方法:通过联用,充分发挥色谱的分离、定量功能和质谱的定性功能。
固相萃取-液相色谱测定复杂基质蔬菜中9种烟碱类残留

固相萃取-液相色谱测定复杂基质蔬菜中9种烟碱类残留侯如燕;卞红正;赵秀霞;胡祎芳;苏婷;王孝辉;宛晓春【摘要】建立了韭菜、洋葱、大蒜等复杂基质蔬菜样品中呋虫胺、烯啶虫胺、氟啶虫酰胺、噻虫嗪、吡虫啉、噻虫胺、氯噻啉、啶虫脒、噻虫啉9种烟碱类农药残留的液相色谱检测方法.对比了几种常用溶剂的提取效率以及固相萃取材料对韭菜、洋葱样品中干扰基质的去除效果.研究结果表明,样品经微波处理后,用乙腈提取,Envi-Carb/PSA固相萃取柱净化,乙腈洗脱后,经反相高效液相色谱紫外检测器检测,在0.02~0.5 mg/kg加标水平下9种烟碱类农药的回收率为67%~110%,相对标准偏差均小于18.6%.所检测的3种蔬菜样品中除噻虫啉的定量下限为0.05 mg/kg外,其他8种农药的定量下限均不大于0.02 mg/kg.方法简便、快速,可满足复杂基质蔬菜中烟碱类农药多残留分析的要求.%A simple and sensitive high performance liquid chromatographic(HPLC) method was developed for the simultaneous determination of 9 nieotinoid insecticide residues, including dinotefuran,nitenpyram, flonicamid, thiamethoxam, imidacloprid, clothianidin, imidaclothiz, acetamiprid and thiacloprid, in sulphur-containing vegetables samples. The extract efficiencies of several solvent and the cleanup capacities of different SPE cartridges were compared. The vegetables were extracted with acetonitrile and cleaned up on an Envi - Carb/PSA cartridge. The nicotinoid insecticides were eluted with acetonitrile and detected with UV detector. The calibration curves showed good linearities in the range of 0.02 - 1.0 mg/L with correlative coefficient more than 0.999. The limits of quantitation (LOQ) were 0. 02 mg/kg for all 9 pesticide except for thiacloprid with LOQ of 0.05 rog/kg. The recoveriesof 9 pesticides from vegetable sample spiked at three concentration levels of 0.02 mg/kg,0.05 rog/kg and 0.5 mg/kg ranged from 67% to 110% with RSDs less than 18.6%. The established method was simple, sensitive and accurate, and was suitable for the routine detection of nicotinoid pesticides residues in vegetables.【期刊名称】《分析测试学报》【年(卷),期】2011(030)001【总页数】6页(P58-63)【关键词】烟碱类残留;杀虫剂;高效液相色谱;固相萃取;蔬菜【作者】侯如燕;卞红正;赵秀霞;胡祎芳;苏婷;王孝辉;宛晓春【作者单位】安徽农业大学,茶与食品科技学院,教育部、农业部茶叶生物化学与生物技术重点开放实验室,安徽,合肥,230036;农业部农产品质量安全监督检验测试中心(合肥),安徽,合肥,230031;安徽农业大学,茶与食品科技学院,教育部、农业部茶叶生物化学与生物技术重点开放实验室,安徽,合肥,230036;安徽农业大学,茶与食品科技学院,教育部、农业部茶叶生物化学与生物技术重点开放实验室,安徽,合肥,230036;安徽农业大学,茶与食品科技学院,教育部、农业部茶叶生物化学与生物技术重点开放实验室,安徽,合肥,230036;安徽农业大学,茶与食品科技学院,教育部、农业部茶叶生物化学与生物技术重点开放实验室,安徽,合肥,230036;农业部农产品质量安全监督检验测试中心,合肥(安徽),合肥,230031;安徽农业大学,茶与食品科技学院,教育部、农业部茶叶生物化学与生物技术重点开放实验室,安徽,合肥,230036【正文语种】中文【中图分类】O657.72;F767.2Abstract:A simple and sensitive high perfor mance liquid chromatographic(HPLC)method was developed for the simultaneous determination of 9 nicotinoid insecticide residues,including dinotefuran,nitenpyram,flonicamid,thiamethoxam,imidacloprid,clothianidin ,imidaclothiz,acetamiprid and thiacloprid,in sulphur-containing vegetables samples.The extract efficiencies of several solvent and the cleanup capacities of different SPE cartridgeswere compared.The vegetableswere extracted with acetonitrile and cleaned up on an Envi-Carb/PSA cartridge.The nicotinoid insecticideswere eluted with acetonitrile and detected with UV detector.The calibration curves showed good linearities in the range of 0.02-1.0 mg/L with correlative coefficient more than0.999.The limits of quantitation(LOQ)were 0.02 mg/kg for all 9 pesticide except for thiacloprid with LOQ of 0.05 mg/kg.The recoveries of 9 pesticides from vegetable sample spiked at three concentration levels of 0.02 mg/kg,0.05 mg/kg and 0.5 mg/kg ranged from 67%to 110%with RSDs less than 18.6%.The established method was simple,sensitive and accurate,and was suitable for the routine detection of nicotinoid pesticides residues in vegetables.Key words:nicotinoid residue;insecticide;HPLC;SPE;vegetable烟碱类农药是一类新型高效、低毒、内吸性强、残效期长、残留量低的广谱性杀虫剂,在市场上占有很高的份额[1-2]。
DB1301_T251-2017蔬菜和水果中多菌灵、吡虫啉啶虫脒除虫脲灭幼脲农药残留的测定液相色谱法

B 04DB1301 石家庄市地方标准DB 1301/T 251—2017蔬菜和水果中多菌灵、吡虫啉、啶虫脒、除虫脲、灭幼脲农药残留的测定液相色谱法前言本标准按照GB/T 1.1-2009给出的规则起草。
本标准由石家庄市农业局提出。
本标准起草单位:石家庄市农产品质量检测中心。
本标准起草人:王雪、郭海谦、孙聪、刘培、范晓鑫、邓一蕾、刘会灵、丁永冲、王琼。
蔬菜和水果中多菌灵、吡虫啉、啶虫脒、除虫脲、灭幼脲农药残留的测定液相色谱法1 范围本标准规定了用高效液相色谱测定蔬菜和水果中多菌灵、吡虫啉、啶虫脒、除虫脲、灭幼脲农药残留量的方法。
本标准适用于蔬菜、水果中多菌灵、吡虫啉、啶虫脒、除虫脲、灭幼脲残留量的测定。
本标准方法检出限为:多菌灵0.007 mg/kg、吡虫啉0.006 mg/kg、啶虫脒0.003 mg/kg、除虫脲0.01 mg/kg、灭幼脲0.01 mg/kg。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法GB/T 8855 新鲜水果和蔬菜的取样方法3 原理样品中多菌灵、吡虫啉、啶虫脒、除虫脲、灭幼脲用乙腈提取,经固相萃取净化,使用高效液相色谱仪紫外检测器(UV)检测,根据保留时间定性,外标法定量。
4 试剂和材料除非另有说明,在分析中仅使用确认的分析纯试剂和GB/T 6682 中规定的至少二级的水。
4.1 乙腈,分析纯。
4.2甲醇,色谱纯。
4.3二氯甲烷,色谱纯。
4.4 氯化钠。
4.5 多菌灵、吡虫啉、啶虫脒、除虫脲、灭幼脲标准品。
使用时根据各农药在对应检测器上的响应值,用甲醇(4.2)稀释成所需质量浓度的标准溶液。
4.6 农药混合标准溶液:根据各农药在检测器上的响应值,逐一吸取一定体积的单个农药标准溶液(4.5)分别注入同一容量瓶中,用50%的甲醇稀释至刻度配制成农药混合标准溶液。
蔬菜中吡虫啉残留检测研究

蔬菜中吡虫啉残留检测研究摘要:果蔬中的农药残留是目前影响食品安全的主要因素之一,特别是中国加入WTO以来,由于果蔬中农药残留超出标准而影响产品出口的事件时有发生,这严重地阻碍了我国对外贸易的发展;另外,农药及其残留也会对人体产生毒害作用,严重危害国民健康。
吡虫啉(imidacloprid)又称咪蚜胺、蚜虱净,是国内近年发展较快的一种新型硝基亚甲基类杀虫剂,主要通过选择性地抑制昆虫烟酸乙酰胆碱酯酶受体,阻断神经系统传导,造成死亡,具有内吸、触杀和胃毒作用,可用于种子和土壤处理及直接喷雾,广泛用于水稻、小麦、蔬菜、果树、棉花、烟草等多种作物上,对飞虱、粉虱、蚜虫等刺吸式口器害虫及其抗药性种群具有优异的防治效果,具有速效、高效、持效期长、使用成本低等特点。
吡虫啉对水稻、棉花、小麦等作物的前期病虫防治有极高的综合控制能力。
但是由于大量使用,某些地区烟粉虱、银叶粉虱、灰飞虱、桃蚜、烟蚜等害虫的田间种群已经对吡虫啉产生了不同程度的耐药性或抗药性,特别是大棚和大田蔬菜、瓜类、果树上白粉虱和蚜虫及棉蚜等害虫对吡虫啉产生抗性的风险较大。
因此使用吡虫啉防治这类害虫时,为了提高防治效果而加大使用剂量,从而容易造成其在农作物上的残留。
因此对蔬菜中吡虫啉残留检测的研究是十分有必要的,可以减少农作物上农药的残留以及减轻对人体的危害。
关键词:吡虫啉农药残留液相色谱检测正文:材料与试剂:蔬菜样品若干试剂:乙腈:色谱纯氢氧化钠:分析纯氯化钠:分析纯固相萃取柱(ENVI-18柱,3毫升,0.5克或相当者)有机滤膜:孔径0.45微米吡虫啉农药标准物质:纯度大于99% 25%乙腈:乙腈与水按1:3体积比混合农药标准溶液标准储备溶液:称取10毫克左右(精确到0.10毫克)标准品于10毫升容量瓶中,加乙腈超声溶解,配成1 000微克/毫升左右的标准储备液,-18℃冰箱保存。
混合标准溶液:使用时根据检测需要稀释成不同浓度的标准使用液,4℃冰箱保存。
固相萃取-气相色谱-质谱法测定韭菜中16种农药残留

固相萃取-气相色谱-质谱法测定韭菜中16种农药残留李莉;郑尊涛;孙大利;刘聪云;刘丰茂【期刊名称】《农药学学报》【年(卷),期】2011(13)5【摘要】建立了韭菜中16种农药的多残留分析方法。
韭菜样本经微波炉加热处理,乙腈提取,新型固相萃取柱Cleanert TPT净化,以气相色谱-质谱-选择离子监测模式测定。
结果表明:微波处理、固相萃取净化可以有效去除基质干扰,16种农药在0.02~2 mg/L范围内线性关系良好;在0.01和0.5 mg/kg两个添加水平下的平均回收率分别在84.6%~124.2%和92.4%~98.5%之间,相对标准偏差(RSD)均小于20%;16种农药的检出限(LOD)在1~6μg/kg范围内。
【总页数】5页(P509-513)【关键词】气相色谱-质谱法;韭菜;农药;多残留【作者】李莉;郑尊涛;孙大利;刘聪云;刘丰茂【作者单位】中国科学院动物研究所农业虫害鼠害综合治理国家重点实验室;农业部农药检定所;中国农业大学理学院【正文语种】中文【中图分类】O657.63【相关文献】1.微波辅助萃取-分散固相萃取-气相色谱质谱法测定茶叶中23种农药残留 [J], 颜鸿飞;李拥军;王美玲;戴华2.分散固相萃取-分散液液微萃取/气相色谱-串联质谱法测定蔬菜中19种有机磷农药残留 [J], 周蓉;曹赵云;赵肖华;林晓燕;牟仁祥3.分散固相萃取-分散液液微萃取结合气相色谱-三重四极杆质谱法测定茶叶中7种拟除虫菊酯类农药残留 [J], 孙梦园;石志红;李建勋;吴兴强;胡雪艳;张博伦;范春林4.加速溶剂萃取凝胶渗透色谱/固相萃取净化气相色谱质谱法测定咸鱼中有机磷农药残留 [J], 王耀;刘少彬;谢翠美;张汉霞;卢伟华5.加速溶剂萃取/凝胶渗透色谱-固相萃取净化/气相色谱-质谱法测定茶叶中残留的33种农药 [J], 胡贝贞;宋伟华;谢丽萍;邵铁锋因版权原因,仅展示原文概要,查看原文内容请购买。
分散固相萃取法联合高效液相色谱法测定水果蔬菜10_种农药残留效果分析

第58卷 第4期 广 东 蚕 业 V ol.58,No.04 2024年4月GUANGDONG CANYE Apr . 202444DOI :10.3969/j .issn .2095-1205.2024.04.14分散固相萃取法联合高效液相色谱法测定水果蔬菜10种农药残留效果分析王 静(扬州市农产品质量监督检测中心 江苏扬州 225000)摘 要 文章为分析水果、蔬菜农药残留检测中分散固相萃取法联合高效液相色谱法的应用价值,文章选择市售的水果和蔬菜,通过分散固相萃取法处理乙腈提取的样本,加入吸附剂将其中的杂质去除,将净化后的样本溶液通过高效液相色谱仪分离,使用外标法定量,检测其中的农药残留情况。
经检测,水果样本农药残留55.81%、超标1.16%,蔬菜样本农药残留31.68%、超标0.41%,超标率均较低;蔬菜中农药检出率前三位分别为百菌清、啶虫脒、苯醚甲环唑,超标农药为啶虫脒、克百威,超标率为0.41%、0.21%;水果中农药检出率前三位分别为吡唑醚菌酯、苯醚甲环唑、烯酰吗啉,超标农药为苯醚甲环唑,超标率为1.16%。
因此,市售水果、蔬菜中偶有农药超标问题,分散固相萃取法联合高效液相色谱法应用效果良好,能够为检测者提供精准数据参考,适用于农药残留检测。
关键词 分散固相萃取法;高效液相色谱法;水果;蔬菜;农药残留;食品安全 中图分类号:TS255.7文献标识码:B文章编号:2095-1205(2024)04-44-03我国始终将保障食品安全作为国家发展的重要课题。
在种植业发展过程中,使用农药、化肥等已成为减少病虫害、增加作物产量的重要策略之一。
但是若存在农药和化肥使用不合理、药品选择不当的问题,蔬菜、水果极易出现农药残留。
若残留量超标,会对人体、生态环境等造成极大负面影响,也易引发社会问题[1-2]。
对此,我国不断优化和推行与国情相符的食品安全法规,2021年3月,国家卫生健康委员会、农业农村部和国家市场监督管理总局联合发布修订后的《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2021),对水果、蔬菜等食品中的农药残留量予以了更明确的限定[3]。
固相萃取-高效液相色谱法同时测定果蔬中吡虫啉和多菌灵残留量

9月出版固相萃取-高效液相色谱法同时测定果蔬中吡虫啉和多菌灵残留量Simultaneous determination of imidacloprid andcarbendazim residues by SPE-HPLC杨宇霞*韩建欣李慧赵欣(山西省生物研究院有限公司,山西太原030006)YANG Yuxia*HAN Jianxin LI Hui ZHAO Xin(Shanxi biological research institute Co.,Ltd,Shanxi Taiyuan030006,China)摘要建立了固相萃取-高效液相色谱同时测定果蔬中吡虫啉和多菌灵含量的方法。
试样用乙腈提取,经Cleanert-NH2固相萃取小柱净化,流动相定容后,采用高效液相色谱法测定。
以甲醇-水(32∶68)为流动相,流速1.0mL/min,于270nm波长下检测。
结果表明,吡虫啉和多菌灵分别在0.02μg/mL~1.0μg/mL 和0.05μg/mL~5.0μg/mL范围内线性良好,相关系数均0.9999以上;回收率在85.1%~100.5%之间,相对标准偏差为1.6%~6.6%(n=6)。
该方法简便、高效,适用于果蔬中吡虫啉和多菌灵含量的同时测定。
关键词固相萃取;高效液相色谱法;吡虫啉;多菌灵Abstract A method for the simultaneous determination of imidacloprid and carbendazim in fruits and vegetables was developed by solid-phase extraction and high performance liquid chromatography(SPE-HPLC).The samples was extracted with acetonitrile and purified by a Cleanert-NH2solid-phase extraction(SPE)cartridge.The extract was analyzed by HPLC with methanol-water(32∶68)as the mobile phase.The flow rate of the mobile phase was1.0 mL/min and the detection wavelength was270nm.The results showed that imidacloprid and carbendazim had good linearity in the concentration ranges of0.02μg/mL~1.0μg/mL and0.05μg/mL~5.0μg/mL respectively,the correlation coefficient was above0.9999,the recovery was85.1%~100.5%,and the relative standard deviation was 1.6%~6.6%(n=6).The method is simple,efficient and suitable for the simultaneous determination of imidacloprid and carbendazim in fruits and vegetables.Keywords solid-phase extraction(SPE);high performance liquid chromatography(HPLC);imidacloprid;carbendazim中图分类号:TS255.7文献标识码:A文章编号:1673-6044(2020)03-0062-04DOI:10.3969/j.issn.1673-6044.2020.03.015FOOD ENGINEERING吡虫啉(Imidacloprid)又名海正吡虫啉,化学名称为1-(6-氯吡啶-3-吡啶基甲基)-N-硝基亚咪唑烷-2-基胺,属硝基亚甲基类内吸杀虫剂,主要用于防治刺吸式口器害虫及其抗性品系。
吡虫啉在韭菜中的残留和消解动态规律研究

吡虫啉在韭菜中的残留和消解动态规律研究
王蕾;周力
【期刊名称】《农药科学与管理》
【年(卷),期】2015(0)10
【摘要】采用液相色谱串联质谱法测定了吡虫啉在韭菜(露天)和韭菜(保护地)中的残留消解动态和最终残留量.本方法的回收率为90.6%~103.7%,相对标准偏差为1.7%~3.3%,样品的最小检出浓度为0.01mg/kg.结果表明:吡虫啉在韭菜上残留量随时间的变化均符合一级反应动力学方程:Ct=Co×e-kt.吡虫啉在韭菜上的半衰期分别为:11.5d(露天)和10.9d(保护地).所测得的韭菜样品中吡虫啉的最终残留量的最大值为0.34mg/kg(保护地)和0.19mg/kg(露天),均低于我国规定的吡虫啉在韭菜上的残留限量值1mg/kg.
【总页数】6页(P33-38)
【作者】王蕾;周力
【作者单位】山东省农药检定所,山东济南250100;山东省农药检定所,山东济南250100
【正文语种】中文
【中图分类】S482.3;S481+.8
【相关文献】
1.噻虫嗪及其代谢物噻虫胺在韭菜和土壤中的残留消解动态及残留量 [J], 冯义志;潘金菊;齐晓雪;刘伟
2.高效氯氰菊酯在韭菜中的残留消解动态及残留量 [J], 冯义志;潘金菊;周力;刘伟;吴亚玉
3.吡虫啉颗粒剂在甘蔗中的残留消解动态探究 [J], 彭思雅
4.海拔对四种叶类蔬菜中吡虫啉和啶虫脒的残留及消解动态的影响 [J], 代艳娜;潘虎;刘青海;蒲继锋;张一帆;白军平;杨晓凤
5.毒死蜱、吡虫啉、螺虫乙酯及其代谢物和苯醚甲环唑在梨中的残留消解动态 [J], 毛江胜;陈子雷;李慧冬;张文君;丁蕊艳;方丽萍;郭长英
因版权原因,仅展示原文概要,查看原文内容请购买。
高效液相色谱—串联质谱法测定韭菜中12种有机磷农药残留效果研究

高效液相色谱—串联质谱法测定韭菜中12种有机磷农药残留效果研究黄和勇;陈其煌【摘要】采用高效液相色谱—串联质谱法测定韭菜中12种有机磷农药多残留。
样品通过乙腈提取,Sep-pak Carbon NH2固相萃取柱净化,Venusil MP C18色谱柱分离,电喷雾正离子源(ESI+)扫描,多反应监测模式(MRM)测定。
结果表明:12种有机磷农药的检出限为0.02~0.60μg/kg,在10.0、20.0、50.0μg/kg 3个加标水平时,平均回收率为70%~95%。
%A HPLC-MS/MS method was established for the determination of 12 kinds of organophosphorus pesticides residues in leek .The samples was extracted byacetonitrile ,cleaned up with Sep-pak Carbon NH2 Solid phase extraction column ,the analytes was separated on Venusil MP Cls column, indentified under positive clcetrospray ionization (ESI+) ,multiple reaction monitoring (MRM)mode. The LOD of 12 kinds of organophosp- horus pesticides wasin 0.02-0.60 p,g,/kg, the recoveries at three spiked concentration levels of 10.0,20.0 and 50.0 p,g/kg ranged from 70% to 95%.【期刊名称】《现代农业科技》【年(卷),期】2012(000)018【总页数】3页(P295-296,298)【关键词】高效液相色谱—串联质谱;韭菜;有机磷;残留;测定【作者】黄和勇;陈其煌【作者单位】厦门市农产品质量安全检验测试中心,福建厦门361012;厦门市农产品质量安全检验测试中心,福建厦门361012【正文语种】中文【中图分类】O657.63;TS207.53近几年来,蔬菜农药残留事件屡见不鲜,各地的“毒韭菜”事件也频频发生,一度达到谈“韭”色变。
高效液相色谱法检测几种蔬菜中啶虫脒农药残留

高效液相色谱法检测几种蔬菜中啶虫脒农药残留作者:张静来源:《农家科技下旬刊》2019年第04期摘要:随着人们生活水平的提高,对日常的衣食住行的质量要求也越来越高,尤其是对于食物方面。
在食物的食用方面,蔬菜瓜果是最普遍的,但是,目前我国的蔬菜瓜果的种植还是主要依赖于农药使用,而人们一般比价排斥用农药种植的蔬菜,原因有二:一是农药种植口味差;二是农药种植的果实残留多。
基于此种现状,本文就用高效液相色谱法检测蔬菜中啶虫脒的农药残留问题进行简单阐述。
关键词:高效液相色谱法;检测;杀虫剂;农药残留一、高效液相色谱法基本原理及啶虫脒的性质1.高效液相色谱法。
高效液相色谱法是农药检测常用的检测方法之一,相比其他检测方法,它具有色谱较为灵敏、反应快速、分辨率高、重复性好的特点。
首先,顾名思义,该方法检测的就是液体相,两相之间是互不相容的,会出现一个明显的界面,当开始试验的时候,由于分离检测极性强,所以当溶质开始测试的时候会相互分配,当即将达到平衡的时候,就可以很明显的发现所测成分的各种表观性质。
下文主要是讲述该方法在农药中检测啶虫脒中的应用。
另外,高效液相色谱主要分类有:高效凝胶色谱、高效离子交换液相色谱、反相高效液相色谱、疏水性高效液相色谱、高效亲和液相色谱以及高效聚焦液相色谱等类型。
用不同类型的高效液相色谱分离或分析各种农作物农药的原理基本上与相对应的普通液相层析的原理是相似的。
2.啶虫脒。
啶虫脒属中等的毒性农药,原来是对害虫以胃毒和触杀,对植物内部组织渗透性强,所以耐雨水冲刷,残效期长,对于害虫的防止有良好效果。
目前,大部分的作用是用来果黄蚜的防止,屡试不爽。
主要使用方法是:根据虫害发生的密集期,当温度提高之后,然后进行喷洒,有良好的治疗和防止效果。
但是在使用的时候,要注意不要在桑园附近喷洒,气雾会对于桑园产生不利影响,在使用过程中,不要与碱性农药混用,这样会减小药效。
二、实验部分1.仪器、试剂和材料。
美国Waters液相色谱仪;德国eppendrf5810离心机;德国IKA匀浆机;涡旋混合器;美国N-EVAP112氮吹仪;电子天平;食品捣碎机。
吡虫啉在蔬菜中残留量高效液相色谱测定方法

fu dt ei h n eo 8 .7 t 0 .3 wi h lt esa d r e it n o v r t no 31 % t .5 . o n ob nter g f 66 % o1 03 % a t er ai tn add vai s f ai i f .9 o99 % ht e v o ao
Ke r s i d co r ;ei u ; x otdv g tbe H L y wo d : mia l i rs e e p r e ea l P C pd d e ;
吡虫啉是一种广谱、高效、低毒、内吸性强、
试剂除另有说 明外 ,均为分析纯。超纯水 ,乙
液相色谱纯) ,乙酸乙酯,石油醚,二氯甲烷 , 残效期长的杀虫剂,能有效 防治蔬菜上蚜虫、叶蝉、 腈 ( 蓟马等刺吸式口器害虫【。 l 近年来 , J 宁波市蔬菜生产 氯化钠 ( 0 2 1 " 烘烤4 h ,O S C 8 4( ) D 1 固相萃取小柱
3 54 ) l0 0 ( 农业部农产 品质量安全监督检验测试中心 ( 宁波) ,浙江宁波
摘要: 建立 了用 高效液相 色谱法测定 出口蔬菜中吡 虫 农药残留量的方法。 啉 试样用酸性 乙 腈提 取,C 8 1 柱净化 ,乙酸 乙酯洗脱,反相 高效液相 色谱。 紫外检测器测定,检测波长为 2 0n 7 m。方
v g tbesmpe se t ce y a i ctnt l,cen d u h o g 8 s l - h e e ta t n c lmn wi ty e ea l a lsi xr t b cd a o ii ad e r e la e p tru h a C1 oi p a xrci ou t eh l d s o h c tt, esd p a ihp roma c q i ho tga h t aUV ee trTh ee t v ln t s 0 a eae a drv re -h ehg efr n el udc rmao rp ywi d tco . ed tcinwa ee ghwa 7 n e s i h o 2
气相色谱-质谱法测定韭菜中5种农药前处理方法的比较

分析检测气相色谱-质谱法测定韭菜中5种农药前处理方法的比较赵阿璇,李雪雪,槐岁绒,杨香娟(咸阳市食品药品检验检测中心,陕西咸阳 712000)摘 要:本文对韭菜中5种农药(腐霉利、氟虫腈、毒死蜱、氯氰菊酯、氯氟氰菊酯)残留量进行了固相萃取和QuEChERS两种前处理方法比较。
结果表明,两种净化方法的5种农药在0.01~0.50 μg/mL范围内与目标物的响应值呈良好的线性关系,相关系数均大于0.9995,方法定量限均为0.01 mg/kg。
采用QuEChERS法前处理时,5种农药的平均回收率为83.0%~116.2%,RSD为0.8%~4.4%;采用SPE法前处理时,5种农药的平均回收率在80.0%~108.2%,RSD为0.8%~4.6%。
两种前处理方法均满足农药残留分析要求。
关键词:韭菜;气相色谱-质谱法;固相萃取;QuEChERS为提高农作物产量,防治病虫害,高毒性农药的使用量越来越多。
食品中特别是水果、蔬菜的农药污染通过食物链在人体积累,给人体健康带来危害,但由于农药残留对人体产生的生理变化不明显,往往被忽视[1]。
目前农药残留所采用的检测方法主要有气相色谱法、气相色谱-质谱联用法、液相色谱法、液相色谱-质谱联用法。
由于韭菜基质较为复杂,天然色素含量较高,有挥发性含硫组分,尤其冷冻后的韭菜较难通过微波加热消除巯基,因此使用上述方法检测农药残留时,经提取净化后方可上机[2]。
检测农药残留常用的净化方式有固相萃取、硫酸磺化、凝胶净化、QuEChERS等[3-4],本文利用固相萃取和QuEChERS两种净化方式对比了韭菜中腐霉利、氟虫腈、毒死蜱、氯氰菊酯和氯氟氰菊酯这5种农药的残留量,并进行了回收率、标准曲线、准确度、精密度等特性参数实验,为相关工作者提供选择。
1 材料与方法1.1 主要仪器气相色谱质谱联用仪,岛津GCMS-TQ8040NCI,EI电子轰击源;电子分析天平(梅特勒ME204);涡旋混合器(IKA VXR B S025);水浴恒温振荡器;高速离心机(湘仪);全自动浓缩仪(LabTech MV5);旋转蒸发仪(广东IKA R V-10)。
3种杀虫剂对韭菜迟眼蕈蚊的亚致死效应

3种杀虫剂对韭菜迟眼蕈蚊的亚致死效应史一荔;刘佰明;许静杨;徐维红;刘茹;胡霞;谷希树【摘要】利用胃毒-触杀法就呋虫胺、高效氯氰菊酯和噻虫嗪三种药剂对韭菜迟眼蕈蚊3龄幼虫进行了毒力测定,分析了3种药剂的LC30 (mg/kg).经LC30浓度药剂处理韭菜迟眼蕈蚊3龄幼虫48 h后,将存活个体无毒饲养,观察存活幼虫的化蛹率、雌雄蛹重、羽化率、雌雄比、单雌产卵量及卵孵化率.结果表明,3种药剂以呋虫胺的毒力最强,LC30值为9.02 mg/kg,噻虫嗪(15.24 mg/kg)次之,高效氯氰菊酯(16.28 mg/kg)毒力最小.3种药剂均不同程度地抑制了韭菜迟眼蕈蚊的个体发育或繁殖,高效氯氰菊酯抑制幼虫的个体发育,呋虫胺则显著降低子代卵的孵化率,噻虫嗪显著降低单雌产卵量.%In this study,we tested the toxicities of dinotefuran,beta-cypermethrin and thiamethoxam on 3-instar larvae of Bradysia odoriphaga by stomach-contact method,and analyzed the LC30 (mg/kg) of three pesticides.After treated with LC30 concentration of pesticides for 48 hours,the surviving 3-instar larvae of Bradysia odoriphaga were raised in non-toxic petri dish,and the pupation rate,weight of male and female pupal,eclosion rate,ratio of female to male,egg number per female and egg hatching rate were observed.The results showed that dinotefuran had the highest toxicity in the three pesticides,with the LC30 value as 9.02 mg/kg,followed by thiamethoxam (15.24 mg/kg) and beta-cypermethrin(16.28 mg/kg).The three pesticides inhibited the development and propagation of Bradysia odoriphaga in different degrees.Beta-cypermethrin inhibited the growth of larvae,dinotefuran reduced the egghatching rate of filial generation,and thiamethoxam decreased the egg number per female obviously.【期刊名称】《山东农业科学》【年(卷),期】2018(050)001【总页数】4页(P118-121)【关键词】韭菜迟眼蕈蚊;生长发育;杀虫剂;亚致死效应【作者】史一荔;刘佰明;许静杨;徐维红;刘茹;胡霞;谷希树【作者单位】天津师范大学生命科学学院,天津300387;天津市植物保护研究所,天津300384;天津市植物保护研究所,天津300384;天津市植物保护研究所,天津300384;天津市植物保护研究所,天津300384;天津师范大学生命科学学院,天津300387;天津市植物保护研究所,天津300384;天津市植物保护研究所,天津300384【正文语种】中文【中图分类】S436.33韭菜迟眼蕈蚊Bradysia odoriphaga Yang et Zhang,属双翅目眼蕈蚊科迟眼蕈蚊属,是一种为害韭菜、大蒜、葱等多种百合科蔬菜嫩茎及根部,同时可取食百合科、菊科、黎科、十字花科、葫芦科、伞形花科多种蔬菜农作物的重要害虫[1,2]。
高效液相色谱法检测蔬菜中吡虫啉残留试验分析

高效液相色谱法检测蔬菜中吡虫啉残留试验分析作者:***来源:《新农业》2021年第03期摘要:本文以蔬菜作为主要研究对象,对蔬菜中的吡虫啉残留情况进行针对性的检测。
从检测结果中可以看出,高效液相色谱法可以在短时间内快速完成检测,并有效保证检测结果的准确性,对蔬菜中的吡虫啉残留测定非常适合。
关键词:蔬菜;高效液相色谱法;吡虫啉;残留吡虫啉是国外经多年研究创造出的烟碱类杀虫剂,已经在世界范围内得到广泛的应用,销量位居同类型杀虫剂首位。
其在杀虫过程中会对乙酰胆碱体产生一定的作用,对昆虫神经系统产生干扰,使昆虫受到强烈的刺激,堵塞神经通路,最终死亡。
吡虫啉具有高效、毒性小的多重特点,可以在果蔬、谷类等作物中广泛应用,也可用来防治害虫。
1 材料与方法1.1 仪器设备、试剂和样品选择安捷伦1260型高效液相色谱仪(配备紫外检测器),准备乙腈、二氯甲烷和甲醇等试剂,另准备好吡虫啉标准品。
由同一农贸市场采购西红柿、菜豆和结球甘蓝3种蔬菜作为样品。
1.2 试验步骤1.2.1 提取使用食品粉碎机粉碎蔬菜样品,用天平称量出试验所需的试样25克,统一放置于250毫升烧杯中,再加入50毫升乙腈,使用高速均浆机进行120秒的匀浆,并将其过滤,放到具塞量筒中,加入4克氯化钠,进行50秒的剧烈振荡后,保持30分钟的静止,将乙腈吸取出10毫升,并放到烧杯中,使用氮气吹干乙腈,配制好甲醇和二氯甲烷混合溶液,使提取物可以被充分溶解。
1.2.2 净化取supel cleaLC-NH2小柱,对甲醇和二氯甲烷按一定比例配制,先預淋洗supelcleaLC-NH2小柱,再将上述提取液加入柱中,并做两次洗脱,收集洗脱液。
将洗脱液收集在定容离心管中,再使用氮吹仪吹干此离心管,取2毫升甲醇溶液加入已吹干的定容离心管中,使用滤膜过滤,为液相色谱分析创造良好的条件。
1.2.3 液相色谱条件色谱柱:Waters symmetry shieldTMC 18(4.6×250毫米,5微米),温度控制在30℃左右,检测波长275纳米;流动相CH3OH∶H2O∶CH3CN=55∶25 ∶20;流速每分钟0.8毫升;进样量10.0微升。
使用高效液相色谱法检测蔬果中啶虫脒等5 种农药残留

64 食品安全导刊 2019年11月Tlogy科技分析与检测1 材料与方法1.1 仪器与设备在本次研究中,使用LC-20A 高效液相色谱仪(紫外检测器,LCsolution 色谱工作站,日本岛津公司);HY-5回旋式振荡器(金坛市鸿科仪器厂);TG16-WS 台式高速离心机(长沙湘仪离心机仪器有限公司);RE-52CS 旋转蒸发仪(上海亚荣生化仪器厂);AL204电子天平(梅特勒-托利多仪器(上海)有限公司);0.22μm 微孔滤膜(天津市津腾实验设备有限公司);Milli-Q direct8超纯水机(密理博公司)。
1.2 材料与试剂本次研究所使用果蔬的样品均在本地的农贸市场采购,进行粉碎后备用。
所使用的农药啶虫脒、嘧霉胺、氟虫腈、辛硫磷和哒螨灵标准物质(浓度为1 000μg/mL,青岛捷世康生物科技有限公司);甲醇、乙腈(色谱纯,MREDA 公司);二氯甲烷(色谱纯,MERCK 公司;氯化钠(分析纯,南京化学试剂股份有限公司);NH 2小柱(500 mg/6 mL,上海安谱实验科技股份有限公司);在本次的实验过程中所使用的水都是超纯水[1]。
1.3 试验方法1.3.1 制备标准溶液100 μg/mL 农药标准储备液:取1 000 μg/mL 农药标准溶液各1 mL,放在10 mL 刻度管中,使用甲醇稀释到刻度,再对其进行摇匀。
1 μg/mL 的农药标准工作液:把0.1 mL 标准储备液移入10 mL 的刻度管中,使用甲醇将其稀释到刻度,再对其进行摇匀。
标准工作液:根据要求使用甲醇-水(1∶1,V ∶V)稀释到合理的浓度。
1.3.2 对样品进行预处理称取10 g 已经粉碎好的蔬果样品,放在50 mL 的离心管里,再加入20 mL 的乙腈,在恒温摇床上振荡30 min 后,再放入10 g 的氯化钠,盖上盖子,使用恒温摇床振荡1 min,以4 000r/min 的速度离心5 min,取上清液10 mL 放入50 mL 的梨形瓶里,在40 ℃下旋转蒸干。
液相色谱- 串联质谱法测定蔬菜中的吡虫啉、啶虫脒、茚虫威和氯虫苯甲酰胺
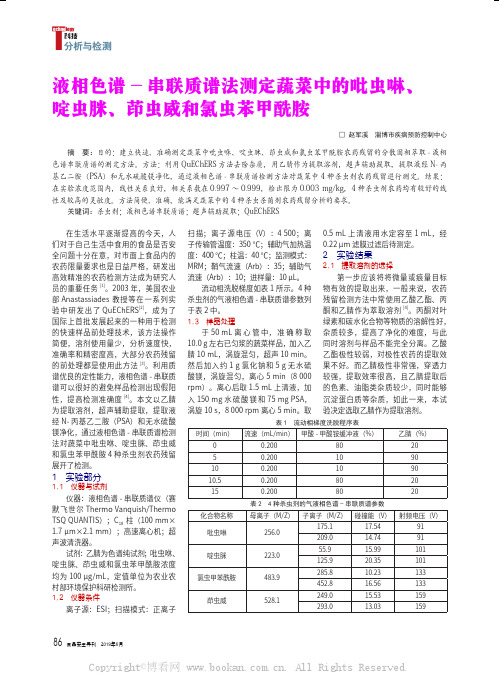
本 文 以 乙 腈 为 提 取 溶 剂,, 超 声 辅 助 提 取, 提 取 液 经 N- 丙 基 乙 二 胺 (PSA)和无水硫酸镁净化,通过液相
表 3 4 种杀虫剂的标准曲线方程及检出限
化合物
浓度范围 (ng/mL)
标准曲线方程 Y=A+B×X
0.5 mL 上 清 液 用 水 定 容 至 1 mL, 经 0.22 μm 滤膜过滤后待测定。
2 实验结果
2.1 提取溶剂的选择
第一步应该将将微量或痕量目标 物有效的提取出来,一般来说,农药 残留检测方法中常使用乙酸乙酯、丙 酮和乙腈作为萃取溶剂 [4]。丙酮对叶 绿素和碳水化合物等物质的溶解性好, 杂质较多,提高了净化的难度,与此 同时溶剂与样品不能完全分离。乙酸 乙酯极性较弱,对极性农药的提取效 果不好。而乙腈极性非常强,穿透力 较强,提取效率很高,且乙腈提取后 的色素、油脂类杂质较少,同时能够 沉淀蛋白质等杂质,如此一来,本试 验决定选取乙腈作为提取溶剂。
吡虫啉
256.0
175.1
17.54
91
209.0
14.74
91
啶虫脒
223.0
55.9
15.99
101
125.9
20.35
101
氯虫甲苯酰胺
483.9
285.8
10.23
133
452.8
16.56
133
茚虫威
528.1
249.0
15.53
159
293.0
13.03
159
86 食品安全导刊 2019年6月 Copyright©博看网 . All Rights Reserved.
1 实验部分
韭菜中吡虫啉和啶虫脒残留的微波处理-逆固相分散法净化及液相色谱检测

韭菜中吡虫啉和啶虫脒残留的微波处理-逆固相分散法净化及液相色谱检测陈黎;王金芳;杜鹏;唐小革;赵坤霞;潘灿平【期刊名称】《分析化学》【年(卷),期】2008(36)10【摘要】建立了韭菜中两种烟碱类农药吡虫啉和啶虫脒残留的快速检测方法.韭菜样本用微波炉加热处理,使酶钝化消除含硫基质干扰,然后用乙腈提取、逆固相分散净化,用反相高效液相色谱-二极管阵列检测器检测.在0.05~2.0 mg/kg添加水平范围内,吡虫啉的平均添加回收率在95.2%~105.3%之间;相对标准偏差在0.8%~7.8%之间;啶虫脒的平均添加回收率在97.4%~108.8%之间;相对标准偏差在1.3%~8.3%之间.本方法对吡虫啉的检出限(LOD)为0.0078 mg/kg,定量检出限(LOQ)为0.026 mg/kg;对啶虫脒的检出限为0.0075 mg/kg,定量检出限为0.025 mg/kg.【总页数】5页(P1364-1368)【作者】陈黎;王金芳;杜鹏;唐小革;赵坤霞;潘灿平【作者单位】中国农业大学理学院,北京,100094;中国农业大学理学院,北京,100094;中国农业大学理学院,北京,100094;农业部农产品质量监督检验测试中心(北京);农业部农产品质量监督检验测试中心(北京);中国农业大学理学院,北京,100094【正文语种】中文【中图分类】O6【相关文献】1.TurboFlow在线净化/液相色谱-串联质谱法测定水果蔬菜中多菌灵、吡虫啉、啶虫脒与甲基硫菌灵的残留量 [J], 张海超;艾连峰;郭春海;张婧雯;葛世辉;窦彩云;刘慧玲2.固相萃取液相色谱法检测大蒜中吡虫啉的残留量及市场调查 [J], 项丽;唐建设3.固相萃取液相色谱法检测大蒜中吡虫啉的残留量及市场调查 [J], 项丽;唐建设4.通过固相萃取净化/高效液相色谱-串联质谱法测定华南黄瓜和华北黄瓜中的烯酰吗啉与啶虫脒残留 [J], 马艺荞; 王禄禄; 王剑锋; 谭克; 李彦军; 姜奇峰5.基质固相分散-高效液相色谱法测定小麦籽粒中吡虫啉和啶虫脒残留 [J], 庞民好;康占海;陶晡;刘颖超因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
韭菜中吡虫啉和啶虫脒残留的微波处理逆固相分散法净化及液相色谱检测作者:作者:陈黎王金芳杜鹏唐小革赵坤霞潘灿平 作者单位:(中国农业大学理学院,北京100094)来源:医学期刊/ 基础医学与生物医学工程【摘要】建立了韭菜中两种烟碱类农药吡虫啉和啶虫脒残留的快速检测方法。
韭菜样本用微波炉加热处理,使酶钝化消除含硫基质干扰,然后用乙腈提取、逆固相分散净化,用反相高效液相色谱 二极管阵列检测器检测。
在0.05~2.0 mg/kg添加水平范围内,吡虫啉的平均添加回收率在95.2%~105.3%之间;相对标准偏差在0.8%~7.8%之间;啶虫脒的平均添加回收率在97.4%~108.8%之间;相对标准偏差在1.3%~8.3%之间。
本方法对吡虫啉的检出限(LOD)为0.0078 mg/kg,定量检出限(LOQ)为0.026 mg/kg;对啶虫脒的检出限为0.0075 mg/kg,定量检出限为0.025 mg/kg。
【关键词】韭菜,烟碱类农药,微波处理,逆固相分散,高效液相色谱Determination of Imidacloprid and Acetamiprid in Leek by Reversed Phase High Performance Liquid Chromatography with Microwave Treatment and Convenient Reverse Solid Phase Dispersion Clean upCHEN Li, WANG Jin Fang, DU Peng, TANG Xiao Ge, ZHAO Kun Xia, PAN Can Ping1(College of Sciences, China Agricultural University, Beijing 100094)2(Quality Supervision, Inspection and Analysis Center of Agro products, Ministry of Agriculture, Beijing 100083)Abstract A rapid method has been developed for the determination of two neonicotinoid insecticide residues including imidacloprid and acetamiprid in leek. The samples of leek were treated with microwave to make the enzyme inactive and to eliminate the matrix interferences. Then the pretreated samples were extracted with acetonitrile, further cleaned up by reverse solid phase dispersion, and analyzed by reversed phase HPLC with diode array detector (DAD). Average recoveries of imidacloprid and acetamiprid were found in the range of 95.2%-105.3% and 97.4%-108.8% at three spiking levels from 0.05 mg/kg to 2.0 mg/kg with relative standard deviations of 0.8%-7.8% and 1.3%-8.3%, respectively. Limit of detections of imidacloprid and acetamiprid were 0.0078 mg/kg and 0.0075 mg/kg, while limit of quantifications were 0.026 mg/kg and 0.025 mg/kg, respectively.Keywords Leek, neonicotinoid insecticide, microwave treatment, reverse solid phase dispersion, reversed phase high performance liquid chromatography本文系国家十一五科技攻关项目(No.2006BAK02A04)和北京市科技新星计划(No.2005A59)资助项目* E mail: canpingp@1 引言韭菜为百合科葱属多年生草本植物。
韭菜中含有蛋白质、脂肪、碳水化合物、粗纤维、钙、磷、胡萝卜素、硫胺素、核黄素、抗坏血酸等营养成分,并且有消炎杀菌作用,所含丰富的纤维素,可增进胃肠消化功能,韭菜中的挥发性精油及含硫化合物具有降低血脂的作用,对治疗冠心病及高血压也有一定的疗效[1],是我国重要的出口创汇蔬菜品种之一。
然而,韭菜易生韭蛆,严重影响韭菜的产量和质量。
目前主要采用化学农药灌根防治韭蛆,一些菜农甚至使用禁用剧毒农药对其进行防治,造成韭菜的农药残留量严重超标。
为对韭蛆进行无公害防治,一批高效、低毒、对生态环境和非靶标生物安全的新型农药逐渐受到青睐。
烟碱类农药是一类新型高效、低毒、内吸性强、残效期长、残留量低的广谱性杀虫剂,因其高效、对人类、哺乳动物及环境安全,在市场上占有很高的份额,年销售额达到60亿欧元。
烟碱类农药包括吡虫啉、啶虫脒、烯啶虫胺、噻虫啉、噻虫嗪、噻虫胺及呋虫胺,其中吡虫啉是世界上销售量最大的杀虫剂品种[2,3]。
吡虫啉、啶虫脒均是通过引入2 氯 5 吡啶甲基杂环结构构建的,其作用机理是作用于神经结合部后膜,通过与胆碱受体结合使昆虫异常兴奋,全身痉挛、麻痹而死,具有触杀、胃毒、渗透和内吸等杀虫活性,可广泛用于水稻、棉花、蔬菜、水果等多种作物的害虫防治。
日本“食品中残留农业化学品肯定列表制度”规定吡虫啉和啶虫脒在韭菜上的最大残留限量均为5 mg/kg,其它国家尚未制定吡虫啉、啶虫脒在韭菜上的最大残留限量。
有关吡虫啉、啶虫脒在的残留分析方法,国内外已有报道,分析方法普遍存在样品前处理烦琐,费用高,使用有机溶剂量较多或基体本身的复杂性影响分析的准确度等不足。
Gupta[2]和Baskaran[3]等用高效液相色谱(HPLC)检测了茶叶、水和土壤中的吡虫啉残留量,样本的提取净化使用了液 液分配和固相萃取(SPE);平立凤等[4]比较了多种从土壤中提取吡虫啉的方法。
文献[5~7]用SPE和液相色谱质谱联用(HPLC/MS)的方法检测了饮用水、蜂蜜、水果和蔬菜(杏、桃、梨、芹菜、小胡瓜)中的4种烟碱类农药残留。
在现有的相关报道中,前处理方法均需固相萃取柱净化(主要有C18固相萃取小柱、Al2O3层析柱、硅胶柱、Florisil和活性炭混合层析柱),且基质样本较为简单[8~12]。
目前,国内外对于吡虫啉、啶虫脒在样品基质较为复杂的韭菜中的农药残留分析方法尚未见报道。
含辛辣气味的韭菜、葱、蒜、洋葱等是一类较特殊的蔬菜,含有硫化物,硫化物的干扰很难去除,且有很强的响应,严重干扰农药残留测定结果,是检测韭菜中农药残留的主要障碍。
最近有报道用微波处理法检测含硫蔬菜中的有机磷、有机氯和拟除虫菊酯类农药残留能有效地去除基质干扰,但其前处理用ENVI CARB/ LC NH2、PSA或Florisil固相萃取柱净化,GC ECD、GC FPD检测,操作繁琐,费用高,不利于推广[13,14]。
本研究旨在建立一套前处理简便、快捷,既能有效消除韭菜中硫化物干扰,又具有较好灵敏度、准确度和精密度的残留分析方法,为科学控制农药使用、无公害生产韭菜、提供科学依据。
2 实验部分2.1 仪器与试剂1100高效液相色谱仪,由四元低压泵、柱温箱、二级管阵列检测器(DAD)、自动进样器及Agilent色谱工作站组成(美国Agilent Technologies公司);Venusil MP C18色谱柱(250 mm×4.6 mm×5 μm);SartoriusBP211D型电子天平(十万分之一,德国);SartoriusBS223S型电子天平(北京赛多利斯仪器系统有限公司);3K15型离心机(德国Sigma公司);Anke TDL 40B型离心机(上海安亭科学仪器厂);QL 901涡旋振荡仪(海门市其林贝尔仪器公司);MILLI Q 超纯水机(Millipore公司),GalanzWP800P23 K1型微波炉。
乙腈(色谱纯,Fish Scientific,Fisher ChemAlert Guide);无水MgSO4、NaCl(分析纯,北京化学试剂公司);PSA(初级次级胺,Agela Technologies Inc.);吡虫啉(99.8%)、啶虫脒(96.9%)(农业部农药检定所);混合标准溶液(两种农药用乙腈配成标准储备液,并稀释成标准工作溶液)。
超纯水。
2.2 样品前处理方法将韭菜切成2 cm的段,称取10 g于50 mL离心管中,置于微波炉中以800 W微波处理90 s。
再将韭菜捣碎,加入10 mL乙腈,以最大速度涡旋振荡1 min,加入4 g无水MgSO4、1 g NaCl,涡旋振荡1 min,以3800 r/min离心5 min。
取1 mL上清液,加入75 mg PSA、250 mg无水MgSO4,涡旋振荡1 min,以6000 r/min离心2 min。
上清液过0.45 μm有机系滤膜于自动进样瓶中,待测。
2.3 色谱条件流动相为V(乙腈)∶V(水)=30∶70;流速:1 mL/min;柱温:25 ℃;检测波长:吡虫啉和啶虫脒分别采用各自最大的紫外吸收波长270和245 nm检测,进样量10μL。
2.4 添加回收将韭菜切成2 cm的段,称取10 g于50 mL离心管中,分别取0.5、5和20 mg/L混合标准溶液1 mL于10 g样本中,放置30 min,然后按照2.2中所述步骤进行处理,分别相当于0.05、0.5和2.0 mg/kg的添加水平。
待仪器稳定后,进0.02、0.05、0.1、0.2、0.5、2.0和5.0 mg/L的混合标准溶液及韭菜添加样本,分别作出吡虫啉、啶虫脒的标准工作曲线。
韭菜添加样本以保留时间对添加农药定性,标准工作曲线法定量。
3 结果与讨论3.1 微波的作用及原理葱蒜类蔬菜作物中含有一类含硫化合物——蒜素,以及相关的一些含硫次生代谢物。
蒜素是在蒜氨酸酶的作用下形成的,其反应底物是葱蒜类作物中的蒜氨酸类物质。
