[精品]细菌生长曲线的测定
细菌生长曲线的测定的实验步骤
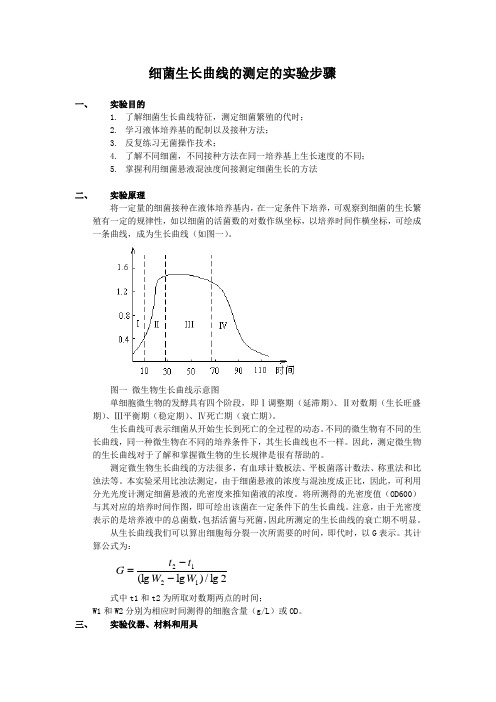
细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
微生物实验报告:测定细菌生长曲线

测定细菌生长曲线一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时;2.学习液体培养基的配制以及接种方法;3.反复练习无菌操作技术;4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5.掌握利用细菌悬液混浊度间接测定细菌生长的方法;二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为:G=(t2-t1)/[(lgW1-lgW2)/lg2]式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。
三、实验器材大肠杆菌,枯草杆菌菌液及平板;培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计;四、实验步骤1.活化菌种将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种6人大组分为3个小组,按表1接种。
细菌生长曲线之测定

實驗六細菌生長曲線之測定◎ Exp 11. Turbidity of bacteria一、目的:在進行細菌生長曲線之測定前,必須先了解 U-2001 Spectropho-tometer 操作方法,才能將細菌的數量以吸光值的方式表示出來。
二、原理:請詳讀整理 p. 90-92,學會調整 Optical density (O.D.) 【Exp 13.會用到】。
三、器材:1. culture:(每組)24 hr Escherichia coli (broth)2. medium: (每組)Nutrient broth3. equipment :1 ml pipette,pipette aid,cuvette,拭鏡紙,廢菌液杯,裝蒸餾水的洗瓶,滅菌空試管,U-2001 Spectrophotometer,振盪器。
四、實驗步驟※由助教先示範操作方法,再由學生自行操作與測量待測液之吸光值。
1. 了解 U-2001 Spectrophotometer 操作方法:a. 溫機約 15 分鐘。
b. MENU → (主目錄) 選 1. Photometer →輸入波長 600 nm 及 ABS →Forward →c. Nutrient broth 歸零 autozero → (前、後二支 cuvette) ※1d. 取出後面之 cuvette ,倒入待測液※2,等到右上方數據穩定後,按下 Start →記錄。
※1 cuvette 有石英管 (測波長 340 nm 以下)、玻璃管、塑膠管等材質,本實驗使用塑膠材質之比色管。
※2 每次測定前需先用蒸餾水滴洗cuvette,再以待測液潤濕,倒掉,再裝入待測液,測完倒掉,用蒸餾水滴洗。
測定之前cuvette 須用拭鏡紙擦乾,手握管的非透明處;廢菌液請滴洗入廢菌液杯中,集中處理) 。
2. 每組取一管助教所準備之E. coli當待測液,實際演練U-2001Spectrophotometer 操作,測出其原液 O.D. 【Exp 13. 將會利用到此操作,故須熟悉其操作步驟】。
细菌生长曲线的测定实验报告

竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告篇一:细菌生长曲线实验九测定细菌生长曲线[实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1.实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。
2.实验仪器取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml 玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
测定细菌生长曲线(整理版)
一原理:
将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
二实验仪器、材料和用具
2.1种子液制备
取菌斜面菌种各1支,以无菌操作挑取1环菌苔,接入LB培养液中,静止培养18h作种子培养液。
2.2接种培养
用1mL无菌吸管分别准确吸取1mL种子液加入已编号的N个三角瓶中,于37℃下振荡培养。
2.3 生长量测定
以蒸馏水作为参比,开始培养前测定每组培养液的OD600值作为起始点。
开始培养后,每小时吸取测定一次OD600值。
(注:对浓度大的菌悬液用未接种的液体培养基适当稀释后测定,使其OD600值在0.10~0.65以内,经稀释后测得的OD600值要乘以稀释倍数,才是培养液实际的OD600值。
)
三结果
将测定的OD值填入下表:。
生长曲线测定方法

生长曲线测定方法
二、间接法:与微生物生长量平行的生理指标很多,可以根据实验目的和条件适当选用。
如测含氮量(一般霉菌的含氮量为其干重的6.5%,含氮量乘以6.25为粗蛋白含量),还有如测含碳量以及测磷、DNA、RNA、ATP、DAP、几丁质或N-乙酰胞壁酸等含量等。
具体测定时你还要得查点相关资料。
请问各位大侠放线菌生长曲线改怎么测呢?谢谢!
三角瓶摇床生长发酵,加入足量的玻璃珠不让菌体长成团状,使菌体均匀分布在液体培养基中!然后每隔一定时间取样分析。
用分光光度计测定OD值即可。
如果菌体浓度过大可先稀释后在测OD值!波长大概在600nm左右!
一般情况下,形成菌丝的微生物的生长曲线,是取培养液离心收集沉淀(工业上通常3000~4000rpm,10min),测沉淀占总体积的百分比,也有称量菌丝体干重的。
楼上的说的方法不能符合发酵过程的真实情况。
另外不同的菌测定OD使用的波长不同。
大肠杆菌是600nm。
使用波长的选择应该跟菌的大小及形态有关。
这方面有一篇文献,大家感兴趣的话可以查询一下。
其实放线菌要看哪些属了,有些属容易产生菌丝,而有些属不产生菌丝球。
本人在做课题的时候就筛选得到一株放线菌,属于北里孢菌属,在摇瓶发酵和发酵罐中发酵时,就没有菌丝球的产生,所以我在实验时就采用测量OD660的方法来测定生长情况的。
但我也做过链霉菌菌的发酵,链霉菌很容易产生菌丝球,我所采用的是称干重法做的。
所以我觉得楼主应该根据实际情况来具体确定你的实验应该采用哪种测量方法了。
细菌增殖曲线的测定

实验3 细菌增殖曲线的测定一.实验目的:通过细菌数量的测量了解大肠杆菌的生物特征和规律,绘制生长曲线图二.实验原理大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次。
将一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期、对数期、稳定期和衰亡期四个阶段。
以培养时间为横坐标,以细菌数目的对数或生长速率为纵坐标作图所绘制的曲线称为该细菌的生长曲线。
不同的细菌在相同的培养条件下其生长曲线不同,同样的细菌在不同的培养条件下所绘制的生长曲线也不相同。
测定细菌的生长曲线,了解其生长繁殖规律,这对人们根据不同的需要,有效地利用和控制细菌的生长具有重要意义。
三.菌种与培养基菌种:大肠杆菌培养基:牛肉膏蛋白胨培养基四.仪器光电比色计,摇床,冰箱五.操作步骤1、将在种子培养基中培养20 h的培养液3000rpm离心10min倾去上层液,加入无菌的生理盐水,成均匀液,细胞数系109/m1。
2.取盛发酵培养液的三角瓶,各接10%菌液作种子,在摇床上相同位置34℃振荡培养,之后于培养1h、2h、3h、4h、5h、6h、7h、8h、10h、24h各取1ml的菌液。
3.用蒸馏水为空白对照,将上述菌液于波长600nm处比色,但要求消光度在0.2~0.8之间,若超过,用未接种培养液适当稀释。
六.实验结果:1.结果(1) 将测定的OD600值填入下表培养时间(h)对照0 1 2 3 4 5 6 7 8 10 24 光密度值OD600(2)以菌悬液0D值为纵坐标,培养时间为横坐标,绘出大肠杆菌培养的增殖曲线.OD600值培养时间(h)七.思考题(1) 细菌生长繁殖所经历的四个时期中,哪个时期其代时最短?若细胞密度为103/m1,培养4.5h后,其密度高达2×108/m3,请计算出其代时。
(2) 次生代谢产物的大量积累在哪个时期?根据细菌生长繁殖的规律,采用哪些措施可使次生代谢产物积累更多?。
细菌生长特点及生长曲线的测定
实验原理(分光光度计与比浊法)
朗伯-比尔定律 A=-lg(I/I。)=-lgT=kLc
比浊法虽只能测相对数量,但便捷。某些情况 下,我们重在数量的变化而不在数量本身
三、实验内容
1、分光光度计的使用
2、大肠杆菌生长曲线的测定与绘制
四、实验材料
1. 试剂
蛋白胨、氯化钠、酵母浸粉等。 2. 仪器 托盘天平、高压蒸汽灭菌锅、分光光度计、恒温箱、恒温振荡 器。 3. 玻璃器皿 试管、烧杯、量筒、锥形瓶、培养皿、移液管等。 4. 其它物品
药匙、称量纸、pH试纸、记号笔、棉花、纱布、耐高温皮筋、 报纸等。
恒温振荡器(摇床)
五、实验流程
接种→培养→取样→比浊
★实验安排(4人一组) 第一组:LB 培养基,1:100
第二组: LB 培养基,1:50
第三组: LB 培养基,1:20 第四组: LB 培养基,1:100 第五组: LB 培养基,1:10 第六组: LB 培养基,1:5
二、实验原理
理想中生长曲线
1.4 1.2 1 0.8 0.6
0.4
数 量
n y=2
0.2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 时间
理想中生长曲线
1.4 1.2 1 0.8 0.6
0.4 0.2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 时间
八、讨论
1.接种龄如何影响大肠杆菌生长?
2.培养基营养成分/浓度如何影响大肠杆菌生长? 3.实验为何观察不到稳定期和衰退期? (请3选1,作答在实验报告上)
★实验安排(4人一组) 第一组:LB 培养基,1:100
第二组: LB 培养基,1:20
测定细菌生长曲线
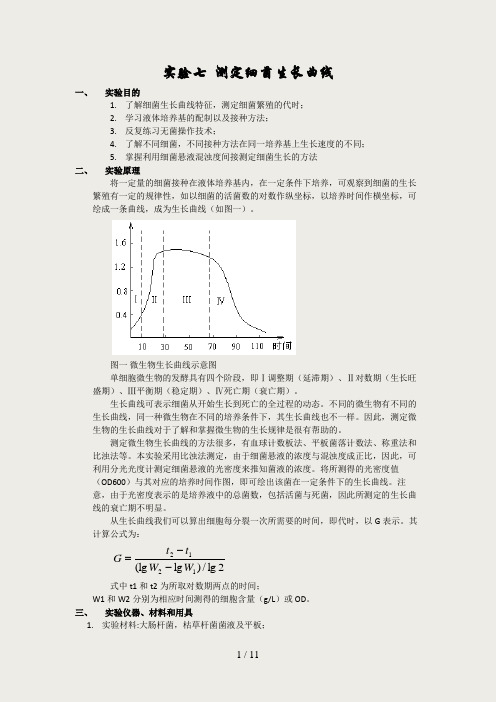
实验七 测定细菌生长曲线一、 实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1. 实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
细菌生长曲线的测定(精)

细菌生长曲线的测定1 目的1.1 了解细菌生长曲线特点及测定原理1.2 学习用比浊法测定细菌的生长曲线2 原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
3 材料3.1菌种大肠杆菌3.2培养基肉膏蛋白胨培养基3.3 仪器和器具721分光光度计,比色杯,恒温摇床,无菌吸管,试管,三角瓶。
4 流程种子液→标记→接种→培养→测定5 方法5.1种子液制备取大肠杆菌斜面菌种1支,以无菌操作挑取1环菌苔,接入肉膏蛋白胨培养液中,静止培养18h作种子培养液。
5.2标记编号取盛有50mL无菌肉膏蛋白胨培养液的250mL三角瓶11个,分别编号为0、1.5、3、4、6、8、10、12、14、16、20h。
5.3接种培养用2mL无菌吸管分别准确吸取2mL种子液加入已编号的11个三角瓶中,于37℃下振荡培养。
然后分别按对应时间将三角瓶取出,立即放冰箱中贮存,待培养结束时一同测定OD 值。
5.4生长量测定将未接种的肉膏蛋白胨培养基倾倒入比色杯中,选用600nm波长分光光度计上调节零点,作为空白对照,并对不同时间培养液从0h起依次进行测定,对浓度大的菌悬液用未接种的牛肉膏蛋白胨液体培养基适当稀释后测定,使其OD值在0.10.~0.65以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。
细菌生长曲线之测定

實驗六細菌生長曲線之測定◎ Exp 11. Turbidity of bacteria一、目的:在進行細菌生長曲線之測定前,必須先了解 U-2001 Spectropho-tometer 操作方法,才能將細菌的數量以吸光值的方式表示出來。
二、原理:請詳讀整理 p. 90-92,學會調整 Optical density (O.D.) 【Exp 13.會用到】。
三、器材:1. culture:(每組)24 hr Escherichia coli (broth)2. medium: (每組)Nutrient broth3. equipment :1 ml pipette,pipette aid,cuvette,拭鏡紙,廢菌液杯,裝蒸餾水的洗瓶,滅菌空試管,U-2001 Spectrophotometer,振盪器。
四、實驗步驟※由助教先示範操作方法,再由學生自行操作與測量待測液之吸光值。
1. 了解 U-2001 Spectrophotometer 操作方法:a. 溫機約 15 分鐘。
b. MENU → (主目錄) 選 1. Photometer →輸入波長 600 nm 及 ABS →Forward →c. Nutrient broth 歸零 autozero → (前、後二支 cuvette) ※1d. 取出後面之 cuvette ,倒入待測液※2,等到右上方數據穩定後,按下 Start →記錄。
※1 cuvette 有石英管 (測波長 340 nm 以下)、玻璃管、塑膠管等材質,本實驗使用塑膠材質之比色管。
※2 每次測定前需先用蒸餾水滴洗cuvette,再以待測液潤濕,倒掉,再裝入待測液,測完倒掉,用蒸餾水滴洗。
測定之前cuvette 須用拭鏡紙擦乾,手握管的非透明處;廢菌液請滴洗入廢菌液杯中,集中處理) 。
2. 每組取一管助教所準備之E. coli當待測液,實際演練U-2001Spectrophotometer 操作,測出其原液 O.D. 【Exp 13. 將會利用到此操作,故須熟悉其操作步驟】。
细菌生长曲线的测定的实验步骤

细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
细菌生长曲线测定实验方法的研究

细菌生长曲线测定实验方法的研究一、本文概述细菌生长曲线测定实验方法的研究对于深入了解细菌的生长规律、生长环境、生长条件以及生长过程中的代谢变化等方面具有重要意义。
本文旨在探讨细菌生长曲线测定的实验方法,包括实验原理、实验步骤、实验条件的选择与优化等方面,以期为提高细菌生长曲线测定的准确性和可靠性提供理论支持和实践指导。
本文将介绍细菌生长曲线测定的基本原理,包括细菌生长曲线的定义、特点以及影响因素等。
在此基础上,本文将详细阐述细菌生长曲线测定的实验步骤,包括实验材料的准备、实验条件的设置、实验过程的操作以及实验结果的记录与分析等。
本文将重点讨论实验条件的选择与优化。
实验条件是影响细菌生长曲线测定结果的关键因素,包括培养基的成分、温度、pH值、接种量等。
本文将通过对比实验和数据分析,探讨不同实验条件对细菌生长曲线的影响,从而确定最佳的实验条件组合。
本文将总结细菌生长曲线测定实验方法的优缺点,并提出改进意见和建议。
通过本文的研究,将为细菌生长曲线测定的实验方法提供更为准确、可靠的理论支持和实践指导,有助于推动细菌学研究的深入发展。
二、细菌生长曲线的理论基础细菌生长曲线测定实验方法的理论基础主要源自微生物生长动力学。
微生物生长动力学描述了微生物在特定环境下的生长规律,其中包括细菌生长曲线的形成机制。
细菌生长曲线是反映细菌群体生长状态的重要指标,通过对细菌生长曲线的分析,可以了解细菌生长的不同阶段,以及影响细菌生长的各种因素。
细菌生长曲线通常可分为四个主要阶段:延迟期、对数生长期、稳定期和衰亡期。
在延迟期,细菌适应新的生长环境,进行必要的代谢准备,此阶段细菌数量增长缓慢。
进入对数生长期后,细菌以指数方式迅速增长,这是细菌生长最为旺盛的阶段。
稳定期时,由于营养物质的消耗和代谢产物的积累,细菌增长速率逐渐减缓,细菌数量趋于稳定。
进入衰亡期,细菌由于营养物质的耗尽和代谢产物的毒性作用,生长速率急剧下降,细菌大量死亡。
实验八细菌生长曲线的测定及

实验⼋细菌⽣长曲线的测定及实验⼋细菌⽣长曲线的测定及⾎球计数板测定微⽣物⽣长⼀、细菌⽣长曲线的测定及★细菌的⽣长曲线就是把⼀定量的菌体细胞接种到恒容积的液体培养基中,在适宜的条件下进⾏培养,在此过程中,其细胞数⽬将随培养时间的延续⽽发⽣规律性的变化,如以细胞数⽬的对数值(或O.D.值)为纵坐标,以培养时间为横坐标作⼀条曲线,即为细菌的⽣长曲线,它反映了细菌的群体⽣长规律。
★⼤多数细菌的繁殖速率很快,在合适的条件下,⼀定时期的⼤肠杆菌细胞每20min分裂⼀次。
★依据其⽣长速率的不同,可把细菌的⽣长曲线划分为延滞期,对数期,稳定期和衰亡期等四个时期。
★微⽣物OD值是反映菌体⽣长状态的⼀个指标,OD是optical delnsity(光密度)的缩写,表⽰被检测物吸收掉的光密度。
通常400~700nm 都是微⽣物测定的范围,505nm测菌丝菌体、560nm测酵母、600nm测细菌。
★本实验测定细菌⽣长曲线的⽅法是,将待测菌种接⼊⼀只⼤试管的培养液中,在适宜的培养温度和良好的通⽓状态下,定时取出此试管,在600纳⽶波长处测定菌液浓度(O.D.值),在⼀定的范围内,菌液浓度与光密度值成线性关系。
因此,根据菌液的O.D.值可以推知细菌⽣长繁殖的进程。
将所测得的⼀组O.D.值与其相应的培养时间作图,即可绘制出该菌的⽣长曲线。
☆实验操作1、菌种培养:取⼤肠杆菌斜⾯菌种1⽀,以⽆菌操作挑取1环菌苔,接⼊⾁膏蛋⽩胨培养液(LB)中,静⽌培养12--14h,备⽤。
2、制备LB培养基100ml置于200ml三⾓瓶内,备⽤。
3、标记:取11⽀⽆菌⼤试管,⽤记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16和20h。
4、接种:分别⽤5ml⽆菌吸管吸取5ml⼤肠杆菌培养液(培养12~14h)转⼊盛有100ml LB液的三⾓瓶内,混合均匀后分别取5ml 混合液放⼊上述标记的11⽀⽆菌⼤试管中。
5、培养:将已接种的试管置摇床37℃振荡培养(振荡频率250r/min),分别培养0、1.5、3、4、6、8、10、12、14、16和20h,将标有相应时间的试管取出,⽴即放冰箱中贮存,最后⼀同⽐浊测定其光密度值。
生长曲线的测定

实验日期:2017.11.1 实验班级:生物技术指导教师:张建丽姓名:高熹学号:1120152430测定细菌生长曲线一.实验目的1.通过对大肠杆菌生长曲线的测定,了解细菌生长的特点,综合训练微生物实验的基本实验技能。
2.巩固培养基的配制、灭菌、仪器的包扎、倒平板。
3.掌握用比浊法测定细菌的生长曲线。
二.实验原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,一定时间测定培养液中的菌量,以菌量的数量作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、生长期、稳定期和衰亡期。
将每一种一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期、对数生长期、稳定期和衰亡期四个阶段。
延迟期:又叫调整期。
细菌接种至培养基后,对新环境有一个短暂适应过程(不适应者可因转种而死亡)。
此期曲线平坦稳定,因为细菌繁殖极少延迟期长短因素种、接种菌量、菌龄以及营养物质等不同而异,一般为1~4小时。
此期中细菌体积增大,代谢活跃,为细菌的分裂增殖合成、储备充足的酶、能量及中间代谢产物。
对数生长期:又称指数期。
此期生长曲线上活菌数直线上升。
细菌以稳定的几何级数极快增长,可持续几小时至几天不等(视培养条件及细菌代时而异)。
此期细菌形态、染色、生物活性都很典型,对外界环境因素的作用敏感,因此研究细菌性状以此期细菌最好。
抗生素作用,对该时期的细菌效果最佳。
稳定期:该期的生长菌群总数处于平坦阶段,但细菌群体活力变化较大细菌浓度达到最大即环境最大容纳量。
由于培养基中营养物质消耗、毒性产物(有机酸、过氧化物等)积累PH下降等不利因素的影响,细菌繁殖速度渐趋下降,相对细菌死亡数开始逐渐增加,此期细菌增殖数与死亡数渐趋平衡。
细菌形态、染色、生物活性可出现改变,并产生相应的代谢产物如外毒素、内毒素、抗生素、以及芽孢等。
简述细菌的生长曲线及其实际意义

简述细菌的生长曲线及其实际意义试验一,细菌的生长曲线实验目的:通过生长曲线测量、培养细菌,获得在不同时间的实际菌数,从而了解细菌的繁殖特性。
方法与步骤:一、选取适当大小的烧杯三只(直径30cm,高20cm)。
分别注入75%的酒精10ml,然后分别加入3、 5ml、 1ml的不同浓度的葡萄糖溶液,再分别加入等量的接种培养液,每只容器的液面高度约为容器的1/2。
另取3mL无菌蒸馏水分别加入到第三只烧杯中。
二、用弯曲的玻璃棒轻轻搅拌,使葡萄糖充分溶解。
取出一只稍冷却的烧杯,迅速将此烧杯倒扣于平皿上。
另取一只稍冷却的烧杯,迅速将此烧杯倒扣于平皿上,这样依次重复三次。
三、平板打开后,待其自然冷却至37 ℃左右时,制成细菌平板。
并计算各菌种在不同培养条件下,该菌种生长的曲线。
四、将各菌种稀释液均匀地分成相等的两组,分别设置5个对照组,每个对照组不变。
各组之间按照表1的比例配成含不同浓度葡萄糖的对照培养基,即对照组1、对照组2、对照组3、对照组4、对照组5。
把一支大烧杯中加满酒精,分别加入2。
0mL、 2ml、 1。
5ml、0。
8ml不同浓度的葡萄糖溶液。
并分别加入等量的接种培养液,每只容器的液面高度约为容器的1/2。
另取3mL无菌蒸馏水分别加入到第三只烧杯中。
二、用弯曲的玻璃棒轻轻搅拌,使葡萄糖充分溶解。
取出一只稍冷却的烧杯,迅速将此烧杯倒扣于平皿上。
另取一只稍冷却的烧杯,迅速将此烧杯倒扣于平皿上,这样依次重复三次。
三、平板打开后,待其自然冷却至37 ℃左右时,制成细菌平板。
并计算各菌种在不同培养条件下,该菌种生长的曲线。
四、将各菌种稀释液均匀地分成相等的两组,分别设置5个对照组,每个对照组不变。
各组之间按照表1的比例配成含不同浓度葡萄糖的对照培养基,即对照组1、对照组2、对照组3、对照组4、对照组5。
每过10天,记录一次菌落数,同时调查第二只烧杯中液体的颜色和气味,判断有无污染。
五、观察统计结果。
六、记录结果,绘制如下图示。
实验八 细菌生长曲线的测定及【内容充实】

实验八细菌生长曲线的测定及血球计数板测定微生物生长一、细菌生长曲线的测定及★细菌的生长曲线就是把一定量的菌体细胞接种到恒容积的液体培养基中,在适宜的条件下进行培养,在此过程中,其细胞数目将随培养时间的延续而发生规律性的变化,如以细胞数目的对数值(或O.D.值)为纵坐标,以培养时间为横坐标作一条曲线,即为细菌的生长曲线,它反映了细菌的群体生长规律。
★大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次。
★依据其生长速率的不同,可把细菌的生长曲线划分为延滞期,对数期,稳定期和衰亡期等四个时期。
★微生物OD值是反映菌体生长状态的一个指标,OD是optical delnsity(光密度)的缩写,表示被检测物吸收掉的光密度。
通常400~700nm 都是微生物测定的范围,505nm测菌丝菌体、560nm测酵母、600nm测细菌。
★本实验测定细菌生长曲线的方法是,将待测菌种接入一只大试管的培养液中,在适宜的培养温度和良好的通气状态下,定时取出此试管,在600纳米波长处测定菌液浓度(O.D.值),在一定的范围内,菌液浓度与光密度值成线性关系。
因此,根据菌液的O.D.值可以推知细菌生长繁殖的进程。
将所测得的一组O.D.值与其相应的培养时间作图,即可绘制出该菌的生长曲线。
☆实验操作1、菌种培养:取大肠杆菌斜面菌种1支,以无菌操作挑取1环菌苔,接入肉膏蛋白胨培养液(LB)中,静止培养12--14h,备用。
2、制备LB培养基100ml置于200ml三角瓶内,备用。
3、标记:取11支无菌大试管,用记号笔分别标明培养时间,即0、1.5、3、4、6、8、10、12、14、16和20h。
4、接种:分别用5ml无菌吸管吸取5ml大肠杆菌培养液(培养12~14h)转入盛有100ml LB液的三角瓶内,混合均匀后分别取5ml混合液放入上述标记的11支无菌大试管中。
5、培养:将已接种的试管置摇床37℃振荡培养(振荡频率250r/min),分别培养0、1.5、3、4、6、8、10、12、14、16和20h,将标有相应时间的试管取出,立即放冰箱中贮存,最后一同比浊测定其光密度值。
最新测定细菌生长曲线

实验七 测定细菌生长曲线一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1. 实验材料:大肠杆菌,枯草杆菌菌液及平板;2. 培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基,37 ℃200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃110rpm取1.0ml大肠杆菌接种到100ml培养基,30 ℃200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基,37 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,30 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,37 ℃110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[精品]细菌生长曲线的测定
细菌生长曲线的测定是细菌学中的一项重要实验。
它可以帮助我们了解细菌的生长繁
殖规律及其影响因素,为控制细菌繁殖提供理论依据。
本次实验将介绍如何通过外观观察、菌落计数及测定细菌生物量的方法,获得细菌在液体培养基中的生长曲线。
实验步骤:
一、准备实验材料和试剂
1、选取一种细菌菌株,本次实验选择了大肠杆菌(Escherichia coli);
2、配置好液体培养基,一般为普通营养琼脂培养基、肉汤培养基等;
3、消毒好实验室的工作台面及实验仪器;
4、准备好移液管、试管、比色管和加热消毒的线圈镊子等实验用具。
二、制备不同浓度的菌液
1、挑选一根菌棒,从培养基上接入一些带有细菌的菌落,将菌落均匀涂抹于培养基
表面;
2、将含有细菌的培养基放置在恒温摇床中,在适宜的温度下进行培养;
3、当细菌生长至一定程度(一般在对数生长期)时,用无菌的移液管,在培养基中取出一定量的菌液;
4、分别将不同体积的菌液加入到含有培养基的试管中,制备成不同浓度的菌液。
三、测定不同浓度菌液对应的OD600值
1、将制备好的不同浓度菌液放入洗涤过的比色管中;
2、由于细菌太小,肉眼观察不能得出其数量的增多或减少,因此需要使用分光光度
计在600nm处测量各个浓度的菌液的吸光度(OD)值;
3、重复测量3次,取平均值计算OD600;
4、根据OD600值和菌液中细胞数量的线性关系,可通过OD600值推算出细胞数。
2、每隔2-3个小时,取出一定量的菌液,测量其OD600值,记录下菌液对应时间的值;
3、采用计数培养法,每隔一定时间取出一定体积的菌液,进行菌落数的计数;
4、利用OD600值曲线和菌落数曲线绘制出细菌生长曲线。
实验注意事项:
1、实验期间需在无菌条件下操作,防止细菌的外界感染对实验结果的影响;
2、实验者需佩戴适当的防护手套及实验服,以免对人体造成伤害;
3、制备好菌液后需要及时放置在摇床中,防止菌落外的细菌感染进去;
4、测量OD600值时比色管必须清洗干净,用甲醇或无菌去离子水。
总结:
通过细菌生长曲线的测定,可以了解到细菌的生长繁殖规律及对物理、化学等因素的适应能力,可为细菌的繁殖控制提供指导。
因此掌握细菌生长曲线的测定方法,对于细菌学相关领域的学习和研究,都具有重要意义。
