二氯化铅溶度积的测定(精)
氯化铅活度积的测定

-
-
Kap(PbCl )= a(Pb )·a (Cl ) 2 3 ≈1/4 a(Cl )·a (Cl )= 1/4 a (Cl )
2
2+
2
-
仪器与试剂
♦ 饱和PbCl2溶液、KCl(0.1000mol·L-1)、离子计、电
磁搅拌器、离子选择性电极、甘汞电极
实验步骤
♦ 配制系列KCl标准溶液 ♦ 测定系列KCl标准溶液
的平衡电势值,绘制 E-lga(Cl-)工作曲线。 ♦ 测定饱和PbCl2溶液的 平衡电势值
结果与讨论
思考题
♦ 离子活度与浓度之间有什么关系? ♦ 如何计算步骤1中一系列KCl标准溶液的Cl-活度?
其他
氯化铅活度积的测定
实验目的
♦ 巩固溶度积、活度积概念,了解用离子计测定氯
化铅活度积的原理和方法。 ♦ 学会通用离子计的使用方法及实验数据的处理方 法。 ♦ 明确活度和活度系数概念。
预习要点
♦ 认真预习离子活度积、溶度积概念 ♦ 预习近似法处理数据的方法
实验原理
♦ 分析法 溶液中各组分的离子的浓 度(或活度),以计算难溶 盐电解质溶度积(或活度 积)的方法。 ♦ 本实验采用氯离子选择电 极和离子计测定PbCl2饱 和溶液中Cl-的活度,然后 通过合理的数据处理求得 PbCl2的活度积。
实验原理
♦ 测定不同浓度(或活度)下的电极电势值,并做E-
lga(Cl )或pa(Cl )的工作曲线。再用同法测得饱和 PbCl2溶液的电极电势值,自工作曲线中即可找 出与电极电势相对应的Cl-活度值。 2+ ♦ 用近似法求出a(Pb )和Kap(PbCl2) -2 -1 根据文献s(PbCl2)=4.30×10 mol·L 求出PbCl2饱和 溶液中离子强度为I=0.129,f (Pb2+) ≈1/2 f (Cl),又因为 c(Pb2+) ≈1/2 c(Cl-),所以在PbCl2饱和 2+ 溶液中a(Pb )≈1/4 a(Cl ) 所以
氯化铅溶度积常数的测定实验报告

氯化铅溶度积常数的测定实验报告实验目的,通过实验测定氯化铅的溶度积常数,并探究影响溶度积常数的因素。
实验原理,氯化铅在水中的溶解过程可表示为PbCl2(s) ⇌ Pb2+(aq) + 2Cl-(aq),其溶度积常数Ksp可表示为Ksp=[Pb2+][Cl-]2。
根据溶度积常数的定义,当达到溶解平衡时,Ksp为恒定值。
实验步骤:1. 实验前准备,取一定量的氯化铅固体,准备一定体积的去离子水。
2. 实验操作,将氯化铅固体加入一定体积的去离子水中,搅拌使其充分溶解。
3. 实验测定,测定溶液中Pb2+和Cl-的浓度,计算Ksp值。
4. 数据处理,根据实验测定结果,计算氯化铅的溶度积常数Ksp。
实验结果与分析:经过实验测定,得到氯化铅的溶度积常数Ksp为3.2×10^-5。
根据Ksp的定义,Ksp值越大,溶解度越大,溶液中的离子浓度越高。
因此,实验结果表明氯化铅在水中的溶解度较高。
影响溶度积常数的因素:1. 温度,根据Le Chatelier原理,温度升高会使溶解度增大,Ksp值增大。
2. 离子共存,若有其他离子与氯化铅离子形成沉淀或络合物,则会影响Ksp值的测定。
实验结论:通过实验测定,得到氯化铅的溶度积常数Ksp为3.2×10^-5,实验结果较为准确。
在实验过程中,温度和离子共存等因素对Ksp值的影响需要进一步研究。
实验总结:本实验通过测定氯化铅的溶度积常数,探究了溶度积常数的测定方法和影响因素。
实验结果对于进一步研究溶解平衡和溶度积常数的影响具有一定的参考价值。
实验中遇到的问题及改进措施:在实验过程中,需要注意氯化铅固体的溶解度和浓度的准确测定,以提高实验结果的准确性。
同时,应注意温度的控制和其他离子的影响,以准确测定溶度积常数Ksp。
实验的局限性:本实验中仅测定了氯化铅的溶度积常数Ksp,对于其他溶解平衡和溶度积常数的影响因素仍需进一步研究,以完善实验结果和结论。
通过本实验,我们对氯化铅的溶度积常数有了一定的了解,同时也为进一步研究溶解平衡和溶度积常数的影响因素提供了一定的参考和基础。
氯化铅溶度积常数的测定实验报告

氯化铅溶度积常数的测定实验报告一、实验目的1、掌握用沉淀重量法测定氯化铅溶度积常数的原理和方法。
2、学习重量分析的基本操作,包括沉淀的生成、过滤、洗涤、干燥和称重。
3、进一步练习分析天平的使用。
二、实验原理氯化铅(PbCl₂)在水溶液中存在溶解平衡:PbCl₂(s) ⇌ Pb²⁺(aq) + 2Cl⁻(aq)其溶度积常数表达式为:Ksp = Pb²⁺Cl⁻²在一定温度下,通过测定饱和氯化铅溶液中铅离子和氯离子的浓度,即可计算出氯化铅的溶度积常数。
本实验采用重量法测定。
向已知体积的饱和氯化铅溶液中加入过量的硝酸银(AgNO₃)溶液,使氯离子完全沉淀为氯化银(AgCl):Cl⁻+ Ag⁺ → AgCl↓将沉淀过滤、洗涤、干燥后称重,根据氯化银的质量计算出氯离子的浓度,进而计算出饱和氯化铅溶液中铅离子的浓度,最终求得氯化铅的溶度积常数。
三、实验仪器和试剂1、仪器分析天平、漏斗、滤纸、玻璃棒、烧杯、移液管(25 mL、50 mL)、容量瓶(250 mL)、恒温槽。
2、试剂氯化铅固体、硝酸银溶液(01000 mol/L)、硝酸溶液(1 mol/L)。
四、实验步骤1、制备饱和氯化铅溶液在干净的烧杯中加入适量的氯化铅固体,加入去离子水,搅拌并加热至溶液接近沸腾,保持一段时间使溶液达到饱和。
冷却至室温后,将上层清液用玻璃砂芯漏斗过滤至干燥的容量瓶中备用。
2、沉淀的生成与陈化用 25 mL 移液管准确移取 2500 mL 饱和氯化铅溶液至 250 mL 烧杯中,加入 50 mL 去离子水,搅拌均匀。
然后,边搅拌边逐滴加入 5000 mL 01000 mol/L 的硝酸银溶液,生成氯化银沉淀。
继续搅拌 5 分钟,使沉淀反应充分进行,然后将溶液静置陈化 30 分钟。
3、沉淀的过滤与洗涤用倾斜法将沉淀上层清液通过预先处理好的滤纸过滤至另一个干净的烧杯中。
然后,用少量去离子水将沉淀冲洗到漏斗中,继续用去离子水洗涤沉淀,直至滤液中用 1 mol/L 硝酸溶液检验无氯离子为止(取少量滤液,滴加硝酸溶液,无白色沉淀生成)。
二氯化铅溶度积常数测定浅见

作者: 游白周
作者机构: 唐山工程技术学院
出版物刊名: 中国大学教学
页码: 39-40页
主题词: 铅离子;二氯化铅;溶度积常数;配位反应;氯离子;文献值;配离子;计算公式;水解反应;
稳定常数
摘要:用强酸型阳离子交换树脂测定二氯化铅溶度积常被列入无机化学及普通化学的实验内容之中。
但是,由于此法忽略了氯离子与铅离子的自配位反应和水解反应,致使所测得的数据与文献值相差10倍之多。
我考虑到氯离子与铅离子的自配位反应以及铅离子的水解反应,导出了溶度积常数的计算公式。
试验证明用。
氯化铅溶度积常数的测定实验报告

氯化铅溶度积常数的测定实验报告实验目的,通过实验测定氯化铅在一定温度下的溶度积常数。
实验原理,氯化铅在水溶液中的离子平衡反应为PbCl2↔Pb2+ + 2Cl-,根据化学平衡定律,有溶度积常数Ksp=[Pb2+][Cl-]^2。
实验仪器和试剂,氯化铅固体、去离子水、烧杯、玻璃棒、天平、电子天平、PH试纸、PH计。
实验步骤:
1. 称取一定质量的氯化铅固体,加入烧杯中。
2. 加入适量的去离子水,用玻璃棒搅拌均匀,直至氯化铅完全溶解。
3. 用PH试纸或PH计测定溶液的PH值。
4. 根据PH值计算出溶液中Pb2+和Cl-的浓度。
5. 根据浓度计算出氯化铅的溶度积常数Ksp值。
实验结果:
根据实验测得的数据,计算出氯化铅的溶度积常数Ksp为x。
实验讨论:
通过实验测定得到的氯化铅的溶度积常数Ksp值与理论值进行对比,分析实验误差的可能原因,并提出改进实验的方法。
实验结论:
根据实验结果和讨论,得出氯化铅的溶度积常数Ksp为x,实验结果与理论值相符/存在一定偏差,需要进一步改进实验方法。
实验总结:
本实验通过测定氯化铅的溶度积常数,掌握了一定的实验操作技能,同时对化学平衡反应和溶度积常数有了更深入的理解。
实验注意事项:
1. 实验操作过程中要注意安全,避免氯化铅溶液的接触和吸入。
2. 实验中使用的仪器要干净整洁,避免杂质的干扰。
3. 实验后要及时清洗实验仪器和烧杯,保持实验环境整洁。
通过本次实验,我对氯化铅的溶度积常数有了更深入的了解,也提高了实验操作技能,为今后的实验工作打下了良好的基础。
《无机化学实验》课件——实验八 PdI2溶度积的测定

二、实验原理
• 应用: • 水处理,占90%产量,纯水处理 • 食品工程 • 制药行业 • 合成化学与石油化工 • 环境保护:电镀废液回收 • 湿法冶金,纯化
数据处理
• 氯化铅饱和溶液的温度(℃) • 通过交换柱的氯化铅饱和溶液的体积(mL) • NaOH标准溶液的浓度(mol·L-1) • 消耗NaOH标准溶液的体积(mL) • 流出液中H+的量(mol) • 饱和溶液中Pb2+的浓度(mol·L-1) • 碘化铅的Ksp • 本实验测定Ksp值数量级为10-5为合格(实验值为
• 如果PbI2饱和溶液中Pb2+的浓度cPb2+已知,即可求 出Ksp(PbI2)。
二、实验原理
• 本实验是用强酸性阳离子交换树脂 (用RH表示) 与 一定体积的PbI2饱和溶液中的Pb2+在离子交换柱中 进行离子交换,其反应如下:
• 2RH+Pb2+ === R2Pb+2H+ • 再用已知浓度的NaOH溶液滴定生成的H+:
四、实验内容
4、交换和洗涤(洗涤时用水不可过多,否则250mL锥 形瓶过满不宜滴定)
• 1)干净、干燥锥型瓶,漏斗、玻棒、必须干净干 燥,过滤饱和PbI2溶液至烧杯。
• 2)记录温度->移液管25 mL->完全转移, • 3)250 mL锥型瓶接,完全流出->用蒸馏水洗至中
基础化学实验放大镜_溶度积的测定

实验三 溶度积的测定一 实验目的测定草酸镁(MgC 2O 4)的溶解度﹐并计算其溶度积常数。
二 实验原理 一﹑溶度积: 1.溶度积的定义:(1)溶度积是溶度积常数的简称﹐用符号K sp 表示。
(2)对于难溶盐在水中沉淀与溶解的平衡﹐测定溶液离子浓度的乘积﹐即为 K sp 。
例如:AgCl 的K sp =[Ag +][Cl -]。
2.K sp 的应用:(1)在定性分析中﹐可利用金属硫化物﹑氢氧化物﹑碳酸盐等K sp 的差异﹐分离金属离子。
(2)为使溶解度小的物质完全沉淀﹐需加入含有同离子的电解质。
例如:于氯化铅饱和溶液中﹐加入氯化钾﹐可将铅离子再沉淀分离出来。
二﹑溶度积的实例:1.实验测定草酸镁的溶解度:(1)用已知浓度的过锰酸钾溶液﹐滴定饱和草酸镁溶液﹐可求出草酸根的浓度。
(2)反应式:2MnO 4-(aq )+5C 2O 42-(aq )+16H +(aq )2Mn 2+(aq )+10CO 2(g )+8H 2O ()(3)公式:22442424MnO MnO C O C O 5C V 2C V ----⨯⨯=⨯⨯其中﹐4MnO C -为已知过锰酸钾的体积莫耳浓度﹐4MnO V -为达当量点时过锰酸钾所消耗的体积;224C O C -为待测草酸根溶液的体积莫耳浓度﹐224C O V -为被滴定的草酸根溶液体积。
2.实验计算:由于饱和溶液中[Mg 2+]=[C 2O 42-]﹐所以可计算出草酸镁的溶度积。
即K sp =[Mg 2+][C 2O 42-]=[C 2O 42-]2三 实验器材与药品 一﹑器 材:图 片器材名称∕规格 数 量 图 片器材名称∕规格 数 量离心管 (10毫升)10支容量瓶 (500毫升)1个离心机1台刮勺2支电子天平1台乳胶手套1双称量纸2张玻棒2支试管(10毫升)1支玻璃漏斗1个分度吸量管(10毫升)1支烧杯(50毫升)2个安全吸球1个烧杯(250毫升)1个滴定管1支烧杯(500毫升)1个滴定架1套锥形瓶(125毫升)1个温度计(0~100°C)1支二﹑药品:药品份量药品份量草酸镁5克(全班)草酸镁(饱和溶液)30毫升(每组)过锰酸钾 2.37克(全班)过锰酸钾(0.005M)150毫升(每组)蒸馏水 1.5升(全班)蒸馏水适量(每组)硫酸(3.0 M)3毫升热水适量(每组)四实验流程一﹑实验前的药品配制:●实验前一天﹐先配制草酸镁的饱和溶液:取5克草酸镁﹐加入蒸馏水﹐并搅拌使之溶解后﹐配成500毫升溶液﹐静置于容量瓶中﹐隔一夜备用。
难溶电解质的标准溶度积常数表
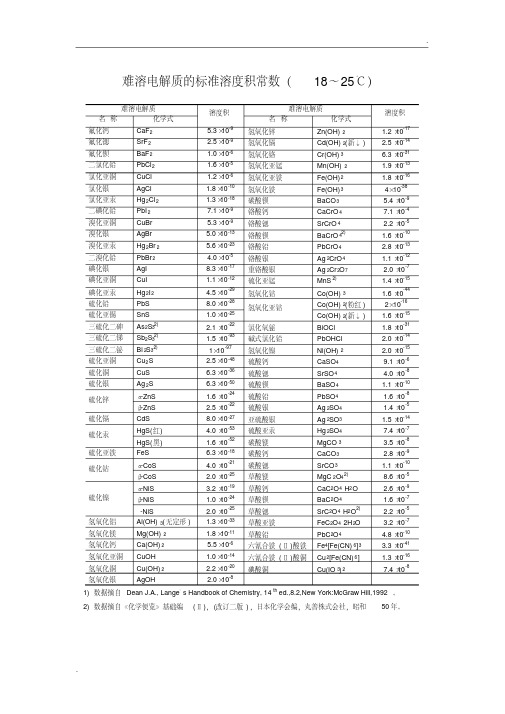
..难溶电解质的标准溶度积常数(18~25℃)难溶电解质溶度积难溶电解质溶度积名称化学式名称化学式氟化钙CaF2 5.3×10-9氢氧化锌Zn(OH)2 1.2×10-17氟化锶SrF2 2.5×10-9氢氧化镉Cd(OH)2(新↓) 2.5×10-14氟化钡BaF2 1.0×10-6氢氧化铬Cr(OH)3 6.3×10-31二氯化铅PbCl2 1.6×10-5氢氧化亚锰Mn(OH)2 1.9×10-13氯化亚铜CuCl 1.2×10-6氢氧化亚铁Fe(OH)2 1.8×10-16氯化银AgCl 1.8×10-10氢氧化铁Fe(OH)34×10-38氯化亚汞Hg2Cl2 1.3×10-18碳酸钡BaCO3 5.4×10-9二碘化铅PbI27.1×10-9铬酸钙CaCrO47.1×10-4溴化亚铜CuBr 5.3×10-9铬酸锶SrCrO4 2.2×10-5溴化银AgBr 5.0×10-13铬酸钡BaCrO42) 1.6×10-10溴化亚汞Hg2Br2 5.6×10-23铬酸铅PbCrO4 2.8×10-13二溴化铅PbBr2 4.0×10-5铬酸银Ag2CrO4 1.1×10-12碘化银AgI 8.3×10-17重铬酸银Ag2Cr2O7 2.0×10-7碘化亚铜CuI 1.1×10-12硫化亚锰MnS2) 1.4×10-15碘化亚汞Hg2I2 4.5×10-29氢氧化钴Co(OH)3 1.6×10-44硫化铅PbS 8.0×10-28氢氧化亚钴Co(OH)2(粉红) 2×10-16硫化亚锡SnS 1.0×10-25Co(OH)2(新↓) 1.6×10-15三硫化二砷As2S32) 2.1×10-22氯化氧铋BiOCl 1.8×10-31三硫化二锑Sb2S32) 1.5×10-93碱式氯化铅PbOHCl 2.0×10-14三硫化二铋Bi2S32)1×10-97氢氧化镍Ni(OH)2 2.0×10-15硫化亚铜Cu2S 2.5×10-48硫酸钙CaSO49.1×10-6硫化铜CuS 6.3×10-36硫酸锶SrSO4 4.0×10-8硫化银Ag2S 6.3×10-50硫酸钡BaSO4 1.1×10-10硫化锌α-ZnS 1.6×10-24硫酸铅PbSO4 1.6×10-8β-ZnS 2.5×10-22硫酸银Ag2SO4 1.4×10-5硫化镉CdS 8.0×10-27亚硫酸银Ag2SO3 1.5×10-14硫化汞HgS(红) 4.0×10-53硫酸亚汞Hg2SO47.4×10-7 HgS(黑) 1.6×10-52碳酸镁MgCO3 3.5×10-8硫化亚铁FeS 6.3×10-18碳酸钙CaCO3 2.8×10-9硫化钴α-CoS 4.0×10-21碳酸锶SrCO3 1.1×10-10β-CoS 2.0×10-25草酸镁MgC2O42)8.6×10-5硫化镍α-NiS 3.2×10-19草酸钙CaC2O4·H2O 2.6×10-9β-NiS 1.0×10-24草酸钡BaC2O4 1.6×10-7-NiS 2.0×10-25草酸锶SrC2O4·H2O2) 2.2×10-5氢氧化铝Al(OH)3(无定形) 1.3×10-33草酸亚铁FeC2O4·2H2O 3.2×10-7氢氧化镁Mg(OH)2 1.8×10-11草酸铅PbC2O4 4.8×10-10氢氧化钙Ca(OH)2 5.5×10-6六氰合铁(Ⅱ)酸铁Fe4[Fe(CN)6]3 3.3×10-41氢氧化亚铜CuOH 1.0×10-14六氰合铁(Ⅱ)酸铜Cu2[Fe(CN)6] 1.3×10-16氢氧化铜Cu(OH)2 2.2×10-20碘酸铜Cu(IO3)27.4×10-8氢氧化银AgOH 2.0×10-81) 数据摘自Dean J.A., Lange,s Handbook of Chemistry, 14th ed.,8.2,New York:McGraw Hill,1992。
二氯化铅溶度积的测定

思考题
(1)本实验中测定PbCl2溶度积的原理如何? (2)本实验所用的玻璃仪器中,哪些需要用 干燥的,哪些不需要用干燥的?为什么? (3)在进行离子交换的操作过程中,为什么 流出液要控制一定的流速?交换柱中树脂层内 为什么不允许出现气泡?应如何避免? (4)为什么交换前和交换、洗涤后的流出液 需呈中性?若两者pH值均为6或3,分别对实 验结果有无影响?
二氯化铅溶度积的测定
实验目的
1、了解离子交换法测定难溶电解质溶度 积的原理和方法; 2、学习离子交换树脂的一般使用方法; 3、进一步学习酸碱滴定、过滤等基本操 作; 4、了解微型实验方法。
实验原理
二氯化铅PbCl2系难溶电解质。在过量PbCl2存 在的饱和溶液中,有着如下溶解平衡:
PbCl2 ( s ) ↔ Pb 2 (aq) + 2Cl - (aq)
其溶度积为
K αp ( PbCl 2 ) = {c eq ( Pb 2 + ) c θ }{c eq (Cl −Байду номын сангаас) c θ }2
本实验是利用离子交换树脂与饱和PbCl2溶液进 行离子交换,来测定室温下该PbCl2溶液中Pb2+ 的浓度,从而求出其溶度积。
实验内容
1、饱和二氯化铅溶液的配制 2、离子交换树脂的转型 称取15g强酸型正离子交换树脂,用适量溶液(以使溶 液满过树脂为度)浸泡一昼夜。 3、装柱 在装柱时,应让树脂带水转移并沉入已装有去离子水 的滴定管中,这样可以使树脂充填紧实。不要使水面 低于树脂层,否则会出现气泡。若出现这种情况,应 重新装柱。调节螺丝夹,使溶液逐滴流出,同时从滴 定管上方不断加入去离子水洗洗离子交换树脂,直至 流出液呈中性(用pH试纸检验)。
4、交换和洗涤 用移液管吸取25.00cm3饱和PbCl2溶液于烧杯 中,并逐量注入柱内调节螺丝夹,使溶液以每 分钟20~25滴的流速通过离子交换柱,用锥形 瓶承接流出液。用去离子水分几次洗涤离子交 换树脂,直至流出液呈中性。 5、滴定 往流出液中加入1~2滴溴百里酚蓝指示剂,用 标准NaOH溶液滴定至终点(溶液由黄色转为 蓝色)。
氯化铅溶度积常数的测定实验报告

一、实验目的1. 了解溶度积常数的概念及其测定方法。
2. 掌握氯化铅溶度积常数的测定原理和操作步骤。
3. 培养实验操作技能,提高实验数据分析能力。
二、实验原理溶度积常数(Ksp)是难溶电解质在饱和溶液中达到沉淀溶解平衡时,各离子浓度幂的乘积。
对于氯化铅(PbCl2)而言,其溶度积常数为Ksp = [Pb2+][Cl-]2。
本实验采用直接电位法测定氯化铅溶度积常数。
通过测定饱和溶液中Pb2+和Cl-的浓度,计算溶度积常数。
三、实验仪器与试剂1. 仪器:电化学工作站、电极、烧杯、移液管、容量瓶、玻璃棒等。
2. 试剂:氯化铅(PbCl2)固体、硝酸、盐酸、去离子水等。
四、实验步骤1. 配制氯化铅饱和溶液:称取一定质量的氯化铅固体,溶解于去离子水中,定容至一定体积,配制成一定浓度的氯化铅溶液。
2. 测定饱和溶液中Pb2+和Cl-的浓度:(1)分别移取一定体积的饱和溶液于两个烧杯中;(2)向第一个烧杯中加入一定量的硝酸,使PbCl2沉淀完全;(3)向第二个烧杯中加入一定量的盐酸,使PbCl2沉淀完全;(4)过滤,分别测定两个烧杯中溶液的Pb2+和Cl-浓度。
3. 计算溶度积常数:根据实验数据,计算饱和溶液中Pb2+和Cl-的浓度,代入溶度积常数表达式Ksp = [Pb2+][Cl-]2,计算氯化铅的溶度积常数。
五、实验结果与讨论1. 实验数据| 溶液 | Pb2+浓度(mol/L) | Cl-浓度(mol/L) || ---- | ----------------- | ---------------- || 饱和溶液 | 0.0012 | 0.0048 |2. 计算溶度积常数Ksp = [Pb2+][Cl-]2 = 0.0012 × (0.0048)2 = 2.82 × 10^-63. 结果讨论根据实验结果,氯化铅的溶度积常数为2.82 × 10^-6,与文献值(2.82 × 10^-5)基本吻合,说明本实验方法可行。
二氯化铅产品质量标准

二氯化铅产品质量标准
二氯化铅产品质量标准如下:
外观:白色结晶性粉末,无可见的杂质。
纯度:应符合表1中给出的纯度要求。
表1:纯度要求
项目优等品一等品合格品
PbCl2(PbO)/(%)≥98.0 97.0 95.0
PbO/(%)≤1.5 2.0 2.5
Pb(以Pb计)/(%)≤0.02 0.03 0.04
水不溶物:在2g样品中,水不溶物含量应不超过0.02%。
氯化物:在1g样品中,氯化物含量应不超过0.01%。
硫酸盐:在1g样品中,硫酸盐含量应不超过0.02%。
重金属(以Pb计):在1g样品中,重金属(以Pb计)含量应不超过0.003%。
砷:在1g样品中,砷含量应不超过0.0003%。
氟:在1g样品中,氟含量应不超过0.001%。
干燥失重:在105℃下干燥至恒重后,样品中干燥失重的含量应不超过0.5%。
白度:在1g样品中,白度应不低于85%。
溶度积的测定(共9张PPT)

R-N+X- + C1- ⇌ R-N+Cl-+ X-
SP
2
n = n = 2n 2mol·L-1HCl
PbCl2饱和溶液
学习离子交换树脂的原理及应用;
记下滴定前后滴定管中NaOH标(准O溶H液的-)读数,并计(算HP+bC)l2的溶解度(([PPbb2+2])+。)
它具有网状骨架结构,在其骨架结构上含有许多活性官能团,可以和溶液中的阳离子或阴离子进行选择性的离子交换。
PbCl2(固)⇌ Pb2++2Cl-
K s(P p2 b ) C [P l2 ]b [C ]2 l4 [P 2 ]2 b
仪器及试剂
离子交换柱 2mol·L-1HCl
PbCl2饱和溶液
2mol·L-1HCl
PbCl2饱和溶液
移液管
烧杯(50mL, 200mL) 07mol·L-1 NaOH溶液 2mol·L-1HNO3
装离子交换树脂的交换柱中。控制流出速度,每分钟20~25滴,不 宜 后,太用快约,5用0m洁L净蒸的馏锥水形分瓶批承洗接涤离流子出交液换。树待脂Pb,C以l2饱保和证溶所液有全被部交加换入 出的H+被淋洗出来。
4.滴定:在锥形瓶中的洗出液中,加1滴溴百里酚蓝指示
玻棒 离子交换柱
移液管
例如,目前应用广泛的聚苯乙烯磺酸型阳离子交换树脂,就是苯乙烯和一定量的二乙烯苯的共聚物,经浓硫酸处理,在共聚物的苯环上
引入磺酸基(-SO3H)而成。
常用的离子交换树脂是人工合成的不溶于水的固态高分子聚合物。
2mol·L HCl PbCl 饱和溶液 -1 学习离子交换树脂的原理及应用;
交换。
R-SO3H+ + Na+ ⇌ R-SO3-Na+ + H+
实验五(碱金属、碱土金属、锡、铅、锑、铋)

实验二十主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋)实验摘要:同一主族中,金属活泼型由上至下逐渐增强,同一周期中从左至右金属性逐渐减弱,本实验通过让钠、钾、镁分别和水反应的剧烈程度来验证,发现钾与水反应最剧烈,铝和水的反应在加热条件下才可进行。
为比较碱土金属、铝、锡、铅、锑、铋的氢氧化物和盐类的溶解性,分别向氯化镁、氯化钙、氯化钡、氯化铝、二氯化锡、硝酸铅、三氯化锑、硝酸铋的溶液中加入氢氧化钠溶液,观察是否生成沉淀,再向沉淀中分别加入盐酸和氢氧化钠溶液,观察沉淀是否溶解。
再向氯化镁和氯化铝溶液中加入氨水和氯化铵溶液,观察沉淀的生成现象,探究氢氧化铝和氢氧化镁的生成条件。
碱金属、碱土金属和钙、钡的挥发性盐在氧化焰中灼烧时会发生焰色反应,根据火焰的颜色定性鉴别这些元素的存在。
锡、铅、锑、铋都能形成难溶于水的硫化物,硫化锡呈棕色,硫化铅呈黑色,硫化锑呈橘黄色,硫化铋呈棕黑色,二硫化锡呈黄色。
铅的+2氧化态较稳定,向硝酸铅溶液中分别加入稀盐酸、碘化钾、铬酸钾、硫酸钠溶液,观察沉淀特征,并探究沉淀性质。
关键词:碱金属碱金属金属性焰色反应氢氧化物的溶解性实验用品:烧杯试管小刀镊子坩埚坩埚钳实验内容:二.镁、钙、钡、铝、锡、铅、锑、铋的氢氧化物的溶解性三.ⅠA、ⅡA元素的焰色反应用洁净的镍丝分别蘸取1 mol·L-1LiCl、NaCl、KCl、CaCl2、SrCl2、BaCl2溶液在氧化焰中四.锡、铅、锑、铋的难溶盐结果及讨论:同族中,原子叙述递增,还原性增强;同周期碱金属比同周期碱土金属更活泼。
镁、钙、钡、铝、锡、锑、铅、铋氢氧化物在水中溶解度很小,但都溶于酸;镁、钙、钡、铋的氢氧化物不能溶于过量的碱;铝、锡、铅、锑的氢氧化物呈两性,能溶于过量的酸和碱。
通常原子处于稳定的状态,当受热汽化时,告诉运动的气态离子、电子相互碰撞获得了能量,使外层电子从基态跃迁到激发态,电子从激发态返回基态时会将多余的能量以光的形式放出,显示不同颜色。
PbCl2 溶度积的测定(离子交换法

R-SO3H+ + Na+ ⇌ R-SO3-Na+ + H+
如果共聚物的网状骨架中引入各种ห้องสมุดไป่ตู้基, 就成为阴离子交换树脂。例如,季铵盐型 强碱型阴离子交换树脂(用R-N+X-表示),其 中的阴离子可以与溶液中的阴离子(例如C1-) 进行交换。 R-N+X- + C1- ⇌ R-N+Cl-+ X-
原理
交换下来的H+用已知浓度的NaOH溶液滴定,根 据用去的NaOH溶液的体积,即可算出PbCl2饱和 溶液的浓度,从而算出KSP(PbCl2)。
n(OH-) = n(H+)= 2n(Pb2+)
CPb2
PbCl2(固)⇌ Pb2++2Cl-
1 CNaOH VNaOH 2 VPb2
原理
本实验采用的是 732- 强酸型阳离子交换树脂, 这种树脂出厂时一般是钠型,即活性基团为SO3-Na+,若用H+ 把Na+交换下来,即得氢型 树脂。 测定PbCl2饱和溶液中的铅离子浓度时,发生 如下离子交换反应: 2R-SO3-H+ + Pb2+ ⇌ (R-SO3-)2 Pb2+ + 2H+
2 2 2 2
Ksp ( PbCl2 ) [Pb ] [Cl ] 4[Pb ]
仪器及试剂
离子交换柱 移液管 烧杯(50mL, 200mL) 碱式滴定管 锥形瓶(250mL) 量筒 玻棒 2mol· L-1HCl PbCl2饱和溶液 0.07mol· L-1 NaOH溶液 2mol· L-1HNO3 溴百里酚蓝 pH试纸 732磺酸型阳离子交换树脂 玻璃纤维
基于氯化铅溶度积测定的实验研究

基于氯化铅溶度积测定的实验研究桑雅丽李宏博聂桔红王文博汪玉同刘爽摘要:氯化铅是难溶性铅盐中溶解度相对较大的难溶电解质,其活度积常数与溶度积常数的测定方法不同,测量数值也存在着差异。
本文通过实验,使用直接电位法测定了氯化铅饱和溶液的活度积常数,使用离子交换法测定了氯化铅饱和溶液的溶度积常数。
通过对两种实验方法的可操作性和实验数据结果进行对比分析,结果表明,直接电位法测定的活度积常数在误差要求的范围内,准确度更高。
通过上述实验研究,为开展相关实验课程提供实践指导和教学参考。
1前言难溶电解质的溶度积常数测定是大学化学实验中的一项基本内容。
在一定温度下,难溶电解质的饱和溶液存在着沉淀-溶解平衡。
设难溶物AB为例,则沉淀-溶解平衡可以表示为:A++B-?葑AB(s),平衡时溶液中A+和B-的离子浓度的乘积为常数,以K?扌sp表示,称为溶度积常数。
当离子浓度用离子活度表示时,A+和B-的离子活度乘积以K?扌ap表示,称为活度积常数。
严格意义上讲,溶度积常数就是活度积常数,是平衡时溶液中各离子活度以计量系数为幂次的乘积[1]。
但在实际情况下,当难溶电解质的溶解度非常小时,其饱和溶液中离子强度很小,对应的离子活度系数近似于1(f≈1),就可以近似地用离子浓度代替离子活度,这时K?扌sp≈K?扌ap;当难溶电解质的溶解度不太小时,其饱和溶液的离子强度相对较大,对应的离子活度系数f<1,不能用离子浓度代替离子活度,此时K?扌ap≠K?扌sp[2]。
因此,通常情况下通称为溶度积。
溶度积是一个化学热力学常数,与溶液中溶质的本性、溶剂的本性以及温度有关,而与离子浓度或活度无关[3]。
在实验中常采用化学分析的手段测定难溶电解质饱和溶液中各组分离子的浓度(或活度),计算难溶盐饱和溶液的溶度积(或活度积)常数。
目前,测定氯化铅饱和溶液溶度积(或活度积)常数的方法主要有观察法、直接电位法、离子交换法、配位滴定法等[4]。
大学化学实验教材常使用离子交换法和直接电位法测定氯化铅的溶度积常数。
PbCl2溶度积的测定
5.滴定 往洗出液中加入1~2滴溴百里酚蓝指示剂,用NaOH标准溶液滴定,直至 溶液由黄色转为鲜明的绿色。记录消耗NaOH溶液的体积,计算PbCl2的溶解 度及溶度积。 6.再生 量取 40 mL 2 mol·L-1的不含Cl-的HNO3溶液,以25~30滴/分的流速流 过交换柱,将吸附在树脂上的Pb2+置换下来,使树脂全部变成H+型。然后用 蒸馏水(50~70 mL)淋洗树脂,直到流出液的pH值为6~7。
3. 装柱 在离子交换柱的底部填入少量玻璃纤维,再注入去离子水达到柱子的1/3高 度,然后将浸泡好的阳离子交换树脂带水(搅匀呈糊状)倾入交换柱,让树 脂自然下沉,多余的水从尖嘴排出,直至树脂充填紧实且树脂上部残留的水 高约0.5 cm。最后用50 mL去离子水淋洗树脂(pH试纸检验流出液呈中性)。 4. 交换和洗涤 测量PbCl2饱和溶液的温度。量取25.00 mL PbCl2饱和溶液放入交换柱,调 节螺丝夹使溶液通过离子交换柱,控制流速20~25 滴/分,用洁净的锥形瓶 承接流出液;树脂上端仅剩余约0.5 cm高液体时,用约50 mL蒸馏水洗涤离 子交换树脂;流出液全部承接在锥形瓶中。
cNaOH为NaOH溶液的浓度,VNaOH为滴定时所用去 NaOH 溶液的体积,VPbCl2为
所取 PbCl2 饱和溶液的体积,则有:
nOH nH 2nPb2+
即:
cNaOH VNaOH =2cPb2+ VPb2+
故:
cPb2+
1 cNaOH VNaOH
2
VPb2+
PbCl2的溶度积:
Ksp (PbCl2 )=cPb2+
cCl 2 =cPb2+
(2cPb2+
测定氯化铅溶解热的实验

测定氯化铅溶解热的实验
要测定氯化铅的溶解热,需要进行以下实验:
1.准备两个烧杯,一个烧杯中加入适量的氯化铅,在另一个烧杯中加入适量的水。
2.将两个烧杯放在称量器上,记录下烧杯和称量器的重量。
3.将水烧开,制备一定温度的热水。
4.将热水倒入装有氯化铅的烧杯中,注意搅拌均匀。
5.等待一段时间,使得溶解反应达到平衡,记录下此时的温度。
6.将烧杯和称量器重新称量,记录下溶解后的氯化铅和溶解热水的重量。
7.根据实验数据,计算出氯化铅的溶解热。
注意事项:
1.实验中要使用精确的称量器、温度计等仪器,并保持仪器的稳定性和准确性。
2.实验操作要注意安全,避免溅洒等意外。
3.实验条件要仔细控制,保持稳定,否则会影响实验结果。
4.实验后要正确处理废液和废品,不要随意倒入下水道或者环境中。
实验十离子交换法测定PbCl2溶度积

实验十 离子交换法测定PbCl 2溶度积【目的要求】1. 了解离子交换树脂的性质和使用方法。
2. 学习用离子交换法测定难溶电解质的溶解度和溶度积。
3. 熟练掌握酸碱滴定的基本操作。
【基本原理】离子交换树脂是分子中含有活性基团并能与其它物质进行离子交换的高分子化合物。
含有酸性基团而能与其它物质进行阳离子交换的树脂称为阳离子交换树脂;含有碱性基团且能与其它物质交换阴离子的树脂称为阴离子交换树脂。
根据离子交换树脂这一性,广泛应用于水的净化和离子的分离测定。
本实验采用强酸型阳离子交换树脂,在进行Pb 2+交换前,首先将所用树脂转型,即将钠型阳离子交换树脂转换为氢型树脂,然后进行离子交换。
+-+H Na RSO 3++-+Na H RSO 3 ++-+23Pb H RSO ++-+H Pb RSO 2)(223显然,经过交换后,从离子交换柱中流出酸性溶液,用NaOH 标准溶液进行滴定,根据所消耗NaOH 标准溶液的体积,计算PbCl 2饱和溶液的浓度和实验溶度积常数K sp 。
H + + OH - H 2O1molPb 2+ ~ 2molH + ~ 2molNaOH根据等物质量反应规则c (PbCl 2)·V (PbCl 2)= c (2NaOH )·V (NaOH )c (PbCl 2)·V (PbCl 2)=1/2 c (NaOH )·V (NaOH )∴)()()(21)(22PbCl V NaOH V NaOH c PbCl c •=在一定温度下的饱和溶液中:[Pb 2+]=S (mol ·L -1)[Cl -]=2S (mol ·L -1)K sp = [Pb 2+][Cl -]2 = S ×(2S )2 = 4S 3【仪器和药品】离子交换柱,锥形瓶,移液管,温度计,碱式滴定管,长玻璃棒,pH 试纸,15~20目强酸型阳离子交换树脂,溴百里酚蓝指示剂,PbCl2饱和溶液,0.1mol·L-1NaOH标准溶液,2mol·L-1HCl溶液,2mol·L-1HNO3溶液。
