α-甲胺基苯丙酮合成工艺与机理
苯丙胺的制备原理

苯丙胺的制备原理苯丙胺(C9H13N),也被称为苯基--丙基胺,是一种有机化合物。
其制备主要有两种方法:一种是通过苯丙酮的铝醇盐合成,另一种是通过苯与丙胺发生缩合反应制得。
首先,我们先来了解一下苯丙酮和丙胺的结构。
苯丙酮的结构式为C6H5CH2COCH3,是一种具有苯环和丙酮基的化合物。
丙胺的结构式为CH3CH2CH2NH2,是一种含有氨基的烷烃。
苯丙胺的制备方法之一是将苯丙酮与铝醇盐反应。
铝醇盐通常是甲基二苯基铝((C6H5)2AlCH3)或环己基二苯基铝((C6H5)2AlC6H11)等。
该反应通常在无水环境下进行,以防止水分的干扰。
反应需要在惰性气氛中进行,如氩气或氮气。
苯丙酮与铝醇盐反应的机制包括两个关键步骤:缩合反应和氧化反应。
首先,苯丙酮和铝醇盐发生缩合反应,生成酮铝间盐化合物(C6H5CH2C(O)−AlR2)。
在此步骤中,酮的羰基碳与铝醇盐的铝之间发生形成共价键。
然后,酮铝间盐被氧化为苯丙酮锂(C6H5CH2C(O)Li),当然,也有可能是苯丙酮钠(C6H5CH2C(O)Na)等。
此时,再加入N,N-二甲基甲酰胺(DMF)或二甲基亚砜(DMSO)等胺络合剂,使苯丙酮的锂盐与丙胺发生交换反应,生成苯丙胺的锂盐(C6H5CH2CH2NH−Li+)。
最后,用酸处理苯丙胺的锂盐,生成苯丙胺。
苯丙酮的合成反应的优点在于可以利用廉价的原料,同时合成过程也相对简单。
然而,此方法需要对反应条件进行精确控制,以确保反应的高效性和选择性。
此外,反应中的铝醇盐和胺络合剂可能会对环境造成一定的污染。
另一种制备苯丙胺的方法是通过苯与丙胺的缩合反应得到。
在此方法中,苯和丙胺被加热至100C以上,经过一定时间的反应后,生成苯丙胺。
该反应通常在无溶剂条件下进行,因为反应物较易挥发。
苯与丙胺的缩合反应是一种自由基反应。
首先,苯经过光照或热激发后产生高能自由基,然后与丙胺发生自由基取代反应,生成苯丙胺自由基。
接着,苯丙胺自由基间发生重组,生成苯丙胺。
α-甲胺基苯丙酮合成工艺与机理

一:α-甲氨基苯丙酮盐酸盐得简介:中文名:α—甲氨基苯丙酮盐酸盐(阿尔法-甲氨基苯丙酮盐酸盐)英文名: 1-Propanone,2-(methylamino)—1—phenyl—,hydrochloride (1:1)别名:1-Propanone,2—(methylamino)-1—phenyl—, hydrochloride 1-Propanone,2—(methylamino)-1-phenyl-, hydrochloride,dl-Ephedrone hydrochloride2-(methylamino)-1-phenylpropan-1-one hydrochloride (1:1)分子式:C10H14ClNO分子量: 199、67726CAS号:49656—78—2α-甲氨基苯丙酮盐酸盐(简称MAK).a-甲胺基苯丙酮盐酸盐就就是2—甲胺基苯丙酮盐酸盐(2-甲氨基苯丙酮盐酸盐)就就是邻甲胺基苯丙酮盐酸盐。
价格:2500元/公斤性质描述:白色或类白色结晶性粉。
用途:抗抑郁药氟西汀中间体。
二:α—甲氨基苯丙酮盐酸盐得合成工艺:以α—溴代苯丙酮为原料进行甲胺化反应.在5000ml得三口烧瓶中,加入90ml甲苯溶液与α-溴代苯丙酮400克、将烧瓶装上搅拌,温度计,升温到80-85度。
在烧瓶另一口装恒压滴液漏斗,恒压滴液漏斗内装10%甲胺水溶液960ml、(其中40%溶液100ml加100ml水得10%甲胺水,甲胺化反应中,改用甲胺水代替甲胺盐或甲胺气体,使反应温度降低,条件温与.),水浴温度恒温,在80—85℃,开动搅拌,搅拌速度控制为90-100转/分,缓慢滴加甲胺,温度控制在80度,时间大约90分钟。
甲胺加入后,在恒压滴液漏斗内装用450克碱配置得15%得溶液(450g+水2550ml),烧碱不要放多了。
安装好装上回流装置。
升温加热回流,温度开始在85度,随甲胺减少,温度提高到88度,加毕反应24小时,停止加热,冷至零下15.然后加入氢氧化钠溶液180毫升,搅拌静置过夜。
甲胺基苯丙酮还原方程

甲胺基苯丙酮还原方程甲胺基苯丙酮是一种有机化合物,其分子式为C9H11NO,也被称为甲酮胺或甲基苯丙酮。
它是一种常见的酮类化合物,在有机合成和医药领域有广泛的应用。
甲胺基苯丙酮还原方程描述了当甲胺基苯丙酮与还原剂反应时,产生的产物及化学反应过程。
甲胺基苯丙酮还原方程可以表示为:C9H11NO + 2H2 → C9H13N + H2O在这个方程中,甲胺基苯丙酮与氢气反应,经过还原作用生成甲胺基丙酮和水。
这个化学反应是通过加氢反应实现的,需要在适当的条件下进行。
甲胺基苯丙酮还原方程的背后是一系列复杂的化学反应步骤。
首先,氢气作为还原剂被导入反应体系中。
然后,甲胺基苯丙酮的酮基被氢气加成,产生一步一步的中间体。
最终,甲胺基苯丙酮的酮基被还原为甲胺基丙酮,同时氢气被氧化为水。
甲胺基苯丙酮还原方程的反应条件对于反应的效率和产物的选择性至关重要。
通常情况下,反应需要在适当的温度和压力下进行,以保证反应的进行和产物的得到。
此外,还原剂的选择也很重要,不同的还原剂可能导致不同的反应路径和产物。
一些常用的还原剂包括氢气、氢化钠和氢化铝等。
甲胺基苯丙酮还原方程的应用广泛。
首先,甲胺基丙酮是一种重要的有机合成中间体,可以被进一步转化为其他有机化合物。
其次,甲胺基丙酮具有药理活性,可以用于合成药物。
此外,甲胺基苯丙酮还可以作为一种重要的化学试剂,在有机合成和药物研发中发挥重要作用。
甲胺基苯丙酮还原方程描述了甲胺基苯丙酮与还原剂反应时产生的产物及化学反应过程。
这个方程涉及到一系列复杂的化学反应步骤,需要在适当的条件下进行。
甲胺基苯丙酮还原方程在有机合成和药物研发领域有广泛的应用,对于合成有机化合物和开发新药物具有重要意义。
苯丙酮与甲胺反应机理

苯丙酮与甲胺反应机理
苯丙酮与甲胺的反应是一个多步骤过程,涉及亲核取代亲电芳
香反应。
反应的机理包括以下步骤:
第一步:苯丙酮质子化
反应起始于苯丙酮的质子化,由甲苯磺酸(TsOH)作为催化剂。
质子化苯丙酮形成共轭酸,即苯丙酮阳离子。
第二步:亲核加成
质子化的苯丙酮阳离子是亲电体,而甲胺是亲核试剂。
甲胺进
攻苯丙酮阳离子,形成四面体中间体。
第三步:脱质子化
四面体中间体不稳定,会发生脱质子化,质子被一个甲胺分子
去除。
脱质子化后,形成imine中间体。
第四步:水解
Imine中间体与水反应,发生水解。
水解反应生成苯丙酮亚胺和甲胺。
第五步:异构化
苯丙酮亚胺自发异构化为更稳定的烯胺,即苯丙烯酰胺。
这个异构化过程是由苯丙烯酰胺的共轭体系的稳定作用驱动的。
总反应方程式:
苯丙酮 + 甲胺→ 苯丙烯酰胺 + 水
反应条件:
苯丙酮与甲胺的反应通常在甲苯或二氯甲烷等无水有机溶剂中进行。
反应需要甲苯磺酸或其他酸性催化剂。
应用:
苯丙酮与甲胺的反应在有机合成中广泛用于合成取代的烯胺。
烯胺是许多天然产物和药物的重要功能基团。
此外,这个反应还可用于合成α-氨基酮,这是药物和精细化学品的重要中间体。
苯丙酮制备之理论知识(一)

苯丙酮制备之理论知识(一)*苯基-1-丙酮和苯基-2-丙酮的区别是什么?苯丙酮属于醛酮类有机化合物, 醛和酮分子中都含有羰基官能团, 它们都是羰基化合物。
在羰基的两端都连有烃基的化合物叫做酮, 羰基碳原子上至少连有一个氢原子的化合物叫做 醛。
可用如下通式表示。
主要性质:它有两种位置异构体,(1)苯基1丙酮(phenyl1propanone),简称苯丙酮又称为 1苯基1丙酮,乙基苯基酮。
为片状晶体或无色液体; 熔点 18.6℃; 沸点 218℃, 135°(8.0kPa),相对密度 1.0996;折射率 1.5269;闪点 87℃。
不溶于水,可溶于醇、醚、苯 和甲苯。
与三氧化铝作用可生成苯甲酸和醋酸,在乙醇中与钠作用可生成乙基苯基甲醇,与 锌加盐酸或氢(加镍)作用生成丙苯。
可由苯在三氯化铝催化下与丙酰氯反应或用三氧化铬 氧化正丙苯制得;因有强烈、持久、愉快的香味, 本品常用作香料和有机合成原料,制取 医药利胆醇和抗癫痫药甲妥因。
(2)苯基2丙酮(phenyl2propanone),简称苯基丙酮(1) (2) 苯基2丙酮:又称为苯基丙酮或苯基2丙酮。
为无色液体;熔点15℃;沸点 216.5℃,101(1.9kPa) ℃ ;相对密度 1.0157;折射率 1.5168。
均不溶于水,能溶于醇、醚、 苯。
有酮的一般化学性质和苯环的亲电取代反应。
可在乙酸钠存在下由苯乙酸与乙酐反应制 得,用于有机合成,制取杀鼠剂敌鼠钠。
*枸椽酸他莫昔芬的知识产权保护情况如何?从中国国家知识产权局网上,查不到枸橼酸他莫昔芬的制备的专利,说明该药的制备已 无专利保护;只能查到枸橼酸他莫昔芬缓释片 、胶囊、分散片、口腔崩解片、微乳外用制 剂等的制备方法。
α-甲胺基苯丙酮合成工艺与机理

一:α-甲氨基苯丙酮盐酸盐的简介:中文名:α-甲氨基苯丙酮盐酸盐(阿尔法-甲氨基苯丙酮盐酸盐)英文名: 1-Propanone,2-(methylamino)-1-phenyl-, hydrochloride (1:1)别名: 1-Propanone,2-(methylamino)-1-phenyl-, hydrochloride1-Propanone,2-(methylamino)-1-phenyl-, hydrochloride,dl-Ephedrone hydrochloride2-(methylamino)-1-phenylpropan-1-one hydrochloride (1:1)分子式:C10H14ClNO分子量: 199.67726CAS号:49656-78-2α-甲氨基苯丙酮盐酸盐(简称MAK)。
a-甲胺基苯丙酮盐酸盐就是2-甲胺基苯丙酮盐酸盐(2-甲氨基苯丙酮盐酸盐)就是邻甲胺基苯丙酮盐酸盐。
价格:2500元/公斤性质描述:白色或类白色结晶性粉。
用途:抗抑郁药氟西汀中间体。
二:α-甲氨基苯丙酮盐酸盐的合成工艺:以α-溴代苯丙酮为原料进行甲胺化反应。
在5000ml的三口烧瓶中,加入90ml甲苯溶液和α-溴代苯丙酮400克.将烧瓶装上搅拌,温度计,升温到80-85度。
在烧瓶另一口装恒压滴液漏斗,恒压滴液漏斗内装10%甲胺水溶液960ml.(其中40%溶液100ml加100ml水得10%甲胺水,甲胺化反应中,改用甲胺水代替甲胺盐或甲胺气体,使反应温度降低,条件温和。
),水浴温度恒温,在80-85℃,开动搅拌,搅拌速度控制为90-100转/分,缓慢滴加甲胺,温度控制在80度,时间大约90分钟。
甲胺加入后,在恒压滴液漏斗内装用450克碱配置的15%的溶液(450g+水2550ml),烧碱不要放多了。
安装好装上回流装置。
升温加热回流,温度开始在85度,随甲胺减少,温度提高到88度,加毕反应24小时,停止加热,冷至零下15。
(3)α甲基β二甲氨基苯丙酮盐酸盐
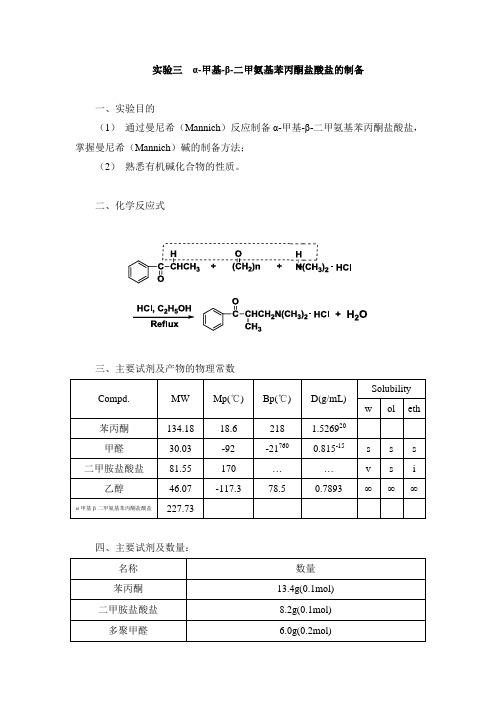
实验三α-甲基-β-二甲氨基苯丙酮盐酸盐的制备一、实验目的(1)通过曼尼希(Mannich)反应制备α-甲基-β-二甲氨基苯丙酮盐酸盐,掌握曼尼希(Mannich)碱的制备方法;(2)熟悉有机碱化合物的性质。
二、化学反应式三、主要试剂及产物的物理常数四、主要试剂及数量:五、操作步骤:(1)仪器的安装:①在250毫升锥形瓶上安装球形冷凝管。
采用电热套加热。
②在内置有250mL茄形瓶上,安装蒸馏头,依次连接直形冷凝管、双支真空接收管和茄形瓶。
采用集热式磁力搅拌器搅拌并加热。
(2)α-甲基-β-二甲氨基苯丙酮盐酸盐的制备:在250毫升锥形瓶中,加入苯丙酮、多聚甲醛、二甲胺盐酸盐、75 mL乙醇和2 mL盐酸(1),回流5小时。
将反应液转移至250mL茄形瓶中,沸水浴加热,常压蒸馏大部分乙醇(2)(3),稍降温后,用水泵减压蒸尽剩余的乙醇。
冷却,溶液将有白色结晶析出,抽滤,滤饼用无水丙酮洗涤(4),压干。
产物(5)在真空干燥器里干燥至恒重称重,计算产量和产率(6)。
本实验约需12学时。
六、注意事项(1)加入2mL盐酸回流一个小时后,若多聚甲醛没有全部解聚,可以再加入1mL盐酸,以促进其解聚;反应初期加热温度不要过高,回流的速度应缓慢,防止甲醛解聚过快而造成挥发。
(2)蒸馏乙醇时,用沸水浴为宜,可防止温度过高,使产物分解。
(3)α-甲基-β-二甲氨基苯丙酮盐酸盐易溶于水,因此应注意无水操作。
(4)无水丙酮洗涤α-甲基-β-二甲氨基苯丙酮盐酸盐的目的主要是除去没有反应的苯丙酮。
(5)α-甲基-β-二甲氨基苯丙酮盐酸盐干燥前有机溶剂残留量约为50%。
(6)α-甲基-β-二甲氨基苯丙酮乙醚溶液的制备:【原理】【方法】将α-甲基-β-二甲氨基苯丙酮盐酸盐置于烧杯中,加入20 mL水溶解。
滴加20%氢氧化钠溶液至pH>12。
用乙醚萃取,每次25mL,共3次,合并乙醚萃取液,用20mL水洗1次,转移到干燥的250 mL锥形瓶中,用无水硫酸镁干燥,即得。
apvp制造技术原理 -回复

apvp制造技术原理-回复APVP制造技术原理APVP(a-pyrrolidinopentiophenone),也被称为α-PVP,是一种合成药物,属于合成苯丙胺类兴奋剂。
它曾被广泛滥用作毒品,因其强烈的致幻和兴奋效果,具有高度的成瘾性和危险性。
本文将详细介绍APVP的制造技术原理,一步一步回答中括号内的主题。
首先,我们需要了解APVP的化学结构和组成。
APVP的化学结构类似于其他合成苯丙胺类药物,如MDPV(methylenedioxypyrovalerone)。
它由一个吡咯烷环与一个苯丙胺结构连接而成,其中吡咯烷环上含有硫醇基团(thioether group)。
这种硫醇基团可以增强药物的生物活性和药效。
APVP的制造过程通常包括四个主要步骤:前体制备、反应合成、纯化和结晶、最后的处理。
第一步是前体制备。
前体物是合成APVP的基础,通常使用易得的原料进行合成。
最常用的前体物之一是piperidine。
通过对piperidine进行反应,我们可以将其转化为2-bromovalerophenone,这是APVP合成的关键前体。
第二步是反应合成。
2-bromovalerophenone是制备APVP的起始物质。
它与硫醇(通常是硫醇酸盐)反应形成硫醇醚中间体。
这个中间体进一步进行胺反应或芳香烃反应,形成APVP的最终产物。
在这个合成过程中,需要使用一种强碱(如氢氧化钠或碳酸钠)来中和反应中生成的酸性物质。
这可以保持反应体系的酸碱平衡,并促进药物的形成。
第三步是纯化和结晶。
在反应结束后,产生的混合物中通常还含有许多杂质和未反应的起始物质。
为了得到高纯度的APVP,需要对混合物进行纯化。
这可以通过多种技术实现,如萃取、晶体化、冷冻干燥等。
最后一步是最后的处理。
在纯化和结晶完成后,得到的APVP晶体需要经过充分的干燥和处理,以去除所有的溶剂和杂质。
这可以通过真空干燥、高温处理或其他化学处理方法来完成。
需要明确指出的是,APVP的制造是一种非法活动,违反了多个国家和地区的法律规定。
丙酮的生产工艺论文怎么写

丙酮的生产工艺论文怎么写丙酮是一种备受关注的重要化学品,广泛应用于各个领域,如药品、塑料制品、溶剂等。
本文将对丙酮的生产工艺进行探讨,包括工艺流程、主要原料、催化剂、反应条件等方面。
一、丙酮的工艺流程目前,丙酮的主要生产工艺分为两种:空气氧化法和胺脱羧法。
空气氧化法是指将煤焦油或石油馏分经过分馏后,将丙烯和氧气在铬铝钾催化剂的作用下进行氧化反应,生成丙酮。
胺脱羧法是指将异丙醇通过催化剂在高温下脱羧,生成丙酮。
1.空气氧化法的工艺流程空气氧化法生产丙酮的工艺流程可以分为三个步骤:制备丙烯、氧化反应和分离纯化。
制备丙烯:煤焦油或石油馏分在加热和分解过程中,生成的丙烯与蒸汽混合,通过分馏将丙烯分离出来。
氧化反应:将丙烯和氧气在铬铝钾催化剂的作用下进行氧化反应,生成丙酮和二氧化碳。
分离纯化:反应后的混合气体经过处理,将丙酮和二氧化碳分离出来。
最后,通过蒸馏法、萃取法等工艺将丙酮纯化得到高纯度的丙酮产品。
2.胺脱羧法的工艺流程胺脱羧法生产丙酮的工艺流程也可以分为三个步骤:制备异丙醇、脱羧反应和纯化。
制备异丙醇:将乙烯和丙烯通过加氢反应制备得到异丙醇。
脱羧反应:将异丙醇通过催化剂在高温下脱羧反应,生成丙酮和氨。
纯化:将反应后的混合物通过萃取、蒸馏等工艺将丙酮纯化得到高纯度的丙酮产品。
二、丙酮的主要原料根据上述的生产工艺流程,空气氧化法的主要原料是煤焦油或石油馏分和氧气,而胺脱羧法的主要原料是乙烯、丙烯和异丙醇。
这些原料质量的好坏会直接影响丙酮的纯度和产量。
三、催化剂铬铝钾是空气氧化法中常用的催化剂,其具有高催化活性和选择性,能够促进丙烯和氧气的氧化反应。
胺脱羧法中常用的催化剂是银和钒,其可使异丙醇在高温下脱羧反应,生成丙酮和氨。
四、反应条件空气氧化法中的反应条件主要包括温度、氧化剂、催化剂和反应时间等方面。
温度通常控制在100~200之间,氧气的用量和催化剂的选取也会影响反应的效果。
胺脱羧法中,反应温度一般在300~400,反应时间较短,只需几秒钟至几分钟不等。
几种合成苯基丙酮常见路线简介

路线1:苯乙腈合成苯基丙酮简介:本反应是一个在有机碱性环境下苯乙腈的α位置的精细化工反应,产量较高。
通过加热醇钠离解成金属钠离子,拔掉苯乙腈的α氢形成苯乙腈α碳负离子,再和乙酸乙酯的羰基碳发生亲核加成,最后中间态的C-O键极化断裂生成α-苯乙酰乙腈和乙醇。
α-苯乙酰乙腈因为β位是羰基,水解很快就成酰胺,然后加水稀释硫酸浓度,继续煮,变成羧酸,再煮,脱羧,机理是六元环过渡态。
反应的关键是时间和反应程度上要控制好,及时保持主反应平衡向右,否则动力学上倾向于副产物。
本工艺原料易得,价格便宜,成本低,操作简单,无苛刻反应要求,易于工业化,是最经济划算的方法。
路线2:苯基-2-硝基丙烯内夫反应合成苯基丙酮简介:在此制备过程中,苯基-2-硝基丙烯与硼氢化钠在甲醇中还原为苯基-2-硝基丙烷,然后用过氧化氢和碳酸钾水解硝基,进行多种内夫反应。
本发明的制备方法为一锅法合成,不分离中间体。
这种合成方法不适用于环取代的苯基-2-硝基丙烯,因为当环上存在给电子取代基时,侧链容易被氧化。
另一种方法是使用二氯化铬作为还原剂,将苯基-2-硝基丙烯还原为苯基丙酮,80%产率。
路线3:2-苯基丙醛重排合成苯基丙酮简介:2-苯丙醛可与氯化汞或硫酸重排,形成异构的苯基丙酮。
2-苯基丙醛(水合醛)是香料工业中使用的一种不可替代的工业化学品。
2-苯丙醛也可以由α-甲基苯乙烯制成。
2-苯基丙醛的cas编号为[93-53-8],其同义词包括水合醛、2-苯基丙醛、异丙醛、α-甲基苯乙醛和α-甲基苯乙醛。
沸点92-94°C/12mmHg,222°C/760mmHg。
还有其他的方法可以进行这种重排,2-苯基丙醛在500℃下通过铁沸石催化剂床上的蒸汽,然后蒸汽冷凝和再蒸馏p2p,异构化为苯基-2-丙酮,产率高达87%。
即使下面使用氯化汞的方法比使用冷硫酸的方法产量更高,我也绝对推荐使用硫酸的方法,因为它使用成本更低,对你的健康和环境都没有灾难性的影响。
甲胺基苯丙酮还原方程

甲胺基苯丙酮还原方程1. 引言甲胺基苯丙酮(也称为MDP2P)是一种有机化合物,它在化学和药物领域中具有重要的应用。
研究甲胺基苯丙酮的还原方程是为了深入了解它的反应性质和可能的合成路径。
本文将分析甲胺基苯丙酮还原方程的主要反应过程,并对其在合成和应用方面的潜力进行讨论。
2. 甲胺基苯丙酮的结构和性质甲胺基苯丙酮是一种有机酮化合物,其结构中包含苯环和一个丙酮基团。
它的化学式为C10H11NO,分子量为161.20 g/mol。
甲胺基苯丙酮是无色液体,在常温下呈沸点较低的液体,可溶于许多有机溶剂。
它具有一定的毒性,并被列为受控物质。
3. 甲胺基苯丙酮还原的反应机制甲胺基苯丙酮的还原反应是通过添加还原剂将其转化为相应的醇衍生物。
常用的还原剂包括金属钠、锂铝氢化物(LiAlH4)和邻苯二甲酸酐。
以下是甲胺基苯丙酮还原的可能反应机制:1.第一步:还原剂与甲胺基苯丙酮发生反应,生成相应的醇衍生物中间体。
2.第二步:中间体经过进一步的化学转化,还原为相应的醇化合物。
3.第三步:通过水解,醇化合物转化为相应的醛或醚。
4. 甲胺基苯丙酮还原的合成应用甲胺基苯丙酮的还原反应具有广泛的合成应用,其中一些重要的应用领域包括:4.1 药物合成甲胺基苯丙酮的还原反应在药物合成中具有重要地位。
许多药物的合成路径中都涉及到对甲胺基苯丙酮的还原。
例如,MDMA(摇头丸)的合成中,甲胺基苯丙酮是一个重要的中间体。
此外,还原反应也可用于合成其他具有药理活性的化合物,如抗癌药物和抗生素。
4.2 化学研究甲胺基苯丙酮的还原反应在化学研究中也具有重要的应用。
它可以作为一个模型化合物,用于研究还原反应的机制和动力学性质。
通过对该反应的研究,我们可以深入了解还原反应的条件、影响因素和可能的副反应路径。
4.3 催化剂研究甲胺基苯丙酮的还原反应也用于研究催化剂的性能和活性。
不同的催化剂可以对该反应的选择性和产率产生不同的影响。
通过研究甲胺基苯丙酮的还原反应,我们可以评估和优化催化剂的性能,从而提高反应的效率和选择性。
最新几种合成苯基丙酮常见路线简介

路线1:苯乙腈合成苯基丙酮简介:本反应是一个在有机碱性环境下苯乙腈的α位置的精细化工反应,产量较高。
通过加热醇钠离解成金属钠离子,拔掉苯乙腈的α氢形成苯乙腈α碳负离子,再和乙酸乙酯的羰基碳发生亲核加成,最后中间态的C-O键极化断裂生成α-苯乙酰乙腈和乙醇。
α-苯乙酰乙腈因为β位是羰基,水解很快就成酰胺,然后加水稀释硫酸浓度,继续煮,变成羧酸,再煮,脱羧,机理是六元环过渡态。
反应的关键是时间和反应程度上要控制好,及时保持主反应平衡向右,否则动力学上倾向于副产物。
本工艺原料易得,价格便宜,成本低,操作简单,无苛刻反应要求,易于工业化,是最经济划算的方法。
路线2:苯基-2-硝基丙烯内夫反应合成苯基丙酮简介:在此制备过程中,苯基-2-硝基丙烯与硼氢化钠在甲醇中还原为苯基-2-硝基丙烷,然后用过氧化氢和碳酸钾水解硝基,进行多种内夫反应。
本发明的制备方法为一锅法合成,不分离中间体。
这种合成方法不适用于环取代的苯基-2-硝基丙烯,因为当环上存在给电子取代基时,侧链容易被氧化。
另一种方法是使用二氯化铬作为还原剂,将苯基-2-硝基丙烯还原为苯基丙酮,80%产率。
路线3:2-苯基丙醛重排合成苯基丙酮简介:2-苯丙醛可与氯化汞或硫酸重排,形成异构的苯基丙酮。
2-苯基丙醛(水合醛)是香料工业中使用的一种不可替代的工业化学品。
2-苯丙醛也可以由α-甲基苯乙烯制成。
2-苯基丙醛的cas编号为[93-53-8],其同义词包括水合醛、2-苯基丙醛、异丙醛、α-甲基苯乙醛和α-甲基苯乙醛。
沸点92-94°C/12mmHg,222°C/760mmHg。
还有其他的方法可以进行这种重排,2-苯基丙醛在500℃下通过铁沸石催化剂床上的蒸汽,然后蒸汽冷凝和再蒸馏p2p,异构化为苯基-2-丙酮,产率高达87%。
即使下面使用氯化汞的方法比使用冷硫酸的方法产量更高,我也绝对推荐使用硫酸的方法,因为它使用成本更低,对你的健康和环境都没有灾难性的影响。
甲基苯丙胺合成工艺技术的解析论述[详实参考]
![甲基苯丙胺合成工艺技术的解析论述[详实参考]](https://img.taocdn.com/s3/m/5f3b0b930408763231126edb6f1aff00bed570b8.png)
一:甲基苯丙胺的合成路线介绍:甲基苯丙胺因其结构简单,所以合成路线比较多,常见的共有两类六条路线,分别是以麻黄素或者伪麻黄素为原料的四条合成路线和以苯基丙酮为原料的两条合成路线。
其他很多路线都是不常用的。
二:以麻黄素为原料的合成路线:以麻黄素为原料合成甲基苯丙胺是合成甲基苯丙胺的传统路线,也是制造甲基苯丙胺最常用的方法之一。
以麻黄素为原料合成甲基苯丙胺通常有四条常见路线,每条合成路线均涉及到麻黄素分子中羟基的氢化。
路线一:Nagai方法,麻黄素在碘,红磷作用下生成甲基苯丙胺。
碘和红磷先生成氢碘酸,氢碘酸中的碘取代麻黄素中的羟基,碱性条件下脱碘生成甲基苯丙胺。
因这条合成路线所需原料,试剂成本较低,对操作者要求不高,所以该方法是传统从麻黄素合成甲基苯丙胺路线中最经典的方法和最常采用的方法。
路线二:Birch还原法,麻黄素在液氨,锂或者钠作用下生成甲基苯丙胺。
由于金属钠非常活泼,且难获得,因此常用一次性锂电池中的金属锂代替金属钠。
但是Birch还原法是极其危险的,因为碱金属和液氨都有极高的反应性。
而且当加入反应物的时候,液氨的温度使其极易爆沸。
又因为其合成路线短,所以这是一条日渐使用普遍使用的方法。
路线三:Emde方法,麻黄素在氯化亚砜或者三氯氧磷作用下1-氯-1-苯基-2-甲氨基丙烷(又称氯麻黄素)经氢和钯共同还原作用下生成甲基苯丙胺。
该方法在合成的过程中不仅要用到强氧化剂,且要用到易燃易爆的氢气和价格昂贵的钯催化剂,因此该路线不仅操作难度大且成本昂贵,实验的操作者需要有较高的有机合成基础。
路线四:Rosenmund方法,麻黄素在高氯酸作用下生成1-氯-1-苯基-2-甲氨基丙烷,经氢和钯共同还原作用下生成甲基苯丙胺。
该方法与路线三相似,只是氧化剂为高氯酸,也要用到易燃易爆的氢气和价格昂贵的钯催化剂,因此该路线操作难度也大且成本昂贵,实验的操作者需要有较高的有机合成基础。
以麻黄素为原料的合成路线最重要的原料就是麻黄素,麻黄素的来源主要分为以下三种途径:途径一:从植物麻黄中提取。
苯丙酮与甲胺反应机理

苯丙酮与甲胺反应机理下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!苯丙酮与甲胺反应是有机化学中一个重要的反应,该反应可以产生出丙酮胺。
左旋α-甲胺苯丙酮的制备及拆分剂重复使用方法[发明专利]
![左旋α-甲胺苯丙酮的制备及拆分剂重复使用方法[发明专利]](https://img.taocdn.com/s3/m/7c49e75b7f21af45b307e87101f69e314332fa13.png)
[19]中华人民共和国国家知识产权局[12]发明专利申请公开说明书[11]公开号CN 1265391A[43]公开日2000年9月6日[21]申请号00100412.3[21]申请号00100412.3[22]申请日2000.01.31[71]申请人李健府地址100011北京市西城区六铺坑一区一号中国化工新材料总公司共同申请人杨荣杰 余启生 肖刚[72]发明人李健府 杨荣杰 余启生 肖刚 [51]Int.CI 7C07C 225/16C07C 221/00//C0 7M7:00权利要求书 1 页 说明书 3 页[54]发明名称左旋α-甲胺苯丙酮的制备及拆分剂重复使用方法[57]摘要本发明是用左旋樟脑磺酸拆分外消旋甲胺苯丙酮,以水作为溶剂,直接得到左旋甲胺苯丙酮盐。
将此盐溶于水,加入等当量氨水和有机溶剂。
从有机溶剂中得到左旋甲胺苯丙酮。
向母液中加硫酸,除去无机盐硫酸氨。
拆分后的母液加入等当量的氨水,加热消旋后,加入等相量的硫酸,可除去无机盐硫酸氨,母液进一步再拆分。
00100412.3权 利 要 求 书第1/1页 1、一种左旋α-甲胺苯丙酮的制备方法,所说α-甲胺苯丙酮为用左旋樟脑磺酸作为拆分剂,用水作溶剂拆分外消旋甲胺苯丙酮,加热溶解,冷却结晶,得到左旋甲胺苯丙酮盐。
将所得盐溶于水中,加入与水不相溶的有机溶剂(如甲苯、氯彷、乙醚)中,向其加入等当量氨水,将水层和有机层分离,有机溶剂减压蒸去,得到左旋甲胺苯丙酮,水溶液减压蒸去,得左旋樟脑磺酸氨盐。
2、根据权利要求1所述,所得左旋樟脑磺酸氨盐溶于水中,加入等当量硫酸或盐酸。
浓缩到一定程度。
冷却到室温,结晶出无机盐硫酸氨或氯化氨,过滤除去无机盐,母液为左旋樟脑磺水溶液,用于循环使用。
3、根据权利要求1所述,将拆分后所得母液加入等当量的氨水,加热到20-50度,待消旋完成后,加入氨水等当量的硫酸或盐酸。
浓缩到一定程度,冷却到20-50度,结晶出无机盐,过滤除去无机盐,母液进一步冷却到0-10度,结晶出左旋甲胺苯丙酮左旋樟脑磺酸盐。
苯丙胺的制备方法与流程

苯丙胺的制备方法与流程本发明涉及苯丙胺的制备技术领域,特别涉及一种苯丙胺的制备方法。
背景技术:苯丙胺,又叫做苯基乙丙胺、α-甲基苯乙胺等,分子式为C9H13N,相对分子量135.21。
为无色油状液体,味辛辣,气味淡薄。
苯丙胺可引起深度精神作用,包括警觉性、主动性和信心提高,欣快感、疲劳感减低,语言增多,以及集中注意力的能力增强。
苯丙胺在饭前食用可降低食欲,所以广泛用来辅助限食以进行减肥。
飞行员、卡车驾驶员和士兵在执行要求长时间保持清醒状态的任务时常使用本药。
在治疗多动症方面,苯丙胺也起了主要作用,因为本药服用一天之后就可使患儿镇静,使他们能集中注意力。
苯丙胺还用于治疗发作性睡眠症。
由于苯丙胺在药物上的广泛使用,苯丙胺的纯度对于疾病的治疗至关重要。
然而,目前在利用苯基丙酮生产苯丙胺的过程中,工艺流程设置不合理,导致生产出的苯丙胺纯度较低,一般为80~85%。
因此急需对苯丙胺的生产工艺进行优化,已实现高纯度的苯丙胺的生产。
技术实现要素:本发明意在提供一种苯丙胺的制备方法,以实现高纯度的苯丙胺的生产。
本方案中的苯丙胺的制备方法,包括以下步骤:a、向搪瓷反应釜中加入甲酸铵,然后向搪瓷反应釜的夹套内通入130~150℃的热油,使甲酸铵成为熔融液;b、将甲酸铵熔融液加热至170~175℃,然后滴加苯基丙酮形成混合液,苯基丙酮与甲酸铵间的摩尔比为1:1.2;c、混合液中的甲酸铵和苯基丙酮在170~175℃下反应3~3.5h 得到反应液;然后通冷油使反应液的温度降至40℃;d、向降温后的反应液中加入浓度为10%的盐酸使反应液呈中性;e、将加入盐酸后的反应液加热至170~180℃反应3~3.5h得到二次反应液,然后将二次反应液降温至40℃;f、向降温后的二次反应液中加入浓度为20%的氢氧化钠溶液得到碱性液,碱性液的pH为11;g、将碱性液静置分层,取出上层的油液,并使用三氯乙烯萃取下层盐液内的苯丙胺得到萃取液,将萃取液与油液合并得到合并液;h、使用88℃的温度对合并液进行蒸馏,蒸出三氯乙烯后再对合并液进行减压蒸馏得到苯丙胺,减压蒸馏的温度为90~120℃,压力为2.6KPa。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一:α-甲氨基苯丙酮盐酸盐的简介:
中文名:α-甲氨基苯丙酮盐酸盐(阿尔法-甲氨基苯丙酮盐酸盐)
英文名: 1-Propanone,2-(methylamino)-1-phenyl-, hydrochloride (1:1)
别名: 1-Propanone,2-(methylamino)-1-phenyl-, hydrochloride
1-Propanone,2-(methylamino)-1-phenyl-, hydrochloride,
dl-Ephedrone hydrochloride
2-(methylamino)-1-phenylpropan-1-one hydrochloride (1:1)
分子式:C10H14ClNO
分子量: 199.67726
CAS号:49656-78-2
α-甲氨基苯丙酮盐酸盐(简称MAK)。
a-甲胺基苯丙酮盐酸盐就是2-甲胺基苯丙酮盐酸盐(2-甲氨基苯丙酮盐酸盐)就是邻甲胺基苯丙酮盐酸盐。
价格:2500元/公斤
性质描述:白色或类白色结晶性粉。
用途:抗抑郁药氟西汀中间体。
二:α-甲氨基苯丙酮盐酸盐的合成工艺:以α-溴代苯丙酮为原料进行甲胺化反应。
在5000ml的三口烧瓶中,加入90ml甲苯溶液和α-溴代苯丙酮400克.将烧瓶装上搅拌,温度计,升温到80-85度。
在烧瓶另一口装恒压滴液漏斗,恒压滴液漏斗内装10%甲胺水溶液960ml.(其中40%溶液100ml加100ml水得10%甲胺水,甲胺化反应中,改用甲胺水代替甲胺盐或甲胺气体,使反应温度降低,条件温和。
),水浴温度恒温,在80-85℃,开动搅拌,搅拌速度控制为90-100转/分,缓慢滴加甲胺,温度控制在80度,时间大约90分钟。
甲胺加入后,在恒压滴液漏斗内装用450克碱配置的15%的溶液(450g+水2550ml),烧碱不要放多了。
安装好装上回流装置。
升温加热回流,温度开始在85度,随甲胺减少,温度提高到88度,加毕反应24小时,停止加热,冷至零下15。
然后加入氢氧化钠溶液180毫升,搅
拌静置过夜。
刚开始溶液是浑浊的白色的。
后来有像油状的东西沉淀了,用玻璃棒刮一下烧杯壁,有油状物产生就搅拌,上层溶液是黄黄的,下边有油状的东西了。
溴代苯丙酮与甲胺溶液再有机溶剂甲苯里
发生了SN2亲核取代反应,如果产物很少或基本没有,可能是甲胺水溶液自身碱性不足,也可能是你甲胺水溶液加的当量不够多,如果你不加其他碱的话,你得甲胺水溶液需要两倍量。
也可以考虑加点强一点的碱,如氢氧化钠等,一般我们都是在碱性条件下反应。
有人问为什么不是先加氢氧化钠溶液再加甲胺溶液呢?先加氢氧化钠溶液
可以去除杂质又可以防止HBr冒出来,多好啊。
其实我告诉你先加氢氧化钠会增大OH-离子浓度,与后加入的甲胺形成亲核竞争,有可能形成羟基取代的副产物。
其次,甲胺应该是过量的吧,与HBr生成甲胺氢溴酸盐,所以不用担心HBr逸出的问题。
反应完毕,加氢氧化钠生成溴化钠,可以游离出甲胺,方便蒸馏回收甲胺。
有人也认为甲胺与氢氧化钠应该是同时加,随着反应进行,甲胺浓
度减少必须加入一定量的碱才能使与溴代苯丙酮完全反应。
反应结束后分出水层,用甲苯洗涤萃取水相两次,合并甲苯层有机相,用温水洗涤甲苯层4次。
无水硫酸钠干燥,抽滤一次,得α-甲胺基苯丙酮的甲苯溶液。
有机相α-甲胺基苯丙酮的甲苯溶液中滴加36%盐酸调PH 到2,搅拌72小时过夜。
分出水相,下面的那层。
减压蒸馏得糖浆状(浓缩温度一般为80度到85度,温度过高会导致出现焦油状的液体,副产品增加,主产品产量很低)。
加奈烷振摇除杂,用奈烷洗涤一下,加热一下,然后加入一些低极性的溶剂,比如乙醚什么的,或者冷却静置一夜,抽滤或过滤,滤出粉末固体物即为α-甲胺基苯丙酮的盐酸盐(α-甲氨基苯丙酮不稳定,成品成盐酸盐,用丙酮来析出晶体是很关键的。
有的时候是像红糖状一样的晶体,有的是时候发黄的晶体,有的时候是白色的晶体,无论哪种都没有关系)。
如果买不到要求的溶剂,只能买到四氢呋喃,做出来的东西(α-甲氨基苯丙酮盐酸盐)都是红色的,想要做出
白色的粉末,必须要除一道杂质,这就需要用到丙酮。
每生产一次,我们整个车间会全速运转,满屋子都摆着40cm×60cm的不锈钢托盘,刚刚生产出来的α-甲氨基苯丙酮盐酸盐由于是湿的,必须在托盘里放阴凉处晾干。
如果收率不高,原因可能是α-甲胺基酮本身不是很稳定,而且在酸、碱或加热的情况下,羰基比较容易烯醇化,使得发生了副反应。
溴代这个基本上不是很难,难点不在氨化上,加了酸成盐之后,最好有个真空度够强的机子用旋转蒸发仪来扩大蒸发
的表面积,再低温蒸发就能避免聚合。
母液减压蒸馏,再加奈烷静置一夜,抽滤或过滤,滤出粉末固体物。
合并两次粉末固体约50克。
加盐酸后溶液也分成两层,蒸发后就拿下来是棕褐色(有的看着也比较黑)很粘的,如果产生的是棕褐色糖浆状物,就加入甲醇盐酸溶液,充分震荡,旋转蒸发,除去大部分甲醇,冷却析出结晶。
冷却后凝固了,等干了就不粘了,里面就有块壮。
加奈烷就融化了,这是正常的。
后面我们选用KBH4,在甲醇溶液中将溴代苯丙酮的羰基进行还
原,再在甲氨水溶液中进行反应。
经过分离纯化得到了混合麻黄碱,收率如果不高,原因可能是:KBH4的还原性活性还不够强,得到的溴代物有可能水解。
由于傅克反应和溴代反应均以苯为溶剂,如果甲胺化也用苯为溶剂,三步反应可采用“一锅合成法”,省去了许多分离步骤,也可避免刺激性的化合物2-溴-1-苯基-1-丙酮外泄。
甲胺水溶液比甲胺气体使用方便,价格较便宜,是符合工业化要求的选择。
甲胺反应中每取代一个溴原子,必有一分子HBr生成,消耗一分子甲胺,需用碱(缚酸剂)释放甲胺,以便反应继续进行。
甲胺本身是碱,可作为缚酸剂,但比用NaOH作缚酸剂的平均收率要低。
氢氧化钠作为缚酸剂。
加快甲胺化反应,减少副反应发生。
在制备2-甲胺基-1-苯基-1-丙酮的过程中,体系呈碱性,所以反应中存在着2-溴-1-苯基-1-丙酮的水解和甲胺化的竞争,而2-溴-1-苯基-1-丙酮的溴原子受羟基的活化,反应性较强,局部碱性稍大,便会导致水解程度上升。
因此应控制甲胺水溶液和Na0H水溶液的加入
速度,加快搅拌速率,使局部和体系的碱性不致于迅速上升。
TLC显示,如果技术
qq2681708947内将甲胺水溶液及NaH0溶液滴加完毕,2-溴-1-苯基-1-丙酮的水解程度比在30min内滴完要大许多。
但缚酸剂NaOH 的碱性比甲胺要强,会不会导致2-溴-1-苯基-1-丙酮水解程度上升。
其实,在搅拌速度较快且Na0H滴加速率较慢情况下,如果搅拌速度和Na0II滴加速度配合适当,应该不会使化合物2-溴-1-苯基-1-丙酮的水解率上升。
