利巴韦林注射液验证方案
利巴韦林注射液中间产品含量快速测定方法

利巴韦林注射液中间产品含量快速测定方法作者:肖七琪周其超张悦来源:《科技视界》 2013年第9期肖七琪周其超张悦(西南药业股份有限公司,中国重庆 400038)【摘要】目的:寻找简单快捷的方法测定利巴韦林注射液的含量。
方法:利用利巴韦林含有—OH、—NH2基团的化合物,为N—à跃进,从结构确定有紫外吸收,采用紫外分光光度法测定其含量。
结果:采用紫外分光光度法测定结果在206nm处的吸收度和含量呈良好的线性关系,标准曲线为:C=21.42A-0.5231,线性范围2~20μg/ml,RSD=0.59%。
结论:本法简便、准确,可用于利巴韦林注射液含量的测定。
【关键词】利巴韦林;氮测定法;紫外分光光度法利巴韦林注射液(1ml:100mg)是由利巴韦林和药用炭配制成的水溶性溶液。
利巴韦林是一种广谱抗病毒药,具有抑制呼吸道合胞病毒、流感病毒、甲肝病毒、腺病毒等多种病毒生长的作用。
在当前流感盛行的时期,利巴韦林注射液发挥了很大的作用。
为了保证药品质量,生产车间需对该药品实施中间产品监控,对产品含量、pH值和颜色进行测定,2010版《中国药典》规定利巴韦林注射液的检测方法为高效液相检测法。
由于高效液相色谱仪价格高昂,如果没购买该设备,就无法对中间产品实行质量控制,所以仍选用原有的氮测定法,而氮测定法方法操作较复杂,测定一份样需要1.5小时,由于利巴韦林注射液市场需求量大,而现在每晚2个批次投产,平行检测两次,需要6小时左右,无法满足生产需要,因此本研究拟探索一种通过紫外分光光度法,快速测定利巴韦林中间产品含量的新方法。
1仪器与试药UV—2401PC型紫外分光光度计(日本岛津),电子天平(sartotius)利巴韦林(广东肇庆星湖制药有限公司、10kg/桶、含量99.8%、原料批号L080102),注射用水(自制)。
2 试验方法2.1 溶液的制备2.1.1 对照品的制备精密称取利巴韦林对照品100mg,置100ml量瓶中,加水溶解并稀释至刻度,摇匀。
反相高效液相色谱法测定利巴韦林注射液的含量和有关物质

反相高效液相色谱法测定利巴韦林注射液的含量和有关物质吴宏富;刘放
【期刊名称】《安徽医药》
【年(卷),期】2009(013)001
【摘要】目的建立了利巴韦林注射液的含量及有关物质测定的RP-HPLC方法.方法采用Hypersil C18(4.6 mm×250 mm,10μm)色谱柱,水为流动相,检测波长:207 nm.结果利巴韦林在20.26~80.96mg·L-1浓度范围内,峰面积与浓度呈良好线性关系(r=0.999 8),平均回收率为98.97%~101.10%,RSD:0.48%~1.53%.利巴韦林及其有关物质得到基线分离,方法的最低检测量为2.5 ng,控制总杂质量不得过
1.0%.结论本法测定利巴韦林注射液的含量及有关物质,方法简便、快速、结果准确,专属性好,适用于利巴韦林及其制剂的质量控制.
【总页数】3页(P31-33)
【作者】吴宏富;刘放
【作者单位】浙江省庆元县中医院,浙江,庆元,323800;浙江省医学科学院药物研究所,浙江,杭州,310013
【正文语种】中文
【中图分类】R9
【相关文献】
1.反相高效液相色谱法测定利巴韦林注射液的有关物质 [J], 吴宏富;刘放
2.反相高效液相色谱法测定利巴韦林注射液的含量 [J], 吴宏富;刘放
3.反相高效液相色谱法测定富马酸替诺福韦二吡呋酯原料药7种有关物质含量 [J], 朱跃芳;姚亮元;林芳;陈珉珉;朱婧
4.反相高效液相色谱法测定尼尔雌醇原料及片剂的有关物质和含量 [J], 孙婷;张菁;刘云;姜建国;王柳;乔晓宁
5.用反相高效液相色谱法测定克林霉素磷酸酯注射液中克林霉素及有关物质含量的效果分析 [J], 董宏伟;李新军;王晓光
因版权原因,仅展示原文概要,查看原文内容请购买。
利巴韦林注射液中间产品含量快速测定方法

Science &Technology Vision 科技视界利巴韦林注射液(1ml:100mg)是由利巴韦林和药用炭配制成的水溶性溶液。
利巴韦林是一种广谱抗病毒药,具有抑制呼吸道合胞病毒、流感病毒、甲肝病毒、腺病毒等多种病毒生长的作用。
在当前流感盛行的时期,利巴韦林注射液发挥了很大的作用。
为了保证药品质量,生产车间需对该药品实施中间产品监控,对产品含量、pH 值和颜色进行测定,2010版《中国药典》规定利巴韦林注射液的检测方法为高效液相检测法。
由于高效液相色谱仪价格高昂,如果没购买该设备,就无法对中间产品实行质量控制,所以仍选用原有的氮测定法,而氮测定法方法操作较复杂,测定一份样需要1.5小时,由于利巴韦林注射液市场需求量大,而现在每晚2个批次投产,平行检测两次,需要6小时左右,无法满足生产需要,因此本研究拟探索一种通过紫外分光光度法,快速测定利巴韦林中间产品含量的新方法。
1仪器与试药UV—2401PC 型紫外分光光度计(日本岛津),电子天平(sartotius)利巴韦林(广东肇庆星湖制药有限公司、10kg/桶、含量99.8%、原料批号L080102),注射用水(自制)。
2试验方法2.1溶液的制备2.1.1对照品的制备精密称取利巴韦林对照品100mg,置100ml 量瓶中,加水溶解并稀释至刻度,摇匀。
再精密量取1ml,置100ml 量瓶中,加水稀释至刻度,摇匀,即得。
2.1.2供试品的制备精密量取利巴韦林注射液(1ml:100mg)1ml 置100ml 量瓶中,加水溶解并稀释至刻度,摇匀,再精密量取1ml 置100ml 量瓶中,加水至刻度,摇匀,即得。
2.1.3标准曲线的制备精密称取经105℃干燥至恒重的利巴韦林对照品100mg,置100mL 量瓶中,加注射用水溶解并稀释至刻度,精密取稀释液0.2ml,0.4ml,0.8ml,1.0ml,1.6ml,2.0ml,置100ml 容量瓶,加蒸馏水稀释至刻度,摇匀,即得浓度为2.0μg/ml,4.0μg/ml,8.0μg/ml,10μg/ml,16μg/ml,20μg/ml 的利巴韦林对照品溶液(标准储备液)。
HPLC法测定利巴韦林注射液中利巴韦林含量的不确定度评定

HPLC法测定利巴韦林注射液中利巴韦林含量的不确定度评定魏丹琦;修虹;王勇
【期刊名称】《海峡药学》
【年(卷),期】2005(17)3
【摘要】目的建立HPLC单点测定方法的不确定度评定.方法依据JJF1059-1999建立数学模型,合成不确定度.结果通过对实验过程不确定度因数的分析,确定不确定度分量,合成不确定度.结论本评定方法适用于日常HPLC单点测定实验的不确定度评定.
【总页数】4页(P48-51)
【作者】魏丹琦;修虹;王勇
【作者单位】福建省药品检验所,福州,350001;福建省药品检验所,福州,350001;福建省药品检验所,福州,350001
【正文语种】中文
【中图分类】R927.2
【相关文献】
1.HPLC法测定利巴韦林可溶性粉中利巴韦林的含量 [J], 孔晓锋;加力西
2.RP-HPLC法测定利巴韦林滴眼液中利巴韦林的含量 [J], 刘放
3.PR—HPLC法测定利巴韦林滴眼液中利巴韦林的含量 [J], 刘放
4.HPLC法测定利巴韦林注射液的含量 [J], 陈艾霞;陈斌
5.HPLC法测定利巴韦林滴眼液中抑菌剂的含量 [J], 李立理;徐可;张菁;刘云;李慧
因版权原因,仅展示原文概要,查看原文内容请购买。
反相高效液相色谱法测定利巴韦林注射液的含量和有关物质.

安徽医药 AnhuiMedicalandPharmaceuticalJournal 2009Jan;13(1)#31#反相高效液相色谱法测定利巴韦林注射液的含量和有关物质吴宏富,刘放2(1.浙江省庆元县中医院,浙江庆元 323800;2.浙江省医学科学院药物研究所,浙江杭州 310013)摘要:目的建立了利巴韦林注射液的含量及有关物质测定的RP-HPLC方法。
方法采用HypersilC18(4.6mm@250mm,10Lm)色谱柱,水为流动相,检测波长:207nm。
结果利巴韦林在20.26~80.96mg#L-1浓度范围内,峰面积与浓度呈良好线性关系(r=0.9998),平均回收率为98.97%~101.10%,RSD=0.48%~1.53%。
利巴韦林及其有关物质得到基线分离,方法的最低检测量为2.5ng,控制总杂质量不得过1.0%。
结论本法测定利巴韦林注射液的含量及有关物质,方法简便、快速、结果准确,专属性好,适用于利巴韦林及其制剂的质量控制。
关键词:利巴韦林;利巴韦林注射液;有关物质;反相高效液相色谱法DeterminationofribavirinandrelatedsubstancesinribavirinjectionbyRP-HPLCWUHong-fu,LIUFang2(1.QingyuanHospitalofTraditionalChineseMedicine,Qingyuan,Zhejiang323800;2.InstituteofMateraMedica,ZhejiangAcademyofMedicalSciences,Hangzhou,Zhejiang31 0013)Abstract:Aim ToestablishaRP-HPLCmethodforthedeterminationofribavirinandrelevantsubstancesinribavirininjection. Meth-ods ARP-HPLCmethodwasdeveloped.ChromatographicconditionincludedahypersilC18columnwit hthemobilephaseofwater.TheUVdetectionwavelengthwassetupat207nm.Results Thelinearityofpiracetamwasshownintherangeof20.26~80.96mg#-1L(r=0.9998).Therecoveryratewas98.97%~101.10%withRSDbeing0.48%~1.53%.Thepea kofribavirinanditsrelatedsubstanceswereseparatedcompletely.TheLODis0.25ng.Conclus ion Thissimpleandreliablemethodisappliedtodetermineriba-virininjectionanditsrelevantsubstancesandcanbeusedtocontrolribavirinanditspreparations .Keywords:ribavirin;ribavirininjection;relatedsubstances;RP-HPLC表1 样品于0、30、60、120min在波长285nm、289nm处的吸收度样品ABCD0min285nm0.47490.51230.16210.7577289nm0.48960.53650.13420.7143285nm0.47510.51200.16150.756230min289nm0.48930.53590.13370.7138285nm0.47020.50790.16070.751160min289nm0.48520.53220.13270.7097285nm0.46060.49750.15870.7426120min289nm0.47510.51960.13150.7008表2 放置30、60、120min后样品的吸收度与0min时吸收度百分比样品ABCD0min285nm100100100100289nm100100100100285nm100.0499.9499.6399.8030min289nm99.9499.8999.6299.93285nm99.0199.1699.1499.1360min289nm99.1099.2098.8899.3428596.97.97.98.nm99119001120min289nm97.0496.8597.9998.11表3 样品在0、30、60、120min时,285nm与289nm处吸收度百分比样品A BCD0min96.9995.49120.78106.0830min97.1095.54120.79105.9460min96.9195.43121.10105.83120min96.9592.28120.68105.97[3] 吴静.复方薄荷脑滴鼻液中樟脑鉴别方法的修正建议[J].基层中药杂志,1998,12(4):55.[4] 林玉仙,陈琳,郑菁华.系数倍增法测定复方薄荷脑滴鼻液中樟脑的含量[J].海峡药学,2000,12(4):9-11.[5] 张全英,潘杰,胡剑峰,等,复方薄荷脑滴鼻液中樟脑鉴别方法改进[J].中国医院药学杂志,2002,22(10):635-6.[6] 巫炳红.复方薄荷脑滴鼻液中樟脑鉴别方法的改进[J].首都医药,1999,6(3):19-20.[7] 钱小蔷.盐酸麻黄碱滴鼻两种含量测定方法比较[J].安徽医药,2003,7(3):216.(收稿日期:2008-08-13)参考文献:[1] 中华人民共和国卫生部药政局编.中国医院制剂规范[M].2版.北京:中国医药科技出版社,1995:166.[2] 杨兴明,林志华.复方薄荷脑滴鼻液中樟脑鉴别方法改进[J].,6(9):-#32#安徽医药 AnhuiMedicalandPharmaceuticalJournal 2009Jan;13(1)表1 利巴韦林注射液含量测定方法回收率测定结果加入量123456789/mg760.0784.0800.0950.1980.11000.11140.01176.01200.0测得量/mg761.27789.4998.00927.35986.05987.161150.851197.031206.58回收率/%100.17100.7099.7597.61100.6198.71100.95101.79100.55平均回收率/%100.21RSD/%0.48利巴韦林(ribavirin)属广谱抗病毒类药物,因其对多种病毒有抑制作用,而被广泛应用。
利巴韦林注射液生产工艺验证方案

长治市三宝生化药业有限公司编号SBB2.8.5.6利巴韦林注射液生产工艺验证方案长治市三宝生化药业有限公司方案制订签名日期方案会签签名日期生产技术部签名日期验证小组签名日期方案批准质量保证部日期目录1.概述`````````````````````````````````````````````````````````````````````````````````````````````````````````````````````````````4` 1.1.产品简述``````````````````````````````````````````````````````````````````````````````````````````````````````````````4 1.2.处方及依据``````````````````````````````````````````````````````````````````````````````````````````````````````````41.3.生产工艺流``````````````````````````````````````````````````````````````````````````````````````````````````````````5`2.验证目的````````````````````````````````````````````````````````````````````````````````````````````````````````````````````53.验证的范围```````````````````````````````````````````````````````````````````````````````````````````````````````````````64.验证各部门职责及组织结构```````````````````````````````````````````````````````````````````````````````65.验证准备````````````````````````````````````````````````````````````````````````````````````````````````````````````````````76.验证内容及实施``````````````````````````````````````````````````````````````````````````````````````````````````````8` 6.1.洗瓶工序````````````````````````````````````````````````````````````````````````````````````````````````````````````8 6.2.配制工序```````````````````````````````````````````````````````````````````````````````````````````````````````````12 6.3.灌封工序```````````````````````````````````````````````````````````````````````````````````````````````````````````15 6.4.灭菌工序```````````````````````````````````````````````````````````````````````````````````````````````````````````206.5.灯检工序```````````````````````````````````````````````````````````````````````````````````````````````````````````246.6.包装工序```````````````````````````````````````````````````````````````````````````````````````````````````````````266.7.成品检验结果``````````````````````````````````````````````````````````````````````````````````````````````````287.偏差分析``````````````````````````````````````````````````````````````````````````````````````````````````````````````````298.验证结论``````````````````````````````````````````````````````````````````````````````````````````````````````````````````299.附表````````````````````````````````````````````````````````````````````````````````````````````````````````````````````````````299.1. 设备一览表及生产能力```````````````````````````````````````````````````````````````````````````````309.2.设备性能验证确认及检查情况表```````````````````````````````````````````````````````````````319.3参加验证人员培训情况检查表````````````````````````````````````````````````````````````````````329.4.厂房与公用设施验证的确认和检查情况表`````````````````````````````````````````````349.5.空气净化系统、工艺用水系统验证的确认和检查情况表`````````````````359.6.计量器具检查情况表```````````````````````````````````````````````````````````````````````````````````````369.7.三批(按四批准备)验证使用的原料、辅料和安瓿供应商确认及检查情况表`````````````````````````````````````````````````````````````````````````````379.8.质量检验系统验证和准备情况表```````````````````````````````````````````````````````````````389.9.检验仪器检查情况表``````````````````````````````````````````````````````````````````````````````````````399.10检验试剂检查情况表````````````````````````````````````````````````````````````````````````````````````409.11质量监控点、监控内容、监控方法、监控频次表`````````````````````````````411.概述1.1.利巴韦林注射液(1ml:100mg)常温状态下是无色的澄明液体,属抗病毒药,用于呼吸道合胞病毒引起的病毒性肺炎与支气管炎。
紫外分光光度法测定利巴韦林注射液的含量

紫外分光光度法测定利巴韦林注射液的含量
李先红
【期刊名称】《湖北文理学院学报》
【年(卷),期】2003(024)005
【摘要】采用紫外分光光度法测定利巴韦林注射液的含量,与液相色谱法(HPLC)比较. 两法测定结果偏差<1%,本法简单、快捷、准确,为制剂车间半成品的质量快速控制提供了一个可行的方法.
【总页数】3页(P28-30)
【作者】李先红
【作者单位】襄樊学院,化学化工系,湖北,襄樊,441053
【正文语种】中文
【中图分类】TQ460.7+2
【相关文献】
1.紫外分光光度法测定双苯氟嗪片的含量、含量均匀度及溶出度 [J], 陈汝红;郭毅;刘铁钢;武国芳;王永利
2.紫外分光光度法测定利巴韦林注射液的含量 [J], 唐志立;彭贤东;陈建勋;欧树凡
3.紫外分光光度法测定利巴韦林注射液的含量 [J], 李爱萍;秦建刚;胡亚将;焦慧敏
4.紫外分光光度法测定利巴韦林注射液的含量 [J], 唐志立;彭贤东;陈建勋;欧树凡
5.紫外分光光度法测定利巴韦林注射液的含量 [J], 唐志立;彭贤东;陈建勋;欧树凡因版权原因,仅展示原文概要,查看原文内容请购买。
利巴韦林工艺验证

利巴韦林工艺验证利巴韦林注射液生产工艺验证方案长治市三宝生化药业有限公司方案制订签名日期方案会签签名日期生产技术部签名日期验证小组签名日期方案批准质量保证部日期目录1.概述``````````````````````````````````````````````````````````````````````````````````` ``````````````````````````````````````````4``````````````````````````````````````41.2.处方及依据``````````````````````````````````````````````````````````````````````` ```````````````````````````````````41.3.生产工艺流``````````````````````````````````````````````````````````````````````` ```````````````````````````````````5`2.验证目的````````````````````````````````````````````````````````````````````````````` ```````````````````````````````````````53.验证的范畴`````````````````````````````````````````````````````````````````````````` `````````````````````````````````````64.验证各部门职责及组织结构```````````````````````````````````````````````````` ```````````````````````````65.验证预备````````````````````````````````````````````````````````````````````````````` ```````````````````````````````````````76.验证内容及实施``````````````````````````````````````````````````````````````````` ```````````````````````````````````8`6.1.洗瓶工序````````````````````````````````````````````````````````````````````````` ```````````````````````````````````86.2.配制工序````````````````````````````````````````````````````````````````````````` ``````````````````````````````````126.3.灌封工序````````````````````````````````````````````````````````````````````````` ``````````````````````````````````156.4.灭菌工序````````````````````````````````````````````````````````````````````````` ``````````````````````````````````206.5.灯检工序````````````````````````````````````````````````````````````````````````` ``````````````````````````````````246.6.包装工序````````````````````````````````````````````````````````````````````````` ``````````````````````````````````26```````````````````````````````287.偏差分析````````````````````````````````````````````````````````````````````````````` `````````````````````````````````````298.验证结论````````````````````````````````````````````````````````````````````````````` `````````````````````````````````````299.附表``````````````````````````````````````````````````````````````````````````````````` `````````````````````````````````````````299.1. 设备一览表及生产能力````````````````````````````````````````````````````` ``````````````````````````309.2.设备性能验证确认及检查情形表``````````````````````````````````````````` ````````````````````319.3参加验证人员培训情形检查表`````````````````````````````````````````````` ``````````````````````329.4.厂房与公用设施验证的确认和检查情形表``````````````````````````````` ``````````````349.5.空气净化系统、工艺用水系统验证的确认和检查情形表````````````` ````359.6.计量器具检查情形表`````````````````````````````````````````````````````````` `````````````````````````````369.7.三批(按四批预备)验证使用的原料、辅料和安瓿供应商确认及检查情形表```````````````````````````````````````````````````` `````````````````````````379.8.质量检验系统验证和预备情形表``````````````````````````````````````````` ````````````````````389.9.检验仪器检查情形表`````````````````````````````````````````````````````````` ````````````````````````````399.10检验试剂检查情形表````````````````````````````````````````````````````````` ```````````````````````````409.11质量监控点、监控内容、监控方法、监控频次表````````````````````` ````````411.概述1.1.利巴韦林注射液(1ml:100mg)常温状态下是无色的澄明液体,属抗病毒药,用于呼吸道合胞病毒引起的病毒性肺炎与支气管炎。
紫外分光光度法测定利巴韦林葡萄糖注射液中利巴韦林的含量

紫外分光光度法测定利巴韦林葡萄糖注射液中利巴韦林的含量刘亚军;谢燕萍
【期刊名称】《海峡药学》
【年(卷),期】2000(12)2
【摘要】本文采用紫外分光光度法测定利巴韦林葡萄糖注射液中利巴韦林的含量,以206.8 nm为测定波长.平均回收率为100.06%,RSD为1.04%.本法简便,结果满意,适用于医院制剂分析.
【总页数】2页(P32-33)
【作者】刘亚军;谢燕萍
【作者单位】江苏省常州市第一人民医院,常州,213003;江苏省常州市第一人民医院,常州,213003
【正文语种】中文
【中图分类】R9
【相关文献】
1.活性炭在利巴韦林葡萄糖注射液配制中对利巴韦林含量的影响 [J], 衡长金
2.紫外分光光度法测定利巴韦林注射液的含量 [J], 李先红
3.紫外分光光度法测定利巴韦林含片含量 [J], 林婉贞;刘怡;任斌;姚秋燕;黄碧莹
4.紫外光谱法测定利巴韦林葡萄糖注射液中利巴韦林的含量 [J], 陈鸣;刘永强;吕建海
5.等吸收双波长紫外分光光度法测定利巴韦林和乙酰胺含量 [J], 李红丽;王克科;张效林
因版权原因,仅展示原文概要,查看原文内容请购买。
反相高效液相色谱法测定利巴韦林注射液的含量

反相高效液相色谱法测定利巴韦林注射液的含量
吴宏富;刘放
【期刊名称】《中国药业》
【年(卷),期】2008(17)23
【摘要】目的建立利巴韦林注射液含量测定的反相高效液相色谱(RP-HPLC)法.方法色谱柱为Hypersil C18柱(250mm×4.6 mm,10 μm).以水为流动相,检测波长为207 nm.结果利巴韦林质量浓度在20.24~80.96 μg/mL范围内与峰面积线性关系良好(r=0.999 8),平均回收率为100.09%.RSD=1.26%(n=9).结论 RP-HPLC 法简便、快速、准确、专属,适用于利巴韦林及其制剂的质量控制.
【总页数】2页(P20-21)
【作者】吴宏富;刘放
【作者单位】浙江省庆元县中医院,浙江,庆元,323800;浙江省医学科学院药物研究所,浙江,杭州,310013
【正文语种】中文
【中图分类】R927.2;R978.7
【相关文献】
1.反相高效液相色谱法测定利巴韦林注射液的含量和有关物质 [J], 吴宏富;刘放
2.离子色谱法测定利巴韦林注射液中亚硝酸盐的含量 [J], 凌小云;刘文;潘健;陈文秋
3.HPLC法测定利巴韦林注射液中利巴韦林含量的不确定度评定 [J], 魏丹琦;修虹;王勇
4.反相高效液相色谱法测定利巴韦林注射液的有关物质 [J], 吴宏富;刘放
5.利巴韦林注射液中间产品含量快速测定方法 [J], 肖七琪;周其超;张悦
因版权原因,仅展示原文概要,查看原文内容请购买。
利巴韦林氯化钠注射液的制备及临床应用

应中和 施劲松 (浙江省永康市第一人民医院 永康 321300)
摘要 目的 :建立利巴韦林氯化钠注射液的制备和质量控制方法 ,观察本制剂的临床疗效 。方法 :采用氯化钠作等渗调节剂 制备输液 ,以 HPLC 法测定制剂中利巴韦林含量 ,将 160 例病毒感染者分组 ,治疗组 50 例 ,对照组 50 例 ,开放组 60 例 ,观察指 标 。结果 :制剂稳定 ,平均回收率99. 92 % ,精密度试验 RSD = 0. 28 % ,临床应用表明治疗组与对照组疗效差异无显著性 ( P > 0. 05) ,总有效率87. 3 %。结论 :本制备工艺可行 ,质量控制方法可靠 ,临床疗效确切 。 关键词 利巴韦林氯化钠注射液 ,制备 ,HPLC 法 ,质量控制
d 为一疗程 ,其他为 7~14 d 。
5. 4 结果 以症状 、体征 、实验室检查等三项均恢 复正常为痊愈 ;病情明显好转 ,但上述三项有一项未
完全恢复正常为显效 ;否则为无效 。以痊愈和显效
计算有效率 ,结果病毒性呼吸道感染治疗组 41 例
(82 %) 、对照组 40 例 (80 %) 有效 ,两者有效率差异
C = 0. 064 0 + 8. 568 ×10 - 5 A , r = 0. 999 9
由此可知利巴韦林在10. 08~90. 72 μg·ml - 1范
围内线性良好 。
3. 4. 4 精密度试验 精密吸取3. 4. 2项下每 1 ml 含 40μg 的对照品溶液 20μl 重复进样 6 次 ,记录峰 面积 ,计算相对标准偏差 RS D ,结果见表 2 。表 2 表 明 6 次重复进样的 RS D 为0. 28 % ,外标法测定利 巴韦林具有良好的重现性 。
利巴韦林注射液验证方案

方案的确认、批准方案起草人:起草日期:方案审核人:审核日期:方案批准人:签名和日期:利巴韦林注射液(1ml :100mg )属抗病毒药,用于呼吸道合胞病毒引起的病毒性肺 炎与支气管炎。
该产品于 1993 年 1 月经河南省卫生厅批准,已经有近 17 年的生产历史。
2022 年,该产品生产了 224 批,总产量 17326.203 万支, 2022 年 1-7 月份生产了 114 批, 总产量 9393.492 万支。
该产品的产量和批次连续两年在公司的小容量注射剂中均属前三 位。
利巴韦林注射液(1ml :00m1g )由利巴韦林、氯化钠、注射用水组成,组方相对简单。
生产工艺如下:处方:物料名称利巴韦林 氯化钠 药用炭万 ml 用量1000g 90g 15g注射用水加至 10000 万 ml生产流程:该产品从 1993 年批准生产以来, 处方和生产工艺没有发生变更, 产品质量基本稳定,活性碳安瓿 利巴韦林 氯化钠配制精洗灌封干燥灭菌灭菌灯检包装注射用水粗洗 过滤纯化水没有质量事故发生。
2002 年公司搬迁和 GMP 改造,厂房设施发生了变更,精洗、配制、灌封等工序的生产环境由原来的普通控制区变更为现在的万级洁净区,灌封机由 4 针机变更为现在的 6 针机, 2003 年首次通过了药品GMP 认证, 2022 年通过了GMP 复认证。
2022 年至今,在公司开展的以品种为单元的药品 GMP 管理工作中,对利巴韦林注射液 (1ml:100mg) 从2022 年元月至2022 年7 月的批生产记录和批检验记录进行了全面的回顾分析和评价,对岗位操作规程和关键技术参数等方面进行了修订、完善。
为进一步确认修订的 SOP 的科学性和合理性,现在我们按照工艺流程和 SOP,分工序对利巴韦林注射液生产过程的每一个操作和技术参数进行具体的验证和分析,在验证分析的基础上,进一步完善和确定生产工艺规程、岗位标准操作规程、关键技术参数, 并对岗位标准操作规程和关键技术参数提出确定或者修订意见,确保产品质量的稳定和均一。
利巴韦林与氧氟沙星注射液的配伍稳定性实验

利巴韦林与氧氟沙星注射液的配伍稳定性实验
廖艺
【期刊名称】《广西医科大学学报》
【年(卷),期】1999(16)6
【摘要】目的:检测利巴韦林与氧氟沙星注射液的配伍稳定性.方法:采用双波长紫外分光光度法分别检测两药配伍前后的含量变化情况.结果:25,37℃时,0~6 h其外观、pH值、含量没有明显变化,8 h后含量有所下降.按相应工作曲线项下所述方法测得相应A值和△A值,计算得利巴韦林的回收率为100.43%,RSD=0.46%.氧氟沙星回收率为99.80%,RSD=0.23%.结论:利巴韦林与氧氟沙星注射液在常温及炎热夏天都可配伍使用,6 h内用完.本方法简单可靠,操作方便.
【总页数】1页(P825)
【作者】廖艺
【作者单位】广西南宁市第二人民医院药剂科,南宁,530031
【正文语种】中文
【中图分类】R969.2
【相关文献】
1.注射用阿奇霉素与常用输液配伍的稳定性实验 [J], 陆颖
2.盐酸左氧氟沙星注射液的稳定性实验 [J], 王艳萍;史沛海;孟庆彪;严晓鹏
3.帕珠沙星注射液在果糖注射液中配伍的稳定性实验 [J], 诸林俏;黄晨
4.盐酸川芎嗪与丹参素配伍的稳定性实验研究 [J], 王益华;来丽丽;刘巧霞
5.甲氧氯普胺与四种输液配伍的稳定性实验 [J], 金伟华;刘永胜;陈华;芦艳萍
因版权原因,仅展示原文概要,查看原文内容请购买。
注射用利巴韦林说明

注射用利巴韦林说明书【药品名称】通用名:注射用利巴韦林英文名:Ribavirin for Injection汉语拼音:Zhusheyong Libaweilin本品主要成份为利巴韦林,化学名为:1-ß-D-呋喃核糖-1,2,4-三氨唑-3-羧酰胺。
分子式:C8H12N4O5分子量:244.21【性状】本品为白色疏松块状物或粉末.【药理毒理】药理作用利巴韦林为合成的核苷类抗病毒。
体外细胞培养试验表明,本品对呼吸道合胞病毒(RSV)具有选择性的抑制作用。
本品的作用机理尚不清楚,但是其体外抗病毒活性可被鸟嘌呤核苷和黄嘌呤核苷逆转的结果提示,本品可能作为这些细胞的代谢类似物而起作用。
毒理研究重复给药毒性:小鼠、大鼠和猴在经口给予本品剂量度30、36和120mg/kg,给药时间为4周或更长时,可引起心脏损伤。
遗传毒性:本品浓度分别为0.015和0.03-5.0mg/ml,在无代谢活化物的条件下,可增加小鼠BaTb/c3T3(成纤维细胞)和L5178Y(淋巴瘤)的细胞转化和突变。
浓度范围为3.75-10.0mg/ml,在加入代谢活化物的条件下,对L5178Y细胞的突变率有一定的增加(3-4倍)。
小鼠微核试验结果提示,静脉注射本品剂量范围为20-200mg/kg时,具有诱裂作用。
在显性致死试验中,大鼠腹腔注射本品剂量范围为50-200mg/kg,连续5天,未见有致突变作用。
生殖毒性:雄性小鼠给予剂量范围在35~150mg/kg时,可导致明显的生精管萎缩,精子浓度降低和形态异常的精子数量增加。
停药后3-6个月,生精能力部分恢复。
其它几项毒性试验也提示,成年大鼠经口给予本品剂量低至16mg/kg时,可引起睾丸损伤(生精管萎缩),未进行更低剂量的研究。
尚未对雄性动物的生殖能力进行研究。
不同种属的动物研究已证实本品有明显的致畸和/或杀胚胎的潜在毒性。
仓鼠单次经口给予本品剂量为2.5mg/kg或更大,家兔和大鼠的剂量分别为0.3和1.0mg/kg,结果均已证实有致畸作用。
紫外分光光度法测定利巴韦林注射液的含量
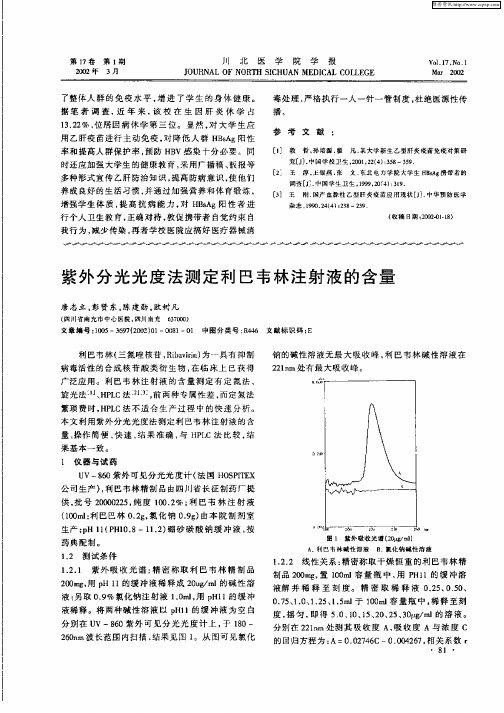
第1 7卷 第 1 期 20 年 3 02 月
川
北
医
学
院
学
报
Vo . 7. 1 1 1 No Ma 2 r 彻
J OUR NALOF N T I HU N DIAL C LL E OR H SC A ME C O C
哲, 培蔼 . 孙 翟
究 [ . 国学 校 卫 生 , 0 .24 t5 —39 们 中 2 12 ()3 8 5 0 [ 王 2 淳. 银燕 . 王 张 文 . 北 电力 学 院 大 学生 H s g 带 者 的 东 BA 携
多种形 式 宣传 乙肝 防治知 识 , 高 防病 意 识 , 他们 提 使 养成 良好 的生活 习惯 , 并通 过加 强营养 和体育锻 炼 , 增强学 生 体质 , 高 抗 病 能 力 , H s g阳 性 者 进 提 对 BA 行个人 卫生 教 育 , 正确 对待 , 敦促 携带 者 自觉约 束 自 我行 为 , 少传染 , 者学 校 医院应 搞 好 医疗器 械消 减 再
广泛应 用 。利 巴韦 林 注射 液 的含 量 测定 有 定 氮 法 、 旋光 法一 H L 、 P C法 - - , 两 种 专 属 性 差 , 定 氮 法 0 前 j 而 繁 琐 费 时 , P C法 不 适 合 生 产 过 程 中 的 快 速 分 析 。 HL
本文 利用 紫外分 光光 度法 测定利 巴韦 林 注射液 的含
调盎 [: 中国 学 生 卫 生 ,99 2 ()3 9 J. 19 .0 4 :1. [] 王 刚 国产 血 豫性 乙 型 肝 炎 疫苗 应 用 现 状 [ . 3 们 中华 预 防 医 学
杂 志 .90 2 ( )28 3 19 .44 :3 —29 ( 稿 日期 : 0-11) 收 2 20 -8 0
利巴韦林及其系列制剂为广谱抗病毒药,其原料药质量标准收载于

利巴韦林的高效液相色谱法测定中华人民共和国湖北省药检所制定北京市龙智达科技开发有限公司协助1引言利巴韦林及其系列制剂为广谱抗病毒药,其原料药质量标准收载于中国药典2000年版二部,含量测定用反相高效液相法,采用C18色谱柱,流动相为水或0.03mol/L硫酸溶液,测定波长为207nm。
利巴韦林制剂共有10个品种,其含量测定除两个品种采用定氮法外,其余均采用高效液相法,所使用的条件与原料药相同。
但是该方法利巴韦林测定所使用的流动相中未加甲醇一类的有机相,具有不可调节,选择性差等缺点;同时在做有关物质测定时,杂质与主峰的分离度不好,特别是注射液中含有氯化钠时,其结果是,C18柱的柱压不断增高,而柱效却在不断降低。
美国药典25版中收载的利巴韦林含量同样也采用高效液相法,所不同的是美国药典采用离子交换柱,检测波长为207nm,流动相为水(用稀硫酸调PH为2.5±0.1)。
因此,我们对离子交换柱进行了可行性实验,试验结果显示:离子交换柱使用方便,色谱柱的再生也比较简单,色谱图峰形对称性好,且杂质的分离度明显优于C18柱。
用此种方法对利巴韦林及其十余种制剂进行了含量及有关物质的测定,均获得了满意的结果。
2实验部分2.1 试剂和仪器LC-10A高效液相色谱仪,SPD-10A检测器,C-R7A数据处理机(均为日本岛津产品)。
利巴韦林对照品,由中国生物制品检定所提供,批号为629-200202。
水:二次重蒸过滤水。
硫酸:分析纯。
2.2 色谱操作条件色谱柱为氢型强阳离子交换树脂,磺化交联的苯乙烯二乙烯苯共聚物的离子交换柱(型号LZD SL17,北京龙智达公司提供),7.8mm×100mm。
柱效TP>1500/m。
流动相为水(用稀硫酸调节PH2.5±0.1);检测波长207nm;灵敏度为0.01(AUFS)。
在此条件下,样品与杂质可实现基线分离。
以上操作参数是典型的,可以根据不同仪器特点,对给定操作参数做适当调整,以期获得最佳效果,在上述操作条件下,利巴韦林测定的典型高效液相色谱图如图1所示。
HPLC法测定利巴韦林注射液的含量

HPLC法测定利巴韦林注射液的含量
陈艾霞;陈斌
【期刊名称】《南昌大学学报:理科版》
【年(卷),期】1998(022)001
【摘要】以水-甲醇(80:20)为流动相,ODSC18为色谱柱,使用高效液相色谱法测定利巴韦林注射液的含量,操作简便,结果与原有的比色法基本一致。
【总页数】3页(P81-83)
【作者】陈艾霞;陈斌
【作者单位】江西省化学工业学校;江西省化学工业学校
【正文语种】中文
【中图分类】R978.7
【相关文献】
1.反相高效液相色谱法测定利巴韦林注射液的含量和有关物质 [J], 吴宏富;刘放
2.离子色谱法测定利巴韦林注射液中亚硝酸盐的含量 [J], 凌小云;刘文;潘健;陈文秋
3.HPLC法测定利巴韦林注射液中利巴韦林含量的不确定度评定 [J], 魏丹琦;修虹;王勇
4.反相高效液相色谱法测定利巴韦林注射液的含量 [J], 吴宏富;刘放
5.旋光法测定利巴韦林注射液含量方法探讨 [J], 范宇;王联民
因版权原因,仅展示原文概要,查看原文内容请购买。
利巴韦林注射液hplc含量测定的不确定度评定

利巴韦林注射液HPLC含量测定的不确定度评定周继勇倪晓霓镇江市药品检验所,镇江212003 摘 要 目的:建立利巴韦林注射液HPLC含量测定法的不确定度评定方法。
方法:根据HPLC含量测定方法,建立数学模型,利用测定过程中具有代表性的实验数据,通过不确定度来源分析,探讨HPLC含量测定方法的不确定度分析方法。
结果:分别计算各变量的不确定度,再计算合成不确定度,最终给出测量结果的扩展不确定度和置信水平。
结论:该方法作为评价药品HPLC含量测定不确定度评定的方法,简便、准确可靠。
关键词 利巴韦林注射液;HPLC;含量测定;不确定度Uncertainty for HPLC Determination of Libaweilin InjectionZHOU Ji - yongNI Xiao - niZhenjiang Institute of Madicine Control, Jiangsu Province, Zhenjiang 212003Abstract Objective: To estabilsh a method for uncertainty analyse in determine the content by HPLC of Libaweilin injection. Methods: Select the Endocrine inpatient 177 cases of diabetic patients, were randomly assigned to the control group, regular group, and group of pharmaceutical care and pharmacy care before and after assessing the self - management capacity of 3 groups. Results :The combined uncertainty was obtained by combining all standard uncertainty, then the combineduncertainty was obtained by synthesizing the uncertanties of various component variables. Conclusion: The method was simple and accurate and can be use to estimate uncertainty for control determination by HPLC of relative density of Libaweilin injection.Keywords Libaweilin injection ; HPLC ; Determination ; Uncertainty。
旋光法测定利巴韦林注射液含量

旋光法测定利巴韦林注射液含量
沙明;彭开菊
【期刊名称】《中国药业》
【年(卷),期】1999(8)9
【摘要】采用旋光法测定利巴韦林注射液的含量,样品不需任何处理可直接测定,方法简便,回收率高,变异系数小,重现性好,可适于药厂生产中间体的快速分析。
【总页数】1页(P27)
【作者】沙明;彭开菊
【作者单位】山东益康药业有限公司,滕州市277500
【正文语种】中文
【中图分类】R978.7
【相关文献】
1.反相高效液相色谱法测定利巴韦林注射液的含量和有关物质 [J], 吴宏富;刘放
2.离子色谱法测定利巴韦林注射液中亚硝酸盐的含量 [J], 凌小云;刘文;潘健;陈文
秋
3.旋光法测定利巴韦林注射液半成品含量 [J], 梁勇
4.反相高效液相色谱法测定利巴韦林注射液的含量 [J], 吴宏富;刘放
5.旋光法测定利巴韦林注射液含量方法探讨 [J], 范宇;王联民
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
验证方案产品名称:产品规格:方案的确认、批准方案起草人:起草日期:方案审核人:审核日期:方案批准人:签名和日期:验证方案一、品种概述:利巴韦林注射液(1ml:100mg)属抗病毒药,用于呼吸道合胞病毒引起的病毒性肺炎与支气管炎。
该产品于1993年1月经河南省卫生厅批准,已经有近17年的生产历史。
2008年,该产品生产了224批,总产量17326.203万支,2009年1-7月份生产了114批,总产量9393.492 万支。
该产品的产量和批次连续两年在公司的小容量注射剂中均属前三位。
利巴韦林注射液(1ml:00m1g)由利巴韦林、氯化钠、注射用水组成,组方相对简单。
生产工艺如下:处方:物料名称万ml用量利巴韦林 1000g氯化钠 90g药用炭 15g注射用水加至 10000万ml生产流程:该产品从1993年批准生产以来,处方和生产工艺没有发生变更,产品质量基本稳定,没有质量事故发生。
2002年公司搬迁和GMP改造,厂房设施发生了变更,精洗、配制、灌封等工序的生产环境由原来的一般控制区变更为现在的万级洁净区,灌封机由4针机变更为现在的6针机, 2003年首次通过了药品GMP认证,2007年通过了GMP复认证。
2007年至今,在公司开展的以品种为单元的药品GMP管理工作中,对利巴韦林注射液(1ml:100mg)从2007年元月至2009年7月的批生产记录和批检验记录进行了全面的回顾分析和评价,对岗位操作规程和关键技术参数等方面进行了修订、完善。
为进一步确认修订的SOP的科学性和合理性,现在我们按照工艺流程和SOP,分工序对利巴韦林注射液生产过程的每个操作和技术参数进行具体的验证和分析,在验证分析的基础上,进一步完善和确定生产工艺规程、岗位标准操作规程、关键技术参数, 并对岗位标准操作规程和关键技术参数提出确定或修订意见,确保产品质量的稳定和均一。
二、验证目的:通过对利巴韦林注射液(1ml:100mg)产品工艺的验证,判断在以品种为单元的药品GMP管理工作中,岗位SOP修订的合理性,分析影响产品质量的关键因素,纠正偏差,建立生产全过程的运行标准和监控标准,确保产品质量安全有效、稳定均一。
同时通过验证,减少误差,降低成本,提高企业运营效率。
三、验证的基本原则本次验证是在该产品正常生产所需的厂房设施、生产设备、仪器仪表、检验设施设备及检验方法均经过了验证和校验、参与验证的相关人员都经过培训的前提下,按照批准的生产工艺规程和岗位SOP进行严格监控下的正常生产;所有记录真实、准确;所有抽样检验严格按照批准的规程进行。
(一)、成立验证组织:1、成立验证领导组,确定组长、成员,明确职责。
2、成立若干验证工作小组,确定组长、成员,明确职责。
(二)、组织验证人员培训;(三)、检查和认定厂房与公用设施是否在验证周期内;(四)、检查和认定空气净化系统是否在验证周期内;(五)、检查和认定工艺用水系统是否在验证周期内;(六)、检查并确定生产设备(水针车间第1生产线)是否在验证周期内;(七)、检查并确定计量器具是否在检定周期内;(八)、检查参加验证的物料;(九)、检查质量检验系统验证和准备情况;(十)、检查并确定检验仪器;(十一)、检查并确定检验试剂;(十二)、根据验证要求,在正常监控的基础上,对验证过程中增加监控内容:1、洗瓶工序:安瓿的洁净度、微生物限度、细菌内毒素检查;2、灌封工序:空气洁净度动态检测、灭菌前产品的细菌内毒素、微生物限度检查;3、灭菌工序:在灭菌柜相对冷点、热点处的产品理化指标的检测,在灭菌柜相对冷点处的产品无菌指标的检测;(十三)、文件准备(技术文件、管理文件);(十四)、拟验证时间:2009月8月1日~9月30日。
按照确定的原辅料、包装材料、生产设备、检验仪器和试剂,由各验证小组按照验证方案,连续投料三批,每批90万支,进行生产工艺验证。
(一)、洗瓶工序1、因素分析本工序主要控制参数有:a.洗瓶用水水温;b.注水机注满水率;c.甩水机甩净水率;d.终端精洗用水的可见异物;e. 远红外隧道烘箱的灭菌温度和灭菌时间。
以上因素中,甩水机甩水效果、注水机注满水率、终端精洗用水的可见异物检查等控制标准生产一直沿用,未做过修订;洗瓶用水水温、远红外隧道烘箱的灭菌温度与灭菌时间等参数因没有明确数据范围,表述不科学。
在实施以品种为单元的GMP管理工作中,进行了如下修订。
2、验证记录:洗瓶工序监控项目及监控结果1:第7 页共27 页洗瓶工序监控项目及监控结果2:第8 页共27 页洗瓶工序洗瓶效果评价结果第9 页共27 页产品工艺验证利巴韦林注射液(1ml:100mg)3、结果评价:根据监控结果和检测结果判断参数标准的可控性与稳定性,分析是否存在偏差。
(二)、配制工序1、因素分析本工序主要控制参数有:a. 首次加水量;b. 配制时注射用水温度;c. 投料顺序d. pH值调节范围e.炭吸附时间f. 药液搅拌时间 g.使用前后终端过滤器完整性检查以上因素中,首次加水量、配制时注射用水温度、投料顺序、pH值调节范围、炭吸附时间、使用前后终端过滤器完整性检查等控制标准生产一直沿用,未做过修订;药液搅拌时间参数因没有明确数据范围,表述不科学,在实施以品种为单元的GMP管理工作中进行了修订。
另在制定本次利巴韦林注射液工艺验证方案时,我们对09年1~7月份114批利巴韦林注射液半成品及成品检验结果数据的回顾性分析,半成品含量平均为98.27%、RSD 值为0.771%;成品含量平均为98.36%、RSD值为0.997%;半成品、成品含量相对稳定;pH 值范围在5.0~5.5的占89%,且pH值灭菌后平均下降0.32;呈下降趋势。
现利巴韦林注射液半成品pH值参数范围为4.5~5.5,拟将pH值参数范围调整为5.0~5.5。
修订的参数及标准如下。
2、验证记录产品工艺验证利巴韦林注射液(1ml:100mg)配制工序监控项目及监控结果第11 页共27 页产品工艺验证利巴韦林注射液(1ml:100mg)配制工序半成品质量评价结果第12 页共27 页产品工艺验证 利巴韦林注射液(1ml :100mg )第 13 页 共 27 页3、结果评价根据监控结果和检测结果判断参数标准的可控性与稳定性,分析是否存在偏差。
(三)、灌封工序 1、因素分析本工序主要控制参数有:a. 灌封前可见异物;b. 灌封期间可见异物;c. 灌装量;d.灌封收率以上参数中,灌封前可见异物、灌装量和灌封收率等控制标准生产一直沿用,未做过修订;灌封期间可见异物检查标准曾发生过两次变更,一次是05年因国家标准改变,将灌封期间可见异物检查的不合格率控制标准由3.0%变更为1.5%;另一次是07年企业为有效控制可见异物质量问题,结合以品种为单元的GMP 管理工作,将灌封期间可见异物检查的不合格率控制标准由1.5%变更为1.0%。
另因为利巴韦林注射液灭菌条件为100℃、30分钟,F 0值远小于8,为确保灭菌后产品无菌合格,拟增加生产过程中的环境洁净度、灌封半成品的细菌内毒素、微生物限度等为特殊监控指标。
2、验证记录产品工艺验证利巴韦林注射液(1ml:100mg)灌封工序监控项目及监控结果第14 页共27 页北南附表1:灌封期间可见异物结果附表2:细菌内毒素、微生物限度检查结果附表3:灌封室尘埃粒子检测结果( 批)灌封室沉降菌检测结果( 批)附表4: 装量检查结果产品批号:3、结果评价根据监控结果和检测结果判断参数标准的可控性与稳定性,分析是否存在偏差。
(四)、灭菌工序1、因素分析本工序主要控制参数有:a. 设定灭菌温度、b. 设定灭菌时间、c. 预热时间、d. 最大载量、e. 装载方式以上参数,灭菌温度、灭菌时间为批准的工艺参数;预热时间、最大载量、装载方式为经验总结,生产一直沿用,未做过修订。
在实施以品种为单元的GMP管理工作中,通过自查发现,因灭菌过程中灭菌柜存在相对的冷点和热点,冷点影响产品灭菌效果,热点影响产品理化性质,而现检验用样品的取样方法多为随机取样,可能存在质量隐患。
本次验证一方面欲通过对灭菌工序主要控制参数的监控,判断参数标准的可控性,另一方面增加冷点处产品的无菌检查,增加产品冷点和热点处理化性质的对比检查,以分析灭菌过程对产品质量的影响,判断是否需修订检验用样品的取样规程。
2、验证记录灭菌工序监控项目及监控结果1第19 页共27 页灭菌工序监控项目及监控结果2第20 页共27 页产品工艺验证利巴韦林注射液(1ml:100mg)灭菌工序半成品质量评价结果第21 页共27 页产品工艺验证利巴韦林注射液(1ml:100mg) 3、结果评价根据监控结果和检测结果判断参数标准的可控性与稳定性,分析是否存在偏差。
(五)、灯检工序1、因素分析本工序主要监控参数有灯检合格品的漏检率;灯检合格品的漏检率检查标准曾发生过两次变更;一次是05年因国家标准改变,灯检合格品的漏检率控制标准由4.0%变更为2.0%;另一次是07年企业为有效控制可见异物质量问题,结合以品种为单元的GMP管理工作,将灯检合格品的漏检率控制标准由2.0%变更为1.5%。
2、验证记录产品工艺验证利巴韦林注射液(1ml:100mg)灯检工序监控项目及监控结果3、结果评价根据监控结果和检测结果判断参数标准的可控性与稳定性,分析是否存在偏差。
第23 页共27 页(六)、包装工序1、因素分析本工序安瓿印字内容于执行国家局24号令时,由产品名称、产品批号变更为产品名称、产品批号、有效期;包装操作,于07年由手工装盒变更为机器装盒,手工线扎变更为机器膜扎,其他操作未有改变。
2、验证记录包装工序监控项目及监控结果3、结果评价根据监控结果和检测结果判断参数标准的可控性与稳定性,分析是否存在偏差。
(七)、成品检验结果3、结果评价:六、偏差分析根据三批利巴韦林注射液(1ml:100mg)的验证结果,对比评价标准,寻找偏差,分析偏差产生的原因,提出纠偏措施。
七、验证结论通过验证,确定需修订和完善的参数,提出合理化建议。
