甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPN底物法)产品技术要求jiuqiang
γ-谷氨酰基转移酶(GGT)测定试剂盒(GCANA底物法)产品技术要求科美

γ-谷氨酰基转移酶(GGT)测定试剂盒(GCANA底物法)适用范围:本试剂盒用于体外定量测定人血清中的γ-谷氨酰基转移酶(GGT)的活性。
1.1包装规格1.2主要组成成分试剂1主要组分:双甘肽125mmol/L 试剂2主要组分:L-γ-谷氨酰-3-羧基-对硝基苯胺14mmol/L2.1外观2.1.1试剂1应为无色或淡黄色透明溶液,无混浊,无未溶解物。
2.1.2试剂2应为无色或淡黄色透明溶液,无混浊,无未溶解物。
2.2装量液体试剂的净含量应不少于标示值。
2.3试剂空白2.3.1试剂空白吸光度:GGT试剂盒在波长395~415nm处测定试剂的空白吸光度值,应不大于0.7。
2.3.2试剂空白吸光度变化率:GGT试剂盒在波长395~415nm处测定试剂的空白吸光度变化率,每分钟的变化值应不大于0.005。
2.4分析灵敏度测试50U/L的γ-谷氨酰基转移酶时,吸光度变化率应不小于0.01。
2.5准确度测定国家标准物质GBW(E)090283,相对偏差应不超过15%。
2.6精密度2.6.1重复性重复测试(50±5)U/L的样本,所得结果的变异系数CV应不大于5%;2.6.2批间差测试(50±5)U/L的样本,所得结果的批间相对极差应不大于10%。
2.7线性范围GGT试剂盒在(10,450)U/L范围内,线性相关系数(r)应不小于0.990;在(10,50]U/L区间内,线性绝对偏差应不超过±5U/L;在(50,450)U/L区间内,线性相对偏差应不超过±10%。
2.8稳定性原包装的试剂盒在2℃~8℃避光保存,有效期为12个月。
在GGT试剂盒有效期满后2个月内,分别检测2.1、2.3、2.4、2.5、2.6.1、2.7项,结果应符合各项目的要求。
γ—谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求danda
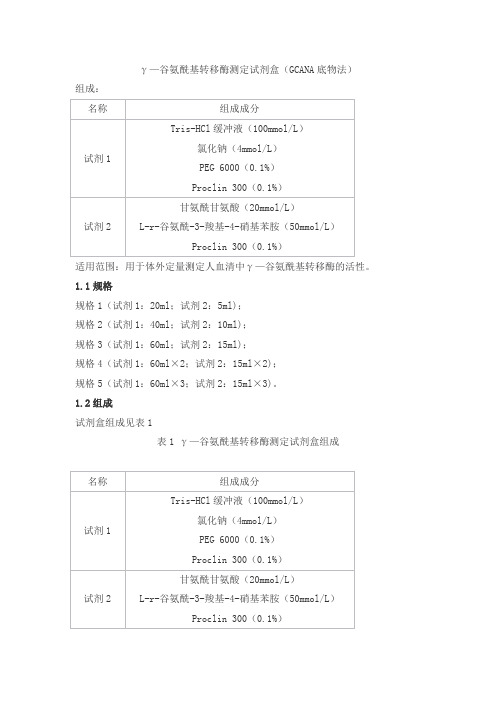
γ—谷氨酰基转移酶测定试剂盒(GCANA底物法)组成:适用范围:用于体外定量测定人血清中γ—谷氨酰基转移酶的活性。
1.1规格规格1(试剂1:20ml;试剂2:5ml);规格2(试剂1:40ml;试剂2:10ml);规格3(试剂1:60ml;试剂2:15ml);规格4(试剂1:60ml×2;试剂2:15ml×2);规格5(试剂1:60ml×3;试剂2:15ml×3)。
1.2组成试剂盒组成见表1表1 γ—谷氨酰基转移酶测定试剂盒组成2. 性能指标2.1外观试剂盒外观应整洁,液体无渗漏,文字符号标识清晰;试剂1为无色透明液体,不得有沉淀和絮状物;试剂2为淡黄色透明液体,不得有沉淀和絮状物。
2.2装量每瓶不少于标示值。
2.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在405nm处测定试剂空白吸光度 A≤1.2,空白吸光度变化率ΔA/min≤0.005。
2.4分析灵敏度试剂测定50U/L被测物,吸光度变化率△A/min≥0.005。
2.5线性范围2.5.1在[10,450]U/L内,相关系数R≥0.990。
2.5.2在 [10,50]U/L内,线性绝对偏差不超过±5U/L;(50,450] U/L内,线性相对偏差不超过±10%。
2.6精密度2.6.1 重复性重复测试(50±5)U/L的样本,所得结果的变异系数(CV%)应不大于5%。
2.6.2批间差测定(50±5)U/L样本,所得结果的批间相对极差(R)应不大于10%。
2.7准确度测定国家标准物质GBW(E)090593,相对偏差不超过±15%。
2.8效期稳定性试剂有效期为12个月,取到效期后一个月内进行检测,测定结果应符合2.3-2.6.1、2.7项要求。
甘氨酰脯氨酸二肽氨基肽酶(GPDA)测定试剂盒SOP

甘氨酰脯氨酸二肽氨基肽酶(GPDA)测定标准操作程序1.摘要血清或血浆样本中甘氨酰脯氨酸二肽氨基肽酶的活力,用于临床相关疾病的辅助诊断。
2.适用范围程序适用于日立7600自动生化分析仪检测血清、血浆中甘氨酰脯氨酸二肽氨基肽酶(GPDA)的活力。
3.职责使用日立7600自动生化分析仪进行测定甘氨酰脯氨酸二肽氨基肽酶(GPDA)活力的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物工程股份有限公司生产的甘氨酰脯氨酸二肽氨基肽酶(GPDA)试剂盒采用的是速率法5.原理−+G PD AOH2−→−甘氨酰脯氨酸对硝基苯胺甘氨酰脯氨酰对硝基苯+胺甘氨酰脯氨酸二肽氨基肽酶(GPDA)催化底物甘氨酰脯氨酰对硝基苯胺水解产生甘氨酰脯氨酸和对硝基苯胺(PNA),PNA在405nm附近有吸收峰,所以,可以通过监测405nm附近的吸光度变化值计算样本中的GPDA的活力。
6.仪器日立7600自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2试剂瓶内主要成分:R1:二甘肽、防腐剂;R2:柠檬酸、甘氨酰脯氨酰对硝基苯胺。
7.3试剂稳定性:未开瓶试剂在2-8℃避光保存,有效期为12个月,试剂开瓶后冷藏于分析仪中可以保存14天。
7.4试剂准备:试剂为即用式。
8.标准品和质量控制8.1校准程序:使用某某公司提供的标准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品响应量通过合适的数学模型绘制校准曲线。
8.2质控品某某公司提供的生化复合定值质控血清做为室内质控品。
每日在测定前做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控后结果进行转换,及时质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
甘氨酰脯氨酸二肽氨基肽酶(GPDA)测定的临床意义

甘氨酰脯氨酸二肽氨基肽酶(GPDA)测定的临床意义上海海员医院中心实验室张抗万雄萍早在1966年,Hopsu-Havu和Glenner等在鼠的肝、肾组织中发现了一种新的二肽氨基肽酶。
这种酶能水解甘氨酰-脯氨酰-B-萘胺,释放二肽甘氨酰脯氨酸,而被称为甘氨酰脯氨酸-B-萘胺酸〔1〕。
由于甘氨酰脯氨酰-B-萘胺有致癌作用,Nagatsu等合成了新底物甘氨酰脯氨酰对硝基苯胺〔2〕,并为大家广泛接受,这种酶也一度被称为甘氨酰脯氨酸对硝基苯胺酶,现已通称为甘氨酰脯氨酸二肽氨基肽酶(Glycyl proline dipeptidyl aminopeptidase,GPDA)。
GPDA分布于肝、肾、结缔组织、唾液腺和血清、唾液等体液中,但其生理功能尚不清楚。
由于GPDA能特异地水解释放肽链N-末端的甘氨酰-脯氨酸(Gly-Pro),而胶原分子中富含有这种Gly-Pro结构,提GPDA的生理作用可能与胶原肽降解有关。
七十年代,血清GPDA测定被逐渐引入到临床应用。
一、血清GPDA对肝癌鉴别诊断的价值在若干学者发现肝胆疾病病人血清GPDA升高之后,Kojima等首先报道了原发性肝癌(PHC)病人血清GPDA活性(198±110.4U/L,n=53)不仅显著高于健康对照组(77.5±17.1U/L,n=100),而且显著高于慢性肝炎,肝硬变和其他胆道疾病(如胆石症、阻赛性黄疸等)病例组〔3〕。
部分肝癌病人的血清GPDA 超过200U/L,而20例超过200U/L的病例中,除一例总胆管结石外,其余都是肝癌。
综合国内外文献报道,原发性肝癌病人血清GPDA约为健康人的1.5~2.5倍〔3~7〕;阳性率在57~100%不等。
原发性肝癌病人血清GPDA水平与转移性肝癌病人无显著差异〔3〕。
但Hutchinson等报道,转移性肝癌病人血清GPDA高达健康对照的3.3倍,阳性87.5%(14/16);其中一例67岁老年女病人在血清GPDA升高一周后,血清转氨酶活性才出现高,提示血清GPDA对早期发现肝细胞损伤,可能比转氨酶更加敏感。
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求shouyi

γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)适用范围:本试剂用于体外定量测定人血清中γ-谷氨酰基转移酶的活性。
1.1产品规格试剂1:3×80ml,试剂2:3×20ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:6×40ml,试剂2:3×20ml;试剂1:2×80ml,试剂2:2×20ml 1.2产品组成成分试剂1:Tris缓冲液100mmol/L,甘氨酰甘氨酸150mmol/L。
试剂2:γ-谷氨酰-3-羧基-4硝基苯胺 5.0mmol/L。
2.1 外观试剂1为无色透明溶液,试剂2为略带黄色透明溶液。
2.2 装量液体试剂的净含量应不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度A≤0.70(光径1.0cm,405nm波长)。
2.3.2 试剂空白吸光度变化率ΔA/5min≤0.01。
2.4分析灵敏度测定93.8U/L被测物,吸光度变化率在0.0278/min~0.057/min范围内。
2.5 准确度相对偏差在±13%范围内。
2.6 精密度2.6.1 重复性变异系数CV≤5%。
2.6.2 批间差批间相对极差≤6%。
2.7 线性区间a)(0,500]U/L(37℃)。
在规定的线性区间内,测定值与样本浓度值的相关系数(r)应不低于0.990。
b)(0,80]U/L区间内,线性绝对偏差应不超过±8U/L;(80,500]U/L 区间内,线性相对偏差应不超过±10%。
2.8稳定性原装试剂2~8℃避光保存,有效期12个月,有效期满后两个月内测定结果应符合2.3、2.4、2.5、2.6.1、2.7的要求。
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求beiken
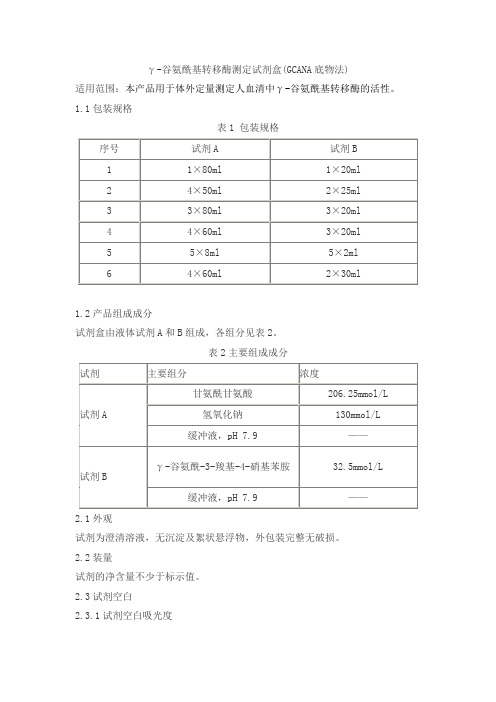
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)适用范围:本产品用于体外定量测定人血清中γ-谷氨酰基转移酶的活性。
1.1包装规格表1 包装规格1.2产品组成成分试剂盒由液体试剂A和B组成,各组分见表2。
表2主要组成成分2.1外观试剂为澄清溶液,无沉淀及絮状悬浮物,外包装完整无破损。
2.2装量试剂的净含量不少于标示值。
2.3试剂空白2.3.1试剂空白吸光度用生理盐水作为样品,按照试剂说明书的规定在37℃、405nm的波长、1cm光径条件下测试时,测定吸光度值不大于1.000。
2.3.2 试剂空白吸光度变化率用生理盐水作为样品,按照试剂说明书的规定在37℃、405nm的波长、1cm光径条件下测试时,引起的吸光度变化率△A/min应不大于0.005。
2.4 分析灵敏度测试一定浓度的γ-谷氨酰基转移酶,50U/L的γ-谷氨酰基转移酶引起的吸光度变化值ΔA/min应不小于0.025。
2.5 线性区间本产品的线性范围在[10,450]U/L(37℃)区间内:a) 线性相关系数|r|应不小于0.990;b) 在[10,50]U/L区间内,绝对偏差应不超过±5U/L;在(50,450]U/L区间内,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性:用质控品重复测试所得结果的变异系数CV应不大于5%。
2.6.2批间差:用同一水平浓度的质控品分别测试3个不同批号的试剂盒,其相对偏差不大于10%。
2.7准确度测试标准物质(编号:GBW(E)090593、GBW(E)090283),所得准确度相对偏差B不超过±15%。
2.8 稳定性:试剂盒贮存在2℃~8℃条件下,有效期为18个月。
产品在有效期末测试2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
甘氨酰脯氨酸二肽氨基肽酶

甘氨酰脯氨酸二肽氨基肽酶:苷氨酰脯氨酸二肽氨基肽酶(Glycyl proline dipeptidyl aminoeptidase,GPDA)主要分布在肝,肾,结缔组织,唾液腺及血清,唾液等体液中,以额下腺含量最为丰富.【正常参考值】44~116 U/L【临床意义】1. 肝胆疾病:原发性肝癌病人血清GPAD平均活性多在对照参考值的2倍以上,继发性肝癌病人血清GPDA活性均值在对照参考值3倍以上,急性肝炎时不管有无黄疸,血清GPDA仅轻度升高,且恢复正常的时间快.慢性肝炎或肝硬变时异常率低于急性肝炎患者.酒精性肝炎时的酶活性和异常率高于肝硬变者.药物性肝损害或原发性肝汁性肝硬变引起肝内胆汁郁积的病人,其血清GPDA明显升高,阳性率也显著高于其它肝病,这有一定的特异性和诊断价值.2.胃肠疾病:胃癌病人血清GPDA活性明显低于对照组.对血清GPDA活性明显降低的胃十二指肠疾病患者,应考虑到胃癌的诊断.胃癌经切除后,病人血清GPDA有上升趋势.3.其它疾病:急性淋巴细胞性白血病,淋巴肉瘤和淋巴网状细胞瘤病人的血清GPDA活性明显降低.类风湿性关节炎病人的血清GPDA活性略低,但重症病人下降明显.全身性红斑狼疮病人的血清GPDA活性显著降低.4.尿液GPDA:慢性肾小球肾炎患者尿中GPDA活性显著升高.血清甲胎蛋白(AFP)临床意义诊断原发性肝癌。
检测AFP的含量是诊断原发性肝癌的重要手段之一,较目前较常用的诊断肝癌的B型超声波、同位素扫描和血液生化测定等方法敏感。
用琼脂扩散法能检出1-3mg/L以上,阳性率可达75%左右。
反向血凝法较琼脂扩散法灵敏度高100-200倍;放射免疫法能检出纳克水平的AFP,较琼脂扩散法灵敏1000倍,可使原发性肝癌阳性检出率达90%左右。
其他消化道肿瘤,如胃癌、胰腺癌、结肠癌、胆管细胞癌等也可导致AFP升高,但肝转移癌却极少增高。
一、急性肝炎和肝硬化的鉴别诊断急性肝炎和肝硬化的鉴别诊断:放射免疫法可在一些肝病患者血清中测得较高含量的AFP。
谷胱甘肽还原酶测定试剂盒(谷胱甘肽底物法)产品技术要求jiuqiang

谷胱甘肽还原酶测定试剂盒(谷胱甘肽底物法)适用范围:本试剂盒用于体外定量测定人血清谷胱甘肽还原酶的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分2.1 外观试剂1a为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂1b为无色或浅黄色粉末状物质,复溶后为无色或浅黄色液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色或浅黄色粉末状物质,复溶后为无色或浅黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色或浅黄色粉末状物质,复溶后为无色或浅黄色液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白吸光度2.3.1 试剂空白吸光度A340nm下测定空白吸光度应≤1.5000。
2.3.2 试剂空白吸光度变化率A340nm下测定试剂空白吸光度变化率(ΔA/min)应≤ 0.0100。
2.4 准确度与已上市产品进行比对试验:在[12,184] U/L区间内,相关系数r≥0.975,在[12,50] U/L区间内测定的绝对偏差应不超过±7.5 U/L,在(50,184]U/L区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为70U/L时,其吸光度变化率应不超过0.5000。
2.6 线性范围在[12,184] U/L区间内,线性相关系数r≥0.990,在[12,50]U/L区间内线性绝对偏差应不超过±7.5U/L,在(50,184] U/L区间内线性相对偏差应不超过±15%。
2.7 测量精密度2.7.1 重复性使用高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 瓶间差试剂1b、试剂2、质控品的瓶间差应≤10%。
γ—谷氨酰基转移酶(GGT)测定试剂(盒)(GCANA底物法)产品技术要求新产业

2.性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2装量
试剂装量的装量应按表1,液体装量的最大允许负偏差应为5%。
2.3试剂空白
2.3.1试剂空白吸光度
用试剂(盒)测试空白样本,在37 ℃±0.1 ℃ 、405 nm 波长、1 cm 光径条件下,试剂空白吸光度应≤0.400 Abs。
2.3.2试剂空白吸光度变化率
用试剂(盒)测试空白样本,在37℃ 0.1℃,405 nm 波长、1 cm 光径条件下,试剂空白吸光度变化率≤0.005 Abs/min。
2.4分析灵敏度
试剂(盒)测试63 U/L 的被测物时,吸光度变化率(ΔA/min)应在0.030 Abs/min ~0.045 Abs/min 的范围内。
2.5线性区间
试剂(盒)线性在(0.00,600.00] U/L区间内:
a) 线性相关系数r≥0.990;
b) (0.00,50.00] U/L 区间内,线性绝对偏差应在±5.00 U/L 范围内;(50.00,600.00] U/L
区间内,线性相对偏差应在±10%范围内。
2.6精密度
2.6.1重复性
试剂(盒)测试活性在(50±5)U/L 范围内的样本时,变异系数CV≤4.0%。
2.6.2批间差
试剂(盒)测试活性在(50±5)U/L 范围内的样本时,相对极差R≤6.0%。
2.7准确度
测可溯源至有证参考物质的校准品,相对偏差 B 在±10%范围内。
甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPDA底物法)产品技术要求lepu

甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPDA底物法)适用范围:用于体外定量测定人血清中甘氨酰脯氨酸二肽氨基肽酶的活性。
分说明1.1规格试剂1: 1×60mL,试剂2: 1×20mL;试剂1: 1×30mL,试剂2: 1×10mL;试剂1: 1×45mL,试剂2: 1×6.5mL;试剂1: 1×35mL,试剂2: 1×4mL;试剂1: 1×60mL,试剂2: 1×60mL;试剂1: 1×60mL,试剂2: 1×30mL;试剂1: 1×60mL,试剂2: 1×15mL;试剂1: 1×60mL,试剂2: 1×12mL;试剂1: 1×60mL,试剂2: 1×10mL;试剂1:1×1.5L,试剂2:1×0.5L;试剂1:1×3L,试剂2:1×1L。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液;试剂2:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度在405nm处测定试剂空白吸光度,应≤1.8;2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.8。
2.4 分析灵敏度测试100U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.0015。
2.5 准确度参照EP9-A2的方法,用比对试剂盒同时测试40例线性区间内的不同浓度的血清样本。
其相关系数(r)不小于0.990。
每个浓度点在[1,72)U/L区间内绝对偏差不超过±8.64U/L;[72,600]U/L区间内相对偏差不超过±12%。
2.6 重复性批内变异系数(CV)应不超过10%。
甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPDA底物法)产品技术要求zhongshengbeikong

甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPDA底物法)产品技术要求zhongshengbeikong甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPDA底物法)适用范围:本试剂用于体外定量测定人血清中甘氨酰脯氨酸二肽氨基肽酶的含量。
1.1规格液体双剂型试剂1(R1):60mL×2, 试剂2(R2):15mL×2;试剂1(R1):60mL×1, 试剂2(R2):15mL×1;试剂1(R1):40mL×1, 试剂2(R2):10mL×1;选配校准品:冻干粉型:0.5mL×1;选配质控品:冻干粉型:(2个水平):0.5mL×2。
1.2规格划分说明根据净含量、复溶体积划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体、校准品冻干粉(选配)和质控品冻干粉(选配)组成。
1.3.1 试剂1(R1)液体:双甘肽100mmol/ L1.3.2 试剂2(R2)液体:甘氨酰脯氨酰对硝基苯胺对甲苯磺酸150mmol/L1.3.3 校准品:人血清基质甘氨酰脯氨酸二肽氨基肽酶定值范围:20U/L~100U/L(每批定值)1.3.4 质控品:人血清基质甘氨酰脯氨酸二肽氨基肽酶定值范围:水平1:10U/L~40U/L,水平2:40U/L~100U/L (每批定值)2.1 外观试剂盒中各组件的外观应满足:a)试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b)试剂2(R2)应为浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损;c) 校准品应为白色或淡黄色冻干粉,复溶后应为白色或淡黄色溶液,无混浊,无未溶解物,外包装完整无破损;d) 质控品应为白色或淡黄色冻干粉,复溶后应为白色或淡黄色溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度和空白吸光度变化率2.3.1试剂空白吸光度:在波长405nm(光径1cm)处,试剂空白吸光度(A)应≤1.000。
γ-谷氨酰基转移酶测定试剂盒(GPNA底物法)产品技术要求jiuqiang

γ-谷氨酰基转移酶测定试剂盒(GPNA底物法)适用范围:用于体外定量测定人血清或血浆中的γ-谷氨酰基转移酶的含量。
2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色或黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 测定项目2.3.1 试剂空白a)试剂空白吸光度试剂空白吸光度应≤1.0000。
b)试剂空白吸光度变化率在37℃、405nm波长、1cm光径条件下,用生理盐水作为样品加入试剂测试时,试剂空白吸光度变化率(ΔA/min)应≤0.0050。
2.3.2 准确度用国际参考物质ERM-AD452/IFCC,对试剂盒进行测试,其测量结果的相对偏差应不超过±10%。
2.3.3 分析灵敏度测试50 U/Lγ-谷氨酰基转移酶时,其吸光度变化率(ΔA/min)在0.0066~0.0200之间。
2.3.4 线性区间测试血清样本,试剂线性在[10,1200]U/L(37℃)区间内:a) 线性相关系数︱r︱应不小于0.990;b) [10,50]U/L区间内,线性偏差应不超过±5 U/L;(50,1200] U/L区间内,线性偏差应不超过±10%。
2.3.5 测量精密度a) 重复性对血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
b) 批间差随机抽取三批试剂盒的批间相对极差(R)应≤10%。
2.4 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,分别检测2.1、2.3.1、2.3.2、2.3.3、2.3.4、2.3.5 a)项,结果应符合各项目的要求。
甘氨酰脯氨酸二肽氨基肽酶的方法学研究

甘氨酰脯氨酸二肽氨基肽酶的方法学研究
曹兴建
【期刊名称】《临床检验杂志》
【年(卷),期】1989(7)3
【摘要】本文研究了甘氨酰脯氨酸二肽氨基肽酶(GPDA)的最佳测定条件。
最适
pH8.6,Km 值为1.91±0.08mmol/L,选用158mmol/L Tris、64mmol/L 双甘氨肽、10 mmol/L 底物。
酶促反应速度在70分钟内呈线性,酶活力在600U/L 内呈线性。
高、中,低活力标本批内变异1.7~3.1%,批问变异3.8~6.7%,标本置4℃一周,结果无明显变化。
168例健康者GPDA 为150.1±49.8(2SD)U/L,同时研究了测定管、
底物空白、对硝基苯胺的光学吸收特性,观察了GPA 试剂在不同pH 和不同时间的变化规律。
【总页数】1页(P114)
【作者】曹兴建
【作者单位】不详;不详
【正文语种】中文
【中图分类】R730.43
【相关文献】
1.血清胃蛋白酶原、甘氨酰脯氨酸二肽氨基肽酶测定在胃癌中的临床意义探讨 [J], 武良;张德忠;江伟春;刘泽洪;叶永玲
2.血清唾液酸、上皮膜抗原和甘氨酰脯氨酸二肽氨基肽酶检测在胃癌诊断中的价值
研究 [J], 项文坤;熊锋宝;杨铁一;付唆林
3.尿甘氨酰脯氨酸二肽氨基肽酶检测诊断肝硬化早期肾损害的临床价值分析 [J], 吕金龙
4.尿甘氨酰脯氨酸二肽氨基肽酶检测诊断肝硬化早期肾损害的临床价值分析 [J], 巩锋
5.尿甘氨酰脯氨酸二肽氨基肽酶检测诊断肝硬化早期肾损害的临床价值 [J], 李红平
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPN底物法)
适用范围:用于体外定量测定人血清或血浆中甘氨酰脯氨酸二肽氨基肽酶(GPDA)的活性。
1.1包装规格
包装规格见表1。
表1包装规格
包装规格
1.2主要组成成分
主要组成成分见表2。
表2主要组成成分
注:不同批号的校准品、质控品赋值有差异。
2.1外观
试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;
试剂2为浅黄绿色到黄绿色澄清液体,目测不得有任何沉淀及絮状悬浮物;
校准品为白色或淡黄色粉末状物质,复溶后为浅黄色或黄褐色澄清液体,目测不得有任何沉淀及絮状悬浮物;
质控品为白色或淡黄色粉末状物质,复溶后为浅黄色或黄褐色澄清液体,目测不得有任何沉淀及絮状悬浮物;
试剂盒标签标识清晰,外包装完整无损。
2.2净含量
试剂的净含量应不少于标称量。
2.3试剂空白吸光度
2.3.1A405nm下测定空白吸光度应≤1.0000。
2.3.2A405nm下测定试剂空白吸光度变化率(ΔA/min)应≤0.0500。
2.4准确度
与已上市产品进行比对试验:在[5,500]U/L区间内,相关系数r≥0.975,在[5,60]U/L区间内测定的绝对偏差应不超过±6U/L,在(60,500]U/L区间内测定的相对偏差应不超过±10%。
2.5分析灵敏度
样本浓度为100U/L时,其吸光度变化率≥0.0160。
2.6线性区间
在[5,500]U/L区间内,线性相关系数r≥0.990,在[5,60]U/L区间内测定的绝对偏差应不超过±6U/L,在(60,500]U/L区间内测定的相对偏差应不超过±10%。
2.7测量精密度
2.7.1重复性
使用高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2批间差
随机抽取三批试剂盒的批间相对极差(R)应不大于15%。
2.8校准品、质控品测量精密度
2.8.1重复性
对不同浓度的校准品、质控品分别重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.8.2瓶间精密度
校准品、质控品的瓶间精密度CV应≤15%。
2.9质控品赋值有效性
使用质控品进行测定,所得结果应在靶值范围内。
2.10稳定性
2.10.1试剂盒稳定性
试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1、2.9的要求。
2.10.2校准品复溶稳定性
复溶后校准品在2℃~8℃保存7天,取复溶7天后的校准品定标后,测量试剂准确度,应符合2.4的要求。
2.10.3质控品复溶稳定性
复溶后质控品在2℃~8℃保存7天,测定复溶7天后的质控品,应符合2.9的要求。
2.11校准品溯源性
按GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,试剂盒校准品溯源至企业工作校准品,与浙江夸克生物科技有限公司试剂盒比对赋值。
