还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定
谷胱甘肽含量测定

谷胱甘肽含量测定谷胱甘肽含量测定植物生理学模块实验指导李玲主编科学出版社还原型谷胱甘肽含量的测定方法(分光光度计法)【实验目的】了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程,学习还原型谷胱甘肽含量的测定原理和方法。
【实验原理】谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
谷胱甘肽能和5,5’-二硫代-双-(2-硝基苯甲酸)(5,5’-dithiobis-2-nitrobenoic acid,DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG)。
2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
【器材与试剂】1.实验仪器与用具研钵、高速冷冻离心机、微量移液枪、离心管、试管、水浴锅、容量瓶(100ml、200ml、1000ml)、分光光度计2.实验试剂50g/L三氯乙酸(TCA)溶液(含5mmol/L Na2-EDTA):称取5g三氯乙酸,用蒸馏水溶解稀释至100ml。
再称取186mg Na2-EDTA·2H2O,加入到100ml 50g/L三氯乙酸溶液中溶解。
0.1mol/L磷酸钠溶液缓冲液(pH7.7):配制方法见附录。
0.1mol/L(pH6.8)磷酸钠缓冲液:配制方法见附录。
4mmol/L二硫代硝基苯甲酸(5,5’-dithiobis-2-nitrobenoic acid,DTNB)溶液:称取15.8mg DTNB,用0.1mol/L、pH6.8磷酸缓冲液溶解,定容至10ml,混匀,4℃保存。
现用现配。
100μmol/L还原型谷胱甘肽标准液:称取3.1mg 还原型谷胱甘肽,加入少量无水乙醇溶解,加蒸馏水定容至100ml。
3.实验材料同抗坏血酸。
【实验步骤】1.标准曲线制作取6支试管,编号,按照表1加入各种试剂,混匀,25℃保温反应10min。
禾本科植物谷胱甘肽氧化物酶的活性测定

禾本科植物谷胱甘肽氧化物酶的活性测定摘要:本文以羊草的叶片和根为材料, 用0. 2 mo l /L pH 6. 2的磷酸缓冲液( 含1 mmo l/L EDTA-2Na,5%的水溶性PVP)作为谷胱甘肽过氧化物酶(GSH一PX)的提取介质,偏磷酸为酶促反应的蛋白质沉淀剂, 二硫代对二硝基苯甲酸(DTNB ) 与GSH显色反应3min, 在412 nm测定酶管和非酶管的OD值, 以测定谷胱甘肽过氧化物酶的活性关键词:盐碱胁迫;羊草;GSH-PX;酶活性Analyzing Soluble Sugar Content and Biomass of Sweet Sorghumunder Saline-alkali StressAbstract:Soil salinization is a global issue. Experiments prove that growing state of sweet sorghum shows growth inhibition,lower production and physiological disorders under soil salinity In this study,sweet sorghum as our material,was sowed in neutral soil and saline soil, respectively,exploring characteristics of salinity stress for the sweet sorghum and the change of soluble sugar and biomass. According to the particularity of different soils,we observed the relationship between different varieties and salt-alkali stress at different growth stages.Profound understanding of physiological mechanism of sweet sorghum response to salt-alkali stress for screening sweet sorghum germplasm,identifying salinity tolerance and cultivating the new sweet sorghum species is significance.Keywords: Salt stress; sweet sorghum; Glutathione peroxidase; enzyme actirityⅠ1前言植物是一个需氧代谢的有机体。
不同方法提取谷胱甘肽的比较

不同方法提取谷胱甘肽的比较实验一不同方法提取谷胱甘肽的比较一、实验目的1、掌握从干酵母中粗提谷胱甘肽的各种方法。
2、掌握还原型谷胱甘肽定量的方法。
二、实验原理谷胱甘肽是种重要的三肽,以还原型(GSH)和氧化型(GSSG)广泛的存在于动、植物及微生物。
在生物体内起作用的主要是GSH,是细胞内主要的还原性物质,能保护细胞免受氧化性、毒害性化合物和辐射的伤害,还是酶的辅因子。
GSH在临床上是重要的解毒药物。
谷胱甘肽是小分子物质,水中溶解度较大,细胞表面出现裂缝就能分散到溶剂中,故可用一些温和的方法提取。
本实验采用热处理、冰冻处理、酸处理、有机溶剂处理等方法提取酵母细胞中的谷胱甘肽,比较最后的得率,探讨各种提取方法的优点和缺点。
三、实验器材、材料和试剂1、器材冰箱,离心机,水浴锅,电炉,滴定管,烧杯,玻棒,研钵。
2、实验材料活性干酵母,2%偏磷酸,5%碘化钾,0.0001mol/l碘酸钾溶液,淀粉指示剂,乙酸:乙醇(2:1),36%乙酸溶液。
四、实验步骤1、热水抽提:1g干酵母与5ml水混合,加15ml沸水,置100℃水浴保温10min,立即放入冰水速冷,取10ml离心,取5ml上清滴定,得滴定体积V1。
2、冷冻研磨后有机酸搅拌提取:1g干酵母先在研钵中研细,与10ml水混合,-20℃冷冻成半固体状,研磨5min转入小烧杯,加10ml 36%乙酸搅拌15min,取10ml离心,取5ml上清滴定,得滴定体积V2。
3、酸热处理:1g干酵母加20ml2%偏磷酸,60℃水浴中搅拌抽提15min,置冰水速冷,取10ml离心,取5ml上清滴定,得滴定体积V3。
4、有机混合液处理:1g干酵母加20ml有机混合液(甲酸:乙醇=2:1),室温搅拌抽提15min,置冰水速冷,取10ml离心,取5ml上清滴定,得滴定体积V4。
5、碘量法测定:取5ml待测样品,置于250ml锥形瓶中,加入5ml2%偏磷酸溶液、1ml5%碘化钾溶液和2滴淀粉指示剂,用0.0001mol/L的碘酸钾滴定至溶液由无色变为蓝色为止。
谷胱甘肽的还原实验报告

一、实验目的1. 了解谷胱甘肽(GSH)的还原特性。
2. 掌握还原型谷胱甘肽(GSH)的制备方法。
3. 探讨GSH在生物体内的抗氧化作用。
二、实验原理谷胱甘肽(GSH)是一种由谷氨酸、半胱氨酸和甘氨酸组成的三肽,广泛存在于生物体内。
GSH具有强大的抗氧化作用,可以清除体内的自由基,保护细胞免受氧化损伤。
本实验通过化学还原法,将氧化型谷胱甘肽(GSSG)还原为GSH,并观察其抗氧化活性。
三、实验材料1. 实验试剂:氧化型谷胱甘肽(GSSG)、NADPH、FAD、Tris-HCl缓冲液、pH 7.4、pH 8.0、pH 9.0的磷酸盐缓冲液、pH 10.0的氢氧化钠溶液、0.1 mol/L的EDTA-Na2溶液、0.1 mol/L的FeCl3溶液、2,2'-联氮-二(3-乙基苯并噻唑-6-磺酸二钠盐)(ABTS)溶液。
2. 实验仪器:紫外-可见分光光度计、恒温水浴锅、高速离心机、电子天平、移液器、比色皿等。
四、实验方法1. GSH的制备将一定量的GSSG溶解于pH 7.4的Tris-HCl缓冲液中,加入适量的NADPH和FAD,在37℃水浴锅中反应30分钟。
反应结束后,用高速离心机离心去除沉淀,收集上清液即为GSH。
2. GSH的鉴定取一定量的GSH溶液,加入适量的FeCl3溶液,观察溶液颜色的变化。
若溶液颜色由黄色变为棕色,则说明GSH已成功制备。
3. GSH的抗氧化活性检测将一定量的GSH溶液加入ABTS溶液中,观察溶液颜色的变化。
以相同浓度的ABTS溶液作为对照,在532 nm处测定溶液的吸光度。
通过计算GSH的还原能力,评价其抗氧化活性。
五、实验结果1. GSH的制备将GSSG溶解于pH 7.4的Tris-HCl缓冲液中,加入NADPH和FAD,反应30分钟后,溶液颜色由黄色变为棕色,说明GSH已成功制备。
2. GSH的鉴定将制备的GSH溶液加入FeCl3溶液中,溶液颜色由黄色变为棕色,证明GSH已成功制备。
检测谷胱甘肽还原酶活性水平在乙型肝炎辅助诊断中的应用

检测谷胱甘肽还原酶活性水平在乙型肝炎辅助诊断中的应用谷胱甘肽还原酶(glutathione reductase, GR)是一种重要的酶,属于还原酶家族,它在细胞内参与谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)系统的正常运转。
这一系统在维持细胞内氧化还原平衡中发挥着关键的作用,对于细胞的生存和代谢起着非常重要的作用。
GR在此过程中作为重要的辅助酶,能够还原氧化型的谷胱甘肽(GSSG)为还原型的谷胱甘肽(GSH),从而维持GSH/GSSG的平衡。
近年来,相关研究表明检测GR活性水平有望成为乙型肝炎辅助诊断的新方法。
乙型肝炎(HBV)是一种由乙型肝炎病毒引起的疾病,在我国致病率较高,给人们的生活和健康带来了很大危害。
目前临床上常用的诊断方法包括HBV标志物的检测、肝脏超声检查、肝组织活检等。
这些方法都存在一定的局限性,如HBV标志物检测的敏感性和特异性不高,肝脏超声检查容易受到操作者技术水平的影响,而肝组织活检则存在较为严重的创伤和风险。
寻找新的乙型肝炎辅助诊断方法显得尤为重要。
近年来,国内外的研究者对GR活性水平在乙型肝炎辅助诊断中的应用进行了深入的探讨。
一些研究者发现,HBV感染患者的血清中GR活性水平明显降低,这与正常人群相比存在显著的差异。
这一降低的趋势与HBV感染的程度呈现出一定的相关性,即随着肝炎病情的加重,GR活性水平的降低趋势也会逐渐加重。
GR活性水平的检测可以作为乙型肝炎患者肝脏炎症程度的一个指标,这对于临床上的诊断、鉴别诊断和治疗具有重要的指导意义。
一些研究者还发现,HBV感染对GR活性水平的影响不仅限于肝细胞,同时它还会对全身的氧化还原平衡产生一定的影响。
HBV感染引起的氧化还原平衡失衡不仅表现在肝脏内,同时也会直接对全身的氧化还原平衡产生影响,这也为利用GR活性水平进行乙型肝炎辅助诊断提供了可能。
尽管GR活性水平检测对于乙型肝炎辅助诊断具有潜在的应用前景,但是也需要注意到目前在治疗过程中的一些建议。
氧化型谷胱甘肽(GSSG)检测试剂盒(DTNB 比色法)说明书
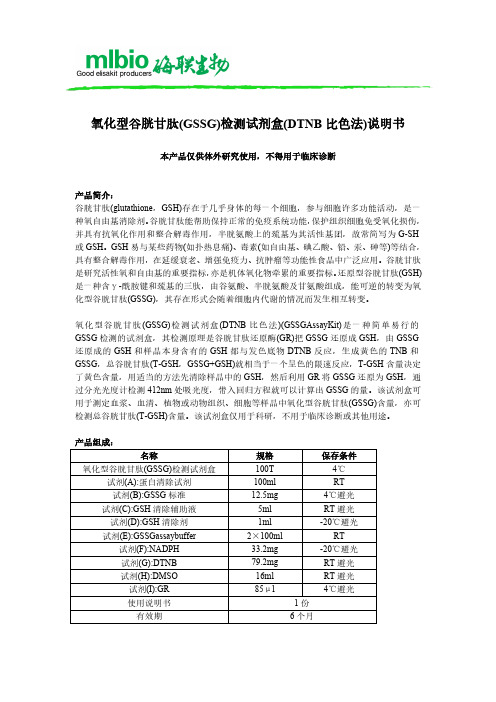
氧化型谷胱甘肽(GSSG)检测试剂盒自备材料:1、匀浆器或研钵、离心管或小试管、低温离心机、水浴锅2、蒸馏水、PBS或生理盐水、70%乙醇3、分光光度计、比色皿操作步骤(仅供参考):1、配制GSSG标准储存液:取12.5mgGSSG标准加入2mlddH2O,溶解并混匀,即为GSSG 标准储存液(10mM)。
一部分立即使用,其余适当分装后-20℃保存。
2、配制GSH清除剂工作液:在1mlGSH清除剂中加入9ml70%乙醇,溶解并混匀,即为GSH 清除剂工作液。
3、配制NADPH工作液:在33.2mgNADPH中加入4mlddH2O,即成NADPH工作液,一部分立即使用,其余适当分装后-20℃保存。
4、配制DTNB储存液:在79.2mgDTNB中加入16mlDMSO,溶解并混匀,即为DTNB储存液(12.5mM)。
一部分立即使用,其余适当分装后-20℃保存。
5、配制GR工作液:按GR:GSSGassaybuffer=1:49的比例混合,即为GR工作液。
-20℃保存,1个月有效。
注意:试剂(I)量较少,使用前应先4℃离心后再使用。
6、配制标准品:把GSSG标准储存液(10mM)用蛋白清除试剂稀释成50μM标准溶液,然后依次稀释成25、12.5、6.25、3.125μMGSSH标准溶液,取空白、3.125、6.25、12.5、25、50μMGSSG标准溶液6个点作标准曲线。
注意:由于GSSG标准在蛋白清除试剂中不太稳定,用蛋白清除试剂配制的GSSG溶液必须新鲜配制后使用,不可冻存后再使用。
7、准备样品:①红细胞或血浆样品:取新鲜血液,600r/min离心10min,沉淀为红细胞,上清为血浆。
对于红细胞,用PBS洗涤两次,取约50μl红细胞沉淀或血浆,加入50μl蛋白清除试剂,充分Vortex振匀。
4℃或冰浴放置10min,4℃10000r/min离心10min,取上清,用于GSSG测定,样品需暂时4℃保存备用,不立即测定的样品可以-70℃保存,但不宜超过10天。
26二氯酚靛酚滴定法原理

26二氯酚靛酚滴定法原理26二氯酚靛酚滴定法是一种常用的测定还原型谷胱甘肽(GSH)的方法,其原理主要基于二氯酚靛酚与谷胱甘肽在碱性环境下的反应。
以下是关于该方法原理的详细解释:一、背景介绍谷胱甘肽是一种重要的三肽,它参与了人体许多重要的生物化学反应。
谷胱甘肽具有还原性,它在细胞内起到了保护其他分子免受氧化损伤的作用。
然而,随着年龄的增长或由于病理情况,谷胱甘肽的水平可能会下降,这可能导致细胞对氧化应激的敏感性增加。
因此,测量血液或组织中的谷胱甘肽水平对于了解生物体的健康状况和疾病过程具有重要意义。
二、方法原理26二氯酚靛酚滴定法是一种常用的测定谷胱甘肽的方法,该方法基于二氯酚靛酚与谷胱甘肽在碱性环境下的反应。
在强碱性环境中(pH 8.0-9.0),二氯酚靛酚(DCPIP)被还原为红色醌,而谷胱甘肽将二氯酚靛酚还原为无色的二氯酚靛酚-谷胱甘肽混合物。
在此过程中,谷胱甘肽被氧化为氧化型谷胱甘肽(GSSG)。
通过滴定混合物中的二氯酚靛酚,可以测定出谷胱甘肽的浓度。
该方法的反应机制如下:1.在碱性环境中,二氯酚靛酚被还原为红色醌:DCPIP + H2O →醌+ H+2.谷胱甘肽将二氯酚靛酚还原为无色的二氯酚靛酚-谷胱甘肽混合物:GSH+ DCPIP →DCPIP-GSH3.生成的混合物可被滴定:DCPIP-GSH + NaOH →醌+ NaCl + GSSG4.通过滴定混合物中的二氯酚靛酚可以测定谷胱甘肽的浓度:DCPIP-GSH+ NaOH →醌+ NaCl + GSSG三、实验步骤1.样品处理:将样品(如血液、组织等)进行处理,以提取其中的谷胱甘肽。
通常需要将样品中的蛋白质沉淀,以去除干扰物质。
2.碱性环境:在提取的谷胱甘肽溶液中加入NaOH,使溶液的pH值达到8.0-9.0。
3.加入二氯酚靛酚:在碱性溶液中加入适量的二氯酚靛酚,使其与谷胱甘肽反应。
4.滴定:用标准NaOH溶液滴定反应后的混合物,直到颜色变化,记录消耗的NaOH体积。
谷胱甘肽过氧化物酶 微板法

谷胱甘肽过氧化物酶微板法
谷胱甘肽过氧化物酶(GSH-Px)微板法是一种检测谷胱甘肽过氧化物酶活性的方法。
其原理是利用谷胱甘肽过氧化物酶催化谷胱甘肽还原型(GSH)氧化为氧化型谷胱甘肽(GSSG)的特性,采用微板法检测GSH的减少量,从而计算出谷胱甘肽过氧化物酶的活性。
具体操作步骤如下:
1.制备标准品和待测样品。
2.在微板中加入试剂1和待测样品或标准品,37℃孵育10分钟。
3.加入试剂2,37℃孵育10分钟。
4.加入试剂3,37℃孵育5分钟。
5.加入试剂4,37℃孵育5分钟。
6.加入试剂5,37℃孵育10分钟。
7.加入试剂6,37℃孵育10分钟。
8.加入试剂7,37℃孵育10分钟。
9.加入试剂8,37℃孵育10分钟。
10.加入试剂9,37℃孵育10分钟。
11.加入终止液,混匀后于412nm波长处测定各孔的光密度值。
细胞抗氧化实验报告

一、实验背景随着生活节奏的加快和环境污染的加剧,自由基损伤已成为导致细胞衰老和疾病的重要因素。
因此,研究细胞抗氧化机制对于揭示疾病发生机理和开发新的治疗策略具有重要意义。
本实验旨在探讨细胞抗氧化系统的功能及其调控机制。
二、实验材料与试剂1. 细胞:小鼠成纤维细胞(3T3-L1)2. 试剂:DPPH自由基清除剂、还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、NADPH、FAD、黄嘌呤、牛血清白蛋白、无水乙醇、磷酸盐缓冲盐溶液(PBS)、Tris-HCl缓冲液、考马斯亮蓝G-250等。
三、实验方法1. 细胞培养:将小鼠成纤维细胞(3T3-L1)接种于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2培养箱中培养。
2. DPPH自由基清除实验:取对数生长期的细胞,用PBS洗涤后,加入不同浓度的GSH和DPPH自由基清除剂,于37℃孵育30min。
采用分光光度法测定DPPH自由基的吸光度值,计算清除率。
3. GSH含量测定:采用比色法测定细胞中的GSH含量。
4. SOD活性测定:采用黄嘌呤氧化酶法测定细胞中的SOD活性。
5. CAT活性测定:采用牛血清白蛋白法测定细胞中的CAT活性。
6. GSSG还原实验:取对数生长期的细胞,用PBS洗涤后,加入不同浓度的NADPH和GSSG,于37℃孵育30min。
采用分光光度法测定GSSG的吸光度值,计算还原率。
四、实验结果1. DPPH自由基清除实验:随着GSH浓度的增加,DPPH自由基清除率逐渐升高,表明GSH具有较好的自由基清除能力。
2. GSH含量测定:与空白组相比,抗氧化剂处理组的GSH含量显著升高。
3. SOD活性测定:与空白组相比,抗氧化剂处理组的SOD活性显著升高。
4. CAT活性测定:与空白组相比,抗氧化剂处理组的CAT活性显著升高。
5. GSSG还原实验:随着NADPH浓度的增加,GSSG的还原率逐渐升高,表明NADPH具有较好的抗氧化作用。
还原型谷胱甘肽 (reduced glutathione,GSH)含量测定试剂盒使用说明

还原型谷胱甘肽(reduced glutathione,GSH)含量测定试剂盒使用说明产品简介:GSH/GSSG是细胞内最重要的氧化还原对之一。
因此,测定细胞内GSH和GSSG含量以及GSH/GSSG比值,能够很好地反映细胞所处的氧化还原状态。
DTNB与GSH反应生成复合物,在412nm处有特征吸收峰;其吸光度变化与GSH含量成正比。
试验中所需的仪器和试剂:可见分光光度计、低温离心机、水浴锅、可调节移液器、1ml比色皿、双蒸水产品内容:试剂一×1支,充分溶解于100ml双蒸水,4℃保存试剂二×1支,充分溶解于50ml试剂一中,4℃保存试剂三×1支,充分溶解于10ml双蒸水中,4℃避光保存操作步骤:一、样品前处理:取组织约0.1g,加1ml试剂二,冰上充分研磨,8000rpm4℃离心10min,取上清。
(如上清不清澈,再离心3min)GSH测定操作:测定前将试剂一于25℃水浴20min按每100mg组织加入1000µL生理盐水的比例进行匀浆。
8000g4℃离心10分钟,取上清,置冰上待测。
对于非哺乳动物组织:按每100mg组织加入1000µL提取液的比例进行匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。
(2)血清(浆)样品:直接检测。
二、测定操作表:测定管空白管样本0.1ml/试剂一0.7ml0.7ml蒸馏水/0.1ml试剂三0.2ml0.2ml 迅速混匀,于412nm测吸光值,并记录第60s的OD值GSH含量计算:GSH标准曲线公式:y=0.0015x+0.0818(x为GSH浓度,y为吸光值)液体中GSH(µmol/L)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数组织中GSH计算:①GSH(µmol/mg prot)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品蛋白浓度(Cpr)②GSH(µmol/g mass)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品质量(g)注意事项:(1)样品处理等过程均需要在冰上进行,且须在当日测定酶活力,以免影响其活力测定时,除试剂一外,其它试剂均需放置在冰上;(2)样本测定前先取1-2个样做预实验,如吸光值太高(超过标准曲线范围,即y >0.2时),应先用试剂二稀释到适当倍数,使得吸光值在标准曲线范围内。
长白山野生蓝莓中还原型谷胱甘肽含量的测定

长白山野生蓝莓中还原型谷胱甘肽含量的测定谷胱甘肽(L-γ-谷氨酰-L-半胱氨酰-甘氨酸,Glutathione)是一种同时具有γ-谷氨酰基和巯基的生物活性三肽化合物,作为生物体内的非蛋白巯基化合物,谷胱甘肽主要有还原型(GSH)和氧化型(GSSG)两种形态,在机体中大量存在并起主要作用的是还原型谷胱甘肽。
临床上,谷胱甘肽可以迅速提高机体免疫力,在抗氧化、抗辐射、清除自由基、解毒、促进铁质吸收等方面具有良好的效果且无副作用;在食品加工领域,谷胱甘肽具有增强食品营养价值和强化食品风味等功能。
科学家们一直研究它在各种生物体内的生理作用,其中GSH在人体各种组织细胞中的含量以及与各种疾病、组织损伤的关系至今仍然是研究的热点[1-2]。
蓝莓,又称笃斯、越橘,俗称都柿,为杜鹃花科越橘属野生落叶灌木,其果实为浆果,成熟后为蓝紫色,球形或椭圆形,果皮有白霜。
蓝莓的果味鲜美、营养丰富,英国权威营养学家将蓝莓列为15种健康食品之首,联合国粮农组织也将蓝莓列为人类五大健康食品之一。
本研究采用DTNB作为GSH的衍生化试剂进行超声波细胞破壁,这种操作可以对蓝莓粉末破壁的同时又可以給衍生化试剂充分的反应时间进行衍生化反应而生成稳定的GSH衍生化产物。
其目的是利用衍生化试剂所进行的化反应来避免巯基化合物从细胞内流出时而被外界的其他化学环境破坏,从而生成稳定的产物,利用其产物的颜色来进行分光光度分析而得到样品中的GSH含量及定性信息。
1 材料与方法1.1实验材料、试剂与仪器1.1.1材料蓝莓购于延吉市千盛超市。
1.1.2试剂与药品5,5-二疏基-2,2-二硝基苯甲酸/DTNB、还原型谷胱甘肽、磷酸氢二钠、氢氧化钠、石油醚、海砂。
1.1.3实验仪器JA-3100精密电子天平(深美仪器有限公司);FA1004电子天平(上海良平仪器仪表有限公司);CX-100高速多功能粉碎机(上海市晟喜制药机械有限公司);DHG-*****-Ⅲ电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司);KQ-500DE型医用数控超声波清洗器(昆山市超声仪器有限公司);TDL-5000B冷冻离心机(上海安亭科学仪器厂);PHS-3CpH计(上海仪电科学仪器股份有限公司);UV-1800紫外/可见分光光度计(上海美谱达仪器有限公司);SJ-2028R榨汁机(佛山市顺德区金宜美电器有限公司);80目网筛;索氏提取器。
总谷胱甘肽检测试剂盒
50 μl
50 μl
50 μl
b. 加入50微升0.16mg/ml NADPH溶液,混匀。
c. 立即用酶标仪测定A412,每5分钟测定一次或实时测定,共测定25分钟,测得5个数据。(说明:为了简化实验步骤,可 以在加入NADPH溶液混匀后25分钟,仅测定一次A412)。如果仪器可以设置温度,把温度设置在25℃,否则就在室温
2. Xiao-Long W, Chuan-Ping Y, Kai X, Ou-Jv Q. Selenoprotein W depletion in vitro might indicate that its main function is not as an antioxidative enzyme. Biochemistry (Mosc). 2010;75(2):201-7.
NADPH。每检测一个样品需50微升0.16mg/ml NADPH。
2. 标准品的准备:
把10mM GSH储备液用蛋白去除试剂S溶液稀释成50μM GSH溶液。然后依次稀释成25、15、10、5、2μM GSH溶液。取
50、25、15、10、5、2μM GSH溶液六个点做标准曲线。注意:由于GSH在蛋白去除试剂S溶液中不太稳定,用蛋白去除
b. 细胞样品的准备。请尽量使用新鲜的细胞进行测定,而不要使用冻存的细胞进行测定。PBS洗涤细胞一次,离心收集
细胞,吸尽上清。加入细胞沉淀体积3倍量的蛋白去除试剂S溶液,即如果细胞沉淀为10微升,则加入30微升蛋白去除
试剂S溶液,充分Vortex。(细胞沉淀的体积可以根据细胞沉淀的重量进行估算。收集细胞前后分别对离心管进行称
等处理,而直接加入适量蛋白去除试剂S溶液进行匀浆)。4℃放置10分钟后,10,000g 4℃离心10分钟,取上清用于总
谷胱甘肽洗脱的原理

谷胱甘肽洗脱的原理
谷胱甘肽(GSH)洗脱是一种常用的蛋白质结构分析方法。
它的原理是利用高效液相色谱(HPLC)技术,通过化学还原将蛋白质样品中的谷胱甘肽分子(还原型GSH)洗脱出来,并通过检测还原型GSH的含量来确定蛋白质样品中的GSH 含量。
具体的洗脱原理如下:
1. 首先,将蛋白质样品加入含有还原剂(例如二硫苏糖(DTT)或二巯基乙醇(DME))的缓冲溶液中进行还原处理。
还原剂的作用是将蛋白质样品中的氧化型谷胱甘肽(GSSG)还原为还原型GSH。
2. 然后,将还原后的样品注入HPLC装置中的柱子,通常使用反相柱或离子交换柱来实现GSH的分离和纯化。
反相柱常用的是C18柱,离子交换柱常用的是强阳离子交换柱。
根据需要,还可以使用梯度洗脱方法来进一步分离和提纯GSH。
3. 最后,通过检测对还原型GSH的吸光度或荧光强度进行定量。
通常,GSH
具有较弱的UV吸收或荧光特性,可以通过对样品进行UV或荧光检测来测量GSH的含量。
谷胱甘肽的洗脱原理通过还原和柱子分离的步骤将还原型GSH从蛋白质样品中分离出来,并通过检测方法定量分析GSH的含量,从而用于蛋白质结构和功能的研究。
还原型谷胱甘肽(GSH)检测

还原型谷胱甘肽(GSH)检测
谷胱甘肽(Glutathione,GSH)是由谷氨酸、半胱氨酸及甘氨酸组成,含有巯基的三肽,广泛存在于动、植物中,在生物体内有着重要的作用,如抗氧化作用、整合解毒作用。
谷胱甘肽在体内以还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)两种形式存在,其活性成分为还原型谷胱甘肽,可参与体内三羧酸循环,激活各种酶,对不稳定的眼晶状体蛋白质巯基有抑制作用,从而抑制白内障的发展,抑制角膜及视网膜病变,在角膜损害时能促进上皮组织的修复。
迪信泰检测平台采用高效液相色谱(HPLC)和液质联用(LC-MS)法,可高效、精准的检测还原型谷胱甘肽的含量变化。
此外,我们还提供其他氨基酸及其代谢物检测服务,以满足您的不同需求。
HPLC和LC-MS测定还原型谷胱甘肽样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)
2. 相关质谱参数(中英文)
3. 质谱图片
4. 原始数据
5. 还原型谷胱甘肽含量信息。
谷胱甘肽过氧化物酶检测方法

谷胱甘肽过氧化物酶检测方法
谷胱甘肽过氧化物酶检测方法是一种用于测定生物体内谷胱甘
肽过氧化物酶(GPx)活性的方法。
本方法基于GPx的催化作用,将
过氧化氢还原成水,并在反应过程中消耗还原型谷胱甘肽(GSH),使其转变为氧化型谷胱甘肽(GSSG)。
测定反应前后GSH和GSSG的比例变化,即可计算出样品中GPx的活性。
常用的谷胱甘肽过氧化物酶检测方法包括紫外-可见分光光度法、荧光法和色谱法等。
其中,紫外-可见分光光度法是常用的定量方法,其原理是利用GPx催化剂将过氧化氢还原为水,测定反应前后NADPH 浓度的变化。
荧光法利用GSH与荧光探针的反应性,在荧光信号变化的同时测定GPx活性。
色谱法则是在高效液相色谱仪上使用GSH和GSSG标准品,通过检测样品中这两种化合物的浓度,计算出GPx活性。
总体而言,谷胱甘肽过氧化物酶检测方法是一种有效的检测生物体内GPx活性的方法,适用于疾病诊断和治疗效果评估等领域。
- 1 -。
谷胱甘肽GSH/GSSG氧化还原态各指标的测定

关 键 词 氧 化 还 原 平 衡 态 ; H/ S G 氧 化 还 原 对 GS G S
氧 化还 原 态 ( e o tts 平 衡 是 机 体 内环 境 R d xsau ) 稳定 ( o ots ) h mes i 的基 本 内 涵 之 一 , 可 以 影 响 到 as 它
原态 。
标 准 液具 体 制备 方法见 表 1 。
表 1 GS 标 准 曲线 的 制 备 H
1 材 料与方 法
研究 对 象 : 0 2 0名健 康 体 检者 , 体 检 心 、 等 经 肺 功 能正 常 , 、 血 尿生 化检 查无 异 常。
材 料 : 光 试 剂 邻 苯 二 醛 ( —p ta e y e 荧 O hhl h d , d o T) N 一 乙基 马 来 酰 亚 胺 ( —eh l lmie P 、 N tyma i d , e NE 购 自 瑞 士 Fu a公 司 ; 光 甘 肽 还 原 型 M) l k 谷 ( S 和氧 化 型( S G) 准 品购 自 Sg 公 司 , G H) GS 标 i ma 其 余 均 为 国产分 析 纯试 剂 。 主要 仪 器 及设 备 : 日本 岛 津R F一5 0 0 0型荧 光分 光光 度 仪 、 国 贺利 氏低 温 德
性 、 胞 和 器 官 的功 能 , 细 以及 细 胞 的增 殖 、 化 、 分 凋
血浆 加入 等 体 积 1 %偏 磷 酸 除 蛋 白 , 行 G H 测 0 进 S
亡、 坏死 等 许 多 生理 、 理 生 理 过程 。 因此 , 测 体 病 监
液 的氧化 一还原 态 成为近 年来 人 们高 度重 视的 一个 基 础领 域 。 由 于大 量 的体 内生 化反 应 属氧化 一还 原 反应 , 机体 内存 在着 种类 繁 多 的还 原 型 、 且 氧化 型物 质, 因此 , 选择 何种 指标 能最 有效 地反 映体液 的氧化
植物叶片中GSH含量测定
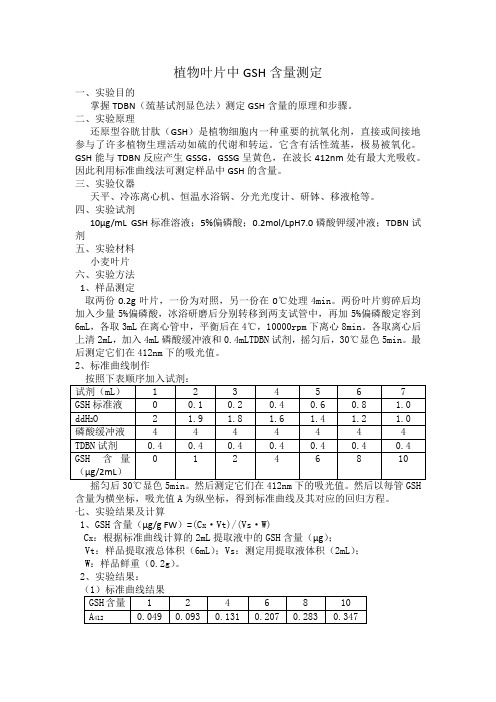
植物叶片中GSH含量测定一、实验目的掌握TDBN(巯基试剂显色法)测定GSH含量的原理和步骤。
二、实验原理还原型谷胱甘肽(GSH)是植物细胞内一种重要的抗氧化剂,直接或间接地参与了许多植物生理活动如硫的代谢和转运。
它含有活性巯基,极易被氧化。
GSH能与TDBN反应产生GSSG,GSSG呈黄色,在波长412nm处有最大光吸收。
因此利用标准曲线法可测定样品中GSH的含量。
三、实验仪器天平、冷冻离心机、恒温水浴锅、分光光度计、研钵、移液枪等。
四、实验试剂10µg/mL GSH标准溶液;5%偏磷酸;0.2mol/LpH7.0磷酸钾缓冲液;TDBN试剂五、实验材料小麦叶片六、实验方法1、样品测定取两份0.2g叶片,一份为对照,另一份在0℃处理4min。
两份叶片剪碎后均加入少量5%偏磷酸,冰浴研磨后分别转移到两支试管中,再加5%偏磷酸定容到6mL,各取3mL在离心管中,平衡后在4℃,10000rpm下离心8min。
各取离心后上清2mL,加入4mL磷酸缓冲液和0.4mLTDBN试剂,摇匀后,30℃显色5min。
最后测定它们在412nm下的吸光值。
2、标准曲线制作含量为横坐标,吸光值A为纵坐标,得到标准曲线及其对应的回归方程。
七、实验结果及计算1、GSH含量(µg/g FW)=(C x·Vt)/(Vs·W)C x:根据标准曲线计算的2mL提取液中的GSH含量(µg);Vt:样品提取液总体积(6mL);Vs:测定用提取液体积(2mL);W:样品鲜重(0.2g)。
2、实验结果:(1)标准曲线结果得到标准曲线及回归方程如下图:(2)样品测定结果计算。
间接分光光度法测定还原型谷胱甘肽

分光光度法测定水溶液中的还原型谷胱甘肽, 测量 精密度及准确度可满足分析要求, 而且操作简便、快 速、经济, 可用于不含其它强还原剂的样品中还原型 谷胱甘肽的测定。
参 考文献 1 刘娟, 王雅琴, 刘刚, 等. 发酵液中还 原型谷胱 甘肽三种 测定方法
分光光度计: 721型, 上海第三分析仪器厂; pH 计: 320型, 梅 特勒 - 托利多仪器上海有限 公司; 电热恒温水浴锅: HH S11- 2型, 北京长安科学 仪器厂; 还 原 型谷 胱甘 肽标 准溶 液: 100 m g /L。称取 0. 025 0 g还原型谷胱甘肽 ( 生化试剂, 第二军医大 学政翔化学试剂研究所 ) , 用少量水溶解后移入 250 mL 容量瓶中, 以水稀释至刻度; 显色剂: 称取邻菲罗啉 0. 091 0 g, 加入 1 mo l /L 盐酸溶液 2 m L、硫酸铁铵 0. 238 0 g, 溶解后用水稀 释至 100 mL;
20. 7
3. 4 103. 5
注: 1# 样 品中 含 有 400 m g /L M gSO 4、400 mg /L C aC l2、200 m g /L N aC 、l 20 m g /L葡萄糖、0. 1 mg /L 脱氧核 糖核酸; 2# 样 品中含 有 400 mg /L N aC l、400 mg /L M gSO 4、400 m g /L C aC l2、40 mg /L 蔗糖、0. 2 mg /L 脱氧核糖核酸。
G SH. 分析试验室, 2004, 23( 12 ): 85 6 李红, 陈玉姬, 任乃林. 谷胱甘肽的极谱测定. 吉林化工学院学报,
2003, 20 ( 1) : 22 7 杨维平, 王卓, 章竹君. 偶合反应流动注射化学发光分析法测定有
细菌毒素氧化呈色反应

细菌毒素氧化呈色反应是指某些细菌毒素具有氧化还
原性质,可以将无色的氧化型谷胱甘肽(GSH)转化为有色
的还原型谷胱甘肽(GSSG)。
通过检测GSSG的生成量,可以反映细菌毒素的活性。
该反应的具体步骤如下:
细菌毒素与谷胱甘肽(GSH)反应,将GSH氧化为GSSG。
GSSG在谷胱甘肽还原酶的作用下,将两个谷胱甘肽分子还原为一个谷胱甘肽分子和一个二硫键。
二硫键将两个谷胱甘肽分子连接在一起,形成一个二聚体谷胱甘肽(GSSG)。
GSSG可以与某些染料发生呈色反应,生成有色的产物。
通过检测呈色反应的强度,可以反映细菌毒素的活性。
例如,如果细菌毒素的活性增强,则生成的GSSG量增加,
呈色反应的强度也会增强。
如果细菌毒素的活性降低或丧失,则生成的GSSG量减少或没有,呈色反应的强度也会减弱或
没有。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定
关键词:还原型谷胱甘肽GSH氧化型谷胱甘肽GSSG测定2009-04-24 00:00 来源:互联网点击次数:6147
GSH和GSSG 参照Anderson等(1992)。
取0.5 g样品,加入3 mL冰冷的6%的偏磷酸(含1 mmol•L-1 EDTA ,pH 2.8),冰浴研磨,匀浆液以20,000 g,4 ℃离心15 min,取上清液来马上测定GSH和GSSG的含量或储存在-20 ℃下等待测定。
总的GSH和GSSG含量测定如下:200 μL提取液加 1.2 mL反应液包含400 μL反应液1(110 mmol•L-1 Na2HPO4•7H20,40 mmol•L-1NaH2PO4•H2O,15 mmol•L-1EDTA,0.3 mmol•L-15,5‘-dithiobis-(2-nitrobenzoic acid)DTNB,0.04% BSA)、320 μL反应液2 (1 mmol•L-1 EDTA,50 mmol•L-1 imidazole 咪唑solution and 0.02% BSA)、400 μL反应液3(5% Na2HPO4,pH 7.5的溶液稀释50倍)、80 μL 9.0 mmol•L-1 NADPH。
测定OD412下的吸收值。
GSSG 含量测定如下:200 μL提取液加入1 mL的2-2乙烯嘧啶(稀释50倍)在25°C下水浴1 h再测定OD412下的吸收值。
GSH的含量可以从总的GSH和GSSG含量中减去GSSG含量获得。
GSH测定方法:取样品0.5 g,加入预冷的5%磺基水杨酸2.5 ml和少许石英砂,充分冰预研磨,转入离心管中,于4℃下20,000×g离心20min,将上清液分装,液氮冷冻后于-20℃保存或直接进行抗氧化剂分析。
取50 μL上清液,用5% 磺基水杨酸定容至100 μL (即加入5% 磺基水杨酸50 μL),加入24 μL 1.84 mol•L-1三乙醇胺triethlene diamine以中和样液,加入50 μL 10% 乙烯吡啶Polyvinyl pyridine (用70% 乙醇配制),25℃水浴1 h,以除去GSH,到时加入706 mL 50 mmol•L-1磷酸缓冲液,pH 7.5,内含2.5 mmol•L-1 EDTA,加入20 μL 10 mmol•L-1 NADPH 和80 μL 12.5 mmol•L-1 DTNB(二硫硝基苯甲酸),混匀,25℃保温10 min,到
时加入20μL 50 U•mL-1 GR,总体积为1 mL,立即混匀,读出3 min时的OD值。
此法用来测定GSSG,总的谷胱甘肽(GSH +GSSG)的测定,只要把上述的乙烯吡啶用等体积的蒸馏水替代即可。
以5% 磺基水杨酸为溶剂,用同样的方法制作GSSG标准曲线。
叶绿素含量的测定参照Arnon(1949)的方法。
从选取第二片完全展开叶,剪碎,称取0.1 g置于研钵中,加少量80%丙酮研磨成匀浆,定容至25 mL,摇匀并置于避光处,待残渣发白后过滤,以80%丙酮作为对照,在663 nm 和645 nm下读取OD值。
样品中叶绿素含量(mg•g-1FW)的计算公式为:叶绿素a含量=0.25
(12.7OD663-2.69OD645);叶绿素b含量=0.25(22.9OD645-4.68OD663)。
