镀铝复合膜袋质量标准整理版版
镀铝膜的质量控制要求和检验方法

镀铝膜的质量控制要求和检验方法镀铝膜的质量控制要求和检验方法,看似一个很专业的话题,其实也挺接地气的,尤其是在日常生产和应用过程中,咱们要关注的其实就是如何确保这些膜的质量能达到标准,不能马马虎虎,毕竟做事讲究的是“精益求精”。
所以,咱们聊聊镀铝膜的质量控制,看看要怎么做,才能避免出问题。
镀铝膜是指在薄膜上镀上一层铝金属的材料,它通常用于包装、电子、汽车等多个行业。
因为铝金属有很好的反射性、抗氧化性和耐腐蚀性,所以这种膜的性能直接关系到它的使用效果。
如果镀铝膜的质量不过关,那不仅影响产品的使用效果,还会造成浪费,甚至带来安全隐患。
想想看,一袋用镀铝膜包装的食品,如果膜有瑕疵,密封不好,食品可能就容易变质,这可不得了!那怎么确保镀铝膜的质量呢?答案就在质量控制上。
镀铝膜的质量控制其实是一个多方面的工作,得从多个环节入手。
要注意原材料的选择,铝金属的纯度、薄膜的厚度等等,直接影响到镀铝膜的性能。
如果原材料选错了,就像盖房子用错了砖,别说质量不稳定,成本也能让你翻车。
好了,原材料问题解决了,接下来就是镀铝工艺了。
要保证镀铝膜的质量,工艺控制很关键。
镀铝的时候,温度、压力、时间等都得精确控制,一点差错,膜的质量就不稳定,可能就出现色差、气泡或者镀层不均匀等问题。
讲到这里,很多人可能会问,怎么知道这些质量控制得好不好呢?是不是得有一些具体的检验方法?当然有啦。
质量检验可不是随便搞搞的,必须得严谨。
外观检查是最基础的一步。
拿到镀铝膜,首先得看看有没有明显的瑕疵,什么褶皱啊、气泡啊、脱落的地方。
这些看起来小问题,但影响可大了!不过,光靠眼睛看可不行,接下来得用一些专业工具,像是测厚仪,来检查膜的厚度是否均匀。
镀铝膜的厚度直接决定了它的质量,太薄了可能抗拉强度不够,太厚了又浪费成本。
然后是密封性测试。
这可不能忽视,要知道,镀铝膜常常是用于包装,包装一旦不严密,就得给产品“开了个口子”,搞不好产品就暴露在空气中,容易变质或者受潮。
镀铝复合膜袋质量标准

包装材料质量标准编号:WJ-ZL-BC-009-01药品包装用复合膜(袋)质量标准批准人/日期:年月日审核人/日期:年月日制定人/日期:年月日生效日期:年月日颁发部门:质量保证部分发部门:质量保证部、物料管理部1.目的建立药品包装用复合膜(袋)检验的质量标准2.适用范围适用于本公司药品包装用复合膜(袋)的质量检验3.职责质检员、质检室主任对本标准的实施负责4.依据国家药品监督管理局药包材标准(YBB00132002-2015)5.检查内容5.1【鉴别】红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,每层应分别与对照图谱基本一致。
(铝、纸成分可不做)5.2【外观】取本品适量,在自然光线明亮处,正视目测。
不得有穿孔,异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、赃污等缺陷。
复合袋的热封部位应平整、无虚封。
5.3【阻隔性能】5.3.1水蒸汽透过量照塑料薄膜和片材透水蒸气性试验方法杯式法(GB1037-88)的规定进行。
试验时热封面向湿度低的一侧,试验温度(38±5)℃,相对湿度(90±2)%,应符合表2的规定。
5.3.2氧气透过量除另有规定外,按塑料薄膜和薄片气体透过性试验方法压差法(GB/T1038-2000)的规定进行。
试验时热封面向氧气低压侧,试验温度(23±2)℃,应符合表2的规定。
表2阻隔性能定,纵、横向剥离强度平均值应符合表3规定。
5.5【复合袋的热合强度】照热合强度测定法(YBB00122003-2015)测定。
测得值应符合表3规定。
表3机械性能5.6材料溶剂残留量(YBB00312004-2015)测定法测定,溶剂残留总量不得过5.0mg/m2,其中苯及苯类溶剂残留量均不得检出。
5.7【袋的耐压性能】取5个袋,袋内填充约二分之一袋容量的水,并热合封口(参照生产工艺采用的热合条件)。
将试样逐个放在上、下板之间,试验中上、下板应保持水平,不变形,与袋的接触面必须光滑,上、下板的面积应大于试验袋。
铝箔袋检验标准
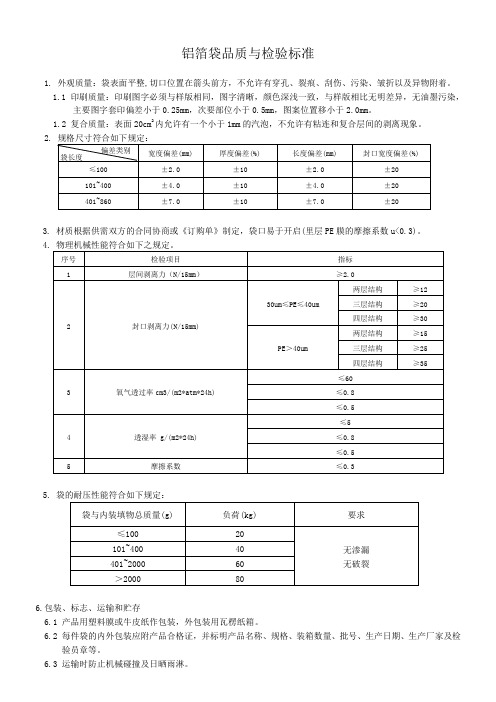
铝箔袋品质与检验标准
1. 外观质量:袋表面平整,切口位置在箭头前方,不允许有穿孔、裂痕、刮伤、污染、皱折以及异物附着。
1.1 印刷质量:印刷图字必须与样版相同,图字清晰,颜色深浅一致,与样版相比无明差异,无油墨污染,
主要图字套印偏差小于0.25mm,次要部位小于0.5mm,图案位置移小于2.0mm。
1.2 复合质量:表面20cm2内允许有一个小于1mm的汽泡,不允许有粘连和复合层间的剥离现象。
3. 材质根据供需双方的合同协商或《订购单》制定,袋口易于开启(里层PE膜的摩擦系数u<0.3)。
5.
6.包装、标志、运输和贮存
6.1 产品用塑料膜或牛皮纸作包装,外包装用瓦楞纸箱。
6.2 每件袋的内外包装应附产品合格证,并标明产品名称、规格、装箱数量、批号、生产日期、生产厂家及检
验员章等。
6.3 运输时防止机械碰撞及日晒雨淋。
食品包装用塑料与铝箔复合膜、袋质量标准
文件制修订记录
1.0目的
依据GB/T28118-2011食品包装用塑料与铝箔复合膜、袋建立其内控质量标准,确保产品质量。
2.0适用范围
适用于公司食品包装用塑料与铝箔复合膜、袋的采购、储存、检验的质量控制。
3.0职责
3.1供应链部负责食品包装用塑料与铝箔复合膜、袋的采购,供方质量必须符合控制指标项下要求;
3.2库管员负责食品包装用塑料与铝箔复合膜、袋的大小,“外观”等项目的验收;
3.3库房以供方质量证明或质量管理部检验报告单为依据办理入库等相关手续。
4.0质量标准
4.1外观:应平整,无皱纹,封边良好。
不得有裂纹。
4.2控制指标:
提供检验报告书。
4.4贮藏:干燥处,密封保存。
4.5复检期:12个月。
复合铝箔袋(膜)的检验标准

±0.4%
膜卷端面
不平整度
≤3mm
二、物理性能检测标准:
项目
指标标准
检测方法
耐热性能
无明显变形、热封部位无剥离现象
生产过程中实测
跌落性能
袋与内装物总重量
≤100g
跌落高度800mm
无渗漏、无破裂
取3个样品袋,内装规定重量的实际填充物或类似内容物后封口,在水泥地上按规定高度将袋水平方向和垂直方向各自由落下一次,进行目测
溶剂残留量
≤10mg/m2
见备注一
氧气透过量
≤0.2cm3/m2·24h·atm
按GB1038的规定进行
水蒸气透过量
≤0.3g/ m2·24h
按GB/T16928的规定进行
同色密度偏差
≤0.05Ds
按GB7707-87的规定进行
套印偏差
±0.3mm
撕裂力(纵横向)
≥3.0N
按QB/T1130的规定进行,其中纵横向试样各裁取至少3个,试验时以单个试样进行测定,撕裂负荷数值,以3个试样最大撕裂负荷的算术平均值表示,精确到0.1N
偏
差
铝
箔
袋
袋宽偏差
±1mm(袋宽度<100)
±2mm(袋宽度101~400)
游标卡尺测量
袋长偏差
<400mm±1.5mm
≥400 mm±2.0mm
封口宽度
±10%
烫脚长
≤100mm≤3mm
101~400mm≤4mm
≥400mm≤5mm
厚度偏差
+ 10%
螺旋测微仪测量
铝
箔
膜
膜宽偏差
±0.5mm
游标卡尺测量
复合膜袋检测标准

复合膜袋检测标准《复合膜袋检测标准:守护包装安全的“武林秘籍”》嘿,你知道吗?在商品的世界里,复合膜袋就像是超级英雄的战衣,默默地保护着里面的宝贝。
但如果这个“战衣”不符合标准,那就像是超级英雄穿了件破洞的衣服,不但没了帅气,还可能让宝贝受到伤害呢!复合膜袋检测标准可绝绝子,是保障商品安全、品质以及消费者权益的秘密武器,要是不重视这个标准,那在商品流通的“江湖”里,可到处都是“拦路虎”呀!一、“材质大阅兵:分清好坏是关键”“在复合膜袋的材质王国里,可别做个‘糊涂蛋’,不同材质就像不同的士兵,各有各的本领。
”复合膜袋的材质多种多样,常见的有塑料与塑料复合、塑料与纸复合等。
不同的材质组合有着不同的特性和适用场景。
比如,聚乙烯(PE)材质的复合膜袋,就像一个柔软的“小棉袄”,它具有良好的柔韧性和防潮性,常用于食品包装中的一些需要柔软包装的产品,像糕点之类的。
而聚酯(PET)材质则像是一个坚强的“盾牌”,它有着较好的强度和透明度,常常被用于一些对包装外观和强度要求较高的产品,如一些高档的电子产品包装。
如果材质选用错误,就像是让一个“文弱书生”去干“大力士”的活,那必然会出现问题,这可是个低级失误大赏!二、“印刷清晰度:美美的外观有讲究”“印刷在复合膜袋上可不能是‘鬼画符’,清晰的印刷就像模特的精致妆容。
”印刷质量在复合膜袋标准里也是重要的一环。
清晰、准确的印刷就像给复合膜袋穿上了一件漂亮得体的衣服。
从产品的标识、说明到图案,都需要清晰可辨。
如果印刷模糊不清,就像你看到一个人脸上的妆容花成了一团,那可太糟糕了。
例如,在药品的复合膜袋包装上,药品的名称、使用方法、保质期等信息如果印刷不清晰,这就像是给患者设置了一个“迷宫”,很容易导致患者误食或者使用不当。
这难道不是很危险的事情吗?三、“密封性能:守住宝贝的防线”“复合膜袋的密封性能啊,那可是‘城墙’,要把里面的东西紧紧护住。
”密封性能如同复合膜袋的“安全锁”。
5004聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准

1.目的建立聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准。
2.范围内包材聚酯、铝、聚乙烯药品包装用复合膜、袋。
3.术语或定义
3.1 包装材料:药品包装所用的材料,包括与药品直接接触的包装材料和容器、印刷包装材料,但不包括发运用的外包装材料。
3.2 药品质量标准:是国家对药品质量、规格及检验方法所作的技术规定,是药品生产、供应、使用、检验和药政管理部门共同遵循的法定依据。
4.职责
4.1 质量控制部负责起草审核质量标准。
4.2 质量保证部负责审批质量标准。
5.内容
5.1 产品名称
中文名称:聚酯、铝、聚乙烯药品包装用复合膜、袋
拼音名称:Juzhi、lv、JulvyixiYaopin Baozhuangyong Fuhemo、dai
5.2【标准依据】《国家包装容器(材料)标准YBB00172002》
5.3定性和定量的限度要求
5.4【批准的供应商】生产商—西安昊宇医药包装有限公司
5.5 取样、检验方法或相关操作规程编号:检验方法见《聚酯、铝、聚乙烯药品包装用复合膜、袋检验标准操作规程》(SOP-QC5004-00),取样方法见《取样标准操作规程》
(SOP-QA001-00)。
5.6【贮藏】密闭保存。
5.7 【注意事项】N/A
5.8 【复验期】二年
6.附件N/A
7.参考或引用文件
7.1《取样标准操作规程》SOP-QA001-00
7.2《聚酯、铝、聚乙烯药品包装用复合、袋检验标准操作规程》SOP-QC5004-00
8.文件变更记载。
5004铝塑复合膜质量标准

陕西德福康制药有限公司________________
1.目的建立铝塑复合膜质量标准。
2.范围内包材铝塑复合膜。
3.术语或定义 N/A
4.职责质量保证部、质量控制部
5.内容
5.1 产品名称
中文名称:铝塑复合膜
拼音名称:Lv Su Fuhemo
5.2 【标准依据】
《国家包装容器(材料)标准YBB00132002》
5.3定性和定量的限度要求
5.4【批准的供应商】生产商--
5.5 取样、检验方法或相关操作规程编号:检验方法见《铝塑复合膜(药用)标准检验操作规程》(SOP-QC5004-00),取样方法见《取样标准操作规程》(SOP-QA001-00)。
5.6【贮存条件和注意事项】密闭保存。
5.7 【复验期】二年
6.附件
N/A
7.参考或引用文件
7.1 《取样标准操作规程》SOP-QA001-00
7.2 《铝塑复合膜检验操作规程》SOP-QC5004-00
8.文件变更记载。
铝箔袋质量标准和检验操作规程
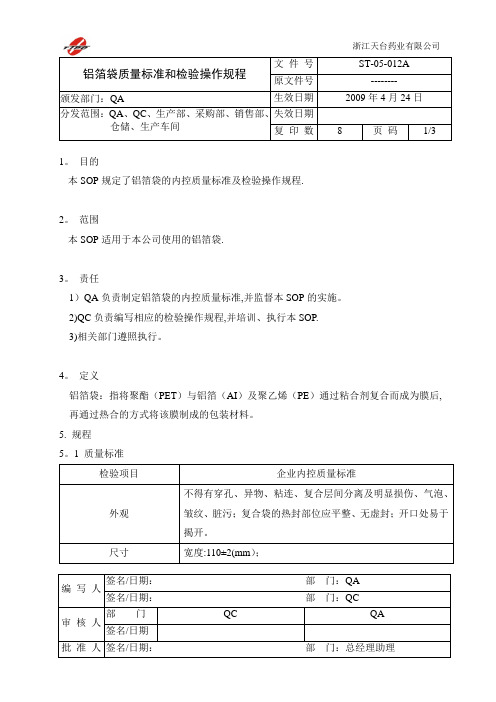
浙江天台药业有限公司铝箔袋质量标准和检验操作规程文 件 号 ST-05-012A 原文件号-------- 颁发部门:QA生效日期 2009年4月24日 分发范围:QA 、QC 、生产部、采购部、销售部、 仓储、生产车间 失效日期复 印 数8页 码1/3编 写 人 签名/日期: 部 门:QA 签名/日期: 部 门:QC审 核 人部 门 QC QA 签名/日期1。
目的本SOP 规定了铝箔袋的内控质量标准及检验操作规程. 2。
范围本SOP 适用于本公司使用的铝箔袋. 3。
责任1)QA 负责制定铝箔袋的内控质量标准,并监督本SOP 的实施。
2)QC 负责编写相应的检验操作规程,并培训、执行本SOP. 3)相关部门遵照执行。
4。
定义铝箔袋:指将聚酯(PET )与铝箔(AI )及聚乙烯(PE )通过粘合剂复合而成为膜后, 再通过热合的方式将该膜制成的包装材料。
5. 规程 5。
1 质量标准检验项目企业内控质量标准外观不得有穿孔、异物、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污;复合袋的热封部位应平整、无虚封;开口处易于揭开。
尺寸 宽度:110±2(mm );浙江天台药业有限公司铝箔袋质量标准和检验操作规程ST-05-012A2/3长度:160±5(mm);单层厚度:0.09±0.009(mm)。
5。
2检验操作规程5.2。
1外观:取本品,在自然光线明亮处,正视目测。
不得有穿孔、异物、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污;复合袋的热封部位应平整、无虚封;开口处易于揭开。
5。
2。
2尺寸:用经过校验合格的5m钢卷尺,测量样品的宽度和高度;再用经校验合格的电子数显千分尺(规格:0-25mm)测量样品的单层厚度。
所测得的数据应在宽度为110±2mm,高度为160±5mm,单层厚度为0。
09±0。
009mm之范围内.6. 相关SOP(无)7。
复合膜袋产品质量监督抽查执行标准明细表
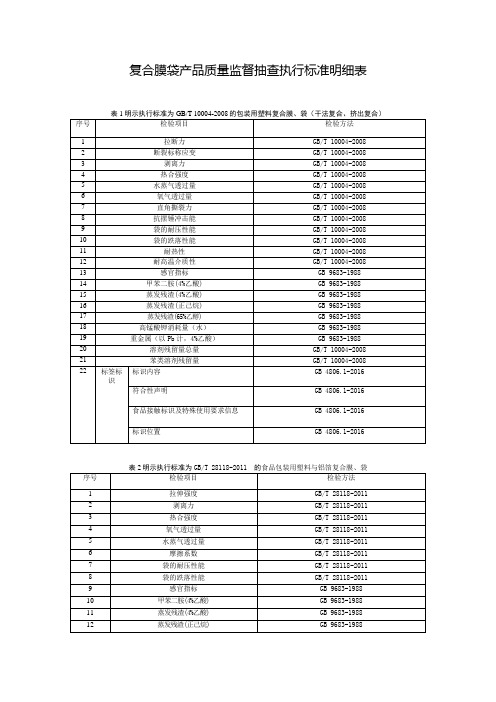
表1明示执行标准为GB/T 10004-2008的包装用塑料复合膜、袋(干法复合、挤出复合)
序号
检验项目08
2
断裂标称应变
GB/T 10004-2008
3
剥离力
GB/T 10004-2008
4
热合强度
GB/T 10004-2008
标识位置
GB 4806.1-2016
表5其他食品接触用复合膜、袋
序号
检验项目
检验方法
1
感官指标
GB 9683-1988
2
甲苯二胺(4%乙酸)
GB 9683-1988
3
蒸发残渣(4%乙酸)
GB 9683-1988
4
蒸发残渣(正己烷)
GB 9683-1988
5
蒸发残渣(65%乙醇)
GB 9683-1988
GB/T 28117-2011
11
袋的跌落性能
GB/T 28117-2011
12
感官要求
GB 4806.7-2016
13
总迁移量
GB 4806.7-2016
14
高锰酸钾消耗量(水)
GB 4806.7-2016
15
重金属(以Pb计,4%乙酸)
GB 4806.7-2016
16
脱色试验
GB 4806.7-2016
19
重金属(以Pb计,4%乙酸)
GB 9683-1988
20
溶剂残留量总量
GB/T 10004-2008
21
苯类溶剂残留量
GB/T 10004-2008
22
标签标识
标识内容
覆铝袋质量标准

应无明显分层现象
厚度
10±2μm(单层)
尺寸
120 mm×168mm×20丝(100克覆铝袋)
222mm×156mm×20丝(200克覆铝袋)
尺寸偏差
宽度偏差(mm)
±2(宽度<100mm);±3(宽度101-400mm)
厚度偏差(%)
±10
长度偏差(%)
±2(宽度<100mm);±3(宽度101-400mm)
ABC有限公司GMP技术文件
题 目
覆铝袋质量标准
编 码:
共2页
第1页
制 定
审 核
批 准
制定日期
审核日期
批准日期
颁发部门
质量部
颁发数量
份
生效日期
分发部门
QC、QA、生产部、技术部
修订原因
公司组织机构变更、重新修订文件
1、目的为便于控制覆铝袋的质量,特制定本标准
2、依据国家药品包装容器标准
3、适用范围本标准适用于覆铝经粘合剂复合而成的食品包装袋。
4、责任者质量部对本标准的实施负责
5. 内 容
检验项目及指标
要求
外观
平整度
应平整,无皱纹,封边良好
气泡、裂纹、孔隙和复合层
不得有明显气泡、裂纹、孔隙和复合层剥离现象
色泽、气味
色泽正常,无异味、异嗅及附着异物
穿孔及破裂
不允许穿孔及破裂
热封
热封位置无虚封
袋装浸泡液(60℃,2h)
不得有异味、异臭、混浊和脱色现象。
封口宽度偏差(%)
±20
跌落项不合格率不能超过1%。
复合铝箔袋(膜)的检验标准

跌落高度700mm
401g~2000g
跌落高度600mm
≥2001g
跌落高度500mm
三、型式检验项目:
供应商在新材质产品第一次供货时,应进行全面检测。检验项目除上述检验项目外,还应包括同色密度偏差、套印偏差、撕裂力、断裂伸长率、扯断力、热封强度。其相应指标为:
项目
指标标准
检测方法
溶剂残留量
≤10mg/m2
见备注一
氧气透过量
≤0.2cm3/m2·24h·atm
按GB1038的规定进行
水蒸气透过量
≤0.3g/ m2·24h
按GB/T16928的规定进行
同色密度偏差
≤0.05Ds
按GB7707-87的规定进行
套印偏差
±0.3mm
撕裂力(纵横向)
≥3.0N
按QB/T1130的规定进行,其中纵横向试样各裁取至少3个,试验时以单个试样进行测定,撕裂负荷数值,以3个试样最大撕裂负荷的算术平均值表示,精确到0.1N
外表
无划伤、烫伤、穿孔、破裂、异物、分层、粘连、残缺、刀丝、无明显脏污等现象
气泡
无气泡,热合处不可有皱纹
பைடு நூலகம்热封牢度
热合交接处,用手顶压不可有破洞。观察无透光现象,热合牢靠
网纹
网纹清晰均匀无明显变形和残缺
内容
文字图案清晰正确、无毛边、位置准确、无污点(与样稿一致);5号字以下不误字意;印迹边缘光洁;
尺
寸
断裂伸长率(纵横向)
≥15%
按GB13022的规定进行,试样采用长条形,长度为150mm以上,宽度为15mm,试样标距为100±1mm;试验拉伸速度(空载)为300±25mm/min
镀铝复合膜袋质量标准

包装材料质量标准编号:WJ-ZL-BC-009-01药品包装用复合膜(袋)质量标准批准人/日期:年月日审核人/日期:年月日制定人/日期:年月日生效日期:年月日颁发部门:质量保证部分发部门:质量保证部、物料管理部1。
目的建立药品包装用复合膜(袋)检验的质量标准2.适用范围适用于本公司药品包装用复合膜(袋)的质量检验3.职责质检员、质检室主任对本标准的实施负责4.依据国家药品监督管理局药包材标准(YBB00132002—2015)5.检查内容5。
1【鉴别】红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004—2015)第四法测定,每层应分别与对照图谱基本一致.(铝、纸成分可不做)5。
2【外观】取本品适量,在自然光线明亮处,正视目测。
不得有穿孔,异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、赃污等缺陷。
复合袋的热封部位应平整、无虚封.5.3【阻隔性能】5.3。
1水蒸汽透过量照塑料薄膜和片材透水蒸气性试验方法杯式法(GB1037—88)的规定进行。
试验时热封面向湿度低的一侧,试验温度(38±5)℃,相对湿度(90±2)%,应符合表2的规定。
5。
3。
2氧气透过量除另有规定外,按塑料薄膜和薄片气体透过性试验方法压差法(GB/T1038-2000)的规定进行.试验时热封面向氧气低压侧,试验温度(23±2)℃,应符合表2的规定。
表2阻隔性能5)测定,纵、横向剥离强度平均值应符合表3规定。
5。
5【复合袋的热合强度】照热合强度测定法(YBB00122003-2015)测定。
测得值应符合表3规定.表3机械性能5.包装材料溶剂残留量(YBB00312004-2015)测定法测定,溶剂残留总量不得过5。
0mg/m2,其中苯及苯类溶剂残留量均不得检出.5.7【袋的耐压性能】取5个袋,袋内填充约二分之一袋容量的水,并热合封口(参照生产工艺采用的热合条件)。
将试样逐个放在上、下板之间,试验中上、下板应保持水平,不变形,与袋的接触面必须光滑,上、下板的面积应大于试验袋.根据表4规定加砝码保持1分钟(负荷为上加压板与砝码重量之和),目视,不得破裂或泄漏。
医药企业包药品包装用复合铝膜袋质量标准

1目的:明确药品包装用铝膜质量标准,确定质量、生产、采供质控依据。
2 范围:药品包装用铝膜。
3 责任者:质量部、生产部、采供部。
4 内容:
4.1 基本信息
4.1.1 物料代码:药品包装用复合铝膜B19。
4.1.2 供应商:西安久志工贸有限公司。
4.2 取样、检验方法或相关操作规程编号
4.2.1 取样管理规程SOP-QA-1005-00。
4.2.2 检验方法或相关操作规程编号
药品包装用复合铝膜检验操作规程SOP-QC-8019-00。
4.3 标准内容
4.3.1 外观质量:不允许有穿孔、异物、异味、粘连、涂层不均匀,复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
4.3.2 规格尺寸:应符合附表1规定。
4.4 贮存:清洁、通风、干燥处存放。
4.5 印刷包装材料的实样或样稿(样稿见附表2)
5 文件的培训:
5.1 内部培训讲师:人力资源部指定人员。
5.2 文件培训对象:质量部、生产部、采供部。
5.3 文件培训课时:0.5~1小时。
6 文件变更历史:
附表1。
复合铝箔袋(膜)的检验标准

四、 包装: 项目 外观 标志
材质及抗压
检测指标 外包装应干燥、清洁,完好无损 产品的内外包装应附有产品合格证,并标示生产厂家、产品名称、规格、 数量、批号、生产日期 膜、袋在箱内均应按相同数量分包捆扎,并采用纸箱内衬薄膜或牛皮纸进
行包装。保证堆高 3m,存放 12 个月,最底层的包装不出现变形
检测方法 目测
搬动时不出现膜间滑动
允许有不影响包装的轻微暴筋
有明显标志
每个接头都有接头标志,总接头数不超过 2 个 无划伤、烫伤、穿孔、破裂、异物、分层、粘连、残 缺、刀丝、无明显脏污等现象 无气泡,热合处不可有皱纹
热合交接处,用手顶压不可有破洞。观察无透光现象,
热合牢靠
网纹清晰均匀无明显变形和残缺
文字图案清晰正确、无毛边、位置准确、无污点(与
项目 溶剂残留量 氧气透过量 水蒸气透过量 同色密度偏差 套印偏差
撕裂力(纵横向)
指标标准 ≤10mg/m2 ≤0.2cm3/m2·24h·atm ≤0.3g/ m2·24h ≤0.05Ds ±0.3mm
≥3.0N
断裂伸长率(纵横向) 扯断力(纵横向) 热封强度(纵横向)
≥15% ≥30N/15mm ≥15.0 N/15mm
五、 验收规则: 按 GB/T 2828.1 规则执行:AQL=4.0;一般检验水平=S-2
备注一: 溶剂残留量的测定: 1. 仪器:采用气相色谱仪;
2. 测定条件:使用氮气做载气,柱温控制在 70~90℃,注入检测口温度控制在 90~150℃; 3. 标准曲线的绘制:按生产实际使用溶剂的种类配制标准溶剂样品。用微升注射器取 1 微升和 2 微
一、 一般性能检测标准: 项目 材质
褶皱
色 卷膜松紧
药品包装用复合膜质量标准

药品包装用复合膜、袋通YBB00132002复合膜系指各种塑料与纸、金属或其它塑料通过黏合剂组合而形成的膜其厚度一般不大于0.2 5mm。
复合袋系将复合膜通过热合的方法而制成的袋,按制袋形式可分为三边封袋、中封袋、风琴袋、自立袋、拉链袋等。
本标准适用于非注射剂用的药品包装用复合膜、袋。
药品包装用复合膜按材料组合分类,如表1所示:表1 复合膜分类种类材质典型示例Ⅰ纸、塑料纸或PT/粘合层/PE或EVA、CPPⅡ塑料BOPET或BOPP、BOPA/粘合层/PE或EVA、CPPⅢ塑料、镀铝膜BOPET或BOPP/粘合层/镀铝CPPBOPET或BOPP/粘合层/镀铝BOPET/粘合层/PE或EVA、CPP、EMA、EAA、离子型聚合物Ⅳ纸、铝箔、塑料纸或PT/粘合层/铝箔/粘合层/PE或EVA、CPP、EMA、EAA、离子型聚合物涂层/铝箔/粘合层/PE或CPP、EVA、EMA、EAA、离子型聚合物Ⅴ塑料(非单层)、铝箔BOPET或BOPP、BOPA/粘合层/铝箔/粘合层/PE或CPP、EVA、EMA、EAA、离子型聚合物注1:玻璃纸简称PT;双向拉伸聚丙烯简称BOPP:双向拉伸聚酯简称BOPET;双向拉伸尼龙简称BOPA;聚乙烯简称PE;流延聚丙烯简称CPP;乙烯与醋酸乙烯酯共聚物简称EVA;乙烯与丙烯酸共聚物简称EAA;乙烯与甲基丙烯酸共聚物简称EMA。
注2:复合时可用干法复合或无溶剂复合,这时粘合层为一般的粘合剂。
也可用挤出复合,这时粘合层为PE或EVA、EMA、EAA等树脂。
[鉴别] 红外光谱选取适宜方法,取每层材料,照分光光度法(中华人民共和国药典2000年版附录ⅣC)测定,应符合规定。
(铝、纸成分可不做)。
[外观]取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
[阻隔性能] 水蒸气透过量照塑料薄膜和片材透水蒸气性试验方法杯式法(GBl037-88)的规定进行。
040-铝塑复合膜质量标准及内控标准

目的:制定铝塑复合膜的质量标准。
适用范围:所有铝塑包装的生产品种。
责任:质检员、车间质量管理人员及包装操作工人有责任正确实施本标准。
标准:
1. 质量标准
1.1铝塑复合膜(简称铝箔)必须符合GB12255-90的质量标准。
1.2表面光洁、平整、无折皱,无划伤,断面整齐,卷曲紧密,驳口处有明显的标记且驳口不能多于2个,驳口识标放在文字正面的左边。
1.3文字、商标、图案印刷必须清晰正确、美观且牢固,无墨迹浸润现象。
1.4印刷错位(感冒通薄膜片):指定位置±1.5mm
1.5文字、商标、图案的具体要求以质管部签定的样板为标准。
1.6厚度为:0.024mm±0.003;宽度为:250mm±0.05mm。
1.7铝箔卷的方向:文字正面顺时针卷。
1.8铝箔金属保护涂层的检验:
取铝箔一块,用明火燃烧4-5秒,如铝箔变淡黄色,就证明铝箔涂有金属保护层。
1.9供应商必须提供来货批号的检验合格报告单。
1.10符合以上各项指标后进行实际上机操作,并以操作结果作为主要判定依据。
2.卫生学标准:细菌≤1000个/100cm2霉菌≤1000个/100cm2,控制菌不得检出。
3.内控标准
卫生学标准:细菌≤800个/100cm2霉菌≤80个/100cm2,控制菌不得检出,其余同质量标准。
《复合膜袋产品质量国家监督抽查实施细则(2023年版)》
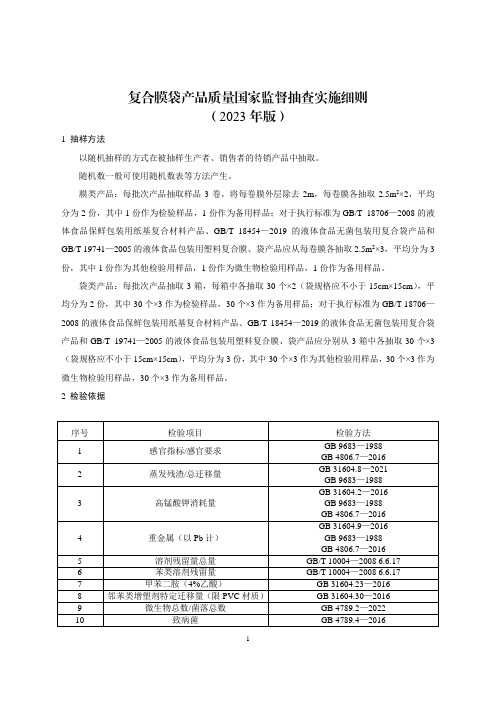
复合膜袋产品质量国家监督抽查实施细则(2023年版)1 抽样方法以随机抽样的方式在被抽样生产者、销售者的待销产品中抽取。
随机数一般可使用随机数表等方法产生。
膜类产品:每批次产品抽取样品3卷,将每卷膜外层除去2m,每卷膜各抽取2.5m2×2,平均分为2份,其中1份作为检验样品,1份作为备用样品;对于执行标准为GB/T 18706—2008的液体食品保鲜包装用纸基复合材料产品、GB/T 18454—2019的液体食品无菌包装用复合袋产品和GB/T 19741—2005的液体食品包装用塑料复合膜、袋产品应从每卷膜各抽取2.5m2×3,平均分为3份,其中1份作为其他检验用样品,1份作为微生物检验用样品,1份作为备用样品。
袋类产品:每批次产品抽取3箱,每箱中各抽取30个×2(袋规格应不小于15cm×15cm),平均分为2份,其中30个×3作为检验样品,30个×3作为备用样品;对于执行标准为GB/T 18706—2008的液体食品保鲜包装用纸基复合材料产品、GB/T 18454—2019的液体食品无菌包装用复合袋产品和GB/T 19741—2005的液体食品包装用塑料复合膜、袋产品应分别从3箱中各抽取30个×3(袋规格应不小于15cm×15cm),平均分为3份,其中30个×3作为其他检验用样品,30个×3作为微生物检验用样品,30个×3作为备用样品。
2 检验依据执行企业标准、团体标准、地方标准的产品,检验项目参照上述内容执行。
凡是注日期的文件,其随后所有的修改单(不包括勘误的内容)或修订版不适用于本细则。
凡是不注日期的文件,其最新版本适用于本细则。
3 判定规则3.1 依据标准GB 4806.6—2016 食品安全国家标准食品接触用塑料树脂GB 4806.7—2016 食品安全国家标准食品接触用塑料材料及制品GB 9683—1988 复合食品包装袋卫生标准GB 9685—2016 食品安全国家标准食品接触材料及制品用添加剂使用标准GB/T 10004—2008 包装用塑料复合膜、袋干法复合、挤出复合GB/T 18192—2008 液体食品无菌包装用纸基复合材料GB/T 18454—2019 液体食品无菌包装用复合袋GB/T 18706—2008 液体食品保鲜包装用纸基复合材料GB/T 19741—2005 液体食品包装用塑料复合膜、袋GB/T 21302—2007 包装用复合膜、袋通则GB/T 26690—2011 丙烯酸涂布双向拉伸聚丙烯薄膜GB/T 26691—2011 改性聚乙烯醇涂布双向拉伸薄膜GB/T 28117—2011 食品包装用多层共挤膜、袋GB/T 28118—2011 食品包装用塑料与铝箔复合膜、袋GB/T 30768—2014 食品包装用纸与塑料复合膜、袋GB/T 40266-2021 食品包装用氧化物阻隔透明塑料复合膜、袋质量通则GB/T 41168-2021 食品包装用塑料与铝箔蒸煮复合膜、袋GB/T 41169-2021 食品包装用纸铝塑复合膜、袋GB/T 41220-2021 食品包装用复合塑料盖膜BB/T 0012—2014 聚偏二氯乙烯(PVDC)涂布薄膜BB/T 0041—2021 包装用多层共挤阻隔膜BB/T 0052—2017 液态奶共挤包装膜、袋BB/T 0084—2021 蒸煮食品常温储存包装用纸基复合材料QB/T 1871—1993 双向拉伸尼龙(BOPA)/低密度聚乙烯(LDPE)复合膜、袋QB/T 2197—1996 榨菜包装用复合膜、袋食品相关产品生产许可实施细则(一)食品用塑料包装容器工具等制品部分现行有效的企业标准、团体标准、地方标准及产品明示质量要求3.2判定原则经检验,检验项目全部合格,判定为被抽查产品所检项目未发现不合格;检验项目中任一项或一项以上不合格,判定为被抽查产品不合格。
5004聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准

5004聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准陕西德福康制药有限公司 ________________文件名称:标准技术程序—内包材质量标准文件编号:STP-QS5004-00 聚酯、铝、聚乙烯药品包装用复合膜、袋质量第 1 页共 3 页标准批准人日期 QA审核日期审核人日期执行日期分发号起草人日期颁发部门质量保证部分发部门质量控制部1. 目的建立聚酯、铝、聚乙烯药品包装用复合膜、袋质量标准。
2. 范围内包材聚酯、铝、聚乙烯药品包装用复合膜、袋。
3. 术语或定义3.1 包装材料:药品包装所用的材料,包括与药品直接接触的包装材料和容器、印刷包装材料,但不包括发运用的外包装材料。
3.2 药品质量标准:是国家对药品质量、规格及检验方法所作的技术规定,是药品生产、供应、使用、检验和药政管理部门共同遵循的法定依据。
4. 职责4.1 质量控制部负责起草审核质量标准。
4.2 质量保证部负责审批质量标准。
5. 内容5.1 产品名称中文名称:聚酯、铝、聚乙烯药品包装用复合膜、袋拼音名称:Juzhi、lv、Julvyixi Yaopin Baozhuangyong Fuhemo、dai 5.2 【标准依据】《国家包装容器(材料)标准YBB00172002》5.3 定性和定量的限度要求序号项目标准1 外观不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气reduction in property value. Find warning signals, timely reporting or warning, develop and implement measures against customer transfers and other acts leading to loss or increase the difficulty of clearing. Personal credit business of late, agencies should be timely collection, if necessary, ask the right institutions to bring proceedings. Non-approved by head office, agencies at all levels shall not without the following: give文件名称:文件编号管理规程文件编号:SMP—PMP 001 01 第 2 页共 3 页泡、皱纹、脏污等缺陷。
复合袋技术标准

± 2
± 3
± 4
101~400
± 2
± 10
101~300
± 4
± 4
± 5
± 6
401~1000
± 4
± 10
301~500
± 7
± 7
± 7
± 8
《复合袋技术标准》二、
袋的图案位置、袋脚偏差标准。(㎜)
袋长度
三边封、自立袋
中封、插腰袋
袋图案位置偏差
袋脚偏差
袋图案位置偏差
袋脚偏差
≤ 100
1000
1000
10.0
10.0
3.0
0.5
3.0
11
水蒸汽透过量,(g/m2· 24h)≦
15.0
5.5
5.5
5.5
2.0
2.0
1.5
0.5
1.5
产品分类
种类
材质组合
示例
Ⅰ
纸、塑料
纸/PE
Ⅱ
塑料
二层
A1
BOPP/CPP PET/PE
A2
NY/PE NY/CPP PET/CPP KOP/CPP
多层
A3
气泡
Ⅰ、Ⅱ、Ⅲ类允许少量不影响使用性能的不气泡;其余产品不允许有气泡
Ⅰ、Ⅱ、Ⅲ类允许有少量不影响使用性能的小气泡;但不得位于热封处;其余产品不允许有气泡
平整性
膜卷两端而应平整,不平整度≤ 3㎜。表面不得有严重暴筋,表面凹凸≤2㎜
允许有轻微的翘曲不平
接头
每卷接头数=膜长〈500m时,不多于1个;膜长≥500m时,不多于2个
≧35
-
≧35
≧35
横向
-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 目的
建立药品包装用复合膜(袋)检验的质量标准
2. 适用范围
适用于本公司药品包装用复合膜(袋)的质量检验
3. 职责
质检员、质检室主任对本标准的实施负责
4. 依据
国家药品监督管理局药包材标准(
YBB00132002-2015)
5. 检查内容
5.1【鉴别】红外光谱 取本品适量,照包装材料红外光谱测定法
(YBB00262004-2015)第四法测定,
每层应分别与对照图谱基本一致。
(铝、纸成分可不做)
5.2【外观】取本品适量,在自然光线明亮处,正视目测。
不得有穿孔,异物、异味、粘连、复合层 间分离及
明显损伤、气泡、皱纹、赃污等缺陷。
复合袋的热封部位应平整、无虚封。
5.3【阻隔性能】 5.3.1水蒸汽透过量
照塑料薄膜和片材透水蒸气性试验方法
杯式法(GB1037-88)的规定进行。
试验时热封面向湿度低的一侧,试验温度( 38 ± 5)C ,相对湿度(90± 2)%,应符合表2的规定。
5.3.2 氧气透过量 除另有规定外,按塑料薄膜和薄片气体透过性试验方法 压差法 (GB/T1038-2000 )的规
定进行。
试验时热封面向氧气低压侧,试验温度 (23 ± 2)C ,应符合表2的
规定。
表
阻隔性能
【机械性能】内层与次内层剥离强度
取膜适量,照剥离强度测定法(
)测
定,纵、横向剥离强度平均值应符合表
3规定。
5.5【复合袋的热合强度 】 照热合强度测定法(YBB00122003-2015 )测定。
测得值应符合表
3规定。
表机械性能
【溶剂残留量】 取样品适量,裁取内表面积 ,将其迅速裁成碎片, 照包装
材料溶剂残留量(YBB00312004-2015)测定法测定,溶剂残留总量不得过 5.0mg/吊,其中苯及苯类
溶剂残留量均不得检出。
5.7 [袋的耐压性能】取5个袋,袋内填充约二分之一袋容量的水,并热合封口(参照生产工艺采用的热合条件)。
将试样逐个放在上、下板之间,试验中上、下板应保持水平,不变形,与袋的接触面必须光滑,上、下板的面积应大于试验袋。
根据表4规定加砝码保持1分钟(负荷为上加压板与砝码
重量之和),目视,不得破裂或泄漏。
5.8 [袋的跌落性能】取个袋,袋内填充约二分之一袋容量的水,并热合封口参照生产工艺采用的热合条件)。
将试样按表5高度逐个自由落于光滑、坚硬的水平面(如水泥地面)。
目视,不得破裂。
5.9 [溶出物试验】除另有规定外,取样品适量,分别取本品内表面积600 cm 2(分割成长3 cm,宽
0.3 cm的小片)三份置具塞锥形瓶中,加水(70C± 2C)、65%乙醇(70 C± 2C)、正己烷(58C
± 2C)200ml浸泡2小时后取出,放冷至室温,用同批试验用溶剂补充至原体积作为供试液,以同批水、
65%乙醇、正己烷为空白液,备用。
5.9.1重金属照重金属检查法(中华人民共和国药典2015年版四部限量检查法第一法目次0821
P101)测定,应符合规定。
5.9.2易氧化物精密量取水浸液20ml,精密加入高锰酸钾滴定液(0.002 mol/L )20 ml与稀盐
酸1ml,煮沸3分钟,迅速冷却,加入碘化钾0.1g,在暗处放置5分钟,用硫代硫酸钠滴定液
(0.0 1
mol/L )滴定,滴定近终点时,加入淀粉指示液0.25 ml,继续滴定至无色,另取水空白液同法操作,
二者消耗滴定液之差不得过 1.5 ml。
5.9.3不挥发物分别取水、65%乙醇、正己烷浸出液与空白液各100 ml置于已恒重的蒸发皿中,
水浴蒸干,105C干燥2小时,冷却后精密称定,水不挥发物残渣与空白残渣之差不得过30.0嗎;
65%乙醇不挥发物残渣与其空白残渣之差不得过30.0嗎;正己烷不挥发物残渣与其空白残渣之差不
得过30.0嗎。
5.10 [微生物限度】取试样开孔面积为20 cm 2的消毒过的金属模板压在内层面上,将无菌棉签用氯
化钠-蛋白胨缓冲液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10
次,共擦抹5个位置100 cm 2。
每支棉签抹完后立即剪断(或烧断),投入盛有30ml无菌氯化钠-蛋白胨缓
冲液的锥形瓶中(或大试管)中。
全部擦抹棉签投入瓶中,将瓶迅速摇晃1分钟,
即得供试液。
取提取液照微生物限度法(中国药典2015版四部附录1100)测定。
应符合表6的规
表6微生物限度指标
注:“” 为每~100cm 中不得检出。
5.11【异常毒性】 照异常毒性检查法(中华人民共和国药典
2015年版四部生物检查法
目次1141
P153)测定,应符合规定。
附件:检验规则
1
、 产品检验分为全项检验和部分检验。
2、 有下列情况之一时,应按标准的要求,进行全项检验。
(1) 产品注册 (2) 产品出现重大质量事故后,重新生产 (3) 监督抽验 (4) 产品停产后,重新恢复生产
3、 产品批准注册后,药包材生产、使用企业在原料产地、添加剂、生产工艺等没有变更的情形下, 可按标准的要求,进行全项检验。
4、 外观检验:复合膜按每卷膜取 2米进行检验。
5、 尺寸偏差见表7。
表7
尺寸偏差
根据国家食品药品监督管理局对药品 认证过程中有关问题的说明,辅料、包装材料在有供
应商提供的该批物料全项检验合格报告单原件的基础上,我公司按下列内控检验。
6.1外观:
6.1.1取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分 离及明显损
伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
6.1.2版面布局:文字或商标图案的位置布局应与标准标本一致。
6.1.3颜色式样:颜色、式样、色度等应与标准样本一致。
6.1.4文字检查:印刷的文字、字体、字母、符号或图案标志等应与标准样本一致,误差不得过土 3%
6.1.5印刷情况:用手擦拭版面,文字或图案等不得脱落或掉色。
规格尺寸:用尺子、游标卡尺测量,规格尺寸应符合下表要求:
微生物限度:取试样用开孔面积为 的消毒过的金属模板压在内层面上,
将无菌棉签用氯化
钠-蛋白胨缓冲液稍沾湿,在板孔范围内擦抹 5次,换1支棉签再擦抹5次,每个位置用2支棉签共
最新范本,供参考!
擦抹10次,共擦抹5个位置100cm2每支棉签抹完后立即剪断(或烧断),投入盛有30ml无菌氯化钠-蛋白胨缓冲液的锥形瓶(或大试管)中。
全部擦抹棉签投入瓶中后,将瓶迅速摇晃1分钟,即得供试液。
取提取液照微生物限度测定。
应符合表3规定。
表3微生物限度指标
数量:每批复合膜的数量应与入库数量一致。
7、物料基本信息:
7.1经批准供应商:见供应商目录
7.2取样规程:ZK-SMP-GG-046-01
7.3检验规程:ZK-SOP-BC-009-01
7.4贮存条件:常温贮存,保持于干燥、清洁处。
7.5复验期:24个月。
