粗多糖的测定方法
(完整版)粗多糖的测定方法

粗多糖的测定方法(1)1. 原理分子量大于10,000道尔顿的多糖经80%乙醇沉淀后,加入碱性铜试剂,选择性地从其他高分子物质中沉淀出葡聚糖,沉淀部分与苯酚-H2SO4反应,生成有色物质,在485nm条件下,有色物质的吸光度值与葡聚糖浓度成正比。
2. 适用范围参照AOAC方法。
适用于检测含有分子量大于10,000道尔顿葡聚糖的样品。
3.仪器(1)分光光度计(2)离心机(3)旋转混匀器(4)恒温水浴锅4.试剂除特殊说明外,实验用水为蒸馏水,试剂为分析纯。
(1)80%乙醇:800ml无水乙醇加水200ml。
(2)2.5 mol/L NaOH溶液:100 g NaOH加蒸馏水稀释至1 L,加入固体无水硫酸钠至饱和。
(3)铜贮存液:称取3.0 g CuSO4 ·5H2O,30.0 g柠檬酸钠加水溶解至1 L。
溶液可贮存2周。
(4)铜应用溶液:取铜贮存液50 ml,加水50 ml混匀后加入无水硫酸钠12.5 g,临用新配。
(5)洗涤液:取水50 ml,加入10 ml铜应用溶液,10 ml 2.5 mol/L NaOH溶液,混匀。
(6)1.8 mol/L H2SO4:取100ml浓硫酸用水稀释至1L。
(7)20 g/L苯酚溶液:称取2.0g苯酚,加水溶解并稀释至100ml,混匀备用。
(8)葡聚糖标准液:称取500mg葡聚糖(分子量500,000D)于称量皿中,105℃干燥4h 至恒重,置于装有干燥硅胶的干燥器中冷却。
准确称取100mg干燥后的葡聚糖,用水定容至100ml,葡聚糖标准浓度为1.0 mg/ml。
(9)葡聚糖标准应用液:吸取葡聚糖标准液10ml,用水稀释10倍,葡聚糖终浓度为0.1mg/ml。
粗多糖的测定方法(2)5. 操作方法5.1 样品处理(1)样品提取:称取样品1~5g,加水100ml,沸水浴加热2h,冷却至室温,定容至200ml (V1),混匀后过滤,弃初滤液,收集余下滤液。
(2)沉淀高分子物质:准确吸取上述滤液100ml (V2),置于烧杯中,加热浓缩至10ml,冷却后,加入无水乙醇40ml,将溶液转至离心管中以3000rpm离心5min,弃上清液,残渣用80%乙醇洗涤3次,残渣供沉淀葡聚糖之用。
粗多糖含量测定方法
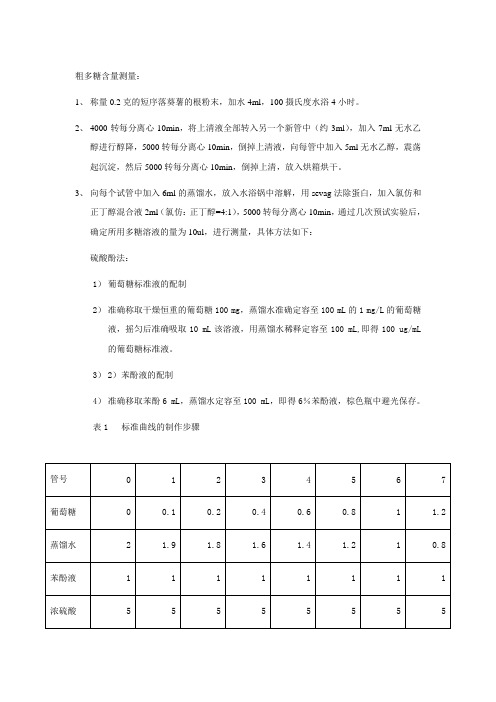
粗多糖含量测量:1、称量0.2克的短序落葵薯的根粉末,加水4ml,100摄氏度水浴4小时。
2、4000转每分离心10min,将上清液全部转入另一个新管中(约3ml),加入7ml无水乙醇进行醇降,5000转每分离心10min,倒掉上清液,向每管中加入5ml无水乙醇,震荡起沉淀,然后5000转每分离心10min,倒掉上清,放入烘箱烘干。
3、向每个试管中加入6ml的蒸馏水,放入水浴锅中溶解,用sevag法除蛋白,加入氯仿和正丁醇混合液2ml(氯仿:正丁醇=4:1),5000转每分离心10min,通过几次预试实验后,确定所用多糖溶液的量为10ul,进行测量,具体方法如下:硫酸酚法:1)葡萄糖标准液的配制2)准确称取干燥恒重的葡萄糖100 mg,蒸馏水准确定容至100 mL的1 mg/L的葡萄糖液,摇匀后准确吸取10 mL该溶液,用蒸馏水稀释定容至100 mL,即得100 ug/mL的葡萄糖标准液。
3)2)苯酚液的配制4)准确移取苯酚6 mL,蒸馏水定容至100 mL,即得6%苯酚液,棕色瓶中避光保存。
表1 标准曲线的制作步骤取8支干净的具塞试管按表2方法操作,摇匀后放置5 min,置沸水浴中加热15min,取出迅速冷却至室温,以0号作为空白调零,在最大吸收波长处测定吸光度。
以葡萄糖浓度Y 为纵坐标(ug/mL),吸光度X为横坐标,从而来绘制标准曲线。
用exceL软件求得回归方程。
计算百分含量:百分含量=L*600*10^(-6)/0.2蒽酮法:1.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡萄糖含量为纵坐标,光密度值为横坐标,作出标准曲线。
样品含量测定:百分含量= L*600*10^(-6)/0.2。
保健食品中总黄酮、总皂甙、粗多糖的测定

保健食品中总黄酮、总皂甙、粗多糖的测定附录 A(规范性的附录)保健食品中总黄酮的测定A.1 试剂聚酰胺粉芦丁标准溶液:称取5.0g芦丁,加甲醇溶解并定容至100mL,即得50μg/mL。
乙醇分析纯。
甲醇分析纯。
A.2 分析步骤试样处理:称取一定量的试样,加乙醇定容至25mL,摇匀后,超声提取20min,放置,吸取上清液1.0mL,于蒸发皿中,加1g聚酰胺粉吸附,于水浴上挥去乙醇,然后转入层析柱。
先用20mL苯洗,苯液弃去,然后用甲醇洗脱黄酮,定容至25mL。
此液于波长360nm测定吸收值。
同时以芦丁为标准品,测定标准曲线,求回归方程,计算试样中的总黄酮含量。
芦丁标准曲线:吸取芦丁标准溶液:0、1.0、2.0、3.0、4.0、5.0mL于10mL比色管中,加甲醛至刻度,摇匀,于波长360nm比色。
求回归方程,计算试样中总黄酮含量。
A.3 计算和结果表示:式中:X:试样中总黄酮的含量,mg/100g;A:由标准曲线算得被测液中总黄酮量,μgM:试样质量,gV1:测定用试样体积,mLV2:试样定容总体积,mL计算结果保留二位有效数字。
此方法选自《保健食品检验与评价技术规范》(2003年版)附录 B(规范性的附录)保健食品中总皂甙的测定B.1 试剂Amberlite-XAD-2 大孔树脂,Sigma 化学公司、U.S.A正丁醇分析纯。
乙醇分析纯。
中性氧化铝层析用,100-200目。
高氯酸分析纯。
冰乙酸分析纯。
香草醛溶液称取5g香草醛,加冰乙酸溶解并定容至100mL。
人参皂甙Re 购自中国药品生物制品检定所。
人参皂甙Re标准溶液:精确称取人参皂甙Re标准品0.020g,用甲醇溶解并定容至10.0mL,即每毫升人参皂甙Re2.0mg。
B.2 仪器比色剂层析柱B.3 实验步骤试样处理固体试样:称取1.000g左右的试样(根据试样含人参量定),置于100mL容量瓶中,加少量水,超声30min,再用水定容至100mL,摇匀,放置,吸取上清液1.0mL进行柱层析。
粗多糖含量测定方法学验证

粗多糖含量测定方法学研究资料一、仪器与试药 (1)二、方法的研究 (2)1.检测波长的测定 (2)2.样品及对照制备方法 (2)三、方法学验证 (3)1.线性 (3)2.精密度实验 (4)3.稳定性实验 (4)4.重复性试验 (5)5.中间精密度实验 (5)6.准确度试验 (6)芪参颗粒粗多糖含量测定方法起草说明标志性成分粗多糖含量测定的方法来源于《保健食品功效成分检测方法》白鸿主编(中国中医药出版社)的第二法,该方法的原理是:多糖经乙醇沉淀分离后,去除其他可溶性糖及杂质的干扰,糖与硫酸在沸水浴中加热脱水生成羟甲基呋喃甲醛(羟甲基呋喃糠醛),再与蒽酮缩合成蓝绿色化合物,其显色强度与溶液中糖的浓度成正比,在625nm波长下比色测定。
主要研究资料如下:一、仪器与试药1、仪器(1) 离心机(湘南湘仪实验室仪器开发有限公司,型号TD25-WS);(2) 离心管:50ml;(3) 水浴锅(上海精宏实验设备有限公司,型号 DK-S26);(4) 旋涡混合器(DioCote,SA8);(5) SHIMADZU UV-1800 紫外可见光分光光度计;(6) JB760-68 石英比色皿(宜兴市伟鑫仪器有限公司);(7) TU-1901 双光束紫外可见光分光光度计(北京普析通用仪器有限责任公司);2、试药(1) 葡萄糖:广州化学试剂厂,分析纯,批号为-1;(2) 无水乙醇:西陇化学股份有限公司,分析纯,批号为160802 1;(3) 蒽酮:国药集团化学试剂有限公司,分析纯,批号为;(4) 硫酸:广州化学试剂厂,分析纯,批号为-1;(5) 葡萄糖标准液:标准称取干燥恒重的分析纯级葡萄糖,加水溶解,并定容至50ml,此溶液1ml含10mg葡萄糖,用前稀释100倍为使用液(ml)。
(6) %蒽酮硫酸溶液(W/V):准确称取蒽酮置于烧杯中,缓缓加入100ml 80%硫酸溶解,溶解后呈黄色透明溶液。
现用现配。
3、试样v1.0 可编辑可修改(1) 样品颗粒:XXXXX 有限公司提供。
食用菌中粗多糖的测定

食用菌中粗多糖的测定苯酚硫酸法作业指导书本作业指导书主要依据NY/T 1676-2008 《食用菌中粗多糖含量的测定》标准而制定作业指导书。
1 范围本标准规定了食用菌粗多糖的比色测定法。
本标准适用于各种干、鲜食用菌产品中粗多糖及食用菌制品中粗多糖含量的测定,不适用于添加淀粉、糊精组分的食用菌产品,以及食用菌液体发酵或固体发酵产品。
2 原理多糖在硫酸作用下,先水解成单糖,并迅速脱水生成糖醛衍生物,与苯酚反应生成橙黄色溶液,在490nm处有特征吸收,与标准系列比较定量。
3 试剂和材料除非另有说明,在分析中仅使用确认为分析纯的试剂和符合GB/T 6682的蒸馏水。
3.1 试剂3.1.1 浓硫酸(H2SO4)。
3.1.2 无水乙醇(C2H6O)。
3.1.3 苯酚(C6H6O),重蒸馏。
3.1.4 80%乙醇。
3.1.5 葡萄糖(C6H12O6),使用前应于105℃恒温烘干至恒重。
3.1.6 80%苯酚溶液:称取80g苯酚(3.1.3)于100ml烧杯中,加水溶解,定容至100ml后转至棕色瓶中,至4℃冰箱中保存。
3.1.7 5%苯酚:吸取5ml苯酚溶液(3.1.6),溶于75ml水中,混匀,现配现用。
3.1.8 100mg/L标准葡萄糖溶液:称取0.1000g葡萄糖于100ml烧杯中,加水溶解,定容至1000ml,至4℃冰箱中保存。
4 仪器和设备4.1 可见分光光度计4.2 分析天平:感量0.001g。
4.3 超声提取器。
4.4 离心机5 分析步骤5.1 样品称取称取样品0.5g,精确到0.001g,置于50ml具塞离心管中。
5.2 单糖去除缓慢加入80%乙醇,同时用涡旋仪振摇,使混合均匀,置超声提取器中超声提取30min。
4000r/min离心10min,弃去上清液,保留沉淀。
5.3 样品中有无淀粉、糊精弃去上清液转移10ml至试管中,加入1滴碘溶液,振荡混合,观察是否有淀粉或糊精与碘溶液反应后呈蓝色或红色。
(完整版)粗多糖的测定方法

粗多糖的测定方法(1)1. 原理分子量大于10,000道尔顿的多糖经80%乙醇沉淀后,加入碱性铜试剂,选择性地从其他高分子物质中沉淀出葡聚糖,沉淀部分与苯酚-H2SO4反应,生成有色物质,在485nm条件下,有色物质的吸光度值与葡聚糖浓度成正比。
2. 适用范围参照AOAC方法。
适用于检测含有分子量大于10,000道尔顿葡聚糖的样品。
3.仪器(1)分光光度计(2)离心机(3)旋转混匀器(4)恒温水浴锅4.试剂除特殊说明外,实验用水为蒸馏水,试剂为分析纯。
(1)80%乙醇:800ml无水乙醇加水200ml。
(2)2.5 mol/L NaOH溶液:100 g NaOH加蒸馏水稀释至1 L,加入固体无水硫酸钠至饱和。
(3)铜贮存液:称取3.0 g CuSO4 ·5H2O,30.0 g柠檬酸钠加水溶解至1 L。
溶液可贮存2周。
(4)铜应用溶液:取铜贮存液50 ml,加水50 ml混匀后加入无水硫酸钠12.5 g,临用新配。
(5)洗涤液:取水50 ml,加入10 ml铜应用溶液,10 ml 2.5 mol/L NaOH溶液,混匀。
(6)1.8 mol/L H2SO4:取100ml浓硫酸用水稀释至1L。
(7)20 g/L苯酚溶液:称取2.0g苯酚,加水溶解并稀释至100ml,混匀备用。
(8)葡聚糖标准液:称取500mg葡聚糖(分子量500,000D)于称量皿中,105℃干燥4h 至恒重,置于装有干燥硅胶的干燥器中冷却。
准确称取100mg干燥后的葡聚糖,用水定容至100ml,葡聚糖标准浓度为1.0 mg/ml。
(9)葡聚糖标准应用液:吸取葡聚糖标准液10ml,用水稀释10倍,葡聚糖终浓度为0.1mg/ml。
粗多糖的测定方法(2)5. 操作方法5.1 样品处理(1)样品提取:称取样品1~5g,加水100ml,沸水浴加热2h,冷却至室温,定容至200ml (V1),混匀后过滤,弃初滤液,收集余下滤液。
(2)沉淀高分子物质:准确吸取上述滤液100ml (V2),置于烧杯中,加热浓缩至10ml,冷却后,加入无水乙醇40ml,将溶液转至离心管中以3000rpm离心5min,弃上清液,残渣用80%乙醇洗涤3次,残渣供沉淀葡聚糖之用。
粗多糖的测定

粗多糖的测定:按王光亚主编,《保健食品功效成分检测方法》P19(分光光度法测定粗多糖的含量)1、适用范围本方法适用于各类食品中以葡聚糖为主要结构,相对分子质量1×104的水溶液性粗多糖的测定。
本方法最低检测浓度为5.0mg/L。
2、原理食品中相对分子质量>1×104的高分子物质在80%乙醇溶液中沉淀,与水溶液中单糖和低聚糖分离,用碱性二价铜试剂选择性地从其他高分子物质中沉淀具有葡聚糖结构的多糖,用苯酚—硫酸反应以碳水化合物形式比色测定其含量,其显色强度与粗多糖中葡聚糖的含量成正比,以此计算食品中粗多糖的含量。
3、主要仪器(1)分光光度计(2)离心机(3000r/min)(3)旋转混匀器4、试剂本方法所用试剂除特殊注明外,均为分析纯;所用水为去离子水或同等纯度蒸馏水。
(1)乙醇溶液(80%):20ml水中加入无水乙醇80mL,混匀。
(2)NaOH溶液(100g/L):称取100g氢氧化钠,加水溶解并稀释至1L,加入固体无水硫酸钠至饱和,备用。
(3)铜试剂储备液:称取3.0gCuSO4·5H2O,30.0g柠檬酸钠,加水溶解并稀释至1L,混匀,备用。
(4)铜试剂溶液:取铜试剂储备液50mL,加水50mL,混匀后加入固体无水硫酸钠12.5g并使其溶解。
临用新配。
(5)洗涤剂:取水50mL,加入10mL铜试剂溶液、10mL氢氧化钠溶液,混匀。
(6)硫酸溶液(10%):取100mL浓硫酸加入到800mL左右水中,混匀,冷却后稀释至1L。
(7)苯酚溶液(50g/L):称取精制苯酚5.0g,加水溶解并稀释至100mL,混匀。
溶液置冰箱中可保存1个月。
(8)葡聚糖标准储备液:准确称取相对分子质量5x105已干燥至恒重的葡聚糖标准品0.5000g,加水溶解,并定容至50mL,混匀,置冰箱保存。
此溶液1mL 含10.0mg葡聚糖。
(9)葡聚糖标准使用液:吸取葡聚糖标准储备液1.0mL,置于100mL容量瓶中,加水至刻度,混匀,置冰箱中保存。
粗多糖检测方法

粗多糖的测定方法(分光光度法)本方法适用于各类食品中以葡聚糖为主要结构,相对分子质量1×104以上的水溶性粗多糖的测定。
本方法最低检测浓度为5.0mg/L。
1. 方法提要食品中相对分子质量>1×104的高分子物质在80%乙醇溶液中沉淀,与水溶液中单糖和低聚糖分离,用碱性二价铜试剂选择性地从其他高分子物质中沉淀具有葡聚糖结构的多糖,用苯酚—硫酸反应以碳水化合物形式比色测定其含量,其显色强度与粗多糖中葡聚糖的含量成正比,以此计算食品中粗多糖的含量。
2. 主要仪器(1)分光光度计。
(2)离心机(3000r/min)。
(3)旋转混匀器。
3. 试剂本方法所用试剂除特殊注明外,均为分析纯;所用水为去离子水或同等纯度蒸馏水。
(1)乙醇溶液(80%):20mL水中加入无水乙醇80mL,混匀。
(2)氢氧化钠溶液(100g/L):称取100g氢氧化钠,加水溶解并稀释至1L,加入固体无水硫酸钠至饱和,备用。
(3)铜试剂储备液:称取3.0gCuSO4·5H2O,30.0g柠檬酸钠,加水溶解并稀释至1L,混匀,备用。
(4)铜试剂溶液:取铜试剂储备液50mL,加水50mL,混匀后加入固体无水硫酸钠12.5g并使其溶解。
临用新配。
(5)洗涤剂:取水50mL,加入10mL铜试剂溶液、10mL氢氧化钠溶液,混匀。
(6)硫酸溶液(10%):取100mL浓硫酸加入到800mL左右水中,混匀,冷却后稀释至1L。
(7)苯酚溶液(50g/L):称取精制苯酚5.0g,加水溶解并稀释至100mL,混匀。
溶液置冰箱中可保存1个月。
(8)葡聚糖标准储备液:准确称取相对分子质量5x105已干燥至恒重的葡聚糖标准品0.5000g,加水溶解,并定容至50mL,混匀,置冰箱保存。
此溶液1mL 含10.0mg葡聚糖。
(9)葡聚糖标准使用液:吸取葡聚糖标准储备液1.0mL,置于100mL容量瓶中,加水至刻度,混匀,置冰箱中保存。
粗多糖检测方法

粗多糖(以葡萄糖计)的测定方法
1. 主要仪器
分光光度计;水浴锅;分析天平等
2. 试剂
蒽酮:分析纯;浓硫酸:分析纯;水为去离子水或蒸馏水。
蒽酮硫酸溶液:精密称取蒽酮0.1g ,加80%的硫酸溶液100ml 使溶解,摇匀。
3. 对照品溶液的制备
取葡萄糖对照品适量,于105℃干燥至恒重,精密称定,加水制成每1ml 含0.1mg 的溶液,即得。
4. 标准曲线的制备
分别精密量取对照品溶液0.2ml 、0.4ml 、0.6ml 、0.8ml 、1.0ml 、1.2ml ,置10ml 具塞试管中,加水至2.0ml ,精密加入硫酸蒽酮溶液6ml ,摇匀,置沸水浴中加热15分钟,取出,放入冰水浴中冷却15分钟,以相应的试剂为空白,照紫外-可见分光光度法,在625nm 波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
5. 供试品溶液的制备
精密量取本品1ml ,置于50ml 容量瓶中,加水稀释至刻度,摇匀,精密量取该溶液2ml 至20ml 容量瓶中,加水稀释至刻度,摇匀,即得。
6. 测定法
精密量取供试品溶液2ml ,置10ml 具塞试管中,照标准曲线的制备项下的方法,自“精密加入硫酸蒽酮溶液6ml ”起,依法测定吸光度,从标准曲线上读出供试品溶液中含葡萄糖的重量(mg ),计算,即得。
7. 结果计算
1000
1001⨯⨯⨯=V V m X 式中 X ——样品中粗多糖含量(以葡萄糖计)(g/100ml )
m ——供试品溶液中含葡萄糖的重量(mg )
V ——样品稀释倍数
V 1——比色时所取的样品溶液体积(ml )。
真菌发酵产物胞内粗多糖测定的实验结果

真菌发酵产物胞内粗多糖测定的实验结果
一、实验目的
本实验旨在通过对真菌发酵产物胞内粗多糖测定,掌握粗多糖的提取和测定方法,了解真菌发酵产物中粗多糖的含量。
二、实验原理
1. 粗多糖提取原理:
将真菌发酵产物经过酸碱处理后,使其细胞壁分解,胞内组分释放出来。
然后通过离心、洗涤等步骤将细胞壁残渣去除,得到纯化的粗多糖。
2. 粗多糖测定原理:
利用硫酸-苯酚法可以将粗多糖转化为含有硫酸根离子的多糖硫酸盐。
然后再与苯酚反应生成红色复合物,在特定波长下测定吸光度,从而计算出样品中粗多糖的含量。
三、实验步骤
1. 粗多糖提取步骤:
(1)称取一定量真菌发酵产物样品加入适量0.05mol/L NaOH溶液中,在60℃下水浴加热30min;
(2)加入适量0.05mol/L HCl溶液中,使溶液pH=2左右;
(3)离心收集胞内组分,洗涤去除细胞壁残渣;
(4)将纯化后的粗多糖样品冷冻干燥备用。
2. 粗多糖测定步骤:
(1)取一定量粗多糖样品加入适量0.5mol/L H2SO4溶液中,在室温下水浴加热30min;
(2)加入适量0.5%苯酚溶液中,混合均匀;
(3)在特定波长下测定吸光度,并根据标准曲线计算出样品中粗多糖的含量。
四、实验结果
经过实验测定,得到真菌发酵产物中粗多糖的含量为XXmg/g。
五、实验注意事项
1. 实验过程中要注意安全,避免接触强酸和强碱。
2. 离心时要注意离心速度和时间。
3. 测定吸光度时应该选取合适的波长,并进行空白对比。
4. 实验前要对所有仪器设备进行检查和校准。
粗多糖检测方法(以葡萄糖计)

A.1粗多糖的测定A.1.1原理样品溶液中粗多糖经80%乙醇沉淀,粗多糖在硫酸作用下,先分解成单糖,并迅速脱水成糖醛衍生物,与苯酚反应生成橙黄色溶液,在490nm成有特征吸收,与标准曲线比较计算含量。
A.1.2试剂和对照品除非另有说明,在分析中仅使用确认为分析纯的试剂和符合GB/T 6682中的蒸馏水。
A.1.2.1硫酸(H2SO4),ρ=1.84g/mlA.1.2.2无水乙醇(C2H6O)A.1.2.3苯酚(C6H6O)A.1.2.4葡萄糖(C6H12O6),使用前于105℃恒温烘干至恒重。
A.1.2.5 5%苯酚溶液:称取苯酚5g,于100ml烧杯中,加适量水溶解,定溶于100ml容量瓶中,现配现用。
A.1.2.6 100mg/L标准葡萄糖溶液:准确称量0.1000g葡萄糖(A.1.2.4)于100ml烧杯中,加水溶解,定容至1000ml容量瓶中,摇匀,至4℃冰箱密塞贮存。
A.1.3仪器设备及装置A.1.3.1可见光分光光度计A.1.3.2分析天平,感量0.001gA.1.3.3离心机A.1.4试样制备精密量取本品软胶囊内容物10.00g,加10倍量的水,在100℃水浴中煮沸1h,重复3次.提取液过滤,浓缩至1:1(g/ml),加入3倍量无水乙醇,震荡摇匀,静止片刻使沉淀出现,在离心机中以4000r/min离心10min,小心弃去上清液,沉淀用热水溶解转移至100ml容量瓶中,离心管用水洗涤2~3次,洗涤液一并转移至容量瓶中,定容摇匀。
取上述溶液5ml 至10ml容量瓶中,加水定容,摇匀作为样品测定液。
A.1.5操作步骤A.1.5.1标准曲线分别吸取0、0.2ml、0.4ml、0.6ml、1.0ml的标准葡萄糖溶液(A1.2.6)置20ml具塞试管中,用蒸馏水补至1.0ml,向试液中加入1.0ml苯酚溶液(A1.2.5),然后快速加入5.0ml 硫酸(于液面垂直加入,勿接触试管壁,以便与反应液充分混合),静置10min,使用涡旋振荡器使反应液充分混合,然后将试管放置于30℃水浴中反应20min,在490nm处测定吸光度,以葡萄糖质量浓度为横坐标,吸光度值为纵坐标,制定标准曲线。
粗多糖测定方法的比较

一)苯酚法测定可溶性糖【实验原理】植物体内的可溶性糖主要是指能溶于水及乙醇的单糖和寡聚糖。
苯酚法测定可溶性糖的原理是:糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10-100mg范围内其颜色深浅与糖的含量成正比,且在485nm波长下有最大吸收峰,故可用比色法在此波长下测定。
苯酚法可用于甲基化的糖、戊糖和多聚糖的测定,方法简单,灵敏度高,实验时基本不受蛋白质存在的影响,并且产生的颜色稳定160min以上。
【实验仪器及试剂】1.仪器:分光光度计、电炉、铝锅、20mL刻度试管、刻度吸管、记号笔、吸水纸适量。
2.试剂:(1)90%苯酚溶液:称取90g苯酚(AR),加蒸馏水10mL溶解,在室温下可保存数月。
(2)9%苯酚溶液:取3mL 90%苯酚溶液,加蒸馏水至30mL,现配现用。
(3)浓硫酸(比重1.84)。
(4)1%蔗糖标准液:将分析纯蔗糖在80℃下烘至恒重,精确称取1.000g。
加少量水溶解,移入100mL容量瓶中,加入0.5mL浓硫酸,用蒸馏水定容至刻度。
(5)100ug/L蔗糖标准液:精确吸取1%蔗糖标准液1mL加入100mL容量瓶中,加水定容。
【实验步骤】1.标准曲线的制作:取20mL刻度试管11支,从0-10分别编号,按表27-1加入溶液和水,然后按顺序向试管内加入1mL 9%苯酚溶液,摇匀,再从管液正面以5-20s。
加入5 mL浓硫酸,摇匀。
比色液总体积为8 mL,在恒温下放置30min。
显色。
然后以空白为参比,在485nm波长下比色测定,以糖含量为横坐标,光密度为纵坐标,绘制标准曲线,求出标准直线方程。
2.可溶性糖的提取取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0.10-0.30g,共3份,分别放入3支刻度试管中,加入5-10mL 蒸馏水,塑料薄膜封口,于沸水中提取30min(提取2次),提取液过滤入25mL容量瓶中,反复冲洗试管及残渣,定容至刻度。
3.测定吸取0.5mL样品液于试管中(重复2次),加蒸馏水1.5mL,同制作标准曲线的步骤,按顺序分别加入苯酚、浓硫酸溶液,显色并测定光密度。
保健食品粗多糖的测定-二次沉淀法

A.1 保健食品中粗多糖的测定方法分光光度法本方法适用于各类食品中以葡聚糖为主要结构,相对分子质量1×104以上的水溶性粗多糖的测定。
1.方法提要食品中相对分子质量>1×104的高分子物质在80%乙醇溶液中沉淀,与水溶液中单糖和低聚糖分离,用碱性二价铜试剂选择性地从其他高分子物质中沉淀具有葡聚糖结构的多糖,用苯酚-硫酸反应以碳水化合物形式比色测定其含量,其显色强度与粗多糖中葡聚糖的含量成正比,以此计算食品中粗多糖含量。
2.主要仪器(1)分光光度计(2)离心机(3000r/min)(3)旋转混匀器3.试剂本方法所用试剂除特殊注明外,均为分析纯;所用水为去离子水或同等纯度蒸馏水。
(1)乙醇溶液(80%):20mL水中加入无水乙醇80mL,混匀。
(2)氢氧化钠溶液(100g/L):称取100g氢氧化钠,加水溶解并稀释至1L,加入固体无水硫酸钠至饱和,备用。
(3)铜试剂储备液:称取3.0gCuSO4•5H2O,30.0g柠檬酸钠,加水溶解并稀释至1L,混匀,备用。
(4)铜试剂溶液:取铜试剂储备液50mL,加水50mL,混匀后加入固体无水硫酸钠12.5g并使其溶解。
临用新配。
(5)洗涤剂:取水50mL,加入10mL铜试剂溶液、10mL氢氧化钠溶液,混匀。
(6)硫酸溶液(10%):取100mL浓硫酸加入到800mL左右水中,混匀,冷却后稀释至1L。
(7)苯酚溶液(50g/L):称取精制苯酚5.0g,加水溶解并稀释至100mL,混匀。
溶液置冰箱中可保存1个月。
(8)葡聚糖标准储备液:准确称取相对分子质量5×105已干燥至恒重的葡聚糖标准品0.5000g,加水溶解,并定容至50mL,混匀,置冰箱中保存。
此溶液1mL含10.0mg葡聚糖。
(9)葡聚糖标准使用液:吸取葡聚糖标准储备液1.0mL,置于100mL容量瓶中,加水至刻度,混匀,置冰箱中保存。
此溶液1mL含葡聚糖0.10mg。
4.测定步骤(1)样品处理:a. 样品提取:称取混合均匀的固体样品2.0g,置于100mL容量瓶中,加水80mL左右,于沸水浴上加热2h,冷却至室温后补加水至刻度,混匀后,过滤,弃去初滤液,收集余下滤液供沉淀多糖。
粗多糖的测定

粗多糖的测定:1、方法提要食品中相对分子质量1×104的高分子物质在80%乙醇溶液中沉淀,与水溶液中单糖和低聚糖分离,用碱性二价铜试剂选择性地从其他高分子物质中沉淀具有葡聚糖结构的多糖,用苯酚-硫酸反应以碳水化合物形式比色测定其含量,其显色强度与粗多糖中葡聚糖的含量成正比,以此计算食品中粗多糖含量。
2、主要仪器(1)分光光度计(2)离心机(3000r/min)(3)旋转混匀器3、试剂本方法所用试剂除特殊注明外,均为分析纯;所用水为去离子水或同等纯度蒸馏水。
(1)乙醇溶液(80%):20ml水中加入无水乙醇80mL,混匀。
(2)NaOH溶液(100g/L):称取100g氢氧化钠,加水溶解并稀释至1L,加入固体无水硫酸钠至饱和,备用。
(3)铜试剂储备液:称取3.0gCuSO4•5H2O,30.0g柠檬酸钠,加水溶解并稀释至1L,混匀,备用。
(4)铜试剂溶液:取铜试剂储备液50mL,加水50mL,混匀后加入固体无水硫酸钠12.5g 并使其溶解。
临用新配。
(5)洗涤剂:取水50mL,加入10mL铜试剂溶液、10mL氢氧化钠溶液,混匀。
(6)硫酸溶液(10%):取100mL浓硫酸加入到800mL左右水中,混匀,冷却后稀释至1L。
(7)苯酚溶液(50g/L):称取精制苯酚5.0g,加水溶解并稀释至100mL,混匀。
溶液置冰箱中可保存1个月。
(8)葡聚糖标准储备液:准确称取相对分子质量5x105已干燥至恒重的葡聚糖标准品0.5000g,加水溶解,并定容至50mL,混匀,置冰箱保存。
此溶液1mL含10.0mg葡聚糖。
(9)葡聚糖标准使用液:吸取葡聚糖标准储备液1.0mL,置于100mL容量瓶中,加水至刻度,混匀,置冰箱中保存。
此溶液1mL含葡聚糖0.10mg。
4、测定步骤(1)样品处理a、样品提取:取胶囊内容物2.0g混匀,置于100mL容量瓶中,加水80mL左右,于沸水浴上加热2h,冷却至室温后补加水至刻度,混匀后,过滤,弃去初滤液,收集余下滤液供沉淀多糖。
粗多糖提取实验报告(3篇)

第1篇一、实验目的1. 了解粗多糖的基本性质和提取方法。
2. 掌握水提醇沉法提取粗多糖的原理和操作流程。
3. 通过实验验证粗多糖提取效果,并对其含量进行测定。
二、实验原理粗多糖是一类高分子碳水化合物,广泛存在于植物、动物和微生物中。
水提醇沉法是一种常用的粗多糖提取方法,其原理是利用多糖在水中的溶解度较高,而在乙醇中的溶解度较低的特点,通过加水提取多糖,然后用乙醇沉淀多糖,从而实现多糖的分离纯化。
三、实验材料与试剂1. 实验材料:植物材料(如大麦、玉米等),乙醇,蒸馏水,硫酸铵,苯酚,浓硫酸等。
2. 实验试剂:95%乙醇,NaOH,FeCl3,浓盐酸,氯仿,乙酸乙酯等。
四、实验仪器1. 实验室常用仪器:电子天平,恒温加热器,水浴锅,旋转蒸发仪,离心机,移液器等。
2. 特殊仪器:分光光度计,真空干燥箱等。
五、实验步骤1. 植物材料预处理:将植物材料洗净、晾干,然后研磨成粉末。
2. 水提:将研磨好的植物粉末加入适量蒸馏水,加热煮沸,提取多糖。
3. 醇沉:将提取液冷却至室温,加入95%乙醇,使多糖沉淀。
4. 沉淀分离:将沉淀物用离心分离,弃去上清液。
5. 沉淀干燥:将沉淀物用无水乙醇洗涤,然后在真空干燥箱中干燥至恒重。
6. 粗多糖含量测定:采用苯酚-硫酸法测定粗多糖含量。
六、实验结果与分析1. 粗多糖提取率:根据实验数据计算粗多糖提取率,并与文献报道进行比较。
2. 粗多糖含量测定:根据苯酚-硫酸法测定粗多糖含量,并与理论值进行比较。
3. 结果分析:分析实验结果,探讨影响粗多糖提取率的因素,如提取时间、提取温度、乙醇浓度等。
七、实验讨论1. 粗多糖提取率的影响因素:实验结果表明,提取时间、提取温度、乙醇浓度等因素对粗多糖提取率有显著影响。
在实验条件下,最佳提取时间为2小时,提取温度为80℃,乙醇浓度为95%。
2. 粗多糖提取方法的优化:通过实验,对水提醇沉法进行了优化,提高了粗多糖提取率。
3. 粗多糖的应用前景:粗多糖具有多种生物活性,如抗炎、抗氧化、降血糖等,具有广泛的应用前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
粗多糖的测定方法(1)
1. 原理
分子量大于10,000道尔顿的多糖经80%乙醇沉淀后,加入碱性铜试剂,选择性地从其他高分子物质中沉淀出葡聚糖,沉淀部分与苯酚-H2SO4反应,生成有色物质,在485nm条件下,有色物质的吸光度值与葡聚糖浓度成正比。
2. 适用范围
参照AOAC方法。
适用于检测含有分子量大于10,000道尔顿葡聚糖的样品。
3.仪器
(1)分光光度计
(2)离心机
(3)旋转混匀器
(4)恒温水浴锅
4.试剂
除特殊说明外,实验用水为蒸馏水,试剂为分析纯。
(1)80%乙醇:800ml无水乙醇加水200ml。
(2)2.5 mol/L NaOH溶液:100 g NaOH加蒸馏水稀释至1 L,加入固体无水硫酸钠至饱和。
(3)铜贮存液:称取3.0 g CuSO4 ·5H2O,30.0 g柠檬酸钠加水溶解至1 L。
溶液可贮存2周。
(4)铜应用溶液:取铜贮存液50 ml,加水50 ml混匀后加入无水硫酸钠12.5 g,临用新配。
(5)洗涤液:取水50 ml,加入10 ml铜应用溶液,10 ml 2.5 mol/L NaOH溶液,混匀。
(6)1.8 mol/L H2SO4:取100ml浓硫酸用水稀释至1L。
(7)20 g/L苯酚溶液:称取2.0g苯酚,加水溶解并稀释至100ml,混匀备用。
(8)葡聚糖标准液:称取500mg葡聚糖(分子量500,000D)于称量皿中,105℃干燥4h 至恒重,置于装有干燥硅胶的干燥器中冷却。
准确称取100mg干燥后的葡聚糖,用水定容至100ml,葡聚糖标准浓度为1.0 mg/ml。
(9)葡聚糖标准应用液:吸取葡聚糖标准液10ml,用水稀释10倍,葡聚糖终浓度为0.1mg/ml。
粗多糖的测定方法(2)
5. 操作方法
5.1 样品处理
(1)样品提取:称取样品1~5g,加水100ml,沸水浴加热2h,冷却至室温,定容至200ml (V1),混匀后过滤,弃初滤液,收集余下滤液。
(2)沉淀高分子物质:准确吸取上述滤液100ml (V2),置于烧杯中,加热浓缩至10ml,冷却后,加入无水乙醇40ml,将溶液转至离心管中以3000rpm离心5min,弃上清液,残渣用80%乙醇洗涤3次,残渣供沉淀葡聚糖之用。
(3)沉淀葡聚糖:上述残渣用水溶解,并定容至50ml (V3),混匀后过滤,弃初始滤液后,取滤液2.0ml (V4),加入2.5mol/L NaOH 2.0ml,Cu应用溶液2.0ml,沸水浴中煮沸2mim,冷却后以3000rpm离心5min,弃上清液,残渣用洗涤液洗涤3次,残渣供测定葡聚糖之用。
(4)测定葡聚糖:上述残渣用2.0mL 1.8mol/L H2SO4溶解,用水定容至100mL(V5)。
准确吸取2.0ml(V6),置于25ml比色管中,加入1.0ml苯酚溶液,10ml浓硫酸,沸水浴煮沸2分钟,冷却比色。
从标准曲线上查得相应含量,计算粗多糖含量。
5.2 标准曲线制备:
精密吸取葡聚糖标准应用液0.10,0.20,0.40,0.60,0.80,1.00,1.50,2.00ml(分别相当于葡聚糖0.01,0.02,0.04,0.06,0.08,0.10,0.15,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,浓硫酸10ml,混匀,沸水浴2分钟,混匀,沸水浴2分钟,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以葡聚糖浓度为横坐标,A为纵坐标绘制标准曲线。
6.计算
从标准曲线上查得样品相应含量,计算粗多糖含量。
葡聚糖(%)= c×V5×V3×V1×0.1 = c×250 (1)
V6×V4×V2×m m
公式中:c--从标准曲线上查得样品测定管中葡聚糖含量,mg;
V1--样品提取时定容体积,ml;
V2--沉淀高分子物质取液量,ml;
V3 --沉淀葡聚糖时定容量,ml;
V4 --沉淀葡聚糖时取液量,ml;
V5 --测定葡聚糖时定容体积,ml;
V6 --样品比色管中取样液体积,ml;
m--样品称量质量,g;
0.1--将mg/g 换算成g/100g 的系数。
7.注意事项
(1)苯酚-H2SO4溶液可以和多种糖类进行显色反应,常用于总糖的测定。
所以测定过程中应注意容器及试剂中其他糖类的干扰。
(2)苯酚-H2SO4溶液和不同类的糖反应,显色的强度略有不同,反映在标准曲线的斜率不同。
如果已知样品中糖的结构,应尽量以同类糖的纯品做标准品,或以含有已知浓度的同类产品做对照品进行检测分析;如果样品中糖的类型未知或结构多样,则只能以葡萄糖计或其他糖计报告结果。
(3)试验证明葡萄糖、果糖等单糖,蔗糖、乳糖等双糖、低聚糖--棉子糖,淀粉、糊精等多糖及甜味剂糖精不干扰粗多糖测定。
(4)本方法由北京市卫生防疫站建立,经中国预防医学科学院营养与食品卫生研究所验证。
以上是我找到的方法,希望对大家有所帮助
0票票数。
