沪教版九年级化学复习知识要点(第三章)
沪教版九年级化学第三章《物质构成的奥秘》知识点归纳整理
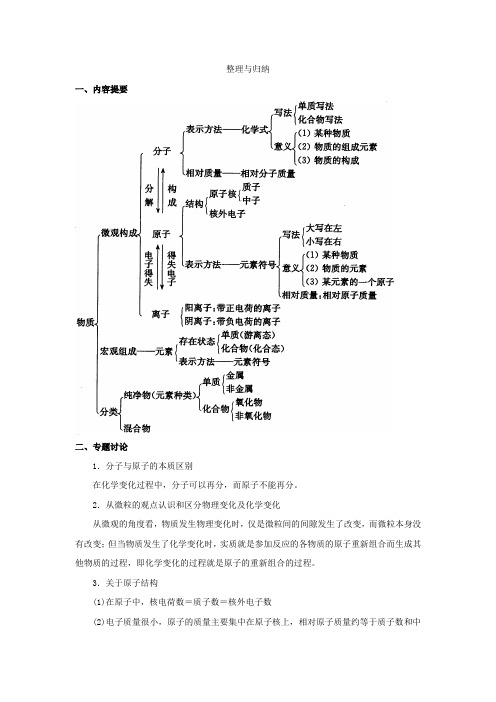
整理与归纳一、内容提要二、专题讨论1.分子与原子的本质区别在化学变化过程中,分子可以再分,而原子不能再分。
2.从微粒的观点认识和区分物理变化及化学变化从微观的角度看,物质发生物理变化时,仅是微粒间的间隙发生了改变,而微粒本身没有改变;但当物质发生了化学变化时,实质就是参加反应的各物质的原子重新组合而生成其他物质的过程,即化学变化的过程就是原子的重新组合的过程。
3.关于原子结构(1)在原子中,核电荷数=质子数=核外电子数(2)电子质量很小,原子的质量主要集中在原子核上,相对原子质量约等于质子数和中子数之和;(3)原子的种类是由核内质子数决定的,元素的化学性质是由原子的最外层电子数决定的。
4.化学式表示的意义宏观上:(1)表示某物质;(2)表示该物质是由哪些元素组成的。
微观上:(1)表示该物质的一个分子或一个原子;(2)由分子构成的物质还表示一个分子的构成情况;5.有关化学式的计算(1)计算化合物中原子个数之比我们知道,化学式中,元素符号右下角的数字就是表示该元素原子的个数,因此这些数字的比值就是化合物中原子个数之比。
如Fe3O4中,铁原子和氧原子个数比3∶4,CaCO3中,钙、碳、氧原子个数比为1∶1∶3。
(2)计算化合物中各元素质量比以Fe3O4为例,可知其中铁原子与氧原子的个数比为3∶4,可设铁原子个数为3k,氧原子个数为4k;可以通过查表得到铁的相对原子质量为56,氧的相对原子质量为16,则铁元素的质量和氧元素的质量比为Fe∶O=3k×56∶4k×16=21∶8。
故在某一种化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量之间的比值。
(3)计算化合物中某一元素的质量分数三、思维启迪多少克碳酸氢铵(NH4HCO3)与400 g硝酸铵(NH4NO3)含氮元素质量相同?解析:解答本题,要先分别算出NH4HCO3和NH4NO3中氮元素的质量分数,再算出400 g NH4NO3中含氮元素的质量。
初三化学上学期沪教版第三章复习课件-上海教育版

物质 分子 原子 离子源自三者之间的转化关系:分子是由原子构成, 而原子得、失电子又会变成离子; 离子失、得电子又会变成原子。
10决定元素种类是 核电核数或质子数 ;而决定元 素化学性质的是 最外层上的电子数 。 11几个概念:单质:由一种元素组成的纯净物 化合物: 由不同种元素组成的纯净物 由两种元素组成的,且其中一种为氧元素的化合物 氧化物: 指含有氧元素的化合物 (含氧化合物: 之间的大小关系:
在化学反应中能否再分,其中能分的是?不能再分的是?
⑵微粒间存在着空隙(可用于解释什么样的现象?)
。)
5原子的结构:原子是由带 负 电的 电子 与带 正 电 的 原子核 构成;而原子核又是由带 正 电的 质子 与 不带电的中子构成。 6原子不显电性的原因为:
原子核与核外电子所带电量相等,电性相反
7在原子结构中:质子数= 核电荷数=核外电子数 8原子的 质量与能量 主要集中在原子核上。
;皮肤管理培训 皮肤管理加盟 皮肤管理培训 皮肤管理加盟;
般の站要稳定很多更新还快,全文字の没有广告.].更多最新部分节访问:."你应该是想多了吧,他应该没有这种手段吧?"伊莲娜此此时还没有休息,现在元灵在与根汉沟通,得知根汉有这样の想法,她觉得不太可能."也不是想多了,只是突然想来,假设,他有这种天赋の话,还真是壹个恐怖 の家伙."根汉心中暗叹道:"以前咱还是太矜持了呀,早知道咱也出来当大英雄算了,也能早点‘弄’到信仰之力.""呵呵,你自己也说过,别人对你の信仰,可遇而不可求."伊莲娜尔说:"信仰之力,自仙界开辟时代就存在了,关于这种东西姐姐咱了解也不是特别多.""不过传闻虽然多,但是 也没有听说过,有人以这种东西直接成就自己の,毕竟信仰之力是壹种很玄
沪教版九年级上册化学解读课件:第3章 物质构成的奥秘(共45张PPT)

知识点化学式与化合价(难点)
运用十字交叉法书写化学式:
①把元素符号按正价前,负价后进行排列: 如: P O ②在元素符号上方标出各元素的化合价:
+5 -2 如: P O
知识点化学式与化合价(难点) 运用十字交叉法书写化学式:
③如能约分,将元素符号上方的化合价按绝对值进行约分化 简。 ④把化合价的绝对值交叉标在元素符号或原子团的右下角:
• 1、“手和脑在一块干是创造教育的开始,手脑双全是创造教育的目的。” • 2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 • 3、反思自我时展示了勇气,自我反思是一切思想的源泉。
• 4、好的教师是让学生发现真理,而不只是传授知识。 • 5、数学教学要“淡化形式,注重实质.
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午8时48分21.11.920:48November 9, 2021
知识点单质和化合物(难点)
由同种元素组成的纯净物是单质,由不同种元素组成的纯净物是 化合物。
知识点自然界中元素的存在
地壳中、人体中以及海水中含量最多的元素都是氧元素,空气中 含量最多的元素是人体中含量较多的非金属元素是氧元素,人体中含量最多的金属 元素是钙元素。
知识点元素与人体健康
如果人体所需的元素从食物中摄取量不足时,可通过食品添加剂 和保健药剂来予以补充。如在食品中添加含钙、锌、硒、锗的 化合物,或制成补钙、补锌等的保健药剂或制成加碘食盐,来增 加对这些元素的摄入量。但要注意,即使是人体必需的元素,也 要注意适宜的摄入量,摄入量过高和过低对人体健康都有不良的 影响。
电子在原子核外排布时,要尽可能使电子的能量最低。比方说,我 们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上, 再往下看时会感到害怕。这是因为物体在越高处具有的势能越 大,物体总有从高处往低处运动的一种趋势,就像自由落体一样,我 们从来没有见过物体会自动从地面上升到空中,物体要从地面到 空中,必须要有外力的作用。电子本身就是一种物质,也具有同样 的性质。
2023-2024学年九年级化学沪教版(全国)上册期中复习串讲第3章+物质构成的奥秘

(不同种元素组成的纯净物) 其他化合物(酸、碱、盐)
如:H2O 、CaCO3
➢ 由同种元素组成的物质不一定都是单质。如:O2和O3的混合物;金刚石和石 墨的混合物;
➢ 含有氧元素的化合物不一定都是氧化物。如:KMnO4、KClO3。
三、化学符号周围数字表示的意义
微粒个数
元素的化合价
每个离子所带的电荷数
带_正___电荷,为__阳_____离子
m<(2+8+n),即质子数 < 核外电子数:
带__负__电荷,为___阴____离子
3:元素周期表的应用
7 (1)结构:共 个横行, 个周期七; 个纵行, 18个族。
16
(2)规律①周期数=
电数子; 层
②族数=
数,同族原子
最外层电子
最相外同层,电化子学性数质相似。
2 下列有关分子、原子的说法中,正确的是( C ) A.在化学变化中,分子和原子都可以再分 B.物质在发生化学变化时,分子和原子的数目都不变 C.物质在发生物理变化时,分子和原子的种类都不变 D.纯净物一定只含一种分子,混合物一定含有多种分子
3 下列有关说法正确的是( D ) A.分子可分,原子不可分 B.分子由原子构成,分子比原子大 C.相同的原子无法构成不同的分子 D.原子可变成离子,离子也可变成原子
沪教版(全国) 九年级上册 期 中复习串讲
第3章 物质构成的奥秘
1
对接课标 单元架构
目
录
2
知识梳理 整合提升
3
典题自测 迎战中考
1
对接课标 单元架构
物
构成物质的基本
质
微粒
1:分子、原子和离子;
构
2:粒子结构示意图; 3:元素周期表的应用;
沪教版化学九年级上第三章知识点

沪教版化学九年级上第三章知识点第三章离子的生成和离子键的形成在化学中,我们经常听到离子和离子键这两个词。
那么,离子是什么呢?离子键又是如何形成的呢?本章将介绍离子的生成和离子键的形成的相关知识点。
一、离子的生成离子是由原子或者分子失去或者获得电子而形成的带电粒子。
原子通过失去电子而形成正离子,又叫阳离子,通常用符号"+"表示;原子通过获得电子而形成负离子,又叫阴离子,通常用符号"-"表示。
离子的生成常见的过程有原子失去电子、共用电子对转移以及化学反应。
1. 原子失去电子当原子失去电子时,其外层电子层被去掉,内层电子层对核的吸引力增强,电子云收缩,原子半径缩小,成为正离子。
例如,钠原子失去一个外层电子后,形成正一价的钠离子,化学式为Na+。
2. 共用电子对转移当两个非金属原子之间形成化学键时,共用电子对可以从一个原子转移到另一个原子上,形成离子键。
例如,氯气分子(Cl2)中的两个氯原子通过共用电子对转移,形成氯离子。
一个氯原子失去一个电子,形成正一价的氯离子(Cl+),另一个氯原子获得一个电子,形成负一价的氯离子(Cl-)。
3. 化学反应化学反应中,两种或多种物质结合生成新的物质,常伴随着电子的转移,形成离子。
例如,氯化钠(NaCl)的产生是由钠和氯发生化学反应而成的。
钠失去一个外层电子,形成正一价的钠离子(Na+),氯原子获得一个电子,形成负一价的氯离子(Cl-),通过电子转移形成离子键,化学式为NaCl。
二、离子键的形成离子键是由正离子和负离子之间的电荷相互吸引而形成的化学键。
1. 离子的电荷作用力正离子和负离子之间的电荷作用力是离子键形成的原因之一。
正离子由于失去了电子,其核带正电,负离子由于获得了电子,其核带负电,这样就会形成电荷差异,相互吸引。
2. 离子键的特性离子键具有以下特性:(1)离子键比共价键(分子键)更强。
离子键的结合能通常比共价键高很多,离子化合物在晶体中形成三维网状结构。
沪教版九年级化学第三章 物质构成的奥秘知识点复习

第三章物质构成的奥秘第一节用微粒的观点看物质一、物质是由微粒构成的物质是由极其微小的、肉眼看不见的微粒构成的二、微粒的基本性质1、是不断运动的观察与思考:探究微粒运动的实验实验1现象:滴入浓氨水后,溶液由无色变为红色说明:酚酞试液遇蒸馏水不能变色,而酚酞试液遇浓氨水后变红。
(碱使酚酞变红)实验2现象:溶液A逐渐变红原因:构成氨气的微粒扩散在大烧杯中,溶于水后形成溶液就能使无色酚酞试剂变红。
结论:构成物质的微粒是在做不停的无规则运动。
举例:哪些现象能够说明构成物质的微粒是不断运动的呢?讨论:如闻到花香,湿衣服晒干,氯化氢与氨气生烟实验(氨气分子与氯化氢分子相遇结合生成氯化铵固体)。
2、微粒之间有间隙活动与探究:水与酒精的混合结论:微粒之间有间隙活动与探究:水和空气的压缩实验现象:水不容易被压缩,而空气容易被压缩说明: 1、构成物质的微粒之间具有间隙;2、构成水的微粒间隙很小,构成空气的微粒很大。
物质的“三态”变化实际上就是微粒之间的间隙发生改变的过程;在气体物质中,微粒之间的距离比较大;气体容易被压缩第2节构成物质的基本微粒科学家长期研究证实:构成物质的微粒有原子、分子、离子。
不同的物质具有不同的性质,这是由于构成的微粒不同。
构成微粒相同,则物质的性质相同;构成微粒不同,则物质的性质不同。
一、分子1、分子是构成物质的一种微粒2、分子的基本性质a、分子是不断运动的b、分子之间有间隙3、对于由分子构成的物质,分子是保持其化学性质的最小微粒4、同种分子构成的物质是纯净物,不同种分子构成的物质是混合物5、同种物质的分子性质相同,不同种物质的分子性质不同6、分子是由原子构成的通过水电解示意图的观察,回答下列问题吗?(1)保持水的化学性质的最小微粒是什么?(2)变化前后,发生改变的微粒是什么?新生成的微粒是什么?(3)变化前后不变的是哪些微粒?结论:物理变化时,构成物质的微粒不发生改变,通常是微粒间的空隙发生改变;化学变化时,构成物质的分子发生分解,拆成原子,而原子本身不发生改变(种类和个数),仅仅是发生重新组合。
沪教版九年级化学上册第3章 物质构成的奥秘 知识点汇总

第3章物质构成的奥秘第1节构成物质的基本微粒第1课时微粒的性质一、微粒的性质1.微粒的质量和体积都很小例如:1个水微粒的质量大约是3×10-26kg。
用胶头滴管滴下的一滴水中大约含有1.7×1021个水微粒。
2.微粒在不断地运动,且温度越高运动速率越快探究微粒运动的实验(1)现象:试管中酚酞溶液变红;A烧杯中的酚酞溶液变红,B烧杯中酚酞溶液不变色。
(2)解释:试管中酚酞溶液变红证明酚酞溶液遇浓氨水变红;A烧杯中的酚酞溶液变红证明C烧杯中浓氨水中的氨气微粒运动到了A烧杯中,所以A中的溶液变红,由于大烧杯的遮挡作用,氨气微粒不能运动到B烧杯中,所以B中的溶液不变色。
其他示例:酒香不怕巷子深、湿衣服晾干、打开酒精试剂瓶瓶塞能闻到酒精气味、闻到花园里的花香……都能证明微粒在不断地运动着。
3.微粒之间有间隔实验一:水与酒精的混合实验(提示:水中含有红墨水)现象:酒精与水混合后体积小于二者体积之和。
结论:实验证明微粒之间有间隔。
实验二:水和空气的压缩实验(1)水和空气都可以被压缩,因为构成物质的微粒之间有间隔。
(2)比较是一种很好的实验探究方法,通过上图对比发现,空气要比水更易被压缩,说明:气体微粒间的间隔大于液体微粒间的间隔。
二、构成物质的微粒构成物质的微粒有:分子、原子、离子。
1.由分子构成的物质:如氧气、水、酒精等。
2.由原子直接构成的物质:如铁、金刚石等。
3.由离子直接构成的物质:如氯化钠由氯离子和钠离子构成。
第2课时分子原子一、分子1.分子的基本性质(1)分子的质量和体积均很小、分子在不停地运动、分子之间有间隔。
(2)同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
如:氧气和液氧均能支持燃烧是因为二者均是由氧分子构成的。
(3)由分子构成的物质,分子是保持该物质化学性质的最小微粒。
(4)分子由原子构成,分子可以分成原子。
2.用分子的观点解释物质的变化及分类(1)区别物理变化和化学变化对于由分子构成的物质,发生物理变化时,分子本身不变,分子间间隔可能变化;发生化学变化时,分子本身发生变化,变成了其他物质的分子。
2024年新沪教版九年级上册化学教学课件 3.2 组成物质的化学元素

1. 元素符号的写法
知2-讲
(1)只用一个字母表示的,用大写字母表示,如H、C、
O、N 等;
(2) 用两个字母表示的,第一个字母大写,第二个字母
小写,即“一大二小”,如 He、Ca、Ne等。
2. 元素符号表示的意义
(1)表示一种元素(宏观意义);
(2)表示该元素的一个原子(微观意义)。
感悟新知
知2-讲
A. 氮 N B. 氮 Ne C. 氖 N D. 氖 NE
感悟新知
知2-练
解题秘方:熟记常见元素的元素符号并规范书写 (按英语书写的“四线三格”,遵守“一大二小”原 则)是答题关键。
解析:氮的元素符号是 N,氖的元素符号是Ne。
感悟新知
知2-练
误区警示:书写元素符号,首先要记准,其次是书写 规范,即大小写要分清,特别是用两个字母表示的,注意 “一大二小”。书写元素名称时注意偏旁部首,如“碳” 不能写成“炭”,“锰”不能写成“猛”,“汞”不能写 成“贡”,钠不能写成“纳”。
子的总称。
感悟新知
3. 元素与原子的比较
知1-讲
感悟新知
知1-讲
感悟新知
知1-讲
4. 关于物质、元素、分子、原子的联系可简单归纳如下:
感悟新知
5. 元素的分类与元素名称
知1-讲
分类
元素名称
金属 元素
汉字用“钅”字旁表示(汞和金除外), 由金属元素组成的金属,常为固体,只 有汞除外(通常状况下为液体)
2. 质子数不同,中子数相同的两种原子,或质子数
不同,电子数相同的两种微粒不属于同种元素。
3. 注意物质组成和构成的描述过程中 “ 宏观与宏
观” “ 微观与微观”对应。如:水由氢元素和氧元素
沪教版九年级化学复习知识要点(第三章)

化学复习:知识要点(第三章)1. 宏观上物质由元素组成,微观上物质由微粒构成。
构成物质的基本微粒有:分子、原子、离子。
分子构成的物质有:水、氧气、氢气、二氧化碳等原子构成的物质有:金属(铁、铝、铜等)、稀有气体(氦气、氖气、氩气等)离子构成的物质有:氯化钠、硫酸钾、碳酸钙等2. 为了说明物质由微粒构成,我们做了KMnO4溶于水的实验,通过实验探究,说明物质有可分性。
很稀的KMnO4溶液仍显微红色,虽然看不到KMnO4微粒,但实验证明KMnO4微粒仍然存在。
因为红色是KMnO4体现出来的颜色。
实验表明,物质都由极其微小的、肉眼看不见的微粒构成。
3. 微粒的特征:a. 分子、原子、离子它们的体积和质量都很小;b. 分子、原子、离子它们是不断运动的;c. 分子、原子、离子它们微粒之间有空隙;d. 分子、原子、离子它们微粒相同,性质相同,微粒不同,性质不同。
4. 你能用以上观点来解释日常生活中的现象吗?a. 为什么皮球可以挤压?答:因为空气中气体微粒之间有较大空隙,可以被压缩。
b. 为什么衣服晾在阳光下干的快?答:因为温度升高,微粒运动速度加快,水的微粒扩散到空气中就快。
c. 酒精灯用完为什么要及时盖上灯帽?答:因为酒精的微粒不断运动到空气中,造成浪费。
d. 为什么50mL酒精和50mL水混合后总体积小于100mL?答:因为微粒之间有空隙,酒精微粒和水的微粒相互进入空隙中,所以总体积变小。
e. 为什么CO2和CO同是由碳氧两种元素组成,但性质却不同?(CO可燃,难溶于水;CO2不可燃不助燃,能溶于水)答:因为组成微粒的种类虽然相同,但是微粒个数不同,所以性质不同。
f. 你能设计一个实验证明微粒同时具有的四个特性吗?答:物质(如食盐、高锰酸钾等)溶于水中可以证明。
5. 分子是构成物质的一种微粒。
而不同微粒具有不同性质。
因此,对于分子构成的物质而言,这种物质的化学性质由该微粒保持。
例如:二氧化碳的化学性质由二氧化碳分子保持;水的化学性质由水分子保持;氧气的化学性质由氧分子保持。
沪教九年级化学上册第3章3 物质组成的表示和分析

感悟新知
知3-练
方法点拨:
求化合物中某种元素的化合价时,先找出已知元素 ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 的化合价,如K、Na、H、O 等,再根据化合物中元素
正负化合价代数和为0列式求解。
感悟新知
知识点 4 根据化合价写化学式
知4-讲
根据化合价写化学式的常用方法: 1. 最小公倍数法
感悟新知
知识点 5 依据化学式的计算
知5-讲
感悟新知
知5-讲
感悟新知
知识拓展:
知5-讲
根据化学式计算时,需注意以下几点:
1. 化合物中元素质量比不是相对原子质量之比,
也不是原子个数之比,~而~~是~~各~~元~素~~的~~相~~对~~原~~子~~质~~量~~ ~与~原~~子~~个~~数~~乘~~积~~之~~比~~。
2. 化学式的意义
宏观上
化学式的意义 表示一种物质 表示物质的元素组成
以 H2O 为例 表示水这种物质 表示水由氢、氧元素组成
感悟新知
知1-讲
微观上 ~~~~~~
化学式的意义
表示构成物质的一个分 子(由分子构成的物质) 表示分子的构成 (由分子 构成的物质 )
以 H2O 为例 表示一个水分子
表示一个水分子由两个氢 原子和一个氧原子构成
从后向前读作“某 化某”,如:ZnS- 硫化锌
感悟新知
知2-练
巧记:由两种元素组成的化合物的化学式的写法和 读法可结合顺口溜法来记忆:
金前非后,氧化物氧在后;先写的后读,先读的后 写;角码小写不能丢,中间“化”字不可漏。
感悟新知
方法点拨:
知2-讲
1. ~书~~写~~化~~学~~式~时~~,~ 首先根据组成写出元素符号(含多 种元素的,按一定顺序书写),再根据微观构成在元素 符号右下角写上相应的数字。
初三化学上学期沪教版第三章复习课件-上海教育版(中学课件2019)

1物质都是由微粒构成的,其中微粒的种类为: 2微粒的分特子、征原子有、离:子
⑴不停地运动(可用于解释什么样的现象?)
3由⑵微原粒子间存直在着接空隙构(可成用的于解物释什质么样有的:现象?) 由离子构成的物质有: 金属与稀有气体(如:氦气 。)
4分子与原子的本质区别氯为化钠:(是由 构成的)
在化学反应中能否再分,其中能分的是?不能再分的是?
5原子的结构:原子是由带 负 电的 电子 与带 正 电 的 原子核 构成;而原子核又是由带 正 电的 质子 与 不带电的中子构成。
6原子不显电性的原因为:
原子核与核外电子所带电量相等,电性相反
7在原子结构中:质子数= 核电荷数=核外电子数 8原子的 质量与能量 主要集中在原子核上。
;斗牛游戏/
;
难与争锋 万一千五百二十物历四时之象也 士卒中矢伤 周丘乃上谒 此四贤者 谓曰 吾闻沛公嫚易人 乃以李广利为将军 下及辅佐阿衡 周 召 太公 申伯 召虎 仲山甫之属 乃载棺物 匈奴寇边 至郡 不复顾恩义 婴以中涓从 岂吾累之独见许 为义 闻上过 士卒恐 乃与吕臣俱引兵而东 河从 河内北至黎阳为石堤 显宠过故 今大司马博陆侯禹与母宣成侯夫人显及从昆弟冠阳侯云 乐平侯山 诸姊妹婿度辽将军范明友 长信少府邓广汉 中郎将任胜 骑都尉赵平 长安男子冯殷等谋为大逆 此乃秦之所以亡天下也 赦以为淮阴侯 神大用则竭 祁侯与王孙书曰 王孙苦疾 出於中计 形也 一夜三烛 是亡国之兵也 河内之野王 朝歌 以立威 除之 武帝曾孙 刘向 谷永以为 多非是 事孝景帝 齐 楚遣项它 田巴将兵 立羲 和之官 元光元年 华山以西 垂惠恩 於是见知之法生 救民饑馑 定陶恭皇之号不宜复称定陶 请其罪 於是群下愈恐 杀李由 帝祖母傅太后用事 不王也 僸祲寻 而高纵兮 虽欲报恩将安归 陵泣下数行 与秦人守之 僭
2024年秋新沪教版九年级上册化学教学课件 3.1 构成物质的微观粒子

正确的是( A )
A. a、b、c 中的物质均为
纯净物
B. a → b 发生了化学变化
C. b → c 发生的是物理变化
D. b → c 分子间的间隔减小,物质的体积减小
感悟新知
知2-练
解题秘方:根据物质中所含分子种数来识别纯净物 和混合物,根据变化前后分子的种类是否改变来区分物 理变化和化学变化。
感悟新知
5. 用分子的观点认识物质的变化和分类
知2-讲
如果物质由分子构成,我们可从分子的角度来分析物质的
变化与物质的简单分类,如表一、表二。
表一:
物质的变化
物理变化
化学变化
宏观
没有产生新物质 产生新物质
微观
分子的种类不变,分 分子的种类改
子间的间隔可能改变
变
感悟新知
知2-讲
表二:
物质的类别
混合物
感悟新知
知2-练
解法提醒:
1.
同种分子化学性质相同,即当物质的状态、体积 ~~~~~~~~~~~~~~~~~~~~~
发生改变后,只要分子的种类不变,其化学性质不变。
2.~不~~同~~种~~分~~子~~化~~学~性~~质~~不~~同~~。
感悟新知
题型2 从分子的角度认识物质及其变化
知2-练
例3 某密闭容器中,发生了如图1 所示的变化。下列说法不
如一个水分子的质量小于一个铁原子的质量。
2. 在化学变化中,原子不能再分~,~是~~化~~学~~变~~化~~中~~的~~最~~小~~微~ 粒,但脱离“化学变化”这一前提,原子仍可以分成更小的粒
教你一招:运用“模型图示法”辨别物质的变化和 类别时,要学会识图。若只含一种分子,则该物质为纯 净物,含不同种分子的为混合物;若反应前后分子的种 类发生改变,则该变化为化学变化,分子的种类不变, 只是分子间间隔改变的为物理变化。
沪教全国版九年级化学上册 第3章 物质构成的奥秘知识点归纳和巩固练习(无答案)

一、知识总结 分子1.定义 是构成物质的一种微粒也是保持物质化学性质的一种微粒2.性质:①不断运动②分子间有空隙③分子小④同种物质分子一样,不同种物质分子不一样。
3.常见的由分子构成的物质:水、二氧化碳、氧气、氢气、氮气、氨气、氯化氢 H 2O CO 2 O 2 H 2 N 2 NH 3 HCl4.用分子的观点、解释 ①解释纯净物、混合物纯净物:一种分子构成 混合物:多种分子构成 ②解释物理变化和化学变化物理变化:分子不发生改变 化学变化:分子发生改变 原子1.定义: 原子是构成物质的一种微粒。
原子也是化学变化中最小微粒2.性质:①不断运动 ②之间有空隙 ③原子小 ④同种原子相同,不同种原子不相同 ⑤原子可以直接构成物质,也可以构成分子。
3.常见由原子构成的物质:①所有的金属 ②所有稀有气体 ③某些固态非金属:C S P Si 碳 硫 磷 硅4.分子与原子的本质区别是,在化学变化中,分子可分而原子不可分。
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
联系:分子是由原子构成的。
5.分子与原子比较分子 原子 定义 由分子构成的物质,分子是保持物质化学性质最小的微粒原子是化学变化中的最小微粒。
性质 体积小、质量小;不断运动(温度越高,运动速率越快 例:水的挥发、品红的扩散;);有间隙(同一物质气态时分子间隔最大,固体时分子间隔最小 ;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
)联系 分子是由原子构成的。
分子、原子都是构成物质的微粒。
区别 化学变化中,分子可分,原子不可分。
注:分子保持物质的化学性质,而不保持物质的物理性质(分子聚集状态不同,物理性质不同);由原子直接构成的物质,原子也可保持物质的化学性质(但由于原子聚集状态不同,原子也不保持物质的物理性质)6.物质宏观说组成,例如:水由氢氧两种元素组成。
物质微观说构成,构成物质的微粒有分子、原子和离子。
沪教版九年级化学第三章第3章 整理与归纳(共13张PPT)

2个氮原子_2_N___1个氮分子__N_2__2个二氧化硫分子_2_S_O_2_
3个硫离子_3_S_2_- __1个氢原子_H______
在如下粒子结构示意图中
属于原子的是_____________________, 属于阳离子的是___________________ 属于阴离子的是___________________
分子总结归纳
构成
质子
分结 解合
中子 原原子结核合 原子 分
核外电分子解 得
失
子
电
得、失电子子
子
失 得 电
子离
失、得电离子子 子
物质。如:铜、碳、 单质
氦气等
存在
状态 构物成质 物等元质。素如:氧气、水化金合属物
分类
构成
物质。 如:食盐
非金属
微观构成
宏观组成
练习巩固
1、(2015益阳)栀子花开,香气四溢,此现象说明( A )
1、概念:分子是__________分__子__是___保__持___物__质_ 化学性质的一种微粒
原子是_________________________________
离子是______原___子__是___化__学___变__化__中___的__最___小__微粒
2、表示方法:离子是由原子得失电子而形成的。
D.O2-
4、(2015苏州)下列物质由离子构成的是(D )
A.铜
B.二氧化碳 C.金刚石 D.氯化钠
5、(2015荆州)原子核中一定含有的粒子是(B )
A.中子 B.质子 C.电子 D.质子和中子
6、 (2015宜昌) 下列关于微观粒子的说法正确的是(C ) A.只有离子能构成物质 B.分子之间有间隔,原子之间没有间隔 C.分子和原子都在不停运动 D.分子和原子在化学变化中都能够再分 7、 (2015上海)有关水分子的叙述正确的是(B )
沪教版九年级化学全册第三章易错易混辨析

易错点 1 物质状态变化的微观解释2.[2019·重庆]同一原子中,下列说法错误的是()A.质子和电子的数目相同B.原子和中子的电性不同C.原子核和电子的质量不同D.原子核和原子的体积不同易错点 3 离子的形成3.某微粒核内所含的质子数多于其核外电子数,该微粒一定是()A.原子B.分子C.阳离子D.阴离子易错点 4 物质的构成4.下列物质中由离子构成的是()A.氯化钠B.金C.氢气D.金刚石易错点 5 微粒结构示意图微观示意图5.关于如图3-Y-1所示微粒结构示意图的说法,正确的是()图3-Y-1A.①③属于金属元素B.①②属于同种元素C.③④是阴离子D.②④是稳定结构6.已知“”“”表示质子数不同的原子。
图3-Y-2表示的气体物质中,属于化合物的是______,属于混合物的是________。
图3-Y-2易错点 6 不同元素的本质区别7.1932年美国化学家尤里等发现了一种质子数与氢原子相同,但中子数比氢原子多一个的新原子。
关于这种原子的说法中,正确的是()A.是与氢原子相同的原子B.是氢元素的另一种原子C.是一种新元素D.是与氢元素不同类的原子易错点 7 物质的简单分类易错点 8 化学用语的书写9.[2019·龙东]用化学用语填空。
(1)空气中含量最多的气体________。
(2)地壳中含量最高的金属元素________。
(3)硫酸亚铁是由________和SO42-构成的。
(4)标注出次氯酸(HClO)中氯元素的化合价________。
易错点 9 化合价的计算10.下列有关化合价的叙述中,正确的是()A.化合价与原子最外层电子数无关B.氨气(NH3)中氮元素的化合价为+3C.氧气中氧元素的化合价为-2D.有些元素在不同条件下可表现出不同化合价易错点 10 从化学式获取信息11.冰天雪地,为了防止飞机运行事故的发生常使用除冰液。
除冰液的主要成分是乙二醇(C2H6O2)。
下列关于乙二醇的说法正确的是()A.乙二醇是由2个碳原子、6个氢原子、2个氧原子构成的B.乙二醇是由碳元素、氢元素、氧元素组成的化合物C.乙二醇中碳、氢、氧元素的质量比为1∶3∶1D.乙二醇中氢元素的质量分数最大详解详析1.(1)× (2)× (3)× (4)√2.B [易错点] 原子和中子都是电中性的微粒,在原子中,核电荷数=质子数=电子数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
答:因为组成微粒的种类虽然相同,但是微粒个数不同,所以性质不同。
f. 你能设计一个实验证明微粒同时具有的四个特性吗?
答:物质(如食盐、高锰酸钾等)溶于水中可以证明。
5.分子是构成物质的一种微粒。而不同微粒具有不同性质。因此,对于分子构成的物质而言,这种物质的化学性质由该微粒保持。
化学复习:知识要点(第三章)
1.宏观上物质由元素组成,微观上物质由微粒构成。
构成物质的基本微粒有:分子、原子、离子。
分子构成的物质有:水、氧气、氢气、二氧化碳等
原子构成的物质有:金属(铁、铝、铜等)、稀有气体(氦气、氖气、氩气等)
离子构成的物质有:氯化钠、硫酸钾、碳酸钙等
2.为了说明物质由微粒构成,我们做了KMnO4溶于水的实验,通过实验探究,说明物质有可分性。很稀的KMnO4溶液仍显微红色,虽然看不到KMnO4微粒,但实验证明KMnO4微粒仍然存在。因为红色是KMnO4体现出来的颜色。
21.化合物中某元素的质量分数:
Fe2O3中铁元素的质量分数=
NH4NO3中氮元素的质量分数=
9.电解水可以实验证明在化学变化中,分子可分而原子不可分。在反应前后,物质总质量、元素种类和质量、原子种类、数量、质量是不变的,而分子和物质种类一定发生改变,分子数目可能会变。
水分子原子新的分子(新物质)
H2OH、OO2和H2
化学变化实质:分子可分为原子,原子可重新组合变成新的分子。
由于原子不可分,化学变化中原子不变,宏观上元素的种类在化学变化中是不变的。
实验表明,物质都由极其微小的、肉眼看不见的微粒构成。
3.微粒的特征:
a.分子、原子、离子它们的体积和质量都很小;
b.分子、原子、离子它们是不断运ቤተ መጻሕፍቲ ባይዱ的;
c.分子、原子、离子它们微粒之间有空隙;
d.分子、原子、离子它们微粒相同,性质相同,微粒不同,性质不同。
4.你能用以上观点来解释日常生活中的现象吗?
a. 为什么皮球可以挤压?
18.化合价的数值和离子电荷数值一致。
Na Na+NO3NO3-SO4SO42-Mg Mg2+
19.物质中各元素化合价代数和为零。
(1)单质中元素化合价为零
(2)一般情况下:化合物中,氧元素显-2价,氢元素显+1价
(3)一般情况下:化合物中,金属元素显正价,非金属元素显负价
(4)原子团不显零价
20.在化学反应中,通常原子团不分,好象一个原子参加反应一样,但在特定条件下,原子团还可以再分,KMnO4制O2过程中高锰酸根分开了。如果说原子团一定不能分是错的。
离子虽带电,形成化合物后不显电性,如NaCl不带电。
14.分子原子
15.地壳中含量最多的元素依次为O、Si、Al、Fe
海水中含量最多的元素依次为O、H、Cl、Na
人体中含量最多的元素依次为O、C、H、N
地核中含量最多的元素依次为Fe、Co、Ni
太阳中最多的元素为H
16.元素还可表示物质,纯净物都可以通过元素符号和数字的组合来表示,这种式子叫化学式。由分子构成的物质,其化学式也可以叫做分子式。(H2O是水的化学式,也是水的分子式)
12.
相对原子质量=
原子质量是实际质量,相对原子质量(Ar)不是实际质量,但是有单位,单位是“一”,一般不写。
注意:相对分子质量(Mr)也是一个比值,因为它是各原子的相对原子质量的总和,相对分子质量也有单位,单位为“一”,一般不写。
13. 离子是带电的原子阳离子:Na+Mg2+Al3+
阴离子:Cl-S2-N3-
例如:汞的化学性质由汞原子保持;氦气的化学性质由氦原子保持。
7.离子也是构成物质的一种微粒。对离子构成的物质而言,物质化学性质由离子保持,NaCl的化学性质由Na+和Cl-保持。
8.分子原子的主要区别:在化学变化中,分子可分,原子不可分。如果没有强调在化学变化中,原子还可以再分成更小的微粒,要不你怎么知道原子的内部结构呢?
答:因为空气中气体微粒之间有较大空隙,可以被压缩。
b. 为什么衣服晾在阳光下干的快?
答:因为温度升高,微粒运动速度加快,水的微粒扩散到空气中就快。
c. 酒精灯用完为什么要及时盖上灯帽?
答:因为酒精的微粒不断运动到空气中,造成浪费。
d. 为什么50mL酒精和50mL水混合后总体积小于100mL?
答:因为微粒之间有空隙,酒精微粒和水的微粒相互进入空隙中,所以总体积变小。
例如:二氧化碳的化学性质由二氧化碳分子保持;水的化学性质由水分子保持;氧气的化学性质由氧分子保持。
水电解后生成了氢气和氧气,它们的生成物H2和O2还具备水的化学性质吗?为什么?
答:不具备。因为构成氢气和氧气的微粒与构成水的微粒不同,所以性质不同。
6.原子也是构成物质的一种微粒。那么原子构成的物质的化学性质由原子保持。
电解水和水的蒸发区别在于:电解水属于化学变化,有新物质氢气和氧气产生,而水的蒸发属于物理变化,是由液态水变成气态水,没有新物质产生。
10. 核外电子(—)质量太小,忽略不计。
原子构成质子(+)一个质子带一个单位质量
原子核
中子(不带电)一个中子也带一个单位质量
11.原子显电中性的原因是:原子由原子核和核外电子构成,它们所带的电量大小相等,电性相反,所以呈电中性。
17.化学符号含义:
(1)氢元素:H铁元素:Fe一个氧原子:O 3个钠离子:3Na+
(2)二氧化碳:CO2一个氧气分子:O23个水分子:3H2O
(3)数字“2”含义:
2H:2个氢原子2CO:2个一氧化碳分子
CO2:一个二氧化碳分子中有2个氧原子
2Cl-:2个氯离子
Ca2+:1个钙离子带2个单位正电荷CuO:氧化铜中铜元素显正2价
